 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

呼吸道感染在婴幼儿中很常见,会导致儿童经常出现哮喘、呼吸困难和呼吸窘迫,是5岁以下儿童住院的最常见原因。
在生命早期接触各种细菌和病毒是不可避免的,这对免疫系统的健康发育至关重要。随着孩子的成长,免疫系统也在发育和成熟,因此,在这段动态变化的时间里,感染的影响可能会产生长期的后果。
婴幼儿免疫系统的发育与呼吸道粘膜表面的微生物群具有相互作用。虽然病毒感染似乎是早期喘息/呼吸窘迫发作的关键触发因素,但暴露于某些细菌物种可以起到保护作用。
本文重点讲述生命早期呼吸道感染如何影响终生呼吸系统健康,结合了关于婴幼儿免疫成熟自然轨迹的最新数据,以及在这一关键发育时期发生的呼吸道感染的性质和类型如何影响免疫。
与呼吸系统疾病有关的术语表
阻塞性肺病——气道收缩或闭塞,使人难以呼出空气。与慢性阻塞性肺病、哮喘、支气管扩张、囊性纤维化和细支气管炎有关。
限制性肺病——肺部更硬,使肺部更难扩张以吸入空气。与肺纤维化、神经肌肉疾病和肥胖相关。
肺表面活性剂——由肺泡II型肺细胞产生的特定脂质、蛋白质和碳水化合物的复杂混合物,具有降低肺泡气液界面表面张力的功能。
气管吸入——一种非侵入性方法,从插管和通气的患者中获取含有气道分泌物的深层呼吸样本。
呼吸道吸入物——通常从鼻咽部获得,含有呼吸道分泌物。
支气管肺泡灌洗——通常在支气管镜检查中获得,在注入生理盐水后获得的下呼吸道液体样本。
支气管镜检查——一种微创手术,将一根带有摄像头和光源的细管(支气管镜)通过鼻子或喉咙进入气道,并进入气道进行采样。
毛细支气管炎——一种常见于婴幼儿的疾病,由一系列不同的病原体引起,但通常是呼吸道合胞病毒。伴有呼吸困难、喘息性咳嗽和粘液增多。
气液界面培养——将气道细胞三维培养的技术。培养物的基侧处于培养基中,液体从培养物的上部抽出,这促进了构成气道的不同上皮细胞的分化,包括那些有跳动的纤毛和产生粘液的上皮细胞。
生命早期的呼吸道感染会对发育中的肺部和免疫系统产生深远的影响。
来自全球的各项研究证据表明,对一些儿童来说,生命早期呼吸道感染会导致严重的终生呼吸道疾病,并可能影响其他合并症的发生,如心血管疾病、糖尿病和抑郁症。
在英国,大约一半的儿童在6岁之前至少经历过一次哮喘,几乎所有的哮喘都是由呼吸道合胞病毒(RSV)或鼻病毒(RV)引起的下呼吸道病毒感染引起的。
注:在英国因急性哮喘发作而入院的患者中,6岁以下儿童占75%。至少有三分之一的6岁以下急性呼吸窘迫儿童在童年时有反复发作的喘息。
随着学龄前儿童呼吸道感染的不断增加,了解为什么一些儿童对常见的季节性病原体有严重的、异常的免疫反应,以及这些多重感染对儿童及以后的免疫和肺部发育的影响是至关重要的。
▼
√早期下呼吸道感染的儿童肺功能降低
来自欧洲150,090名儿童的个体研究数据显示,早期(6个月至5岁)下呼吸道感染儿童的肺功能明显较低,学龄期(中位7岁)患哮喘的风险也较高。
√肺功能模式与相关疾病
在塔斯马尼亚纵向健康研究(n=2422)中,对7岁学龄儿童至53岁的成年人进行了随访,确定了四种终生肺功能模式:
(1)阻塞性肺功能模式,与哮喘和慢性阻塞性肺疾病(COPD)等呼吸道疾病有关(25%);
(2)限制性肺功能模式,通常见于肺间质性和实质性疾病(10%);
(3)阻塞性和限制性混合(3.5%);
(4)肺功能正常(60%)。
53岁时慢性阻塞性肺疾病患病率以混合型最高,其次为阻塞性。这种混合模式与儿童呼吸道疾病和成人哮喘有关。
限制性模式的非呼吸系统疾病患病率最高,包括成人肥胖、糖尿病、心血管疾病、高血压和阻塞性睡眠呼吸暂停。
注:在低收入和中等收入国家的队列中也显示出对早期下呼吸道感染的不良影响。
√低肺功能与反复的喘息和严重的哮喘有关
在成年早期未能达到最大肺功能会导致慢性阻塞性肺疾病的风险增加。
英国两个大型队列(n=1046)的肺功能轨迹显示,从学龄前到成年的持续低肺功能可归因于反复发作的喘息和严重的哮喘发作;并且来自美国的独立队列显示,在生命的第四个十年中,低肺功能与早期呼吸道合胞病毒感染和儿童哮喘有关。
!
注意
到目前为止,没有证据表明在生命的前5年过后肺功能会恢复。此外令人担忧的是,现在有证据表明,持续的低肺功能会增加早期全因死亡率的风险。
从出生到成年的肺功能轨迹
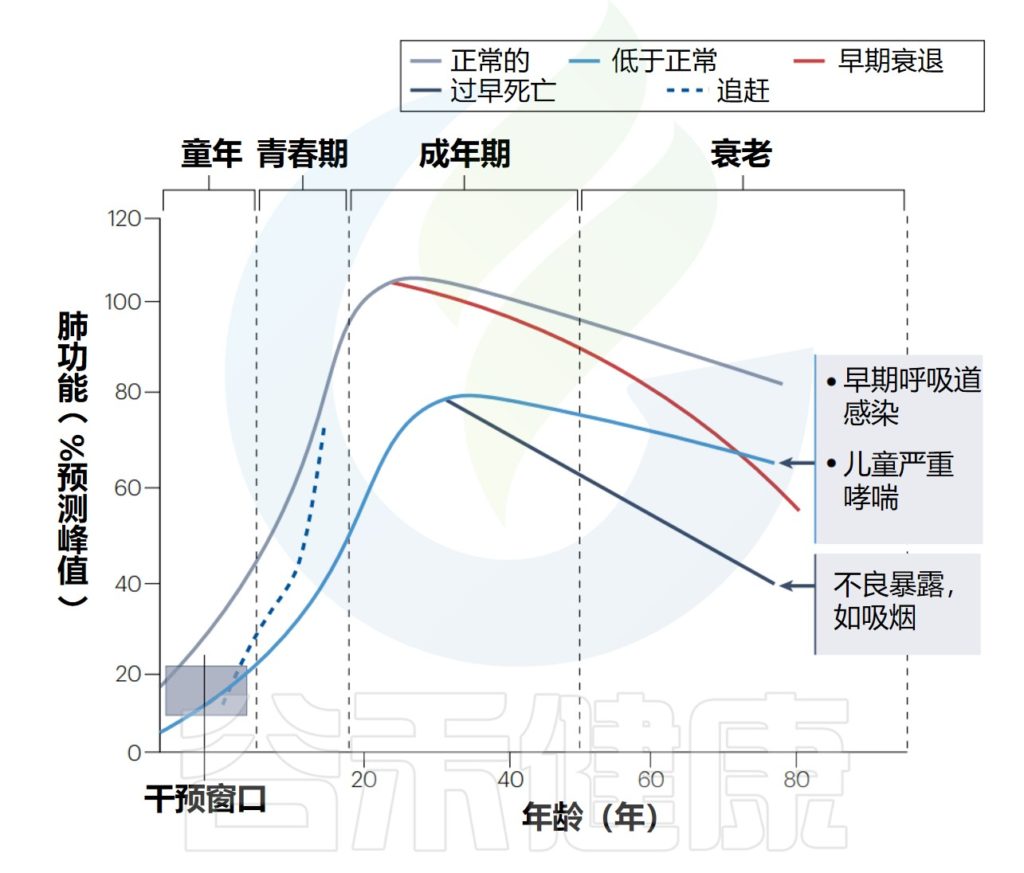
Lloyd CM,et al.Nat Immunol.2023
解读:肺功能发育正常的例子(灰线),在成年早期达到预期的峰值,随后在正常的衰老过程中缓慢下降。
成人接触不良环境(如吸烟)可能会加速下降。由于不良的早期生活事件,如复发性呼吸道感染和严重的儿童哮喘(蓝线),未能在成年早期(20岁)达到“正常”肺功能峰值,导致成年肺部疾病的风险增加,即使在成年期间肺功能可能没有任何加速下降。
现在人们普遍认为,免疫成熟是在出生后的几天和几个月内按照规定的过程发生的。
虽然大部分信息来自小鼠模型,但新方法和技术的出现促进了免疫细胞在非常小的样本中的蛋白质组学和转录组学细节,揭示了免疫发育的正常轨迹。
检查这种免疫发育轨迹是至关重要的,以便了解偏离标准如何导致呼吸系统健康状况不佳。
▼
将早产儿和足月儿纳入研究表明,他们的免疫状况在出生时有所不同。
“
早产儿的促炎信号更强烈
发现早产与强烈的促炎信号有关,其特征是趋化因子CXCL11和CXCL8的表达增强。
CXCL11是一小分子的细胞因子属于CXC趋化因子家族,又被称作“干扰素诱导的T细胞a趋化因子”
CXCL8是CXC趋化因子家族的一员,是炎症反应的主要介质编码的蛋白质
“
新生儿的免疫系统具有更多的个体差异
总的来说,与成年人相比,新生儿免疫系统表现出更多的个体差异,突出了这一关键窗口期免疫的动态性。
“
出生后免疫细胞组成发生变化
此外,出生后免疫细胞组成发生变化,中性粒细胞数量减少,CD4+和CD8+ T细胞比例增加。
出生前3个月是B细胞、自然杀伤细胞和树突状细胞表型发育的关键时期,这些表型受环境因素的影响。当单核细胞在出生后的第一个月扩充和收缩时,B细胞的数量从第一个月开始增加。
另一项研究分析了剖宫产足月婴儿血液中的免疫细胞成分。通过刺破脚跟获得的血液与匹配的脐带血进行比较,发现免疫细胞在出生后几小时内就发生了快速变化。
胎儿(脐带血)和新生儿(脚后跟刺破)样本的基本免疫表型比例相同。效应T细胞增殖增加,这些效应T细胞表现出增强的细胞因子分泌能力。
▼
研究人员通过检查器官捐献者的血液、淋巴组织和粘膜组织,绘制了60年来人类T细胞区隔化的空间图。他们揭示了与年龄相关的一些T细胞亚群在体内特定部位的比例变化。
“
淋巴组织中的T细胞发生了动态变化
淋巴结发生了动态变化,而粘膜部位的T细胞表型保持更稳定。表达组织驻留记忆T细胞(TRM)特征的效应记忆T(TEM)细胞亚群主要分布在粘膜部位,而淋巴组织内的效应记忆T细胞亚群在整个生命过程中都有变化。
“
儿童与成人之间的免疫细胞数量不同
对从婴儿器官供体收集的淋巴组织和粘膜组织中收集的T细胞进行的更系统的分析显示,T细胞分化和调节功能在生命的前2年进行早期划分。
调节性T细胞在儿童组织中占CD4+ T细胞的比例相对较高(30-40%),而在成人组织中则低得多(<10%)。
来自婴儿供体的T细胞可以抑制内源性T细胞活化,并且早期T细胞功能仅限于最低Treg:TEM细胞比率的粘膜部位,这表明早期生活中T细胞反应的局部控制。
▼
产后暴露可导致先天免疫训练,从而通过表观遗传组蛋白修饰产生持久的程序,增强或减弱细胞因子反应。
产后暴露不仅包括环境因素,如感染史和污染,还包括生活方式,如营养、压力、吸烟、与兄弟姐妹一起生活等。这些因素一起影响发育中的新生儿免疫系统。
“
粘膜相关不变T细胞对免疫影响巨大
非常规T细胞,如粘膜相关不变T(MAIT)细胞,在生命早期对来自局部微生物群的信号有反应,这对组织免疫的调节具有终身影响。有证据表明,粘膜相关不变T细胞与皮肤局部微生物群之间的相互作用对于促进组织损伤后的伤口修复至关重要。
尽管我们知道粘膜相关不变T细胞细胞在成人肺中大量存在,并且被认为在控制呼吸道病毒感染中起重要作用,但尚未在儿童肺中进行研究。
由于先天免疫细胞对疫苗接种的成功至关重要,并且受每次接触的水平和性质的影响,因此了解这些不同的接触如何影响免疫系统的各个分支,以了解如何促进充分的免疫增强非常重要。
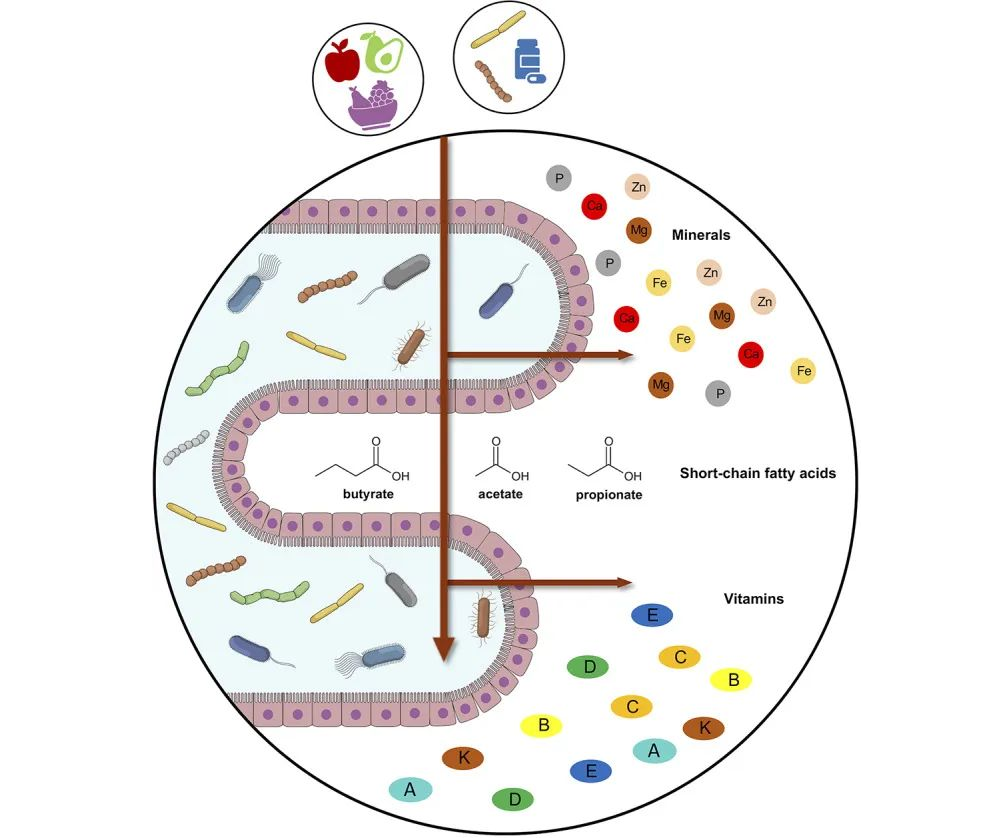
先进的测序技术揭示了人体是一个由细菌、真菌、病毒和寄生虫组成的复杂生态系统。这种微生物群普遍存在于包括肺在内的粘膜屏障部位,尽管其密度远低于肠道。
★ 微生物群与免疫系统的相互作用至关重要
微生物群与免疫系统的相互作用现在被认为对免疫发育和疾病预防至关重要。局部微生物群落和免疫细胞之间的密切相互作用促进了从对母体和自身抗原的耐受到对促进疾病的因子的保护的转变。
因此,生命早期可能是微生物生态失调破坏免疫发育的关键阶段。
▼
呼吸道是一个复杂的系统,分为不同的区域:上呼吸道包括鼻腔、咽部和喉部,下呼吸道包括传导气道(气管和支气管)、小气道(细支气管)和肺泡。
在健康或疾病时,微生物群在呼吸道的不同区域定植
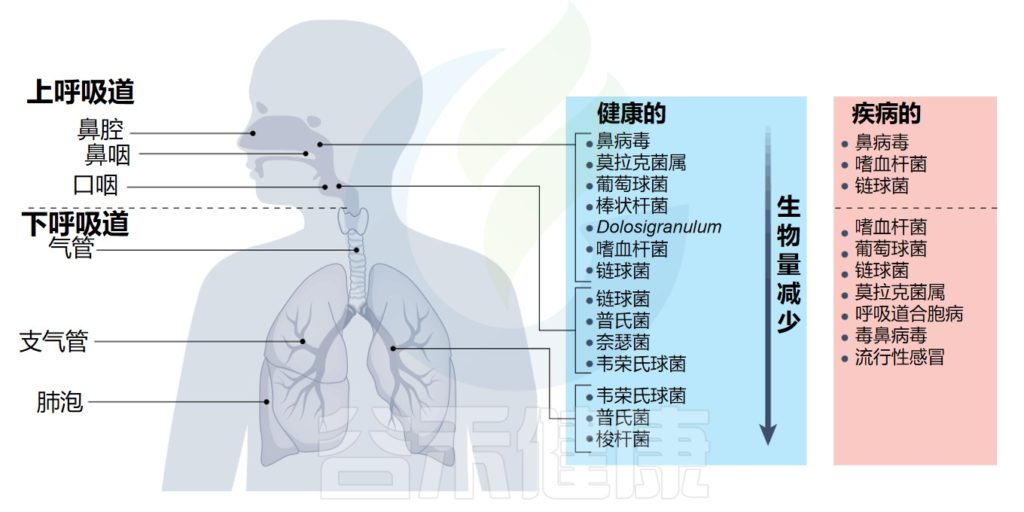
Lloyd CM,et al.Nat Immunol.2023
总的来说,这个大的表面积容纳了一系列不同的微生物群落,其中最高的细菌负荷位于上呼吸道内。
▼
一般认为,新生儿在出生时收集了其最初的微生物种类。这些微生物主要来源于母体,由阴道、肛门、直肠和皮肤微生物群组成,其组成取决于分娩方式。
根据解剖生态位和环境影响施加的局部选择压力,这种最初均匀的细菌物种“初始包”迅速多样化。在金黄色葡萄球菌(Staphylococcus aureus)最初占优势后,鼻咽微生物群迅速多样化,棒状杆菌(Corynebacterium)和狡诈球菌属( Dolosigranulum )的定植和生长。
从6周大开始,莫拉克菌属(Moraxella)开始繁殖,并最终在3个月大时占主导地位。微生物群在出生后7周在呼吸道中成熟,并建立了多样性。
▸ 上呼吸道的微生物群
口咽菌群是上呼吸道所有生态位中最多样化的,与鼻咽相比,幼儿和成人的微生物组成相似,由厌氧菌属组成,如链球菌(Streptococcus)、普雷沃氏菌(Prevotella)、奈瑟菌(Neisseria)和韦荣氏球菌(Veillonella)。
注:最近对出生第一周婴儿样本的分析显示,口咽和鼻腔代表着细菌和真菌的不同生态位。
▸ 下呼吸道的微生物群
下呼吸道环境特别专门化,反映了特定的环境。例如,肺表面活性剂的分泌有助于形成富含磷脂的环境,从而有助于维持更多样化的微生物群。
注:考虑到下气道的不可接近性,对这个生态位进行采样是具有挑战性的,研究使用气管吸入物作为细菌的来源。
虽然下呼吸道的总生物量较低,但健康婴儿的微生物群在出生后的前2个月内发育,并随着时间的推移而增加。
链球菌是下呼吸道的关键物种
观察到韦荣氏球菌属(Veillonella)、普雷沃氏菌(Prevotella)和梭杆菌(Fusobacterium),并确定链球菌(Streptococcus)是下呼吸道微生物群落结构的关键物种。
▼
尽管人们普遍认为肠道微生物群在免疫发育中起着至关重要的作用,但对局部肺微生物群的作用却知之甚少。
✦防止不必要的免疫反应
研究认为,生命早期的微生物群在建立耐受原免疫途径中起着重要作用,以防止对自身抗原和无害的吸入抗原(如过敏原)产生不必要的免疫反应。
✦诱导调节性T细胞
对肠道共生体的分析表明,梭菌(Clostridia)通过转化生长因子-β在小鼠和人类结肠中诱导FOXP3+Treg细胞,而脆弱拟杆菌(Bacteroides fragilis)通过Toll样受体2的参与诱导Treg细胞
普雷沃氏菌(Prevotella)、罗氏菌属(Roseburia)和韦荣氏球菌(Veillonella)在下呼吸道的富集与典型TH17细胞因子谱呈正相关,白细胞介素-1α (IL-1α), IL-1β, IL-6和IL-17增加,并伴有TH17和中性粒细胞在肺部的募集。
✦肺部微生物多样性与长期肺部健康相关
对一组出生后最初几个月的儿童气道吸入物的检查显示,1个月时的微生物多样性与6岁时的哮喘有关。
具体来说,韦荣氏球菌(Veillonella)和普雷沃氏菌(Prevotella)的相对丰度与呼吸道免疫相关,其特征是CCL2和CCL17增加,肿瘤坏死因子和白细胞介素1β减少。
CCL2——趋化因子配体2,可招募单核细胞、记忆性T细胞和树突状细胞到组织损伤或感染引起的炎症位点。
CCL17——又称胸腺和激活调节趋化因子(TARC),是一种强大的趋化因子,通常与2型免疫反应相关,其编码基因在人类中位于16号染色体上。
小结
尽管大多数研究使用小鼠模型来检查呼吸道微生物生态系统与发育中的免疫系统之间的关系,但似乎很有可能呼吸道免疫弹性降低和肺部微生物群多样性沿着共同的轨迹发展,以促进肺部健康。
生命的最初几周是微生物在粘膜表面定植的关键时期。然而,理想的微生物丰富度和多样性可能会被感染或抗生素治疗等事件所破坏,这些事件会影响自然发育过程,有时会产生持久的影响。
出生时胎龄是微生物成熟和多样性的关键驱动因素,也是出生方式和喂养方式的关键驱动因素。微生物群结构的其他重要决定因素包括环境因素,如兄弟姐妹的存在,环境污染,以及感染史。
肺免疫和微生物组受到一系列内在和外在因素的影响
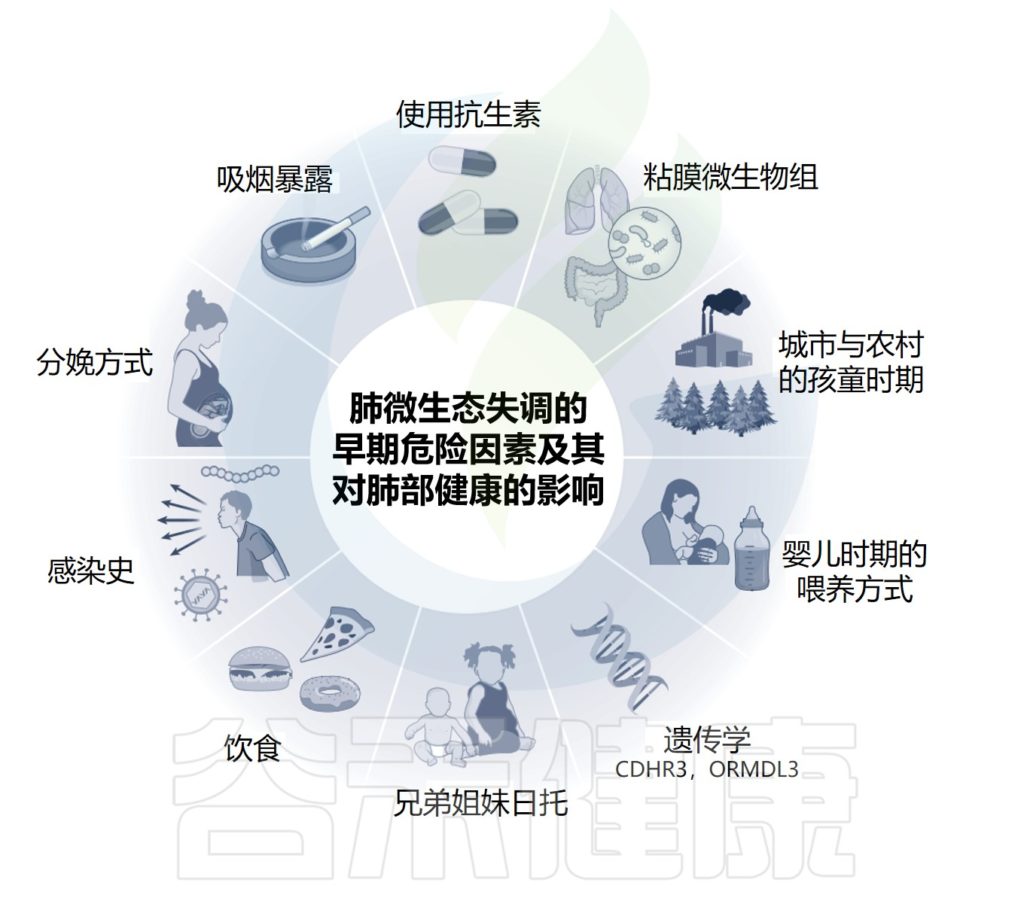
Lloyd CM,et al.Nat Immunol.2023
免疫力和微生物组在整个生命过程中可能遇到的各种因素的影响,但由于婴儿正处于紧张的发育期,他们特别容易受到影响。
免疫系统和微生物组之间的局部关系是高度动态的,外部刺激和生活方式的选择可能导致肺生态位内细胞和细菌群落的振荡,甚至可能对肺功能产生终身影响。
在生命的第一年导致下呼吸道疾病的两种最常见病原体包括呼吸道合胞病毒和人类鼻病毒。
▼
许多观察性研究报道,反复出现的病毒性下呼吸道感染,尤其是严重的下呼吸道感染,与儿童反复喘息和哮喘发作增加有关。
一项由35项研究组成的系统综述和荟萃分析估计,呼吸道合胞病毒下呼吸道感染对儿童喘息性疾病具有直接影响。
•免疫预防可能改变呼吸道细菌组成
在8项介入研究中评估呼吸道合胞病毒免疫预防对哮喘的保护作用时,虽然观察到保护作用,但效果并不显著。
接受呼吸道合胞病毒免疫预防的早产儿在1岁和6岁时的上呼吸道微生物组的特征是:在1岁时葡萄球菌(Staphylococcus)明显减少;在6岁时与更多的嗜血杆菌(Haemophilus)和明显减少的莫拉克菌(Moraxella)。
这表明呼吸道合胞病毒免疫预防与改变呼吸道细菌微生态失调之间的相互作用可能与疾病保护有关。
▼
另一个队列包括1304份鼻咽样本,这些样本是从连续11次定期采样中获得的,以及在生命第一年急性呼吸道感染期间获得的。
呼吸道病毒的定量PCR检测显示,早期无症状的鼻病毒与以后呼吸道感染的易感性增加和复发相关。
直到最近,鼻病毒被认为是一种只引起上呼吸道感冒症状的病毒,对下呼吸道疾病影响不大;然而,我们现在了解到三种鼻病毒 (RV-A, RV-B和RV-C)可能诱导不同的感染模式和毒力。
•个人因素影响呼吸道疾病的严重程度
个人因素,如肺功能和免疫,特别是与年龄相关的因素(例如干扰素)反应在幼儿中较低,可能部分解释了这个年龄组鼻病毒疾病的严重程度,并影响鼻病毒感染的下呼吸道结局。
鼻病毒的粘膜免疫反应至关重要;伴有变应性炎症的干扰素反应的质量影响鼻病毒喘息的风险。
几种宿主因素导致严重鼻病毒疾病和喘息的风险增加。年轻时易患喘息或发热性疾病,尤其是RV-C感染。遗传因素也会增加鼻病毒相关喘息的风险。17q12-21区单核苷酸多态性与急性喘息和哮喘发展相关。
▼
在调查生命早期呼吸道感染和未来的喘息/哮喘和肺功能影响的研究中,发现与特定病原体(鼻病毒或呼吸道合胞病毒)及细菌(莫拉氏菌、嗜血杆菌、链球菌、葡萄球菌)之间的关联有关。
•特定病原体和细菌与呼吸道疾病风险相关
与定义肺功能轨迹类似,在出生队列中也描述了微生物组轨迹,并与复发性喘息和哮喘的风险相关。
参与哮喘童年起源研究的儿童(N=285)在7个时间点提供了鼻咽粘膜样本,健康时相隔1-3个月,生命的头2年,急性呼吸道疾病期间提供了额外的样本。6岁、11岁、13岁和18岁时的发育微生物群轨迹与哮喘有关。
生命最初6个月的葡萄球菌优势菌群与3岁时复发性喘息和整个儿童期持续哮喘的风险增加有关。在急性喘息疾病中,鼻病毒的检测和莫拉菌的优势与整个儿童后期持续存在的哮喘相关。
▼
最近,一项包括美国247家医院婴儿的前瞻性研究证明了特定病毒、细菌种类、免疫反应和代谢后遗症之间相互作用的重要性:研究对象是因毛细支气管炎住院的婴儿(小于1岁)。
研究过程
在初次急性发作期间收集临床资料和鼻咽样本,以评估微生物组、呼吸道病毒、细胞因子和代谢组谱。
随后,对这些婴儿进行随访至5岁,并对病毒和微生物、炎症和代谢组学特征进行无偏见的综合分析,以确定与喘息和哮喘持续存在相关的不同感染模式,而不是症状缓解。
对13%经历过鼻病毒相关性细支气管炎的婴儿分析定义了一个特定的RV-C儿童亚组,莫拉菌优势加上2型高细胞因子反应,预测3岁时持续喘息和5岁时哮喘风险增加。
住院的呼吸道合胞病毒毛细支气管炎患儿中,IgE致敏和呼吸道合胞病毒/鼻病毒共感染比例高、链球菌/莫拉克菌共优势、IFNα和IFNγ反应高的组发生哮喘的风险明显更高。
!
注意
从一岁前采集的上呼吸道样本中出现了一种模式,将症状前病毒(鼻病毒和呼吸道合胞病毒优势)和微生物谱(莫拉克菌、嗜血杆菌、链球菌优势)与随后的喘息/哮喘风险联系起来。
在急性发作期间病原体生态失调,病毒和细菌谱的类似改变也与随后的呼吸道疾病有关。
缺乏证据表明上呼吸道微生物群与病毒检测和下呼吸道微生物群之间存在关系。这一点至关重要,因为我们知道,长期的有害后果与生命早期出现的下呼吸道疾病密切相关,而与上呼吸道症状无关。
纵向收集儿童下呼吸道样本极具挑战性;因此,数据主要依赖于临床指征手术(如支气管镜检查)期间采集的横断面样本。
将同一患者的咽拭子与支气管肺泡灌洗液中的微生物组进行比较,发现同一患者的上下气道样本在α多样性(丰富度、均匀度或Shannon多样性指数)方面没有差异,而个体之间的差异大于上下气道样本之间的差异。
进一步支持上呼吸道和下呼吸道样本之间关系的是,在患有严重复发性喘息的学龄前儿童无症状稳定疾病期间,在支气管肺泡灌洗样本中发现了不同的簇。
从下呼吸道样本中描述的鼻病毒/莫拉菌属/特应性集群在患有严重喘息的儿童3岁时表现出与第一次下呼吸道疾病期间婴儿队列中发现的非常相似的呼吸道微生态失调,这是哮喘发生的最大风险。
在免疫和肺部发育的关键时期(生命的前5年),外部暴露(环境、病毒和细菌感染)之间的平衡决定了先天免疫反应和健康的肺功能,或导致肺功能下降和不可逆且长期预后不良的病理反应。
需要在这一免疫和肺部发育时期采取有针对性的干预措施,以便赶上肺部生长和疾病改变。
下图展示了早期呼吸道感染、环境暴露、宿主免疫反应与终生肺部健康之间的相互作用:
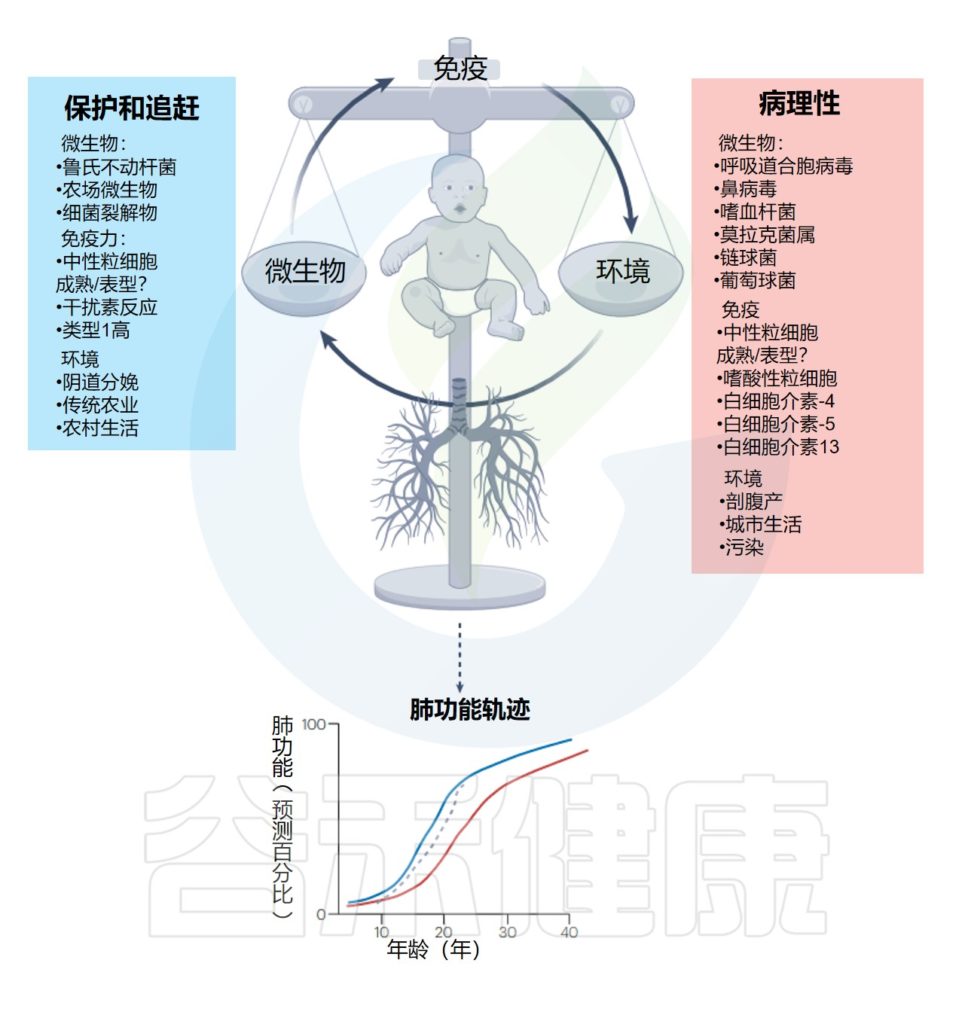
编辑
Lloyd CM,et al.Nat Immunol.2023
▷
流行病学数据表明,特定的环境暴露对儿童哮喘和过敏性疾病提供了强有力的保护,并可能提高对感染性病原体的先天免疫反应的效率。
这种保护作用最好的例子也许是阿米什儿童和哈特派信徒儿童的比较。
阿米什实行传统农业,因此孩子们在整个童年时期,甚至在出生前,都与农场和动物密切接触。
相比之下,哈特派人使用工业化农业方法,因此家庭往往与他们的动物和农场分开居住。
阿米什儿童的哮喘和喘息的患病率要低4倍,而哈特派儿童的患病率与北美土著人口相同。
值得注意的是,两组儿童在先天免疫细胞的比例、表型和功能方面存在显著差异。
与动物接触密切的儿童中性粒细胞较高
具体来说,阿米什儿童有较高的循环中性粒细胞,其独特的表型表现为CXCR4和CD11b的表达减少,这可能是由于持续的环境微生物暴露导致的不成熟的表型。
趋化因子受体CXCR4是趋化因子基质细胞衍生因子-1(CXCL12)的特异受体。
与动物接触密切的儿童T细胞活性较高
对T细胞表型的分析表明,阿米什儿童表现出增强的活化调节性CD4+T细胞表型(CD45RO+ICOS+),而传统的CD4+T淋巴细胞表达较低水平的共刺激和活化标志物。
此外,阿米什儿童的CD28null CD8+细胞比例高于哈特派儿童,这与高T细胞干扰素γ产生和低血清IgE浓度相关。
阿米什儿童在外周血白细胞中也表现出更高的先天基因TNF和TNF诱导蛋白3 (TNFAIP3)的表达,并伴有抑制表型的单核细胞。
总的来说,传统的农场环境可以通过参与和塑造生命早期的先天和适应性免疫反应来预防哮喘。
▷
有趣的是,在农场长大也与呼吸道感染和肺功能低下呈强烈的负相关。因此,暴露于动物棚内不同的环境微生物群似乎是预防哮喘的关键。
农场环境下婴儿的肠道菌群与哮喘风险降低有关
在传统农业环境中长大的出生队列中,2至12个月大的婴儿肠道微生物组的成熟已经被建模。12个月大婴儿的估计微生物组年龄与先前的农场接触和学龄前患哮喘的风险降低有关。
微生物组年龄介导了19%的保护作用。粪便丁酸水平、预测丁酸产生的细菌分类群以及编码丁酰辅酶A:乙酸辅酶A转移酶基因的相对丰度与哮喘呈负相关。
这些数据表明,农场微生物对哮喘发展的保护机制可能是通过微生物代谢物改变和更成熟的肠道微生物群,以及代谢物通过肠-肺轴影响肺免疫反应。
▷
儿童口服混合细菌裂解物的临床试验进一步证明了保护性肠道微生物群在预防生命早期下呼吸道感染方面的重要性。
口服或舌下给药混合呼吸道致病菌的裂解物已被用于预防呼吸道感染,以及预防可能由呼吸道感染引起的喘息和哮喘加重。
一项关于细菌裂解物治疗对学龄前儿童喘息发作和哮喘加重效果的系统综述显示,儿童喘息发作(平均减少2.35次)和哮喘加重(平均减少0.90次)均有所减少。
// OM-85
细菌裂解液混合物OM-85包括呼吸道病原体混合物的21种细菌菌株的冻干组分。在感染鼻病毒前,对成人健康对照和哮喘或慢性阻塞性肺疾病患者培养的原代人支气管上皮细胞进行预孵育,结果显示,所有三组患者的干扰素γ分泌均显著增加。
也有体外证据表明OM-85能抑制鼻病毒和流感病毒对支气管上皮细胞的感染,从而增加上皮细胞的存活率。
// MV130
MV130是一种灭活的多细菌化合物,人舌下或小鼠鼻内给药,其作用机制是通过对小鼠骨髓祖细胞和体外人类单核细胞进行重新编程来诱导经过训练的免疫力,促进细胞因子产生(TNF)的增强,该增强依赖于通过增加乳酸产生的代谢转变。
注:该实验还没有在早期生命模型中进行,也没有在儿童的免疫细胞中进行。
呼吸道微生物组是一个尚未充分研究的治疗靶点,以促进良好的肺部健康结果。细菌代谢产物在调节免疫功能和保护过敏和哮喘方面的机制作用已被证明,但仅在肠道微生物组的背景下。
小结
微生物代谢产物,或在改变呼吸道微生物组以提供保护方面重要的特定分子的作用仍然未知。至关重要的是,农场提取物中提供保护的微生物是冻干和灭活的,因此不太可能产生代谢产物。
因此,未来干预措施的机制假设需要侧重于研究提供保护的吸入农场微生物的特定分子成分。
此外,与哮喘风险增加相关的共生细菌病原体(M.catarrhalis、肺炎链球菌、流感嗜血杆菌)和更具保护性的微生物(双歧杆菌、棒状杆菌)之间的相互作用也可能导致呼吸道代谢产物之间的不平衡,从而导致TH2偏斜的免疫反应。
建立健康的呼吸系统,在正确的时间接触正确的微生物是关键。
肺部免疫在生命的最初几个月形成。婴儿通过呼吸道暴露于多种不同的病原体。如鼻病毒,呼吸道合胞病毒,莫拉菌属(Moraxella)、嗜血杆菌(Haemophilus)、链球菌(Streptococcus)都会引起呼吸道感染,进而导致反复的喘息和哮喘等呼吸系统疾病。
当然,也有一部分细菌对呼吸系统是有益的,例如普雷沃氏菌(Prevotella)、罗氏菌属(Roseburia)和韦荣氏球菌(Veillonella)。
这些不同病原体、发育中的免疫系统和成熟的呼吸系统以及环境之间的关系对于儿童时期的慢性呼吸系统疾病和建立具有终身影响的肺部免疫健康轨迹至关重要。
对健康呼吸系统分子机制的更深入了解,能够有效防止儿童喘息障碍发展为慢性哮喘和低肺功能直至成年。
相关阅读:
主要参考文献
Lloyd CM, Saglani S. Early-life respiratory infections and developmental immunity determine lifelong lung health. Nat Immunol. 2023 Jul 6.
Sandall, J. et al. Short-term and long-term effects of caesarean section on the health of women and children. Lancet 392, 1349–1357 (2018).
Achten, N. B., van Rossum, A. M. C., Bacharier, L. B., Fitzpatrick, A. M. & Hartert, T . V . Long-term respiratory consequences of early-life respiratory viral infections: a pragmatic approach to fundamental questions. J. Allergy Clin. Immunol. Pract. 10, 664–670 (2022).
van Meel, E. R. et al. Early-life respiratory tract infections and the risk of school-age lower lung function and asthma: a meta-analysis of 150,000 European children. Eur. Respir. J. 60, 2102395 (2022).
Bose, S., Pascoe, C. & McEvoy, C. Lifetime lung function trajectories and COPD: when the train derails. Lancet Respir. Med. 11, 221–222 (2022).
Zar, H. J. et al. Early-life respiratory syncytial virus lower respiratory tract infection in a South African birth cohort: epidemiology and effect on lung health. Lancet Glob. Health 8, e1316–e1325 (2020).
Ariyakumar, G. et al. Activation of lymphocytes in healthy neonates within hours of birth. Front. Immunol. 13, 883933 (2022).

谷禾健康

维生素C是一种广泛存在于自然界中的水溶性维生素。维生素C在人体新陈代谢中具有多种重要功能,包括抗氧化、参与胶原蛋白合成、增强铁的吸收等。由于其众多生理益处,维生素C被广泛地应用于修复伤口、治疗感冒、癌症等多种疾病。
人体无法自行合成维生素C,需要从膳食来源(如水果、蔬菜)中获取。维生素C的代谢过程涉及多个酶和转运蛋白。肠道微生物群可能通过影响这些酶和蛋白的活性或表达,来影响维生素C的代谢吸收过程。
维生素C也可以直接调节肠道微生物群,或通过修复肠道屏障、改变氧化还原电位等方式间接对肠道微生物群的平衡起到调节作用。
个体之间的差异、饮食习惯和生活方式等因素各不相同,这些都可能对维生素C与肠道菌群的相互作用产生影响。
本文将从维生素C的结构、功能、吸收和代谢、与肠道菌群的关联等多角度,全面探讨维生素C的作用及其对人体健康的影响,同时介绍了一些维生素C的食物来源、人体需要的剂量、如何补充、注意事项等。
▼
本文主要内容:

编辑
维生素C,也称为抗坏血酸,是一种水溶性维生素,对人体健康非常重要。它在许多身体功能中起着关键作用,包括增强免疫力、抗氧化、胶原蛋白的合成等。
▼
维生素C的化学名称是L-抗坏血酸,它是一种有机化合物。无臭,味酸,易溶于水,微溶于乙醇,不溶于乙醚。
维生素C结构简单,化学式为C6H8O6:
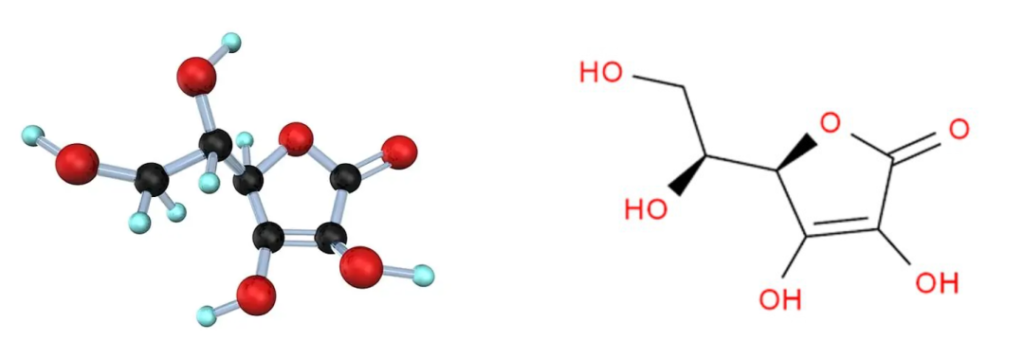
这种结构使维生素C具有抗氧化性质,能够捕捉自由基,并保护细胞免受氧化损伤。
注:体内的分子暴露于环境污染物、吸烟和慢性炎症等情况时,它们会变成自由基。自由基是不稳定的分子,会破坏细胞并导致疾病,维生素C可以通过中和自由基来减缓或预防某些健康问题。
由于其与葡萄糖的结构相似,维生素C可以在许多化学反应中取代葡萄糖,并且可以防止蛋白质的非酶糖基化。
▼
维生素C参与胶原蛋白、激素、肉碱的合成,促进铁离子的吸收,此外,它在免疫系统的功能和调节中发挥着重要作用,对维持内部环境的平衡和中枢神经系统的正常功能极为重要。
维生素C的大部分功能是由于其作为抗氧化剂和辅助因子的能力。由于人类缺乏L-gulono-1, 4-lactone氧化酶,无法自行合成维生素C,因此完全依赖于维生素C的饮食摄入。
▼
从食物中获取营养总是最好的。大约90%的日常需求来自蔬菜和水果,它们是这种维生素的极好来源,例如奇异果、橙子、芒果、草莓、红椒、青椒等。
一些维生素C含量较高的食物

注:单位“杯”是一个常见的非正式计量单位,美规和英规略有区别,大约是237毫升-250毫升左右,涉及到果蔬的份量时,一杯通常是指将果蔬切碎后填满一杯容器的量。
▼
维生素 C 对大脑健康非常重要。大脑在长期缺乏维生素 C 的情况下以牺牲其他组织为代价来保留维生素 C,并且可以维持比其他器官(例如肝脏和肾脏)高很多倍的浓度,如下图。
维生素C的分布在身体各器官之间差异很大
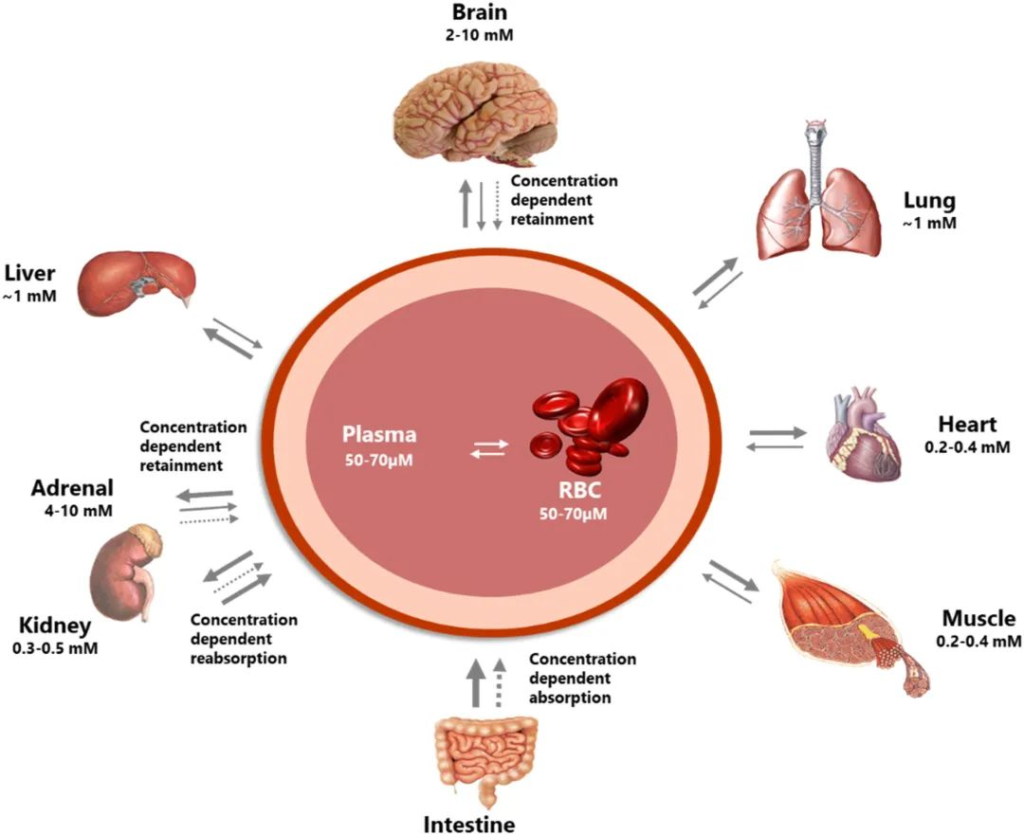
doi.org/10.1016/j.redox.2020.101532
维生素C供应不足时,首先保证大脑里的浓度,那么维生素C对于大脑而言有什么作用?
▼
维生素 C 对胶原蛋白的稳定作用对于形成整个身体的结缔组织框架至关重要;包括皮肤、骨骼、软骨、肌腱、韧带、血管等。
胶原蛋白生产的最后步骤取决于维生素 C,维生素 C 在前胶原脯氨酰和赖氨酰残基的羟基化中充当电子供体。
▼
维生素 C 可增强其他营养素的生物利用度,例如维生素 E 和非血红素铁,这可能会增强含维生素 C 的食物的健康效果。
维生素C经常添加到含铁的口服制剂中,以增加铁的吸收。
▼
维生素 C 是否可以预防或减轻包括普通感冒在内的感染的严重程度是一个有争议的话题。大多数证据都支持其好处。
▼
维生素C对正常骨骼发育至关重要。维生素C水平与骨骼健康之间存在正相关关系,如骨密度、骨折概率、骨转换标志物等。
▼
维生素 C 有助于维持健康的皮肤。
▼
肺部的维生素C水平是血液中的30倍。
维生素C在抵御氧化剂的同时也会被消耗,这表明即使是单剂量的维生素C,也能有效抵御肺部氧化应激的急性增加。
▼
根据现有证据,摄入足够的维生素 C 可能有助于保持健康的情绪。
焦虑
抑郁
▼
人类慢性低维生素 C 状态与神经退行性疾病有关。但是,尚未确定因果关系。
▼
维生素 C 可以通过抑制炎性细胞因子来减轻炎症。
▼
除上述主要的功能之外,在部分小型研究中提到的关于维生素C的功能如下:
助孕育:
助减肥:
降血压、防中风:
降血糖:
助排毒:
助抗癌:
牙周健康:
水溶性维生素在人体内储存较少,从肠道吸收后进入人体的多余的水溶性维生素大多从尿中排出。因此,摄入较多的水溶性维生素一般不会引起中毒现象,但是若摄入量过少,则会很快出现缺乏症状。
▼
刚缺乏的时候症状不明显,饮食中缺乏VC需要大约一个月的时间才会出现症状。
体内维生素C总含量低于300-400mg会出现明显症状。
维生素C的缺乏会出现什么症状?
由于维生素C功能的复杂性及其被不同还原剂的部分替代性,维生素C与坏血病症状的直接联系不容易确定。
如果发展为坏血病,典型症状是:
肌肉无力、牙龈肿胀和出血、牙齿脱落、瘀点出血、自发性瘀斑、贫血、愈合障碍、角化过度、虚弱、肌痛、关节痛和体重减轻(也可能因肿胀而出现矛盾的体重增加),而早期表现包括嗜睡、倦怠、易激惹,甚至呼吸困难等。
在生化上,维生素C血浆水平低于11μM被认为与坏血病的临床症状一致。
在专业医疗人员的指导下,补充维生素C可以轻松有效地逆转坏血病。许多症状可以在几周内轻松解决。富含维生素C的饮食将防止坏血病的发展。
什么人群更容易发生维生素C缺乏?
▼
NIH 认为,成人可耐受的上限是每天 2000 毫克,仅仅靠含有维生素 C 的食物几乎不可能达到这一上限,所以食物可以放心吃。服用补充剂则需注意剂量,可能存在过量的风险。
更高的剂量更有可能导致副作用。
维生素C过量可能会出现什么症状?
单次口服5-10克维生素C会产生短暂的渗透性腹泻和/或腹胀伴疼痛,不建议这样做。
随食物一起摄入可减少这些不良反应。
每天超过 2000 毫克的剂量可能会增加腹泻和肾结石的风险。如果有肾结石病史,每天摄入超过 1000 毫克可能会增加患结石的几率。
那么到底应该怎么补充?每日摄取多少维生素C 合适呢?
▼
科学界对维生素C的最佳剂量方案(摄入量和频率)最健康存在持续争论。
对于大多数健康人来说,通过食物可以获得足量的维生素 C。
维生素C摄入量标准在不同地区有所不同:
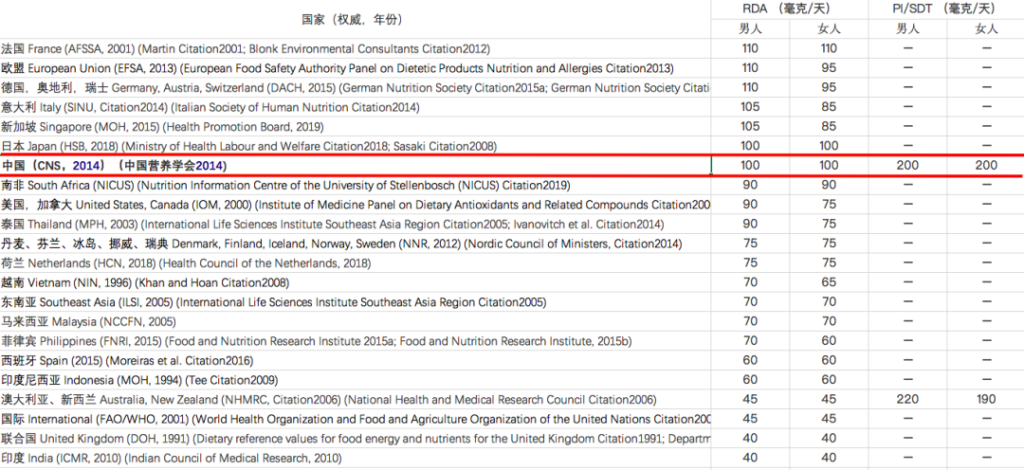
注:RDA – 推荐膳食摄入量,
PI – 建议摄入量,SDT – 建议膳食目标
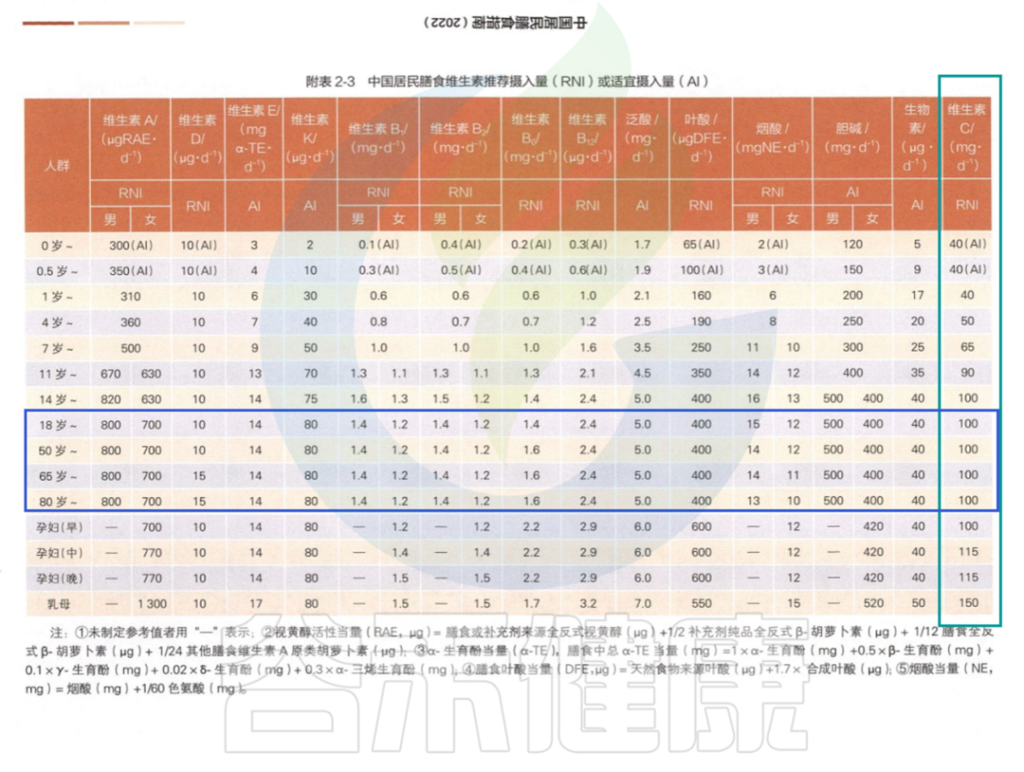
在中国营养学会编著的《中国居民膳食指南》2022版中对维生素C的推荐摄入量:
中国居民膳食指南2022版
为什么不同地区的标准不一样呢?
这主要是由于RDA标准的基本前提从预防坏血病(~45 mg/d)至健康优化(~200 mg/d)。许多权威机构建议使用最低量的维生素C,但这可能无法满足不同亚群的健康需求。
例如,吸烟者和肥胖者比普通人群有更高的要求。一些国家的吸烟率继续上升,有证据表明,吸烟者每天至少摄入200 mg的维生素C。
随着全球肥胖率的增加,以及与肥胖相关的合并症,如代谢综合征、糖尿病和心血管疾病,需要更多地考虑适当的建议,以优化快速增加的亚健康人群中的维生素C状态。
以上是维生素C的摄入量标准,具体该如何补充,应该注意什么?详见下一章节。
▼
食物:如何才能最大程度地保留其维生素C?
——烹饪方式
长时间烹饪,特别是用大量水煮沸会导致维生素C浸出到水中,显著降低食物中的维生素C含量。
在少量水中蒸或煮,且持续时间较短,是保存维生素C的更温和的方法。
即使将所有外部因素消除到最低限度,也会发生损失,因为由于抗坏血酸氧化酶的存在,材料内部会发生氧化反应。因此,理想的加工方法是用最少量的水快速热灭活酶,然后快速冷却。
——长期保存条件
温度对储存稳定性也有很大影响。随着温度的升高,会出现更显著的损失。然而,在长期储存期间,即使维持短期储存期间仅发生少量损失的条件,维生素C的量也会显著减少。
损失主要是由于酶催化的氧化反应,其程度尤其取决于pH、材料完整性和温度。
总之,为了使水果和蔬菜的维生素C含量保持更长时间,最温和的方法是深度冷冻。
补充剂:一天中分几次服用
食物和许多补充剂中的维生素 C 是一种抗坏血酸的形式。
当肠道面临较低水平的抗坏血酸(即低于约 400 毫克)时,主动运输系统会吸收维生素 C(即,将营养物质通过肠道并进入血液,到身体需要的地方)。
一旦这些主动运输变得不堪重负,被动扩散就会接管吸收其余的维生素 C(这是一个相当低效的过程)。吸收并不像听起来那么容易,事实上抗坏血酸有吸收上限。
身体一次可以处理大约 300 – 400 毫克的纯抗坏血酸形式的维生素 C,更多量一下子难吸收。
所以如果能记得的话,一天中分几次服用比较合适。
▼
维生素C补充剂并非适合所有人。如果遇到以下任何情况,请首先与医生联系:
也不要认为维生素C服用越多越好,每天服用 1000 毫克或更多,实际上会使吸收率降低约 50%。
▼
维生素C可以增加某些药物的吸收,例如:
服用维生素C可以增加含铝药物(如磷酸盐粘合剂)对铝的吸收。这可能对有肾脏问题的人有害。抗酸剂中含铝:不要同时服用维生素C和抗酸剂。服用维生素C后至少等待两个小时,然后再服用抗酸剂。服用抗酸剂后等待四个小时服用维生素C。
维生素C可能会增加左旋甲状腺素的吸收。
补充维生素C会降低一些药物的疗效:
口服维生素C可能会降低这些抗病毒药物的作用。
当与维生素C一起服用时,烟酸和他汀类药物的影响可能会降低,这可能有益于高胆固醇的人。
高剂量的维生素C可能会降低人体对这种抗凝剂的反应。
其他还包括:
维生素C增加或减少药物副作用的风险
如果服用雌激素或基于雌激素的避孕药,维生素C可能会增加激素副作用的风险。这是因为维生素C可能会减缓雌激素离开身体的速度。
一些早期的研究认为, 维生素C可能有助于预防阿司匹林和非甾体抗炎药引起的胃部不适。
▼
维生素 C 和益生菌对肠道健康和免疫力有不同的好处,它们可以很好地互补,这意味着它们可以安全地一起服用。
一项针对学龄前儿童的双盲、随机、安慰剂对照初步研究中,发现益生菌与维生素 C 联合预防呼吸道感染的功效(URTI;33%,P =0.002)。
Lab4 益生菌和维生素 C 组合补充 6 个月的儿童显示,上呼吸道感染症状的发生率和持续时间有所减少,降低感染的严重程度。
注:Lab4 益生菌包含:嗜酸乳杆菌CUL21(NCIMB 30156)和CUL60(NCIMM 30157),双歧杆菌CUL20(NCIMB 30153)和动物双歧杆菌乳亚种CUL34(NCIMM 30172)。
注意:根据说明书剂量服用或遵医嘱。
以上并不是维生素C可能发生的相互作用的完整列表。在开始补充维生素C或调整摄入量之前,请与医生或药剂师沟通,让医生知道你正在服用的所有药物,包括处方药和非处方药、其他维生素或微量营养素、草药补充剂等。
▼
静脉注射和口服给药,这两者可能具有不同的药代动力学特征。
药理学模型显示,口服维生素C,即使是在非常大和频繁的剂量下,也只能适度地增加血浆浓度,从0.07 mM增加到最大0.22 mM。
而静脉注射剂量预计会导致血浆维生素C峰值水平比口服剂量高60倍以上,尿液浓度比口服剂量低140倍。
分子的实际生物利用度由许多因素控制,包括肠道和其他组织的吸收、肾脏的吸收和排泄以及其他患者特异性因素。
除了通过静脉给药和口服给药的浓度差异外,口服给药将维生素C直接输送到肠道微生物组,而不是通过血液;因此,它对肠道微生物的影响可能与动力学和浓度有关,这与影响血浆水平的动力学和浓度完全不同。
静脉注射维生素C常用于临床医疗环境中,用于治疗某些疾病或特殊情况下的高剂量补充,如感染、外伤、手术恢复等。专业医生会给予相应的建议。
口服给药适用于一般的日常维生素C补充,维持正常的维生素C水平。
有几种方法可以评估人体中的维生素C状态。这些包括测量血浆、尿液、组织、粪便中维生素 C 的浓度。
▼
检测血浆维生素C,血浆样品中维生素C的定量测定常见的有两种方法:酶法和色谱法。
酶促维生素C测定
有几种基于维生素C的酶促转化的商业试剂盒,产生可以用光光谱法检测的信号。通常,抗坏血酸氧化酶用于这种类型的测定。这些测定的常见方法是酶联免疫吸附测定(ELISA),它非常适合分批处理样品,但不太方便立即测定少数样品中的值。
根据欧洲外部质量评估计划(Instand EQAS)中报告的方法,基于酶的分析方法在医院中并不常规使用。如果临床对立即测定维生素C的需求增加,由于其直接的技术性质,这些基于酶的测定可用于护理点或集中平台。
色谱法测定维生素C
抗坏血酸和DHA的定量测量目前是通过高效液相色谱(HPLC)方法进行的。如果必须分析具有相似性质的多种化合物,或者如果存在许多可能干扰感兴趣化合物定量的物质,则HPLC方法是优越的。
将酸化样品注射到HPLC仪器中后,通过通过基于化合物的物理性质不同地保留化合物的柱来分离化合物。结果,在分离柱的末端,可以选择性地检测抗坏血酸和DHA,而不受其他化合物的干扰。
目前有两种方法可以检测分离后的抗坏血酸和DHA,一种是电化学检测,另一种是紫外线检测。这两种检测方法给出的结果相同,但由于相对技术简单,紫外线检测更广泛地用于日常检测。
其他检测技术,如荧光检测,需要在柱前对抗坏血酸和DHA进行化学改性,但使用较少。比色/荧光法可能会产生更高的DHA浓度,因为该方法缺乏特异性。
▼
可以查看近期体内维生素状况。
肠道菌群可以影响食物中的营养物质的吸收和利用。肠道菌群的失调可能会影响维生素C吸收,从而出现维生素C缺乏,引发一系列健康问题。因此,检测肠道菌群的状况,可以帮助我们更好地了解维生素C的吸收和利用情况。
与抽血检测不同,肠道菌群的评估更加反映一段时间 ( 一般2周左右 ) 的长期状态,如部分维生素无法在体内留存,需要每日补充,血液检测波动较大。
肠道菌群与维生素C的水平之间存在怎样的关联?
为什么肠道菌群检测报告可以了解维生素情况?
我们来看下一章节。
我们在日常生活会看到,同样吃食物,有些人的维生素吸收状况比较好,有些人就容易缺乏,这是为什么呢?
为什么大剂量补充对一些人的身体有益,而少数人因为过量出现了肾结石呢?
这其实都与肠道微生物群相关。
这里我们分为两个方面来讨论:
一个是肠道微生物群对维生素C的影响,
一个是维生素C的补充对肠道微生物群的影响。
维生素C在人体代谢过程中的吸收和利用,与肠道微生物群相关。了解肠道微生物群对维生素C的吸收和利用的影响,可以帮助我们更好地理解其与人体健康之间的关系。
▼
微量营养素使用各种特定的吸收途径和机制,既可以是被动的,也可以是主动的。
膳食维生素 C 很容易通过钠依赖性维生素 C 转运蛋白(SVCT1 和 SVCT2)在肠道中吸收,其他比如维生素A 、维生素D 的吸收通过小肠中的被动扩散发生。
肠道微生物群是人体肠道中的有效生物反应器,可将各种化合物转化为有益或有害的代谢物,因此对其生物利用度起着至关重要的作用。
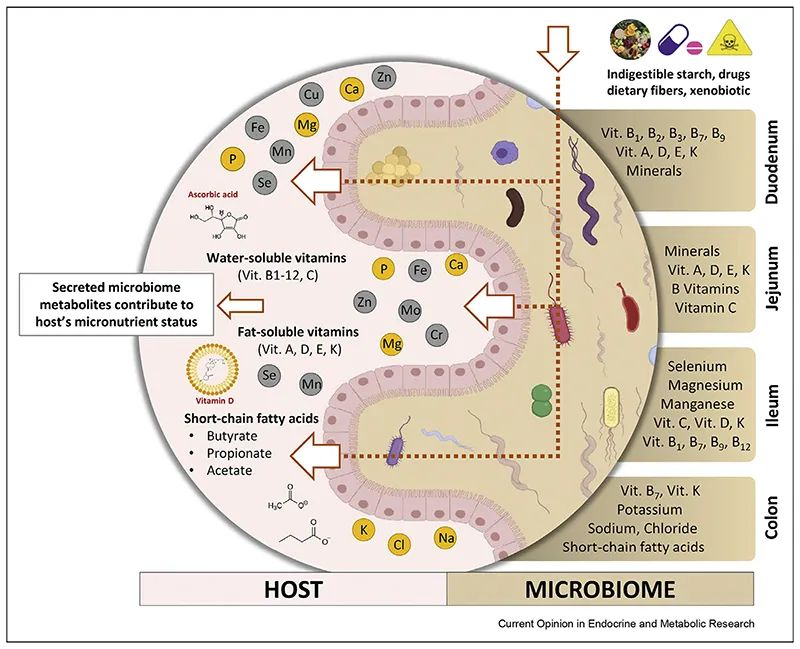
doi: 10.1016/j.coemr.2021.100285
胃肠道各部分理化特性的差异,以及位点特异性受体的存在,使得不同的维生素和矿物质能够沿胃肠道吸收。不同微生物在每个不同部分的定殖会影响当地环境,从而对微量营养素的生物利用度产生积极或消极的影响。
微生物可以干扰维生素C的吸收
微生物可以通过干预生物合成过程和调节吸收,来调节微量营养素的水平,包括维生素C。
来自革兰氏阴性菌的脂多糖降低SVCT-1的表达,进而降低SVCT-1-介导的维生素C的摄取。
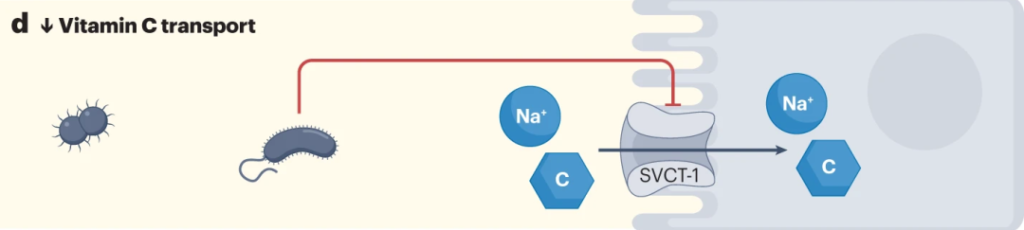
Chmiel JA, et al.,Nat Rev Urol. 2023
大肠杆菌可以通过释放脂多糖来减少宿主对抗坏血酸的摄取,从而增加NF-κB依赖性TNF的产生,其进而通过抑制SLC23A1和SLC23A2启动子(分别编码SVCT1和SVCT2),来降低钠依赖性维生素C转运蛋白SVCT1与SVCT2的表达。从而对维生素C的吸收率产生负面影响。
细菌可以与宿主竞争维生素C
大肠杆菌抗坏血酸转运蛋白对抗坏血酸的亲和力高于哺乳动物SVCT1,这表明细菌可以与宿主竞争维生素C。
因此,肠道菌群中大肠杆菌等革兰氏阴性菌占比较多的情况,可能不利于维生素C的吸收,这在谷禾肠道菌群检测报告中也是可以反映的。
▼
肠道细菌如大肠杆菌和乳酸杆菌代谢维生素C。
利用ula基因簇,大肠杆菌等细菌可以将抗坏血酸代谢为D-木酮糖,宿主细胞可以进一步加工木酮糖以产生草酸盐。
在肺炎链球菌、沙门氏菌、福氏志贺菌、粪肠球菌、肺炎克雷伯菌等病原菌中,也发现了相同的ula基因簇。
带ula的致病菌与草酸盐:携手制造结石
结石形成者(比如肾结石患者)微生物群更常见地富含携带ula基因簇的致病菌,并且这些患者在接受口服维生素C时,草酸盐增加的水平比非结石者增加得更多。高草酸盐水平增加了结石的风险。
因此,如果在肠道菌群检测报告中发现以上提到的致病菌占比较多,则有可能在代谢维生素C的时候产生的草酸盐过多,增加了结石的风险。
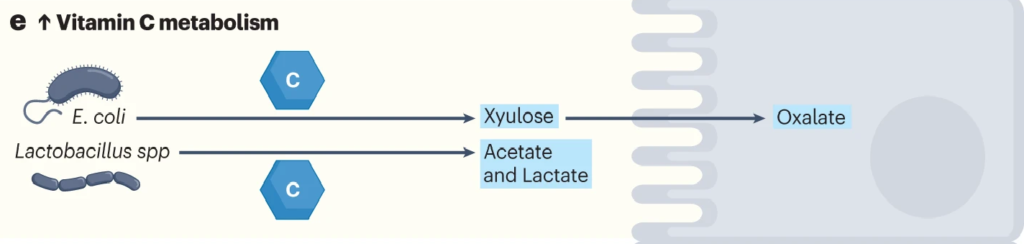
Chmiel JA, et al.,Nat Rev Urol. 2023
“
以上通过微生物群代谢维生素的机制,有助于我们更好地理解结石形成的机制。
既然有促进结石的细菌,自然也有降解的细菌:
一些乳酸杆菌可以将维生素C转化为乙酸盐和乳酸盐,这是一种无毒的代谢产物,通过生物能量途径增加微生物组的功能,并可能促进这些草酸降解细菌的定植。
Oxalobacter formigenes是一种革兰氏阴性厌氧细菌,可降解肠道草酸盐并促进原发性高草酸条件下肠道草酸盐的分泌。该菌在肠道定植可降低尿液或血浆中的草酸盐浓度。
Barone M, et al., Biofactors. 2022
我们看到生活中有人认为不能吃生菠菜,会得肾结石,但有些人每天吃生菠菜也没事…其实可能是因为人家的肠道菌群中致病菌较少,而降解草酸的菌群又在拼命干活…
因此,健康的肠道菌群结构非常重要,菌群在该干活的时候各司其职,井井有条,那么你的身体抵抗疾病的能力也随之提升。
以上是肠道菌群对维生素代谢吸收的影响,反过来,维生素C的补充也可以影响肠道菌群的组成。
二、
补充维生素C可以直接调节肠道微生物群,也可以通过改变氧化还原电位、修复肠道屏障,改善肠道条件,支持部分有益菌生长,防止有害菌泄漏到身体其他部位。
▼
维生素C直接调节肠道菌群
与安慰剂组相比,补充维生素C已被证明可以显着增加微生物生态系统的多样性,以及Collinsella的相对丰度和粪便水平的短链脂肪酸,特别是丁酸盐和丙酸盐。
在健康受试者中,每日高剂量维生素C补充(1000 mg/天):
下列菌群的相对丰度升高
下列菌群的相对丰度下降
一项观察性研究探讨了微量营养素维生素C对肠道微生物组组成和多样性的影响。结果表明,维生素C增加了肠道中双歧杆菌属的丰度,在科水平上,毛螺菌科和双歧杆菌科显著增加。
双歧杆菌属的成员是有益菌,例如增加ATP生成、调节免疫系统、黏膜屏障完整性、短链脂肪酸的产生,对健康有益,维生素C通过增加肠道有益菌促进健康。
研究发现,囊性纤维化患者维生素C摄入量的增加与厚壁菌门的丰度呈正相关,与拟杆菌门的丰度呈负相关。
▼
改变氧化还原电位
调节微生物组的机制类似于维生素B2:通过改变氧化还原电位,改善消化道中的厌氧/耐氧平衡,从而选择性地支持微生物生长,改善肠道条件。
与安慰剂相比,维生素C组粪便样本中的粪便pH值和氧化还原平衡降低。
▼
修复肠道屏障
我们知道,肠道屏障受损,细菌和有害物质有可能会穿过屏障进入血液循环,对人体产生各种负面影响,导致诸如过敏、炎症、自身免疫疾病等多种反应。
关于肠漏可以详见我们之前的文章:
而维生素 C 具有维持肠粘膜屏障完整性和修复粘膜屏障的作用。
这里介绍两种修复肠屏障机制。
——通过激活Notch 信号
Notch 信号影响细胞正常形态发生的多个过程,与许多人类疾病有关,包括IBD,因此被认为是癌症治疗的潜在靶点。Notch 信号通路的激活会改变紧密连接蛋白的表达并影响其分布的连续性,从而降低细胞屏障通透性。
豚鼠结肠组织相关基因检测表明,低剂量的维生素C可强烈激活Notch/Hes-1信号通路,对DSS诱导的结肠炎豚鼠的肠粘膜具有一定的保护作用。肠上皮受损时,Notch-1表达增加可促进上皮细胞增殖,有利于损伤部位的修复和重建。
——通过增加肠道胶原蛋白合成
增加维生素 C 摄入量的另一个潜在好处是肠道胶原蛋白合成增加,从而改善屏障功能。这一提出的机制与抗坏血酸的辅酶功能一致,即羟基化脯氨酸和赖氨酸以交联胶原蛋白。
例如,对具有吲哚美辛诱导的屏障功能障碍的 T84 人隐窝样上皮细胞系的研究表明,细菌通过跨细胞途径穿过上皮细胞,维生素 C 治疗可消除该途径。因此,肠道中抗坏血酸状态不佳可能会加剧屏障功能障碍,从而增加 LPS 衍生的革兰氏阴性菌的易位,从而加剧炎症。
维生素C修复肠道屏障后,肠道屏障可以正常发挥吸收、分解和转换营养物质等功能,同时可以帮助促进健康微生物群栖息和生长,从而促进整体健康。
以上我们了解到,维生素C可以通过多种方式影响肠道菌群,从而促进整体健康。那么当我们看到肠道菌群报告中菌群多样性较低,部分菌群失调,尤其是上面提到的毛螺菌科、肠球菌属、Collinsella、Gemmiger formicilis等,可以考虑通过补充维生素C来调节。
我们首先可以考虑通过食物补充,如卡姆果、针叶樱桃等维生素C含量很高的食物,或者一些常见的蔬菜水果例如:猕猴桃、番石榴(芭乐)、青椒、羽衣甘蓝等。也可以考虑通过维生素C补充剂调节。
人体维生素研究面临着许多挑战,维生素通常是通过食物摄入的,而食物中同时存在多种营养素,这使得难以研究单一维生素的作用;某些高剂量维生素的使用可能存在潜在的风险,进行研究时涉及到人体试验和干预,需要遵循伦理准则,并确保研究的安全性;不同人对维生素的需求和代谢能力存在个体差异,基因、环境和生活方式等因素都可能影响维生素的吸收、利用和代谢。
肠道菌群研究可以揭示不同个体之间菌群组成的差异,这有助于理解个体差异对维生素代谢和利用的影响。可以通过检测肠道菌群的组成和丰度,了解维生素的代谢情况,从而辅助评估维生素水平。
综合运用多种研究方法和技术,结合肠道菌群检测,可以考虑多个因素对维生素代谢和利用的综合影响,进一步理解维生素的作用机制,对人体健康具有重要意义。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Barone M, D’Amico F, Brigidi P, Turroni S. Gut microbiome-micronutrient interaction: The key to controlling the bioavailability of minerals and vitamins? Biofactors. 2022 Mar;48(2):307-314.
Chmiel JA, Stuivenberg GA, Al KF, Akouris PP, Razvi H, Burton JP, Bjazevic J. Vitamins as regulators of calcium-containing kidney stones – new perspectives on the role of the gut microbiome. Nat Rev Urol. 2023 May 9:1–23.
Pham VT, Dold S, Rehman A, Bird JK, Steinert RE. Vitamins, the gut microbiome and gastrointestinal health in humans. Nutr Res. 2021 Nov;95:35-53.
Li XY, Meng L, Shen L, Ji HF. Regulation of gut microbiota by vitamin C, vitamin E and β-carotene. Food Res Int. 2023 Jul;169:112749.
Yang Q, Liang Q, Balakrishnan B, Belobrajdic DP, Feng QJ, Zhang W. Role of Dietary Nutrients in the Modulation of Gut Microbiota: A Narrative Review. Nutrients. 2020 Jan 31;12(2):381.
Steinert RE, Lee YK, Sybesma W. Vitamins for the Gut Microbiome. Trends Mol Med. 2020 Feb;26(2):137-140.
Gomes-Neto JC, Round JL. Gut microbiota: a new way to take your vitamins. Nat Rev Gastroenterol Hepatol. 2018 Sep;15(9):521-522.
Rowland I, Gibson G, Heinken A, Scott K, Swann J, Thiele I, Tuohy K. Gut microbiota functions: metabolism of nutrients and other food components. Eur J Nutr. 2018 Feb;57(1):1-24. doi: 10.1007/s00394-017-1445-8. Epub 2017 Apr 9. PMID: 28393285; PMCID: PMC5847071.
Traber MG, Buettner GR, Bruno RS. The relationship between vitamin C status, the gut-liver axis, and metabolic syndrome. Redox Biol. 2019 Feb;21:101091.
Rozemeijer S, Spoelstra-de Man AME, Coenen S, Smit B, Elbers PWG, de Grooth HJ, Girbes ARJ, Oudemans-van Straaten HM. Estimating Vitamin C Status in Critically Ill Patients with a Novel Point-of-Care Oxidation-Reduction Potential Measurement. Nutrients. 2019 May 8;11(5):1031.
Otten AT, Bourgonje AR, Peters V, Alizadeh BZ, Dijkstra G, Harmsen HJM. Vitamin C Supplementation in Healthy Individuals Leads to Shifts of Bacterial Populations in the Gut-A Pilot Study. Antioxidants (Basel). 2021 Aug 12;10(8):1278.