 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
组胺是人体内的一种生物胺,最为人们所熟知的作用是作为过敏反应的介质,但也是神经系统、肠道、皮肤和免疫系统中重要的信号分子。
花粉之所以会引起人体过敏反应,并不是因为花粉本身,而是由于花粉颗粒携带了能引起过敏的抗原。接触过敏源后,体内的组织会释放组胺,作为一种神经递质,组胺会使毛细血管和微静脉的管壁通透性增加,导致局部组织水肿,造成皮肤发红、疹块;也会使气管平滑肌收缩,造成呼吸道狭窄,引起气喘、呼吸困难。
组胺主要由肥大细胞和嗜碱性粒细胞等免疫细胞产生和释放。一些细胞如树突状细胞或T细胞可以表达组氨酸脱羧酶,这是一种在刺激后合成组胺的酶。
尽管如此,一些食物中的微生物群和部分人体肠道微生物群也可以分泌组胺。表明组胺在肠道免疫调节中的潜在作用。事实上,最近的一项研究表明,组胺可以通过抑制肠道中白细胞介素18的产生来发挥抗炎作用。
组胺在免疫反应、神经传递和过敏反应中发挥着重要作用。在某些浓度范围内,组胺起着保护作用,对于维持健康状态至关重要。例如组胺可以刺激胃酸分泌,有助于消化;还会影响排便情况;组胺作为重要的神经递质,参与睡眠调节和体温调节。
然而,在较高浓度下,会导致包括组胺中毒和组胺不耐受或扩张血管,影响血压,导致免疫调节紊乱、胃肠道症状和神经系统疾病。组胺中毒是在食用被大量组胺污染的食物后发生的。如果个体由于基因突变而缺乏生物胺降解能力,或者正在服用单胺氧化酶抑制剂等抗抑郁药来减缓胺的降解,他们就会更容易出现组胺不耐受的症状。
组胺在体内与相应受体(H1、H2、H3、H4)结合而介导的各种症状。不同类型的组胺受体与该化合物之间的相互作用可能会引起多种影响,例如H1R主要介导过敏反应,而H2R具有抗炎作用,而H3R主要影响睡眠、认知障碍等精神健康。
肠道内的组胺对许多细胞过程的广泛影响会导致各种胃肠道疾病,包括食物过敏、肠易激综合征、炎症性肠病、结直肠癌等。谷禾将在本文带大家了解组胺在免疫及各种肠道疾病中的保护或致病作用。
组胺(C5H9N3)是一种重要的生物胺类神经递质,于20世纪初首次发现。从那时起,它的功能开始被逐渐发现并得到越来越详细的描述。
组胺存在于多种细胞类型中,是人体的关键信号分子,具有多种功能。例如作为神经递质或免疫反应调节剂。
拓展知识:组胺的发现
1903年,一位叫威廉·邓巴的医生证明了吸入花粉后的过敏反应并不是由花粉本身引起的,而是机体对花粉的反应引起的一种毒素的释放所造成的。
后来,亨利·戴尔于1910年在研究黑麦的毒性时,从麦角菌中提取出一种叫做组织胺的物质。他发现用组胺可以人工诱发荨麻疹。如果将组胺滴入气管,还会诱发哮喘发作。
★ 组胺的重要作用
介导过敏反应
组胺最被人熟知的是在过敏反应中的作用。例如在过敏性鼻炎、荨麻疹和血管神经性水肿等过敏性疾病中发挥重要的病理生理学作用。
当免疫系统对过敏原产生过度反应时,免疫细胞(如肥大细胞和嗜酸性粒细胞)会释放存储在细胞内的组胺。释放的组胺会结合到特定的受体上,引发一系列生理反应,例如瘙痒、肿胀、打喷嚏等。
扩张血管,影响血压
组胺对人心血管系统最突出的作用是扩张小血管。血管扩张使外周阻力降低,血压下降,并伴有潮红、头痛等症状。
组胺还增加毛细血管的通透性,使渗出增加,引起水肿,严重时甚至导致循环血量减少,可能引起休克。组胺对心脏的直接作用包括增强心肌收缩力、加快心率和减慢房室传导。
刺激胃酸分泌
首先,组胺可以刺激胃黏膜细胞中的H2受体,当组胺与H2受体结合时,会激活细胞内的信号转导通路,导致胃壁上的壁细胞释放胃酸。
其次,组胺还可以通过刺激嗜酸性细胞(胃窦细胞)来促进胃酸的分泌。嗜酸性细胞是胃黏膜中的一种细胞类型,它们包含大量的组胺。当胃黏膜受到刺激时,嗜酸性细胞会释放存储的组胺。释放的组胺通过与H2受体结合,刺激壁细胞分泌胃酸。
影响排便
一项研究中,发现细菌产生的组胺与小鼠结肠运动和粪便排出量增加有关,并且组胺受体拮抗剂治疗在很大程度上阻断了细菌组胺对结肠运动的影响。
收缩平滑肌
此外,组胺会诱导平滑肌细胞(包括支气管和肠道)收缩,哮喘患者对组胺比正常人敏感100~1000倍,组胺可引起支气管痉挛导致呼吸困难。组胺收缩胃肠平滑肌和子宫平滑肌还会引起痉挛性腹痛。
重要的神经递质
在中枢神经系统中,组胺作为一种神经递质,参与睡眠调节和体温调节等生理过程。组胺对感觉神经末梢有强烈的刺激作用,尤其对调节痛和痒的神经,该效应由H1受体所调节。
除此之外,有研究发现组胺还会影响伤口愈合、食欲和情绪等方面。
组氨酸是组胺的前体物质
组胺的主要细胞来源是肥大细胞和嗜碱性粒细胞。在细胞的高尔基体中,组胺是通过组氨酸脱羧酶将L-组氨酸氧化脱羧形成的,其辅助因子是吡哆醛(维生素B6)。
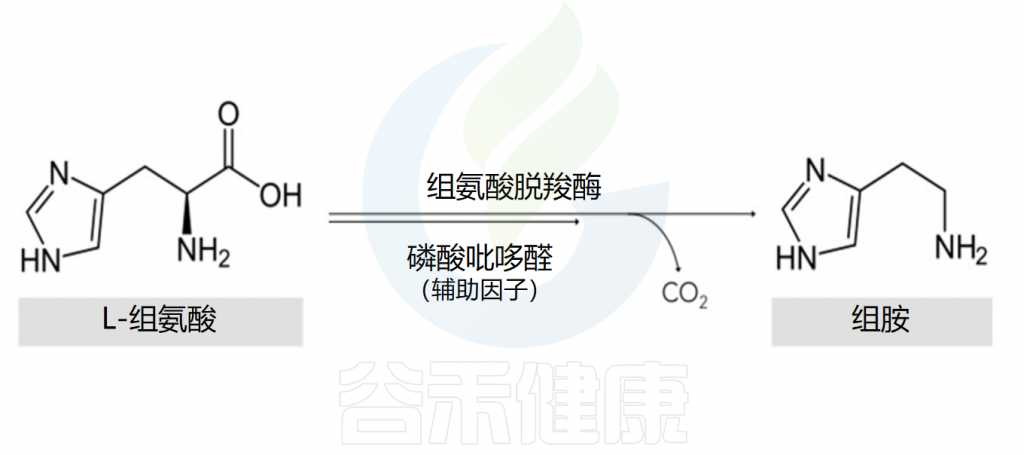
Comas-Basté O,et al.Biomolecules.2020
该反应的结果是组胺的形成,组胺随后与其他胺(如5-羟色胺)、蛋白酶、蛋白聚糖、细胞因子/趋化因子和血管生成因子一起储存在细胞质颗粒中,并在细胞致敏和脱颗粒后释放。
过敏时组胺会大量释放
肥大细胞的脱颗粒和组胺的释放主要是由于特异性抗原与FcRI受体结合以及对非免疫刺激(例如神经肽、补体系统的一部分、细胞因子、血小板活化因子)的反应。
IgE抗体是过敏性疾病期间肥大细胞脱颗粒的介质。IgE与其肥大细胞表面的高亲和力IgE受体的结合称为“致敏”。肥大细胞和嗜碱性粒细胞释放的组胺通过激活四种G蛋白偶联受体,即H1R、H2R、H3R(主要在大脑中表达)和H4R,发挥其生物活性。
细菌感染
某些细菌感染也可以引起组胺的释放。例如,胃幽门螺杆菌感染可以导致胃黏膜炎症,促使组胺释放,进而引发胃酸增多和溃疡等胃部疾病。
药物和化学物质
某些药物和化学物质也可以诱发组胺的释放。例如,非甾体抗炎药(如阿司匹林)和某些麻醉药物以及酒精可以引起组胺的释放,可能导致过敏样反应。
物理刺激
组胺释放也可由多种物理因素引起,如极端温度、创伤、摩擦等。这种情况下的组胺释放通常是局部性的,导致局部组织的充血和炎症反应。
运动和应激
剧烈运动、情绪激动和精神压力等也可以促使组胺的释放。这种情况下,组胺的释放通常是全身性的,可能导致血管扩张、心率增加和其他应激反应。
注:组胺也可以由其他细胞类型(例如胃肠嗜铬样细胞、组胺能神经元、树突状细胞、T淋巴细胞、血小板等)合成和释放。
食物和肠道微生物也是组胺的重要来源
一部分组胺通过食物进入人体或由肠道微生物产生。最受欢迎的富含组胺的食物是鱼和海鲜、发酵食品(如奶酪、葡萄酒、泡菜等)和一些蔬菜(如菠菜、茄子、番茄等)。
组氨酸主要在自溶或细菌过程中产生,因此高浓度的组胺主要存在于微生物发酵产物中。食品中生物胺形成的条件是游离氨基酸的可用性、脱羧酶阳性微生物的存在以及细菌生长和脱羧酶活性的条件。
影响细菌组氨酸脱羧酶活性的因素
细菌分泌脱羧酶受许多因素(例如,发酵碳水化合物、氧气或氯化物浓度的存在)调节。在酸性环境中,氨基酸脱羧酶活性的表达增加。
组氨酸脱羧酶活性较高的细菌种类有:
Morganella morganii,Eschericha coli, Hafnia alvei, Proteus vulgaris, Proteus milabilis, Enterobacter aerogenes, Raoultella planticola, Raoultella ornithinolytica, Citrobacter freundii, Pseudomonas fluorescens, Photobacterium damselae。其中一些细菌具有代谢组胺的能力。
我们将在下面的一个段落中展开讲述肠道中的组胺与微生物群。
在人体内,组胺降解主要有两种途径,涉及二胺氧化酶(DAO)或组胺-N-甲基转移酶(HNMT)。组胺降解酶缺失会导致组胺浓度过高甚至中毒,组胺不耐受患者就是组胺降解酶的酶活性降低或受到抑制,并且不足以灭活食物中的组胺并阻止其进入血液。
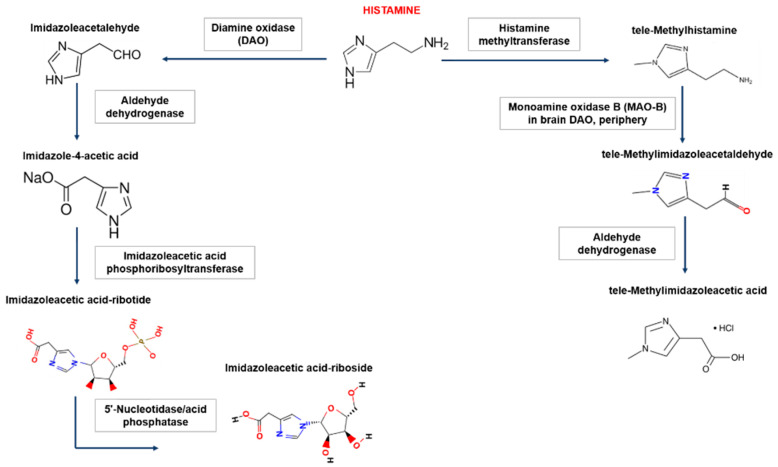
Shulpekova YO,et al.Nutrients.2021
组胺-N-甲基转移酶负责细胞内的组胺降解
组胺-N-甲基转移酶(HNMT)主要负责细胞内组胺的降解。HNMT在肾脏和肝脏以及脾脏、结肠、前列腺、卵巢、脊髓细胞、支气管和气管中的表达最高。一小部分组胺在HNMT的作用下转化为N-甲基组胺。
注:在原始形式中,约2%-3%的组胺被排泄。
二胺氧化酶负责细胞外的组胺降解
二胺氧化酶(DAO)是一种分泌蛋白,负责细胞外组胺的降解。DAO的最大活性记录在小肠、结肠、胎盘和肾脏中。DAO在细胞内囊泡中积累,然后进入细胞外空间,在那里降解组胺。绝大多数组胺通过DAO转化为咪唑乙酸。
保护身体免受组胺过高的侵害
二胺氧化酶执行“屏障功能”,从而限制组胺从肠道进入血液;组胺-N-甲基转移酶通过B族维生素和S-腺苷甲硫氨酸的参与使组胺甲基化,从而调节细胞内的组胺含量。
尽管二胺氧化酶和组胺-N-甲基转移酶这两种酶都存在于肠上皮中,但吸收组胺进入血流的主要障碍是 二胺氧化酶,组胺-N-甲基转移酶在此过程中仅发挥次要作用。在正常情况下,这种酶屏障足以防止组胺被吸收到血流中。
注:二胺氧化酶和组胺-N-甲基转移酶基因的多态性可能是组胺代谢个体差异的基础。在突触中,乙醛脱氢酶在组胺降解中发挥作用。
虽然健康人体内的组胺很快就会被二胺氧化酶降解,但即使在健康人体内,也可能会因摄入组胺含量高的食物(例如鲭鱼)导致血液中组胺浓度升高而出现严重症状——组胺中毒。
• 组胺中毒的症状
组胺中毒症状多种多样,可能包括口腔麻木、头痛、头晕、心悸、低血压、吞咽困难、脉搏微弱、荨麻疹、面部肿胀、潮红、呕吐、恶心和腹泻等。
组胺中毒的症状可能持续数小时或一天,但在极少数情况下,症状可能会持续数天。
• 组胺中毒的主要原因是食用鱼类和海鲜
不仅是鲭鱼,一些非鲭鱼(鲯鳅鱼、蓝鱼、沙丁鱼等)都含有大量组胺,此外发酵产品(奶酪、葡萄酒、罐头食品、腌制蔬菜和一些饮料)中组胺和血清素的含量也较高。
一项针对科学报告的分析显示,在98%的病例中,组胺中毒的原因是食用鱼类和海鲜,其余2%是由于食用奶酪等发酵食品。
鱼组织中的组胺是由多种细菌对游离组氨酸进行转化而产生的,这些细菌包括摩氏摩根菌(Morganellamorganii)、产气肠杆菌 (Enterobacter aerogenes), Raoultella planticola, Raoultella ornithinolytica和Photobacterium damselae。
鱼分解产生的其他物质会增强组胺的毒性并促进吸收
组胺中毒的发病机制不能仅用组胺的作用来解释。与口服等效剂量的纯组胺相比,鲭鱼毒性较高。还提出了其他机制,例如控制组胺的酶的抑制或增强、导致肥大细胞脱颗粒的物质的存在、其他组胺激动剂的存在。
鱼分解过程中产生的其他物质(尸胺和腐胺)会增强组胺的毒性,这些物质还会抑制肠道单胺氧化酶和二胺氧化酶,或从与粘膜粘蛋白的结合中释放组胺,促进其吸收。
组胺中毒后的干预及治疗
在生理值范围内。组胺中毒的病程通常是轻微的、自限性的、持续时间较短且不需要治疗。
对于严重的组胺中毒病例,需要进行治疗干预——支持性容量疗法和氧气疗法,并给予口服抗组胺药和支气管扩张剂。
组胺不耐受是由于组胺摄入量与机体清除能力不相称,导致组胺过度蓄积,并与相应的物质结合而出现症状的病理过程。
与组胺中毒不同,组胺中毒的严重程度与营养物质中组胺的含量成正比,组胺不耐受的发病机制与先天性或后天性缺乏中和组胺的酶有关。在健康患者中,肠上皮细胞具有由二胺氧化酶和组胺-N-甲基转移酶创建的酶屏障。该屏障可防止血液中外源性组胺的过度吸收。如果这些酶被抑制或减少,即使摄入少量的组胺也可能出现组胺不耐受的症状。
• 组胺不耐受的症状
组胺不耐受的神经系统症状包括头痛。除头痛外,其他重要症状包括弥漫性胃痛、绞痛、胀气和腹泻。
组胺不耐受的患者,在摄入组胺或酒精含量高的食物时或摄入后会出现流鼻涕、鼻塞等症状,极端情况下甚至会出现支气管哮喘发作、支气管收缩、咳嗽、喘息并伴有肺功能下降。
组胺不耐受患者还会出现皮肤瘙痒、发红、肿胀甚至荨麻疹。而患有组胺不耐受的女性会出现与月经周期相关的痛经和头痛。
• 影响组胺降解酶活性的因素
在胃肠道疾病(炎症性肠病、寄生虫感染、微生物菌群失调、代谢吸收不良)中,损伤的肠上皮细胞会减少二胺氧化酶的产生,或其他生物胺、酒精或药物也会抑制二胺氧化酶。
二胺氧化酶活性降低可见于慢性肾功能衰竭、病毒性肝炎、晚期肝硬化和慢性荨麻疹(一种典型的组胺相关疾病,对内源性组胺的耐受性降低)的患者。
二胺氧化酶降解能力下降还可能是由于缺乏其辅助因子、维生素B6、维生素C、铜和锌而导致的。
• 肠道微生物会影响组胺不耐受的发生
肠道微生物群也会影响组胺不耐受的发生。最近的研究表明,组胺不耐受可能是由肠道微生物群的改变引起的。肠道中大量的组胺分泌细菌可能会导致组胺不耐受。健康人体内双歧杆菌的数量较多。而在血清二胺氧化酶活性降低的人群中观察到变形菌属数量较多。
组胺不耐受人群存在肠道菌群失调
在组胺不耐受人群中观察到肠道菌群失调,与健康个体相比,与肠道健康相关的普氏菌科(Prevotellaceae)、瘤胃球菌(Ruminococcus)、粪杆菌(Faecalibacterium)和普拉梭菌(Faecablibacterium prausnitzii)的比例明显较低。组胺不耐受人群还具有显著更高丰度的组胺分泌细菌,包括葡萄球菌属和变形杆菌属、属于肠杆菌科的几个未识别属,以及产气荚膜梭菌和粪肠球菌。
需要注意的是,几项研究表明,即使在没有二胺氧化酶缺陷的个体中,大量的组胺产生细菌也会导致肠道内高水平组胺的积累、随后在血浆中的吸收以及不良反应的出现。
低组胺饮食
组胺不耐受疗法的基础是基于低组胺含量食物的消除饮食。一般来说,公认的饮食指南尚未制定;但是,建议避免食用富含组胺的食物如奶酪、油性鱼类和贝类,以及生发酵肉制品、腌菜、发酵豆制品、葡萄酒和啤酒、鸡蛋、巧克力和蘑菇。
避免食用易刺激组胺释放的蔬果
此外,应避免食用会刺激内源性组胺释放的蔬菜和水果(如菠菜、西红柿、柑橘类水果、草莓、茄子、鳄梨、木瓜、香蕉、猕猴桃、菠萝和李子)。


Kovacova-Hanuskova E,et al.Allergol Immunopathol.2015
补充二胺氧化酶
研究还发现补充二胺氧化酶可以改善组胺不耐受患者的生活质量。已开发出基于肠溶猪肾提取物的含二胺氧化酶食品添加剂。豆芽也被用作二胺氧化酶的来源,这种酶的活性是未发芽种子的250倍。
施用抗组胺药物
纠正组胺不耐受的药物方案基于使用组胺受体阻滞剂、肥大细胞膜稳定剂和其他具有抗组胺活性的药物。
在这方面,H1R拮抗剂是最有效的,特别是依巴斯汀。每天服用20毫克该药物,持续12周,46%的患者出现临床缓解。
一些生物活性物质有助于增强组胺降解
维生素C被用作纠正组胺不耐受的佐剂。每日剂量300-500毫克可增强组胺降解并抑制肥大细胞脱颗粒。
天然类黄酮(非瑟酮、山奈酚、槲皮素、芦丁和木犀草素)和活性生物碱小檗碱在体外抑制肥大细胞脱颗粒。这些都有助于减轻组胺不耐受。
虽然组胺含量过低的情况相对较少见,但也可能会对身体产生一些影响,包括:
• 伤口愈合减慢
组胺在人体中起着重要的调节作用,其能够帮助调节纤维细胞生长因子的生成,该成分可以加速局部肉芽的生长,帮助促进伤口的愈合。因此组胺含量较低时,伤口愈合能力也会减弱,速度会随之减慢。
• 消化不良
组胺可以通过刺激胃部,进而起到促进胃酸分泌的效果。若身体中没有组胺,则会导致胃酸减少,无法有效消化分解食物,进而引起消化不良的问题。
• 情绪不良
组胺还可以作为神经递质帮助调节中枢神经系统,而一旦没有组胺,则会影响中枢神经系统稳定性,引起睡眠异常、激素水平紊乱等情况,进而导致情绪不良。
• 血压升高
人体缺少组胺还会导致血压升高。因为组胺可以促进血管扩张,增加血管的通透性,所以具有降低血压的作用。若没有该成分,则血管会由于舒张能力减弱,因此出现血压升高的问题。
• 免疫力下降
组胺对免疫细胞,如吞噬细胞、T细胞、B细胞等,起到增强活性的功效,因此组胺还具有增强免疫功能的作用。若人体缺少该物质,则人体免疫力会下降,无法有效抵抗细菌、真菌等有害物质的侵入。
组胺对人体许多生理功能都可以起到积极作用,但是人体中的组胺也不能过量,否则容易导致过敏反应,出现头晕、皮肤瘙痒、胸闷等不适症状。
此种情况需及时就医,并且在医生的指导下服用抗组胺药物,例如盐酸西替利嗪片、氯雷他定片等药物,进行抗过敏治疗。
★ 组胺的免疫调节因受体的不同而存在区别
先天性和适应性免疫系统的细胞都可以被组胺调节。组胺的调节取决于它与组胺受体的四种亚型的结合,这些亚型按发现时间顺序命名——H1R-H4R,在多种细胞类型中差异表达,进而产生不同的作用。
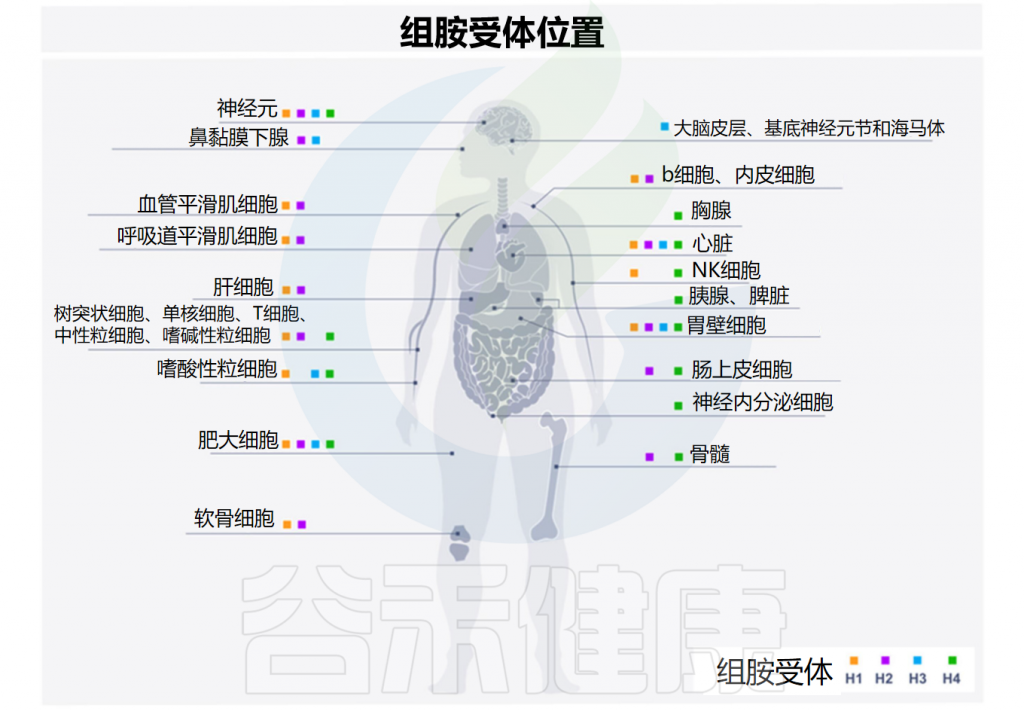
Smolinska S,et al.Metabolites.2022
1
H1R
H1R受体存在于几乎所有组织的内皮细胞和血管平滑肌细胞中(它们的密度在胃肠道中特别高),以及下丘脑、肾上腺髓质和免疫活性细胞(单核细胞、中性粒细胞、T细胞和B细胞)中。
• H1R受体介导的主要作用
H1R刺激的主要作用是炎症、全身血管舒张、血管通透性增加、支气管收缩、回肠收缩和昼夜节律周期调节。
外周H1R介导的影响包括鼻漏、支气管收缩、过敏反应、结膜炎和荨麻疹,而中枢相关的H1R影响包括食物和水摄入的调节、抽搐、注意力和睡眠调节。
• H1R是过敏反应的主要受体
IL-3、IL-4和组胺可上调H1R基因表达,而H1R激活导致许多与过敏性即时型超敏反应相关的特征,例如发红、瘙痒和肿胀。
例如小鼠模型中H1R的激活会诱导IFN(干扰素)产生增加,这与1型辅助性T细胞的增殖有关,并诱导促炎作用。
研究表明,瘙痒因子(例如神经生长因子、信号素 3A)的表达受组胺H1R的调节。在小鼠模型和特应性皮炎患者中,使用H1R拮抗剂可降低IL-31(白细胞介素-31)水平,这与瘙痒的发作有关。
2
H2R
与H1R类似,H2R的表达存在于多种组织和细胞中,包括脑、胃壁细胞、平滑肌细胞、T和B细胞、树突状细胞和心脏组织。H2R受体位于突触后,主要通过环腺苷单正膦(cAMP)传递信号并与Gαs偶联。
不同组胺受体下游的信号通路
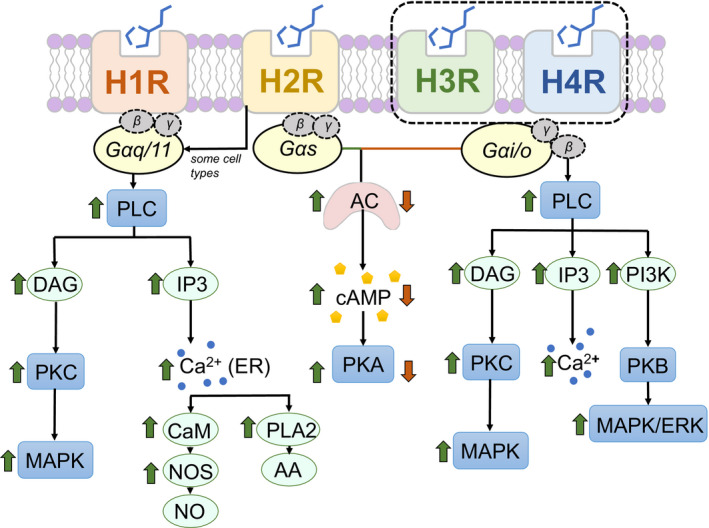
Sudarikova AV,et al.Physiol Rep.2021
H2R刺激的主要作用是外分泌(主要是盐酸)、心动过速、平滑肌细胞松弛、抗炎作用、抗体合成等免疫活动。
• H2R具有抗炎作用
在组胺与H2R结合期间,H2R刺激通过抑制单核细胞或巨噬细胞和肥大细胞产生IL-12、IFN-γ、TNF-α细胞因子,而IL-10分泌增加,从而引起抗炎作用。
• H2R影响对微生物的免疫反应
组胺(内源性和外源性)通过H2R显著改变对微生物的先天免疫反应。特别地,树突状细胞对微生物配体的反应被组胺以H2R依赖的方式显著改变。
H2R敲除的小鼠免疫系统紊乱以及胃缺陷(胃酸分泌减少),此外还观察到认知能力下降和伤害感受异常。
• 注意:不同组胺受体可能具有相反的作用!
H2R以与H1R不同的方式传输信号,H1R和H2R的激活对各种生物过程具有相反的影响。在T细胞介导的免疫反应中,H1R激活促进Th1极化,而H2R激活则抑制Th1极化。
在平滑肌收缩中也观察到H1R和H2R激活的相反作用。H1R和H2R拮抗剂分别抑制和加剧组胺引起的轻度哮喘患者的支气管痉挛。这些数据表明,组胺可能会产生相反的作用,具体取决于被激活的特定组胺受体。
3
H3R
• H3R主要存在于神经系统中
H3R受体在神经系统细胞中表达,特别是在大脑皮层,基底神经节神经元和海马体中。H3R位于含组胺神经元的突触前区域。它们的功能是调节组胺以及其他神经递质(如多巴胺、去甲肾上腺素、γ-氨基丁酸、乙酰胆碱和血清素)的合成和释放。
• H3R受体影响睡眠、认知障碍等精神健康
H3R受体表达和激活的变化在睡眠-觉醒周期障碍、注意力缺陷多动障碍、癫痫和认知障碍以及炎症的发展中发挥重要作用。
H3R缺陷小鼠表现出行为反应和运动的变化,以及伴有肥胖、食欲过盛以及瘦素和胰岛素水平升高的代谢综合征。
• H3R可能会促进炎症反应
H3R刺激可增加促炎活性以及免疫细胞呈递抗原的能力。H3R敲除也可导致神经炎症性疾病的严重程度和T细胞中IFN-诱导蛋白10的表达增加。
因此,组胺H3R拮抗剂的使用有可能用于预防或抑制炎症性疾病(例如呼吸系统疾病)的发展。
4
H4R
H4R受体是最近才发现的,它们的作用尚未完全了解。H4R主要存在于免疫细胞(嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞、自然杀伤细胞、树突状细胞、单核细胞和T细胞)中,也存在于脾脏、胸腺、骨髓、胆管、胰腺、肠上皮细胞和神经内分泌细胞中。
• H4R会增强过敏和炎症反应
与其他类型的组胺受体相比,H4受体在中枢和周围神经系统中表达并不显著。H4R通过与蛋白质Gα/io相互作用介导,参与炎症和超敏反应的发展。
H4R介导的肥大细胞活化,促炎细胞因子和趋化因子IL-6、TNF-α、TGF-β1、RANTES、IL-8、MIP-1α和MCP-1均被表达。研究发现H4R激活显著增强结肠炎、放射性结肠炎、肠道缺血/再灌注损伤和过敏反应的炎症反应。
因此,选择性H4R阻滞剂的开发可能代表了治疗炎症性肠病的一种有前途的方法。
• H4R的激活还会导致瘙痒
H4R的激活已被证明会导致瘙痒。而H1R和H4R拮抗剂的联合治疗可能通过协同抑制瘙痒和皮肤炎症对慢性皮炎产生显著的治疗效果。
此外,H4R通过激活Th2细胞并产生 IL-31,可能引发过敏性皮炎的发生。H4R和H3R的激活增加了乙酰胆碱对肠道蠕动的影响。H4R受体还参与消化性溃疡的形成和癌变。
//小结
如前所述,组胺特异性受体的组织定位、功能和对组胺的亲和力不同。组胺调节广泛的代谢过程,具有促炎和抗炎作用,具体取决于受体亚型和受刺激细胞的类型。
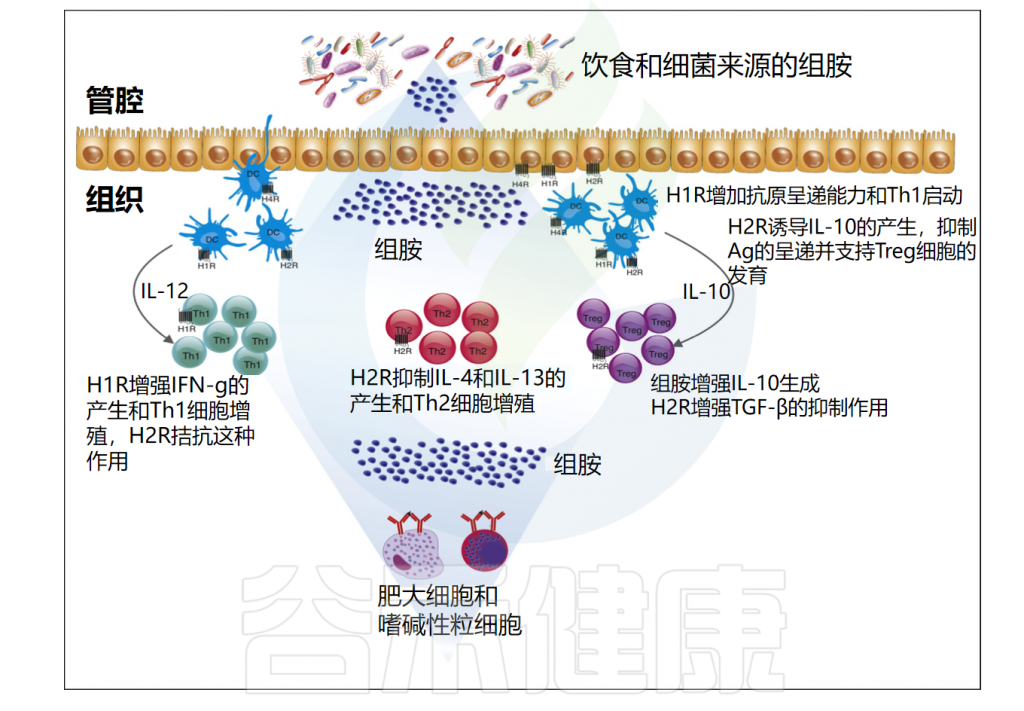
Barcik W,et al.Curr Opin Immunol.2017
组胺对免疫调节的各种作用似乎与其受体及其各自的细胞内信号的差异表达和调节有关。此外,这些受体对组胺的亲和力的差异在组胺和组胺受体药物配体的生物效应中发挥着关键作用。组胺受体在多种病理生理状况中发挥重要作用,是治疗过敏的有效靶点。
组胺因其在速发型超敏反应中的作用而广为人知。在胃肠道内,组胺以相对较高的浓度存在,特别是在炎症过程中。组胺水平的增加改变了宿主与微生物群的免疫相互作用,并导致体内平衡的破坏,导致许多难以应对的肠道疾病的发展。
★ 组胺的水平会影响肠道稳态
肠道中的组胺水平受到宿主过敏和炎症反应的影响,除了宿主微生物群的产生外,还会以某种方式改变降解或合成组胺的酶的活性及其饮食摄入量。
此外,在刺激产生组胺的免疫细胞时,可以增加内源性组胺的水平。所有这些都会影响肠道稳态,导致组胺积累,并影响特定疾病。组胺还可能对肠道寄生虫和细菌感染产生一定影响。
注:除H3R外,所有组胺受体都在人体肠道中表达。从量的角度来看,H4R表达的丰度明显低于H1R和H2R。
粘膜内的组胺
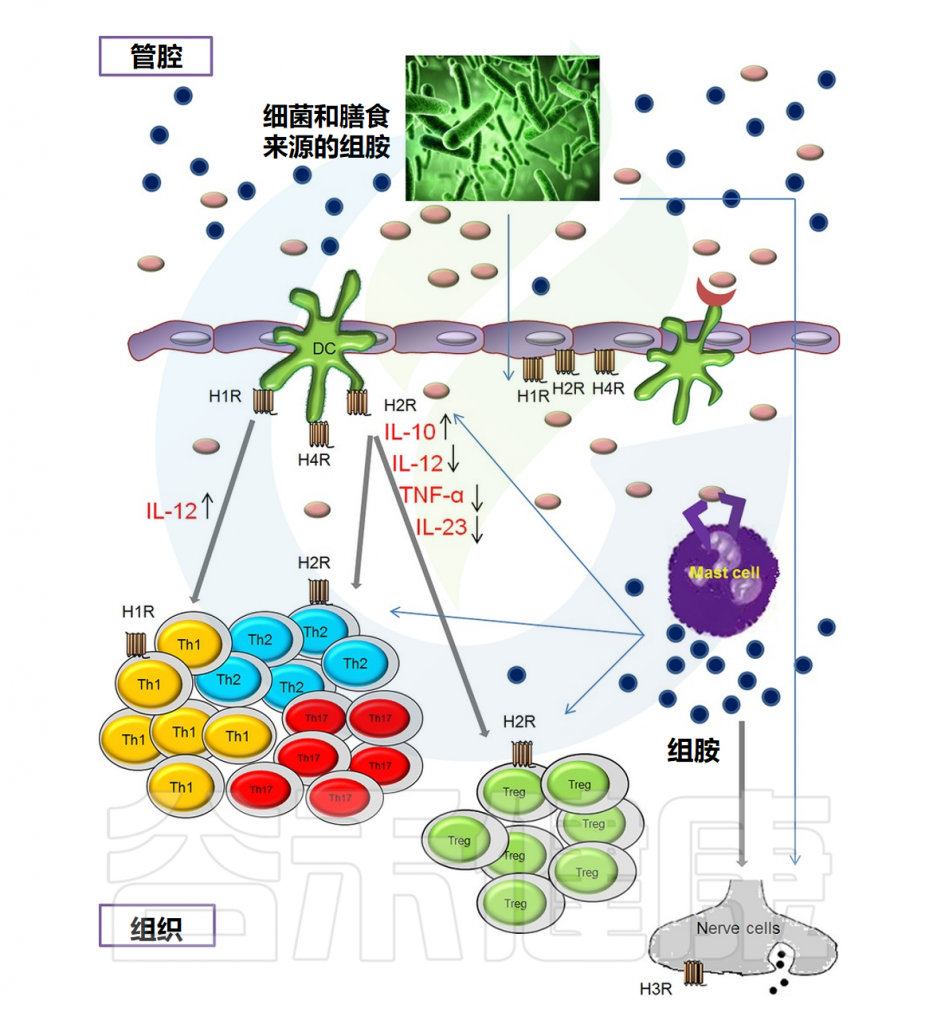
Smolinska S,et al.Allergy.2014
• 食物中的一些菌株会分泌组胺
除哺乳动物细胞外,还发现许多不同的细菌菌株能够在组氨酸通过组氨酸脱羧酶作用后分泌组胺。
最有力的证据就是那些能够在食品中分泌组胺的细菌。它们在奶酪、肉罐头、乳制品以及啤酒和葡萄酒发酵过程中产生组胺。鲭鱼中毒就是在储存或加工过程中处理不当,细菌代谢了鱼类中的组氨酸,导致组胺含量过高。
• 部分肠道微生物也会分泌组胺
迄今为止,对产生组胺细菌的研究主要集中在从食物样品中分离的菌株。肠道微生物群的组胺生成能力直到最近才被研究,数据仍然有限。
2021年发表的一项荟萃分析展示了人类肠道微生物组中具有假定组胺分泌能力的物种 ,其中许多属于广泛报道的组胺产生属,例如摩根菌属(Morganella),乳杆菌(Lactobacillus),葡萄球菌属(Staphylococcus), Photobacterium和巴氏梭菌(Clostridium)。
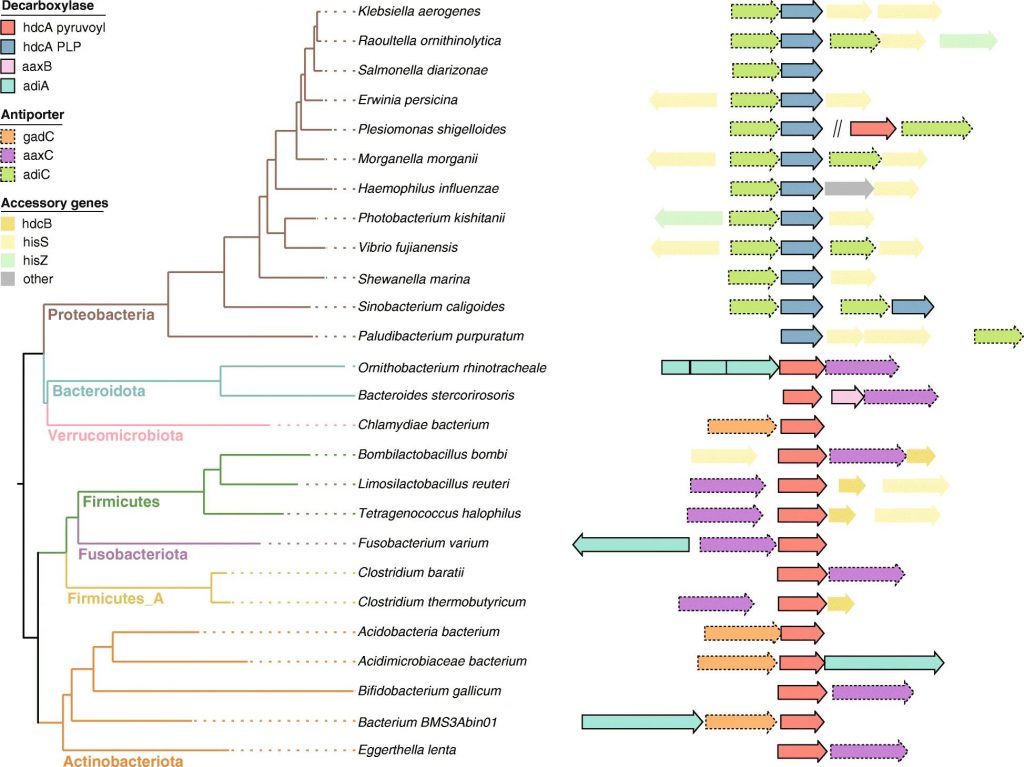
Mou Z,et al.BMC Genomics.2021
• 一些细菌具有组氨酸脱羧酶活性,也可能产生组胺
需要注意的是,一些具有组氨酸脱羧酶活性并与组胺中毒有关的细菌,可能也是潜在的组胺产生细菌。包括:Morganella morganii,
Eschericha coli,
Hafnia alvei,
Proteus vulgaris,
Proteus milabilis,
Enterobacter aerogenes,
Raoultella planticola,
Raoultella ornithinolytica,
Citrobacter freundii,
Pseudomonas fluorescens,
Photobacterium damselae。
证据表明细菌衍生的组胺具有多种影响,例如对宿主健康和食品安全。
• 抑制了促炎细胞因子的分泌
初步体外研究表明,组胺抑制人单核细胞衍生的树突状细胞中趋化因子和促炎细胞因子的分泌。
小鼠研究表明,给予分泌组胺的鼠李糖乳杆菌具有抗炎作用,各种白细胞介素和肿瘤坏死因子α的分泌减少。这种作用在缺乏组胺2受体的动物中消失,表明微生物群衍生的组胺可能具有免疫调节作用。
• 组胺的含量对于免疫效果至关重要
与鼠李糖乳杆菌相比,另一种乳杆菌能够分泌大约100倍多的组胺,服用这种乳杆菌会导致动物体重减轻和健康状况恶化。谷禾认为,微生物分泌的组胺量可能是决定其作用性质的关键。
最近的研究还表明,肠道中细菌释放的组胺不仅会引起宿主免疫系统的局部调节,而且还会在远处的粘膜部位(例如肺部)产生免疫学后果。例如成年哮喘患者肠道中分泌组胺的细菌丰度有所增加。
由于许多食物中含有组胺,一部分肠道微生物群也可以产生组胺,研究发现组胺在肠道疾病中可能发挥多种作用,下面讲述了一些与组胺相关的肠道疾病,组胺在其中发挥着有益或有害的作用。
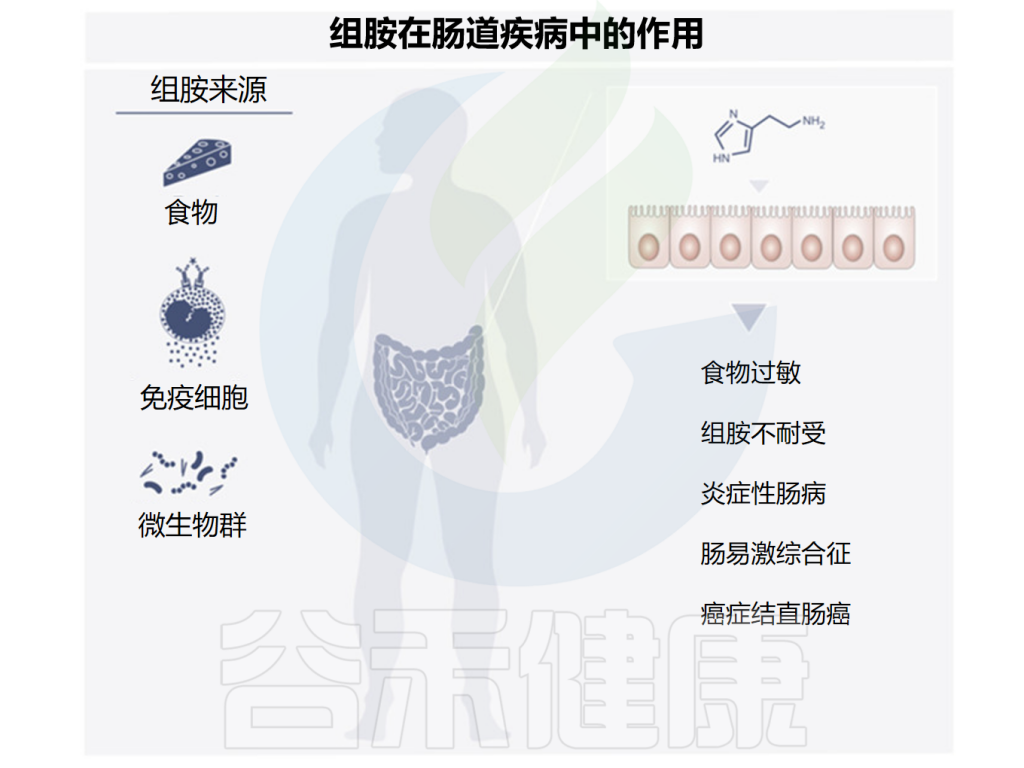
Smolinska S,et al.Metabolites.2022
消化道是接触大量不同分子的地方,这些分子中的一部分是潜在的过敏原,可能从而引起食物过敏。食物过敏可表现为轻度和重度症状,最严重的可能危及生命。
拓展:常见的食物过敏症状
食物过敏的症状表现在呼吸系统、消化系统、心血管系统和皮肤系统等。
皮肤反应:皮肤反应是最常见的食物过敏症状之一。它可以表现为皮疹、荨麻疹、瘙痒、红肿、水肿等。这些反应通常发生在口腔、面部、颈部和四肢等部位。
呼吸道症状:食物过敏还可以引起呼吸道症状,包括鼻塞、流涕、打喷嚏、喉咙痒、咳嗽、喉咙紧闭感和哮喘。严重的过敏反应可能导致呼吸困难和哮喘发作。
消化系统症状:食物过敏可以引起消化系统症状,包括腹痛、腹胀、恶心、呕吐和腹泻。这些症状还可能与肠道炎症反应、肠道收缩有关。
循环系统症状:在严重的食物过敏反应中,可能出现循环系统症状,如低血压、心悸、头晕和昏厥。这些症状是由于过敏反应导致血管扩张和血压下降。
全身症状:某些人可能出现全身性症状,如疲劳、焦虑、情绪波动和体重下降。这些症状可能与食物过敏引起的炎症反应和免疫系统的激活有关。
• 食物过敏时组胺分泌增加
IgE依赖性食物过敏是免疫系统紊乱的结果,使耐受性丧失。这导致将温和的食物抗原识别为病原体。组胺受体参与食物过敏的发展。研究表明,在人类中使用H2R拮抗剂会增加针对食物抗原的IgE的产生。在Th2细胞的刺激下,IgE与效应细胞(肥大细胞和嗜碱性粒细胞)上的Fcε受体结合。由于效应细胞的激活,组胺以及其他介质被释放。
在食物过敏受试者中,组胺分泌增加和肥大细胞数量增加已得到充分证明。嗜碱性粒细胞释放的组胺与皮肤点刺试验和食物激发呈正相关。与非过敏患者相比,食物过敏患者抗IgE介导的肥大细胞组胺释放增加。
此外,将食物过敏患者的活检与抗IgE(人类)抗体或过敏原一起孵育,会导致组胺释放增加9倍。
• 食物过敏的治疗
由于食物过敏的发生率不断增加,已经进行了大量研究以开发新的治疗和预防策略。严格避免食物过敏原是管理IgE介导的食物过敏的长期策略。
关于食物过敏发病机制的各个阶段也有许多研究,例如对Th2通路的影响、阻断IgE、抑制效应细胞和微生物治疗。长期免疫耐受应该是治疗食物过敏最理想的效果。
口服免疫疗法是食物过敏的发展治疗方法之一。它包括以每2-4周增加一次的剂量向患者施用过敏原,直到达到最大维持剂量。这个过程的结果是发展对食物的耐受性。该方法已用于对牛奶、鸡蛋、小麦、花生、坚果和贝类的食物过敏。
目前正在研究表皮和舌下免疫疗法。对牛奶和鸡蛋过敏的表皮免疫疗法也进行了临床试验。
炎症性肠病是特发性、慢性复发性肠道疾病。溃疡性结肠炎和克罗恩病是两种主要临床表现。
在克罗恩病中,炎症出现在弥漫性病变中,这些病变遍布消化道并深入穿透肠壁,可能影响所有层。相反,溃疡性结肠炎的炎性病变从直肠开始,向上但不超过结肠,并在黏膜浅表处保持。克罗恩病导致整个胃肠道的透壁性炎症,但其特征是模式不连续。与炎症为浅表的溃疡性结肠炎相比,溃疡主要局限于结肠粘膜。
• 炎症性肠病患者黏膜组胺水平升高
这两种疾病的发展都是遗传易感患者宿主免疫系统、肠道微生物群和环境因素之间复杂相互作用的结果。
炎症性肠病患者的黏膜组胺水平(而非血浆水平)升高。在患者尿液中发现与疾病活动度相关的N-甲基组胺水平升高。当受到抗原刺激时,源自活动性克罗恩病或溃疡性结肠炎切除结肠的肥大细胞能够释放比正常结肠更多的组胺。
• 炎症性肠病患者的组胺通路被破坏
克罗恩病和溃疡性结肠炎患者的组胺信号通路均被破坏,研究分析显示。炎症性肠病患者的组胺受体表达和功能活性发生改变。
在结肠炎模型中,H2R的阻断导致更严重的炎症性疾病。组胺主要抑制IFN-γ和TNF-α的分泌,这些细胞因子的基因表达与溃疡性结肠炎患者的H4R和H2R表达呈正相关。
发炎黏膜中组胺-N-甲基转移酶(HNMT)表达降低,二氨基氧化酶(DAO)多态性与炎症性肠病风险增加有关。使用H2R拮抗剂会增加克罗恩病患者的风险。
注:在小鼠结肠炎模型中,缺乏H2R或使用非莫替丁(H2R拮抗剂)抑制H2R的T细胞转移可加速体重减轻并增加疾病严重程度。
• 炎症性肠病的治疗
在许多情况下,获得缓解的唯一选择是根治性手术,切除发炎区域。潜在地,使用H1R和H4R拮抗剂同时使用H2R激动剂可能对炎症性肠病患者有益。
炎症性肠病患者还可接受抗炎药、类固醇、抗生素、氨基水杨酸盐治疗,或使用英夫利昔单抗(抗 TNF-α)进行生物疗法。
肠易激综合征是一种与腹部不适或疼痛有关的慢性疾病,其中吃的食物是更严重症状的触发因素。一些证据表明,肠易激综合征中肠道菌群发生了改变,这种改变会破坏黏膜的免疫应答。
• 内源性组胺与肠易激综合征的严重程度相关
研究显示,超过一半的患者因食用释放组胺的食物或富含生物胺的食物而出现胃肠道症状。内源性组胺的水平与肠易激综合征患者症状的严重程度绝对相关。活化的肥大细胞产生更多的组胺,这与肠易激综合征患者的腹痛相关。肠易激综合征患者的黏膜上清液的组胺含量高于健康受试者的上清液。
组胺水平更高,组胺受体表达也更高
肠易激综合征患者中组胺受体H1R和H2R的表达水平上调。我们推测:伴有组胺分泌或含组氨酸脱羧酶细菌的菌群失调可能与肠易激综合征的发生和加重有关。
给予特定微生物具有治疗作用,这也可能是微生物群变化导致疾病的原因。肠易激综合征没有特效治疗方法,减少炎症的药物正在使用中。
结直肠癌是第三常见癌症,也是癌症相关死亡的重要原因。与一般人群相比,炎症性肠病患者发生结直肠癌的终生风险会增加。
• 组胺可能具有潜在的抗肿瘤作用
肠道微生物群在结直肠癌中的作用已在谷禾之前的文章中详细描述过。而特定的肠道微生物代谢物可能与结直肠癌的病因有关。组氨酸脱羧酶缺乏已被证明通过CD11b+Gr-1+未成熟髓系细胞的积累促进炎症相关的结直肠癌,表明组胺具有潜在的抗肿瘤作用。
几种益生菌菌株,包括长双歧杆菌(Bifidobacterium longum)、嗜酸乳杆菌(Lactobacillus acidophilus NCFM)和鼠李糖乳杆菌GG,在结肠癌的小鼠模型中显示出有益作用。这些产生组胺的益生菌减少了结肠肿瘤的数量和大小。

Gao C,et al.Am J Pathol.2017
罗伊氏乳杆菌(L. reuteri)抑制结肠粘膜中IL-22、IL-6、tnf-α和IL-1α 基因的表达,并减少血浆中促炎、癌症相关细胞因子、角质形成细胞趋化剂、IL-22和IL-6的数量。
此外,不能产生组胺的等基因组氨酸脱羧酶(HDC)缺陷罗伊氏乳杆菌突变体不能抑制致癌作用,这表明共代谢物组胺在抑制慢性肠道炎症和结直肠肿瘤发生中具有重要作用。
• 结直肠癌患者组胺含量和活性增加
在结直肠癌患者的结肠黏膜中,组氨酸脱羧酶活性和组胺含量均高于正常样本。在实验诱导的结直肠癌小鼠中,与野生型小鼠相比,组氨酸脱羧酶的缺失导致肿瘤发生增强,这也表明组胺具有抑制结直肠肿瘤发生的作用。
• 注意:过高的组胺含量可能对癌症不利!
需要注意的是,已发现肥大细胞在结肠癌中含量丰富,并促进小鼠化学诱导的结直肠癌的癌变,并且与人类结直肠癌患者的不良预后有关。与组胺通过H4R的促炎作用类似,H4R表达的缺失也导致小鼠化学诱导的致癌作用减少。
组胺作为一种重要信号分子,主要因其在诱导过敏症状中的作用而被识别,但它也参与非过敏性炎症反应。
组胺是肠道稳态的重要调节剂。通过增强分泌和蠕动,组胺促进潜在有毒物质的快速清除。这种生物胺对于肠道细菌的生存也至关重要。与健康个体相比,组胺不耐受患者的肠道菌群失衡或失调。
在某些浓度范围内,组胺起着保护作用,对于维持健康状态至关重要。然而,由于先天性或后天性缺乏组胺降解酶,以及肠道肥大细胞过度增生和过度活跃,使组胺浓度较高,会导致粘膜炎症性疾病,产生腹泻和腹痛。增强H2R表达或其细胞内信号,同时降低H1R和 H4R活性是提高粘膜免疫力的合理方法
组胺不耐受的现代治疗方法包括避免高组胺食物的摄入、影响组胺水平的药物(H1R阻滞剂、肥大细胞膜稳定剂和米氮平)和补充天然成分(维生素C、类黄酮、二氨基氧化酶强化补充剂和益生菌) 。
与此同时,使用具有释放组胺潜力的肠道微生物群提供了一种新的治疗视角。
主要参考文献
Smolinska S, Winiarska E, Globinska A, Jutel M. Histamine: A Mediator of Intestinal Disorders-A Review. Metabolites. 2022 Sep 23;12(10):895.
Sánchez-Pérez S, Comas-Basté O, Duelo A, Veciana-Nogués MT, Berlanga M, Latorre-Moratalla ML, Vidal-Carou MC. Intestinal Dysbiosis in Patients with Histamine Intolerance. Nutrients. 2022 Apr 23;14(9):1774.
Shulpekova YO, Nechaev VM, Popova IR, Deeva TA, Kopylov AT, Malsagova KA, Kaysheva AL, Ivashkin VT. Food Intolerance: The Role of Histamine. Nutrients. 2021 Sep 15;13(9):3207.
Krell T, Gavira JA, Velando F, Fernández M, Roca A, Monteagudo-Cascales E, Matilla MA. Histamine: A Bacterial Signal Molecule. Int J Mol Sci. 2021 Jun 12;22(12):6312.
Mou Z, Yang Y, Hall AB, Jiang X. The taxonomic distribution of histamine-secreting bacteria in the human gut microbiome. BMC Genomics. 2021 Sep 26;22(1):695.
Gao C, Ganesh BP, Shi Z, Shah RR, Fultz R, Major A, Venable S, Lugo M, Hoch K, Chen X, Haag A, Wang TC, Versalovic J. Gut Microbe-Mediated Suppression of Inflammation-Associated Colon Carcinogenesis by Luminal Histamine Production. Am J Pathol. 2017 Oct;187(10):2323-2336.
Kovacova-Hanuskova E, Buday T, Gavliakova S, Plevkova J. Histamine, histamine intoxication and intolerance. Allergol Immunopathol (Madr). 2015 Sep-Oct;43(5):498-506.
Barcik W, Wawrzyniak M, Akdis CA, O’Mahony L. Immune regulation by histamine and histamine-secreting bacteria. Curr Opin Immunol. 2017 Oct;48:108-113.
Smolinska S, Jutel M, Crameri R, O’Mahony L. Histamine and gut mucosal immune regulation. Allergy. 2014 Mar;69(3):273-81.
谷禾健康
过敏性鼻炎是个全球性健康问题,易反复发作,困扰着全世界大约着4亿人。自20世纪60年代以来,过敏性鼻炎的患病率持续上升。近几年,我国主要大中城市过敏性鼻炎的平均患病率从11.1%升高到17.6%。
过敏性鼻炎主要临床表现包括发痒、打喷嚏、鼻塞等,这些症状不加以改善,严重的话会导致睡眠障碍、学习障碍和行为改变等,最终影响患者的生活质量。
过敏性鼻炎与普通感冒不一样,它不是由任何病毒引起的,因此不会传染。过敏性鼻炎主要由过敏原引起,常见过敏原包括花粉、灰尘、动物毛发、皮屑等。
目前过敏性鼻炎的治疗主要基于鼻用皮质类固醇以及鼻用和口服H1-抗组胺药等。但这些药物的有效性是有限的,并且还具有多种副作用,会产生药物依赖性,药效下降等问题。
目前越来越多的研究表明,过敏性鼻炎是一个较复杂的免疫炎症反应疾病,其中肠道微生物群在该病的发生发展过程中扮演了不可替代的角色,针对菌群的干预,无论在动物还是人类临床上均显示出了较大的改善,以及作为药物治疗的补充综合改善措施。
本文我们来详细了解关于过敏性鼻炎的症状,发生过程,风险因素,与肠道微生物群的关系,益生菌在该病中发挥的作用,其他过敏性鼻炎相关治疗干预措施包括饮食、生活方式、益生元、合生元等。
【全文概览】
01 关于过敏性鼻炎,你需要知道
发病率、症状、风险因素、易感人群
与普通鼻炎的区别;与感冒的区别
02 过敏性鼻炎是如何形成的?
发病机理、如何与肠道相关联
03 过敏性鼻炎与肠道菌群之间的关系
04 肠道菌群在过敏性鼻炎中的重要作用(机理)
肠道菌群 ⇄ Th1/Th2 平衡
肠道菌群影响ILC2:过敏中的重要作用
肠道菌群对血清炎症因子的影响
肠道菌群对Treg/Th17细胞平衡的影响
肠道菌群对耐受树突状细胞活性的影响
肠道菌群对Toll样受体的刺激
05 过敏性鼻炎的治疗
06 基于菌群的干预,对过敏性鼻炎的改善
益生菌
益生元
合生元
细菌裂解物
粪菌移植
饮食
07 关于改善过敏性鼻炎的其他自然疗法
草药或补充剂等
锻炼
生活方式
在了解过敏性鼻炎是如何形成之前,我们先了解一下,什么是过敏性鼻炎?

据不完全统计,我国过敏性鼻炎的发病率在5%-25%之间,各个地区发病率不太一样,城乡差异也十分显著,估计全国患病人数在1亿以上。
尘螨在南方的致敏率最高,艾蒿、豚草和蒲公英则是西北最常见的过敏原。
大约 80% 的过敏性鼻炎症状在 20 岁之前出现,并在 20-40 岁达到高峰,然后逐渐下降。据报道,出生后头 5 年儿童过敏性鼻炎的发病率为 17.2%,诊断时的高峰年龄为 24 ~ 29 个月 (2.5%) .
过敏性鼻炎是一个常见病、多发病,可分为季节性(间歇性)或常年性(慢性),大约 20% 的病例是季节性的,40% 是常年性的,40% 的病例同时具有这两种特征。
最初可能出现的症状包括:
可能还会遇到其他较多症状,包括:
当身体对大多数人无害的物质(如花粉)反应过度时,就会发生过敏性鼻炎。
通常在接触某些物质后会出现过敏性鼻炎,过敏原一般分为以下四大类:
我们稍作展开讨论:
➤ 来自屋尘过敏原
实际上,携带过敏原的并不是尘螨本身,而是一种化学物质,在尘螨的排泄物中发现,一般会以人类皮屑为生,常见于家中的以下位置:
地毯、床垫、枕头、床单、窗帘等
➤ 来自树、草等花粉过敏原
根据一年中的不同时间,会出现不同类型的过敏原,因为从春季到深秋,树木、草都会产生花粉
树木包括:
桦木(非常常见)、雪松、榛、扁柏、角树、七叶树、菩提树、橄榄、松树、白杨、柳树等
草包括:
黑麦草、蒂莫西、艾蒿、荨麻、芭蕉、豚草等
➤ 来自动物毛发的过敏原
注意过敏原携带在动物的毛发上。引起过敏原的不是真正的毛发,而是毛发上携带的动物死皮屑、唾液、尿液等。
研究表明,早年接触通常携带过敏原的动物会降低晚年患此类过敏性鼻炎的患病率。
这类动物包括:
猫、狗(这两种非常常见)
牛、马、兔子、啮齿动物等
➤ 来自工作中明确遇到的过敏原
某些特定物质会在一些人身上引起过敏性鼻炎,因此如果职业要求接触以下的一种或多种过敏原,那么患过敏性鼻炎的风险就会增加。
过敏性鼻炎是由遗传和环境因素相互作用引起的。
父母或家庭成员患有过敏性鼻炎,则患过敏性鼻炎的几率更大。
根据卫生假说,过敏性鼻炎发病率的增加与环境因素的变化有关,例如:
近期发表的在小鼠实验中,万古霉素诱导的肠道菌群失调,通过改变短链脂肪酸,加剧肠粘膜屏障的破坏,增加小鼠过敏性鼻炎的易感性和严重性。
鼻粘膜的 H&E 染色
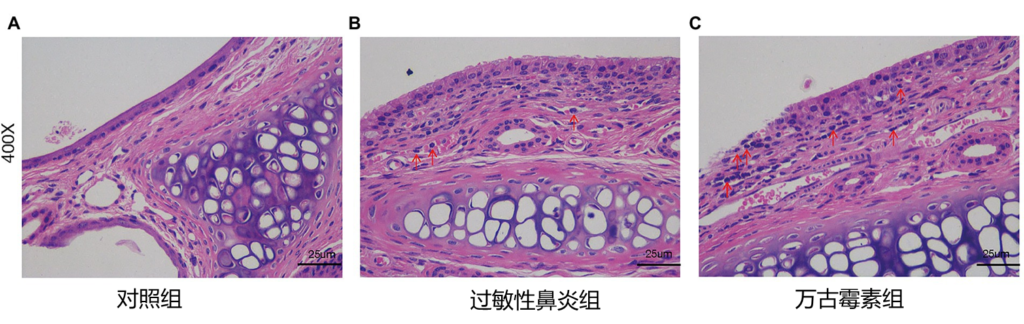
Zhen et al., Front. Microbiol. 2022
万古霉素诱导的肠道菌群失调加重了过敏性鼻炎的严重程度,加重了鼻粘膜的炎症细胞浸润和粘液分泌。
关于过敏性鼻炎,这里有几个需要注意的点:
鼻炎是鼻粘膜的炎症,它是一种上呼吸道疾病。鼻炎的临床症状包括阵发性打喷嚏、鼻塞、流鼻涕、流眼泪等,没有明显病因。而过敏性鼻炎作为鼻炎的一种,症状是由过敏原引发的。
很多人刚开始打喷嚏的时候,还以为是感冒了,赶紧吃感冒药,却发现并没有好转…
实际上过敏性鼻炎的症状往往与早期感冒的症状很相似。
一般来说,可以通过以下几点来区分到底是感冒还是过敏性鼻炎:
1
感冒通常伴有全身症状,如无力、发热、全身酸痛等,而过敏性鼻炎只是单纯的鼻部问题,除了可能有头痛,没有其他全身性疼痛症状。
2
过敏性鼻炎有可能会持续数周至数月,而感冒通常会在1-2周内自愈。
3
大多数过敏性鼻炎具有非常明显的季节性,尤其是春秋两季,而感冒一年四季都可能发生。
4
通过验血,大多数过敏性鼻炎在血液分析中显示嗜酸性粒细胞和 IgE 值升高,而其他值通常正常。相反,感冒通常具有升高的淋巴细胞值。
5
过敏性鼻炎过敏原阳性几率高,感冒几率低。
一旦过敏原吸入鼻腔,就会引起免疫反应。过敏原会和IgE抗体结合,激活肥大细胞。
也许对于普通人来说这没什么,但是对于过敏性鼻炎患者来说,就会引起过度反应,也就是说,免疫系统把花粉,灰尘等莫名扣上“通缉犯”,对其进行打击。
肥大细胞通过释放“组胺”,通知其他细胞,包括嗜酸性粒细胞、嗜碱性粒细胞、嗜中性粒细胞和T细胞等,会导致炎症和鼻粘膜充血:
• 本来好好的通道变窄了,气体很难通过就是鼻塞;
• 炎症刺激到神经,就是鼻子痒;
• 鼻粘膜分泌过多的粘液,结果就是流鼻涕…
过度分泌的粘液会堵塞两个鼻子的重要开口:
鼻泪管的作用是将眼泪从眼睛排到鼻子,一旦因为过敏性鼻炎,粘膜肿胀就会导致鼻泪管堵塞,这时候看起来像是“泪汪汪”的。

咽鼓管引流中耳分泌物,一旦因为过敏性鼻炎被堵塞,就会让人感觉到耳朵被塞住。

最后鼻腔内的神经受到刺激会开始打喷嚏

甚至,过敏性鼻炎患者会感到呼吸困难…

过敏性鼻炎的发病机理
鼻粘膜中的树突状细胞(DC)吸收过敏原 ➞ 引流淋巴结 ➞ 呈递给原始CD4+T细胞 ➞ 分化为过敏原特异性Th2细胞 ➞ 诱导B细胞活化产生浆细胞 ➞ 分化产生特异性IgE抗体 ➞ 在效应细胞(如肥大细胞和嗜碱性细胞)表面进行再循环和相互作用 ➞ 与IgE受体(FcεRI)结合 ➞ 炎症介质(如组胺、前列腺素、白三烯)释放 ➞ 介质与鼻感觉神经、血管系统和腺体相互作用,导致过敏性鼻炎症状
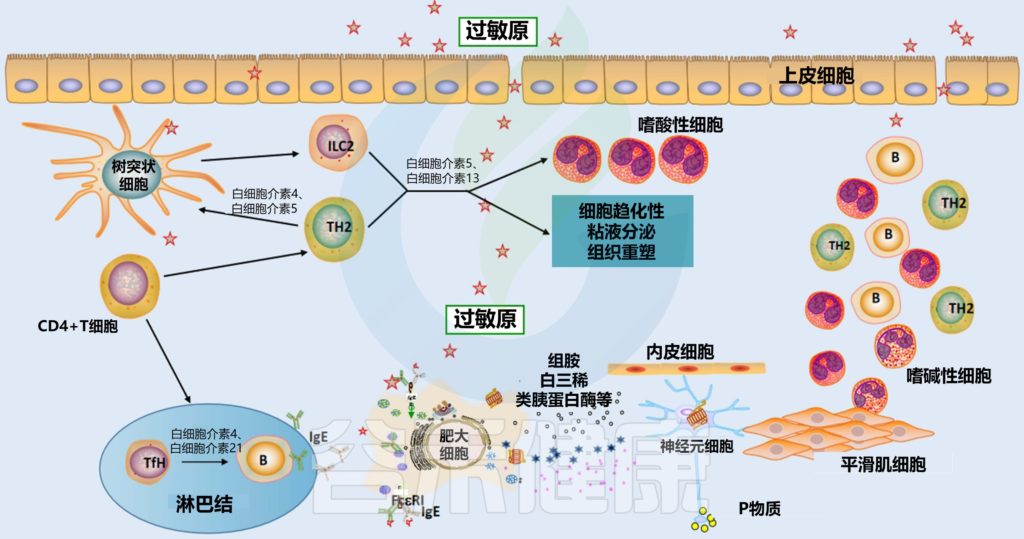
Liu P, et al., J Asthma Allergy. 2022
以上我们知道过敏性鼻炎涉及免疫反应,而人体内60%~70% 的免疫细胞集中在胃肠道中。肠道健康与过敏之间的联系始于免疫系统。
所有的免疫系统成分都直接或间接地受到微生物群的调节。
健康的微生物群会改变 Th1/Th2 细胞的比例,有利于 Th1 细胞,特应性疾病的特征在于对过敏原的 Th2 免疫反应。过敏性鼻炎以鼻腔黏膜Th2免疫反应为主的过敏性炎症反应,病变组织中存在大量Th2细胞因子浸润。
注:Th1细胞介导细胞免疫反应,直接攻击病原体或者促使其他细胞攻击病原体,就算病原体进入被感染的细胞,还会追进感染细胞里面去攻击;
Th2细胞介导体液免疫反应,它们会促使其他免疫细胞产生抗体,由这些抗体来攻击病原体。Th2细胞就不会进入被感染的细胞。
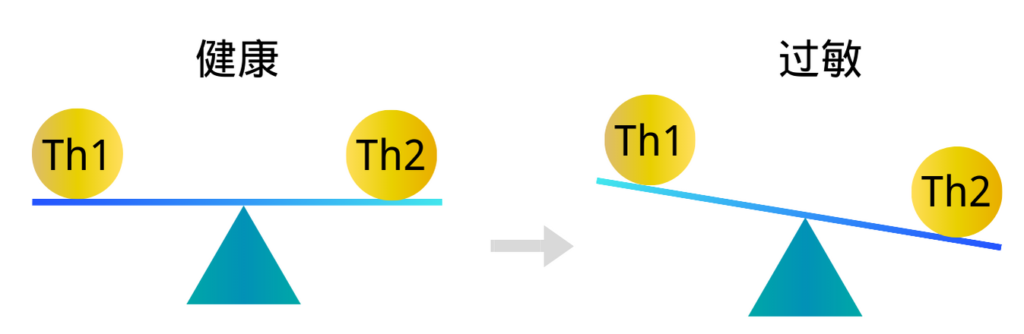
在免疫系统发育过程中,如果肠道失调通过将Th1/Th2细胞因子平衡向Th2反应转移,导致产生产生IgE的浆细胞,从而导致异常过敏反应。
越来越多的证据表明,平衡良好的肠道菌群对发育调节性T细胞(Tregs)至关重要,这对肠道耐受诱导至关重要。下一章节我们来讨论肠道菌群与过敏性鼻炎之间的关系。
注解:由于Th1细胞和Th2细胞都能分泌细胞因子促进自身的增殖并抑制对方的增殖,因此在正常情况下机体中 Th1细胞和Th2细胞处于相对平衡的状态。 但当机体发生功能异常时,常表现出平衡偏向其中一方,称为 “Th1/Th2漂移”。Th1细胞和Th2细胞之间的平衡状态被打破,会引起许多疾病的产生和发展。 包括肿瘤和一些自身免疫性疾病。
但是,不同的疾病表现出的Th1/Th2平衡漂移各不相同。如类风湿性关节炎、I型糖尿病、多发性硬化及慢性甲状腺炎等疾病中,Th1占优势状态;而在系统性红斑狼疮、硬皮病以及一些常见的变态反应性疾病比如过敏性鼻炎中,则Th2占优势状态。
我们知道,肠道菌群在人体中发挥着重要的生理作用,如影响维生素合成、免疫等,且与过敏性疾病的发生、发展相关。
肠道多样性的改变在过敏性疾病患者中较为常见。
目前已有的研究显示,与健康人相比,过敏性鼻炎患者的肠道菌群多样性显著较低(Chao1和Shannon多样性指数),其他菌群变化如下:
过敏性鼻炎患者肠道增加的菌群:
过敏性鼻炎患者肠道减少的菌群:
可见,健康个体和过敏性鼻炎患者的肠道菌群组成不同。
其中,普雷沃氏菌可能是影响免疫系统发育的重要微生物之一。
产丁酸盐的细菌,如梭状芽胞杆菌,可诱导调节性 T 细胞并通过预防肠道炎症来抑制过敏症状。
要解释肠道菌群是如何影响过敏性鼻炎的,我们要先从肠道菌群对免疫系统的塑造开始了解。
肠上皮细胞:将细菌和宿主的免疫系统连接起来
肠上皮细胞(IEC)翻译来自共生细菌的信号(细菌代谢物、细菌成分和细菌本身)并将它们发送到粘膜免疫细胞。可见,肠上皮细胞在肠道免疫中起关键作用。
微生物在肠道定植,并通过肠上皮细胞诱导血清淀粉样蛋白 A 的产生,从而改善 Th17 分化和 IL-22 的产生。
主要参与与定殖肠道细菌的串扰的免疫细胞主要见于固有层。其中,最常见的是树突状细胞(DCs)、Tregs、NK细胞和CD4+ T细胞。
树突状细胞:刺激 CD4+ T 细胞分化
树突状细胞在与先天性和适应性免疫反应的相互作用中起着至关重要的作用。它们迁移到次级淋巴组织并根据激活信号刺激 CD4+ T 细胞分化成亚型。
共生细菌衍生的代谢物影响树突状细胞的功能。例如,短链脂肪酸抑制 IL-12 并增加 IL-10 和 IL-23 的产生,降低 CCL3、CCL4、CCL5、CXCL9、CXCL10 和 CXCL11 的水平,间接调节 T 细胞功能。此外,它们通过树突状细胞的调制诱导 B 细胞IgA 类别转换和 IgA 产生,并调节其他适应性反应细胞功能。
巨噬细胞:摄取病原体
与肠上皮相关的巨噬细胞具有广泛的功能。它们可以摄取病原体,产生多种影响其他免疫细胞的细胞因子,并支持 Treg 的维持。
短链脂肪酸:促进巨噬细胞分泌抗炎 IL-10
微生物产生的短链脂肪酸促进巨噬细胞分泌抗炎 IL-10。此外,它们改变巨噬细胞的新陈代谢,降低 mTOR 激酶活性并增加抗菌肽的产生。
在正常情况下,微生物群和身体之间的相互作用是决定身体健康的基础,如果其中一个环节受损,可能会导致肠道菌群失衡。肠道微生物群的失调显著影响微生物群与宿主之间的代谢,并抑制宿主免疫系统。大多数过敏性疾病与肠道微生物群失衡有关,如过敏性鼻炎。
典型的过敏性鼻炎肠道菌群促进细胞因子的不利变化,从而促进过敏性鼻炎发展中涉及的 Th1/Th2 失衡。
过敏性鼻炎患者的肠道菌群失调及其对 Th1/Th2 平衡的影响
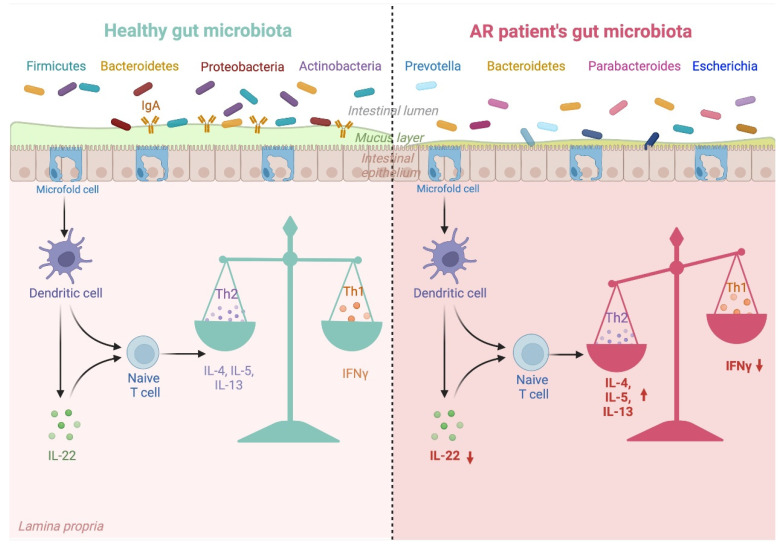
Kaczynska A, et al., Nutrients. 2022
肠道菌群的每一次紊乱都会对免疫系统产生负面影响,并破坏先天性和适应性反应。上图解释了改变的肠道微生物群组成与其对过敏性鼻炎患者免疫系统的影响之间的联系。
接下来章节,我们来详细了解,肠道菌群如何影响免疫系统从而引发过敏性鼻炎。
肠道菌群失调可能会破坏 Th1/Th2 细胞之间的稳态,这可能会对免疫耐受产生负面影响,破坏过敏原的正常清除,并增加过敏性鼻炎的风险。我们从以下六个方面详细展开讨论肠道微生物群在过敏性鼻炎中扮演的重要角色。
前面我们已经知道,过敏性鼻炎是一种I型过敏性疾病,与Th1/Th2平衡向Th2倾斜有关。
为什么生命早期肠道菌群多样性的变化会与过敏有关?
在生命早期,全身免疫反应偏向于Th2。研究表明,生命早期肠道菌群的多样性较低,会影响 IL-4 和 IFN-γ 的水平, IL-4 由Th2细胞产生的,IFN-γ由Th1产生,因此,这可能通过调节 Th1/Th2 平衡来影响气道炎症。
此外,在生命的前两年,较低的微生物多样性会延迟拟杆菌的定殖,并导致 Th1 型反应减少,从而导致Th1/Th2 平衡向Th2倾斜。
一些益生菌也能通过影响Th1/Th2 平衡,从而发挥作用。
植物乳杆菌(NR16)
从发酵韩国泡菜中提取的植物乳杆菌(NR16) 是一种强大的 Th1 诱导剂,当 NR16 与免疫细胞共培养时,它可以产生大量的 IFN-γ 和 IL-12,并且在同时口服 NR16 可降低小鼠气道高反应性和白细胞浸润。此外,口服 NR16 可以通过诱导 Th1 免疫反应来缓解过敏性鼻炎症状,这反过来又可以通过减少特定粘膜病变中 Th2 细胞因子的产生来重新平衡 Th1/Th2 比率。
植物乳杆菌可增加过敏性鼻炎小鼠模型中Th1型细胞因子(IFN-γ、特异性血清IgG2a)的产生,Th2型细胞因子(IL-4、IL-5、IL-13)减少并达到Th1/Th2的平衡。
泛福舒
一项随机对照研究表明,与对照组相比,泛福舒治疗后,泛福舒组鼻腔灌洗液中IL-4和IL-13的含量显著降低,而INF-γ的含量显著升高,导致IL-4/INF-γ的比值显著降低,泛福舒可以调节Th1/Th2细胞因子平衡,作为一种潜在的细胞信号机制,提高整体粘膜免疫。
短双歧杆菌
研究人员证实,口服短双歧杆菌可抑制 Th2 反应并诱导 CD4+CD25+Tregs 活性,但不引起 Th1 反应,但可调节 Th1/Th2 平衡并具有抗过敏作用。
其次,大剂量短双歧杆菌可显着减少打喷嚏的频率,同时降低血清IL-4和特异性IgE水平,增加脾脏中CD4+CD25+ Tregs的数量,显着降低鼻黏膜上皮的过敏反应,低剂量的短双歧杆菌只能轻微缓解过敏反应。
2型先天性淋巴细胞(ILC2)是一种先天性免疫细胞,缺乏表面标记物,因此难以识别。它们反映Th2型细胞,在过敏发展中发挥着重要作用。
我们知道,过敏性鼻炎是一种IgE介导的炎症,导致鼻粘膜中Th2细胞和II型细胞因子的数量增加。
研究人员发现鼻粘膜中ILC2的数量与过敏性鼻炎临床视觉模拟量表(VAS)评分呈正相关。
肠道微生物群失调如何影响过敏性鼻炎
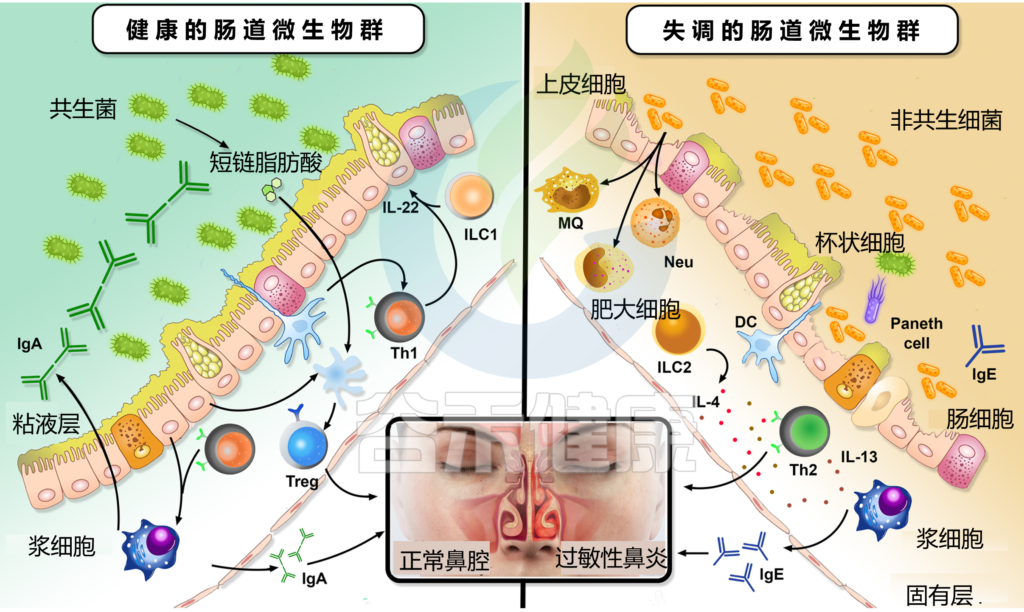
Li J, et al., Eur Arch Otorhinolaryngol. 2022
为什么ILC2在过敏性鼻炎的调节中起重要作用?
过敏性鼻炎患者中多种脂质受体上调,包括CysL1R(LTD4配体)和PGD2。尽管LTD4可激活ILC2中IL-4的产生,但过敏性鼻炎患者鼻分泌物中IL-4水平没有显著变化。
臭氧通过诱导ILC2释放IL-5和IL-13来加重过敏性鼻炎症状。
患有屋尘螨敏感的过敏性鼻炎的儿童外周血ILC2水平显著升高。所有这些发现表明ILC2在过敏性鼻炎的调节中起着重要作用。
肠道菌群对ILC2的影响
值得注意的是,肠道微生物群影响ILC2通过肠-肺轴从肠道向肺的迁移。例如,变形菌门显著促进了上述迁移,并促进了IL-33的产生。
此外,呼吸道过敏的发展与Ruminococcus gnavus的丰度增加有关联。
研究人员发现,肠道菌群失调刺激ILC2和树突状细胞产生2型细胞因子,并促进嗜酸性粒细胞和肥大细胞的肺浸润。
另一方面,肠道微生物群发酵膳食纤维产生的短链脂肪酸抑制ILC2的功能,防止肺部炎症。因此,研究表明ILC2s的活性受到肠道微生物群的调节,但其潜在机制尚未得到充分阐明。
益生菌可以通过抑制ILC2的激活来控制过敏性鼻炎的发生和发展
在一项木瓜蛋白酶诱导的BL6小鼠的研究中,益生菌大肠杆菌菌株Nisle 1917(ECN)的治疗导致IL-5的降低较小,IL-13,IL-33的水平显著降低。ECN处理的小鼠具有显著更低的CD3+CD4+IL5+和IL13+细胞频率。数据表明,ECN能够抑制Th2和ILC2的活化以及原型致敏IL-5和IL-13的产生。
然而目前的研究相对有限,需要更多的基础和临床研究来评估未来的长期治疗效果。
对于肠道菌群在人和动物过敏性鼻炎模型中的研究显示,在益生菌的作用下,大多数血清炎症因子都有不同程度的下降,如IL-4、IL-5、IL-13、IgE、特异性血清IgG1、嗜酸性粒细胞和嗜碱性粒细胞水平减少,但一些抗炎因子增加,如 IL-10、IFN-γ 和特异性血清 IgG2a 分泌增加。因此,益生菌可以通过提高血清中炎症因子的水平来缓解过敏性鼻炎患者的炎症反应,从而减轻他们的临床症状。
NVP-1703 益生菌混合物:IL-5↓ IL-13↓ IL-10↑
(长双歧杆菌IM55 和植物乳杆菌IM76)
一项关于多年过敏性鼻炎的成人研究评估了NVP-1703益生菌混合物(长双歧杆菌IM55和植物乳杆菌IM76)干预4周的疗效和安全性,IL-4血清中尘螨水平无明显变化,但尘螨特异性IgE水平显著降低。在第4周,与安慰剂组相比,NVP-1703组的血清IL-5和IL-13水平降低,而IL-10水平显著升高。
泛福舒:IL-4↓ IL-13↓ INF-γ↑
在早期研究中,60名过敏性鼻炎患者被随机分为泛福舒(BV)组和对照组。泛福舒治疗后,治疗组的药物评分明显低于对照组,且个体和总体鼻症状评分均显著低于对照组。
泛福舒组鼻腔灌洗液中的IL-4和IL-13水平显著降低,而干扰素γ(INF-γ)水平显著升高,这使得IL-4/INF-γ比值显著降低,嗜酸性粒细胞也显著减少,过敏性鼻炎患儿呼吸道病毒感染率/严重程度的增加可能由多种机制引起,但IFN-γ缺乏可能是其中之一,益生菌可以通过提高IFN-γ水平来改善呼吸道病毒感染。
植物乳杆菌:IL-4↓ IL-5↓ IL-13↓ IgE↓ IgG1↓ IFN-γ↑ IgG2↑
在过敏性鼻炎小鼠模型中,口服植物乳杆菌可减少过敏性鼻炎小鼠模型鼻腔和肺部浸润细胞数量,而支气管肺泡灌洗液和引流淋巴结标本显示免疫细胞计数减少,IL-4、IL-5、IL-13、血清IgE和特异性血清IgG1水平降低,IFN-γ和特异性血清IgG2a分泌增加,可改善过敏性鼻炎。
丁酸梭菌:IgE/G1↓ IL-10↑ 逆转Th1/Th2失衡
显着降低了肺阻力、肺气道炎症、肥大细胞脱粒、小鼠气道炎症重塑和 OVA 特异性 IgE/G1 表达。同时,它还逆转了Th1/Th2失衡,增加了抗炎血清因子IL-10.
益生菌发酵的红参:IL-4↓ IgE↓
益生菌发酵的红参(FRG)对卵白蛋白(OVA)诱导的小鼠过敏性鼻炎模型的影响是,FRG比红参更有效地降低支气管肺泡灌洗液、鼻液和血清中的IL-4和IgE水平,表明FRG比红参具有更好的免疫调节作用。 FRG 治疗可减少炎症。
瑞士乳杆菌SBT2171:IL-4↓ IL-13↓ IFN-γ↑ IL-10↑
瑞士乳杆菌SBT2171(LH2171)可在体外诱导抗原刺激的幼稚小鼠脾细胞产生细胞因子,从而抑制IL-4和IL-13的产生,并增加IFN-γ和IL-10的产生。
Treg作为免疫抑制性CD4+T细胞,而Th17作为炎性CD4+T细胞,两者之间的平衡是维持人体免疫系统稳定性的关键条件。 过敏性鼻炎患者Th1/Th2失衡。
益生菌可以通过调节Treg/Th17的平衡来改善过敏和免疫疾病的调节,并产生了一些具有相当效果的靶向治疗方法。
对变应性真菌性鼻窦炎患者的研究表明,血清中IL-1、IL-17、IL-21和TGF-β的分泌都有不同程度的增加,导致Th17/Treg平衡Th17方向的偏移。
研究数据证实,过敏性鼻炎患者外周血中炎性因子如IL-17、IL-35和Th17的分泌增加,炎性因子的增加导致Treg/Th17失衡,进而导致Th1/Th2失衡,导致一系列过敏性鼻炎典型临床症状和鼻粘膜纤毛破坏,鼻腺增生和炎性细胞浸润。
益生菌通过影响Treg / Th17的平衡调节自身免疫
梭菌孢子诱导CD4+FoxP3+Treg细胞可以抑制Th17细胞的促炎反应。
使用益生菌混合物VSL#3来诱导Treg细胞的增殖。
细胞实验表明,乳酸菌上清液可以减少CD4+T细胞、CD8+T细胞和粘膜相关恒定T细胞等的活化,乳酸菌的产物可以抑制这些细胞的增殖和脱颗粒。
其他研究表明,炎症引起的T细胞代谢变化会影响Treg细胞的免疫功能。例如,糖酵解过程中的烯醇化酶可以调节外显子中FoxP3的结合变体,以及应激状态引起的Treg代谢变化,这是触发自身免疫反应的重要部分。
使用干酪乳杆菌作为干预对照,结果表明,干预组脾脏中CD4+CD25+Foxp3+Treg的百分比增加,而CD4+IL-17A+Th17细胞的百分比降低,调节了Treg/Th17细胞比例的失衡。
另一项研究表明,鼠李糖乳杆菌GG(LGG)提取物可以通过Toll受体(TLR2)途径,降低IL-17+Th17的比率,增加CD25+Foxp3+Treg的比率,从而维持Treg/Th17的稳态。
树突状细胞(DC)是体内最有效的抗原呈递细胞(APC),通过调节对微生物抗原的耐受性和免疫性,可以有效诱导抗原特异性免疫应答。
益生菌可能通过调节树突状细胞成熟和免疫耐受性树突状细胞(TDC)产生,产生抗炎细胞因子,从而抑制炎症,影响免疫调节。
免疫耐受性树突状细胞在调节免疫耐受中发挥关键作用
其特征在于表达共刺激分子(CD80/CD86)的半成熟表型,其可通过TLR配体或通过暴露于特定细胞而激活,在因子环境中分化。
此外,它们还表达免疫调节分子并产生免疫抑制因子,半成熟的共刺激CD80/CD86信号通过CD28分子的作用影响T细胞上Treg的激活,进而诱导免疫耐受。
目前,一些临床试验正在进行,以探讨TDC作为免疫介导疾病的替代治疗方案的有效性。与抗炎分子相比,这些TDC具有半成熟表型,表现出低水平的T细胞共刺激特性,并且产生促炎细胞因子的能力降低,特别是通过调节性T细胞(Tregs)的扩增和/或诱导。
其他研究也表明,TDCs分泌抗炎细胞因子并调节T细胞,以促进小鼠和人类肠道中Foxp3+Treg的发育。在全球范围内,这些数据表明DC/Treg/B调节轴通过重新建立耐受性和调节Tregs在肠道中发挥中心作用。
菌群的免疫调节作用来自免疫细胞与肠道树突状细胞的相互作用
最近的证据表明,益生菌可能通过调节DC成熟和TDC产生,从而抑制炎症,从而影响体外和体内的免疫调节。益生菌的免疫调节作用来自免疫细胞与肠道DC的相互作用,从而调节先天和适应性免疫系统。
研究表明,益生菌能够与DC上的模式识别受体(PRR)反应,后者检测病原体上不同的进化保守结构(病原体相关分子模式,PAMP),或通过产生可溶性化合物,从而诱导TDCs。
不同种类和菌株的益生菌可能直接影响树突状细胞的成熟,益生菌可能调节抗炎细胞因子的水平,如转化生长因子β(TGF-β)、IL-10,并诱导Treg。
一项针对四种益生菌菌株(包括唾液乳杆菌、双歧杆菌、凝结芽孢杆菌和纳豆枯草杆菌)的研究,都诱导DC产生IL-10和TGF-β,双歧杆菌和凝结芽孢杆菌表现出更强的诱导IL-10和转化生长因子-β的能力。因此,益生菌诱导的树突状细胞活性产生抗炎细胞因子在免疫调节功能中起着关键作用。
总之,益生菌通过调节TDC活性是过敏性鼻炎治疗的潜在靶点。
Toll样受体(TLRs)是机体免疫的主要组成部分之一,是肠粘膜淋巴细胞和上皮细胞表面表达的识别受体,为入侵病原体和炎症反应提供防御屏障。
肠道共生菌群的一部分,可以通过与TLR相互作用,在控制免疫反应中发挥关键作用。
TLR位于细胞质膜和细胞内内体中,可检测细菌、病毒和真菌的一系列致病分子模式,树突状细胞中TLR的激活可影响适应性免疫反应。
许多微生物感染可以激活TLR4信号,而肠道共生微生物群的一部分,可以影响TLR4.
益生菌多糖胶囊可以通过调节Th1/Th2平衡、诱导T调节细胞分化和激活DC,进而通过TLR与肠道微生物群相互作用,在控制免疫反应中发挥关键作用。
在一项益生菌(鼠李糖乳杆菌GG)与舌下免疫疗法(SLIT)联合的研究中,组间分析表明,与SLIT维生素D组相比,SLIT益生菌组的CD4+CD25+Foxp3+诱导率显著增加,相比之下,TLR阳性细胞组的百分比降低更多。
研究表明,益生菌产生的瞬时蛋白可以诱导TLR的产生,这种蛋白可以缓解特定IgE引起的过敏反应。
此外,一些TLR可以刺激DC激活,进而导致Treg细胞产量增加。先前的研究指出,TLR可能是益生菌影响Treg细胞增殖和分化的潜在靶点。
菌群可以依赖TLR4/NF-κB途径调节过敏性炎症
在一项研究中,阐明了益生菌对TLR4/NF-kB通路在调节宿主对肺损伤和气道炎症的防御中的调节作用。过敏性婴儿哮喘和TLR有影响。
结果表明,β-乳蛋白刺激导致巨噬细胞TLR4/NF-κB信号通路的转导增加。
嗜酸乳杆菌KLDS 1.0738干预通过抑制TLR4通路显著减少过敏性炎症。此外,嗜酸乳杆菌KLDS 1.0738菌株可以显著降低TLR4转导和炎性细胞因子的产生,这与miR-146a水平的上调密切相关。
// 小结
总的来说,肠道菌群可以通过减少血清促炎因子、增加免疫细胞数量、调节Th1和Th2平衡、增加Treg数量和抑制Th17等方式来预防过敏性鼻炎的发生发展,此外,某些菌可以直接刺激TDC的形成或激活TLR通路以间接刺激DC,从而诱导Treg的形成。
通过增加有益细菌的水平可以调节肠道微生物群的稳定性,恢复肠道粘膜屏障,从而改善过敏性鼻炎。
可以根据疾病的具体严重程度、疾病类型和生活方式选择合适的治疗药物。
过敏性鼻炎的治疗选择

▸鼻用皮质类固醇
局部鼻用皮质类固醇起效迅速,尤其是缓解鼻塞。外用类固醇与特定的细胞质糖皮质激素受体 (GRs) 结合,激活抗炎基因转录并抑制促炎基因转录,外用类固醇的抗炎作用可减轻所有鼻部和眼部症状。
▸外用类固醇联合抗组胺药
MP Aze-Flu 是一种由盐酸氮卓斯汀和丙酸氟替卡松组成的鼻喷雾剂,在症状评分和生活质量方面比安慰剂或丙酸氟替卡松单独有效。
▸ 鼻塞减轻剂
由于鼻黏膜的反弹作用和习惯作用,连续使用最好不超过7天。大部分药物可使α肾上腺素受体起作用,引起血管舒张和收缩,可立即缓解鼻塞症状,主要包括伪麻黄碱、羟甲唑啉、三唑啉或去氧肾上腺素。
▸鼻用抗胆碱能药和色甘酸钠/肥大细胞稳定剂
主要影响鼻腔分泌物的鼻用色甘宁和抗胆碱能药有一些较早的研究,但没有足够的证据做出充分的推荐。
▸盐水冲洗
增加儿童的鼻腔冲洗是有益的,可以减少鼻嗜酸性粒细胞和中性粒细胞。
全身性糖皮质激素的所有机制均受 GR 的调节,GR 属于配体调节的核受体超家族,类固醇的抗炎作用可以通过三种广泛的分子机制来解释:促炎基因表达降低、抗炎炎症基因表达增加和非基因组机制。
▸口服抗组胺药
已在多种细胞上鉴定出四种组胺受体 H1 和 H2 受体,可刺激过敏反应的早期和晚期。第二代/第三代非镇静 H1 受体拮抗剂是过敏性鼻炎的首选抗组胺药。
许多研究表明西替利嗪是有效的,并且西替利嗪在症状缓解方面优于氯雷他定,并且具有良好的安全性。
▸白三烯受体拮抗剂(LTRA)
白三烯是炎症介质家族,包括LTA4、LTB4、LTC4、LTD4和LTE4,通过阻断半胱氨酸LT1(CysLT1)受体,LTRAs(如蒙特鲁甾醇)可以改善过敏性鼻炎和哮喘症状。目前,口服色甘酸作为肥大细胞稳定剂的研究不足。
迄今为止,过敏原免疫疗法是目前唯一可用于 IgE 介导的过敏性疾病患者的免疫调节和因果治疗。
过敏原免疫疗法的目的是对免疫系统进行重新编程以减少特异性IgE的产生,从而诱导对过敏原的耐受,可通过不同的给药途径分为皮下免疫和舌下免疫两种方式,通过不断增加过敏原剂量使患者脱敏。
同时,研究人员发现接种疫苗可以改善长期空气污染对过敏性呼吸道的负面影响。针对风疹、伤寒和天花的预防性免疫显示过敏性鼻炎的发生率较低,而麻疹疫苗的过敏性鼻炎发生率较高。
目前过敏性鼻炎的治疗仍然基于过敏原避免、症状缓解药物、抗炎治疗和过敏免疫治疗。现阶段过敏性鼻炎治疗药物不良反应多且无法治愈,症状易反复,免疫治疗疗程较长,依从性差,同时降低生活质量。
肠道微生物群正在成为早期治疗特应性疾病的新靶点,如过敏性鼻炎也是特应性疾病的一种。
益生菌可以用作宿主防御途径的免疫调节剂和激活剂,口服益生菌可以调节呼吸系统的免疫反应,并可以通过调节肠道微生物群和免疫反应的变化来预防和治疗上呼吸道疾病。
国际上对益生菌作为替代治疗方法的研究和应用正在增加,大多数研究表明益生菌可以显着改善过敏性鼻炎患者的症状。
接下来我们详细了解基于菌群干预的过敏性鼻炎疗法。
作为调节肠道菌群平衡的重要手段,益生菌包括多种细菌,其主要作用是维持免疫系统的平衡,改善菌群结构,恢复菌群平衡,同时,它可以减轻肠道局部黏膜炎症反应,恢复黏膜屏障,阻断外来病原体的入侵。
前面章节我们了解到,益生菌可以激活 Th1 或抑制 Th2,引起抗炎作用,还可以刺激免疫因子如IL-10的产生,其主要作用是抑制炎症反应。
因此益生菌治疗过敏性鼻炎的基础研究和临床应用越来越多。
➤ 关于益生菌改善过敏性鼻炎的研究
益生菌的使用可积极改善克雷伯菌与双歧杆菌的比例,并可预防过敏性疾病的发展。
对过敏性鼻炎大鼠的研究表明,婴儿双歧杆菌和长双歧杆菌的混合物LacB可以降低粘膜中H1受体和脱羧酶组氨酸的mRNA表达,从而减轻过敏性鼻炎表现。
在一项双盲安慰剂对照试验中,与安慰剂组相比,食用5个月的干酪乳杆菌(LcS)会导致IgG水平升高,IL-6、IL-5和干扰素γ(IFN-γ)水平显著降低。
研究人员还调查了嗜酸乳杆菌对患有实验性过敏性鼻炎的BALB/c小鼠的影响,并报告使用第二周后喷嚏明显减少,而对照干预措施在第四周减少了喷嚏。
在对1919名过敏性鼻炎患者的23篇论文进行的系统回顾和荟萃分析中,研究人员表明益生菌可能有效缓解过敏性鼻炎患者的症状和生活质量。
在另一项系统综述中,包括了11项关于使用益生菌治疗和预防过敏性鼻炎的随机对照试验。研究结果表明,益生菌的使用与过敏性鼻炎患者的生活质量和鼻腔症状的显著改善有关。
关于益生菌治疗过敏性鼻炎的研究


Liu P, et al., J Asthma Allergy. 2022
研究表明,添加益生菌可以通过恢复肠道菌群紊乱来调节过敏性鼻炎的免疫反应。
一项研究指出,用益生菌发酵乳治疗后,患者的血清特异性IgE显著降低,免疫功能显著改善,体内肠道菌群结构得到改善,肠道菌群平衡得到恢复,症状也显著缓解。
用从人类粪便和泡菜中分离的长双歧杆菌和植物乳杆菌的益生菌混合物(PM)进行过敏性鼻炎治疗,可以通过控制肠道菌群紊乱(显著抑制变形菌,增加拟杆菌和放线菌的组成)来缓解过敏性鼻炎。
也有结果表明,益生菌和L-谷氨酰胺可以有效调节过敏性鼻炎患儿治疗过程中胃肠肽的水平,恢复肠道菌群的平衡,并恢复肠黏膜的屏障功能,从而达到治疗目的。
基于上述研究结果,可以看出益生菌可以调节和恢复肠道微生物群紊乱以治疗过敏性鼻炎。
当然,也有研究中发现益生菌治疗后效果没有明显改善的,例如:
在一项关于益生菌治疗过敏性鼻炎疗效的研究中,患者的过敏症状没有明显缓解,但与治疗前相比,一些患者的鼻粘膜微环境有所改善。
17项纳入的研究发现,益生菌治疗至少在一个结果指标上比安慰剂有显著的治疗优势,而六项试验未发现效果。
目前,作为临床过敏性疾病研究的一个新方向,益生菌有望成为过敏性鼻炎控制和治疗的潜在新目标。益生菌治疗的可能机制如下图所示:
益生菌治疗过敏性鼻炎的简要机制

Liu P, et al., J Asthma Allergy. 2022
益生菌作为过敏性鼻炎的辅助疗法,不仅可以从深层次恢复肠道微生物群紊乱,缓解鼻过敏的典型症状,而且具有高性价比和低风险的优势。
然而需要注意的是,目前的关于益生菌的基础研究仍在进行中,益生菌的最佳菌株、剂量和持续时间还需要进一步探索,同时,在引入新的治疗方法的过程中,有必要注意其可能带来的副作用。
益生元是影响肠道微生物群组成和活性的特定膳食成分。常用的益生元是乳糖醇、乳果糖、菊粉、乳糖、低聚果糖、低聚半乳糖和大豆低聚糖等。
◣ 益生元对IgE水平高的过敏性鼻炎成人的影响
在52周内,患者接受乳糖,并测量其血清IgE水平。治疗一年后,血清IgE水平(尤其是花粉过敏原)显著降低,同时伴有过敏症状的缓解。
一项研究比较,干燥的Ma-al-Shaeer(一种富含纤维的传统伊朗药物,配方基于大麦)与非索非那定对成人过敏性鼻炎患者的影响。
受试者连续14天每天两次接受口头提及的制剂。两组过敏性鼻炎的临床病程均得到改善,而Ma al-Shaeer组的鼻塞、鼻后滴漏和头痛评分显著降低。
◣ 益生元被广泛用作婴儿配方奶粉的补充
一项研究评估了益生元寡糖对过敏的保护作用。
在这项随机对照试验中,具有特应性风险的健康婴儿在出生后的前六个月接受了补充益生元或补充安慰剂的配方奶粉喂养。随访期为五年。
补充益生元组的累计过敏表现发生率显著降低。该干预措施对预防过敏性鼻结膜炎和过敏性荨麻疹特别有益。
其他关于益生元预防/治疗哮喘或过敏性鼻炎的研究
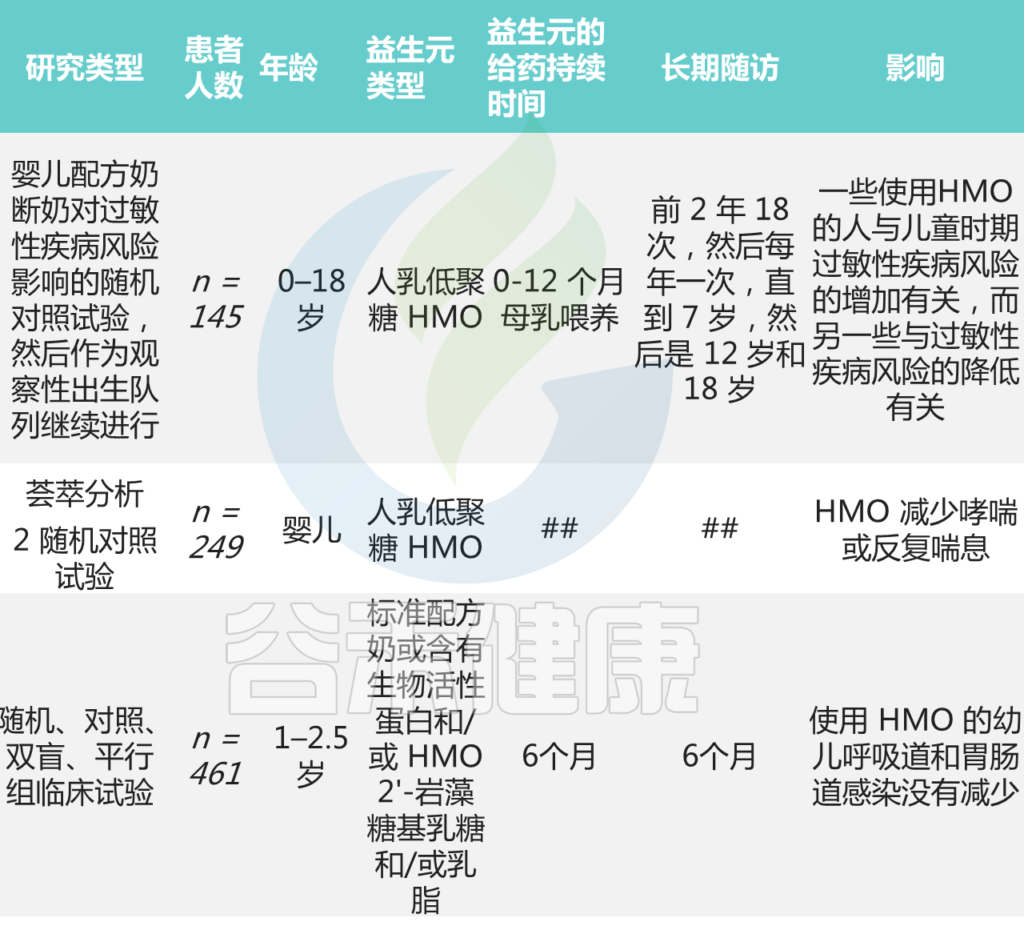
Meirlaen L, et al.,Nutrients. 2021
总之,关于益生元用于预防和治疗过敏性鼻炎的数据仍然不足。然而,它们调节细胞因子释放的能力,似乎是治疗过敏性疾病的一种新的、有前途的方法。
合生元治疗过敏性鼻炎的研究也很少,个别研究益生菌功效的试验实际上涉及合生元。
关于合生元预防/治疗过敏性鼻炎的研究
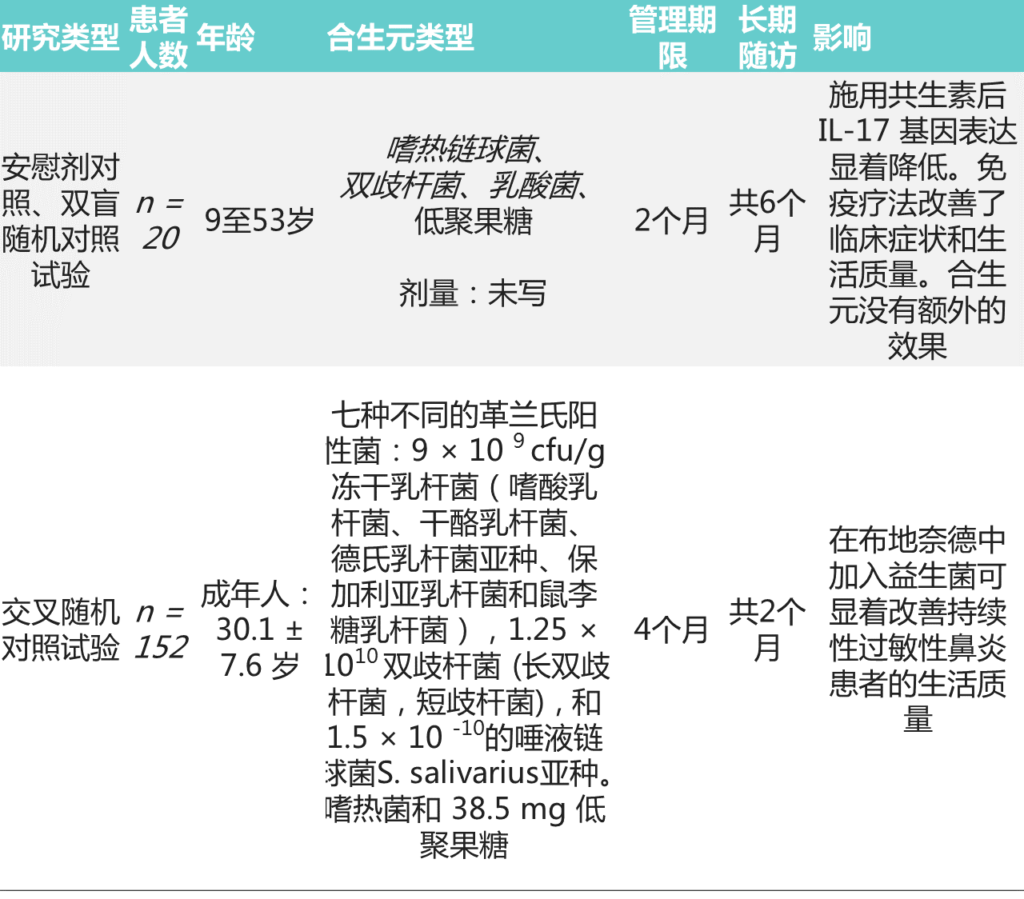
Meirlaen L, et al.,Nutrients. 2021
合生元对预防过敏性鼻炎的作用仍未得到解答,需要更多设计良好的研究,仅研究合生元对过敏预防和/或治疗的影响。
细菌裂解物是由源自呼吸道病原体的抗原组成的免疫调节制剂。最常见的是肺炎链球菌、流感嗜血杆菌、卡他莫拉菌、化脓性链球菌、绿色链球菌、金黄色葡萄球菌、肺炎克雷伯菌和奥扎纳克雷伯杆菌。
该制剂可通过化学或机械裂解获得。不同的生产方法可以产生不同的免疫效果。细菌裂解物可以口服、鼻内和舌下给药。这里讨论了口服给药对肠道环境的影响。
细菌裂解物的作用机制基于自然暴露于病原体抗原和随后的免疫反应。它们通过Toll样受体激活DC,促进抗病毒细胞因子释放、NK细胞活化和Th1/Th2平衡的恢复。
只有五项研究调查了细菌裂解物对过敏性鼻炎的影响。其中两个使用口服OM-85。
OM-85
一项开放标签的顺序研究,研究了在过敏性鼻炎、哮喘或慢性阻塞性肺疾病患者中使用OM-85对呼吸道感染率、原发病加重率和症状严重程度的影响。
减少过敏性鼻炎发作次数,严重程度减轻
患者分三个周期接受制剂,包括连续10天的摄入,然后休息20天。他们表明,与前一年相比,OM-85治疗减少了呼吸道感染和过敏性鼻炎发作的次数,并缓解了过敏症状的严重程度,而前一年患者只接受了标准的优化护理。
已证明血清和唾液IgA水平增加。为了进一步扩大这项研究,评估了60名常年过敏性鼻炎患者的临床效果。参与研究的参与者按照与前述研究相同的方案服用OM-85。治疗后,OM-85组的总鼻部症状评分、瘙痒评分、鼻溢评分、喷嚏评分和药物评分均显著下降。此外,观察到鼻IFN-γ增加,鼻IL-4和IL-13水平降低,鼻拭子中嗜酸性粒细胞数量减少。
细菌裂解物不会直接影响肠道细菌;然而,它们刺激的细胞因子可能会影响肠道环境。关于细菌裂解物对过敏性鼻炎的影响还需要更多的研究。
粪菌移植是将健康供体的粪便转化为粪便悬浮液,并将其施用于患者的肠道,以重建肠道微生物群的平衡的过程。目前,没有关于其在过敏性鼻炎治疗中的应用的研究;然而,这可能是恢复肠道细菌组成的一种有前途的方法。潜在地,它可能比益生菌更有效,因为其显著更丰富的注入微生物和永久定植肠道的能力。
一项研究证实了这一假设,他们研究了粪菌移植对成年特异性皮炎患者的影响。结果表明,粪菌移植后特应性皮炎评分显著降低。此外,在研究和随访期间,每周局部使用皮质类固醇的情况有所减少。
肠道微生物群的宏基因组分析显示,从供体到患者的细菌菌株传播显著。未观察到治疗的不良反应。
然而,关于其在过敏性疾病中的应用,仍然没有足够的数据;因此,需要更多的大样本研究。
高质量的饮食结构,如水果和蔬菜、高纤维食物、鱼、低脂食物、蛋白适量,可以增加肠道多样性,维持肠道菌群平衡,有助于平衡免疫反应。
研究表明饮食习惯和肠道微生物群与过敏性疾病有关。
一项研究招募了 186 名有过敏性鼻炎症状的参与者和 106 名没有过敏性鼻炎症状的对照受试者,该研究结果深入了解膳食营养素、肠道微生物组、肠道免疫系统和过敏性鼻炎发展之间的复杂相互作用。

维生素A
关联分析表明,视黄醇、维生素 A、隐黄素(维生素A原的一种)、铜与经年龄和性别调整后的过敏性鼻炎几率相关。
维生素A的主要膳食来源是动物性食物中的视黄醇,水果、蔬菜、蛋黄和黄油中的维生素A类胡萝卜素原。
在该研究人群中,维生素A和视黄醇的膳食摄入水平高度相关(R = 0.96).
维生素A对人体的多种功能至关重要,包括胚胎发育、良好视力、上皮分化和维持免疫功能,特别是在幼稚T细胞分化中。
如果没有维甲酸(注:维甲酸是维生素A的代谢产物),转化生长因子β(TGF-β)促进初始T细胞分化为Th17细胞,后者参与炎症、自身免疫和过敏性疾病。
在视黄酸的存在下,TGF-β帮助肠道树突状细胞介导幼稚T细胞分化为Treg细胞,从而抑制自身免疫反应。
在该研究中检测的类胡萝卜素中,只有隐黄素与过敏性鼻炎相关。
铜 和过敏性鼻炎之间:反向J形关系
铜是一种重要的微量金属,是许多氧化还原酶的辅因子,它参与铁代谢、抗氧化活性、神经肽合成和免疫功能。缺铜和过量铜都会对健康产生不利影响。
在该研究中,观察到铜和过敏性鼻炎之间的反向J形关系。这种反向J形曲线可能分别与铜在适当浓度和高浓度下的抗氧化和促氧化活性有关。
高膳食摄入视黄醇与类胡萝卜素与高丰度普雷沃氏菌的结合,可能对过敏性鼻炎的发展具有保护作用
该研究认为四种营养素(视黄醇、维生素A、隐黄质和铜)和两种肠道菌属(普雷沃氏菌属和大肠杆菌属)与过敏性鼻炎的年龄和性别调整几率相关。
此外,还观察到视黄醇和普雷沃氏菌的组合保护作用,与低视黄醇摄入量和低普雷沃氏菌丰度的受试者相比,高视黄醇摄入和高普雷沃氏菌丰度受试者的年龄和性别调整后的过敏性鼻炎几率低25倍。
绿叶蔬菜、时令水果,含有多种维生素和矿物质,有助于对抗过敏性鼻炎。
绿叶蔬菜包括菠菜、羽衣甘蓝、生菜、芝麻菜等,对于提高免疫系统非常重要。其他还包括黄瓜、大蒜、番茄、红椒、南瓜、红薯、西葫芦、西芹等,都是非常好的食物。水果包括香蕉、柠檬、橙子、蓝莓等。
当然并不是马上有效,这个饮食结构调整需要持续一定的时间。
生姜
生姜的抗炎特性有助于治疗花粉症引起的眼睛、鼻子和喉咙的瘙痒、刺激和炎症。
柑橘类水果
柑橘类水果有助于治疗过敏性鼻炎的症状以及由此引起的上呼吸道刺激。葡萄柚、柠檬、酸橙、橙子、浆果是维生素 C的丰富来源。
姜黄
姜黄抗炎和抗氧化特性,有助于治疗缓解过敏性鼻炎引起的症状。它有助于减少过敏引起的刺激和肿胀。 姜黄可以通过茶、药丸或酊剂服用,甚至可以添加到烹饪时食用的食物中。
西红柿
番茄红素是西红柿中的一种抗氧化化合物,有助于减少过敏引起的炎症。
洋葱
洋葱有抗炎和抗氧化特性,同时富含榭皮素,榭皮素是一种天然抗组胺剂,有助于减轻过敏性鼻炎的症状。
omega-3 脂肪酸
鱼(金枪鱼,三文鱼等)、杏仁、核桃、南瓜和亚麻籽富含的omega-3 脂肪酸的饮食,可以降低儿童和成人发生过敏的风险。
怀孕期间和产后早期摄入 omega-3 脂肪酸的母亲可能会调节免疫系统并降低孩子发生过敏症的风险。
其他饮食建议
易过敏体质尽可能从饮食中去除蛋,乳制品,麸质谷物等容易造成过敏的食品。尽可能减少摄入添加糖和加工食品。
研究发现,一些草药对过敏性鼻炎具有治疗作用,并显示出一些治疗前景。
Septilin
Septilin是一种阿育吠陀草药配方,含有苦皮草、堇叶天花粉、茜草、山茱萸、辣木和甘草,也显示出治疗过敏性鼻炎的巨大潜力。
在一项双盲研究中,190人接受了以上草药组合或标准抗组胺药(扑尔敏)治疗。结果表明,两种治疗方法同样有效。
在这项对32名健康人进行的双盲安慰剂对照试验中,使用Septilin 4周可显著减少皮下注射组胺引起的过敏反应。Septilin也被用作提高免疫力的治疗方法。
在一项针对40名持续性低度感染(如慢性咽痛或鼻窦感染)儿童的双盲安慰剂对照研究中,与安慰剂相比,服用Septilin1个月可显著改善病情。
异株荨麻
一项初步研究表明,异株荨麻 ( Urtica dioica ) 的冻干胶囊可减少患者的打喷嚏和瘙痒。推荐剂量为 600-900 mg TID。荨麻在植物医学中具有治疗咳嗽、肺结核和关节炎的历史用途。体外研究表明它还可能具有抗炎作用。
蓍草(Achillea millefolium)
蓍草是一种多年生草本植物,在欧洲和亚洲很常见。这种多用途草本植物具有抗氧化、健胃、解痉、收敛和透明的特性。传统上用于治疗感冒、流感和发烧,蓍草也可以是对抗过敏性鼻炎的有效药物。
它的抗菌和抗卡他性作用使其成为呼吸系统的理想草药,这种天然的治疗剂还治疗鼻窦炎和粉尘过敏。可以以茶的形式或作为酊剂服用。这是一种强效草本植物,不建议超过连续两周的限度。此外,如果对豚草过敏,应该避免这种草药。
蜂斗菜 ( Petasites hybridus )
在一项开放标签研究中,580名季节性过敏性鼻炎患者服用了50-75 mg BID的蜂斗菜提取物2周(每片含8 mg petasine)。
与基线相比,90%的患者在治疗后,改善了鼻漏、鼻塞、眼睛和鼻子发痒、眼睛发红和皮肤刺激等症状。
蜂斗菜也是一种温和的白三烯抑制剂,在一项研究中发现其与180 mg非索非那定一样有效。但蜂斗菜含有潜在的肝毒性吡咯里啶生物碱(PA),所以应谨慎使用,或者可以使用不含PA的提取物。它属于豚草科,因此对豚草过敏的人也应谨慎使用。
生蜂蜜
生蜂蜜含有很多种活性植物化学物质,有助于体内激素水平恢复正常,有助于构建强大的免疫系统,从而有助于预防过敏性鼻炎。一项随机对照试验表明,食用桦树花粉蜂蜜的过敏患者过敏症状减少了60%,在桦树花粉季节无症状天数增加了一倍。
维生素E
维生素E也可用于治疗过敏性鼻炎,因为它是一种温和的白三烯抑制剂。
一项研究发现,112名患有过敏性鼻炎的成年人在连续10周每天服用800IU维生素E后,鼻部症状明显改善。富含维生素E的饮食也被证明有助于预防过敏性鼻炎的症状,维生素的保护作用随着剂量的增加而增加。建议使用混合生育酚,而不是单独使用α.
注:生育酚,是维生素E的水解产物。天然的生育酚都是D-生育酚(右旋型),它有α、β、ϒ、δ等8种同分异构体,其中以α-生育酚的活性最强。作为抗氧化剂使用的生育酚混合浓缩物,是天然生育酚的各种同分异构体的混合物。
维生素 C
维生素 C具有抗组胺特性,有助于减轻过敏症状。此外,维生素C也有助于增强免疫系统。因此,它有助于预防感染,同时缩短过敏性鼻炎的持续时间。
因此,每天应多吃橙子、灯笼椒、西红柿、柠檬、草莓、豆芽、土豆、奇异果、西兰花、柚子等富含维生素C的食物。
金钗石斛
金钗石斛具有抗炎和免疫活性,近期的一项小鼠研究发现,石虎提取物的治疗抑制了PI3K/AKT/mTOR通路,在门和属水平上恢复了肠道菌群的平衡,并改善了调节T细胞分化,从而有效地扭转了过敏性鼻炎症状。
适度运动
定期锻炼有助于减少过敏反应,适度运动对有过敏症的人无害,过敏体质的人可以按照普通人群的运动建议进行。这包括每周至少 150 分钟的中等强度有氧运动或 75 分钟的高强度运动。
这些活动包括步行、跑步、骑自行车、跑步机锻炼、游泳等。
瑜伽
瑜伽可以通过很多种方式帮助缓解和治愈身体,甚至有助于缓解过敏性鼻炎的症状。瑜伽中的呼吸练习被称为调息,已被用作治疗哮喘的方法。它可能在减轻与过敏性鼻炎相关的症状方面发挥作用。
注意选择正规教师,一开始不要追求动作的完美,重要的是注意调息。
避免触发因素
一旦确定了过敏原,请尽量远离。例如:
洗鼻子
洗鼻液可以帮助清除鼻子中的过敏原。使用生理盐水喷雾有助于减少接触过敏原。
改善不良习惯
与其他过敏性疾病相比,肠道菌群在过敏性鼻炎发病机制中作用的证据仍然较少,但肠道菌群失调与 过敏性鼻炎之间的关系是显而易见的。
肠道微生物群的高度多样性有助于平衡免疫反应,其机制涉及增加代谢物(如短链脂肪酸)和减少炎症介质的产生。
肠道菌群结构异常与过敏性鼻炎的发生率密切相关,这为我们提供了一个新思路,即肠道菌群失调可能是过敏性疾病的重要预测因子。
目前很多研究已经发现益生菌在临床上治疗过敏性疾病的初步效果,可能会减少过敏症状的发生率和持续时间。然而也有一些研究发现,益生菌治疗并没有显着改善临床症状,这可能是因为临床试验包括许多变量,例如伴随疾病、年龄、性别和许多其他因素,还需进一步探索研究。同时,益生菌辅助联合疗法也是一个值得关注的领域。
总的来说,通过各种方式调节肠道微生物群,恢复肠道粘膜屏障,恢复免疫平衡,抑制炎症,有助于改善过敏性鼻炎,肠道菌群或将成为过敏性鼻炎早期干预的新靶点。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Li J, Fang F, Mei M, Wu D. The gut microbiome and allergic rhinitis; refocusing on the role of probiotics as a treatment option. Eur Arch Otorhinolaryngol. 2022 Oct 14. doi: 10.1007/s00405-022-07694-z. Epub ahead of print. PMID: 36239785.
Zhou MS, Zhang B, Gao ZL, Zheng RP, Marcellin DFHM, Saro A, Pan J, Chu L, Wang TS, Huang JF. Altered diversity and composition of gut microbiota in patients with allergic rhinitis. Microb Pathog. 2021 Dec;161(Pt A):105272. doi: 10.1016/j.micpath.2021.105272. Epub 2021 Nov 2. PMID: 34740809.
Zhu L, Xu F, Wan W, Yu B, Tang L, Yang Y, Du Y, Chen Z, Xu H. Gut microbial characteristics of adult patients with allergy rhinitis. Microb Cell Fact. 2020 Sep 1;19(1):171. doi: 10.1186/s12934-020-01430-0. Erratum in: Microb Cell Fact. 2020 Oct 8;19(1):192. PMID: 32873292; PMCID: PMC7466420.
Kaczynska A, Klosinska M, Chmiel P, Janeczek K, Emeryk A. The Crosstalk between the Gut Microbiota Composition and the Clinical Course of Allergic Rhinitis: The Use of Probiotics, Prebiotics and Bacterial Lysates in the Treatment of Allergic Rhinitis. Nutrients. 2022 Oct 16;14(20):4328. doi: 10.3390/nu14204328. PMID: 36297012; PMCID: PMC9607052.
Liu P, Hu T, Kang C, Liu J, Zhang J, Ran H, Zeng X, Qiu S. Research Advances in the Treatment of Allergic Rhinitis by Probiotics. J Asthma Allergy. 2022 Oct 7;15:1413-1428. doi: 10.2147/JAA.S382978. PMID: 36238950; PMCID: PMC9552798.
Sahoyama Y, Hamazato F, Shiozawa M, Nakagawa T, Suda W, Ogata Y, Hachiya T, Kawakami E, Hattori M. Multiple nutritional and gut microbial factors associated with allergic rhinitis: the Hitachi Health Study. Sci Rep. 2022 Mar 1;12(1):3359. doi: 10.1038/s41598-022-07398-8. PMID: 35233003; PMCID: PMC8888718.
Huang J, Zhang J, Wang X, Jin Z, Zhang P, Su H, Sun X. Effect of Probiotics on Respiratory Tract Allergic Disease and Gut Microbiota. Front Nutr. 2022 Feb 22;9:821900. doi: 10.3389/fnut.2022.821900. PMID: 35295917; PMCID: PMC8920559.
Zoabi Y, Levi-Schaffer F, Eliashar R. Allergic Rhinitis: Pathophysiology and Treatment Focusing on Mast Cells. Biomedicines. 2022 Oct 5;10(10):2486. doi: 10.3390/biomedicines10102486. PMID: 36289748; PMCID: PMC9599528.
Meirlaen L, Levy EI, Vandenplas Y. Prevention and Management with Pro-, Pre and Synbiotics in Children with Asthma and Allergic Rhinitis: A Narrative Review. Nutrients. 2021 Mar 14;13(3):934. doi: 10.3390/nu13030934. PMID: 33799367; PMCID: PMC7999316.