 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

随着社会的快速发展,环境污染物也逐渐增多(就像过年期间绚烂的烟花虽然让节日气氛更浓厚热闹,但在一定程度上也造成了污染)。这些污染物不仅对自然生态系统构成了威胁,也严重影响了人类的健康和生活质量。
环境毒物是指能够损害环境质量并对人类和其他动物产生不利影响的化学物质。接触这些污染物的主要途径是通过呼吸道、皮肤和口腔摄入。当通过口腔摄入时,它们会遇到生活在人体内的一个特殊的群体——肠道微生物群。
虽然污染物会破坏肠道微生物群平衡,但肠道微生物群在这些化合物的代谢和生物利用度中发挥着重要作用。在正常生理条件下,肠道微生物群用于代谢或排泄外源物质的策略包括还原和水解转化、裂合酶和官能团转移反应以及酶介导的功能转化。同时,宿主进行主要基于结合、氧化和水解反应的代谢过程。
肠道微生物群中存在多种细菌酶,化学物质以及次生代谢物,因此微生物转化被认为是人类和其他哺乳动物污染物代谢机制的关键组成部分。
在污染物中,近年来重金属的污染特备值得关注,因为其毒性,即使在非常低的浓度下也对人体有许多不利影响。下图列出了几种常见重金属对人器官的毒性以及被破坏的生理分子机制。
汞、铅、镉、砷的毒性

Balali-Mood M,et al.Front Pharmacol.2021
在本文中,将根据最新文献讨论污染物尤其重金属例如铅、砷、镉和汞与宿主生物体及其肠道微生物群之间的双向相互作用,以及肠道微生物群如何改变宿主生物体对有毒物质的敏感性,另外讨论针对微生物群的干预措施在多大程度上可以减轻重金属中毒造成的不良影响。
这些有可能是确定未来治疗方法中能够最小化金属毒性的有益物种的关键因素。
★ 每个人都拥有独特的肠道微生物群
肠道微生物群落在出生时就开始获得,个体通过阴道分娩出生或剖腹产出生呈现出不同的肠道微生物群成分。
此外,怀孕期间的许多其他因素也会影响新生儿肠道微生物群的组成,包括母亲预防性使用抗生素、压力和饮食类型。分娩地点和出生后母乳喂养也是影响新生儿肠道微生物群组成的关键因素。
出生后,肠道微生物群会在个体2或3岁时成熟,此时儿童呈现出与成人在多样性和丰度方面相似的肠道微生物群组成。在整个产后发育过程中,许多其他因素可以改变这种已经确定的肠道微生物群成分,例如饮食、药物尤其是抗生素的摄入、使用益生菌和益生元、接触异生素、体力活动、压力、衰老、睡眠剥夺以及粪菌移植等干预措施。
★ 肠道微生物与免疫紧密相关
根据研究推测,先天免疫系统和适应性免疫系统在整个出生后生命中都随着宿主和肠道微生物群成分一起进化。胃肠道中微生物的最佳平衡被称为生态平衡;其特征是微生物、其次级代谢产物和宿主之间的平衡。然而,这种稳定性的变化称为生态失调,其特征是微生物多样性丧失、潜在有害细菌物种过度生长或对宿主有益的物种丧失。
此外,生态失调状态通常伴随着肠上皮屏障功能和渗透性的变化,从而改变个体的免疫反应和炎症状态。这种反应是由肠上皮固有层中的免疫成分精心策划的,这些成分负责检测肠道中微生物成分的变化,从而激活局部免疫反应,最终导致炎症。
★ 肠道微生物的代谢产物对宿主免疫和代谢健康也具有重要影响
反过来,宿主免疫系统的调节可能通过肠道微生物在宿主摄入的食物消化和发酵过程中产生的次级化合物发生。
次级化合物的一个例子是短链脂肪酸,它是肠道微生物和肠上皮细胞的能量来源,也是影响宿主生理和免疫系统的重要调节分子,被认为是具有抗炎特性的代谢产物。短链脂肪酸对肠上皮具有保护作用,调节上皮紧密连接蛋白的表达,并抑制多形核细胞、淋巴细胞或吞噬细胞的炎症反应。
类似地,次级胆汁酸,由肠道微生物代谢产生的化合物,具有保护和代谢作用,起到抗菌化合物的作用;它们还负责激活宿主中的免疫反应。
健康的微生物群还会产生维生素等有机化合物,这些化合物主要作为生物体内重要反应的催化剂,如能量转换。当肠道微生物成分发生变化时,这些重要化合物的合成发生变化,宿主的代谢也发生变化。
这些变化还与微生物群和周围组织之间通讯轴稳态的改变有关,例如大脑、心脏、肝脏、肾脏和肺,这些器官之前被研究发现受肠道微生物调节。
因此,影响肠道微生物建立和发展的因素也可能对人体产生系统性影响。事实上,由肥胖、癌症、高血压、糖尿病、抑郁症以及克罗恩病和帕金森病、自身免疫性疾病和心血管疾病等引起的宿主健康变化与肠道微生物成分的变化以及对人类宿主免疫反应或代谢特征的影响有关。
“外源物质”一词是指对生物体来说是外来的化合物,由人类活动产生,例如工业化学品、药物、农用化学品、食品添加剂等。环境污染物则定义为进入环境、累积超出自然水平、降低环境质量并对各种生物体有毒的化合物。
扩展阅读:
肠道菌群对药物毒性,重金属,污染物,膳食化合物的代谢和健康效应及应用前景
✦ 现代环境污染物越来越多,会对人体产生各种不利影响
现代生活方式伴随着农业、工业和自我护理过程中大量化学物质的使用,这些化合物由于使用和处置不当,可能导致水、土壤和空气的环境污染,这被认为是全球性的问题。
最常用和研究的环境污染物是农药、邻苯二甲酸盐、对羟基苯甲酸酯、金属和药物残留。
越来越多的证据表明,这些环境污染物会对免疫反应的正常功能以及内分泌、生殖和呼吸生理机能产生负面影响。
✦ 肠道微生物可能改善摄入的环境污染物毒性
有趣的是,肠道微生物群一个非常重要的功能与其代谢宿主生物体摄入的物质的能力有关。肠道微生物群可以改变各种物质的活性、分布和半衰期,产生宿主生物体无法自行产生的次生代谢物。
为了代谢和消除摄入的外源性物质,宿主生物体通常会进行化学结合、氧化和水解反应,而肠道微生物群则通过还原和水解转化、裂合酶反应和酶介导的官能团转移来修饰这些化合物。肠道微生物群可能导致宿主胃肠道中化合物的失活、激活或再激活,这突显了肠道微生物群在环境污染物代谢中的重要性。
考虑到肠道微生物群与环境污染物之间的相互作用是双向途径,一方面,污染物可以改变肠道微生物群的组成,从而改变其所执行的功能,另一方面,肠道微生物群具有以下能力:改变化合物的毒性,从而改变其对暴露个体的不良健康影响,本文主要讲述第二种作用,尽管研究仍然很少。
肠道微生物与环境污染物之间的双向关系
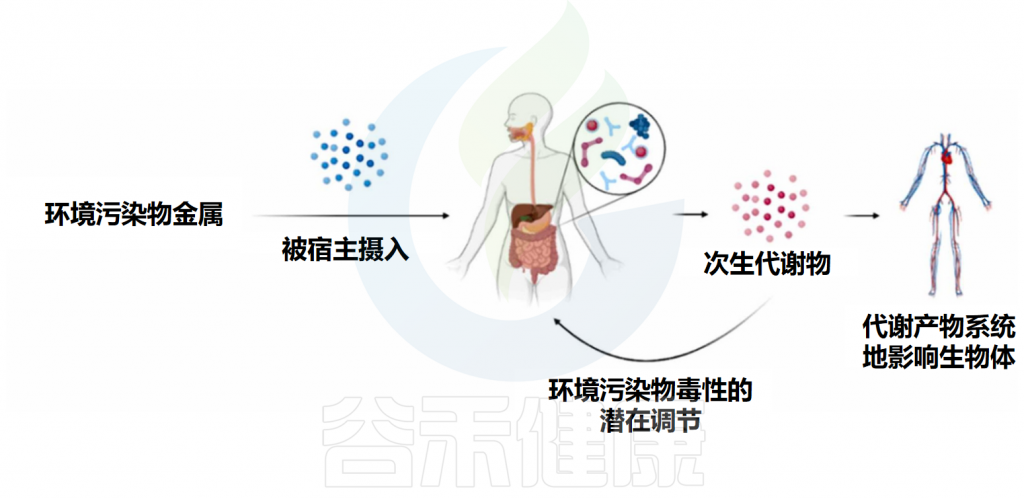
Santiago MSA,et al.Toxicology.2024
铅是一种耐蚀的重有色金属,常用于制造油漆、电池和电缆,并存在于一般环境中。一旦进入人体,铅就会对大脑和各种外周器官(肝脏、肾脏和骨骼)产生负面影响,并会在这些器官中累积多年。因此,铅可以影响重要的生物过程,包括内分泌、免疫、炎症和表观遗传反应。
根据美国毒物管理委员会(ATSDR),即使铅剂量非常低(≤5µg/dL),也可以观察到对健康的不利影响。
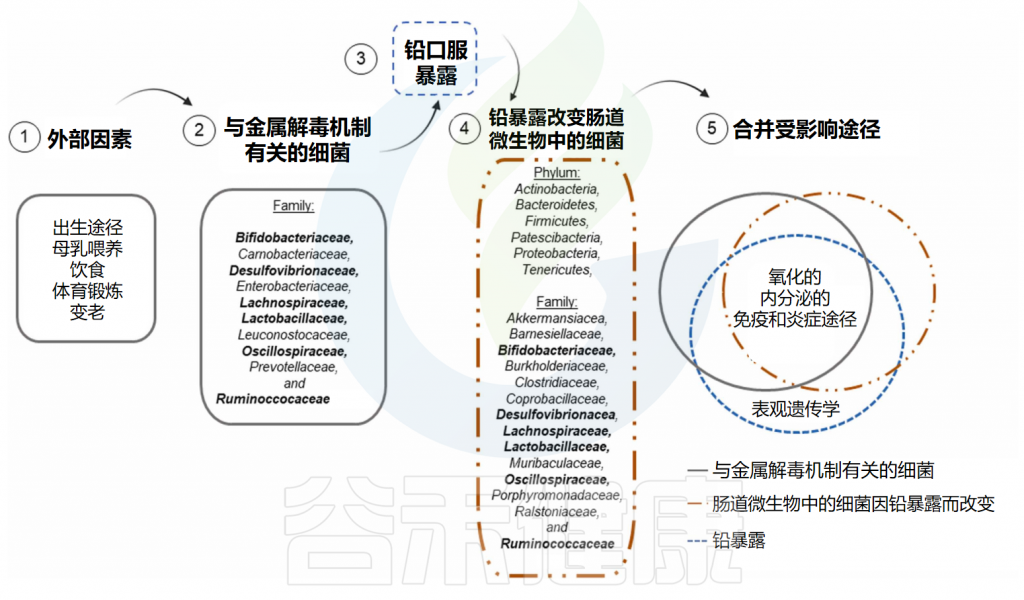
Santiago MSA,et al.Toxicology.2024
✦ 生态失调会加剧铅诱导的不良反应
影响人体和其他哺乳动物摄入铅的主要途径是摄入后胃肠道对铅的吸收和滞留,这取决于胃肠道内腔的微环境,特别是肠道微生物的特征。
动物暴露于不同剂量的铅(灌胃从20至1304毫克/公斤体重;饮用水中10微克/升至1.56克/升或100至 300ppm)以及治疗持续时间(从3天到28周)后,肠道微生物群的细菌特征发生变化。
与正常饮食(ND)喂养的动物相比,高脂肪饮食(HFD)喂养的动物因可能导致生态失调而出现加剧的铅诱导的不良反应,如组织中铅积累增加(结肠、肝脏、肾和胫骨)和组织学损伤(脂肪和肝组织),以及肠道微生物群组成的改变和许多其他结果。
✦ 铅浓度较高导致肠上皮渗透性增加
在临床环境中,中国电子垃圾回收区的土壤、水、空气、灰尘和植物中的铅浓度较高,发现生活在该区域的儿童肠上皮屏障渗透性增加 。
此外,暴露于铅正常饮食动物的肠道微生物群成分中,如脱硫弧菌属(Desulfovibrio)、罗氏菌属(Roseburia)和普雷沃氏菌(Prevotella)等细菌丰度增加,表明它们在调节铅毒性方面具有潜在相关性。
✦ 一些肠道细菌具有去除铅的能力对人体有益
最近,体外研究表明,99种乳酸菌菌株中至少有32种具有从培养基中去除铅(25ppm)的高能力。在这些微生物中,来自乳杆菌科(例如乳杆菌、魏斯氏菌和片球菌)或肉杆菌科(肉杆菌)的革兰氏阳性细菌被鉴定具有这种铅解毒的能力。
此外,来自双歧杆菌科(Bifidobacteriaceae)和肠杆菌科(Enterobacteriaceae)的细菌也表现出较高的铅去除能力,表明它们在暴露于铅的个体的肠道微生物中的多样性和丰度对于管理这种金属的毒性作用极其重要。
一些生物过程可能受到这些与铅解毒机制相关的细菌的影响,而铅暴露本身以及因暴露而改变的肠道微生物也可能影响相同的生物过程。
✦ 含有益生菌的膳食可减轻铅摄入的不利影响
临床前研究还表明,含有益生菌的膳食配方可减轻铅摄入引起的不利影响。在这些研究中,益生菌由单一革兰氏阳性菌组成,如鼠李糖乳杆菌、植物乳杆菌,或乳杆菌和双歧杆菌的组合、乳杆菌、双歧杆菌和链球菌、植物乳杆菌、罗伊氏乳杆菌或粪肠球菌,或与革兰氏阴性菌和Akkermansia muciniphila、Faecalibacter prausnitzii和Oscillibacter ruminantium,表明这些微生物在调节铅生物降解方面的潜在相关性。
大胆推测
这些结果提出了这样一个假设:口服某些类型的益生菌将有益于保护健康个体一生免受铅中毒的风险。其他类型的膳食补充剂,例如可溶性益生元低聚半乳糖、药用植物果实提取物溶液、源自蛹虫草的多糖以及高等植物中天然存在的绿原酸,也被建议用来减轻铅暴露对生物体的不利影响。
在膳食中添加益生元或益生菌来刺激已知调节铅解毒机制的细菌生长可能是对这些弱势群体的有益干预措施。这将是一个具有成本效益且无副作用的解决方案,也有助于缓解重要的公共卫生问题。
!
不足之处
迄今为止关于铅暴露和肠道微生物群成分的大多数研究都与铅如何影响肠道微生物群有关,而不是与肠道微生物如何影响和支持铅代谢有关。
有几点值得注意:除了表观遗传效应外,受铅暴露本身影响的生物过程与金属解毒机制相关的细菌以及受铅暴露改变的细菌调节的生物过程相同。因此,氧化、内分泌、免疫和炎症途径的损伤被认为在铅暴露个体中是重叠的,特别是在长期暴露中,这可能导致健康影响加剧,包括长期影响。
砷(As)是一种剧毒类金属,天然存在于水、土壤和沉积物中。砷中毒的主要来源是受污染的水和食物,无论是来自采矿和农业等人类活动还是自然保护区。
根据美国毒物管理委员会(ATSDR),砷的最低风险水平对于口服急性暴露(胃肠道结果)为0.005毫克/公斤/天, 对于口服慢性暴露(皮肤结果)为0.0003毫克/公斤/天。
✦砷暴露会导致人体肠道微生物组成改变、功能紊乱
一些研究了砷暴露对肠道微生物群成分的影响以及对个人可能产生的后果。这些研究主要使用亚砷酸钠或无机砷,剂量范围为0.05至750mg/kg体重(灌胃、食物或皮下注射)、0.05ppm至100ppm(饮用水或灌胃)或0.05至80mg /L(饮用水)。观察到肠道微生物群组成的改变和代谢组的变化等。
在砷处理的动物中还观察到以下结果:肠道微生物群组成改变、肠道微生物群功能紊乱、短链脂肪酸水平改变等。在肠道微生物群耗尽的动物中更为突出,这表明肠道微生物在保护宿主暴露于砷中的重要性。
对动物进行腹腔注射砷治疗,证实肠道微生物群在砷代谢中发挥着重要作用。还观察到,诱发生态失调的动物在接触100ppm的亚砷酸钠10周后,肝脏和肾脏功能损伤增加,肝脏和肾脏中砷的积累增加。
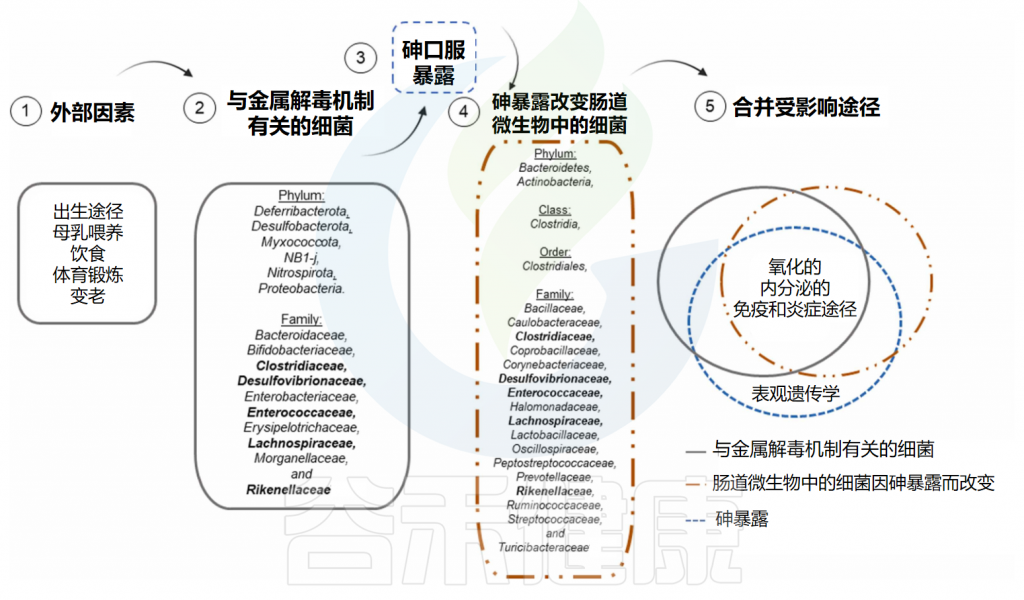
Santiago MSA,et al.Toxicology.2024
✦肠道微生物的生物转化可以减轻砷的危害
一些肠道微生物能够利用甲基化、去甲基化、氧化、还原和硫醇化反应来代谢和影响砷的生物转化。
将石墨烯给予暴露于砷的小鼠,通过改变肠道微生物群组成,从而改变了砷代谢。石墨烯减轻了砷引起的肠上皮结构改变、肠道和肝脏的氧化损伤以及其他不良反应,这表明石墨烯可能是砷暴露时的补充目标。
此外,暴露于亚砷酸盐的Beclin1+/-小鼠也表现出结果的减轻,例如肠道微生物群成分改变、脑组织学改变(神经元细胞形状异常、细胞核萎缩和断裂)、焦虑样行为等,表明抑制自噬也可能是预防砷引起的肠道微生物群干扰的一种方法。
✦ 影响砷代谢和转化的细菌
上图显示了肠道微生物群中一些特定的细菌物种在砷暴露后发生变化,这些细菌与重要的生物途径有关,这些途径与负责砷解毒机制的细菌和砷暴露本身调节的途径相同。 Alistipes、Bilophila和Clostridia是接触砷后发生变化的细菌,推测参与砷代谢和消除。
因此,这些细菌可能是干预策略的目标物种,例如在与砷暴露有关的地区中进行益生菌补充。乳酸杆菌和双歧杆菌是在体外具有生物转化砷能力的细菌,这表明它们也可能作为益生菌使用。
值得注意的是,除了表观遗传学外,砷暴露后受影响的所有其他过程(即氧化平衡、内分泌和免疫调节以及炎症反应)也受到参与砷解毒机制的细菌以及砷暴露后改变的细菌的调节。这些生物过程可能在砷暴露后受到长期影响,并产生长期影响,正如已经讨论过的铅一样。
镉(Cd)是一种毒性广泛的金属,导致人体生理发生许多变化。人类接触镉的主要来源是从受污染的土壤和水中摄入谷物和蔬菜。镉通过内分泌和免疫系统调节、炎症、先天、适应性和粘膜免疫反应的调节、DNA修复机制的损伤、氧化应激、细胞凋亡的诱导和表观遗传学的变化来发挥其毒性。
根据ATSDR(2024),口服中等暴露(肌肉结果)的镉最低风险水平为0.0005毫克/公斤/天 ,口服慢性暴露(肾脏结果)的最低风险水平为0.0001毫克/公斤/天。
✦ 镉暴露会导致肠上皮损伤、代谢紊乱
据描述,肠道微生物在摄入镉后的代谢中起着关键作用。在啮齿类动物的研究中,镉暴露与肠道微生物群成分的改变以及肠上皮屏障的损伤有关(通过Ocln、Cldn-1、Cldn-4、ZO-1的表达和 FITC-葡聚糖的血清水平的改变来证明),代谢谱(主要是氨基酸、多胺、长链脂肪酸、短链脂肪酸、核苷酸、糖、吲哚衍生物等)的紊乱和其他不良影响。
在这些研究中,氯化镉是所用镉的主要形式,剂量范围为0.25至85mg/kg(灌胃或腹腔注射),或150μg/L至100mg/L(饮用水),或50至100ppm(饮用水),暴露时间从5天到52周不等。
✦ 肠道微生物在镉代谢中发挥重要作用
暴露于镉的动物,与高脂肪饮食或阿尔茨海默症的遗传风险因素——这两个因素都已知会改变肠道微生物成分,对镉暴露的反应加剧。不良反应包括肠道微生物成分的改变、代谢途径的紊乱(通过改变KEGG直向同源物证明)以及肝脏和肾脏损伤。这些数据表明了健康微生物群在镉代谢方面的重要性。
关于补充益生菌,革兰氏阳性菌如植物乳杆菌CCFM8610、植物乳杆菌BGAN8、P. pentosaceus GS4、P. distasonis和革兰氏阴性A.muciniphila MucT、B. cepacia被证明可以减轻镉暴露对生理的影响。
细菌介导的镉消除具有菌株特异性
在一项225种细菌菌株混合物去除镉的体外研究中,细菌介导的镉去除被证明具有门、属和菌株特异性,其中革兰氏阳性菌为短双歧杆菌 FPL 19317、L.sakei DMS 20017、Carnobacters divergens V41、Pediococcus Acidilacici DSM 19927和Pediococcus claussenii DSM 14800表现出高镉 去除能力。
众所周知,外部因素可以改变肠道微生物中的一些细菌,从而影响宿主生物体的镉代谢、解毒和排泄能力。已知一些特定的细菌菌株在接触镉后会发生变化,这些细菌也与镉解毒有关,参与许多生物过程,如下图所示。
迄今为止的研究认为Pediococcus pentosaceus GS4 、植物乳杆菌CCFM8610和鼠李糖乳杆菌-发酵灵芝——是作为未来减轻镉毒理学有前途的物种。
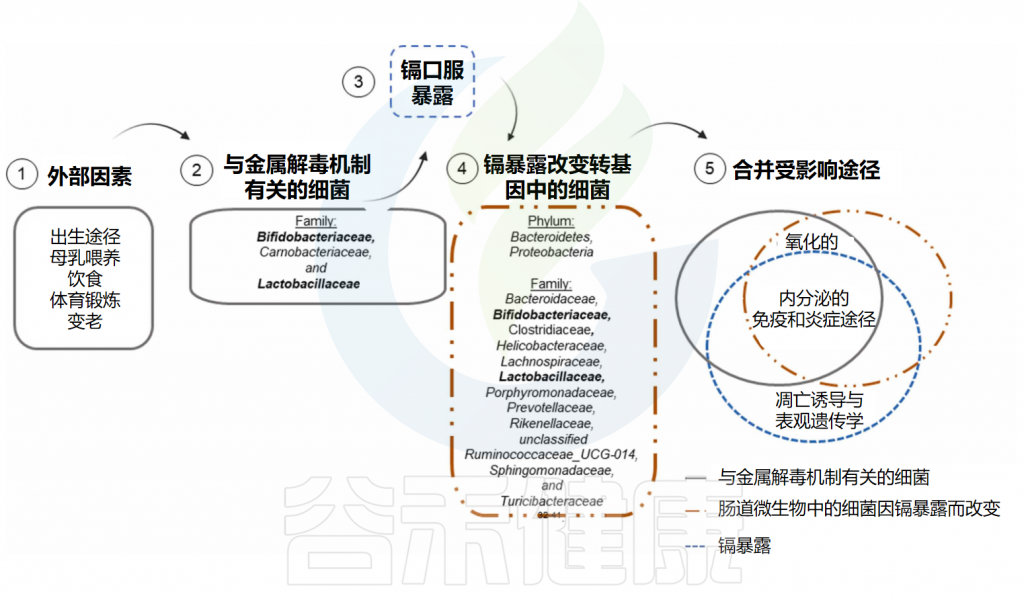
Santiago MSA,et al.Toxicology.2024
除了细菌补充外,有证据表明还有其他方法可以减轻镉毒性,例如膳食补充低聚果糖、绿原酸和褪黑激素,可以间接促进肠道微生物群稳态。
汞(Hg)污染的主要来源是通过汞蒸气(污染物全球分布的主要途径)、通过受污染的土壤和水(使汞进入食物链)以及通过颜料等受汞污染的产品。
汞是毒性方面研究最多的金属之一,主要以无机汞(IHg)和甲基汞(MeHg)形式存在。有机汞在胃肠道中被吸收,然后分布到全身。
根据ATSDR(2024),口服急性暴露(肾脏结果)的IHg最低风险水平为2ug/kg/天,口服中间暴露(肾脏结果)的最低风险水平为0.01ug/kg/天,而MeHg的最低风险水平为0.1ug/kg/天口服慢性暴露(神经系统结果)。
✦ 汞影响人体的内分泌、免疫,扰乱代谢
许多研究已经报道汞影响生物体的重要途径,例如内分泌和免疫系统调节、炎症、氧化应激和表观遗传学,还提出了通过肠道微生物进行甲基汞代谢的间接途径,该途径主要增强肠道屏障功能,即肠道通透性,以防止甲基汞的再摄取。
从啮齿动物研究中可以推断,汞暴露会改变肠道微生物群组成,并扰乱代谢途径(与核苷酸、碳水化合物、氨基酸和脂质的代谢、肠道免疫系统和神经系统等相关)、肠道(细胞坏死、肠上皮改变、炎症细胞等)、肝脏(主要是炎症细胞浸润)和脑(具有小尺寸深染和浓缩细胞核的锥体细胞)的组织学变化。
✦ 通过改善肠道微生物有助于汞解毒
根据人类和动物研究,已知一些细菌种类在汞解毒中发挥重要作用。值得注意的是,外部因素可以改变肠道微生物中这些细菌的多样性和丰度,并且据报道这些细菌可以调节许多生物过程。
此外研究发现,在喂食补充低聚果糖的饮食后接触汞的小鼠,粪便中的汞含量增加,组织中的汞含量降低,这表明汞排泄有所改善。
研究还发现白藜芦醇治疗可以减轻汞引起的大鼠后果,例如肠道微生物成分的恢复、神经发育障碍、肠道和大脑组织学改变以及汞积累。
而使用抗生素治疗后暴露的汞(已知会导致生态失调)会降低粪便中的汞含量,并增加血液中的汞含量,这强化了肠道微生物在汞解毒机制和排泄中的重要作用。
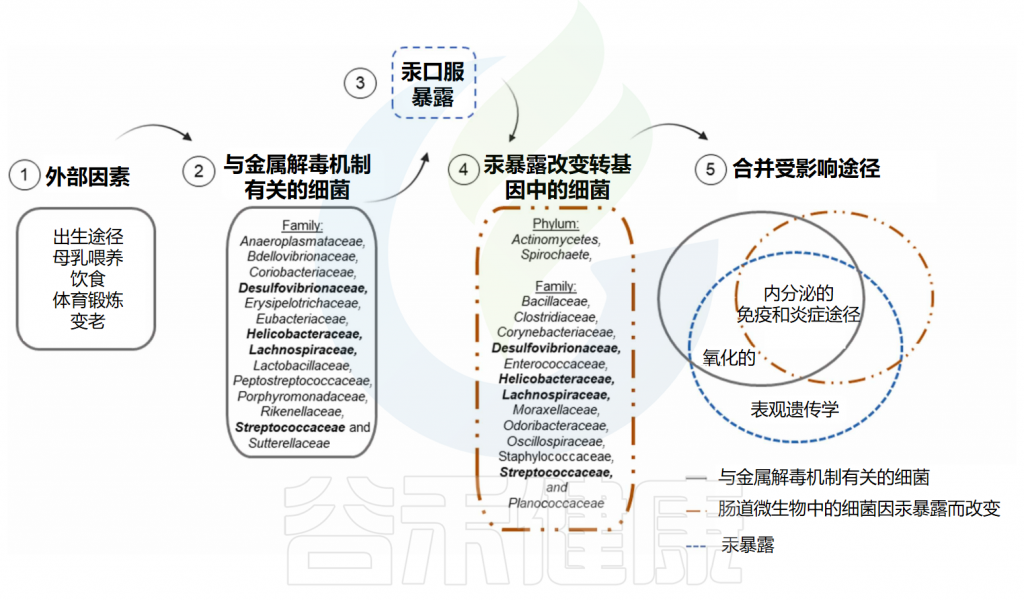
Santiago MSA,et al.Toxicology.2024
合理建议
关于汞暴露后减轻不利影响的可能干预行动的研究很少。在这种情况下,可以假设螺旋杆菌科(Helicobacteraceae)、丹毒丝菌科(Erysipelotrichaceae)和消化链球菌科(Peptostreptococcaceae)可能是针对接触汞的个体进行补充的目标细菌家族,这些细菌被发现受到汞暴露的影响,并且也参与汞解毒机制。并开始采取一些举措来减轻汞对弱势群体的毒性影响,比如生活在淘金区的人,应定期进行医学检查,以早期发现和治疗汞中毒。
在本文提出的四种金属中,汞是关于汞暴露后潜在的益生元、益生菌或其他补充剂的研究较少的金属。因此,需要更多的研究来确定与汞暴露有关的潜在补充目标。
大多数研究都提到了金属可能对肠道微生物群造成的不利影响,然而肠道微生物细菌如何通过参与金属的代谢来影响金属毒性的研究却较少。
由于肠道微生物群可以改变摄入化合物的活性和反应性,因此肠道微生物群成为减轻异生物质(例如环境污染物)毒性的可能策略的重要研究目标。肠道微生物与环境污染物毒性调节之间关系的机制仍有待更好地阐明。
值得注意的是,除了肠道微生物生态失调之外,接触金属通常还与其他威胁有关,例如神经、内分泌、免疫和生殖损伤。除了已知的金属对这些目标系统的直接毒理学影响外,观察到的不利影响可能是由于直接和间接损害的重叠造成的,因为受影响的肠道微生物还可以通过以下方式调节这些目标系统的生理学:胃肠道和这些器官之间的通讯轴。这可能意味着暴露于重金属的个体生理方面会受到长期损害。
一些受金属接触影响的细菌与负责金属代谢的细菌可能存在重叠,并且容易因金属暴露而发生改变。因此长期暴露于金属污染的个体可能会逐渐变得更加脆弱。此外,深入了解肠道微生物对有毒金属的影响可以被认为是确定未来治疗方法中能够最小化金属毒性的有益物种的关键因素。需要进一步的研究来阐明可能涉及的新机制,以及可能的补充缓解策略,特别是在生活在污染地区的人群。
主要参考文献
Could the gut microbiota be capable of making individuals more or less susceptible to environmental toxicants?
Al Osman M, Yang F, Massey IY. Exposure routes and health effects of heavy metals on children. Biometals. 2019 Aug;32(4):563-573.
Balali-Mood M, Naseri K, Tahergorabi Z, Khazdair MR, Sadeghi M. Toxic Mechanisms of Five Heavy Metals: Mercury, Lead, Chromium, Cadmium, and Arsenic. Front Pharmacol. 2021 Apr 13;12:643972.
Dai Z, Liu J, Yao X, Wang A, Liu Y, Strappe P, Huang W, Zhou Z. Association of gut microbiota characteristics and metabolites reveals the regulation mechanisms under cadmium consumption circumstance. J Sci Food Agric. 2022 Nov;102(14):6737-6748.
Iljazovic A, Amend L, Galvez EJC, de Oliveira R, Strowig T. Modulation of inflammatory responses by gastrointestinal Prevotella spp. – From associations to functional studies. Int J Med Microbiol. 2021 Feb;311(2):151472.
Li D, Yang C, Xu X, Li S, Luo G, Zhang C, Wang Z, Sun D, Cheng J, Zhang Q. Low dosage fluorine ameliorates the bioaccumulation, hepatorenal dysfunction and oxidative stress, and gut microbiota perturbation of cadmium in rats. Environ Pollut. 2023 May 1;324:121375.
Ortigão R, Pimentel-Nunes P, Dinis-Ribeiro M, Libânio D. Gastrointestinal Microbiome – What We Need to Know in Clinical Practice. GE Port J Gastroenterol. 2020 Aug;27(5):336-351.