 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
酒精与健康

饮酒作为一种特殊的文化形式,在我们国家有其独特的地位,在几千年的发展中,酒几乎渗透到日常生活、社会经济、文化活动之中。
据2018年发表的《中国饮酒人群适量饮酒状况》白皮书数据显示,中国饮酒人群高达6亿。酒精暴露是一种环境刺激,可显著改变许多生理、心理以及周围和中枢神经系统过程。从心脏和肝功能,到对肠道微生物组和内分泌途径的影响,酒精对全身和大脑都有广泛的影响。
众多的研究表明酒精本身可以产生双重效果,当然,这取决于饮酒量和酒的生产方式。
▸ 低-中剂量
低度至中度酒精对肠道微生物组、肠道代谢物和免疫相关疾病甚至一些癌症似乎起保护和有益作用。
▸ 高剂量
高剂量酒精或长期酗酒对胃肠道、肠道微生物组、免疫细胞和营养物质起破坏和损害作用。
目前的证据还表明,不同剂量的酒精在体内不同组织部位发挥不同的作用。
总体来说,过度饮酒,尤其在青少年和部分职业人群中占比越来越高,带来的伤害和健康风险不容忽视。过度饮酒会导致许多不良的病理健康影响和沉重的医疗保健负担。
根据世界卫生组织最新的通报指出,全球每年大约有超过300万人因过量饮酒而被夺去生命,其死亡人数已经超过爱滋病、暴力和交通事故死亡人数的总和。在饮酒所造成的直接或间接的死亡事件中,男性饮酒带来的风险尤为突出。

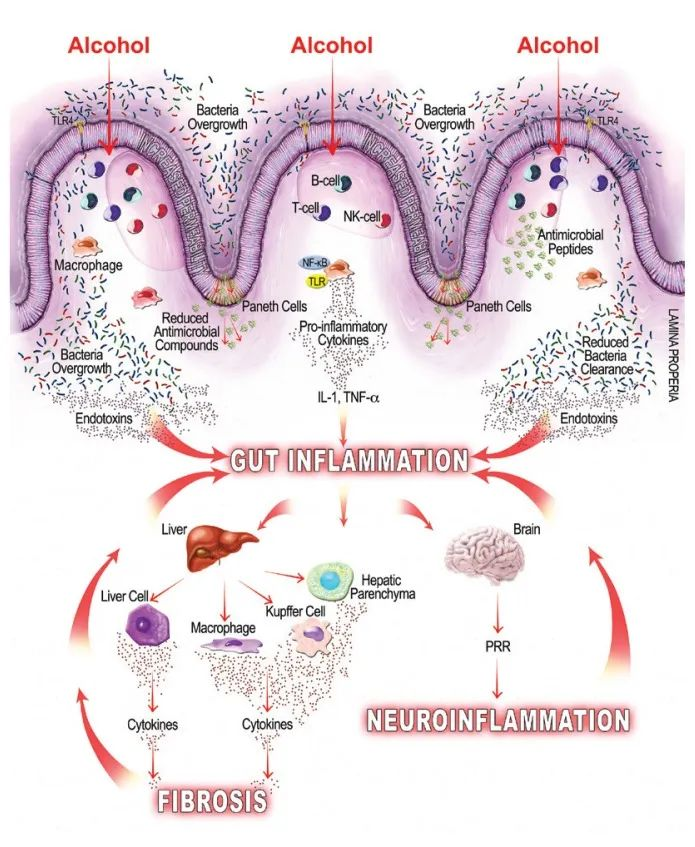
酒精引起的胃肠道功能以及微生物群组成和代谢的变化,内毒素血症的肠道通透性与全身性炎症和组织损伤/器官病变相关。
在过去的十年中,肠道,特别是肠道微生物群与酒精性肝病之间的关联引起了研究人员的关注。酒精与消化系统密不可分。它通过肠道吸收,并在肝脏内被肝细胞代谢。过量饮酒会导致肠道微生物组和肠道上皮完整性发生改变。它会导致重要的微量营养素缺乏症,包括短链脂肪酸和微量元素,这些元素会影响免疫功能并导致肝和其它器官损伤。
而且,酒精引起的微生物组改变和肠道屏障完整性下降会对中枢神经系统产生深远影响,导致抑郁、焦虑和对酒精的渴望增加,从而增加酗酒行为,造成恶心循环。
目前,酒精的治疗干预措施主要包括药物治疗、心理治疗、社会支持等方面。然而,这些干预措施都存在着一定的局限性,例如药物治疗可能会产生副作用,心理治疗需要长时间的治疗过程,社会支持需要家庭、朋友等的积极配合。
因此,寻找一种更加有效、安全、方便的治疗方法成为了当前治疗酒精成瘾和酒精使用障碍的研究重点。近年来,越来越多的研究表明,肠道菌群可能成为新的治疗酒精成瘾和酒精使用障碍的途径。新兴研究表明,通过调节肠道菌群可以减轻酒精成瘾的症状,例如减少饮酒量、降低戒断症状等。
本文将介绍酒精摄入或饮酒与肠道菌群及其代谢,肠内外健康的关系。
↘
本文目录
01 饮酒如何影响健康
酒精进入人体过程
酒精和肠道
酒精带来的有害影响
适量酒精带来的益处
02 轻中剂量酒精对自身免疫性疾病的保护作用
短链脂肪酸
多不饱和脂肪酸
自身免疫性糖尿病
自身免疫性甲状腺疾病
系统性红斑狼疮
类风湿关节炎
多发性硬化症
03 高剂量酒精对肠道菌群及其代谢物和营养物质的促炎作用
高剂量酒精对肠道菌群组成的影响
高剂量酒精对肠道屏障功能的影响
高剂量酒精对肠道微生物代谢物的影响
长期饮酒对营养状况的影响
高剂量酒精对肠道炎症和黏膜免疫的影响
04 酒精对相关疾病的影响
酒精与肠-肝轴和肝病
-酒精代谢
-酒精相关性脂肪变性
-酒精性脂肪性肝炎
-酒精引起的纤维化和肝硬化
-肝癌
酒精与胃肠道疾病
酒精和营养不良&肥胖
-营养不良
-肥胖
酒精和心血管疾病
-血脂概括
-高血压
05 酒精与肠脑轴和酒精成瘾
06 干预措施
酒精(乙醇)是一种水溶性小分子,通过胃和近端小肠进入血流,然后分布到全身。它首先进入门静脉,门静脉直接排入肝脏,这是接触酒精最多的地方。肝脏消除了大部分酒精 (90%),而 2–5% 以原形通过尿液、汗液和呼吸排出。
身体第一个直接接触酒精的器官系统是消化系统;因此,从口腔到直肠,几乎消化系统的每个部分都会受到酒精的影响。
酒精对消化系统的病理影响部分取决于肠-肝轴。这种由肠肝循环促进的双向关系涉及消化和细菌产物从肠道到肝脏的运输,以及胆汁、抗体和细胞因子返回肠道。
过量酒精摄入已被证明会通过破坏肠道微生物组成、代谢组和肠道上皮屏障来改变这一轴。这些干扰最终会对营养吸收产生连锁反应。
酒精对肠道的影响
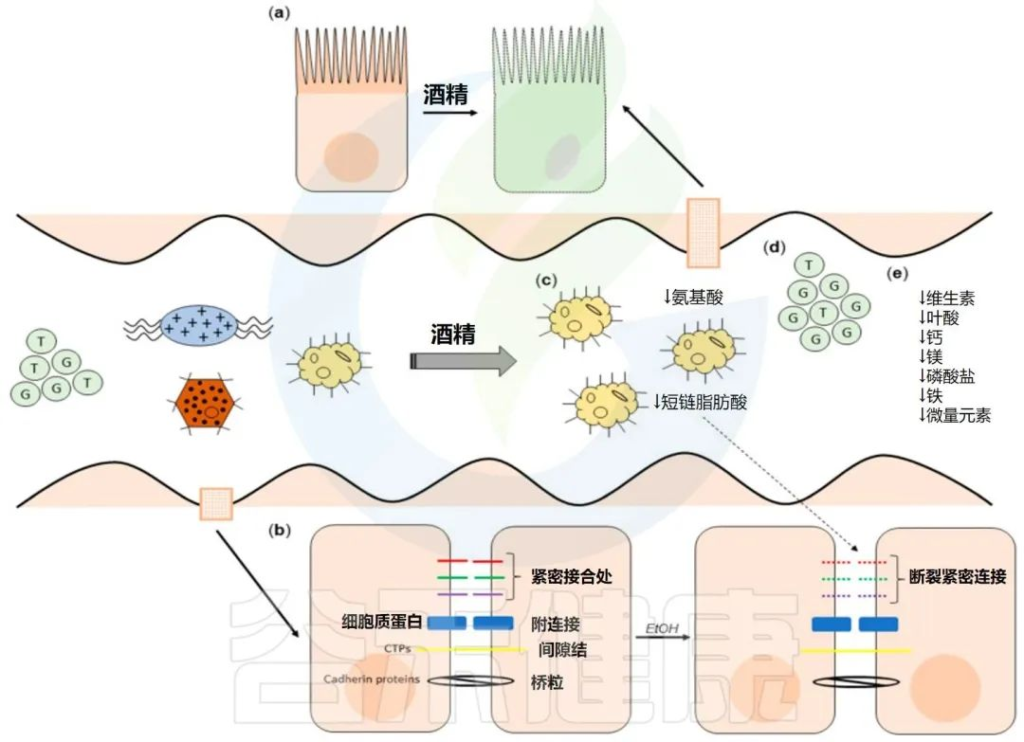
Pohl K et al. Nutrients. 2021,13(9):3170.
CTP:连接蛋白跨膜蛋白;JAM:连接粘附分子;EtOH:酒精。
( a ) 酒精对肠粘膜的组织学影响(细胞死亡、粘膜侵蚀和绒毛尖端上皮细胞丢失)。
( b ) 酒精引起的紧密连接破坏,因管腔短链脂肪酸浓度降低而加剧。
( c ) 酒精引起的生态失调导致短链脂肪酸和氨基酸浓度降低。
( d ) 次级胆汁酸浓度增加,与甘氨酸结合的比例增加。
( e ) ( a – d ) 导致的营养缺乏。
酒精对人体的影响是双重的,既有正面的作用,也有负面的作用。
▼
过量饮酒对人体各部位可能引起的有害影响
– 嘴
饮酒会刺激口腔和喉咙,这会增加患口腔癌的风险。
– 食管
酒精从口腔进入胃部时会引起刺激,从而增加患食道癌的风险。
– 胃
酒精会引起胃壁刺激和随后的炎症,这种情况也称为胃炎。胃壁过度刺激或发炎会导致受影响区域出血和溃疡。
此外,饮酒会导致营养吸收不良,从而使个人患上一系列其他疾病的风险更高。
– 大/小肠
饮酒会抑制大肠和小肠内的营养吸收。肠道蠕动也会受到影响并导致腹泻。
– 胰腺
酒精会导致胰腺发炎,也称为胰腺炎。酒精还会影响胰腺产生胰岛素的方式,如果不停止饮酒,最终会导致个体患上糖尿病。
– 肝脏
酒精是通过 ADH 和 CYP2E1 代谢的,这两种酶都是肝脏的重要功能酶。
通过干扰这些酶的正常功能并产生有害的副产物,对肝脏的影响可能包括肝脏炎症或肝炎、肝硬化、黄疸。
饮酒过多的人可能的直接有害影响
长期酗酒的危害
长期饮酒是全世界最常见的死亡原因之一。根据世界卫生组织的数据,全世界有 23 亿人饮酒,其中约 7500 万人被归类为患有酒精障碍。
酒精滥用会对多个终末器官造成损害,主要是肝脏、肠道和大脑,从而引发多系统损伤。
酒精中毒对全球发病率和死亡率有显著影响,每年约有 5.3% 的死亡是由有害饮酒造成的(世卫组织,2018 年)。一项针对印度南部农村 167,343 名成年受试者的研究发现,每天饮酒 30 年或更长时间会增加癌症相关死亡率的总体水平。
大量饮酒通常与患癌症的风险增加有关;然而,具体的剂量反应关系因癌症部位而异。
——饮酒量越多,肝癌风险越高
最近对涉及 19 组肝癌(即肝细胞癌)受试者的 16 篇文章进行的荟萃分析发现,与不饮酒者相比,饮酒量与肝癌风险之间存在线性关系。
因此,每天饮用 3 杯酒精饮料与风险增加相关,而每天饮用约 7 杯酒精饮料则风险增加高达 66%。
——不同种类乳腺癌,饮酒风险不同
乳腺癌风险也存在类似的线性关系。虽然饮酒总体上与女性患乳腺癌的风险较高有关,但这种关联并不适用于所有类型的乳腺癌。
在参加妇女健康倡议的女性中,饮酒者患雌激素阳性乳腺癌的风险增加。
而与从未饮酒的女性相比,饮酒者患三阴性乳腺癌的风险降低。
注:三阴性乳腺癌,孕激素、雌激素受体以及Her-2即表皮上皮生长因子,都是阴性,叫三阴性乳腺癌。
总之,饮酒和滥用酒精与多种癌症有关,并且这些关联的数量还在不断增加。与此同时,现在越来越清楚的是,酒精对某些慢病和癌症具有预防作用。此外,尽管酒精在预防某些癌症方面具有潜在的有益作用,但重要的是要记住,不能忽视长期酗酒的有害影响。
可能会增加以下疾病的易感性:
酒精引起的肠道菌群和代谢功能的变化可能导致
虽然酒精的新陈代谢看起来相当简单,但酒精的有害影响最常与新陈代谢过程相关,而新陈代谢过程通常会导致烟酰胺腺嘌呤二核苷酸加氢 (NADH) 的过量产生。
大量的 NADH 会导致乳酸,从而导致体内酸中毒,以及葡萄糖合成不足,从而导致低血糖。
▼
虽然大多时候我们都认为饮酒会带来许多有害影响,但过去几年进行的几项临床研究表明,适度饮酒实际上可以促进许多健康益处,例如:可能有助于降低患心脏病和死亡、缺血性中风、糖尿病的风险。这些益处的前提是要适度饮酒,那么什么是适度饮酒?
根据疾病预防控制中心的说法:
轻度饮酒:每周喝三杯或更少的酒精饮料。
适度饮酒:女性每天喝一杯酒精饮料,男性每天喝两杯。
大量饮酒:女性每天喝四杯或更多酒,男性每天喝五杯或更多酒。
注:这个定义在不同的研究中存在差异。由于参与者的主观记忆和准确的报告,准确的人类消费量很难量化。
适度饮酒具体是如何带来益处的?
适量的酒精已被证明可以提高高密度脂蛋白 (HDL) 的水平,这是一种“好”胆固醇,实际上这已经从你的身体中去除了有害的胆固醇。
当一个人的 HDL 水平较高时,它们就能更好地保护自己免受心脏病的侵害。
适度摄入不含酒精的啤酒,可以通过补充生物活性多酚和酚酸,以及通过有益菌丰富肠道微生物群多样性,对人体健康产生积极影响。
——适量饮酒与血癌发病率较低相关
有趣的是,饮酒还与几种血癌的发病率较低有关,包括非霍奇金淋巴瘤 (NHL) 和多发性骨髓瘤。对与瑞典癌症登记处相关的 420489 名被诊断患有酒精使用障碍 (AUD) 的人进行的分析还发现,他们患白血病、多发性骨髓瘤和霍奇金病的风险较低。
最近的另一项研究还表明,饮酒与白血病风险增加无关,事实上,少量饮酒(每天少于或等于一杯)与白血病发病率降低 10% 有关。
——适量饮酒与甲状腺癌和肾细胞癌风险降低有关
在肾细胞癌的案例中,男性和女性的饮酒量低至每天 1 杯,风险也会降低,而更高的酒精摄入量并没有带来进一步的好处。
——适度饮酒与直肠腺癌呈负相关
一项针对结肠和直肠腺癌的回顾性观察性研究表明,适度饮酒(每天少于 14 克)与直肠癌的发病率呈负相关。研究人员还发现,适度摄入啤酒,尤其是葡萄酒与远端结直肠癌呈负相关。
酒精在体内具有多效性
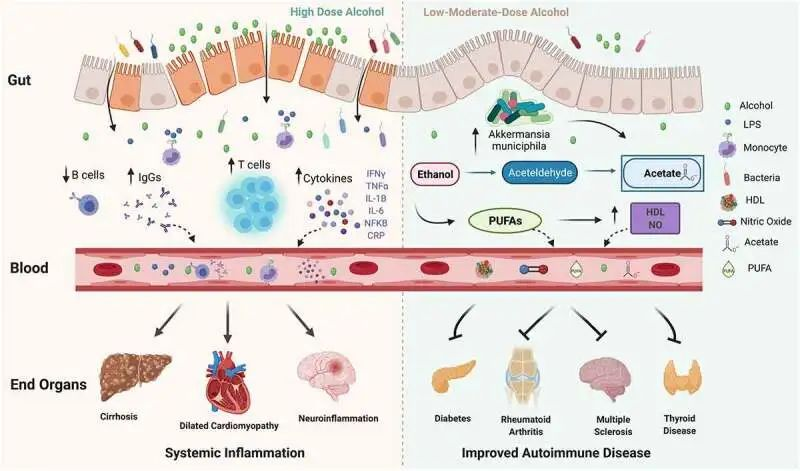
10.1080/19490976.2021.1916278
在高剂量下,酒精会破坏肠道屏障的稳定性,并可能导致肠道微生态失调、细菌壁产物、脂多糖 (LPS) 增加,后者会刺激免疫细胞上的 Toll 样受体 (TLR),并导致单核细胞、T 细胞、细胞因子和免疫球蛋白 (IgG) 水平以及 B 细胞减少。反过来,循环的炎性细胞因子、IgG 和免疫细胞会导致终末器官损伤。
在中低剂量下,酒精已被证明可以改善自身免疫性疾病的风险和进展。
低剂量酒精可能通过增加Akkermansia muciniphila对炎症产生积极影响和其他保护性肠道微生物,并有助于增加乙酸盐、多不饱和脂肪酸 (PUFA)、高密度脂蛋白 (HDL) 和一氧化氮 (NO)。
接下来展开讨论低-中剂量酒精对自身免疫性疾病的保护作用,以及高剂量酒精带来的健康危害,包括免疫系统、肠道菌群及其代谢产物、营养物质等多方面。
酒精可能对自身免疫性炎症产生有益影响的一个重要方式是通过其对肠道中脂肪酸代谢的影响。
众所周知,高剂量酒精会导致脂肪酸失调和发展为脂肪肝疾病,而在低剂量时,酒精可能有助于产生肠道衍生的抗炎脂肪酸,例如短链脂肪酸(SCFAs) 和多不饱和脂肪酸 (PUFAs)。
短链脂肪酸
低度至中度饮酒可以通过两种方式调节短链脂肪酸的产生:
1、通过改变肠道中产短链脂肪酸菌
低度至中度酒精会改变肠道中产生短链脂肪酸的微生物群,例如Akkermansia muciniphila。
短期饮酒(5 天 0.8 g/kg 胃内)会升高小鼠的Akkermansia muciniphila水平,而在消耗同等酒精强度的发酵米酒 (FRL) 的组中未观察到升高。
2、通过乙酸盐产生
酒精本身会代谢成短链脂肪酸、乙酸盐,并且喂食 Lieber-DeCarli 饮食 8 周的动物与对照组相比显示乙酸水平升高。
Lieber-DeCarli 饮食
Lieber-DeCarli 饮食是一种常用于动物实验中的饮食方案。它是由两位科学家 Lieber 和 DeCarli 在 1980 年代开发的,旨在为动物提供一种高度可控的饮食,也就是说可以根据实验需要增加或减少某种营养素的含量,以便研究不同营养素对健康和疾病的影响。
Lieber-DeCarli 饮食的特点是含有高浓度的葡萄糖和脂肪,而蛋白质含量相对较低。这种饮食的能量密度非常高,因此可以使动物快速增重。
Lieber-DeCarli 饮食在动物实验中应用广泛,特别是在研究肝脏疾病、肿瘤、代谢疾病等方面。由于该饮食的成分非常可控,可以帮助研究人员更准确地评估不同营养素对健康的影响,因此被广泛应用于基础医学和临床研究中。
需要注意的是,Lieber-DeCarli 饮食虽然在动物实验中应用广泛,但并不适合人类长期食用。这是因为该饮食的成分并不符合人类的膳食建议,长期食用可能会导致营养不良和健康问题。
多不饱和脂肪酸
低度至中度酒精保护自身免疫性疾病的另一个潜在机制,可能依赖于酒精在必需多不饱和脂肪酸代谢中的重要作用,如二十二碳六烯酸 (DHA) 和二十碳五烯酸 (EPA)。这些多不饱和脂肪酸(PUFA)可以减少活性氧的形成并充当抗炎分子。
低至中等剂量的酒精已被证明会增加多不饱和脂肪酸的产生,而在高剂量酒精下,由于脂肪酸分解代谢增加,多不饱和脂肪酸浓度会降低。
值得注意的是,多不饱和脂肪酸和多不饱和脂肪酸衍生物,如分解素、脂氧素和与自身免疫性疾病的缓解有关。
此外,多项研究还表明,多不饱和脂肪酸的增加具有心脏保护作用。由于心血管健康正在成为自身免疫性疾病结果的一个重要因素,这可能是另一种由低度至中度酒精介导的保护机制。
鉴于促炎特性,饮酒可能会导致自身免疫性疾病的风险增加或恶化。事实上,在某些炎症性疾病中,例如肠易激综合征 (IBS) 和常年性过敏,大量饮酒与疾病发作之间存在直接相关性。然而,适度饮酒似乎可以降低疾病风险、严重程度和进展。
这里介绍几种酒精相关的自身免疫性疾病,包括自身免疫性糖尿病、自身免疫性甲状腺疾病、系统性红斑狼疮、类风湿关节炎、多发性硬化症等,适度饮酒可降低其风险。
自身免疫性糖尿病
适度饮酒的有益作用已在成人非自身免疫性2 型糖尿病和自身免疫性 1 型糖尿病 (LADA) 中得到证实。
每天摄入 2–7 g 的患者风险降低了 60%
在一项自身免疫性 1 型糖尿病研究中,与每天摄入 0.01–2 g 的患者相比,每天摄入 2–7 g 的患者风险降低了 60%。这项研究还指出,与饮酒者相比,戒酒者的抗谷氨酸脱羧酶抗体 (GAD Ab) 水平更高,C 肽水平更低,对男性的影响更为明显。
注:抗谷氨酸脱羧酶抗体 (GAD-Ab) 在1型糖尿病发病前期和发病时多为阳性,而在正常人群及2型糖尿病患者中多为阴性。
葡萄酒的效果显著,可能与葡萄酒中的多酚类抗氧化物质相关
在另一项自身免疫性 1 型糖尿病研究中,发现摄入量超过 25 克/天的男性和女性的风险降低了 46%。这种效果似乎在抗 GAD 抗体水平低的患者中最强,并且与啤酒或白酒消费者相比仅限于葡萄酒饮用者。作者推测,抗 GAD 抗体水平较低的患者可能与 2 型糖尿病患者最相似,可能是葡萄酒中的多酚和羟基二苯乙烯类物质促进了酒精在自身免疫中的抗氧化或抗炎作用。
自身免疫性甲状腺疾病
与糖尿病类似,适度饮酒已被证明对自身免疫性甲状腺功能减退症和甲状腺功能亢进症均有保护作用。
例如,与对照组相比,适度饮酒与甲状腺功能减退症和格雷夫氏病的风险降低呈剂量依赖关系,无论性别或饮酒类型如何。
几项研究还发现,适度饮酒 >10 单位/周或每天至少饮酒 35 克,与自身免疫性甲状腺疾病和甲状腺过氧化物酶抗体阳性的发生概率较低有关。
系统性红斑狼疮(SLE)
多个病例对照、队列和横断面研究已经确定适度饮酒与系统性红斑狼疮风险之间存在显著的剂量依赖性关联。
在一项荟萃分析中,适度饮酒的保护作用与系统性红斑狼疮的持续时间有关,与治疗少于 5 年的患者相比,治疗少于 10 年的患者具有显著性。
另一项研究得出结论,适度饮酒可能会降低 ANA 阳性患者进展为系统性红斑狼疮的概率。
注:系统性红斑狼疮(SLE)是临床上最为常见的自身免疫性疾病之一。SLE的实验室检查包括多种项目,抗核抗体(ANA)是其中较为经常检测的项目之一。ANA阳性尤其是ANA核型为核均质性的结果往往与SLE具有较高的相关性,故临床上往往以此结果联合其他检查并结合患者症状作为诊断SLE的依据。
类风湿关节炎
与甲状腺疾病、糖尿病和系统性红斑狼疮类似,多项流行病学研究和几项机制研究支持轻度至中度酒精以 J 型或 U型剂量依赖方式在类风湿关节炎中发挥保护作用。
适度饮酒女性:较低的风险,较高的生活质量
在一项荟萃分析研究中,男性和女性的类风湿关节炎风险在10年内均有所降低,其中女性的风险降低幅度最大。
在其他研究中,与男性相比,适度饮酒的女性报告了较低的疾病活动和较高的生活质量。
然而,也有文献记载:酒精可能会阻止男性的放射学进展,并增加女性的放射学进展。与不饮酒的患者相比,中度饮酒的类风湿关节炎患者的改良健康评估问卷得分(提示功能状态改善)也显著降低。这种影响在HLA-DRB1共享表位阳性的患者中更强。
因此,类风湿关节炎患者的酒精、性别和基因构成之间可能存在有益但复杂的关系。
在类风湿关节炎中,适度饮酒与CRP 水平、IL-6水平的关联
在类风湿关节炎(RA)中,已注意到 CRP 水平呈 J 型关联:每周饮用 1-7 杯酒的患者 CRP 水平最低。
51 名适度饮酒的类风湿关节炎患者在症状出现前与 IL-6 水平呈 U 型关联,饮酒与可溶性肿瘤坏死因子受体 2 (TNFR2) 水平呈负相关。
适度饮酒:ACPA阳性患者类风湿关节炎风险降低
由于酒精会导致肝损伤,一项评估饮酒与肝脏炎症之间关系的研究报告称,每周饮酒量大于 21 单位与转氨酶相关,而每周饮酒量小于 14 单位则没有。适度饮酒还与抗瓜氨酸化蛋白抗体 (ACPA) 阳性患者的类风湿关节炎风险降低 50% 相关,并且与 ACPA 阴性类风湿关节炎患者的疾病风险降低 30% 呈反比剂量反应关系。
在类风湿关节炎小鼠模型中也注意到酒精对免疫系统的剂量依赖性影响。
适度饮酒:胶原性关节炎发病率下降
在胶原性关节炎 (CIA) 模型中,与非酒精对照组相比,适度饮酒的小鼠的 CIA 发病率降低了 40%,放射疾病严重程度降低了 50% 以上。
饮酒小鼠的 IL-21 和 IL-17A、中性粒细胞、单核细胞、浆 B 细胞和 IgG 水平也较低。酒精和乙酸盐都会影响体外和体内T 滤泡辅助 (TFH ) 细胞的功能状态,从而抑制 IL-21 的分泌。
这些发现很有趣,因为 TFH细胞通常存在于类风湿关节炎患者的滑膜关节中,也是肠道免疫的重要介质,表明肠道免疫过程与类风湿关节炎之间可能存在联系。
在另一项 CIA 研究中,适度饮酒(10% 乙醇水溶液)通过增加内源性睾酮、抑制核因子 B 活化和下调白细胞迁移来延缓 CIA 的发作并改善其进展。
多发性硬化症(MS)
同样,在多发性硬化症中,也有证据表明,适度饮酒在降低疾病风险和/或疾病进展方面具有保护作用。几项大型人口研究表明:
酒精与男女多发性硬化症风险之间存在剂量依赖性负相关
适度饮用红酒似乎与较低的扩展残疾状态量表评分相关,这表明功能有所改善,尽管适度饮酒的患者在脑部 MRI 上表现出 T2 病变体积增加。
相反,大量饮酒可能会增加患多发性硬化症的风险,尤其是男性。
也有研究认为剂量和多发性硬化症风险之间没有关联,性别可能是一个变量
一些研究指出,不同剂量的酒精与患多发性硬化症的风险之间没有关联。在这些研究中,性别可能是一个变量,可以解释酒精对多发性硬化症的影响。
例如,在一项女性护士健康研究(NHS)I和II中,不同类型的酒精与多发性麻痹症的风险没有关联。尽管这是一项针对英国国家医疗服务体系两项研究中超过90000名女性的大型研究,但258例多发性硬化症患者的队列相对较小,与男性相比,女性可能没有经历到酒精的保护作用。
例如,在多发性硬化症的动物模型,即实验性自身免疫性脑脊髓炎(EAE)中,最近的研究表明,主要是雄性小鼠在适度饮酒后疾病评分有所改善。
以上是低-中剂量酒精带来的健康益处,“凡事皆有度,过犹不及”。接下来章节来看过量饮酒可能带来哪些不利影响。
酒精与消化系统密不可分。它通过肠道吸收,并在肝脏内被肝细胞代谢。过量饮酒会导致肠道微生物组和肠道上皮完整性发生改变。它会导致重要的微量营养素缺乏症,包括短链脂肪酸和微量元素,这些元素会影响免疫功能并导致肝损伤。在某些人中,长期酗酒会导致肝病从脂肪肝发展为肝硬化和肝细胞癌。
持续酗酒会改变肠腔pH 值,促进病原体过度生长,并且还与肠道微生物群功能的改变有关,因为它会改变与肠屏障功能障碍有关的特定代谢物分泌物。酒精使用障碍患者通常表现出血浆细胞因子水平升高,例如 TNF-α、IL-10 和 CRP,这表明慢性、低度、全身性炎症。
几项研究调查了饮酒对动物和人体模型的影响,并一致表明过量饮酒与肠道微生态失调的发展有关。
简而言之,酒精已被证明可以增加变形杆菌、肠杆菌和链球菌的相对丰度,并降低拟杆菌、阿克曼氏菌和粪杆菌的丰度。其他还包括抗炎细菌(如Faecalibacterium prausnitzii和双歧杆菌等)水平下降。
在人类酒精使用障碍 (AUD) 研究中,生态失调的特征是:
扩展阅读:
肠道细菌四大“门派”——拟杆菌门,厚壁菌门,变形菌门,放线菌门
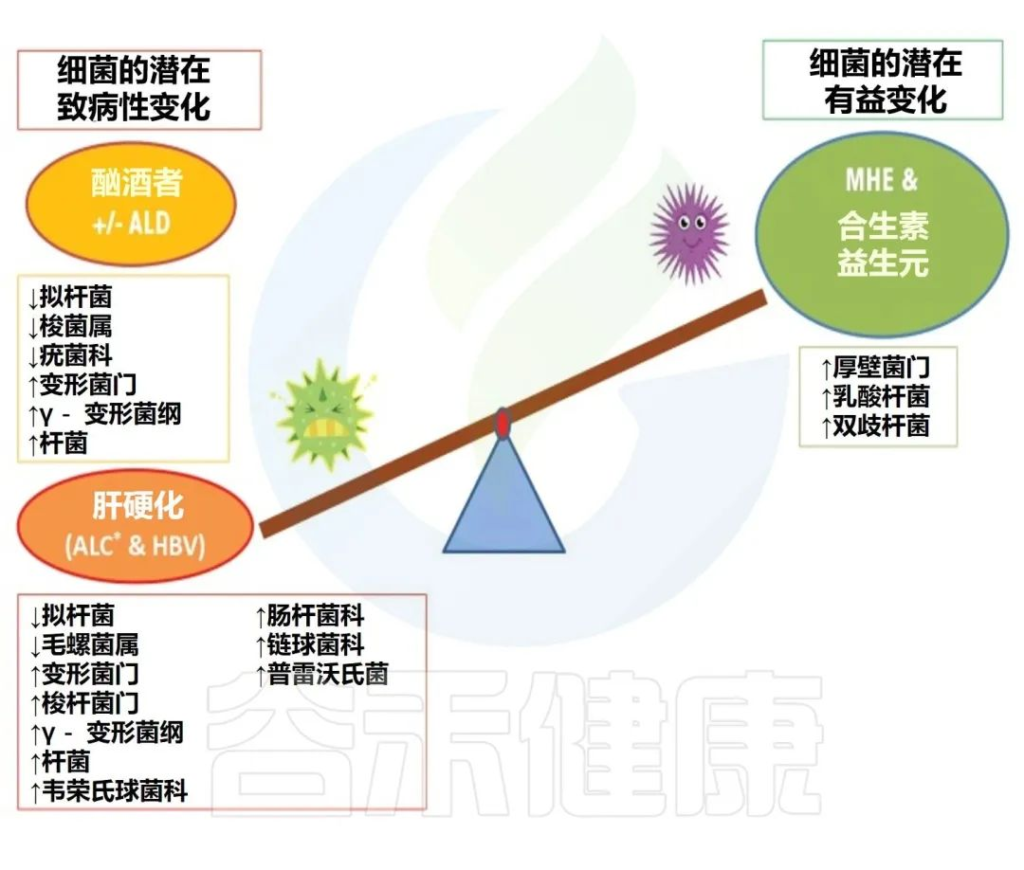
然而,并非所有研究都注意到厚壁菌门对高剂量酒精的反应有所减少。例如,在猕猴中自愿自我给予慢性高剂量酒精会导致拟杆菌减少、厚壁菌门升高,并且在饮酒期间完全没有Akkermansia muciniphila,而戒酒则恢复了基线细菌种类。
肠道微生物群稳态的破坏与这些疾病有关
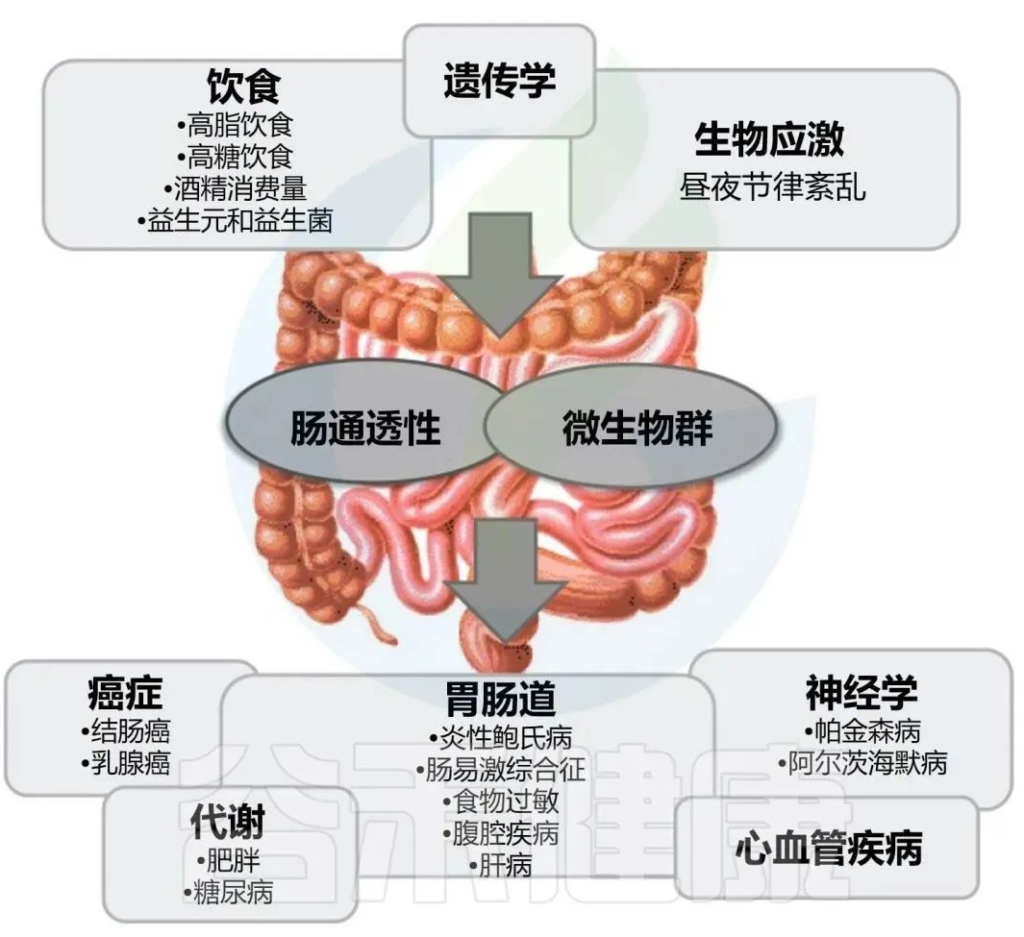
Engen PA et al., Alcohol Res. 2015;37(2):223-36.
此外,生态失调可能是由西方社会常见的环境因素引起的,包括饮食、遗传、昼夜节律紊乱和酒精饮料消费。
在酒精成瘾者中,饮酒会破坏肠道屏障功能,也称为肠漏症。肠道屏障由肠细胞、杯状细胞和影响粘液层内肠道微生物组的抗菌物质以及固有层中的众多免疫细胞组成。
酒精引起的生态失调通过其对肠道完整性的病理影响促进急性(例如,酒精性肝炎)和慢性(例如,酒精相关性肝硬化)肝病的发展。
肠粘液屏障在肠道的免疫功能中起着至关重要的作用,它的破坏会导致这些疾病状态。在这个屏障中,相邻的肠细胞被顶端“紧密连接”蛋白 claudins、occludin 和 zona occludens 结合在一起,防止病原体相关分子颗粒 (PAMP) 和细菌内毒素等管腔内容物意外转移到门脉循环中。
饮酒引起的生态失调与这些紧密连接的破坏有关。因此,随后的免疫功能障碍和循环促炎细胞因子(如肿瘤坏死因子 (TNF)-α 和IL-1β)的增加进一步破坏了肠道屏障。
扩展阅读:什么是肠漏综合征,它如何影响健康?
酒精相关的微生态失调不可避免地会影响肠道代谢,包括短链脂肪酸 (SCFA)、氨基酸和胆汁酸的显著变化。
短链脂肪酸
短链脂肪酸在维持紧密连接方面的作用越来越明显。短链脂肪酸是肠道菌群对难消化膳食纤维进行厌氧发酵的产物。
对酒精使用障碍患者的粪便代谢组分析显示,短链脂肪酸减少,这可能部分是由于生态失调对粪杆菌等产短链脂肪酸菌产生负面影响。一些小鼠模型表明,以高纤维饮食、益生菌或饮食调整形式补充短链脂肪酸,可增强肠道上皮完整性,并减少酒精模型中的肝损伤。
氨基酸
从饮食中获得的必需氨基酸(例如赖氨酸)和非必需氨基酸(例如谷氨酸)都会受到酒精影响。据推测,这是由于生态失调导致微生物-宿主共同代谢紊乱的结果。
虽然管腔氨基酸浓度会随着饮酒而下降,但一些氨基酸(如酪氨酸和苯丙氨酸)的血清水平会升高,这表明失调微生物组的代谢和吸收特征发生了改变。这种代谢失衡可能在活性氧 (ROS) 和有毒中间体水平升高的过程中发挥作用。
胆汁酸
胆汁酸已被证明在人类和大鼠饮酒后的血清和管腔内容物中都会发生变化。初级(由肝脏合成)和次级(来自细菌代谢)胆汁酸主要在小肠中发挥多种功能,并通过其类固醇结构在脂质吸收、胆固醇稳态以及激素作用中发挥关键作用。
在健康的肠肝循环中,初级胆汁酸与牛磺酸或甘氨酸结合形成分泌到肠腔中的胆汁盐。然后肠道微生物群将这些代谢为次级胆汁酸,在将它们循环回肝脏之前去除牛磺酸/甘氨酸基团。饮酒通过增加次级胆汁酸的比例和胆汁酸的总浓度,以及增加与甘氨酸而非牛磺酸结合的比例来破坏这一点。
这是由于生态失调降低了牛磺酸的生物利用度和肠肝循环率增加所致。这种破坏的后果尚不完全清楚;然而,在饮酒过程中更普遍的甘氨酸结合酸可能毒性相对更大,尽管管腔浓度高但胆汁酸的合成增加导致肝脂肪变性。
长期饮酒会减少营养吸收并导致营养不良。肠道通透性、胆汁酸概况和微生物组的改变都促成了这一点,此外,酒精代谢过程中释放的有毒代谢物和 ROS 会对肠道造成结构损伤。
特别是,长期饮酒已被证明会导致细胞死亡、粘膜侵蚀和绒毛尖端上皮细胞丢失。其后果是维生素 A、B1(硫胺素)、B2(核黄素)、B6(吡哆醇)、C、D、E 和 K 以及叶酸、钙、镁、磷酸盐、铁和微量元素锌和硒的不同程度的缺乏。
扩展阅读:如何解读肠道菌群检测报告中的维生素指标?
所有患有慢性酒精使用障碍的患者都要接受全面的营养评估,因为这些缺乏症因人而异,例如铁可能缺乏或过量。
除了上述机制外,重度饮酒者每天从营养不良的酒精饮料中获取高达 50% 的热量摄入 。此外,应该注意的是,除了慢性酒精滥用的症状影响(例如,呕吐、厌食和腹痛)之外,该群体中的社会因素(例如贫困和获得营养“完整”的饮食)也可能导致营养不良。
微生物组从高剂量酒精喂养的小鼠,转移到未接触酒精的无菌小鼠,已被证明会在受体小鼠中诱发肠道炎症。
酒精通过影响肠粘膜免疫诱发炎症
肠道炎症是由免疫系统对酒精及其代谢物产生的炎症反应引起的。酒精通过多种机制影响肠粘膜免疫。特别是,它可能首先降低粘膜中的先天免疫反应,导致对肠道病原体的易感性增加。
随后,正如在细胞培养研究中发现的那样,酒精可能会触发免疫系统反应和促进炎症反应的分子上调,包括释放炎症免疫细胞,例如白细胞和肥大细胞。
研究还表明,酒精可以直接调节先天免疫和适应性免疫,进一步促进肠道和肠道源性炎症。例如,一项针对小鼠的研究发现酒精会抑制肠道清除有害细菌的免疫反应,而其他研究发现酒精会抑制肠道粘膜免疫细胞的活性。
酒精通过引起肠道菌群失调诱发炎症
酒精相关的细菌过度生长和生态失调可能导致肠道内毒素产生增加,内毒素可与肠粘膜上的细胞结合,引起局部炎症,并易位至肠外部位,引起全身炎症。
微生物群失调可导致肠道通透性受损,并通过肠道细菌内毒素、LPS 的系统易位、免疫细胞上 TLR 和NF-kB 的激活以及炎症 iNOS 的诱导促进炎症。
酒精通过肝毒性诱发炎症
肝毒性会干扰肝脏解毒物质的能力,从而导致酒精的有毒代谢物乙醛在全身蓄积。此外,LPS 介导的肝脏驻留巨噬细胞 Kupffer 细胞的激活进一步促进了促炎细胞因子的释放和全身炎症的传播。
其他研究发现酒精影响粘膜免疫的多种方式,包括:
酒精对先天免疫系统和适应性免疫系统的影响具有剂量依赖性。
酒精对小胶质细胞(中枢神经系统的先天免疫细胞)具有显著的剂量依赖性影响
在急性酒精滥用的小鼠模型中:
酒精还以剂量依赖的方式调节适应性免疫系统
长期适度饮酒会导致 T 细胞和 B 细胞活化和增殖,而长期大量饮酒则与 T 细胞和 B 细胞耗竭和凋亡以及免疫球蛋白增加有关。
此外,长期酗酒会改变 T 细胞表型,导致幼稚 T 淋巴细胞百分比下降和记忆 T 细胞百分比升高。相反,适度饮酒与滤泡辅助性 T (T FH )细胞的调节有关。
细胞因子和炎症标志物也以剂量依赖的方式受到酒精的影响。例如,C 反应蛋白 (CRP) 和白细胞介素 6 (IL-6) 在人类重度饮酒者中升高,但与不饮酒者相比,在适度饮酒者中相对降低。
CRP 效应也可能是性别二态的,一些研究表明酒精引起的 CRP 降低是女性特有的,也有其他研究表明适度饮酒会以 U 形模式降低 CRP,而与性别无关。
以上是高剂量酒精对肠道屏障、肠道菌群及其代谢产物、营养状况、免疫系统等方面的影响。接下来章节我们具体来了解一下酒精相关疾病,包括肝病、胃肠道疾病、营养不良、肥胖、心血管疾病等。
►►►
酒精代谢
肝肠微生物轴在营养吸收和肝毒性中起着重要作用,其中肝脏是营养物质、毒素和肠道血液供应的细菌代谢产物的第一道过滤器。
酒精性肝病 (ALD) 是一种由过量饮酒引起的疾病,是全球医疗保健的负担。酒精性肝病涵盖范围广泛的肝损伤,包括无症状脂肪变性、酒精性脂肪性肝炎 (ASH)、纤维化、肝硬化和肝细胞癌 (HCC)。
酗酒患者发展为酒精性肝病的易感性是高度可变的,并且其向更晚期的进展受若干因素(即酒精滥用的量和持续时间)的强烈影响。
其中,肠道微生物群及其代谢物最近被确定为酒精性肝病病理生理学中最重要的。
酒精滥用会引发肠道菌群分类组成、粘膜炎症和肠道屏障紊乱的定性和定量改变。肠道通透性过高导致活致病菌、革兰氏阴性微生物产物和促炎性内腔代谢物转移到血液中,进一步证实了酒精引起的肝损伤。
酒精在肝脏中的代谢
酒精在肝脏中的代谢是了解其在酒精相关肝病发病机制中的作用的关键。酒精在肝细胞中主要通过乙醇脱氢酶代谢为乙醛,然后通过乙醛脱氢酶代谢为乙酸。
乙醛是一种高反应性蛋白质,会导致肝损伤。它与脂质、蛋白质和 DNA 结合形成潜在的免疫原性加合物。这些加合物可产生适应性免疫反应,导致肝细胞损伤和炎症。
线粒体结构改变可导致功能障碍,包括 ATP 生成减少、ROS 生成和乙醛脱氢酶活性降低。乙醛也是肝纤维化进程中的关键代谢物。它可以促进肝星状细胞 (hepatic stellate cells, HSCs) 中胶原 I 的合成,乙醛加合物刺激炎性细胞因子和趋化因子的释放。
乙醇脱氢酶途径可有效代谢少量酒精,但在长期接触酒精时,该途径会变得饱和,并且会显著诱导 CYP2E1。向 CYP 途径的转变导致 ROS 的产生,从而导致氧化应激。
ROS 与蛋白质结合,改变它们的结构和功能特性,并可能充当新抗原。ROS 还可以直接与 DNA 结合,造成损伤,或导致脂质过氧化产物,如 4-羟基壬烯醛 (4-HNE) 和丙二醛 (MDA),从而产生高度致癌的 DNA 加合物。
此外,在慢性重度酒精摄入中,由于乙醛介导的谷胱甘肽减少,肝脏的抗氧化清除系统受损。氧化应激的结果是诱导肝细胞凋亡和坏死。
酒精性肝损伤
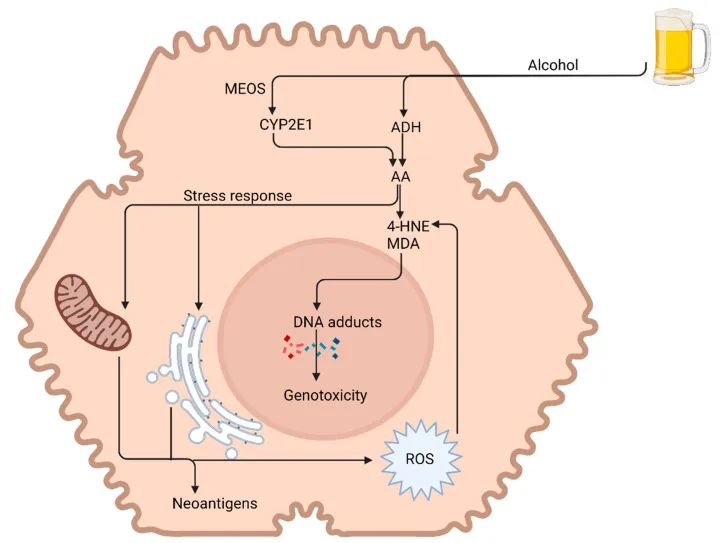
编辑
图源:biorender
乙醛 (AA) 是造成酒精对肝脏的大部分毒性作用的原因。乙醛极度亲脂,导致形成乙醛加合物——丙二醛 (MDA) 和 4-羟基壬烯醛 (4-HNE)。这与活性氧 (ROS) 一起导致 DNA 损伤和遗传毒性。
乙醛还会诱导各种细胞器(例如线粒体和内质网)的功能和结构改变。
MEOS:线粒体酶氧化系统;ADH:乙醇脱氢酶。
酒精相关性脂肪变性
脂肪变性的特征是肝细胞中脂肪(甘油三酯、磷脂和胆固醇酯)的积累,是肝脏对长期饮酒的最早反应,几乎普遍存在于慢性重度饮酒者中。
虽然它在减少饮酒后是完全可逆的,但它的存在与酒精相关肝病的进展有关,最近的一项荟萃分析发现肝硬化的年进展率为 3%。 肝脂肪变性可能通过更大的脂质过氧化和氧化应激增加肝脏炎症(脂肪性肝炎)、纤维化和肝硬化的风险。
然而,进展不仅受饮酒量的影响,还受其他因素的影响,包括性别、共存的肝病、吸烟和遗传。
慢性酒精摄入通过增加肝脂肪生成和减少肝脂肪分解导致肝脂肪变性
酒精通过多种机制诱导肝脂肪变性
图源:biorender
↑:增加;↓:减少;HSC:肝星状细胞。
酒精性脂肪性肝炎
肝脏炎症强烈影响纤维化、肝硬化和最终肝细胞癌的发展
酒精引起的肠漏症导致病原体相关分子模式(PAMP) 输送到肝脏。PAMP 与受损细胞释放的损伤相关分子模式一起激活单核细胞、巨噬细胞、枯否细胞和肝实质细胞上的先天受体【Toll 样受体 (TLR) 和 NOD 样受体 (NLR)】。
通过这些受体发出的信号导致包括 NF-κB 在内的促炎转录因子的转录增加以及促炎趋化因子和细胞因子的产生。
净效应是单核细胞、中性粒细胞和 T 细胞的流入,导致细胞死亡和肝星状细胞 (HSC) 激活的可溶性介质的释放。
除了对酒精激活的促炎性免疫反应外,酒精性肝炎患者还有免疫功能障碍的证据。肠道来源的 PAMP 对单核细胞的激活导致 T 细胞耗竭,同时产生抗炎 IL-10 的 T 细胞数量减少,单核细胞和中性粒细胞功能受损 。
酒精引起的炎症
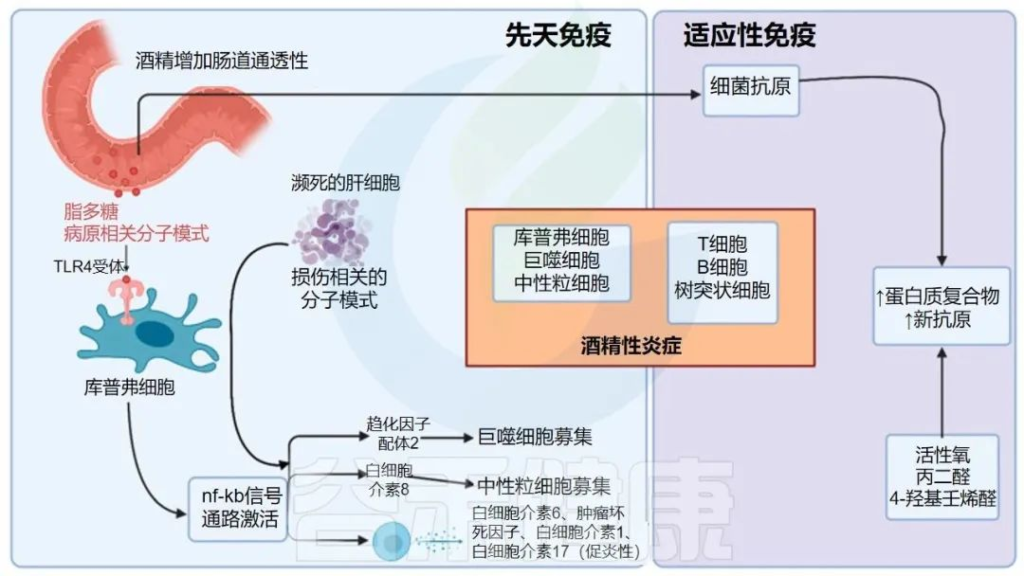
酒精对先天免疫和适应性免疫均有影响。酒精不仅会诱发肠道菌群失调,还会增加肠道通透性。病原体相关分子模式 (PAMP) 如脂多糖与 Kupffer 细胞上的 TLR4 受体相互作用,并通过 NF-κB 途径产生促炎细胞因子和趋化因子,导致肝脏炎症。
乙醛诱导各种蛋白质的结构变化并产生新抗原,从而引发适应性免疫反应并导致肝脏炎症。
CCL2:CC基序趋化因子配体2;DAMPs:损伤相关分子模式;4-HNE:4-羟基壬烯醛;IL:白细胞介素;MDA:丙二醛;NF-κB:核因子 kappa B;ROS:活性氧;TLR4:toll 样受体 4;TNFα:肿瘤坏死因子α;↑: 增加; ↓:减少。
肝细胞死亡通过多种机制发生
包括细胞凋亡、细胞焦亡、坏死和坏死性凋亡。
细胞凋亡是由直接酒精介导的肝毒性、氧化应激的诱导、存活基因 ( C-met ) 的抑制和促细胞凋亡信号分子(TNF-α 和 Fas 配体)的诱导引起的。
坏死、细胞肿胀和膜破裂也可以通过称为坏死性凋亡的程序化途径发生。
而细胞焦亡是一种依赖于 caspase-1 的程序性细胞死亡。
细胞死亡的模式可能受疾病状态的影响,早期酒精相关肝病中细胞凋亡占主导地位,但酒精性肝炎中炎性体激活驱动细胞焦亡和肝损伤扩散。
长期饮酒通过多种机制影响肝脏
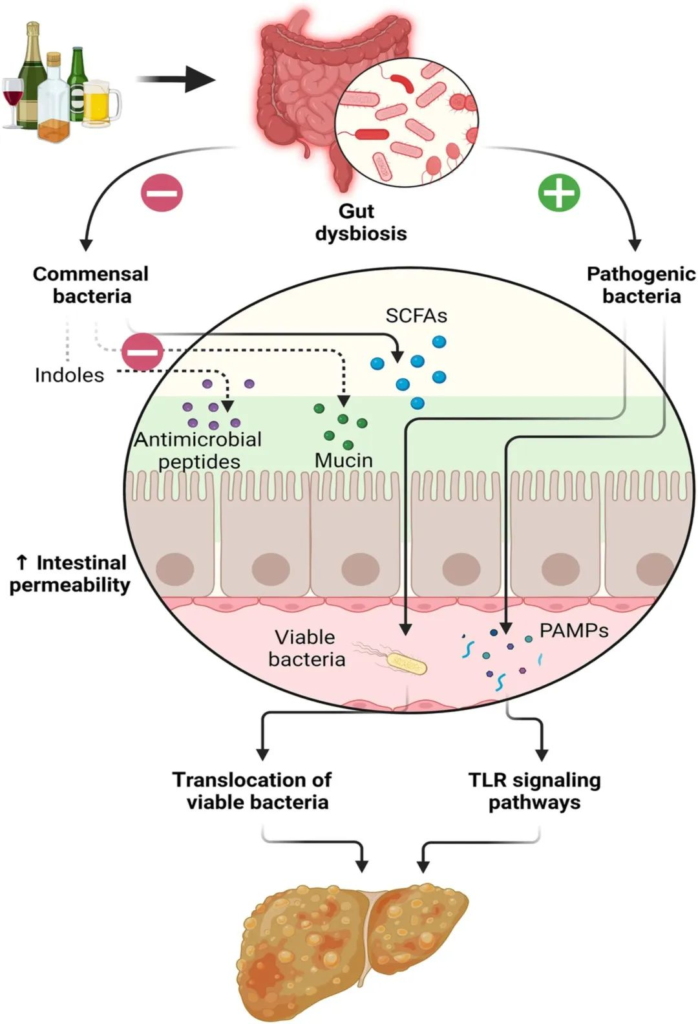
doi.org/10.1111/jgh.16199
长期饮酒会导致肠道生态失调,从而导致肠道通透性增加、肠道细菌易位和病原体相关分子模式 (PAMP),并通过 Toll 样受体 (TLR) 信号通路增加肝脏炎症和纤维化。
为什么有些人不喝酒也有可能得脂肪肝?
脂肪肝的发生与多种因素有关,包括肥胖、高血压、高血脂、糖尿病等,也与外源性酒精和内源性酒精相关。这些因素会影响肝脏的代谢功能,导致脂肪在肝脏内积累,从而引起脂肪肝。
我们一般认为的酒精摄入是指外源性酒精,是通过饮酒等途径摄入的酒精。而内源性酒精则是由人体自身产生的一种酒精,主要产生于肠道中的细菌代谢过程中。这两种酒精对人体的影响有所不同。
内源性酒精对人体的影响相对较小,因为它的产生量较少。但是,如果肠道细菌失衡,导致内源性酒精产生过多,就可能会对人体健康产生负面影响,如肝脏疾病、代谢紊乱等。
酒精引起的纤维化和肝硬化
纤维化是肝脏对破坏性刺激的伤口愈合反应,在去除刺激后可逆。在长期大量饮酒的情况下,会发生慢性炎症和纤维化,导致宽频带纤维组织沉积,扭曲肝脏结构并改变肝脏血流,导致门脉高压及其相关并发症。
当肝纤维化发展到扭曲肝脏结构并形成结节时,患者会发展为肝硬化。
活化的星形细胞 (HSC) 引起的细胞外基质沉积是肝纤维化发生和发展的关键事件。其他细胞(门静脉成纤维细胞和肌成纤维细胞)的贡献较小。HSC 被炎性细胞因子和直接被酒精及其代谢物和 ROS 激活。活化的 HSC 通过分泌趋化因子和表达粘附分子来吸引和刺激循环免疫细胞,从而使炎症反应持续存在,进而激活静止的 HSC。
肝癌
肝硬化是一种癌前状态,会增加原发性肝癌的风险,最常见的是肝细胞癌(HCC)。在全球范围内,大约 30% 的肝细胞癌是由酒精引起的。
酒精本身是一种致癌物,在肝细胞癌的背景下,通过 ROS 诱导的损伤、炎症机制及其反应性代谢物乙醛,酒精在其发展中起着特定的作用。
在大量饮酒者中,CYP 通路活性增加会产生 ROS,导致 DNA 损伤,导致细胞周期停滞和细胞凋亡并破坏基因功能,从而增加癌发生。
酒精相关性肝病患者炎症通路的激活与癌症风险增加相关
尽管机制尚未完全阐明,但可能涉及促炎细胞因子促进 ROS 积累(关于ROS平衡与健康我们准备专门搞一个主题讲下)。细胞因子的产生也与血管生成和转移发展的上调有关。此外,酒精会抑制 CD8+ T 细胞的抗肿瘤反应。
乙醛具有高反应性,并与 DNA 和蛋白质形成加合物,导致线粒体损伤和 DNA 修复机制的破坏。在具有遗传变异的人群中发现的乙醛水平升高会导致酒精脱氢酶和乙醛脱氢酶的活性改变,这与重度饮酒者患肝细胞癌的风险较高有关。
扩展阅读:深度解析 | 肠道菌群与慢性肝病,肝癌
►►►
胃肠道 (GI) 是与摄入体内任何物质的第一道接触线,特别容易受到毒素的损害。越来越多的研究表明,胃肠道健康状况不佳对身体的整体健康起着重要作用。任何可能导致胃肠道损伤的事情,其后果可能远远超出肠道。事实上,研究人员已经开始发现酒精,特别是如果长期大量饮酒,会引发肠道内启动的过程,从而促进全身炎症。
酒精使用障碍患者肠道通透性增加
对人类的研究表明,一部分酒精使用障碍 (AUD) 患者的肠道通透性实际上有所增加,这是使用称为 Cr-EDTA 的方法测量的,该方法检查口服铬的排泄。此外,那些患有酒精使用障碍且通透性增加的人更容易患肝病,表明肠道通透性可能是某些酒精使用障碍患者器官损伤的介质。
另一项研究表明,患有酒精使用障碍的人不仅肠道通透性增加,而且增加到足以让大分子通过肠道屏障。内毒素 – 也称为脂多糖 (LPS),是大分子,同一项研究发现血浆内毒素水平随着肠道通透性的增加而增加。
酒精是如何诱导肠道通透性的呢?
简短的回答是通过破坏上皮细胞本身(跨上皮通透性)和破坏上皮细胞之间的空间(细胞旁通透性),它由紧密连接、细胞骨架和一些相关蛋白组成。
跨上皮渗透性是由直接细胞损伤引起的。例如:
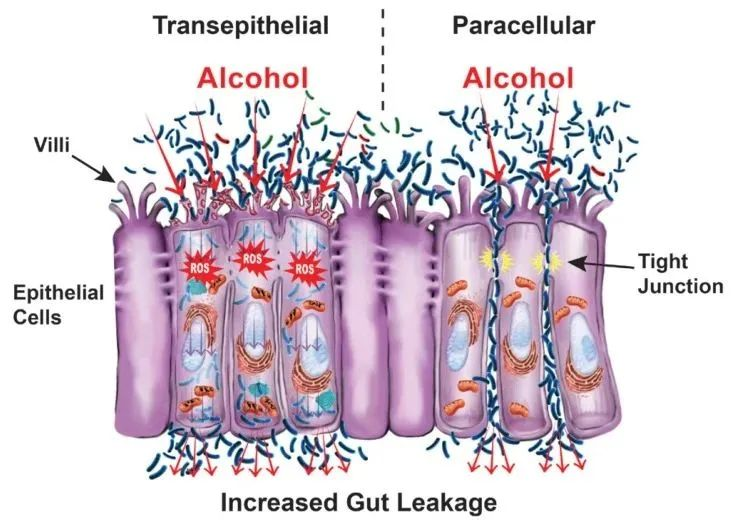
肠道屏障调节肠道内部(食物和饮料流经的地方)和肠道内部上皮细胞层另一侧的细胞和血管之间的物质通道,包括微生物产物。
破坏肠道屏障有两种方式:
肠道屏障通透性增加,使细菌及其产生的毒素离开肠道,并通过血液渗入其他器官。
酒精及代谢物如何通过触发以上两种机制?
— 酒精及其代谢物通过直接破坏细胞和通过活性氧 (ROS) 引起的氧化应激等多种机制削弱细胞膜来触发跨上皮机制。
酒精会导致细胞死亡,从而导致肠道发生变化,包括粘膜溃疡、糜烂和主要位于绒毛尖端的上皮细胞丢失;乙醛形成导致直接细胞损伤的 DNA 加合物;和酒精代谢过程中释放的活性氧 (ROS) 通过氧化应激导致直接细胞损伤。
— 酒精的代谢物通过破坏产生连接细胞和稳定细胞骨架的蛋白质的紧密连接的蛋白质,来触发细胞旁路机制。
酒精及其代谢物通过作用于将两个相邻细胞融合在一起的紧密连接复合物而引起细胞旁通透性。例如,乙醛通过重新分配蛋白质来破坏紧密连接的稳定性;酒精及其代谢物改变紧密连接蛋白的表达;和酒精的非氧化代谢物导致紧密连接再分布,破坏其屏障功能。
此外,研究表明酒精会破坏细胞的细胞骨架,即赋予它们结构的细胞边界。还有越来越多的证据表明,酒精会导致 microRNA (miRNA) 的过度表达,这些小片段的非编码 RNA 会沉默基因表达。具体而言,酒精会导致 miRNA 过度表达,从而影响与肠道屏障完整性相关的基因。
酒精和胃肠道癌症
长期饮酒会增加患主要胃肠道癌症的风险,包括食道癌、胃癌和结肠癌(结直肠癌)。这种风险通常随着饮酒量的增加以及与其他生活方式相关因素(如吸烟或代谢综合征)的增加而增加。虽然酒精最初被认为是一种直接致癌物,但研究表明酒精引起的肠道炎症可能是罪魁祸首。
代谢综合征和肥胖中出现的全身性炎症会增加多种上皮癌的风险,包括胃肠道癌,这表明酒精引起的肠道炎症造成的全身性炎症状态,也可能导致酒精引起的胃肠道和其他器官癌症发生。这个过程像滚雪球,因为随着细胞转变为癌变状态,ADH 活性会增加,而 ALDH 活性可能会降低 。
这导致氧化速率增加和清除酒精代谢物的能力降低,这反过来又可以通过对 DNA、氧化应激和肠道炎症的直接影响进一步促进癌变。
►►►
营养不良
酒精的能量价值及其对营养状况的影响
酒精是唯一提供能量 (7.1 kcal/g) 的精神药物。然而,它的卡路里被认为是“空的”,因为酒精摄入不能提供维生素和矿物质,并且它的过量摄入会导致营养状况的改变。
由于酒精的高能量值,人们普遍认为,过量饮酒会增加体重和肥胖的风险。尽管酒精密度高,但与不饮酒者相比,饮酒者的体重似乎并未增加。
当酒精摄入热量占总热量摄入的 50% 或更多时,由于微粒体乙醇氧化系统 (MEOS) 的激活,身体系统可能无法有效利用乙醇摄入提供的能量。以能量浪费为代价,MEOS 是乙醇氧化的主要肝脏途径。其诱导在戒酒后是可逆的。
饮酒与体重的关系及戒酒对营养状况的改善
在对 181 名每天消耗超过 80 克乙醇的住院男性进行观察性研究期间观察到,63.1% 的人患有厌食症,58.7% 的人体重减轻,17.8% 的人的 BMI 低于 20 kg/m2。经过三个月的戒酒期后,酗酒者的热量使用正常化,体重指数 (BMI) 和腰臀比 (WHP) 也有所增加。
作者认为,戒酒期间营养状况的改善可能是由于 MEOS 活性较低,从而减少了热量的浪费。
少量或中等程度饮酒的女性肥胖风险较低
酗酒患者因饮酒而出现代谢和营养障碍,并表现出在静息状态下大量使用能量,优先使用脂质作为能量来源,并且与对照组相比,脂肪组织比健康对照减少了 19%。
队列研究表明,与戒酒的女性相比,少量或中等程度饮酒(最多 30 克/天)的女性体重增加和肥胖的风险较低,而其他研究已经达到无论受试者的性别如何,都得出相同的结论。
研究评估了酗酒者脂肪和肌肉组织长期变化的预后价值以及戒酒对这些变化的影响。结果表明,在第一次评估后的头六个月内,原来体重较轻与较差的预后相关,无论患者是否在同一时期戒酒。然而,不禁欲与瘦体重的减少相关性更大。
低剂量饮酒是热量的重要来源
身体对酒精热量的利用可能与酒精的用量有关。酒精消耗量低于每日卡路里的 25-35% 可用作能量来源;然而,在更高的消耗量下,利用可能不完整。
在人类中,热量营养不良是世界各地数以百万计死于饥饿的人所面临的现实,并且由于价格低廉且可用性高,乙醇被摄入以代替食物。一些研究创建动物模型是为了阐明当营养不良的生物体暴露于乙醇时会发生什么。然而,结果并不是人们所期望的。
事实上,低剂量饮酒是热量的重要来源,可减轻营养不良的影响。动物研究表明,摄入低至中等剂量的酒精(最多占总热量摄入的 20%)会导致营养不良的大鼠体重增加,这表明有效利用了酒精的能量含量。然而,当酒精中的能量含量占总卡路里摄入量的 10% 或更多时,富营养化大鼠的体重就会减轻。
肥胖
个人的营养状况可能会影响酒精饮料中能量的利用。在人类中,瘦个体对酒精卡路里的利用效率可能较低,而在肥胖个体中,卡路里有助于增加体重。
酒精对体重的影响仍然是一个有争议的话题
一项长达10年的前瞻性研究表明,饮酒者的体重比不饮酒者更稳定,这表明饮酒不是肥胖的危险因素。每月长期适度饮用啤酒不会改变成年人的体重或身体成分。
一些研究表明,身体和腹部脂肪的增加与适度和频繁饮酒有关。还有证据表明,不同的饮酒方式会导致体重增加。每天摄入 ≥ 30 克酒精可能会改变能量稳态的平衡,促使食欲增加,从而导致体重增加和肥胖,无论摄入哪种类型的酒精。
为什么有可能增加肥胖的风险?
在短期内,饮酒被认为是一种食欲兴奋剂,影响用于控制食欲的神经化学和外周系统,如瘦素抑制、胰高血糖素样肽-1 和血清素,并增强γ-氨基丁酸的作用,内源性阿片类药物和神经肽 Y。因此,在没有依赖性的情况下大量饮酒以及酗酒可能会增加肥胖的风险。
饮酒与体重变化及发展为肥胖的关联因性别而异
男性将酒精添加到日常摄入的卡路里中,而女性则倾向于使用酒精替代其他能源,例如减少碳水化合物的消耗而不会增加总卡路里摄取。在考虑能量平衡时必须包括这些差异,因为它们可能会产生关于体重的不同结果。
多种肥胖风险因素与饮酒有关
例如腹部脂肪增加 、脂质氧化能力下降、高热量饮食消耗和皮质醇分泌增加。有人可能会说,与酗酒者和饮食富含脂肪的人相比,超重或肥胖的人和非日常适度饮酒者更多地利用酒精中的卡路里。
女性、饮酒者、大学生的身体、腹部和外周脂肪值也较高,表明 AUDIT 问卷中较高的分数与 BMI、体脂百分比、腰围、三头肌皮褶,手臂周长呈正相关。
喝得量少,频率高 ⇒ BMI 较低
喝得量多,频率低 ⇒ BMI 较高
一项基于 1997 – 2001 年全国健康采访调查数据的研究表明,与 BMI 相关的饮酒量和频率之间存在强烈的相反影响。喝得频率更高但喝得少(即每天喝一杯)的人 BMI 较低。另一方面,饮酒频率较低但饮酒量较大(暴饮暴食)的个体 BMI 较高。那些每天摄入 ≥ 50 g 的人的腹部肥胖风险因素增加。
与这一发现一致的是,在对英国人进行的一项研究中,有人指出,摄入 30 克或更多的酒精会增高 BMI 和体重增加的风险。
肥胖风险:当前适度饮酒者<戒酒者<酗酒者
同样,在对第三次全国健康和营养检查数据进行研究后提供的结果显示,与戒酒者相比,当前饮酒者肥胖的可能性较低,而酗酒者(一天四剂或更多剂饮酒者)肥胖的可能性更大。在报告经常饮酒但每周饮酒量少于 5 剂的人群中,肥胖风险因素显著降低。
扩展阅读:体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
►►►
血脂概况
每周饮酒三到四天与患心肌梗塞的风险较低有关
据估计,酒精的心脏保护作用可能归因于 50% 的 HDL 升高。适量饮酒(30 克乙醇/天)可使 HDL-c 浓度增加约 4 mg/dL,apoA-I 浓度增加 8.82 mg/dL,心脏病风险估计降低 24.7%。
不管饮用的饮料(葡萄酒、烈酒或啤酒)的数量或类型如何,这种改变都可能发生。此外,酒精促进 HDL (好胆固醇)的较少降解和 LDL(坏胆固醇)的更大肝脏代谢。
重度饮酒者中风风险较高
尽管饮酒会改变血脂水平并减少心血管事件,但已证明重度饮酒者中脑出血和蛛网膜下腔出血等中风的发生率高于不饮酒者 。此外,由于大量饮酒,如糖尿病、高血压性心脏病、缺血性心脏病、缺血性和出血性中风等疾病逐渐增加。
酒精的风险和益处之间的差异因人而异,科学家呼吁不应将其用作保护心血管的工具作为一项公共卫生措施加以鼓励。
在一项荟萃分析研究中描述了酒精对预防冠心病的益处的减少,其中节制和轻度和中度饮酒者显示出相同的冠心病死亡风险。
发现每天饮酒 10 克的人甘油三酯水平较高。摄入量大于 50 克/天可显著降低发生低水平 HDL-c 的风险,但会增加发生高水平胆固醇的风险。
在餐后时期,酒精会导致甘油三酯升高,并抑制游离脂肪酸 (FFA) 的氧化 。重要的是要强调,对于患有冠心病的个体,餐后高甘油三酯血症更大、持续时间更长。高甘油三酯血症或 FFA 增加与正常个体和胰岛素抵抗者的内皮血管舒张减少有关。
扩展阅读:
高血压
酒精摄入会以剂量依赖性反应升高动脉压
每天摄入超过两次的剂量是最常见的可逆性高血压原因之一 。肾素-血管紧张素系统可能参与了酒精诱发高血压的机制。
一项研究表明,急性酒精中毒改变了肾素-醛固酮系统,使人体具有正常的氢和钠平衡。血浆肾素的增加可能是由于乙醇利尿或乙醇对醛固酮分泌的抑制作用引起的脱水。渗透压、动脉压和心脏频率没有发现显著变化。后来,证实适度饮酒时肾素活性会急剧增加,从而引起液体和电解质平衡以及动脉血压的变化。
少量和适度饮酒的影响可能因性别而异
文献对这个问题的描述并不一致。在一项由女性健康研究对 28,848 名女性开展的前瞻性研究和由医生健康研究开展的另一项对 13,455 名女性开展的前瞻性研究中,少量和适度饮酒降低了女性患高血压的风险,并增加了男性患高血压的风险。
酒精成为高血压危险因素的阈值在女性中等于或大于每天 4 剂,而男性的中等水平等于或大于每天 1 剂。 然而,一些研究在考虑男性和女性的动脉血压对酒精的敏感性是否不同时存在争议。
饮酒推荐量因体重而异
由于习惯性饮酒不同,动脉血压升高在低体重个体中比在高体重个体中更为显著。因此,低体重女性预防高血压的推荐饮酒限度必须低于高体重女性。
对于重度饮酒者而言,少喝可以预防治疗高血压
在没有其他心血管疾病的健康男性和女性中调查了饮酒和当前饮酒标准与高血压风险之间的关联。与节制的人相比,那些饮酒且饮酒量很大的人患高血压的风险更高。
重度饮酒者酒精摄入量的减少显著降低了动脉收缩压和舒张压。因此,必须推荐减少饮酒作为生活方式调整措施,以预防和治疗重度饮酒者的高血压。
扩展阅读:认识肠道微生物及其与高血压的关系
以上是酒精对相关疾病的影响。长期大量饮酒后,人体对酒精容易产生依赖性,出现无法自主控制饮酒行为,也就是戒不掉、戒断症状等现象,我们通常说酒精成瘾。他们需要往往更多的酒精来获得同样的愉悦感。接下来章节,我们来看一下酒精成瘾的相关因素。
肠道和大脑是两个器官,它们在解剖学上相距甚远,但在其他方面却如此接近。我们过去的文章写过,肠道微生物组和大脑之间的代谢和神经串扰对大脑功能、情绪和行为具有重要意义。
详见:
在过去十年中,多项研究表明,全身性炎症与精神疾病(包括抑郁症和自闭症)之间存在关联。然而,全身炎症与酒精成瘾、抑郁症和自闭症等精神疾病之间相互作用的机制尚不完全清楚,肠道菌群可能是一个很好的研究目标。
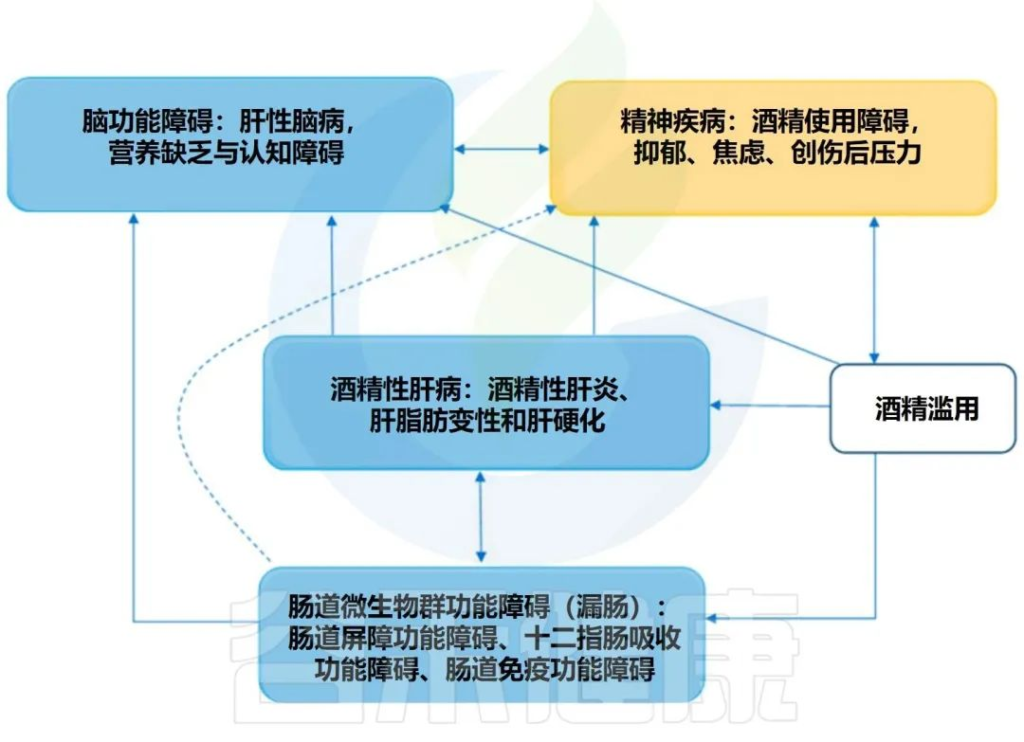
全身性炎症和酒精成瘾的一个可能机制是肠道细菌产物激活外周血单核细胞,诱导细胞因子进入血流,在酒精依赖者中引起低度全身性炎症 。
肠道炎症还可以将内毒素和细胞因子传播到血液中,在那里它们可以进入中枢神经系统 (CNS),引起神经炎症。
酒精成瘾与十二指肠的吸收障碍有关,导致营养不良和硫胺素的肝脏储存受损。
酒精成瘾与其他精神疾病高度相关,包括重度抑郁症、双相情感障碍以及焦虑症。重度抑郁症等情绪障碍通常先于酒瘾发作;例如,有人使用酒精来应对情绪低落。
酒精成瘾的严重程度与其渴望、认知功能障碍、焦虑和抑郁症状的强度相关
正如我们上面提到的,全身炎症可能在酒精成瘾的发展中起重要作用;肠道和肝脏的肠屏障功能障碍和炎症可能导致外周炎症并引起脑部炎症,从而诱发小胶质细胞或星形胶质细胞等脑细胞的炎症。
疾病行为理论可能将全身性炎症与酒精成瘾和情绪障碍联系起来。该理论支持外周炎症,如肠漏症,激活免疫系统并产生可到达大脑的细胞因子,导致发烧、疲劳、疲倦、无法集中注意力和退出社交;当上述行为持续存在时,可能会出现抑郁症状。
越来越多的研究将肠道微生物组的组成和功能与物质使用障碍 (SUD) 联系起来。
肠脑轴和物质使用障碍(SUD)
SUD 的特征是:尽管知道会对精神、身体和社会造成负面影响,但仍对某种物质(例如,酒精、阿片类药物和/或其他药物)长期依赖。
它们具有社会经济、生物化学、遗传以及越来越多的微生物学基础。众所周知,大脑是调节成瘾参数的重要器官,然而,通过微生物角度研究成瘾提供了一种思考:与身体相关的其他因素如何与大脑携手合作,以调解获得滥用药物的动机的新方法。
肠道和大脑通过双向、生化和神经高速公路(肠-脑轴)进行交流。肠上皮细胞下方的神经末梢接收来自肠道微生物群的代谢信号,这可能会影响行为,例如压力或焦虑。
除了与中枢神经系统发育和大脑功能有关的其他代谢物,如短链脂肪酸,肠道微生物还有助于产生一系列与情绪、认知和奖赏相关的神经递质(例如血清素和多巴胺)。
肠脑轴
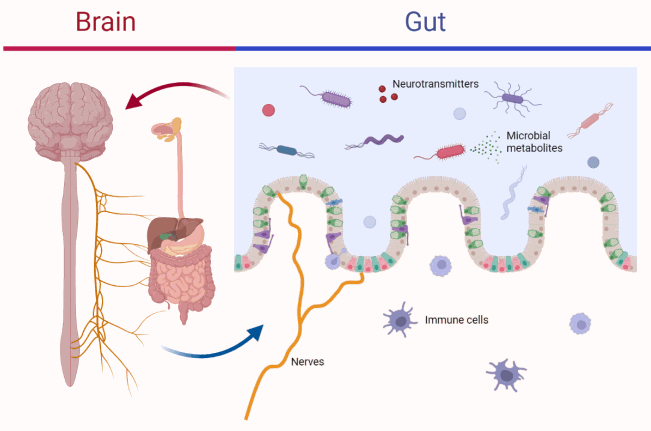
图源:BioRender
这些神经递质在 SUD 的情况下特别相关;许多滥用物质通过触发大量多巴胺进入奖励途径来劫持大脑的奖励系统。这种多巴胺泛滥带来的愉悦感最终会减弱,个人可能会反复服用该物质以再次体验这些感觉。研究表明,肠道微生物参与自然(例如食物)和人工奖励(包括药物)的奖励感知,这表明 SUD 的发展/进展与肠道微生物组组成之间存在联系。
事实上,滥用酒精或药物与微生物组组成的变化有关。尽管这些改变的具体情况因物质而异,但与“健康”相关的微生物通常会减少,而具有促炎作用的微生物会增加,例如变形杆菌。这些变化伴随着关键微生物代谢物(如短链脂肪酸)的减少,具有各种全身和局部效应(例如,肠道屏障完整性的破坏)。
通常,SUD 的特征是肠道炎症增加,部分原因是这种渗漏的肠道屏障允许微生物及其产物与底层免疫细胞相互作用。激活后,这些免疫细胞会产生细胞因子,这些细胞因子不仅会引发局部炎症,还会进入循环并穿过血脑屏障。由此产生的神经炎症会改变神经元活动,包括在大脑的奖励通路内,并可能影响对物质本身的反应和耐受性。
管理物质使用障碍——肠道微生物
治疗 SUD 的策略因人和物质而异,但可能涉及药物(如阿片类拮抗剂)、咨询和行为护理。然而,这些策略可能并不总是奏效,并且可能会复发。目前药物成瘾治疗干预的成功率很低,大约40-60% 接受治疗的人最终会复发并重新使用滥用药物。
鉴于肠道微生物群和 SUD 之间出现的交叉点,发现用某些细菌补充肠道微生物群,它们的发酵产物(如短链脂肪酸)可能会减少滥用物质的影响。
例如,一项研究发现富含双歧杆菌的益生菌和Lactobacillaeae 可逆转小鼠对吗啡的耐受性。
粪便微生物群移植 (FMT) 也可能是一种选择,或许未来可以用于干预酒精成瘾或使用障碍。一项 1 期临床试验表明,与安慰剂组相比,接受富含毛螺菌科和瘤胃球菌科 FMT 的酒精使用障碍患者在 15 天后 对酒精的渴望有所减少(分别减少 90% 和 30%)。在吗啡依赖小鼠中,FMT减轻了戒断症状由阿片拮抗剂触发。由于阿片类药物耐受性容易导致剂量增加和用药过量,这些发现表明微生物可以延长药物的疗效。
以上表明肠道微生物组的未来及其对健康和福祉的影响有很大的应用,尤其是与 SUD 相关的情况。这是一个有前景的领域。
目前,酒精摄入过量的治疗干预措施主要包括药物治疗、心理治疗、社会支持等方面。以下是一些应对过度饮酒的可行性计划:
这里再介绍一些关于过量饮酒的饮食干预。
1. 豆腐
豆腐中所含的半脱氨酸是一种氨基酸,其重要性在于能解除乙醇的毒性,食用后能促进酒中乙醇的排出,从而达到解酒的目的。
2. 香蕉
香蕉还有解酒作用,因为香蕉中含有丰富的果糖,进入人体后可以稀释酒精,所以可以解酒。

3. 糖水
适量白糖和开水混合,甜度视醉度而定,稍凉片刻即可饮用。糖分进入人体后,会增加体内血糖浓度,降低血液中酒精浓度,加速体内酒精的排出,从而达到醒酒的目的。
4. 蜂蜜水
其实酒后喝点蜂蜜水可以有效减轻酒后头痛的症状,蜂蜜可以促进人体对酒精的吸收从而减轻酒后头痛的症状,此外,蜂蜜还有镇静催眠的作用. 多吃蜂蜜对皮肤和胃都有好处。

5.葛根水
葛根泡水喝,不管是喝前还是喝后,都有很好的效果。饮酒前先喝葛根水,可预防酒精对肝脏的损害。酒后饮用可起到醒酒作用。
6.番茄
番茄中的果糖、葡萄糖和维生素对肝脏和心脏都有保健作用,而且果糖还是解酒醒酒的好味道。酒后吃几个西红柿,可使头晕逐渐消失。
7.红薯
将生红薯磨碎,加入适量白糖,搅拌均匀后服用。
8.绿豆
绿豆适量,用温水冲净,捣烂,用沸水冲净或熬汤食用。
9.甘蔗
1 根甘蔗,去皮并榨汁。
10.盐水
在开水中加少许盐,喝下醒酒。
11.柑橘皮(陈皮)
将陈皮烘熟,研末,加食盐1.5克煮汤。
12.白萝卜
白萝卜1公斤,捣成泥取汁,分次服用。也可以在白萝卜汁中加入适量的红糖饮用,也可以生吃萝卜。

编辑
这些用食物解酒的方法虽然看似简单,但是却能够起到解酒作用。如果你也喜欢喝酒,经常喝醉,那么学习一些有效的解酒方法就显得非常重要了。对于喜欢喝酒的朋友而言,为了整体健康,请根据自身情况适度饮酒,尽可能避免过量饮酒。
总的来说,适量酒精可能给人体带来好处,尤其对自身免疫性疾病具有保护作用。低剂量酒精可能通过增加Akk菌等保护性肠道微生物,并有助于增加乙酸盐、多不饱和脂肪酸等,间接产生积极影响。
而高剂量酒精则可能带来不利影响,破坏肠道屏障的稳定性,增加肠道通透性,导致微生物成分进入循环系统,引发肝脏和其他器官的炎症反应;并可能导致肠道微生态失调、肠道菌群产物、脂多糖增加;导致单核细胞、T 细胞、细胞因子、IgG 水平以及 B 细胞减少;进而影响酒精性肝病、肥胖、胃肠道疾病、心血管疾病等发生和发展。
此外,饮酒还会影响肠道微生物组影响社交行为和精神障碍。因此,保持健康的肠道微生物组对于预防和治疗与饮酒相关的疾病具有重要意义。
未来的研究应该进一步探讨肠道菌群与酒精代谢和酒精成瘾之间的因果关系,肠道菌群的调节可能成为预防和治疗酒精成瘾的新靶点。
主要参考文献:
Jew MH, Hsu CL. Alcohol, the gut microbiome, and liver disease. J Gastroenterol Hepatol. 2023 Apr 25. doi: 10.1111/jgh.16199. Epub ahead of print. PMID: 37096652.
Meroni M, Longo M, Dongiovanni P. Alcohol or Gut Microbiota: Who Is the Guilty? Int J Mol Sci. 2019 Sep 14;20(18):4568.
Caslin B, Mohler K, Thiagarajan S, Melamed E. Alcohol as friend or foe in autoimmune diseases: a role for gut microbiome? Gut Microbes. 2021 Jan-Dec;13(1):1916278.
Zugravu CA, Medar C, Manolescu LSC, Constantin C. Beer and Microbiota: Pathways for a Positive and Healthy Interaction. Nutrients. 2023 Feb 7;15(4):844.
Engen PA, Green SJ, Voigt RM, Forsyth CB, Keshavarzian A. The Gastrointestinal Microbiome: Alcohol Effects on the Composition of Intestinal Microbiota. Alcohol Res. 2015;37(2):223-36.
González-Zancada N, Redondo-Useros N, Díaz LE, Gómez-Martínez S, Marcos A, Nova E. Association of Moderate Beer Consumption with the Gut Microbiota and SCFA of Healthy Adults. Molecules. 2020 Oct 17;25(20):4772
Crews FT, Sarkar DK, Qin L, Zou J, Boyadjieva N, Vetreno RP. Neuroimmune Function and the Consequences of Alcohol Exposure. Alcohol Res. 2015;37(2):331-41, 344-51.
González-Zancada N, Redondo-Useros N, Díaz LE, Gómez-Martínez S, Marcos A, Nova E. Association of Moderate Beer Consumption with the Gut Microbiota and SCFA of Healthy Adults. Molecules. 2020 Oct 17;25(20):4772.
Hernández-Quiroz F, Nirmalkar K, Villalobos-Flores LE, Murugesan S, Cruz-Narváez Y, Rico-Arzate E, Hoyo-Vadillo C, Chavez-Carbajal A, Pizano-Zárate ML, García-Mena J. Influence of moderate beer consumption on human gut microbiota and its impact on fasting glucose and β-cell function. Alcohol. 2020 Jun;85:77-94.
Doremus-Fitzwater TL, Deak T. Adolescent neuroimmune function and its interaction with alcohol. Int Rev Neurobiol. 2022;161:167-208.
Tirado-Kulieva VA, Hernández-Martínez E, Minchán-Velayarce HH, Pasapera-Campos SE, Luque-Vilca OM. A comprehensive review of the benefits of drinking craft beer: Role of phenolic content in health and possible potential of the alcoholic fraction. Curr Res Food Sci. 2023 Mar 4;6:100477.
Caslin B, Mohler K, Thiagarajan S, Melamed E. Alcohol as friend or foe in autoimmune diseases: a role for gut microbiome? Gut Microbes. 2021 Jan-Dec;13(1):1916278.

谷禾健康

编辑
癌症一直是全球人类关注的重点,近年来癌症的发病率迅速增加,例如乳腺癌、前列腺癌和肺癌非常普遍。胃肠道癌在发病率和死亡率方面位居首位,并造成重大的社会经济负担。
胃肠道癌症包括胃癌、肝癌、食道癌、胰腺癌和结直肠癌等,占所有癌症的四分之一以上。
▷生活行为影响胃肠道癌症
目前的证据表明,社会经济发展导致生活方式的一些改变。如吸烟和饮酒是癌症最常见的风险因素,越来越多的共识也将饮食习惯列为胃肠道癌症的相关风险因素。这些行为与各种慢性非传染性疾病和胃肠道癌症的出现直接或间接相关。
▷肠道微生物影响胃肠道癌症
肠道微生物群在人类的健康和疾病状态中都发挥着重要作用。大量研究证明肠道微生物群对胃肠道癌症(包括食管癌、胃癌、结直肠癌、肝癌和胰腺癌)具有一定的影响。
在本篇文章中,讲述了胃肠道癌症的一些基本特征,并探讨了在社会进步的背景下,不健康的行为、饮食,及其影响的肠道微生物群变化对胃肠道癌症的影响。希望在未来有助于胃肠道癌症的预防、诊断和治疗。
本文主要分三部分讲述
Part1:胃肠道癌症的一些基本特征
Part2:不良生活方式对胃肠道癌症的影响
Part3:肠道微生物与胃肠道癌症的关系
胃肠道 (GI) 癌症,包括胃癌、肝癌、食管癌、胰腺癌和结直肠癌,胃肠道癌症是全球最常见的癌症,也是导致死亡的主要原因之一,它们的患病率正在持续上升。
疫情前的数据统计,2018年,约有500万例新增胃肠道癌症病例,超过300万例相关死亡。
胃肠道癌症严重危害人们健康
从GLOBOCAN数据库获得的数据估计,2020年食管癌新发病例超过60万例,相关死亡超过50万例。
使用同一数据库,分析估计2020年全球有110万例胃癌新发病例和超过70万例相关死亡。
同样,结直肠癌的发病率一直在以惊人的速度上升,2020年全球估计有190万新病例和90万例相关死亡。
胃肠道癌症已经成为不容忽视的健康问题,下面先来了解一下这些癌症:
▼
食管癌是第四常见的胃肠道癌症。
鳞状细胞癌是食管癌最常见的组织学类型
食管癌有两种主要的组织学亚型:腺癌和鳞状细胞癌 (SCC)。鳞状细胞癌是世界范围内的主要亚型。
我国食管癌90%以上为鳞状细胞癌,少数为腺癌。大多数食管癌患者表现为疾病晚期;因此,平均5年内总生存率仅为18%。
注:腺癌在美国和北欧排名第一(约60%)。
✦食管癌的症状
早期无明显症状
食管癌在早期往往是无明显症状的,偶有表现为胸骨后隐痛不适。随着肿瘤增大,患者会出现进食时吞咽不适或异物感。常表现为进食速度减慢并常需汤水送饭。
病情加重导致肿瘤增大阻塞食管
数月后因肿瘤进一步增大并阻塞食管腔,患者只能进食流质,当肿瘤完全阻塞管腔时,病人表现为“滴水难通”。从症状出现至完全梗阻一般约一年时间。
因此,有可疑症状时应尽早到医院检查。
✦男性食管癌的发病率高于女性
食管癌的男女差异较大,男性患食管癌的比例明显高于女性。食管癌在男性患者中的发生率是女性患者的三倍。
鳞状细胞癌的主要危险因素是饮酒和吸烟,而腺癌的主要危险因素是胃食管反流(尤其是糜烂性食管炎和巴雷特食管)、吸烟和肥胖。
胃食管腔因过度接触(或暴露于)胃液而引起的临床胃食管反流症和食管黏膜损伤的疾病称为胃食管反流。
▼
胃癌是全球第五常见癌症,也是癌症相关死亡率的第三大原因。
✦胃癌的症状
根据癌组织浸润深度分为早期胃癌和进展期胃癌(中、晚期胃癌)。
胃癌早期较难诊断
胃癌及癌前病变的症状隐匿且无特异性,因此早期胃癌很难发现。事实上,中国只有5~10%的胃癌能被早期诊断。
如捉摸不定的上腹部不适、隐痛、泛酸、食欲减退、轻度贫血等部分类似胃十二指肠溃疡或慢性胃炎症状。
随着病情的进展,胃部症状渐转明显出现上腹部疼痛、食欲不振、消瘦、体重减轻和贫血等。后期常有癌肿转移、出现腹部肿块、左锁骨上淋巴结肿大、黑便、腹水及严重营养不良等。
✦胃癌在不同人群中差异很大
非贲门胃癌 (NCGC) 占胃癌病例的近75%。与其他胃肠道癌症类似,非贲门胃癌的流行病学在不同人群中差异很大。
非贲门胃癌在东亚的发病率(韩国每10万人中有34人;日本每10万人中有28人)明显高于欧洲或美国(每10万人中有6人)。
✦影响胃癌的风险因素
除了幽门螺杆菌感染外,胃癌的其他主要危险因素包括年龄增长、性别、种族、饮食摄入类型、社会经济地位、遗传和吸烟。
尽管在过去几十年美国胃癌的发病率有所下降,但50岁或以下人群的非贲门胃癌发病率却出现升高,并且经常出现诊断晚和预后不良的情况。
▼
结直肠癌是常见的消化道恶性肿瘤,也是导致癌症相关死亡的第二大原因,每年全世界约有180万新发病例。
发病多在40岁以后,好发部位为直肠及直肠与乙状结肠交界处,男女比约为2:1。
✦结直肠癌的症状
结直肠癌的临床表现随其病灶大小、所在部位及病理类型而有所不同。
早期症状:
腹部不适:可能表现为腹胀、腹部隐痛等不适症状,疼痛多出现在中下腹部,逐渐加重;
排便习惯的改变:可能出现便频、腹泻或便秘,腹泻和便秘可交替出现,还可能出现腹部隐痛、肛门坠胀感等。
中期症状:
腹部肿块:当肿瘤生长到一定大小后,可能在腹部触及肿块,初期可推动,待到侵袭周围组织后则不易推动;
恶心、呕吐:当肿瘤侵犯胃部时,患者可能出现恶心、呕吐等症状;
晚期症状:
肠梗阻:以左侧结肠多见,由肿瘤向肠壁四周侵袭浸润,导致肠腔狭窄引起肠梗阻,多为慢性不完全性肠梗阻。可先出现腹胀、腹痛、肠鸣音亢进、便秘、粪便变细等;
全身中毒症状:以右侧结肠多见,由于肿瘤消耗体内营养,并造成慢性长期出血,还可继发感染,因此可出现贫血、消瘦、发热、无力、水肿等全身中毒症状;
转移症状:结肠癌晚期时可出现多处转移,肝转移可造成肝大、黄疸、腹水;肺转移可出现咳嗽、气促、血痰或呼吸困难等症状;脑转移可出现偏瘫、昏迷;骨转移可出现骨痛、跛行等。发展到最后可出现恶病质表现,引起全身多器官功能衰竭。
✦影响结直肠癌的风险因素
超过90%的结直肠癌病例是偶发的,这突显了除了癌症相关基因之外,环境风险因素的重要性。例如不健康的饮食模式、超重、肥胖、2型糖尿病、久坐不动、吸烟和饮酒。
正如在其他胃肠道癌症流行病学研究中观察到的那样,不同国家和地理区域之间的结直肠癌发病率差异很大,澳大利亚和新西兰的发病率最高,中南亚的发病率最低。
工业化影响了结直肠癌的发病率
多项研究支持高人类发展指数与结直肠癌发病率和死亡率之间的关系;发达国家通常报告的发病率最高。尽管经济发展和随之而来的工业化有望改善医疗保健的可及性,但这极大地影响了生活方式和不健康习惯。
尽管如此,许多欠发达国家的发病率正在上升,加拿大和巴西等国家的结直肠癌发病率的巨大差异可能不仅与卫生政策有关,还与地区贫困有关。
扩展阅读:结直肠癌防治新策略——微生物群
▼
一般分为肝细胞癌和肝内胆管癌
原发性肝癌一般可分为肝细胞癌(HCC)和肝内胆管癌(ICC),这两种约占肝癌75-85%的病例。
预后不良是该疾病的标志;因此,肝癌的发病率和死亡率密切相关。肝癌在胃肠道癌症中的发病率与死亡率均排名第三。此外,肝癌是全球第六至第七常见的癌症,也是导致癌症相关死亡的第四大原因。
✦肝癌的症状
早期症状:肝癌从第一个癌细胞形成发展到有自觉症状,大约需要2年时间,在此期间,病人可无任何症状或体征,少数病人会出现食欲减退,上腹闷胀、乏力等,有些病人可能轻度肝肿大。
中、晚期症状:肝癌的典型症状和体征一般出现于中、晚期,主要有肝痛、乏力、消瘦、黄疸、腹水等。
转移症状:如果肝癌出现转移,可能出现相对应的症状。肺转移可能出现咳嗽、咳痰等症状,骨转移可能出现疼痛的症状。
✦肝癌的地区差异较大
肝癌的全球分布差异很大,近75%的病例发生在亚洲,其中中国占病例的50%以上,蒙古的发病率最高(93.7/100000)。
在过去的四十年里,一些国家,如美国、加拿大、新西兰和澳大利亚,出现了肝癌病例增加的趋势。
✦影响肝癌的风险因素
病毒性肝炎
乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)以及饮酒被认为是世界范围内肝细胞癌最重要的危险因素。
非酒精性脂肪肝
随着肥胖、糖尿病和相关代谢综合征的高度流行,非酒精性脂肪肝被认为是慢性肝病最常见的原因之一,也是肝细胞癌的相关原因。
工业化进程影响着社会经济环境,人们生活方式的改变,有利于高热量的西方化饮食,并增加了肥胖和糖尿病的发病率。
扩展阅读:
▼
胰腺癌是五种主要胃肠道癌症中最不常见的,累计5年生存率仅为5–15%。
胰腺癌的发病率近年来呈快速上升的趋势,死亡率排在首位,因此也被称为“癌中之王”。
✦胰腺癌的症状
胰腺癌是最致命的癌症之一,其特点是:难发现(发现多为晚期),病程短,发展恶化速度快,中位生存期为3-6个月,正所谓 “无声杀手”。
胰腺癌的早期临床表现往往是无特异性的,与许多其它常见疾病症状相似。中后期主要症状有:不明原因的厌食,消化不良及体重下降;腹部不适或疼痛;黄疸。
✦影响胰腺癌的风险因素
高人类发展指数国家胰腺癌的发病率和死亡率均高出3-4倍,其中北美、欧洲和澳大利亚/新西兰报告的发病率最高,男性患者的发病率略高于女性患者。
高体重指数(BMI)、2型糖尿病,以及酗酒和吸烟是胰腺癌的可变风险因素。关于胰腺癌的风险,发现吸烟者与非吸烟者的发病率比值约为1.74。大量饮酒似乎与胰腺癌有关,是胰腺炎的相关原因,胰腺炎也是胰腺癌的一个既定风险因素。
注:胰腺癌通常具有高度侵袭性,由于非特异性的临床表现而难以诊断。此外,同一国家的国家和地区的诊断准确性差异很大,主要与城市、大都市和高度发达的中心有关。
扩展阅读:“隐藏高手” 胰腺癌的新出路——微生物
中国是全球肝癌、食管癌、胃癌新发病例和死亡人数最多的国家,2020年新增确诊病例121万。中国结直肠癌发病率也在快速上升,占2020年全球发病率的40%以上。
中国胃肠道肿瘤负担沉重,发病率高于世界平均水平。
★ 胃肠道癌症与生活习惯有关
中国近几十年经历了饮食和营养、身体活动及吸烟等生活方式的快速变化。大量证据支持胃肠道癌症与饮食和其他生活行为风险因素有关。
统计与胃肠道癌症风险相关的饮食等生活因素的时间趋势,将有助于衡量由这些因素引起的胃肠道癌症发病的未来趋势,影响预防癌症的公共卫生政策,并优化健康促进的资源分配。
研究团队根据1991年至2011年中国健康与营养调查 (CHNS) 的数据描述和预测了中国饮食和生活方式因素以及相关胃肠道癌症负担的时间趋势。
Wu Y,et al.Gastroenterology.2021
下面来讲述一下这些生活方式与胃肠道癌症之间的具体关系:
▼
饮酒是全球疾病负担的主要风险因素,饮酒会增加患癌症的风险。1990年至今,全球成人人均酒精消费量增加,当前饮酒率从45%增加到47%,终生戒酒率从46%减少到43%,预计到2030年这两种趋势将持续。
✦大量饮酒会增加癌症风险
酒精饮料导致近4%的癌症,而最高风险与大量饮酒有关。考虑到不同的饮酒模式,研究表明癌症风险与饮酒频率、每天通常饮酒的量和偶尔大量饮酒之间存在不同的关联,所有这些都与风险增加有关。
教育状况、饮食、吸烟、个人偏好以及地区和宗教习惯是与饮酒或戒酒模式相关的多种生活方式因素中的一部分,可能会混淆当前的研究结果。
几种胃肠道癌症与饮酒有关:
鳞状细胞食管癌与饮酒有关,但与食管腺癌无关。
研究显示关于结直肠癌和胰腺癌的不同结果;胰腺癌的风险似乎与大量饮酒有关,而 结直肠癌的风险与中度或大量饮酒有关。
关于胃癌,世界癌症研究基金会/美国癌症研究所2018年的报告观察到,酒精摄入量 >45 克/天的人群患胃癌风险增加。
肝细胞癌与饮酒直接相关;该关联主要由酒精相关性肝硬化、乙型或丙型肝炎病毒携带者饮酒以及可能大量饮酒驱动。
✦酒精致癌的一些途径
酒精可能通过多种途径促进致癌作用,包括:乙醇及其代谢物乙醛会影响DNA甲基化,导致致癌基因的表达;乙醛形成DNA加合物,损害DNA合成和修复并导致突变。
除此之外,炎症、氧化应激的诱导、叶酸吸收的破坏、免疫系统功能下降、微生物群失调、肝硬化和雌激素调节的变化也可能在癌症发展中发挥作用。
▼
吸烟是多种疾病的主要危险因素,包括胃肠道癌症。
★ 烟草的危害非常大
尽管近几十年来吸烟率有所下降,但与吸烟相关的疾病和死亡仍然是一个令人严重关切的问题,也是一个全球健康问题。
《2019年全球疾病、伤害和风险因素负担研究》确定,就残疾调整寿命而言,吸烟是87个风险因素中的主导因素。
烟草烟雾含有不同的化学制剂,包括活性氧(ROS)和活性氮(RNS)。氧化损伤导致遗传和表观遗传改变、基因失调、调节元件破坏和炎症反应途径激活,在恶性循环中导致活性氧的进一步生成,并可能最终演变为癌症的发生和发展。
✦吸烟者患胃肠道癌症风险更高
食管鳞状细胞癌风险增加
过去几十年的研究支持吸烟与胃肠道癌症之间的关系。吸烟也与食管鳞状细胞癌风险增加20-30%有关,重要的是,注意到烟酒联合使用的具有协同作用。
吸烟人群患胃癌风险较高
数据还表明,吸烟是贲门型和非贲门型胃癌的危险因素。对于其他胃肠道癌症,吸烟率较高的吸烟者患胃癌的风险更高。
荟萃分析还支持吸烟在结直肠癌发展中的作用。 吸烟是肝癌和胰腺癌的公认危险因素。2014年美国卫生部长的报告显示,目前吸烟者因吸烟而患肝癌的风险增加了70%,以前吸烟者增加了40%。
在那些每天吸烟量最大的人中,患胰腺癌的风险最高。荟萃分析研究发现,与不吸烟者相比,当前吸烟者的胰腺癌患者比值升高,但重度吸烟者的比值更高,随着戒烟后的年数成比例下降。
戒烟的好处已经得到了很好的证实。戒烟者的死亡和癌症风险降低。
戒烟和控制烟草消费需要战略规划。成功的戒烟尝试与社会经济地位、教育水平、获得原烟草广告、反烟草运动以及与其他吸烟者一起生活有关。
▼
高脂饮食可显著促进胃肠道肿瘤的发生和发展,主要涉及代谢重编程和多种致癌分子的改变。
高脂饮食与胃肠道癌症的关联
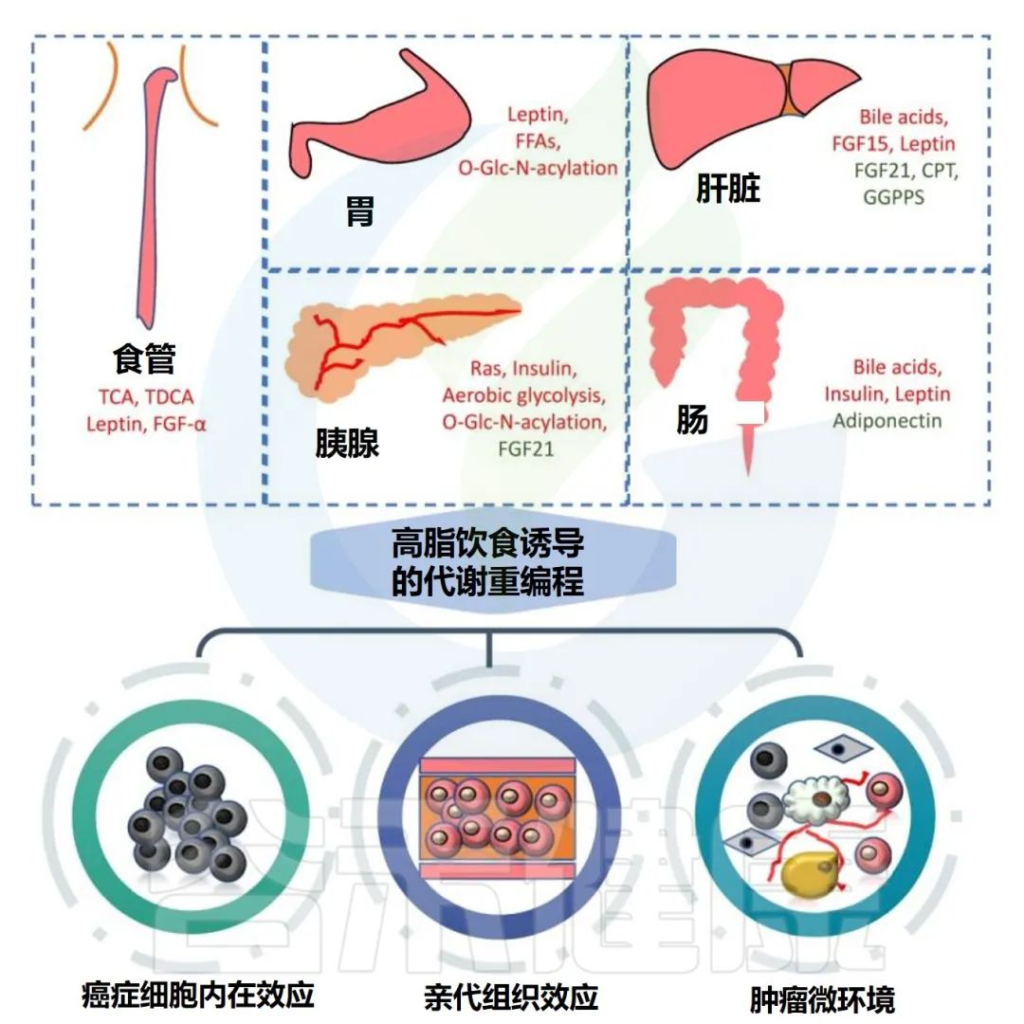
Tong Y,et al.Theranostics.2021
✦高脂饮食下食管癌发病率较高
早在1994年,就发现喂食高脂饮食的小鼠食管癌发病率较高,提示高脂饮食与食管癌之间存在关联。
胆汁酸组成发生变化
高脂饮食可导致小鼠胆汁酸组成发生变化,尤其是牛磺胆酸和牛磺熊去氧胆酸,导致小鼠巴雷特食管和食管癌的发病率增加。
巴雷特食管——食管下段的鳞状上皮被柱状上皮覆盖,可能与反流性食管炎相关,并有发生腺癌的可能。
促炎和致瘤因子增加
喂食高脂饮食的小鼠的食管腺癌具有更高的生长和代谢活性,脂肪组织中促炎和致瘤因子(如瘦素、IGFBP)的表达增加,而抗炎和生长抑制分子减少。
在临床流行病学研究中,发现“肉和脂肪”与食管腺癌和食管鳞状细胞癌密切相关。同时还发现,较高比例的脂肪会加剧食道癌和食道胃腺癌的发生,而碳水化合物会降低食道腺癌的发生。
✦过量膳食脂肪易导致胃癌
许多流行病学研究报告说,膳食脂肪可能是胃癌的危险因素。
瘦素在胃癌中发挥重要作用
瘦素被认为在肥胖相关的胃肠道恶性肿瘤中发挥重要作用,因为它在血管生成、细胞凋亡、细胞增殖和细胞迁移中发挥作用。
瘦素是一种由脂肪组织分泌的激素,它在血清中的含量与动物脂肪组织大小成正比。瘦素作用于位于中枢神经系统的受体,从而调控生物的行为以及新陈代谢。
它还显示通过调节mTOR、STAT3和ERK依赖性途径、PI3K依赖性途径和MAPK依赖性途径来促进粘蛋白产生和胃肠道肿瘤形成。
作用机制
过度的瘦素和瘦素信号激活通过抑制胃肠道上皮细胞中的细胞因子信号3的抑制剂以及增加与肠上皮相关的异位分子如肠粘蛋白2和潘氏细胞标志物PLA2的表达而导致胃肿瘤,以及转录因子SRY-box转录因子2和H+/K+ATP酶的表达降低。
由于瘦素受体(OBR)信号介导的胃上皮细胞器稳态、组织完整性和干性基因表达的破坏,与高脂饮食相关的脂肪毒性会诱发癌前病变。
简而言之,高脂饮食通过上皮细胞中PI3K-Akt通路的上调,促进β-连环蛋白并破坏细胞器稳态,并且可以上调癌症干细胞的特性。
一项研究发现,在高脂饮食喂养的8-20周内,胃壁细胞出现线粒体损伤,并伴有粘膜厚度增加。游离脂肪酸(FFAs)的添加可以复制这种表达并促进后生变化,表明游离脂肪酸的脂质毒性诱导壁细胞死亡和癌前病变的发生。
还有研究发现高脂饮食可以为转移提供足够的能量,并增加O-Glc-N-酰化水平,从而促进脂肪酸受体CD36的转录激活。CD36上调导致癌症细胞脂肪摄取增加,形成促进癌症转移的恶性循环。
✦高脂饮食促进了肝癌
研究证实,高脂饮食可导致疏水性胆汁酸的肝脏滞留显著增加,这与肠道微生物的变化显著相关。同时,肝内胆汁酸的合成和转运紊乱,导致多种炎性细胞因子释放和胆汁酸严重沉积,促进癌症的发生。
此外,调节新陈代谢的各种分子也发生了变化。例如,饮食诱导的肥胖小鼠肝脏中的FGF21和CPT2减少,而FGF15、IRE1α和瘦素上调,然后与其他病理变化联系起来,促进致癌作用。
FGF21减少与过度增殖、TGF-β和Smad信号以及肝脏中上皮-间质转化和Wnt信号通路/β-连环蛋白 信号的异常表达密切相关。
脂肪酸氧化酶CPT2在高脂喂养小鼠体内显著下调,导致酰基肉碱在肝细胞癌组织和血清中蓄积,协同抑制脂肪酸氧化和激活STAT3,共同促进肝癌发生。
高脂饮食产生的代谢变化导致肝脏炎症
长期高脂饮食可降低小鼠香叶基香叶基二磷酸合酶的表达。肝香叶基香叶基二磷酸合酶敲除增强肝激酶B1超法尼基化,通过调节AMPK 活性破坏线粒体功能并促进糖酵解。这些代谢变化导致肝脏炎症,巨噬细胞和促炎细胞因子浸润,进而促进肝脏病理进展。
IRE1α与癌症内质网应激有关,并驱动发病机制。一方面,IRE1α促进NFκB途径的肥胖相关抑制剂的激活,导致肝脏中产生典型的促炎细胞因子,如肿瘤坏死因子和白细胞介素6。
另一方面,它维持STAT3的激活,从而促进肝细胞增殖。瘦素信号通路可以通过下游PI3K/Akt信号激活mTOR,而mTOR间接激活真核起始因子4E,从而刺激编码增殖和抗凋亡因子的mRNA的翻译。
同时,高脂饮食可显著提高血清DPP4水平,促进DPP4/CL2/血管生成的级联反应和DPP4调节的巨噬细胞浸润介导的炎症反应,所有这些都在高脂饮食相关的肝细胞癌进展中起着关键作用。
✦高脂饮食对胰腺癌有影响
高脂饮食降低了上皮对癌症的防御
高脂饮食能促进细胞增殖,抑制异常细胞清除。西方饮食诱导小鼠胰腺上皮细胞过度增殖,并导致突变频率和可能性增加。高脂饮食喂养显著降低了RasV12转化细胞的清除能力,从而损害了上皮对癌症的防御。
高脂饮食可以产生炎症和免疫抑制性肿瘤微环境。发现喂食高脂饮食的小鼠的胰腺组织具有更高的KRAS活性、纤维化基质、更短的存活时间和更高程度的胰腺上皮内肿瘤和胰腺导管腺癌。
高脂饮食导致高胰岛素血症
高脂饮食还可以导致高胰岛素血症并加速胰腺上皮内肿瘤小鼠中的形成和进展。同时发现增加的内源性胰岛素会促进高脂饮食诱发的癌前病变和胰腺癌,这表明可能存在致癌机制。
胰腺导管腺癌发展的机制可能与DNA损伤有关。给 小鼠喂食高糖、高脂肪饮食,高糖处理的正常胰腺细胞系在体外表现出明显的DNA损伤和KRAS突变增加,他们还发现KRAS突变细胞在正常和高糖条件下均具有生长优势环境。
✦高脂饮食促进结直肠癌的发生和转移
对结直肠癌和高脂饮食的流行病学研究证实了它们之间的联系。
高脂饮食促进结直肠癌的发生和转移。伴随着APC基因的杂合丢失和ERK1/2、AKT和mTOR 信号通路的下调。
以下几种途径在高脂饮食促进结直肠癌中发挥关键作用:
JNK通路在肥胖和胰岛素抵抗中起着至关重要的作用并促进致癌转化和细胞增殖。
STRA6通路充当高脂饮食和结直肠癌之间的桥梁,维持结直肠癌干细胞。高脂饮食促进肿瘤组织中STRA6的增加,而STRA6激活转导JAK2-STAT3信号级联。
高脂饮食还可以激活MAPK、ERK和PI3K/Akt信号通路。在一项研究中,高脂饮食引起的肥胖可促进炎症相关结直肠癌的发生,这是由PI3K/Akt途径和肿瘤微环境中IL-12、MCP-1、IL-6和TNF-α的增加驱动的。
关于高脂饮食对细胞因子或肥胖因素的影响,也有许多研究。血清胰岛素、瘦素、TNF-α、IGF1水平升高,以及增殖细胞核抗原、COX-2、细胞周期蛋白 D1、β-连环蛋白和 NFκB 蛋白水平升高表明高脂饮食促进通过炎症和代谢异常形成结肠腺瘤,并影响细胞周期。
▼
慢性心理压力也被认为是包括癌症在内的多种疾病发展的危险因素。
慢性应激刺激下丘脑-垂体-肾上腺轴和交感神经系统,导致应激相关介质的合成和肾素-血管紧张素系统的激活 。
皮质类固醇和儿茶酚胺的过量产生会导致促炎细胞因子的产生和代谢变化,包括胰岛素抵抗的增加和脂肪分解释放游离脂肪酸。
✦慢性心理压力造成炎症环境
总而言之,这些改变似乎创造了一个炎症环境,加剧代谢综合征、糖尿病和胰岛素抵抗的发病机制以及其他非传染性慢性和免疫介导疾病的发展,所有这些都可能由慢性心理压力介导。
在癌症中,肾上腺素能受体在肿瘤细胞和肿瘤微环境中过度表达。肾上腺素能受体的下游激活反过来会抑制细胞凋亡和DNA修复,并具有增强细胞周期进程的原癌效应。
肾上腺素能受体的激活会诱导PI3K/AKT信号通路,从而刺激细胞增殖和血管生成。此外,应激介导的炎症反应和免疫功能改变可能会损害免疫监视机制,进一步促进癌变。
▼
恶性肿瘤的发展是一个多步骤的过程,病毒已被确定为肿瘤促进剂。肿瘤促进剂刺激信号通路和细胞增殖,最终导致癌症。
✦乙肝病毒、丙肝病毒感染易诱发肝癌
乙型肝炎病毒和丙型肝炎病毒感染是目前肝细胞癌最重要的全球危险因素,肝细胞癌是肝癌的主要组织学类型。
注:来自肝细胞癌高患病率地区的患者在诊断时往往比患病率地区的患者更年轻。
乙型肝炎病毒引起的慢性坏死性炎症性疾病会诱发肝细胞突变,估计发生肝细胞癌的风险为10-25%,并且取决于是否存在活动性乙型肝炎病毒感染或肝硬化。
丙型肝炎病毒是一种不整合到宿主基因组中的RNA病毒。丙型肝炎病毒引起的肿瘤发生可能是重复性损伤、再生和纤维化的结果,并且近90%的丙型肝炎病毒相关肝细胞癌之前有肝硬化。
扩展阅读:细菌,真菌,病毒——感染,免疫反应以及治疗用药差异
▼
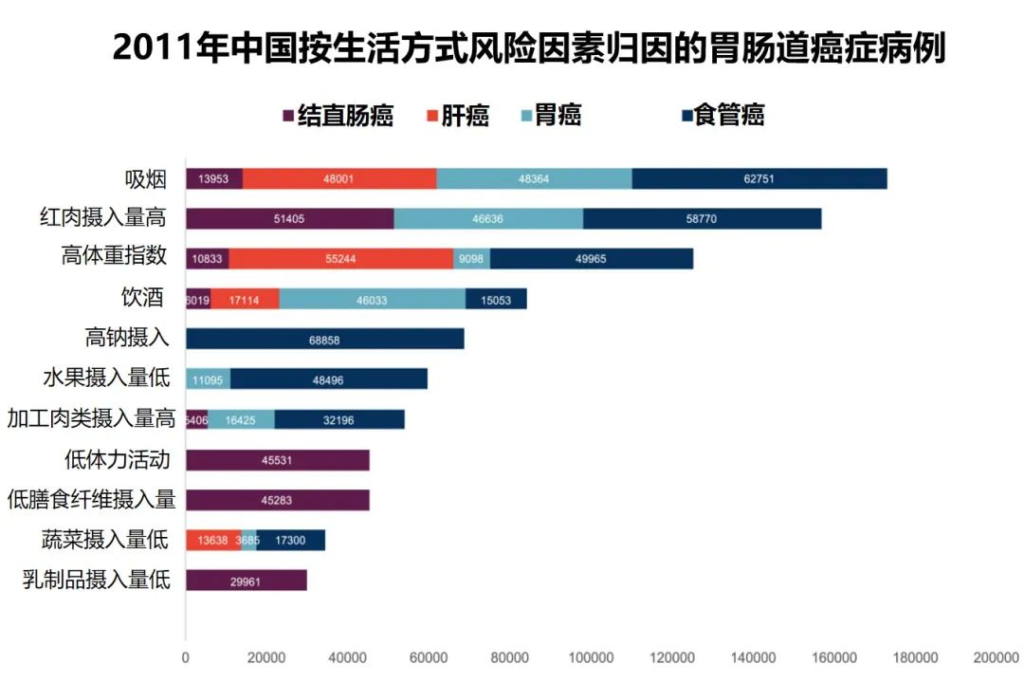
研究团队应用比较风险评估方法估计归因于每个风险因素的胃肠道癌症的人群归因分数
2011年中国不同生活方式危险因素的胃肠癌归因分数
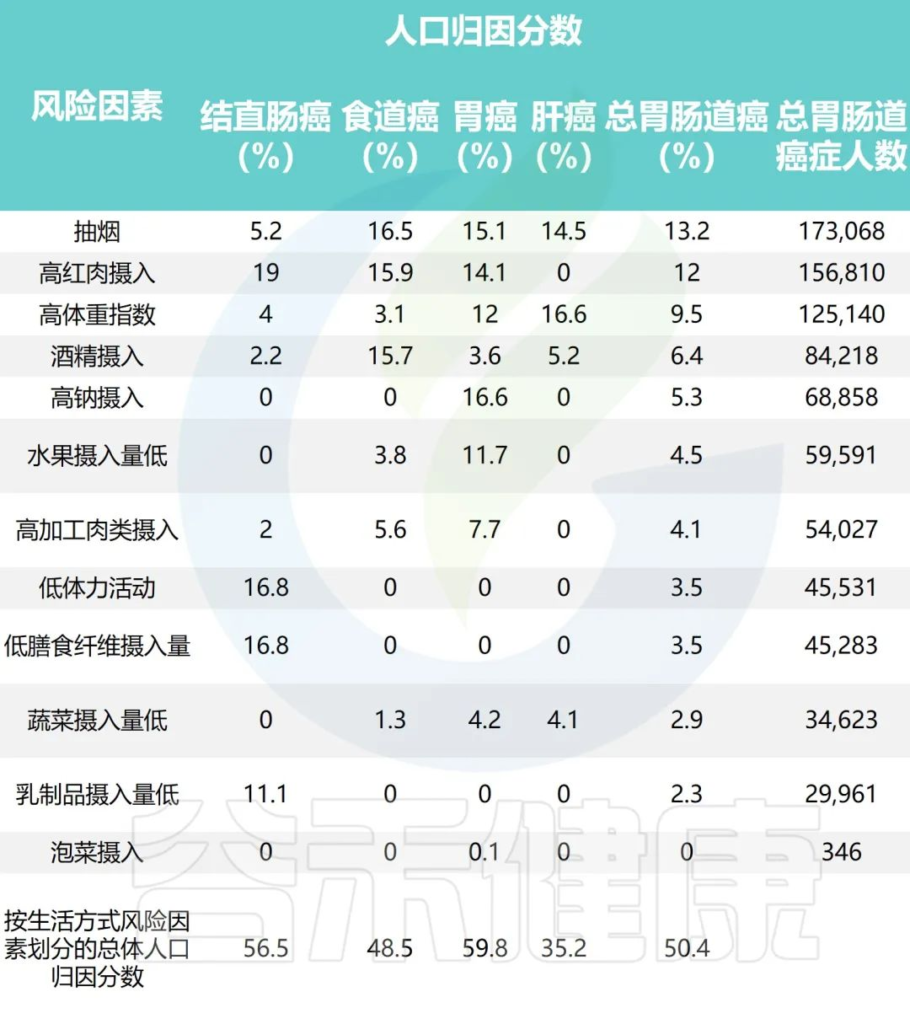
Wu Y,et al.Gastroenterology.2021
•高红肉摄入与51405例结直肠癌病例相关(PAF=19.0%)
•据估计,高身体质量指数(BMI)导致55244例新发肝癌病例 (PAF=16.6%)
•吸烟是食管癌的首要归因危险因素,占48364例病例 (PAF=16.5%)
•高钠摄入量与最多(68,858)例胃癌(PAF= 6.6%) 相关。
研究团队还根据1991年至2011年中国健康与营养调查估计了生活方式因素的时间趋势,同时预测了2011年至2031年生活方式因素的流行程度和胃肠道癌症的相关负担。
1991年至2031年按生活方式风险因素划分的胃肠癌病例的历史和预测趋势
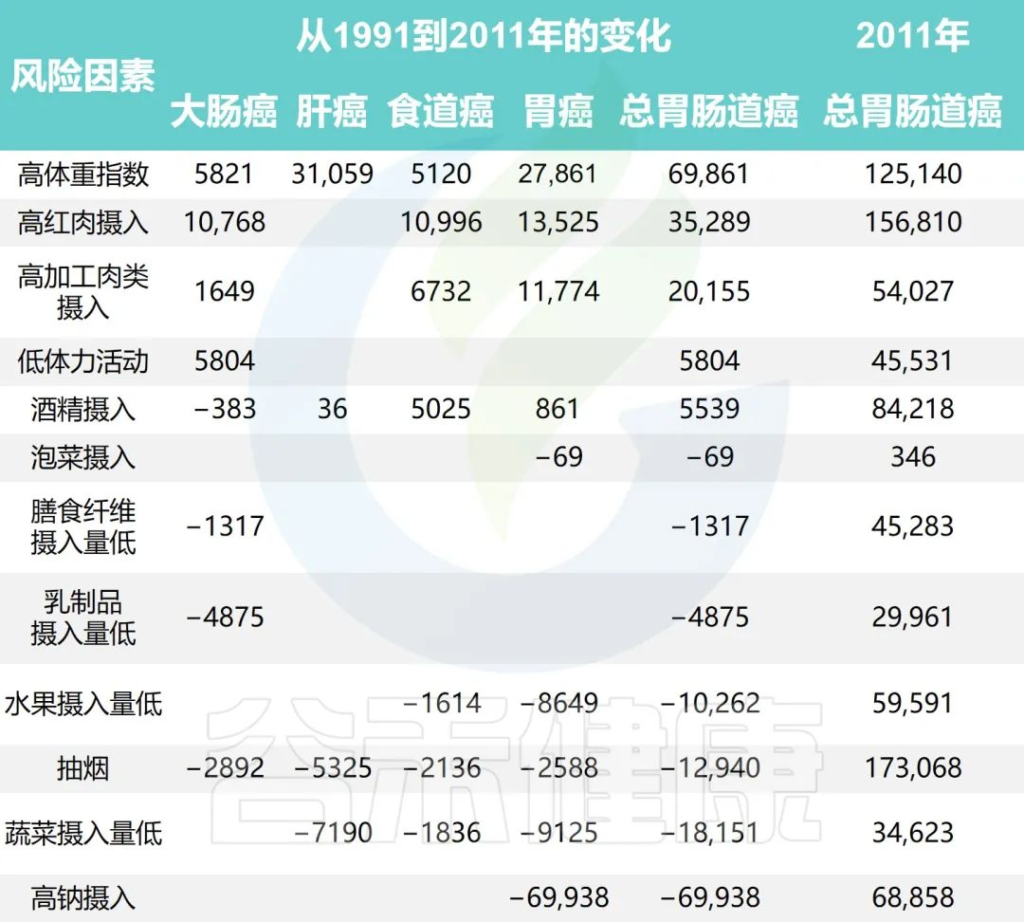
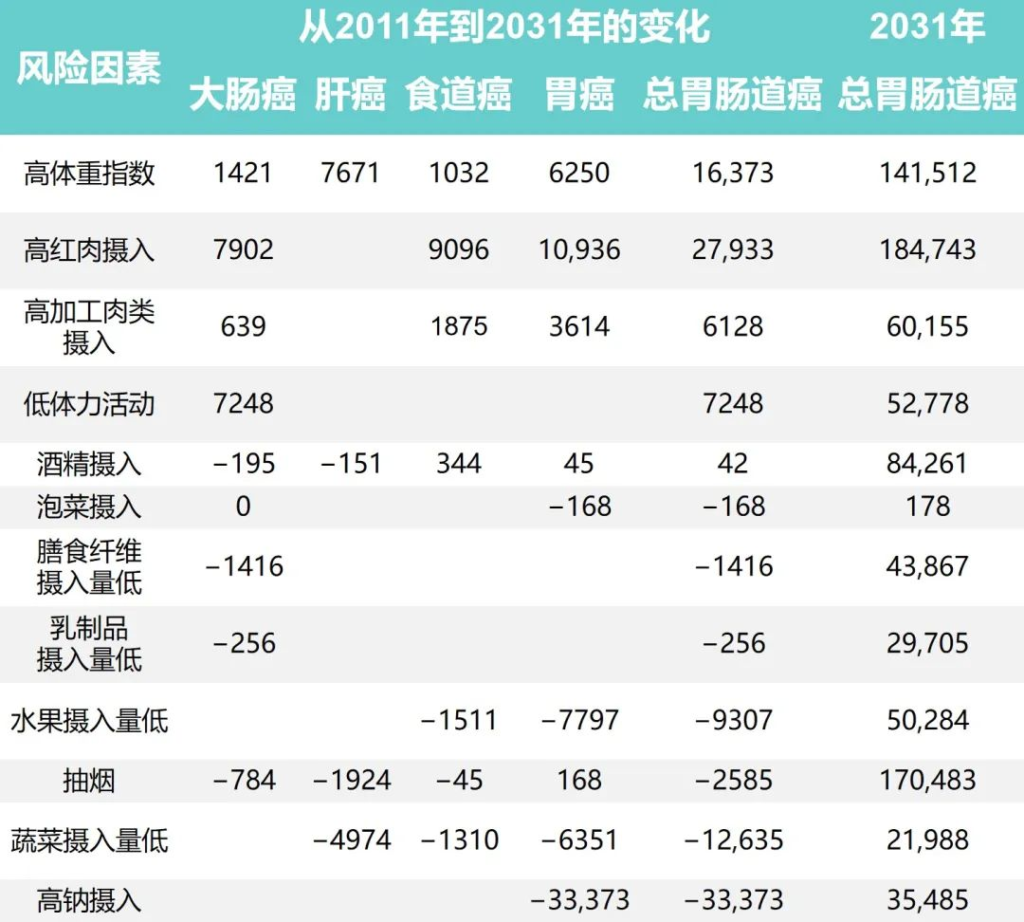
Wu Y,et al.Gastroenterology.2021
•钠摄入量降低减少了胃癌
随着时间的推移,钠摄入量、低蔬菜摄入量、低水果摄入量和吸烟情况有所改善。人口的平均钠摄入量已从1997年的7.5 克/天减少到2011年的5.6克/天,预计到2031年将进一步减少到3.3克/天。
相应的归因胃癌病例估计为138796、68858和 35484,每20年下降约50%。
•蔬菜、水果的摄入增加有助于减少胃肠道癌症
随着平均蔬菜摄入量从252.6克/天上升到323.8克/天,肝癌、食管癌和胃癌的相关数量从1997年的 52774例减少到2011年的34623例。
水果摄入量表现出类似的趋势,1997年总体水果摄入量为18.2克/天,2011年中国人水果消费量为69.6克/天,与1997年相比新增病例减少10262例;到 2031 年,由于水果摄入量增加,预计年发病率将再次下降。
扩展阅读:常见水果对肠道菌群、肠道蠕动和便秘的影响
•吸烟减少胃肠道癌症的发病率也减少
同时,与2011年和1991年相比,吸烟减少与胃肠道癌症事件减少12940例相关,预计2011年至2031年期间将进一步减少。
•饮酒使得胃肠道癌症病例增加
从1997年到2011年,与饮酒相关的胃肠道癌症病例增加了5539例,之后的预测趋势也稳定在每年约84000例。
•锻炼、乳制品和膳食纤维摄入影响结直肠癌
体力活动、乳制品和膳食纤维摄入量仅与结直肠癌有关。据估计,2011年身体锻炼不足与45531例结直肠癌病例相关,预计到2031年还会有7248例病例发生。
1997年、2011年和2031年的预计平均膳食摄入量乳制品分别为5.8克、12.4克和17.6克,膳食纤维分别为10.5克、10.8克和11.1克。2011年,摄入不足分别导致了29961起和45283例结直肠癌病例。
扩展阅读:
人类肠道微生物群在人类的健康和疾病状态中都发挥着重要作用。在过去的十年中,微生物与肿瘤之间的相互作用引起了人们的广泛关注,人们努力了解复杂微生物群落的各种特征,以及微生物群参与癌症预防、致癌和抗癌的可能机制。
大量研究表明,微生物失调通过多种途径促进癌症易感性。肠道微生物主要通过其细菌或分泌的代谢物成分导致消化道肿瘤的发生。
微生物群及其相关代谢产物不仅通过诱导炎症和免疫失调与致癌作用密切相关,还会干扰抗癌药物的药效学。
肠道微生物组与胃肠道癌症的关联
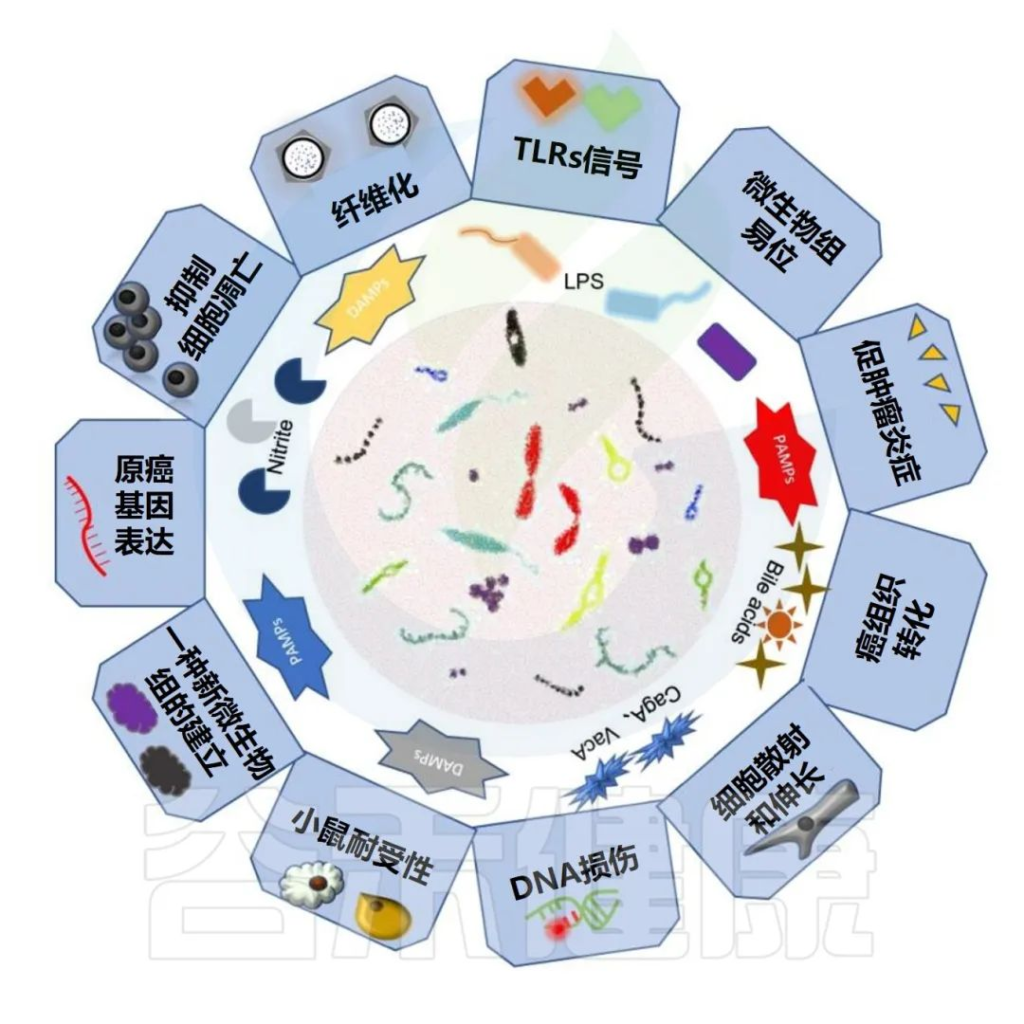
Tong Y,et al.Theranostics.2021
▼
√幽门螺杆菌影响胃癌患病率
胃癌被认为是一种与炎症相关的癌症。幽门螺杆菌(H.Pyloni)感染被称为I类危险因素,可以刺激免疫反应和炎症,调节许多信号通路,并诱发胃酸缺乏、上皮萎缩和发育异常。因此,有效根除幽门螺杆菌可预防胃癌。
癌蛋白细胞毒素相关基因A(CagA)和空泡毒素A(VacA) 是幽门螺杆菌的关键毒力因子。幽门螺旋杆菌感染会显著增加患胃癌的风险。
空泡毒素A可通过直接作用于线粒体 ,导致细胞空泡形成,并在人源性胃上皮细胞内诱导自噬 , 上调 MAP激酶和ERK1/2表达, 激活血管内皮生长因子, 上调细胞生长和分化所必需的 Wnt/β-catenin 信号通路, 抑制GSK3通过PI3K/Akt信号通路。
幽门螺杆菌感染个体中炎症细胞因子增加
在幽门螺杆菌感染个体的胃中发现炎症细胞因子的积累增加,包括干扰素-γ、肿瘤坏死因子、IL-1、IL1β、IL-6、IL-7、IL-8、IL-10和IL-18。
因此,多种类型的免疫细胞受到刺激,包括淋巴细胞、外周单核细胞、嗜酸性粒细胞、巨噬细胞、嗜中性粒细胞、肥大细胞和树突细胞。
包含ERK/MAPK、PI3K/Akt、NF-κB、Wnt/β-catenin以及STAT3的致癌通路的活性随着幽门螺杆菌的感染而上调。相反,肿瘤抑制通路因诱导的P53突变而失活。
此外,幽门螺杆菌感染可导致E-钙粘蛋白和抑癌基因的CpG 岛甲基化,包括编码三叶因子2(TFF2)和叉头盒转录调节因子(FOXD3)的基因,导致显著增加胃癌的风险。
扩展阅读: 正确认识幽门螺杆菌
√其他微生物群
目前的测序技术使研究人员能够深入研究肠道微生物群的复杂性。
幽门螺杆菌阳性个体的微生物群落特征是以下细菌的数量增加:
变形杆菌(Proteobacteria) ↑↑↑
螺旋体(Spirochaetes) ↑↑↑
酸杆菌门(Acidobacteria) ↑↑↑
而以下菌群的数量减少:
放线菌门(Actinobacteria) ↓↓↓
拟杆菌门(Bacteroidetes) ↓↓↓
厚壁菌门(Firmicutes) ↓↓↓
相反,幽门螺杆菌阴性个体携带更丰富的厚壁菌、拟杆菌和放线菌。
√肠道微生物失调增加胃癌发生率
微生物失调也与胃癌发生有关。使用定量PCR,已经表明胃癌患者的微生物群组成非常多样化。
例如卟啉菌属(porphyromonas)、奈瑟菌属(Neisseria)、苍白普氏菌(prevotella pallens)、Streptococcus sinensis的减少,以及大肠杆菌、 肺炎克雷伯菌(Klebsiella pneumoniae)、鲍氏不动杆菌(Acinetobacter baumannii)和毛螺菌科(Lachnospiraceae)的富集。
扩展阅读:
全面认识——肺炎克雷伯菌 (Klebsiella pneumoniae)
来源于幽门螺杆菌的致病成分,如外膜蛋白磷脂酶C-γ2、BAK蛋白和镍结合蛋白,帮助微生物在胃粘膜层定植,然后加剧胃炎的进程,最终增加胃中肿瘤发生的可能性。
肠道微生物与食管癌
据报道,食管癌与常见的潜在危险因素密切相关,如人类乳头状瘤病毒和EB病毒的感染,尽管致病机制仍有争议。除了病毒,细菌感染也会导致食管恶性肿瘤的形成。
√感染幽门螺杆菌的人群食管癌呈下降趋势
在最近20多年来,在感染幽门螺杆菌的普通人群中,食管腺癌的发病率呈下降趋势,尤其是在东部人群中。与此同时,食管鳞状细胞癌的发病率也有所下降。
胃食管反流病是巴雷特食管的主要原因,巴雷特食管是食管腺癌的一种癌前病变。通过抑制壁细胞功能或诱导萎缩性胃炎的发展,慢性幽门螺杆菌感染可以抑制壁细胞分泌盐酸,从而增加胃肠道的pH值,最终导致食管腺癌降低。
√食管炎患者体内肠杆菌丰度较高
与正常人群相比,食管炎和巴雷特食管患者胃中肠杆菌科的相对丰度更高。
有人认为,抗生素可能会改变胃食管反流病患者食道中的微生物组。定植在食管和胃中的肠道微生物群通过质子泵抑制剂(PPIs)的治疗而显著改变。然而,质子泵抑制剂引起的变化是否有益还没有定论。
最新的系统综述和荟萃分析表明,质子泵抑制剂不会减少发育不良和巴雷特食管相关食管腺癌的发展。
√食管中的微生物参与致癌过程
食道传统上被认为是无微生物的部位,只有有限的微生物来自吞咽和胃食管反流。通过应用16S rRNA 测序技术,发现一些特定的微生物栖息在食管粘膜中,包括厚壁菌门、拟杆菌门、变形菌门、放线菌门和梭杆菌门。
此外,与正常食管相比,食管鳞状细胞癌(I-II 期)和食管鳞状异型增生 (ESD) 患者的食管中发现了不同的微生物群落。
与正常胃粘膜微生物群一致,早期食管鳞状细胞癌和食管鳞状异型增生样本中最常见的门是变形菌门、厚壁菌门和拟杆菌门。当食管微生物群失调时,它们参与食管的致瘤过程。
已经发现人类远端食管具有其自身特征性的微生物群。包括厚壁菌门和链球菌在内的革兰氏阳性细菌在正常食管中占主导地位,而革兰氏阴性厌氧菌/微需氧菌,如拟杆菌、变形菌、梭杆菌和螺旋体,主要与食管炎和巴雷特食管有关。
注:脂多糖是革兰氏阴性菌细胞壁的重要组成部分,通过多种机制参与肿瘤发生过程。这些包括激活导致NF-κB激活的先天免疫反应, 促进包括IL1β、IL6、IL8和TNFα在内的炎症相关介质的释放和延迟胃排空。
▼
结直肠中的肠道微生物组是人体中最复杂的群落。细菌种群主要包括厚壁菌门和拟杆菌门和变形杆菌门。
√饮食、微生物代谢物影响结直肠癌
各种因素都会导致结直肠癌,而饮食是与结直肠癌相关的重要环境因素。许多不同的肠道微生物群代谢物具有致瘤或抗肿瘤特性。
在结肠细胞上表达的脂多糖受体抑制细胞死亡,通过Toll样受体2激活细胞免疫反应,然后刺激下游促炎细胞因子信号传导,导致肿瘤发生。
脂磷壁酸是一种来自革兰氏阳性菌细胞壁的元素,被认为是脂多糖的对应物。高脂肪饮食会增加硫酸盐还原菌的相对丰度,例如普通脱硫弧菌,它将初级胆汁酸转化为次级胆汁酸,如石胆酸和脱氧胆酸,具有潜在的致瘤性。
丁酸盐具有抗肿瘤作用
相反,丁酸是一种重要的短链脂肪酸 ,由结肠细菌从饮食中的可发酵纤维中产生,已被证明具有抗肿瘤作用。
参与发酵过程最重要的丁酸盐产生微生物群是普拉梭菌(Faecalibacterium prausnitzii)和直肠真杆菌(Eubacterium rectale)。
丁酸被结肠细胞中的线粒体利用,这有助于维持健康的能量平衡并有益于结肠上皮细胞增殖。GPR109a是一种在免疫细胞上表达的短链脂肪酸受体,主要激活丁酸的配体,然后抑制炎症细胞因子,从而抑制炎症过程。宿主免疫反应通过干扰素γ对抗DNA甲基化介导的GPR109a沉默,从而相应地促进抗癌作用。
丁酸通过诱导P21基因表达、抑制激活蛋白-1(AP-1)信号通路以及增加c-Fos和ERK1/2的磷酸化来发挥各种化学预防作用。此外,尿石蛋白如尿石蛋白A是水果和坚果的肠道微生物群代谢产物,含有大量鞣花酸。据报道,它们可以抑制Wnt信号传导,并显示出对癌症的益处。
扩展阅读:如何通过喂养菌群产生丁酸调节人体健康
√长期炎症容易导致结直肠癌
肠道微生物群引起的通路
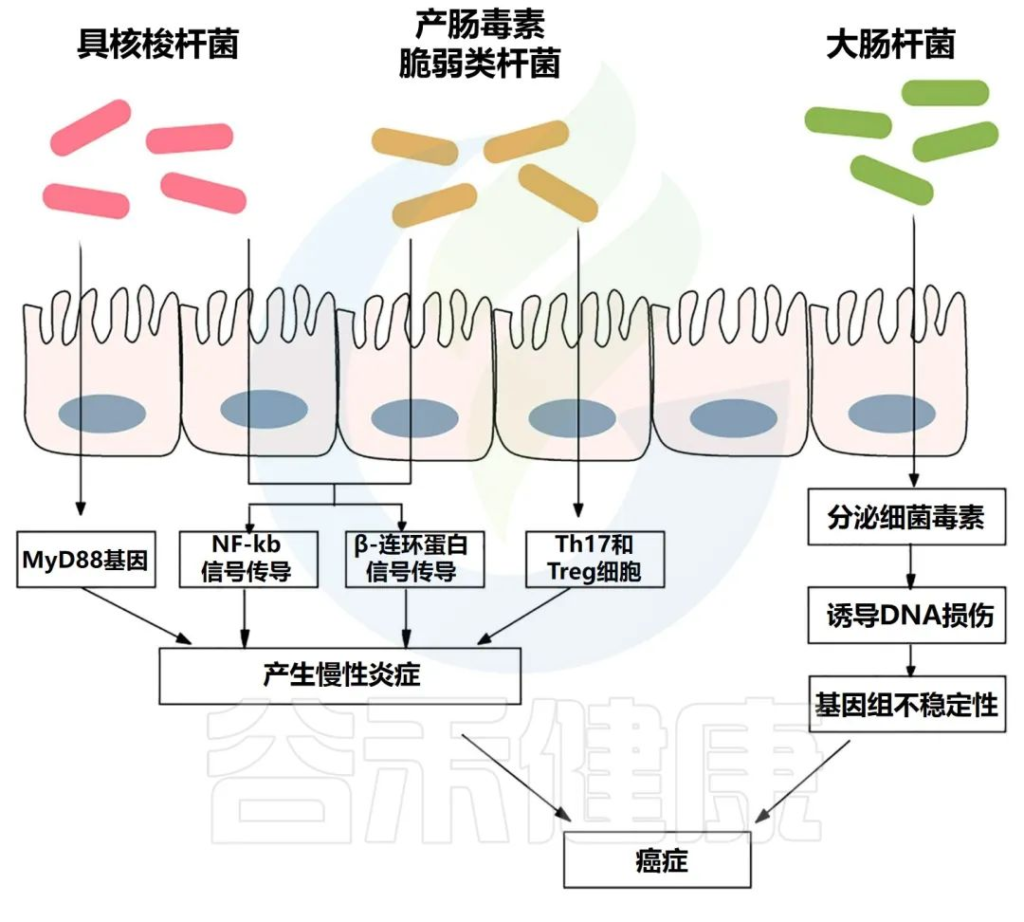
Si H,et al.Semin Cancer Biol.2021
慢性炎症会产生大量炎症介质,如肿瘤坏死因子、白细胞介素6、白细胞介素1b和其他细胞因子,它们会激活NF-κB,从而导致结肠癌发生。
炎症性肠病与更高的结直肠癌风险相关。例如,与局限性结肠炎患者相比,全结肠炎患者患癌症的风险更高。
与健康受试者相比,炎症性肠病患者的肠道微生物群具有较低的多样性和生态失调,其特征是厚壁菌门和拟杆菌门的丰度较低。
产肠毒素脆弱拟杆菌与炎症性肠病的存在显著相关。炎症性肠病和结直肠癌都有一个共同的过程,即转化生长因子-β (TGF-β)、TNFα、NF-κB、ROS 和其他信号分子水平升高,导致肠道微生物失调。
已经证明伴有炎症性肠病的结直肠癌患者比没有炎症性肠病的患者预后更差。
扩展阅读:肠道菌群失调与炎症性肠病的关联
√肠道菌群失调导致结直肠癌风险增加
如果肠道微生物群保持在失调状态,有益共生体的多样性和丰度可以最小化。一旦受干扰的微生物过度生长,它们就会产生积累的外毒素和内毒素。
如大肠杆菌的细胞致死性膨胀毒素和大肠杆菌素,痢疾志贺菌的细胞致命性膨胀毒素,脆弱芽孢杆菌的脆弱芽孢杆菌毒素,粪肠球菌的细胞外超氧化物和过氧化氢等。
这些细菌毒素能够直接或间接诱导DNA损伤、基因组不稳定、肿瘤发生和腺癌的侵袭。
此外,微生态失调导致结肠上皮细胞暴露于致癌物质的增加。未修复的DNA和碱基切除修复(BER)中间体的积累导致基因组不稳定,并最终致癌。
注意:微生物生态失调会使免疫反应失调并增加炎症,导致PIK3CA基因突变,这可能会加速结直肠癌的发生或生长。
//梭杆菌粘附素A可作为生物标志物
梭杆菌粘附素A(FadA)是一种由梭杆菌表达的细胞表面毒力因子,经常在腺瘤性息肉或结直肠癌患者中检测到。
FadA与内皮上的E-钙粘蛋白相互作用,并调节E-钙粘素/β-连环蛋白通路,导致转录因子、癌基因和炎症基因的表达增加。
它还促进梭杆菌粘附并入侵表达E-钙粘蛋白的细胞,从而直接影响上皮细胞的增殖和生长。最近的一份报告表明,结直肠癌组织中梭杆菌的总体丰度是邻近正常组织的400多倍。因此,FadA可能是结直肠癌诊断和治疗的潜在生物标志物。
▼
虽然肝脏通常被认为是无菌的,但肝脏环境受到胃肠道微生物群通过肝门静脉系统产生的病原体或代谢物的极大影响。
肝细胞癌和胆管癌是最常见的肝癌组织学类型。酒精性肝病、非酒精性脂肪肝以及食源性污染物黄曲霉毒素B1、乙型或丙型肝炎病毒感染被认为是肝细胞癌的主要危险因素。
值得注意的是,肠道菌群失调是非酒精性脂肪性肝病的主要诱因之一。
√肠道微生物失调会导致肝癌发生
肝脏通过过滤血流以及代谢和中和肠道微生物产生的毒素对宿主微生物群落产生重要影响。肠道微生物失调会导致肝癌发生,因为微生物群和微生物代谢物可被肝脏常驻免疫细胞检测到,并能够改变肝脏代谢。
肝细胞癌患者粪便中大肠杆菌的丰度远高于健康对照者粪便中的大肠杆菌,而迪茨氏菌科(Dietziaceae),假单胞菌属(Pseudomonas)和草酸杆菌科(Oxalobacteraceae)在胆管癌患者的胆管样本中比非胆管癌个体的样本更丰富。
据推测,肠道微生物的过度生长可能会促进肝癌的发展,这需要进一步探索。
√幽门螺杆菌促进肝癌的生长和迁移
幽门螺杆菌通常栖息在人的胃中。然而,来自肠道的幽门螺杆菌可以通过门静脉的血流到达肝组织,在吞噬消除后幸存下来,或者通过十二指肠反向迁移。
已在肝细胞癌患者的肝组织中发现幽门螺杆菌产生的代谢物 。已经表明,来自幽门螺杆菌的脂多糖通过增加白细胞介素8和转化生长因子β1的水平直接促进肝癌的生长和迁移。
作为螺杆菌科的一员,幽门螺杆菌通过激活NF-κB 和Wnt信号通路、肝细胞更新和氧化应激导致肝细胞癌的发展。
此外,一些螺杆菌属物种,如胆螺杆菌(H.bilis)、H.ganmani和H.hepaticus,与胆管癌特异性相关,但与胆管中的非肿瘤疾病无关。
√肠道微生物代谢物影响肝癌
微生物代谢物会扰乱肝脏中的代谢途径和免疫反应。
Toll样受体4(TLR4)识别来自细菌的脂多糖(LPS),并通过脂多糖诱导的TNF-β和IL-6激活库普弗细胞。它还可以通过上皮调节蛋白等生长因子刺激星状细胞,并启动各种炎症和致癌途径。LPS-TLR4通路可促进肝细胞癌,而去除脂多糖或Toll样受体4 基因失活可降低肝细胞癌的发展。
库普弗细胞——是位于肝脏中的特殊巨噬细胞,是单核吞噬细胞系统的一部分。
胆酸和鹅脱氧胆酸是肝脏产生的主要初级胆汁酸。它们通过增加活性氧的产生而导致DNA损伤,从而诱发肝癌的发展。
此外,胆汁酸也被证实可以调节肠道微生物群。胆汁酸数量减少会导致肠道菌群过度生长并加速炎症。梭菌产生的脱氧胆酸的肠肝循环会导致DNA损伤并在肝星状细胞中引发衰老相关分泌表型。
这个过程涉及许多炎症细胞因子和生长因子,从而导致炎症和肥胖相关的肝细胞癌转变。脱氧胆酸和石胆酸被证明可通过DNA损伤直接促进癌症。
▼
胰腺是胃外消化器官。胰腺导管腺癌(PDAC)是全球最致命的癌症之一,是最常见的胰腺癌类型。越来越多的研究表明,肠道微生物群可能通过促进炎症、激活免疫反应和使癌症相关炎症持续存在来影响胰腺癌发生。
√幽门螺杆菌感染是胰腺导管癌的风险因素
对数百项胰腺癌荟萃分析的回顾表明,幽门螺杆菌感染是胰腺导管腺癌的一个重要危险因素。除胰腺导管腺癌外,幽门螺杆菌还参与急性和慢性胰腺炎以及自身免疫性胰腺炎。
许多源自幽门螺杆菌的致病成分,包括氨和脂多糖,以及由此产生的大量炎性细胞因子,都会损害胰腺。
幽门螺杆菌感染激活NF-κB和AP-1,导致细胞过程失调。白细胞介素8水平升高会加速炎症反应,最终导致胰腺癌发生。
此外,幽门螺杆菌感染持续激活STAT3可通过上调抗凋亡和促增殖蛋白(包括Bcl-xL蛋白、MCL-1、生存素、c-myc和细胞周期蛋白D1)的表达来促进胰腺癌进展。
√炎症及免疫反应与胰腺癌
微生物引起轻微和持续的免疫反应和炎症反应,会导致胰腺癌的形成。
已经进行了许多研究来探索可能的机制。在各种免疫细胞上表达的toll样受体使免疫细胞能够识别多种微生物相关分子模式 (MAMP) 和非感染性炎症损伤相关分子模式 (DAMP),然后激活NF-κB和MAPK信号通路。这些过程引发并延续胰腺炎,最终促进胰腺癌的进展。
NLRs是细胞质模式识别受体(PRRs),参与NF-κB的激活和炎症小体的形成。P38丝裂原活化蛋白激酶(P38 MAPKs)对细胞因子有反应,参与细胞分化、凋亡和自噬,从而加速胰腺导管腺癌的过程。因此,P38抑制剂可能是治疗癌症的药物。
味觉受体2型成员38(TAS2R38)是一种苦味受体。有趣的是,T2R38不仅在口腔细胞中表达,也在胰腺癌细胞中表达。铜绿假单胞菌(Pseudomonas aeruginosa)是T2R38的独特配体,据称可激活 T2R38,诱导多药耐药相关蛋白1(ABCB1),并参与癌症侵袭和转移。
此外,梭杆菌属存在于8.8%的胰腺癌组织中。值得注意的是,梭杆菌属的状态是胰腺癌的一个独立的阴性预后生物标志物。
扩展阅读:梭杆菌属Fusobacterium——共生菌、机会致病菌、致癌菌
√其他肠道微生物对癌症的作用




Tong Y,et al.Theranostics.2021
研究显示生活方式对胃肠道癌症风险的影响越来越大。吸烟、饮酒、饮食构成、肥胖等都是影响胃肠道癌症的重要因素。
肠道微生物群与人类密切相关,在人类健康和疾病中也发挥着重要而独特的作用。肠道微生物群还能够与化学治疗剂和免疫治疗剂发挥协同作用。
基于对肠道微生物群的研究,人们也在探索新的治疗靶点,以及使用人类肠道微生物群的诊断、预测和预后癌症生物标志物。加速肠道微生物组研究在精准医学中的转化。
生活行为及肠道微生物群与胃肠道癌症之间的准确关系需要进一步探索,将对我们的日常生活和临床治疗将产生重大影响。
主要参考文献:
Jardim SR, de Souza LMP, de Souza HSP. The Rise of Gastrointestinal Cancers as a Global Phenomenon: Unhealthy Behavior or Progress? Int J Environ Res Public Health. 2023 Feb 18;20(4):3640. doi: 10.3390/ijerph20043640