 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
肠道菌群是健康和疾病的新领域。不仅许多疾病都与微生物群落紊乱有关,而且越来越多的研究指出了其因果关系。在目前我们所知的情况下,很难定义什么是健康的微生物群,这主要是由于个体间的高度可变性。那么,“弹性菌群”可用作健康菌群的替代物。此外,肠道菌群是最容易受到环境变化和损害的“器官”。
在个人的一生中,面临着不健康饮食,药物和感染等状况。恢复到出状况之前基线的能力受损可能导致菌群失调。因此,有理由假设,维持有弹性力的微生物群对健康很重要。本文综述了复原力的概念,有关弹性菌群特征的已知知识,以及如何使用高脂饮食干预的人类模型,通过实验评估微生物菌群的复原力。


可以通过维持微生物群恢复力的干预措施来了解哪些微生物群或功能会受到干预的干扰,并可以使用益生菌(如果有)替代减少的物种,或使用益生元进行强化。具有多种结构和组成的纤维也可以用于增加微生物群的多样性,微生物群的特征可能与弹性有关。最后,讨论一些未解决的问题和知识缺口。
人类肠道内有数万亿种微生物,大多数是细菌。这种微生物生态系统,即微生物群落,在人类生理和健康中起着至关重要的作用。肠道微生物群的研究历来集中在与肠易激综合征、炎症性肠病、过敏、糖尿病、癌症、哮喘和肥胖的关联。
一些研究已经超出了相关性,并基于人类粪便移植或人类微生物群转移至无菌小鼠的研究表明微生物群对某些疾病的致病作用。成人肠道微生物群是相当稳定的,同时不断受到宿主和多种外部因素的影响。在特别强烈的应激反应下,肠道微生物群可能会发生严重改变,这可能会影响个人的健康。
定义一个健康的微生物群对于预防或纠正失调,并将其对健康的影响降到最低非常重要。然而,微生物群的组成非常多样,变化很大,这取决于饮食、地理位置、种族、运动水平、药物使用(包括但不限于抗生素)和遗传学等。除了这些内在和外在因素,很大一部分个体之间的微生物群变化不能用任何特定的因素来解释。
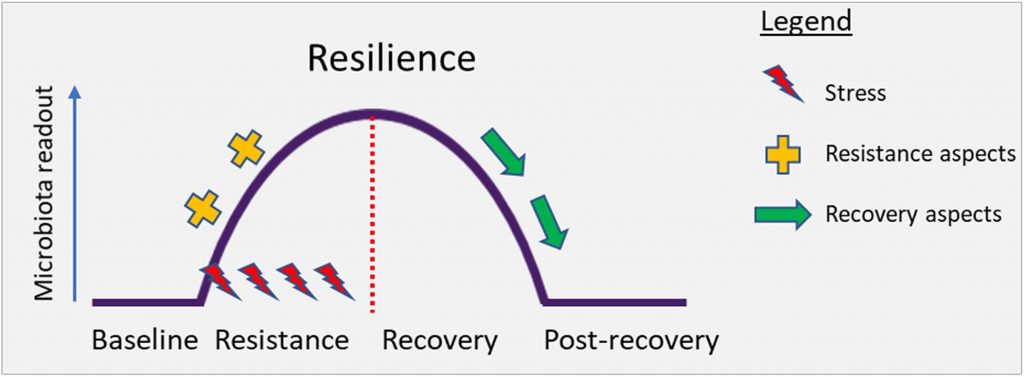
高度的变异性使得很难定义正常或健康的微生物群。然而,微生物多样性的某些特征,如微生物多样性的增加,通常被认为是肠道微生物多样性的增加。在确定肠道微生物群是否健康或有益生元时,也可以考虑对宿主(如肠道屏障功能和免疫功能)的影响。或者,在肠道微生物生态系统中,恢复力可以作为健康生态系统的替代标志。恢复力是其在压力下抵抗变化或从扰动中迅速完全恢复的特性。
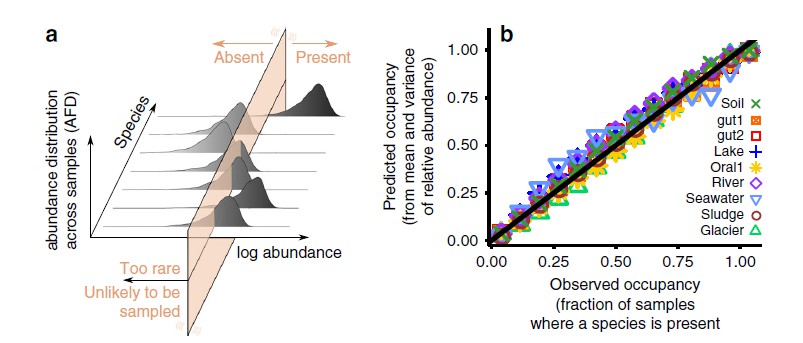
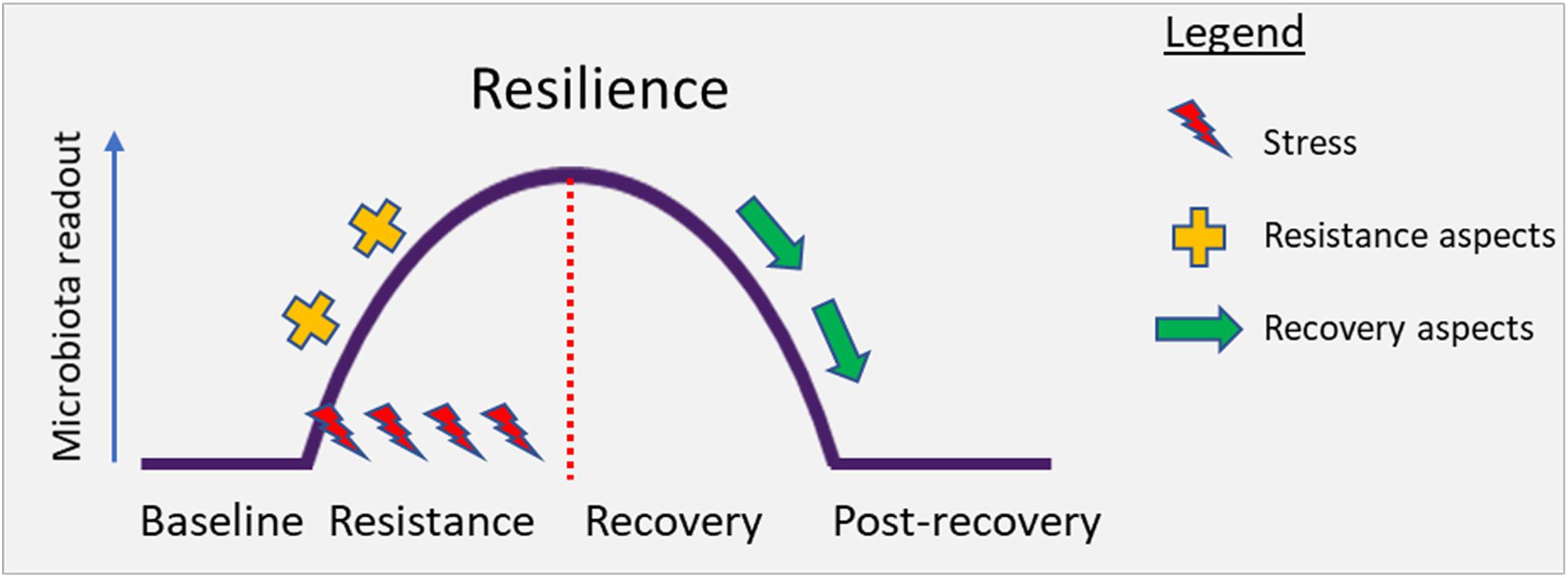
与功能和生命维持相互依赖联系在一起,人类肠道内的细菌被构造成一个复杂的生态系统,具有多重交互作用。这种肠道微生物生态系统在从新生儿到婴儿到幼儿的早期生命中演化和建立,在成人生活中基本保持稳定。外部压力因素,如极端饮食变化、感染、抗生素使用或其他药物,包括所有治疗类的成员都会扰乱这个生态系统。随后,这种肠道微生物生态系统可能恢复或恢复不到其原始状态(下图)。一个有弹性的微生物群在受到扰动后将恢复到原来的平衡状态,而非弹性微生物群将转向一个改变后的新状态。

描述生态系统的原生状态、扰动、回到原始状态或过渡到新状态可能性的概念图解
基线是发生扰动前生态系统的状态。
影响是由于压力源而引起的生态系统的变化。
恢复力是生态系统保持其状态并从扰动中恢复的特性。系统在冲击(阻力)期间持续存在的能力以及在干扰影响(恢复)后恢复到基线的能力决定了整体的弹性。从概念上讲,下面的图对此进行了说明。

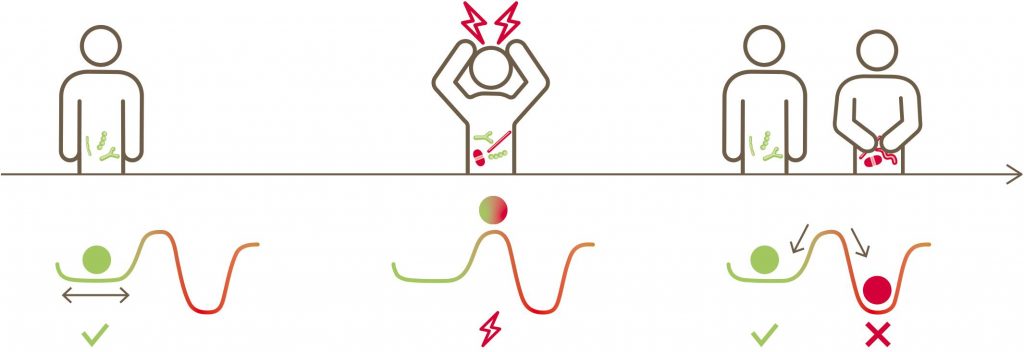
描述在压力下肠道微生物群的扰动的概念图解。弹性描述了生态系统维持其状态或从干扰中恢复的能力。弹性取决于减少冲击(抵抗)和从干扰影响中恢复(恢复)的能力
可以说,一个健康个体在受到刺激后能够迅速、完全恢复到基线水平的微生物群是一个健康的微生物群,因为这种恢复力可能会阻止新平衡偏向失调方向,从而阻止对个人的健康产生负面影响。
肠道弹性的概念已经在一些文章中进行了讨论。正如最近提出的,一种结合挑战性测试和生物标志物的模型,可以告知微生物群恢复的动态,从而记录恢复力作为健康的指标。然而,这些建议仍然是理论上的,据我们所知,关于弹性量化模型的实验验证还没有报道。
微生物多样性可能对恢复力起到积极作用。Tap等人发现,当膳食纤维摄入量增加时,人体肠道微生物群的丰富性提高了其稳定性。另一项人类研究表明,抗生素引起的微生物群扰动较弱,与刺激前微生物群多样性较高有关。
宿主免疫状态也可能影响微生物群的恢复力。两项研究表明,基因消融小鼠体内的细菌传感器nod2会导致微生物群从抗生素干扰中恢复受损。然而,第三项以aroA缺陷沙门氏菌为干预的研究并没有发现nod蛋白对微生物群恢复力有任何影响。Nod是一种免疫信号的细胞内传感器,对特定的肽聚糖结构特别敏感,因此反应性可能取决于干预中使用的病原体。这些基础研究表明,宿主微生物群共生的稳定性可能是评估恢复力的另一个重要指标。
一些作者试图模拟肠道微生物生态系统的稳定性和恢复力。Shaw等人使用稳定性景观框架模拟抗生素治疗后肠道微生物群的恢复力。某些其他方法,如增加的自相关和“主导”群体中变量的方差,可以作为关键过渡到替代稳定状态的早期指标。
一项研究集中于通过研究特定微生物群落物种的分布来定义微生物群落中的“危机元素”,并发现与宿主参数相关的双峰分布。有些细菌要么几乎不存在,要么相当丰富,这取决于某些宿主因素,而且可能是那些与改变状态有关的细菌。
文献中描述了一些恢复力公式。最近对其中的大部分进行了审查,并将其归类为一个概念框架。简言之,这些公式可分为三类指标:一类指标描述了相对于干扰前状态基线的变化,从而评估系统受到干扰的程度;另两类指标考察干扰后的恢复情况。这种恢复既可以表示为相对于基线,也可以表示为相对于扰动的大小。前者强调系统恢复到扰动前状态的程度。后者强调它从扰动的影响中恢复了多少。
为了实验性地评估微生物群的弹性,必须对微生物群提出挑战,并测量一些或所有上述参数。一些研究使用抗生素或饮食干预来扰乱微生物群,并评估各种干预措施对这种干扰的影响。
大卫等人的一项研究为在人体试验中研究微生物群的恢复力提供了一个很好的模型。它所面临的干预是动物性饮食(如肉、奶酪),由70%的脂肪、0%的碳水化合物和30%的蛋白质组成。在饮食干预2天后,微生物群组成就发生了显著变化,并在饮食干预结束后6天恢复到基线水平。使用饮食干预的好处是它可以标准化,并且不会像在健康受试者中使用抗生素那样引发伦理问题。

弹性指数可以通过使用已知受压力影响的参数(如微生物群组成、功能和/或代谢物)来计算。弹性指数可用于定量衡量微生物群偏离的程度以及恢复的速度和充分程度,从而量化弹性。这种弹性指数提供了一种测量方法,可以用来比较不同的压力源。
理想情况下,一个人应该能够在不施加压力的情况下评估个人的微生物群弹性。综合大数据的机器学习可以帮助设计基于微生物群和宿主参数的算法,用于预测微生物群的弹性。其中一个参数是α-多样性。这一点得到了一项人类研究的支持,该研究表明,抗生素引起的微生物群扰动较弱,与干预前较高的微生物群α-多样性有关。
一项将微生物群转移到无菌小鼠中的研究表明,抗生素引起的扰动程度取决于供体,这为在没有干预的情况下通过分析基线微生物群来预测恢复力的假设提供了依据。
如上所述,在整个生命周期中,肠道微生物群都会受到反复而多样的干预,包括不健康的饮食、药物、酒精、剧烈运动和病原体等。抵抗这些干预的能力下降或迅速完全恢复到干预前状态的能力可能导致新的平衡和失调,这可能有助于慢性非传染性疾病(CNCDs)的发展。在接受抗生素治疗的人类受试者中,观察到微生物群恢复基线和建立新平衡的能力减弱。因此,干预以维持微生物群处于弹性状态可能是一种措施,以延迟或阻止微生物群相关的CNCDs的发展。值得注意的是,微生物群构成了一个易于接近的干预“器官”,尽管如何稳定地调节微生物群可能不那么明显。
这种微生物群恢复力与健康之间的联系的理论很有吸引力,但支持它的数据却很少。在人类研究中,Mondot等人将微生物群落稳健性定义为物种丰富度高和OTU(操作分类学单位)之间的高度相关性。他们发现微生物群落的稳定性与回肠结肠切除术后克罗恩病的缓解呈正相关。
了解弹性微生物群的特征将有助于设计旨在提高弹性的干预措施。虽然这方面的知识目前还不完全,但已经知道微生物多样性可能是一个影响因素,膳食纤维可能是增加微生物多样性的一种方式。膳食纤维是碳水化合物聚合物,在上消化道中不被消化吸收,到达结肠,在那里受到细菌发酵。许多研究表明,纤维会影响微生物群的组成和功能,尤其是短链脂肪酸的产生。对不同地理位置的人类的研究表明,摄入更多的膳食纤维与肠道微生物群多样性增加有关,人类干预研究表明,膳食纤维和全谷类食物的摄入增加了肠道微生物群的多样性。


微生物群落多样性原则上也可以通过膳食纤维的复杂混合来增加,如至少一项小鼠研究所示,它提供了广泛的结构和单糖单元。在小鼠身上的一项研究表明,纤维对改善微生物群的恢复力有直接作用。在这项研究中,喂食富含纤维的饮食并用抗生素和艰难梭菌(原为梭状芽孢杆菌)激发的小鼠的微生物群恢复到激发前的组成,而喂食低纤维饮食并以同样方式激发的小鼠的微生物群则没有恢复。
已发表的关于人类微生物群的数据显示,许多物种通常受到干扰。这些可能是脆弱的物种,可以通过营养干预来促进或补充。例如,B. adolescentis是高脂肪饮食中减少最多的菌群。此外,在抗生素的作用下,该菌数量急剧减少,恢复缓慢。因此,有理由提出并(i)检验假设,将B. adolescentis作为益生菌混合物的组成部分可以提高微生物群的弹性,(ii)排除Bifidobacterium adolescentis只是一种生物指示剂的可能性。其他作为益生菌存在的双歧杆菌和乳杆菌物种,如长双歧杆菌、双歧杆菌、B. angulatum 和 L. casei,也会因对微生物群的干预而发生变化,尽管不像B. adolescentis那样剧烈,因此,可以成为弹性混合营养液的一部分。
并非所有干预中减少的菌都以益生菌的形式存在,但已知能够促进这些物种生长的成分也可以用来防止它们在干预期间和之后的下降。例如,菊粉有利于 B. adolescentis 和 Faecalibacterium prausnitzii 的生长。F. prausnitzii 是一种有益菌,当微生物群受到抗生素或高脂肪饮食的干预时,它就会减少,并且与腹泻的恢复有关。
以促进某些菌为目的的饮食干预必须谨慎地进行,以避免目标物种变得过于突出,从而对物种多样性产生负面影响,这将与预期的效果相违背。
两项研究调查了益生菌对抗生素干扰微生物群的影响,以确定它们是否能提高恢复力。一项研究表明,补充鼠李糖乳杆菌和瑞士乳杆菌对抗生素阿莫西林+克拉维酸引起的微生物群扰动没有影响,而另一项较早的研究表明,混合益生菌(B.lactis Bl-04, B. lactis Bi-07, Lactobacillus acidophilus NCFM, Lactobacillus paracasei Lpc-37, 和 Bifidobacterium bifidum Bb-02),将阿莫西林+克拉维酸引起的粪便微生物群破坏降至最低。本研究中的益生菌组,通过随机片段长度多态性(RFLP)分析显示出明显的恢复趋势,此外,通过细菌培养可显著提高耐药性。
除了修复微生物群的组成外,还需要考虑如何将受到干扰的微生物群对宿主的影响降至最低。菌群失调通常会导致炎症和肠道通透性增加,进而对微生物群产生负面影响。
为了打破这一恶性循环,混合益生菌(如鼠李糖乳杆菌GG)或显示可增强肠道屏障(如植物乳杆菌)的益生菌混合物,可能是通过作用于宿主生理学来改善微生物群的一个很好的补充方法。
还有许多问题有待回答,即还有哪些参数能使微生物群具有弹性。关键物种的作用必须确定,而且可能很重要。这些分类群被认为与大量其他分类群相互作用,可能有助于维持微生物群落的状态。目前,关键物种在微生物群恢复力中所起的作用尚未阐明,仅提出了一些候选关键物种(例如,瘤胃球菌)。
稀有物种呢?通常,丰度低于某一阈值的分类群被合理地排除在分析之外,因为极低的数字和零之间的差异可能是由于方法敏感性而不是生理差异。这一方法可用于与恢复力相关的研究,因为低丰度类群的消失可能比丰度类群的大量减少更为相关。如果提供重要功能的低丰度物种灭绝,这种不可逆的事件可能会将微生物群转移到另一种稳定状态,这可能是迈向菌群失调的一步。
关于物种层面的知识是否足够可靠以进行干预,这个问题仍然悬而未决。益生菌的好处是已知的菌株依赖性。因此,提供一个特定的菌株来取代一个减少的物种可能行不通,如果它是另一个具有不同功能的受干扰菌株。分析技术还需要进一步改进,因为目前的鸟枪式宏基因组微生物群分析技术允许在物种级别进行区分,但很少在菌株级别进行区分。
其他领域的肠道微生物在微生物群落弹性中的作用仍有待阐明。大多数微生物群的研究都集中在细菌上,但古细菌、真核生物和病毒也存在于肠道中。一些研究发现病毒组、真菌或古细菌的组成与人类疾病(包括2型糖尿病、炎症性肠病和肥胖)之间存在关联。有趣的是,一项研究显示,在易患1型糖尿病的儿童中,病毒组多样性在自身免疫发生之前减少。
关于共生肠道微生物之间的相互作用知之甚少。据我们所知,没有研究表明病毒、古生菌和真菌在哺乳动物肠道微生物群恢复力中的作用。然而,细菌以外的其他微生物也有可能在恢复力方面发挥作用,尤其是噬菌体,因为它们有能力感染和溶解特定的细菌,从而可能控制它们的数量。
另一个重要的问题是,肠道微生物群的弹性是特定于压力的,还是与压力性质无关的弹性程度相似?目前这个问题还没有实验性地解决。
本文总结了造就有弹性的微生物群的因素,以及如何设计一种有效的营养干预策略来提高恢复力。提高微生物群的恢复力可能对健康产生重要的有益影响。目前的知识虽然不完整,但包含了足够的信息来证明和指导第一代解决方案的人体试验的设计。随着我们对微生物群恢复力机制的进一步了解,未来的新发现将用于设计下一代干预措施的组成。
参考文献:
Shaillay Kumar Dogra, Joel Doré, Sami Damak, Gut Microbiota Resilience: Definition, Link to Health and Strategies for Intervention,Front. Microbiol., 15 September 2020

谷禾健康
过敏在日常生活中越来越常见,包括哮喘,食物过敏,过敏性鼻结膜炎,特应性皮炎等,是全球范围内最普遍的慢性炎症性疾病。

最近的证据表明,除了遗传易感性,现代化导致的生活方式的改变也发挥了重要作用。其中包括剖腹产的增加,生命早期使用抗生素的情况增加,西方化饮食和肥胖的发展,以及室内外生活方式和活动模式的变化。
这些因素大多直接或间接影响各种微生物的形成,包括细菌、病毒和真菌;而微生物在形成(早期)免疫反应方面发挥主导作用。在环境和生活方式风险因素的影响下,这种默认程序明显受到干扰。
近日,来自德国实验室医学研究所的Harald Renz等人在《Nature》发表一篇名为“Early life microbial exposures and allergy risks: opportunities for prevention”的文章,概述了与微生物接触变化有关的过敏风险因素,并重点介绍了预防过敏的机会。

在胃肠道、皮肤、口腔、鼻腔和泌尿生殖道中发现了广泛的细菌群落,其中肠道的细菌群落是研究得最好的。细菌定植在出生后几个小时开始,并在出生后的第一个月内形成,主要取决于婴儿的营养来源。
母乳喂养的婴儿表现出双歧杆菌(Bifidobacterium)、乳酸杆菌(Lactobacillus)和韦荣氏球菌(Veillonella)的优势,随着辅食的引入,这一优势转变为拟杆菌(Bacteroides)和梭状芽孢杆菌(Clostridiales)。
由于营养来源的原因,某些菌株具有明显的优势,但生命最初几年的微生物群在分类单元水平上具有很大程度的个体间和个体内异质性。
总的来说,随着时间的推移,微生物群落的多样性和丰富性不断增加。
然而,生命的最初几年也是微生物群发展的一个非常脆弱的时期,感染、发烧和抗生素治疗的发作等事件都会对微生物群产生直接或间接的影响,而且这些变化有些会随着时间的推移而持续。超过一定年龄(通常定义为3-4岁),微生物群达到稳定的组成,并持续到成年。
现在已经确定,早期生命的微生物群在形成耐受性免疫功能、防止针对自身抗原和非自身抗原(例如,过敏原)的不良炎症反应方面具有重要作用。
耐性微生物的突出例子包括脆弱类杆菌(Bacteroides fragilis),它能产生多糖A通过Toll样受体2(TLR2)诱导调节性T细胞(Treg细胞)发育; 梭状芽胞杆菌簇IV和XIVA通过转化生长因子-β(TGFβ)诱导Treg细胞。以及其他未分类的共生菌,诱导结肠Treg细胞表达视黄酸受体相关的孤儿受体-γt (RORγt)或通过TLR-和MyD88依赖途径从初始CD4+T细胞诱导Treg细胞。
此外,营养素在促进这一微生物群-免疫轴中也起着重要作用。一个突出的例子是厚壁菌门的某些成员对淀粉的发酵,产生了短链脂肪酸(SCFA),例如丁酸。丁酸作为组蛋白脱乙酰基酶抑制剂,有利于叉头盒蛋白P3(FOXP3)的表达,因此增强了诱导的Treg细胞的抑制功能。粪杆菌(Faecalibacterium), 乳杆菌(Lactobacillus)和韦荣氏球菌(Veillonella)均属于厚壁菌门。
许多过敏和特应性患者的微生物菌群改变,主要是通过评估粪便微生物菌群来确定的。异位性皮炎患者皮肤微生物群中也有菌群失调,哮喘患者,上呼吸道和下呼吸道微生物群和食物过敏者胃肠道中也有菌群失调。甚至在临床体征和症状发作之前就可以检测到菌群失调,并且纵向研究表明,粘膜和皮肤表面微生物定植的干扰与慢性炎症反应的发展之间存在因果关系。
人体病毒包括感染宿主的病毒(真核病毒),宿主染色体中可改变宿主基因表达、表达蛋白质甚至产生感染性病毒(原噬菌体、内源性逆转录病毒和感染病毒成分)的病毒来源的基因突变,以及感染细菌微生物群成员的病毒(最重要的噬菌体)。
此外,所有成年人都长期感染病毒,这些病毒可能是常见病原体,罕见病原体或未知病原性病毒。
在婴儿肠道中发现了多种噬菌体和偶发性真核病毒。几种致病性真核病毒(例如HIV,巨细胞病毒,人乳头瘤病毒,水痘带状疱疹病毒和风疹病毒)可能会在子宫内或阴道分娩时传播给后代。
此外,尽管子宫内病毒尚未完全鉴定,但在羊水中已检测到真核病毒[如呼吸道合胞病毒(RSV),爱泼斯坦-巴尔病毒和单纯疱疹病毒],没有明显的临床意义。饮食,生活条件,水质,卫生和社会经济状况等环境因素都可能影响肠道病毒的组成。双胞胎婴儿之间的密切接触也会影响病毒的共享。
与肠道细菌菌群相似,肠道病毒在婴儿期是动态的,在成年后是稳定的。
婴儿的噬菌体多样性较高,而成年人则较低,而一生之间个体间的病毒变异仍然很高。早期婴儿肠道病毒包括高度丰富和多样的噬菌体群落。
从出生到2岁,真核生物的病毒和细菌的菌群都会扩展,但这伴随着噬菌体病毒的组成的收缩和向着以微病毒科为主的群落的转移。肠道真核病毒(如小RNA病毒科、腺病毒科和呼肠孤病毒科)在婴儿中偶尔被识别,而不是在早期发育过程中持续存在。
人类真菌群落的多样性和丰度都不如细菌群落。婴儿出生后不久通过护理人员和环境被真菌侵染,主要是枝孢菌属(Cladosporium)、隐球菌属(Cryptococcus)、酵母菌属(Saccharomyces)、念珠菌属(Candida)和马拉色菌属(Malassezia)。在健康成年人的大便中,后三种也是占优势的。
与环境相比,人类的真菌类群显示出更低的多样性,与特定解剖部位的关联显示出真菌的选择和适应性。
例如,皮肤真菌因年龄和性别而异,并且与成年人相比,儿童的真菌更多,多样性更高。这种变化可能与皮脂组成和皮脂腺活化的差异有关。马拉色菌占据大多数皮肤部位,并产生一种芳基烃受体配体,支持上皮细胞并提供紫外线保护。
过敏风险始于子宫内,并在出生后持续,与分娩类型和抗生素使用等重要因素有关,这些因素会影响婴儿肠道和呼吸道的微生物定植。这些因素的影响可能是累积的和剂量依赖的,可能会长期影响免疫稳态和哮喘和过敏发展的风险。事实上,早期的微生物群对于适当的免疫发展和有益于整体健康状况至关重要。
在过去的几十年里,无论是发达国家还是发展中国家,剖腹产的婴儿数量都有了相当大的增长,这就提出了高剖产率是否导致了过敏的增加。
尽管许多关于分娩方式对儿童健康影响的研究已经发表,但证据仍在争论之中。据报道,与阴道分娩相比,剖腹产婴儿发生食物过敏的风险增加,其中最有力的证据表明牛奶过敏。
一项相关研究的荟萃分析显示,剖腹产婴儿随后患哮喘的风险增加了约20%。
剖腹产和哮喘之间的联系得到了最近一些研究的支持,但没有其他研究支持。
剖腹产与特应性皮炎之间的关系尚不清楚。
剖腹产可能有几个潜在的机制作为过敏的危险因素。一种可能的机制是对新生儿早期微生物群发育的直接影响。然而,作为许多剖腹产婴儿接受围产期抗生素预防,这也可能是风险的一部分。
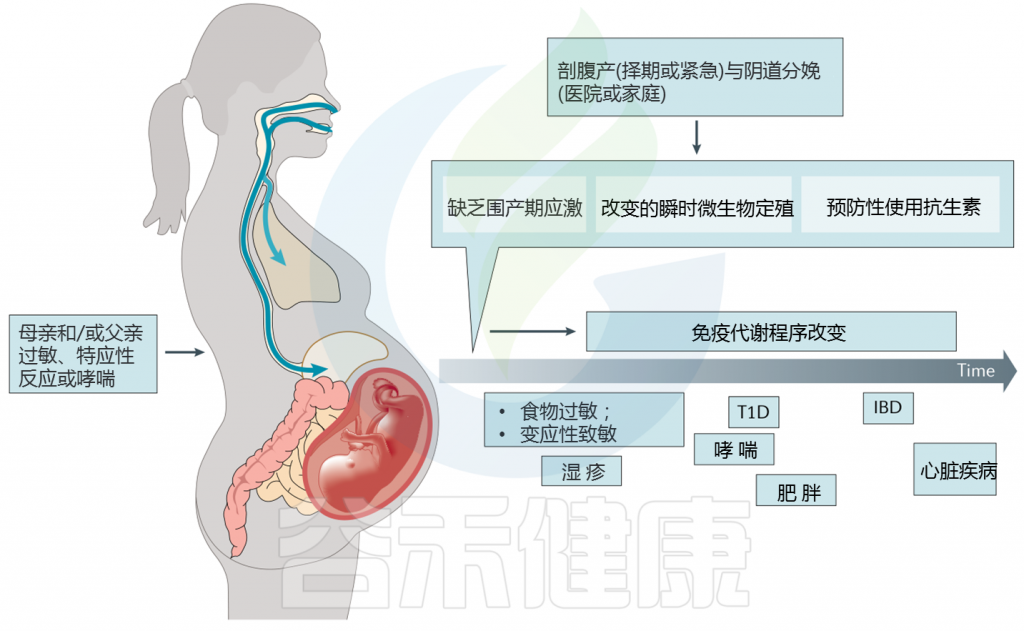
此外,与阴道分娩相关的围产期应激因素的缺乏(例如,早期深层免疫激活伴新生儿白细胞增多和其他变化)也可能起作用。分娩方式塑造了出生后的早期微生物模式(图1)。
图1 剖腹产是慢性免疫和代谢性疾病发生的重要危险因素

与非孕妇相比,正常孕妇的阴道微生物群特别是四种乳酸菌系统类型(Limosilactobacillus vaginalis, Lactobacillus jensenii, Lactobacillus crispatus,Lactobacillus gasseri)的丰度相对较高,其他22种菌的丰度较低。这一特征表明,在整个怀孕期间,特别是当雌激素浓度高达时,稳定性相对较高。
雌激素有利于阴道上皮细胞的成熟,这导致糖原的积累,而糖原被乳酸菌代谢成乳酸,这表明阴道上皮细胞和驻留的微生物群之间存在重要的功能关系。
阴道分娩的婴儿获得的细菌群落(皮肤、口腔和鼻咽表面)与母亲的阴道微生物群(主要是乳酸杆菌、普雷沃特菌和/或鼻咽分泌物)非常相似,而剖腹产婴儿体内的细菌群落更像母亲的皮肤表面,以葡萄球菌和丙酸杆菌为主。
在接下来的几个月里,口腔微生物群经历了显著的重组:分娩时,主要由丙酸杆菌或乳酸杆菌组成新生儿口腔微生物群,而在6周大时,大多数口腔样本中以链球菌为主。
过敏和哮喘的另一个微生物危险因素是1个月时艰难梭状芽胞杆菌定植,这与以后的哮喘和特应性皮炎有关。艰难梭菌定植与剖腹产和分娩地点(家庭阴道分娩与医院阴道分娩)有关。
在母亲和/或父亲患有特应性和过敏的儿童中,剖腹产与生命后期出现各种过敏表型的风险相关性最高。该观察结果是基因-环境相互作用与个体过敏风险状况有关的重要例子。
特应性母亲的2型炎症水平高,对胎儿的免疫程序有很大影响。剖腹产衍生信号可能会进一步加速和加重受干扰的新生儿程序。这在韩国人群的特应性皮炎中得到了证实,其中遗传风险因素(某种母体IL13多态性)和环境因素(分娩方式)共同影响了疾病的发展。
剖腹产对新生儿免疫程序有很大影响,这表现在TLR1或TLR2刺激后促炎性细胞因子反应减少,出生时肿瘤坏死因子(TNF)和IL-6水平降低,随后鼻咽间隙的细菌定植丰度更高,并与儿童哮喘有关。这些数据和其他数据为分娩方式,微生物定植和新生儿免疫程序之间的强有力的调节循环的一个例子,这些循环对过敏风险具有协同作用。
最近进行了一项初步研究,其中将剖腹产出生的婴儿暴露于分娩前1小时收集的母体阴道液。新生儿微生物群发育的后续分析表明,肠道,口腔和皮肤表面富含阴道细菌,而剖宫产分娩的婴儿中阴道细菌的代表性不足(例如放线菌,拟杆菌和双歧杆菌)。 尽管仍然需要研究对新生儿免疫代谢功能和对生命后期健康状况的长期影响,但这些数据表明,早期定植模式易于操作。
由于在怀孕期间(图2a)和生命的最初几年(图2b),抗生素的使用已大大增加,因此越来越有兴趣研究在此关键时期使用抗生素与生命后期对健康结果的影响之间的潜在关系。
图2 过敏和哮喘发生的产前和产后危险因素
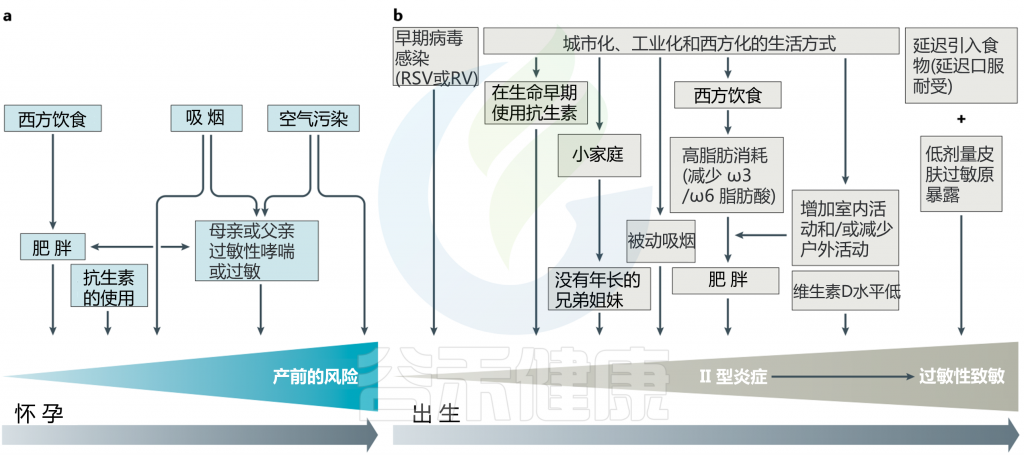

据报道,儿童肥胖症型糖尿病,哮喘和(儿童)炎性肠病之间,抗生素的使用与疾病的发展呈正相关。 在生命的头6个月和头2年使用抗生素分别与3岁和7.5岁哮喘的发生有关。婴儿牛奶过敏的发生也获得了类似的结果。在孕前和孕期中,母亲的抗生素暴露量也发现了这种关联。
随着抗生素循环次数的增加,哮喘发展的风险增加。 据报道,广谱抗生素(头孢菌素)的相关性最强,近几十年来其特殊用途有所增加。
抗生素治疗以定性和定量的方式影响微生物的多样性和组成。低剂量抗生素治疗已用于破坏幼鼠中的微生物群。这不仅导致微生物群组成的改变,而且导致脂肪量增加,代谢激素和肝代谢的改变。
出生时给小鼠的小剂量青霉素可引起代谢变化和免疫相关基因回肠表达的变化,并且对代谢具有长期影响,并增强了对高脂饮食诱发的肥胖症的易感性。将停药后恢复的微生物群落转移到无菌小鼠体内,使生长促进表型转移。
但是,不能排除抗生素使用与哮喘之间的关联可能是由各种形式的偏见引起的,例如咨询行为,分类错误,回忆偏倚和适应症混淆。例如,一个混杂因素可能是在患哮喘或罹患哮喘的高风险儿童中观察到的呼吸道感染数量增加。
抗生素不仅会减少重要的致肠菌肠道细菌的数量,包括乳杆菌和分段丝状菌(segmented filamentous)细菌以及某些梭状芽孢杆菌,它们还以直接或间接的方式增加胃肠道真菌的丰度并损害抗病毒免疫,这在人类身上也得到证实。
母乳喂养时间的延长与儿童哮喘,特应性皮炎和鼻炎的风险降低相关。纯母乳喂养婴儿的肠道菌群具有更大的微生物多样性,尽管结果好坏参半,这会影响免疫系统的成熟并可能免受过敏。
在最近的一项大型多中心研究中,母乳喂养是与生命早期微生物群组成和多样性相关的最重要因素。 母乳喂养直接通过人乳微生物群(包括乳酸杆菌和双歧杆菌)的转移,并通过暴露于诸如人乳寡糖(HMO),分泌型IgA,糖巨肽,色氨酸代谢物,脂质, 先天免疫系统(例如可溶性TLR2,可溶性TLR4及其共受体)以及抗菌蛋白和多肽,它们共同影响并指导微生物的生长和代谢。
新生儿和幼儿的微生物组富含降解HMOs92所需的微生物基因。
HMO是复杂的短链糖,迄今已鉴定出200多种不同的寡糖,其组成和多样性在母亲之间有所不同。这种个体间的异质性归因于来自不同母亲的母乳在肠道粘膜免疫系统成熟方面的不同作用。
HMO还通过充当可溶性诱饵受体来影响上皮屏障功能,该受体会阻止细菌和其他微生物附着在上皮细胞表面糖上。已经提出,这有助于预防肠道以及呼吸道和泌尿道的传染病。低浓度的HMO乳酸-N-岩藻糖糖III与婴儿发生牛奶过敏的可能性增加相关。
母乳喂养还负责在母婴之间传播真核病毒(例如Herpesviridae,Poxviridae,Mimiviridae和 Iridoviridae)以及噬菌体(例如母婴之间的肌病毒科,Siphoviridae和Podoviridae)。 噬菌体占人乳中病毒的大部分(95%)。
人乳中的真核病毒可能直接影响婴儿的健康,而噬菌体则有助于塑造婴儿肠道菌群。此外,母乳喂养后婴儿的反流也可能使上呼吸道感染微生物。然而,可用的病毒学数据大多是横断面的,包括少量的个体,并且没有考虑母婴配对。
Rekima等证明,母亲哺育的小鼠暴露于屋尘螨Der p过敏原(与磷酸盐缓冲盐水接触)表现出增加的通透性,IL-33水平,第2组先天淋巴样细胞(ILC2s)的活化和分化。肠粘膜中的T辅助2(TH2)细胞。 这导致通过卵母蛋白暴露于母乳中而抑制了抗原特异性Treg细胞的诱导并防止了食物过敏。
这强调了母乳中呼吸道过敏原的存在作为因干扰口服诱导而引起食物过敏的危险因素的重要性。在人类环境中进行验证对于控制Der p的水平(和/或其蛋白酶活性)具有重要意义,可以作为食品过敏保护的一种手段。
注:Der p 1是在屋尘螨(Dermatophagoides pteronyssinus, Der p)中发现的第一组过敏原,也是最主要过敏原之一。1980年Chapman和Platts-Mills第一次分离出Derp 1,人们对这种过敏原的了解才逐渐增多。75%以上屋尘螨过敏的患者,Derp 1特异性IgE均呈阳性,但Der p 1绝不是仅仅产生特异性IgE那么简单。
病毒感染也与哮喘的发生密切相关。生命早期下呼吸道感染,特别是RSV或鼻病毒感染,可能在生命后期诱发喘息和哮喘的发生。变应原致敏作用似乎先于鼻病毒引起的喘息。
最近的研究表明,宿主对发热感染的反应以及炎性体的相关活化可能对哮喘的发作至关重要。实际上,基于炎症小体激活,IL-1β和IL-18产生,T辅助17(TH17)细胞激活以及IL-8和IL-6过度产生的轴,某些哮喘内型与嗜中性气道炎症相关。
与RSV相关的细支气管炎儿童的气道中渗透的细胞中有80%是嗜中性粒细胞。在早期肺部发育过程中,中性粒细胞可能导致气道损伤,对肺部结构产生长期影响,并可能诱发哮喘的发展。
实际上,过度的嗜中性粒细胞反应导致通过IL-9募集肥大细胞。肺内肥大细胞继而引起气道高反应性,因此易患哮喘。
此外,过多的中性粒细胞可能通过释放蛋白酶,活性氧和中性粒细胞胞外陷阱而导致肺损伤,最终导致慢性肺损伤,这一过程可由实验性鼻病毒感染触发。 这个概念带来了新的临床意义,需要进一步研究。
过敏原和病毒性呼吸道感染可能以多种方式相互作用,包括通过有缺陷的上皮屏障功能。病毒性呼吸道感染与紧密连接破坏,先天免疫力受损和抗氧化特性降低有关,这可能导致对感染和过敏原的敏感性过高。
此外,小鼠的早期RSV暴露抑制了Treg细胞的发育并增强了对过敏的敏感性。特别关注以下事实:在干扰素产生方面,患有哮喘的个体的细胞或组织对病毒感染的反应最佳。 哮喘中干扰素应答不足已归因于单个或多个基因缺陷,microRNA或表观遗传决定因素。
图3 哮喘患者中I型和III型干扰素与TH2型反应的相互负调节
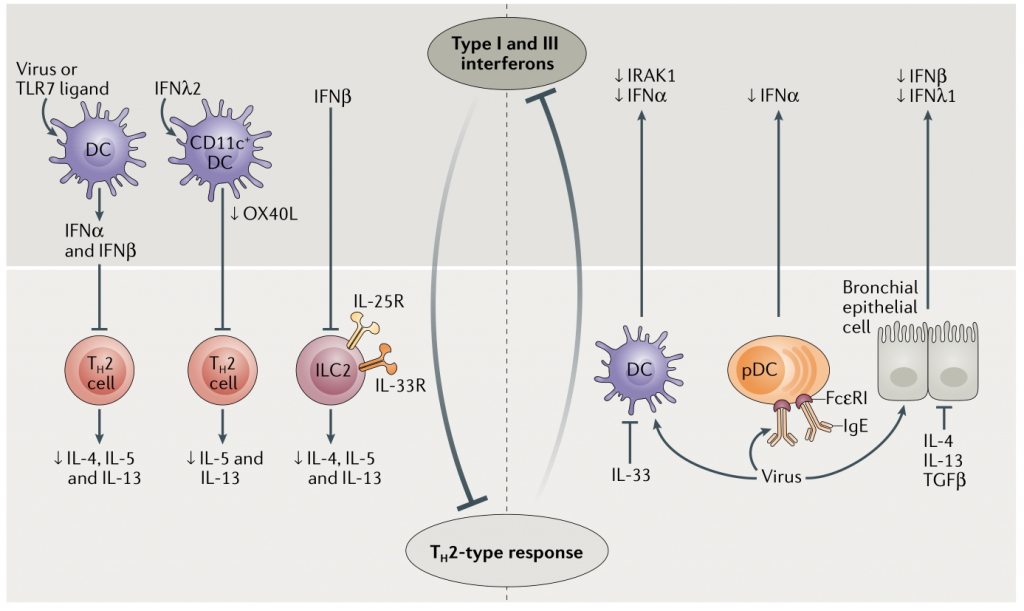

另外,TH2细胞反应(例如IgE交联和2型细胞因子的产生)抑制了支气管上皮细胞产生干扰素,进而浆细胞样树突状细胞(pDC)衍生的I型和III型干扰素抑制了TH2细胞和ILC2s中的2型途径(图3)。如果这是真的,目前的抗TH2生物制剂(抗IgE、IL-5和IL-13的抗体、IL-5受体拮抗剂、IL-4受体拮抗剂和小分子如TH2细胞上表达的趋化剂受体同源分子(CRTH2)和DNAzymes)不仅可以减轻TH2型炎症,还可以恢复抗病毒反应。
的确,在存在IgE交联的情况下,用鼻病毒或流感病毒进行离体刺激后,奥马珠单抗(抗IgE)对市中心哮喘儿童的治疗导致pDC衍生的I型干扰素应答增强,pDC FcεRIα表达减弱。 这些发现与预后期间哮喘急性发作率降低有关。
注:奥马珠单抗是一种重组的人源化单克隆抗体,为抗IgE靶向生物制剂,是全球首个批准治疗中至重度哮喘的靶向治疗药物,该产品于2003年首次在全球上市。
现在有越来越多的证据表明,菌群失调先于过敏表现的发展。 对出生队列的研究表明,婴儿的肠道菌群在1至3个月大时某些细菌属的缺失,与生命后期特应性,反复喘息或哮喘发展的风险增加相关。这种改变与消炎性多不饱和脂肪酸水平的降低或不存在相关。
怀孕母亲的健康状况影响宝宝早期菌群发育
此外,来自高危新生儿的无菌粪便水促进了产生IL-4的CD4 + T细胞的扩增,但以FOXP3 + Treg细胞损失为代价。 根据最近的发现,由于高危婴儿的胎粪表现出肠道微生物多样化的延迟和微生物源性代谢组的改变(主要以消炎性粪便脂质的消耗为特征),因此菌群失调可能更早时候就开始了。这种菌群失调与父母疾病密切相关,表明怀孕期间的母亲健康状况可能会影响生命早期微生物群发育的微生物的垂直传播。
这不仅限于哮喘,因为肠道微生物群组成的变化还可以通过微生物反应性RORγt+ FOXP3 + Treg细胞亚群提高对食物过敏的敏感性或抵抗力,已知这对于维持食物耐受性至关重要。
过敏发展与微生物群之间联系的实验证据来自无菌小鼠模型。对无菌小鼠的适应性免疫反应进行了重新编程。特别是,它们显示出对TH2细胞发育的默认偏差。 可以用确定的微生物菌株重建无菌小鼠。并且已经表明,梭状芽胞杆菌属物种和其他与过敏保护作用有关的物种通过诱导Treg细胞,IgA产生和其他免疫学作用而触发了过敏保护的发展。
最近,研究表明,以健康婴儿的菌群定植到无菌小鼠,可以免受牛奶过敏原的过敏反应。在该模型中,进一步的鉴定表明,梭状芽胞杆菌中Anaerostipes caccae可以防止对食物的过敏反应。在另一种食物过敏模型中研究表明,用梭状芽孢杆菌成员或由七种细菌组成的拟杆菌属菌落定居,可在小鼠模型中抑制食物过敏。
进一步的功能性实验确定了通过共生导致Treg细胞发育的MyD88–RORγt途径的激活。这些重要的实验填补了在了解食物过敏患者中观察到的菌群失调的功能相关性方面的空白。然而需要更多的实验来牢固地建立微生物群与其他变态反应和哮喘临床表型之间的因果关系。
饮食,微生物群以及随后的代谢和免疫功能密切相关
一个重要的例子是微生物代谢产生的SCFA在免疫功能中的作用。 最近的研究表明,在“哮喘保护”环境下成长的孩子(称为PASTURE队列)在生命早期开始控制饮食,粪便中的丁酸盐含量很高。
对这些儿童进行了6年的随访,结果显示与对照组相比,特应性过敏症,哮喘和食物过敏的发生率明显降低。 在患有过敏症的儿童中观察到了丁酸盐的保护作用,并且据报道,对牛奶过敏的患病速度更快的儿童中,丁酸盐产生的类群(Clostridia和Firmicutes)的含量增加了。
SCFA已显示可减少DC分泌IL-12和IL-6,并促进Treg细胞的发育。丁酸酯还可能通过抑制组蛋白脱乙酰基酶来影响ILC2的增殖和功能,该途径已被认为是哮喘的潜在治疗靶点。 的确,用产生丁酸的梭状芽孢杆菌属物种对无菌小鼠的体内重构减弱了依赖ILC2的气道高反应性。 重要的分子机制包括在DNA甲基化和组蛋白乙酰化水平上对表观遗传细胞程序的影响。 这些作用是通过G蛋白偶联受体43介导的,该受体已被确定为重要的SCFA受体。
关于过敏和哮喘保护,有几种独特的生活条件已被用于研究微生物生物多样性与免疫程序在细胞和分子水平上的因果关系。这些生活条件包括传统的农业和耕作方法(例如,在欧洲中部的高山地区),拟人化的生活方式(与未加工食品的消费,低抗生素用量和较高的户外活动水平相关),宠物的存在,尤其是狗和猫,居住环境,出生顺序和日托设施的早期使用。
在传统农业环境中,已很好地证明了微生物暴露与哮喘发生概率之间的反比关系。 这项研究表明了微生物多样性在促进这种有益效果方面的重要性,并且进一步的研究已经确定了所涉及的细菌种类。
通过使用实验性哮喘和过敏性致敏的常规小鼠模型或细胞培养实验,已显示过敏保护细菌可通过多种方式促进抵抗TH2型免疫和炎症的免疫反应的发展。 其中包括松鼠葡萄球菌(Staphylococcus sciuri),鲁氏不动杆菌(Acinetobacter lwoffii)和乳酸乳球菌(Lactococcus lactis1)。 这些菌株中的一些在产生或不产生IL-12的情况下诱导DC活化,其他一些菌株不仅产生TH2型炎症,而且产生TH1型和TH17型炎症,均具有更广泛的抗炎活性,其他在预防实验性哮喘方面更具选择性。 为了发挥这些过敏和哮喘保护作用,需要通过模式识别受体进行识别并通过其进行信号传递。
革兰氏阴性菌A. lwoffii可以作为模型微生物来研究过敏和哮喘保护,并且是在芬兰和俄罗斯的卡累利阿族人群中进行的一项研究的主题。 俄罗斯卡累利阿人的人口是独特的,因为它的遗传同质人口生活在两个不同的国家。
俄罗斯的卡累利阿人人口生活在传统的农村条件下,而芬兰的卡累利阿人人口生活在西化的农村条件下,对过敏性疾病的敏感性增加,不动杆菌属(Acinetobacter genus)的丰度和多样性降低。 该细菌也可能与皮肤微生物群,环境暴露以及特应性或特应性皮炎的发展有关。 通过向怀孕的小鼠反复鼻内施用A. lwoffii,模仿了传统耕作环境的反复和连续的微生物暴露,从而防止了后代实验性哮喘的发展,从而影响了后代。
具体而言,A. lwoffii可诱导母亲的肺和血清促炎细胞因子以及肺TLR mRNA表达。 然而,令人惊讶的是,胎盘组织中的TLR表达被广泛抑制。
在许多促炎性细胞因子中,尽管长期处于较低水平,但只有IL-6长期处于升高的水平。与其他促炎性细胞因子相反,即使连续施用十多个农杆菌,IL-6反应也没有适应性。这与在长期和连续的脂多糖刺激后发生的脂多糖耐受期间观察到的结果相反,这导致减少的促炎细胞因子产生,特别是先天免疫细胞的促炎细胞因子产生。这些选定变化的分子基础涉及表观遗传修饰和染色质重塑,从而导致基因转录改变。A. lwoffii对CD4+T细胞(但不是CD8+T细胞或自然杀伤T细胞)的表观遗传程序具有高度特异性的作用,修饰Ifng启动子以增加干扰素-γ132的转录和翻译。
这些抗过敏微生物中的许多是生物多样性环境的组成部分。 生物多样性假说指出,与自然环境的接触丰富了人类微生物群,促进了免疫平衡,并防止了病理性慢性炎症,包括变态反应和自身免疫。
我们认为这种炎症恢复力是由于源自微生物接触的这些激活信号的重复性质。正如许多观察性纵向和横断面研究表明的那样,当免疫耐受性增强时,生命早期就会出现特别脆弱的机会窗口。
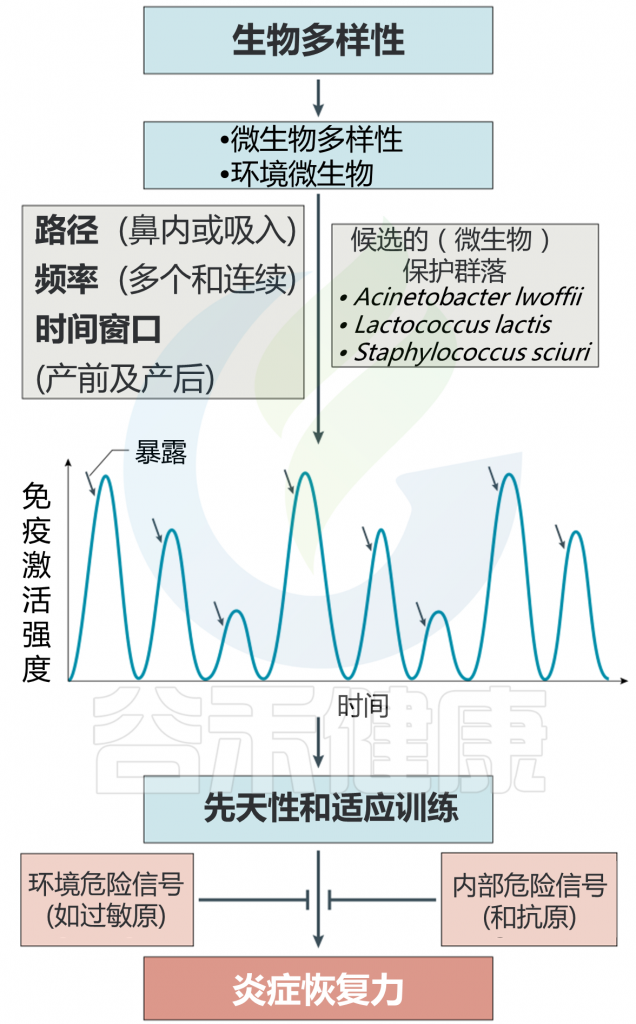

这种机会之窗与微生物群的发展之窗重叠,并从子宫发育早期到儿童早期。 重要的结果是,如果已经发展出适当水平的弹性的免疫系统遇到环境变应原,食物抗原或自身抗原,则对该系统进行预编程以防止病理性慢性炎性疾病的发展。
相反,在没有这种源自生物多样性暴露体的反复微生物暴露的情况下,不会发生炎症弹性,并且在这种情况下,过敏原或自身抗原会触发不良的免疫反应,从而导致慢性炎症,过敏,哮喘和/或自身免疫。
免疫反应可能显示出对环境微生物的相对较快的适应性或对其他微生物的适应性不足。 这种适应的特征是低度的炎症反应起源于局部粘膜进入部位(例如气道),并在全身扩散,因此可作为一种额外的策略来增强抵抗不良病理性炎症反应的能力。 炎症弹性的概念与建立耐受性免疫系统密切相关。
支持细菌物种在变态反应中作用的另一个相关实例是古老的幽门螺杆菌,在过去的几十年中,其在胃肠道中的存在已大大减少。 实验数据表明,经母体暴露于幽门螺杆菌可减少F1和F2后代的过敏性气道炎症。 这种对过敏的保护作用需要Treg细胞,并与胃肠道菌群的强劲转变有关。 这与较早的数据相反,后者显示幽门螺杆菌增加了人胃活检样品中食物抗原的上皮通透性。
通过长期感染,病毒可能有助于宿主表型,并且某些病毒的存在可能通过免疫调节而受益。病毒介导的免疫调节会影响抗病毒防御能力以及对各种疾病的敏感性,包括过敏和继发感染,继而可能影响过敏的发展。一方面,病毒的存在可以增强免疫反应的强度或降低免疫激活的阈值。 另一方面,病毒可能会抑制免疫反应或降低其大小,或者可能改变对后续抗原暴露的反应性质,从而有利于更有效的TH1-type136或TH2-type137反应和/或持续性I型 干扰素水平。
在这种情况下,I型干扰素对鼻病毒的应答减弱与哮喘的发作有关,而鼻内感染γ疱疹病毒的小鼠可通过改变肺泡巨噬细胞亚群保护它们免受过敏性哮喘的侵袭,有利于调节性单核细胞浸润肺。
这些单核细胞衍生的巨噬细胞抑制了DC介导的对屋尘螨抗原的TH2型反应,因此抑制了过敏性哮喘。 此外,病毒免疫调节在空间和时间上是动态的,并影响T细胞和B细胞受体的组成。
Anelloviruses是病毒的代表成员,并与嗜酸性粒细胞活化有关。在患有哮喘的个体中。 在血液以及大多数组织和器官中,Anellovirus病毒占病毒总数的70%。 脊髓灰质炎病毒扭矩腱糖病毒(TTV)可以通过多种方式调节宿主防御:首先,TTV通过CpG介导的TLR9激活和促炎性介质(如呼出的一氧化氮和分泌的嗜酸性粒细胞阳离子蛋白)的诱导来刺激免疫防御。 第二,TTV通过干扰素信号传导和T细胞耗竭来抑制宿主的免疫反应。 高TTV负荷与循环CD4 + T细胞减少,B细胞增加和嗜酸性粒细胞活性增加相关。
此外,据报道,在肺活量指数中度至严重受损的哮喘患儿中,鼻TTV负荷与嗜酸性粒细胞阳离子蛋白水平高呈正相关。 这表明TTV(单独或与其他病毒协同作用)在肺损伤中起作用,可能是通过全身或局部诱导炎症介导的。 反过来,炎症的增强可能是由血液中TTV复制上的免疫复合物形成或致敏个体中的过敏原暴露引起的。
对真菌的免疫反应涉及先天性免疫途径以及调节耐受性和免疫监视的细胞免疫。过度的免疫反应可能导致真菌过敏,这可能是由于免疫调节机制的扰动所致。 肠道菌群的变化与过敏性气道疾病有关。例如,肠道中白色念珠菌的存在会影响TH17型通路,进而可能影响慢性气道疾病中与曲霉菌相关的病理学。
在皮肤中,马拉色菌属较高或针对它们的免疫反应减弱与特应性皮炎有关。 尽管在此背景下还描述了非马拉色菌,但共生马拉色菌,马拉色假丝酵母和皮肤马拉色菌一直与特应性皮炎及其恶化相关。 患有这种疾病的患者会向马拉色菌种产生IgE,并且来自马拉色菌的囊泡已与定义明确的一致RNA序列集相关联,而这些序列不受pH升高的影响,这是特应性皮炎患者的标志性特征。 此外,在特应性皮炎患者中,马拉色菌可能会诱导皮肤TH17细胞诱导的炎症,并增强马拉色菌特有的CCR6 +记忆性TH17细胞。
在健康的肺结核菌组和在慢性炎症性呼吸系统疾病(如哮喘和慢性阻塞性肺疾病)中观察到的结核菌之间也存在差异。 在这些疾病中,由于真菌过度生长或丧失多样性,肺表现出较低的真菌多样性和较差的肺功能。 特别是在哮喘中,某些真菌(例如,Psathyrella,Malassezia,Termitomyces和Grifola)的负载量已有报道。
与没有哮喘的儿童相比,患有严重哮喘的儿童的红景天孢子菌,肺孢子虫,白孢菌等的丰度更高。
支气管扩张与不利的过敏性致敏和对曲霉的免疫反应有关。在哮喘和囊性纤维化中,都可能诱发对曲霉的过敏反应,例如在过敏性支气管肺曲霉病中。
预防过敏的微生物处理
对影响过敏风险的早期事件的详细了解对于建立一级预防策略(即阻止过敏原致敏)和二级预防策略(即阻止致敏后临床症状的发展)特别重要。
如上所述,有大量的临床和实验证据表明,微生物群在训练针对耐受的早期免疫反应中起着关键作用。
然而,尚不清楚细菌治疗后是否可以永久改变微生物群。 目前,一些针对花生过敏的小型I期临床试验正在进行中,以探索胎儿微生物转移的可能性,正如其他人最近总结的。 这些研究和其他研究的结果将提供进一步的认识,即微生物群的操纵是否将是预防和/或治疗(食物)过敏的现实选择。
育儿习惯,包括清洁母亲口中的安抚奶嘴,食用发酵食品以及用手洗碗代替使用洗碗机。 但是,需要通过对婴儿和儿童进行的其他随机对照研究来证实其积极作用。 此外,作为防过敏措施,正在探索旨在增加绿色空间,增加年轻的母亲和儿童在富含微生物的土壤中工作以及使年轻人从城市进入农村地区的机会的社区干预措施。 但是,在将成人研究的结果翻译为婴儿时必须谨慎。
益生菌可以直接或间接(例如,通过肠道微生物群的校正)提供帮助,从而随着临床和免疫耐受的发展而使正常的免疫成熟。当然支持这一点的临床证据有限。关于食物过敏,即使在高风险家庭或未选择或混合风险人群中,也没有发现使用益生菌的积极结果。 同样,哮喘也获得了阴性结果。
相比之下,调查益生菌对孕妇,母乳喂养的母亲或婴儿的影响的随机试验提供了证据,表明益生菌可以降低婴儿特应性皮炎的风险。 这些结果也反映在国际准则中。
混合结果的原因可能有以下几点:第一,不同的微生物用于不同的研究;第二,不同的微生物菌株可能有不同的效果;第三,时间和剂量与给药时间表一起也起着重要作用。
益生菌的免疫调节作用
大量的体外和动物体内研究表明,一些益生菌菌株具有免疫调节作用。最广泛使用的益生菌菌株是乳杆菌科和双歧杆菌科菌株。对于鼠李糖乳杆菌GG(LGG)、干酪乳杆菌、reuteri石灰乳杆菌、副干酪乳杆菌、植物乳杆菌和嗜酸乳杆菌,FOXP3+Treg细胞在产生IL-10的同时,无论是否产生TGFβ,其数量和/或功能均有不同程度的增加。一些菌株促进单核细胞来源的树突状细胞成熟和启动。
在实验性哮喘小鼠模型中,给予LGG抑制气道高反应性并降低TH2型细胞因子的产生。据报道,在哮喘儿童中,服用LGG可以降低呼出的一氧化氮浓度,但这些结果不能被其他人复制。
动物双歧杆菌亚种,乳双歧杆菌、双歧杆菌、婴儿双歧杆菌、长双歧杆菌、短双歧杆菌和其他双歧杆菌,也得到了类似的结果。已有报道诱导FOXP3+Treg细胞,诱导巨噬细胞和树突状细胞产生IL-10,以及对TNF水平和IL-6产生的抑制作用。益生菌介导的免疫调节的进一步机制包括稳定肠道黏膜紧密连接、增加粘液分泌、增强肠道动力和产生氨基酸副产物,包括精氨酸和谷氨酰胺,以及可能导致某些原发性硬化的短链脂肪酸。
益生元被定义为对宿主而言不易消化,但可作为选定微生物的营养物质的糖,进而对宿主产生有益于健康的作用。实例包括短链低聚半乳糖,长链低聚果糖和果胶。在这方面,HMOs还可以作为婴儿微生物群的益生元。
在动物模型和人体研究中,分别显示了益生元对高危婴儿的粘膜免疫功能和特应性皮炎发展的积极影响。 但是,需要进行更大的研究,才能证明补充婴儿配方奶粉中的HMO是否对过敏和哮喘预防具有有益作用。 现在,仅大规模合成了有限数量的HMO(2′-岩藻糖半乳糖和乳酸-N-四糖),因此它们可用作婴儿配方食品的补充剂。
大量证据表明病毒在从头诱发哮喘中起着核心作用,这使得预防呼吸道感染成为防止过敏和哮喘的有吸引力的潜在措施。
用抗RSV单克隆抗体帕利珠单抗预防RSV诱发的细支气管炎可降低RSV相关疾病,反复喘息和潜在的非特应性哮喘的风险。 在临床试验中针对鼻病毒和RSV的当前和候选抗病毒药和疫苗已在其他地方进行了审查。 口服免疫调节剂可能会影响迁徙的T细胞和B细胞种群,这些种群在与肠道相关的淋巴组织中成熟并形成归巢受体,这些受体优先移动至粘膜(包括呼吸)部位。 由于局部肺抗病毒反应,此类细胞亚群可通过控制旁观者炎症起作用。 也可能涉及其他保护机制,例如启动肺中的内源性炎症小体功能,从而增强了局部适应性抗病毒免疫力。
免疫调节可以由活的益生菌或细菌提取物提供,也可以通过与病原菌的抑制作用来实现,这些病原菌可以与病毒协同作用,并通过例如抗菌疫苗或靶向抗菌疗法增加疾病的严重性。 在后一种情况下,收益必须与对共生细菌的潜在有害影响和选择抗微生物有机体相平衡。
英国和美国的较旧建议建议在怀孕期间避免食用花生和坚果,以防止后代对坚果过敏。但是,没有发现任何好处,因此建议被撤销。确实,来自丹麦国家出生队列的数据显示,母亲食用花生和坚果与18个月大的儿童哮喘成反比。早期学习有关花生过敏(LEAP)的研究彻底改变了当前的规则,因为该研究显示,在1岁之前接受花生喂养的高危婴儿中,花生过敏的发生率较低(5岁时相对减少81%)(4– 11个月)。考虑到花生过敏症目前影响西方国家的1-3%的儿童,因此该首次随机对照试验的结果对研究饮食蛋白的引入或避免有很高的相关性。
但是,很难将一项涉及高危婴儿的试验的结果归纳起来,该试验在将花生普遍引入普通人群之前,对患者进行了花生过敏性筛查。大规模的筛查计划在逻辑上要求很高,而引入的剂量和时间也仍然是未解决的问题。 在有限的时间窗口内引入花生,以及随着引入年龄的变化而研究免疫调节的机制研究是必要的。
后续LEAP-On研究的结果表明,在早期引入花生的儿童中,避免食用花生12个月与短暂的脱敏无关,而与对花生的持续无反应有关。在最初的食用花生的人群中,在回避1年后的6岁时评估了其花生特异性IgE水平的显着下降(LEAP-On)。这些发现为过敏预防和相关的未来研究提供了重要的见识。他们证明,食物特异性IgE的产生在婴儿早期就开始了,可能需要很长时间才能停止,这可能是由于长期存在的产生IgE的记忆B细胞和浆细胞(又称效应B细胞)。
在生命的第一年,食物的多样性增加似乎对过敏性疾病有保护作用 诱导免疫耐受。饮食多样性可以通过增强微生物群多样性来减少过敏性疾病,进而改善肠壁的完整性和免疫系统的调节,尽管这一点尚待证实。同样,科学界也讨论了食品生产和烹调方法以及先前所描述的“健康饮食”(例如地中海式饮食),但迄今为止有关任何过敏保护作用的证据都是有限的,而且常常存在争议。
已开发出水解牛乳配方,其中通过多种物理和化学过程对蛋白质进行修饰,包括过热和胰蛋白酶和化学胰蛋白酶的酶促裂解。 蛋白质的修饰程度在各配方之间不同,被称为部分或广泛水解。
这样的配方源自乳清蛋白或酪蛋白。 迄今为止,尚未就这种广泛或部分水解的配方的定义达成普遍共识。 这种方法背后的概念是变应原性和抗原性之间的平衡。
部分和广泛水解的食品配方包含明显减少的过敏原表位。
但是,在这些条件下,抗原性以及保持免疫耐受的能力仍然得以保持。 这一概念得到动物模型系统的支持,但临床试验显示出矛盾的结果。 荟萃分析和其他研究提示,临床观察和效果是水解产物特异性的。 为了预防食物过敏,两项系统评价和若干随机试验发现,广泛水解的乳清或酪蛋白配方有有益的作用。 但是,关于过敏性疾病的发展也有不同的发现,最近的发现并不支持使用水解配方食品预防高危婴儿的过敏性疾病。 在一些指导方针中,建议在危险的婴儿中预防部分牛奶水解物,证明其功效已得到证实,以预防婴儿的牛奶过敏和过敏性疾病,因此可以被认为是婴儿配方奶粉中的蛋白质来源。
根据目前对健康免疫发展和过敏危险因素的了解,在生命中似乎有一个脆弱的时期,在产前和产后早期这一时期,过敏预防可能是最有效的。
最近的证据,仅仅调节单一的危险因素不足以显著改善幼儿的健康状况。哮喘发病危险因素的数学模型表明,相当大比例的(儿童期)哮喘可归因于一系列可改变的环境危险因素。 反过来,这也促进了我我们预防控制过敏的措施。
参考文献:
Renz Harald., Skevaki Chrysanthi.(2020). Early life microbial exposures and allergy risks: opportunities for prevention. Nat. Rev. Immunol., undefined(undefined), undefined. doi:10.1038/s41577-020-00420-y
谷禾健康
肾脏的主要功能是保持体内平衡,包括酸碱平衡,水平衡,血压调节和葡萄糖稳态在内的功能需要肾脏进行精确的协调和调节。 全球大约9%的人口正在遭受慢性肾脏疾病。近年来,研究表明,肠道菌群的变化(通常是各种细菌的相对比例的变化)与多种疾病和病症相关,包括肥胖,糖尿病,躁郁症和抑郁症,人们也越来越关注肠道菌群在调节肾脏疾病结局中的潜在作用。但是这些菌群和疾病研究中有许多是相关的,通常不清楚为什么会发生这些变化,或者是否是因果关系以及这些变化是否以某种方式促进了相关的表型?
近日,发在在《Science》上的一篇来自哈佛大学公共卫生学院和医学院的教授Wendy S. Garrett团队的关于慢性肾脏病与肠道菌群的研究(Diet posttranslationally modifies the mouse gut microbial proteome to modulate renal function)在这个范例上引入了全新的思路。文章指出饮食变化可以触发微生物蛋白的翻译后修饰,从而改变尿毒症毒素的形成,从而影响慢性肾脏疾病的进展。这些发现可能有助于慢性肾脏病的治疗,并为改善人类健康提供了针对微生物群及其蛋白质组酶活性的临床方法。

缩略词:
Saa:含硫氨基酸
Ade:腺嘌呤
SPF:无特殊病原体
GF:无菌
SAF: 无菌小鼠肠道中接种ASF
研究背景:
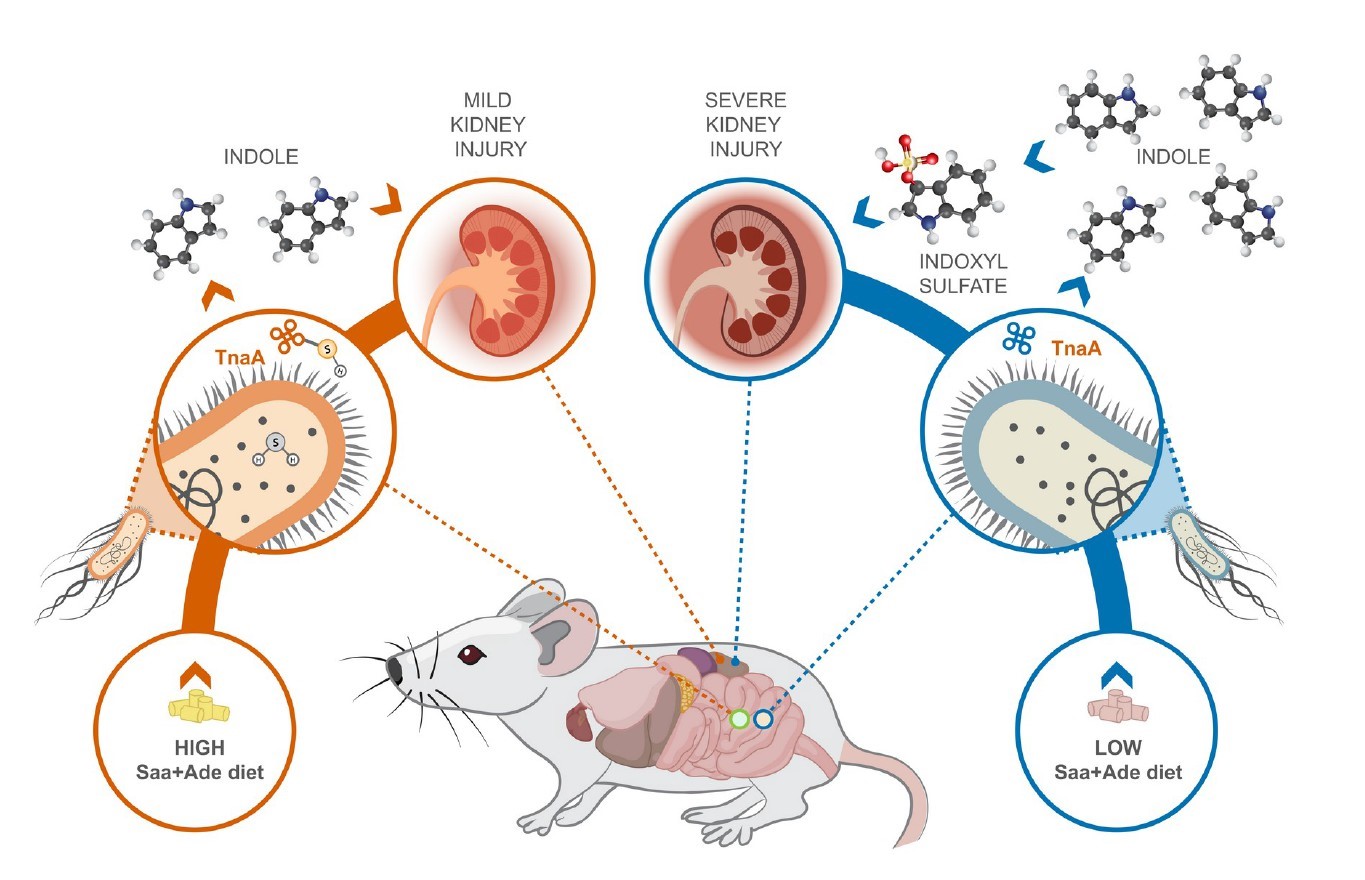
尽管饮食调整是慢性肾脏病治疗的基石,但饮食与微生物群相互作用在慢性肾脏病发病机理和治疗中的机制作用尚未得到充分研究。 数十年来,改变患者饮食中蛋白质的摄入量一直是治疗慢性肾脏病的临床策略,更具体地说,是饮食中含硫氨基酸(Saa)的摄入量会影响患者和疾病模型的慢性肾脏病进展。尽管膳食氨基酸中有5%到10%到达了大多数肠道细菌代谢发生的结肠。 在人类中,膳食蛋白质的增加会增加肠道细菌产生硫化氢(H2S),吲哚和吲哚酚硫酸盐的产量。 吲哚和吲哚酚硫酸盐是尿毒症毒素,H2S具有多种生理功能,其中一些功能是由翻译后修饰S-硫酸化介导的。尿毒症毒素是肾功能受损时残留在血液中的化合物,尿毒症毒素的增加会导致多种疾病,包括内皮功能障碍。尽管已在哺乳动物系统中进行了大量研究,但仍未充分研究H2S在调节宿主内肠道细菌功能方面的生理作用。
实验方法:
⑴ 组织学观察:小鼠肾脏石蜡包埋切片观察,包括肾皮质和髓质的定向切片。
⑵ 血清肌酐测定,血清肌酸酐比色测定试剂盒(Cayman Chemical)测量肌酐水平。
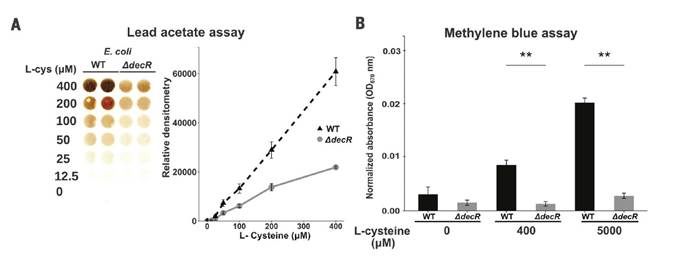
⑶ H2S测定:ASF小鼠盲肠硫化物的检测,采用上述醋酸铅硫化物分析法进行分析。
⑷ 宿主肾基因表达分析:石蜡块中提取小鼠肾RNA,然后进行RT-PCR定量分析。
⑸ 慢性肾病患者粪便微生物组学公共数据集收集和Meta分析
⑹ 菌种培养和试验:E. coli K-12 BW25113菌株自己克隆培养,E. coli MG1655,
BW25113, W3110 和tnaA739::kan来自耶鲁大学大肠杆菌遗传储备中心(CGSC)。
⑺ 盲肠DNA提取及RT-qPCR分析:
⑻ 细菌16srRNA基因扩增子序列:盲肠内容物16s,V4可变区测序分析
⑼ 蛋白质实验:
硫水合蛋白质的降解
蛋白质印迹分析实验
蛋白质消化和标记实验
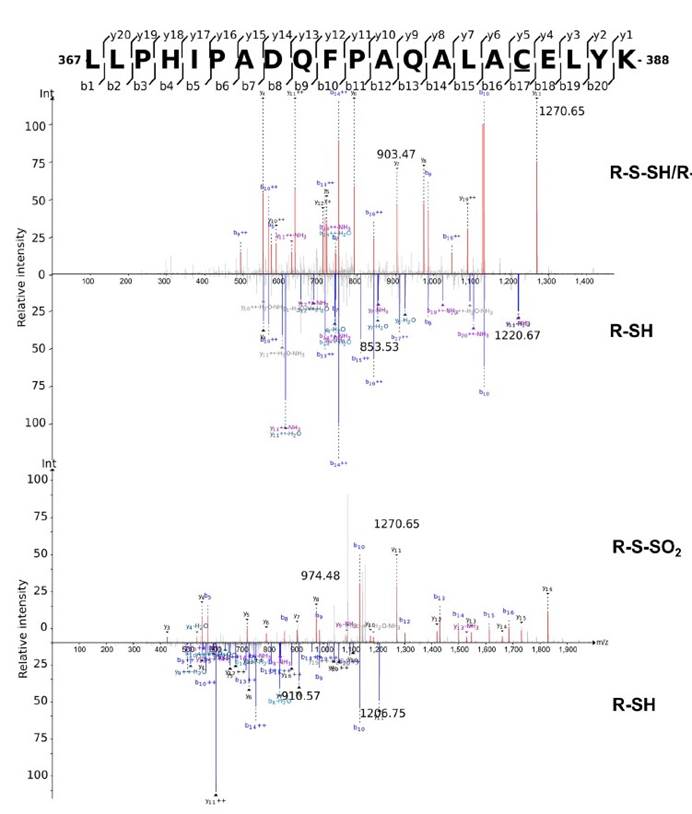
⑽ 质谱分析,吲哚和硫酸吲哚的LC-MS/MS分析
⑾用Kovac试剂比色法测定吲哚
⑿ 体外色氨酸酶测定
⒀大肠杆菌的基因插入与克隆
实验结论:
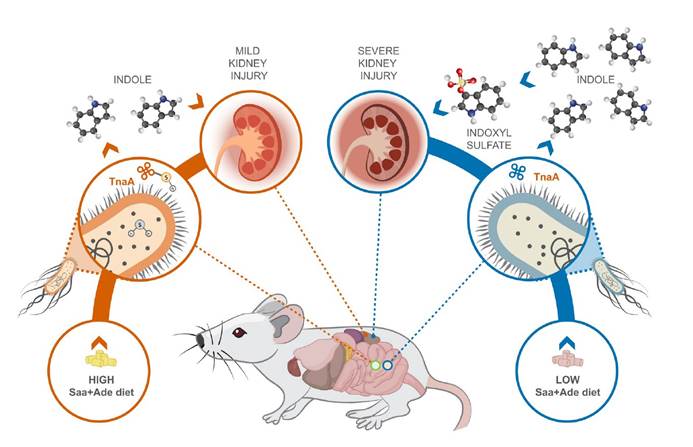
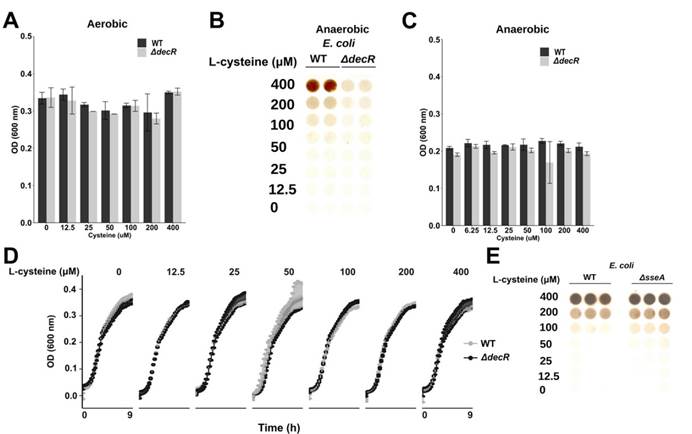
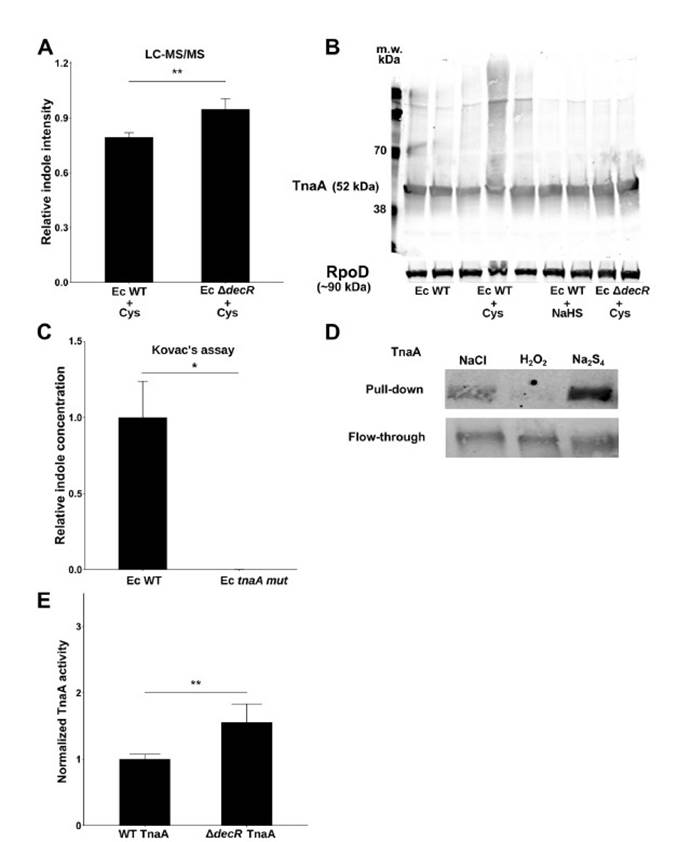
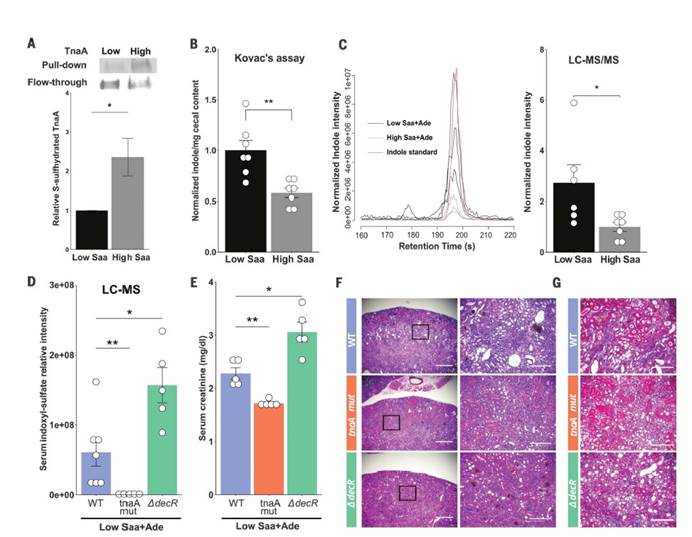
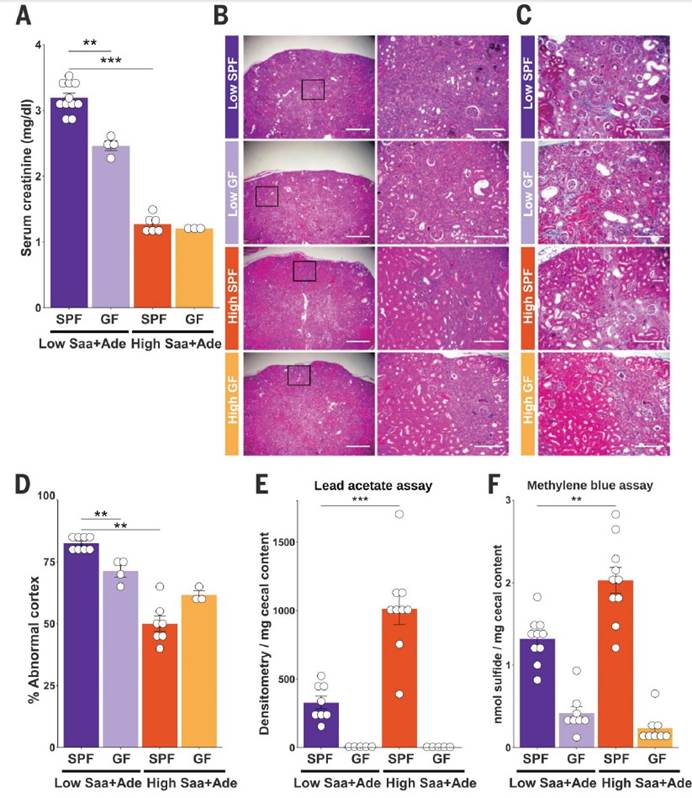
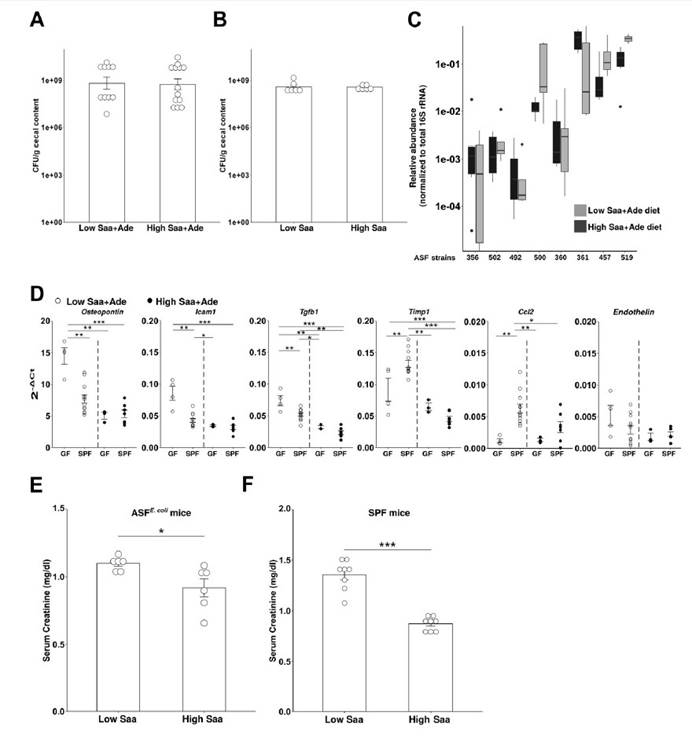
一,与高Saa + Ade(腺嘌呤)的小鼠相比,低Saa + Ade的饮食常规饲养,无特定病原(SPF)小鼠的血清肌酐水平显着升高,而且范围更广以及严重的肾皮质组织病理学改变,包括肾小管扩张和脱落,肾小管炎伴肾小管周围纤维化以及皮质晶体沉积。与低Saa + Ade饮食的SPF小鼠相比,GF小鼠的血清肌酐和肾脏损害明显减少,并且在高Saa + Ade饮食的GF和SPF小鼠中存在相似的表型。
二,微生物群可以缓冲某些宿主基因的表达,同时刺激其他宿主基因的表达。低Saa饮食会加剧观察到的慢性肾脏病表型,而肠道菌群的存在会进一步放大这些影响。
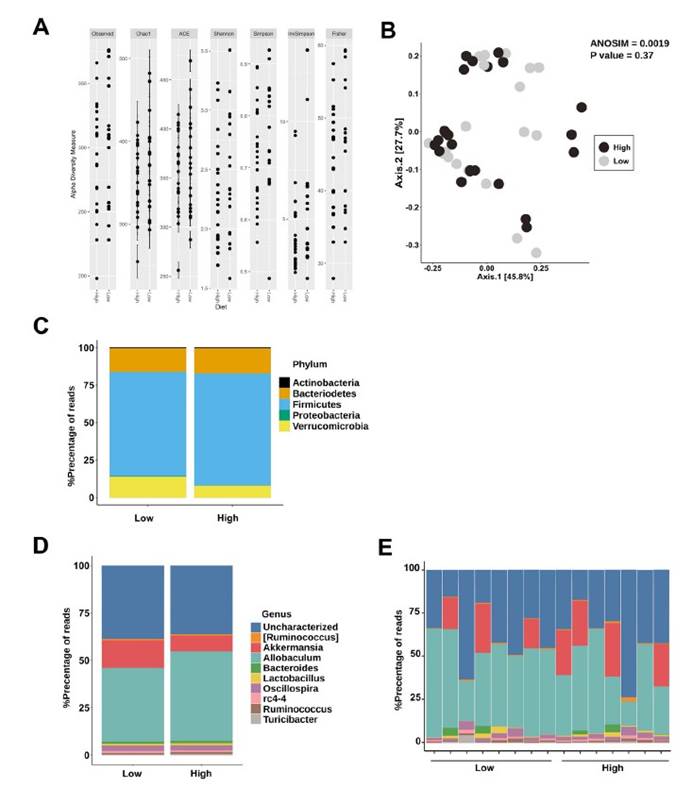
三,未观察到低Saa和高Saa饮食的SPF小鼠肠道微生物群成员的分类丰度存在任何显著差异,支持健康小鼠盲肠硫化物的差异可能是通过改变微生物功能而不是通过改变微生物功能来实现的微生物群落结构的变化。
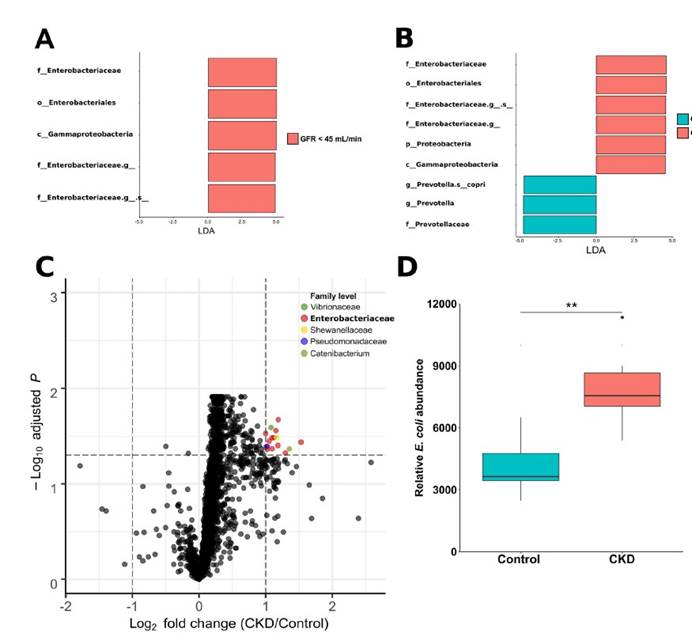
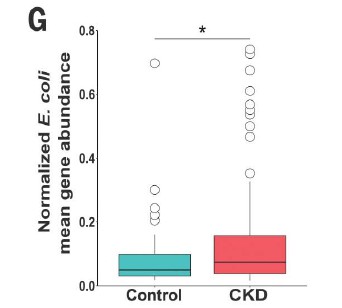
四,在患有终末期肾脏疾病的慢性肾脏病患者的粪便样本中测得的7种大肠杆菌的总平均丰度显着增加。
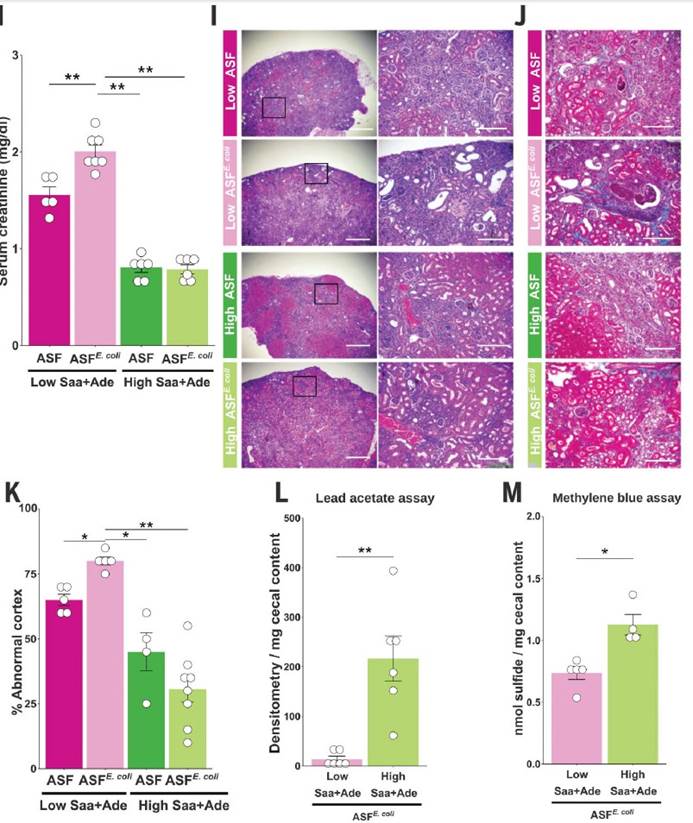
五,在低Saa + Ade饮食下,定植于大肠杆菌(ASFE. coli)的ASF小鼠比ASF小鼠具有更高的血清肌酐和更广泛的肾小管炎,肾小管萎缩和脱落,肾小管周围纤维化和皮质晶体。在低Saa+Ade饮食中,ASF小鼠感染了大肠杆菌(ASFE. coli)比ASF小鼠血清肌酐更高,更广泛的小管炎,肾小管萎缩和脱落,肾小管周围纤维化和皮质结晶。
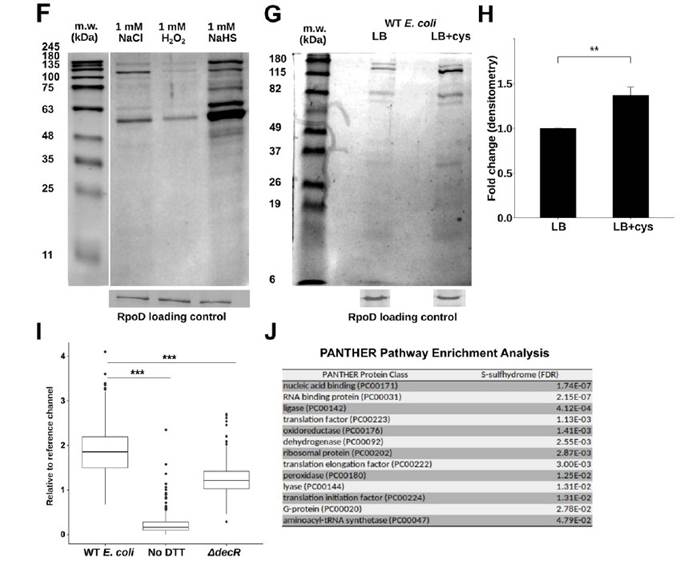
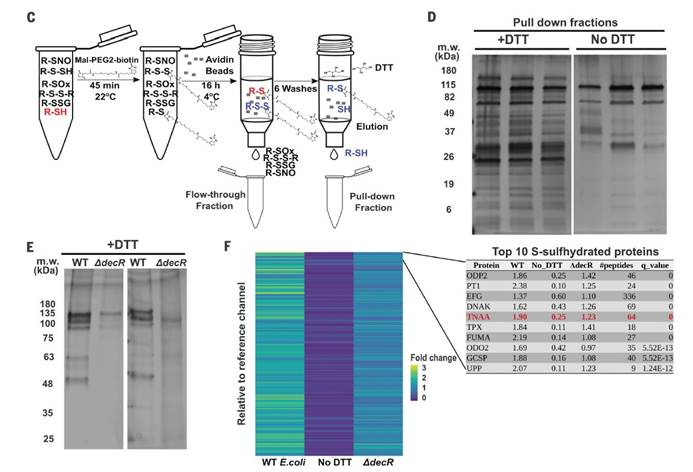
六,用定量串联质谱(TMT)和液相色谱-多阶段质谱(LC-MS3)分析表明大多数在大肠杆菌裂解物中富集的蛋白质确实是S-硫水合物洗脱的。
七,SPF和ASFE.coli中的血清肌酐水平结果支持大肠杆菌与饮食性Saa相互作用以调节肾脏功能。
八,SPF和ASFE.coli小鼠中盲肠H2S的观察结果显示需氧或厌氧生长的大肠杆菌以剂量依赖性方式从半胱氨酸产生硫化物,而对生长没有任何影响。
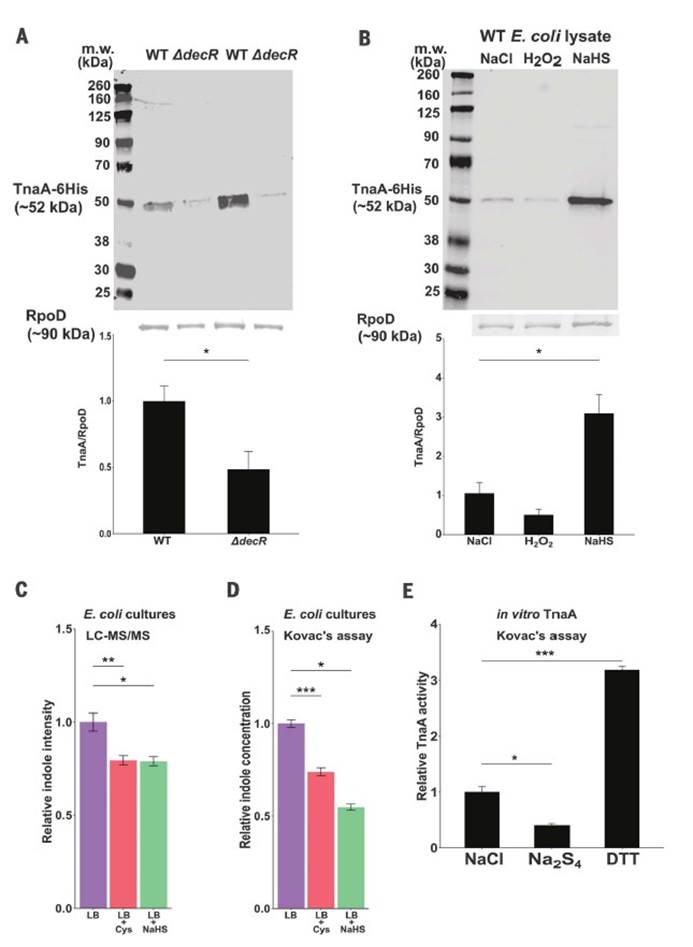
九,Western印迹分析法分析WT与DdecR大肠杆菌裂解物中的TnaA S-硫酸化反应验证了S-巯基水解结果,并发现DdecR裂解物中TnaA S-硫酸化反应降低。 用H2O2和NaHS处理的大肠杆菌裂解物分别显示出减少和增加的TnaA S硫酸盐化作用。
十,外从细菌细胞裂解物中检测到纯化的蛋白质和TnaA的TnaA S硫酸盐化反应,证明了这种修饰抑制了其活性。
十一, 发现采用高Saa饮食的小鼠的吲哚水平显着降低,这表明高饮食Saa不仅增加了TnaA S的硫酸化作用,而且这种修饰足以影响体内TnaA的活性。
研究总结:
研究发现,源自饮食Saa细菌代谢的硫化物通过抑制S-巯基化色氨酸酶来调节大肠杆菌的吲哚生产。表明饮食成分可以被微生物群代谢,从而产生微生物蛋白的翻译后修饰,从而影响宿主的生理,并为宿主-饮食-微生物群之间的相互作用如何促进或阻止诸如慢性肾脏病的疾病状态提供了框架。小鼠慢性肾脏病模型中,饮食的细微变化不会导致微生物成分的变化,这揭示了大肠杆菌产生的吲哚受到肠道细菌内源性产生的硫化物水平的差异性影响。表明细菌代谢不仅可能对宿主生理产生直接影响,而且还可能影响宿主饮食介导的细菌翻译后修饰驱动的微生物相互作用。
局限性:
研究观察表明,GF小鼠在腺嘌呤模型中表现出肾衰竭表型,尽管比SPF小鼠轻,但表明宿主因素以及氧化还原状态(例如,谷胱甘肽水平改变)在饮食Saa中也起作用调节肾功能。
饮食中Saa和细菌TnaA吲哚生产对人慢性肾脏病肾衰竭的贡献值得进一步研究。 在小鼠慢性肾脏病模型中盲肠吲哚的2倍增加最终导致血清吲哚酚硫酸盐增加10倍,这是值得注意的。
研究意义和启示:
研究报道了一种饮食干预措施,该干预措施诱导了微生物酶的翻译后修饰(S-巯基化),导致尿毒症毒素产生的减少,这对肾脏疾病的小鼠模型具有保护作用。尽管这样的研究很困难,但这篇研究提供如何实现它们的示例蓝图。此外,这些研究暗示可以通过改变肠道微生物群和/或肠道微生物蛋白质组的酶活性的新策略来改变慢性肾脏疾病的进展。
这些类型的方法不仅可以为慢性肾脏疾病带来好处,而且可以为与微生物群有关的许多其他疾病和状况带来好处。根据定义,这些类型的研究需要采取多学科的方法,因为不仅必须认识微生物生物学和翻译后修饰方式,还必须了解疾病的整个动物生理学和病理生理学。 因此,对于来自不同领域的科学家们来说,这是一个巨大的机会。通过汇集不同领域的知识和方法,可以增进对宿主-微生物组相互作用和疾病进展的了解,也许可以发现新的疾病治疗和预防方法。
主要图表:


谷禾健康
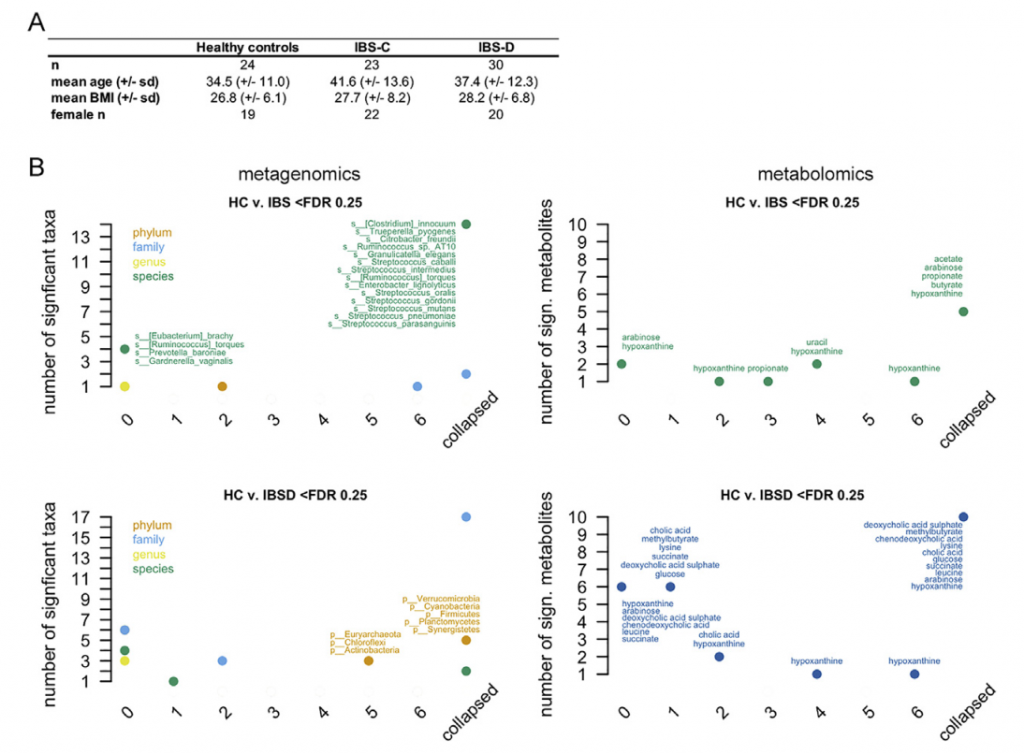
肠道微生物组与多种人类慢性胃肠道(GI)疾病有关。肠易激综合症(IBS)是一种普遍存在的疾病,其特征是反复出现腹痛或不适。IBS主要见于女性,并与粪便形式或频率变化有关,并基于主要便秘形式(便秘为主(IBS-C),腹泻为主(IBS-D)或混合型(IBS-M))。 由于动物和人类研究之间明显的脱节以及缺乏针对疾病特异性生理变化的综合多组学观点,因此很难确定肠道菌群在疾病中的作用机理。
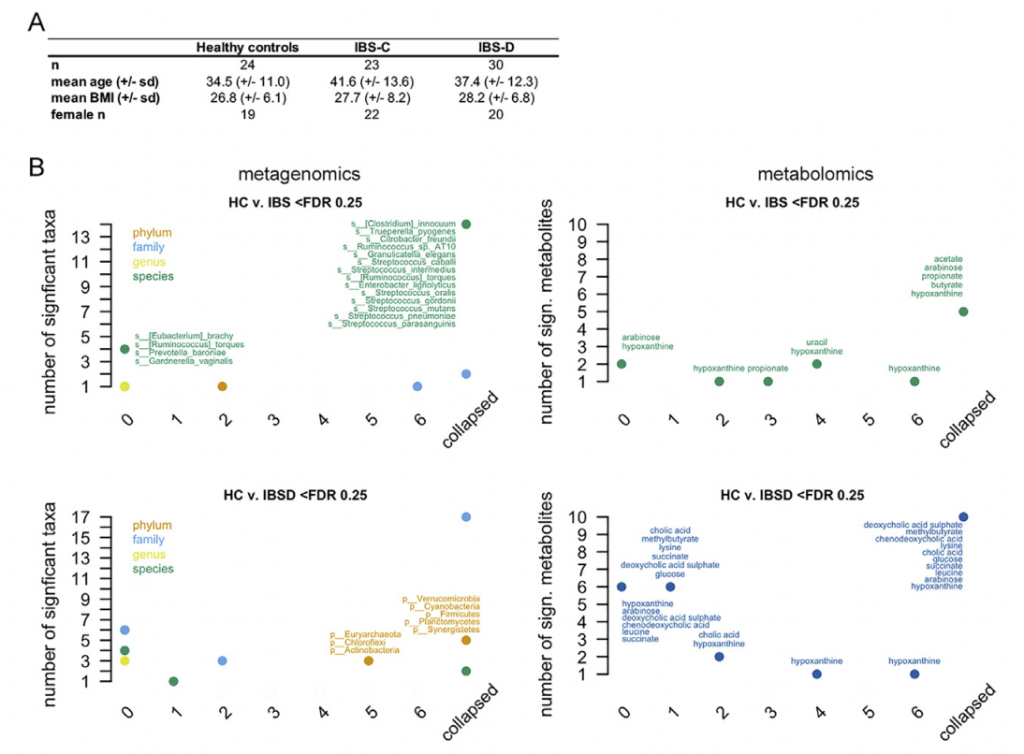

近日,美国梅奥诊所消化内科和肝病科 Purna C. Kashyap研究团队和明尼苏达大学生物科学学院 Dan Knights团队合作在 Cell上发表了题为 Longitudinal Multi-omics Reveals Subset-Specific Mechanisms Underlying Irritable Bowel Syndrome 的文章,研究团队对IBS宿主生理进行了多组学测量的纵向研究 (gun弹枪浅宏基因组测序、16S rRNA基因测序、代谢组学研究,细胞因子测量,转录组和甲基化组分析)最终确定了IBS亚类型特异性、症状相关的微生物组成和功能变异,其中一组已确定的微生物代谢产物变异子集与IBS有关的宿主生理机制相关。 通过Lasso回归机器学习方法整合多个数据层,鉴定出的微生物代谢物变化的子集对应于与IBS相关的宿主生理机制。研究团队将嘌呤代谢确定为一种新型IBS宿主-微生物代谢途径,同时嘌呤饥饿被确认为潜在的IBS治疗靶标。
这项研究主要采用了纵向多时间点采样,针对IBS这类症状波动较为明显的疾病研究纵向多时间点采样可以减少横断面研究的采样偏差,减少入组病人的数量但提高统计检验的效力。可以看到研究纳入的病人并不很多,但采用平均值之后统计效果明显。
另外研究同时进行了多组学的检测,包括代谢组和黏膜转录组等,通过对宏基因组功能差异的分析以及代谢组的差异分析同时锁定了多项代谢异常,尤其是次黄嘌呤的水平异常。进一步对次黄嘌呤水平与宏基因组的菌种进行关联分析锁定了重要的相关菌,通过SV关联分析,在更细尺度上筛选出了可能的功能基因区段。
这种组合方式提供了完整的研究思路,从人群尺度寻找疾病可能的代谢和生理机制,并经由多组学的关联分析锁定可能的菌种标志,再到精细化筛选出可能的功能基因。
在菌群方面研究采用了宏基因组和16S,对粪便样本采用宏基因组,对黏膜样本采用16S,因为黏膜样本含有较高的人体DNA,16S更为合适。粪便样本的宏基因组直接采用和RefSeq89版本进行比对注释,基因部分同时结合了序列比对和利用基因组数据直接提取注释相结合。宏基因组测序能够提供菌株层面的分辨率,同时也是后续结构变异关联分析的必要条件,随着参考基因集的完善,中等测序深度的浅宏基因组将可以大量应用于这类研究中(浅宏基因组文末详细介绍和福利活动 )。
全文缩略词整理:
肠易激综合征(IBS)
便秘为主的肠易激综合征(IBS-C)
腹泻为主的肠易激综合征(IBS-D)
混合型为主的肠易激综合征(IBS-M)
健康对照(HCs)
症状严重程度评分(SSS)
短链脂肪酸(SCFA)
靶向液相色谱-质谱(LC-MS)
5-羟色胺受体4(5-HT4R)
胆汁酸(BAs)
胆酸(CA)
鹅去氧胆酸(CDCA)
核磁共振氢谱(1H-NMR)
黄嘌呤磷酸核糖基转移酶(XPRT)
嘌呤核苷磷酸化酶(PNP)
缺失区(DR)
可变区(VR)
Bray-Curtis差异(BCD)
不规则性(BCDI)
差异甲基化区域(DMR)
本文用到的实验方法汇总:
样本人群和数据生成
18-65岁的IBS-C和IBS-D患者经过严格的筛查确诊患者入组。IBS-C和IBS-D受试者均符合罗马III级标准。有腹部手术史(阑尾切除和胆囊切除除外)、被诊断为炎症性肠道疾病、显微镜下结肠炎、腹腔疾病或其他炎症性疾病、在过去4周内使用抗生素、出血风险或服用增加出血风险的药物、过去一周准备接受结肠镜检查、怀孕、计划在研究期间怀孕、是易受感染的成年人以及年龄在18岁以下或65岁以上的志愿者被排除在外。
食物频率问卷(FFQ)和24小时饮食回想问卷
动物实验
小鼠实验
Ussing chamber 试验
Ussing Chamber,尤斯灌流室,离是研究跨上皮转运的工具,可用于包括离子转运、营养物质转运及药物转运等的研究。通过跨上皮转运的研究,可以了解上皮的离子通道机制、营养成分及药物透过上皮的吸收、影响上皮屏障功能以及通透性的因素等。本文的Ussing Chamber实验研究了5-羟色胺(5-HT)对结肠上皮短路电流(ISC;一种反映肠道分泌物的跨上皮离子流量的测量)的变化。
微生物组测序
QIAGEN PowerSoil 提取粪便和组织DNA
浅宏基因组使用HiSeq 2500(快速模式)单端读数为100 bp(1×100)和NextSeq 150 bp单端读数(1×150)进行测序。
扩增子测序,对核糖体RNA基因的V4区进行测序,扩增子序列与来自同一细菌基因组的16S rRNA基因在shotgun测序法中使用BURST。
微生物组数据分析
宏基因组部分使用的是浅宏基因组,使用1×100或1×150单端,使用BURST以97%相似度和RefSeq(v86版本)进行比对,过滤比对测序深度低于1万reads的样本。KEGG正射图也可以从参考基因组中进行预测,并利用SHOGUN对预测的图谱进行扩充,以改进对低丰度基因的估计
基因丰度部分是直接比对从refseq基因组中提取的KEGG注释序列,并利用SHOGUN改进低丰度基因的预测)
在测试亚组之间的分类单元差异之前,删除了90%的受试者中不存在的分类单元。 为了识别差异丰富的特征,使用FDR截止值<0.25。
通过提取所有健康对照(HC)与HC或IBS样本之间的成对差异来计算基于Bray-Curtis差异(BCD)的不规则性(BCDI),并存储这些差异的中位数。HC值的第90个百分位数用作鉴定与HC样品不同的微生物组样品的临界值。通过随机抽取每个HC对象一个样本并在这些样本中识别BCDI 500次,对第90个百分位数的临界值进行了敏感性分析。 此外,还计算了平均HC微生物组丰度的第90个百分位数临界值。 使用平均值不会改变第90个百分位数的临界值(0.63)。
代谢组学
血清和粪便样品的核磁共振代谢(1H-NMR)谱分析,测定粪便样品中丙酸、丁酸和醋酸的相对丰度,非靶向1H-NMR谱判别分析(PLS-DA)模型确定了IBS亚组和HC粪便样本之间的代谢变异
通过LC-MS /MS进行胆汁酸分析
使用ACQUITY超高效液相色谱(UPLC)系统和Xevo G2-S四极飞行时间(Q-TOF)质谱仪上对样品进行了分析。
通过GC-MS / MS进行SCFA定量
使用7000D 三重四极杆 GC/MS((Agilent Technologies Ltd.)对SCFA进行定量分析。7000D 三重四极杆气质联用系统是 GC/MS/MS 发展史上迄今为止最为成功的最新型号。使用真正的SCFA标准品绘制了11点校准曲线和合并的QC样品。
通过LC-MS / MS进行色氨酸定量
色氨酸定量使用LC-MS/MS在Waters Acquity UPLC上进行,色谱柱为T3 C18柱(1 ×50 mm,1.7 uM),联用Waters Xevo TQ-S三重四极杆质谱仪。
细胞因子测量
使用多路Luminex定量分析IL-8,IFNγ,IL-10,II-18,IL-22,瘦素,血管内皮生长因子(VEGF),膜结合免疫球蛋白(MIG),IL-1β,IL-17A,IL-1RA,IL-6和 TNFα。使用酶联免疫吸附测定(ELISA)对TGFb-1进行了定量。
RNA测序和分析
提取mRNA, 使用Illumina High Seq-2000测序,使用MAP-RSeq v.2.0.0、edgeR 2.6.2、R包RITAN(https://www.bioconductor.org/packages/release/bioc/html/RITAN.html)进行基因机损,差异表达和路径富集分析。
甲基基因组测序和分析
使用Illumina Infinium甲基化EPIC BeadChip评估基因组DNA中的全基因组甲基化,使用R软件包ChAMP 2.9.10、Combat方法、limma函数和Benjamini-Hochberg(BH)得到甲基化的CpG位点,使用R包RITAN,将与DMC或DMR相关的基因用于途径富集分析。
多组学数据整合
使用R中的Maaslin2软件包(http://huttenhower.sph.harvard.edu/maaslin)研究了粪便微生物特征与粪便代谢产物之间的关联。 使用最小丰度运行Maaslin2,将微生物特征的最小患病率分别设置为0.0001和0.5。 经FDR校正的q值的阈值设置为0.25。 将线性混合效应模型应用于与被设置为随机效应的受试者的关联。
用Lasso回归机器学习方法拟合,鉴定基因-微生物组和基因-代谢物关联,该基因模型使用每个基因的基因表达作为响应,并使用微生物组丰度或代谢物浓度作为预测因子。回归方法是一种对数值型连续随机变量进行预测和建模的监督学习算法,回归分为Linear Regression线性回归,Logistic Regression逻辑回归,Polynomial Regression多项式回归,Stepwise Regression逐步回归,Ridge Regression岭回归,Lasso Regression套索回归,ElasticNet回归。其中,Lasso回归方法是在统计学和机器学习中同时进行特征选择和正则化(数学)的回归分析方法,旨在增强统计模型的预测准确性和可解释性,在实践中,岭回归与套索回归首先岭回归。但是,如果特征特别多,而某些特征更重要,具有选择性,那就选择Lasso可能更好。
体内和体外次黄嘌呤消耗实验
Mega培养基中培养细菌,使用LC-MS测定培养上清液中的次黄嘌呤水平,在6周龄的无菌Swiss Webster小鼠上进行了单菌落实验。
次黄嘌呤(Sigma-Aldrich)管饲喂养后第4天,处死小鼠并收集盲肠内容物,使用Amplex Red黄嘌呤/黄嘌呤氧化酶测定试剂盒(Thermo Fisher)测定盲肠内次黄嘌呤和黄嘌呤的总浓度
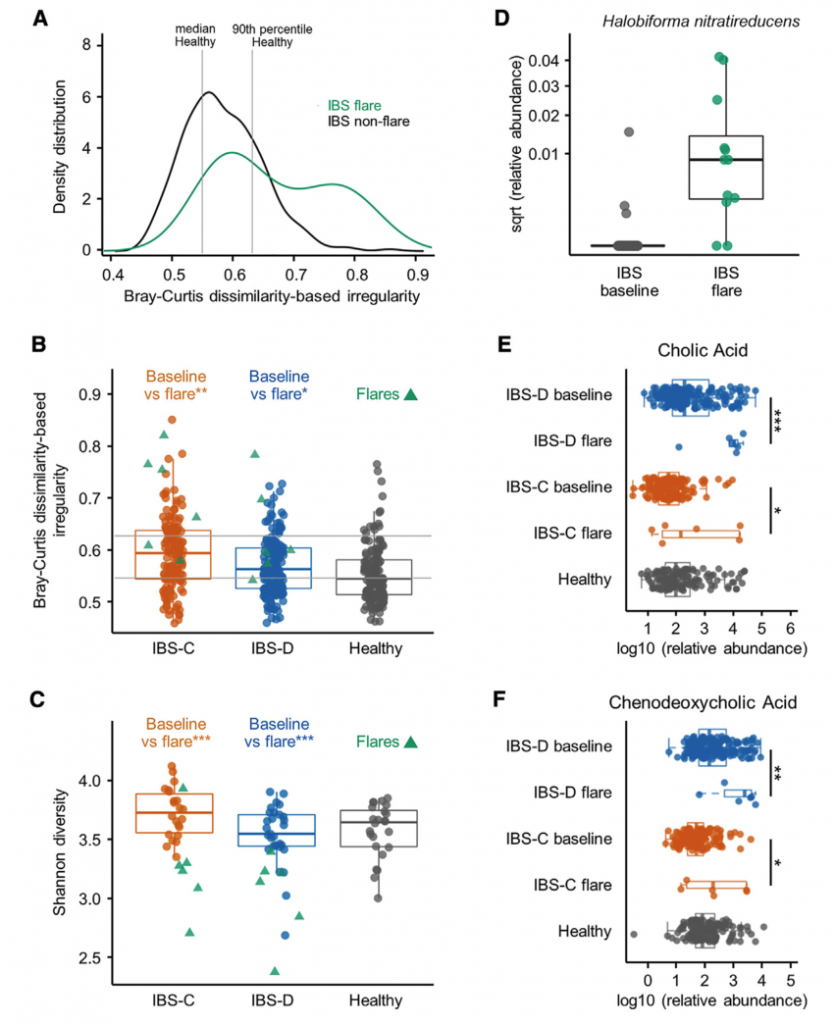
一 纵向采样克服了跨部门微生物组研究中的异质性
慢性胃肠道疾病中肠道微生物组的横断面研究提供了高度动态的生态系统的快照。 除了饮食,药物使用,生活方式和其他环境因素的影响外,随着时间的流逝微生物群的变化也可能反映疾病活动的变化。
该文通过对纵向数据进行二次采样,测试显着的分类单元,将单个时间点的结果与受试者平均所有数据所获得的结果进行比较,来评估纵向采样与横截面采样相比对识别成分变化的影响时间点。
比较不同时间点时,在各个时间点观察到的HC和疾病组之间的分类单元丰度差异非常不一致,并且与平均数据中观察到的变化不重叠。 当使用平均数据而不是单时间点数据时,发现多个链球菌属物种的丰度明显更高。与HC相比,IBS-D中新近鉴定出的门合生植物的丰度要低得多。 我们还发现,个体内部差异高于个体内部差异,这支持了我们对每个个体的纵向数据进行平均的方法(STAR方法,t检验p <0.0001)。
这些发现凸显了在慢性疾病中进行纵向采样的必要性,以可靠地识别使用横截面采样可能遗漏的微生物群变化。 因此,我们主要报告时间平均数据的发现。 最近的一项研究进一步证明了这一点,该研究表明,在多个采样时间点使用平均值时,常用的“组学”方法更为准确。

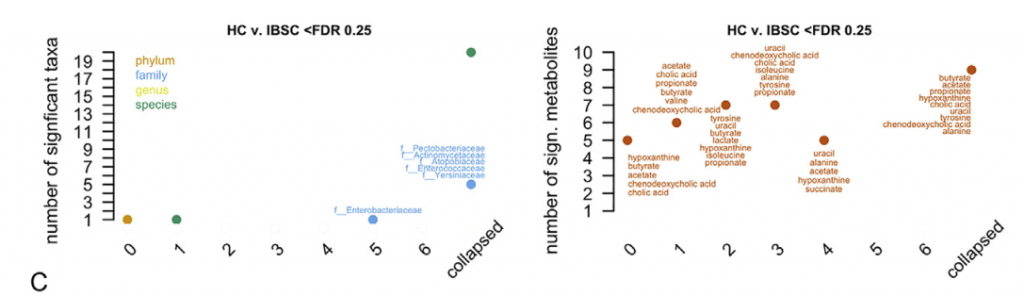

二 纵向采样揭示了随着时间的流逝,IBS-C微生物群具有更大的可变性
与HC和IBS-D受试者相比,IBS-C患者的粪便微生物群组成随时间表现出更大的变异性。 此外,与IBS-D样本相比,平均IBS-C粪便样本的香农多样性更高(ANOVA,Tukey HSD p值为0.016)。
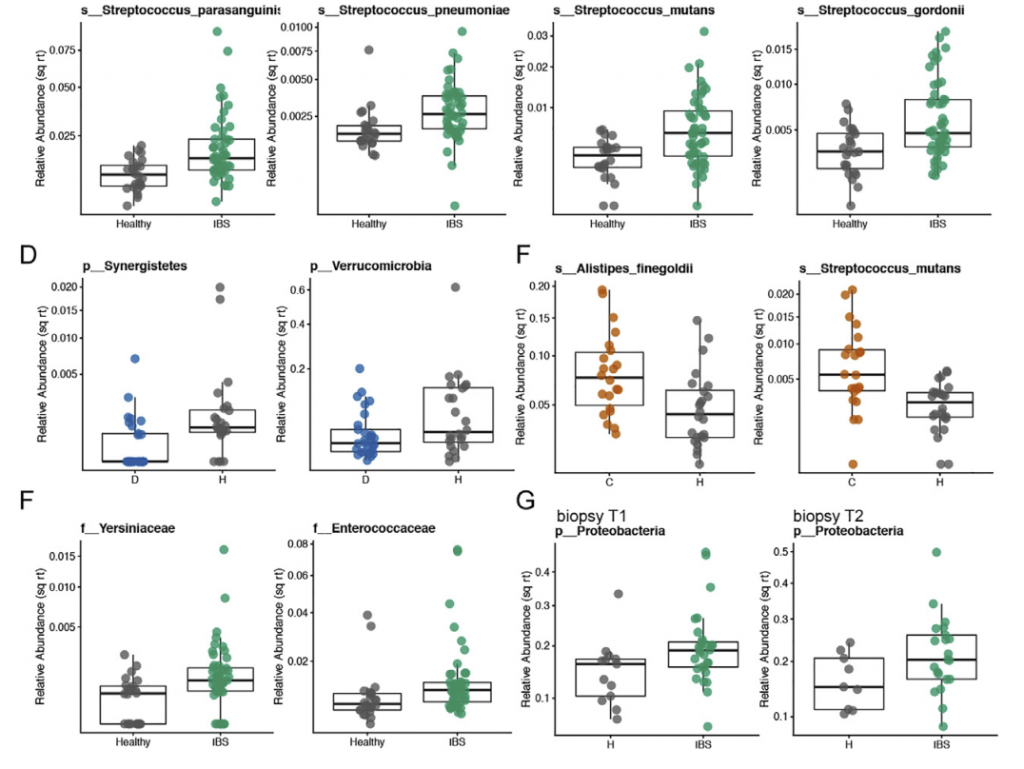

粪便样品中结肠黏膜的微生物组成与腔微生物群有显着差异。 与HC相比,IBS患者的粘膜相关菌群的特征是变形杆菌水平明显较高。 与IBS-D或HC相比,IBS-C患者的与黏膜相关的微生物菌群与其各自的腔内微生物菌群相似性较低。 这可能反映出IBS-C患者菌群的迁移时间较长,而社区之间有更多的时间分化。 此外,IBS-C患者的粘膜相关菌群的个体内变异性随时间变化更大,这与我们在腔菌群中观察到的相似。

三IBS症状严重程度与肠道菌群的功能变化有关
在特定采样点使用IBS SSS(0-500)报告IBS的严重程度,IBS SSS是腹痛强度、频率、肿胀、对排便习惯的不满以及IBS对一般生活的影响的累积度量。我们观察到重度IBS-D(SSS>300)中超过20种乳杆菌的相对丰度高于轻中度IBS-D(SSS<300)。而且这与受试者食用益生菌或乳制品无关。
在粪便宏基因组学功能富集分析时,我们发现在FDR中74个KO与严重的IBS-C相关,而44个与严重的IBS-D相关。 重度IBS-C和IBS-D中均发现了乙醇脱氢酶(ADH)的KO途径,且在重度IBS-C和IBS-D比轻中度IBS中高。 乙醇脱氢酶(ADH)显示与双歧杆菌和链球菌属呈正相关。这些数据表明ADH活性可能与腹痛有关,腹痛是IBS-C和IBS-D共同的主要症状。

四 代谢组学与生理学结果阐明了肠道微生物群代谢对胃肠功能的影响
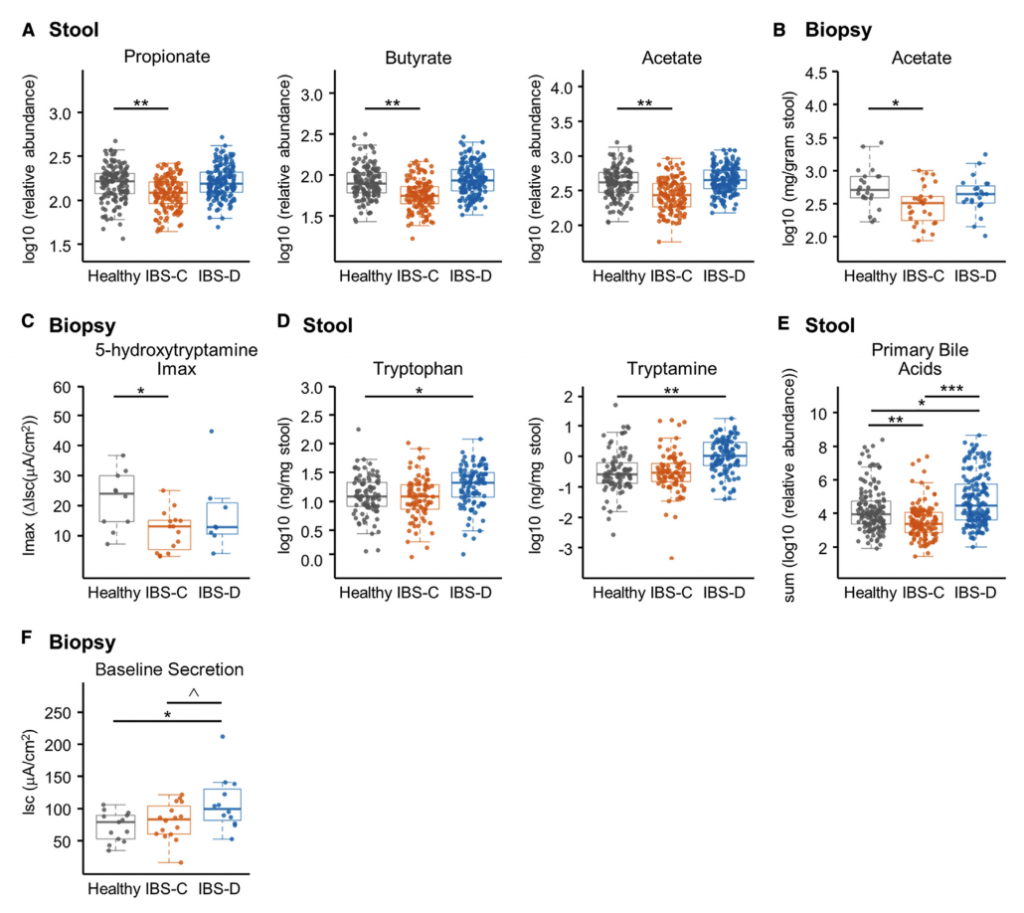
H1核磁共振(NMR)光谱显示,与HC相比,IBS-C患者粪便样本中的短链脂肪酸(SCFA)丙酸酯,丁酸酯和乙酸酯显着降低。与腔内代谢产物一致,与HC组相比,IBS-C组的结肠黏膜活检样品中的乙酸盐(通过气相色谱-质谱[GC-MS]测定)也显着减少。,SCFA的这些差异与膳食纤维的总摄入量无关,因为这在各组之间没有显着差异。
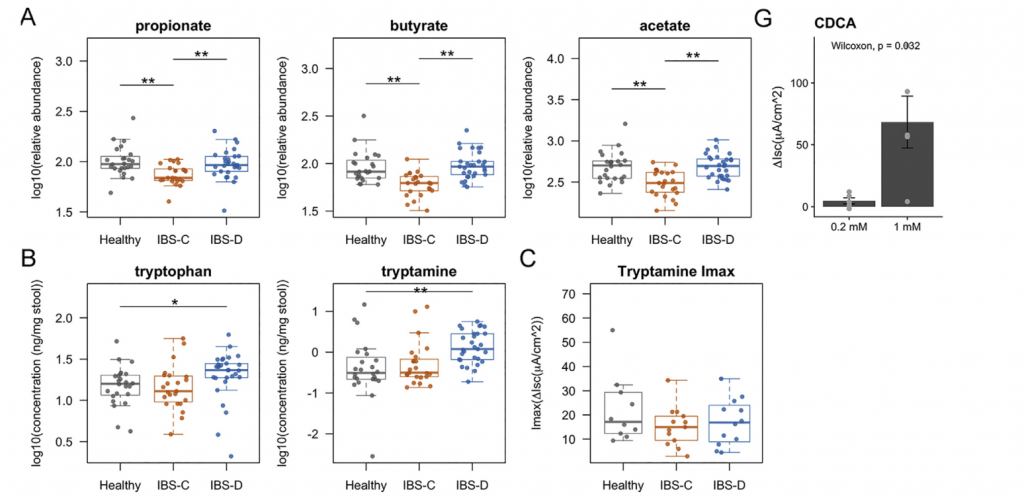

Ussing chamber 试验结果表明水分流伴随离子通量,并且分泌减少会导致便秘中粪便含水量降低。 相反,增加的离子通量可导致分泌更多的水,导致腹泻。色胺均显着增加了结肠分泌且在各组之间没有显着差异,表明,IBS患者和HCs的结肠上皮能够由色胺引起的液体分泌,因此观察到的变化可能是由于色胺的丰度变化导致。
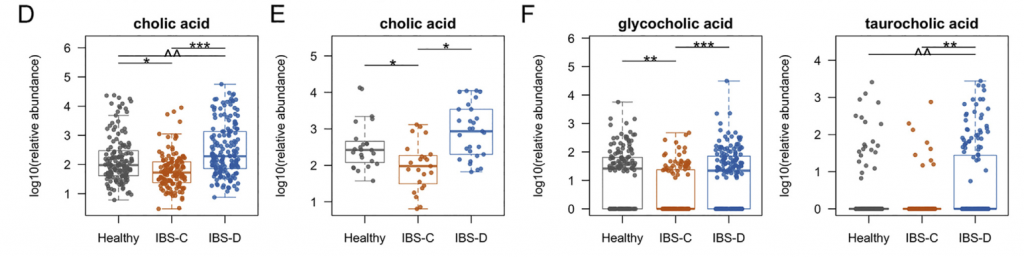

进一步使用靶向液相色谱-质谱(LC-MS)方法研究了粪便样品中色胺和其他色氨酸代谢物的变化。 发现,IBS-D患者粪便样品中的色氨酸和色胺都显着增加,因此可能部分归因于IBS-D粪便中水分的增加。 我们证实这些代谢物的变化与蛋白质摄入的饮食差异无关。
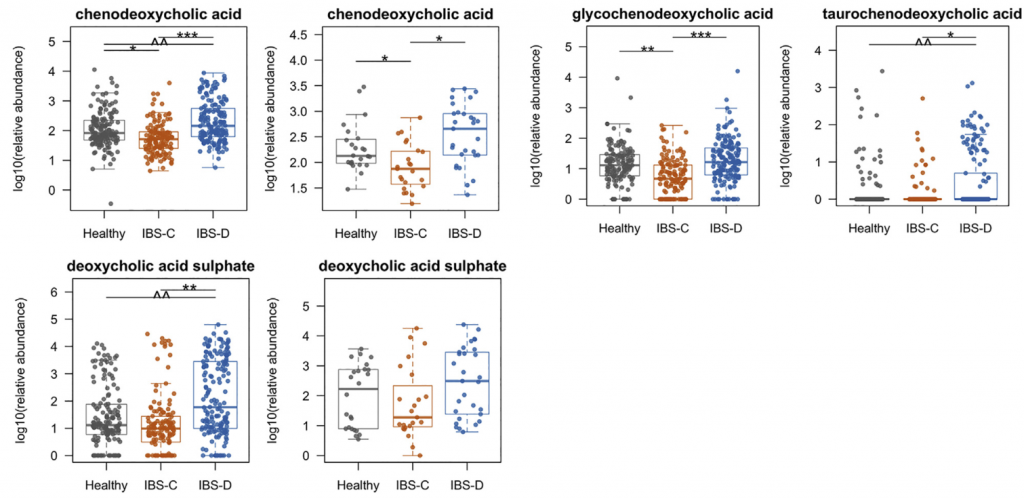

使用LC-MS / MS我们IBS-D患者粪便样品中未结合的初级BA含量明显较高,而IBS-D患者粪便样品中未结合的初级BAs含量明显较低。与HC和IBS-C受试者相比,IBSD中个体初级共轭和非共轭BA和DCA-S的量更高。 由于像CDCA这样的羟基化初级BA可能会增加结肠分泌,因此运用Ussing chamber测试了CDCA在无菌小鼠结肠黏膜下黏膜下层制剂中的作用,结论支持了CDCA水平升高在增加IBS-D患者粪便中水分含量方面的生理作用。
五 联合多组学分析确定了IBS中的新型微生物代谢途径
采用了非靶向代谢组学方法来鉴定可能导致IBS病理生理变化的新型微生物途径。基于无目标1H-NMR光谱图的潜在结构判别分析(PLS-DA)模型的投影确定了IBS亚组和HC粪便样品之间的代谢变化。 与HC相比,IBS-C患者粪便样品中的赖氨酸,尿嘧啶和次黄嘌呤均显着降低。 IBS-D患者的次黄嘌呤含量也较低,尽管与IBS-C的意义不同。

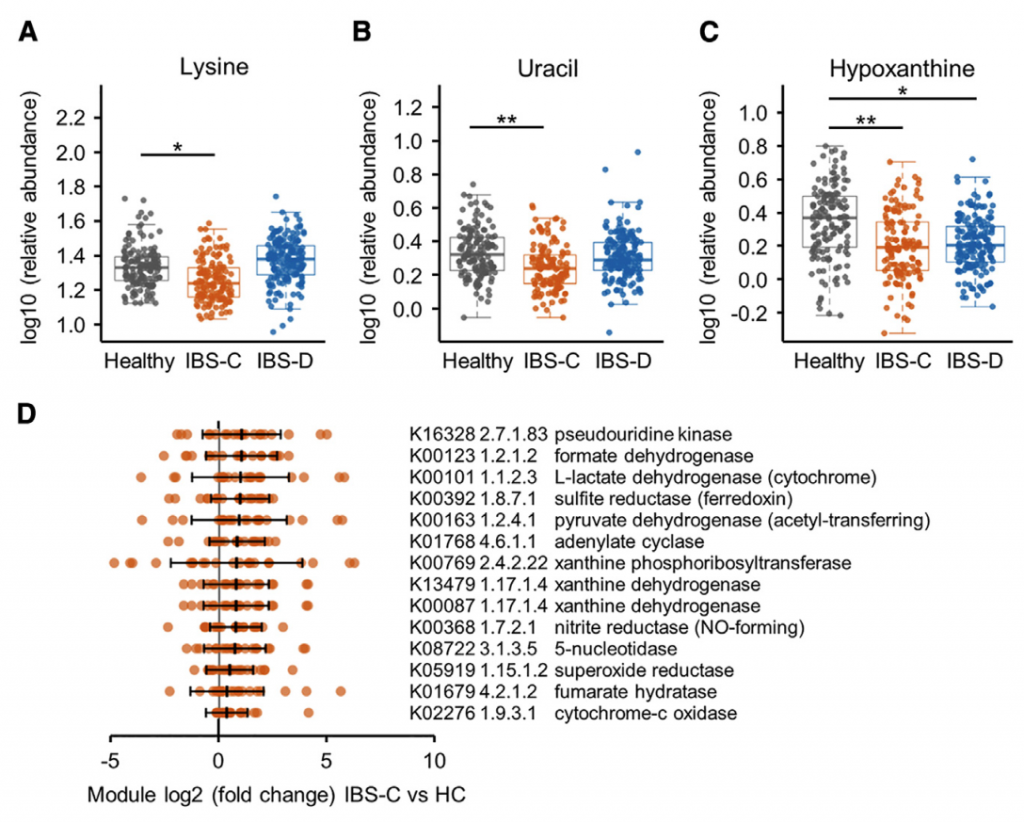
分析IBS和HC患者粪便样本中次黄嘌呤相关的宏基因组学功能,发现IBS-C中的黄嘌呤脱氢酶/氧化酶(XO; 1.17.1.4)和黄嘌呤磷酸核糖基转移酶(XPRT; 2.4.2.22)途径相对于HC有所升高。 XPRT从黄嘌呤单磷酸中释放出黄嘌呤,这是抢救嘌呤的第一步。 在下游,XO是一种具有低底物特异性的酶,可作用于黄嘌呤或次黄嘌呤以产生尿酸。 这些较高水平的XPRT和XO模块表明,IBS患者中肠道菌群对嘌呤的分解作用增加。

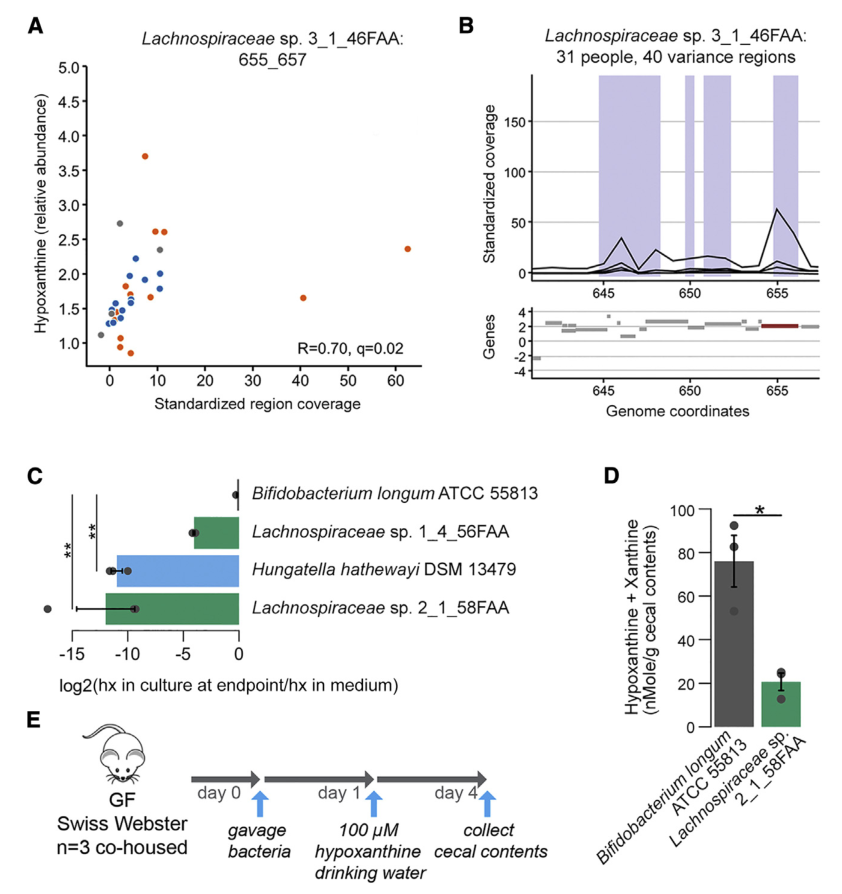

进一步检查了宏基因组的KO分析,以探索次黄嘌呤代谢的两个方面,即其在调节上皮能量状态中的作用以及在假定的氧化剂作用下生成H2O2和超氧阴离子。 与HC相比,IBS-C粪便中C氧化酶的丰度明显更高。 有趣的是,IBS-C中的超氧化物还原酶(1.15.1.2)升高,这可能反映了IBS-C肠道微生物组应对氧化应激的能力增强。 在XO活跃的情况下,这可能是必要的。

综上所述,这表明IBS患者的微生物组对次黄嘌呤的利用和分解能力增强,这与IBS-C粪便中次黄嘌呤水平的降低是一致的。
六 胆汁酸,丁酸和次黄嘌呤代谢有关
为了进一步阐明微生物对IBS中鉴定的代谢物丰度的贡献,首先基于线性模型(Maaslin2; http://huttenhower.sph.harvard.edu/maaslin)进行了直接多元相关分析。 这确定了HC样品有60种重要的代谢物种类相关性,IBS-C有28种,IBS-D有46种。 所有组均无相关性。 HC和IBSC或IBS-D中存在12个。 IBS-C和IBS-D子组都存在两种相关性。

尽管以上相关方法使我们能够识别粪便代谢物差异的潜在微生物驱动因素,但无法识别可能与检测到的代谢物差异相关的特定微生物基因。 因此,我们使用最近描述的将结构可变的基因组区域与代谢物丰度相关联的方法(SV关联),测试了可能导致各组之间代谢输出变化的特定细菌基因组区域。
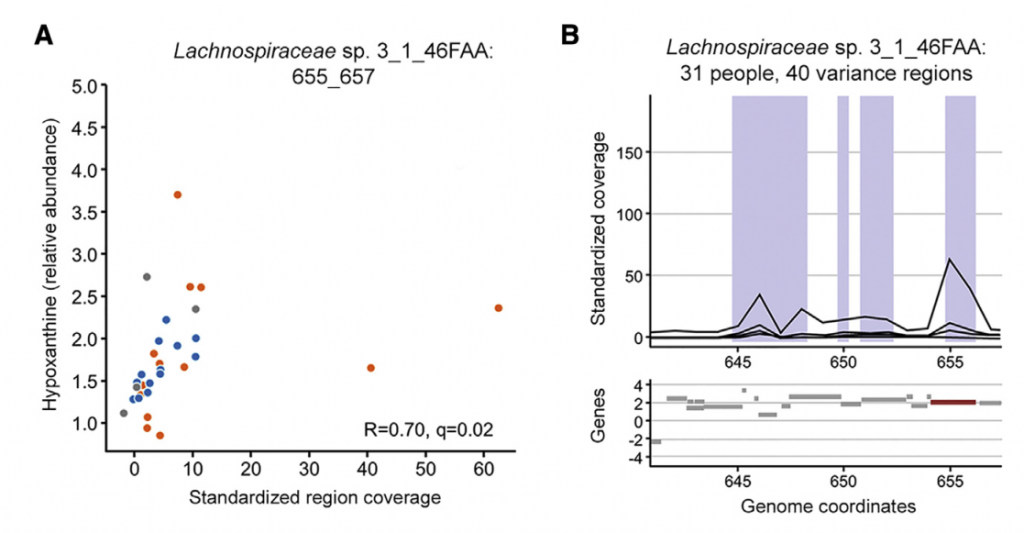
七 微生物代谢有助于次黄嘌呤水平
为了更深入地了解微生物组在降低次黄嘌呤水平中的作用,选择了与Lachnospiraceae sp的基因组相似性选择了2个Lachnospiraceae菌株进行无菌小鼠实验,结果表明现定植了Lachnospiraceae sp的小鼠的盲肠内次黄嘌呤水平明显降低。 与长双歧杆菌定植的小鼠相比为2_1_58FAA(图4E)。 由于常规使用次黄嘌呤水平会增加,这表明微生物确定的次黄嘌呤水平是微生物生产与消耗之间平衡的结果。
八 IBS患者爆发时肠道微生物组和微生物代谢产物的改变
IBS是一种症状严重程度随时间变化的慢性疾病,大多数患者会出现短暂的症状恶化。前面纵向分析确定了肠微生物组与IBS患者症状严重程度之间的潜在联系。对个别报告中显示恶化时收集的粪便样本进行分析,与非爆发基线组合IBS样本相比,爆发期样本显示出更高的BCDI),与各个IBS子组的平均样本相比,爆发期样本的Shannonα多样性更低(图5C)。 在将IBS患者作为一组时以及在IBS-D和IBS-C患者中,特定细菌类群都与耀斑显着相关(IBS-D和IBS-C患者为168种,IBS-C为40种,IBS-D为7种) 与各自平均基线样本相比,来自Mann-Whitney U检验的q <0.1(表S2)。 这些重要物种在爆发期间几乎普遍减少。发现包括色胺,CA和CDCA在内的分泌代谢物在亚组中升高爆发时IBS患者的比例(BA为6/11,色胺为4/11)。 这些观察结果表明,不同患者的症状恶化可能是独特的微生物和代谢特征。


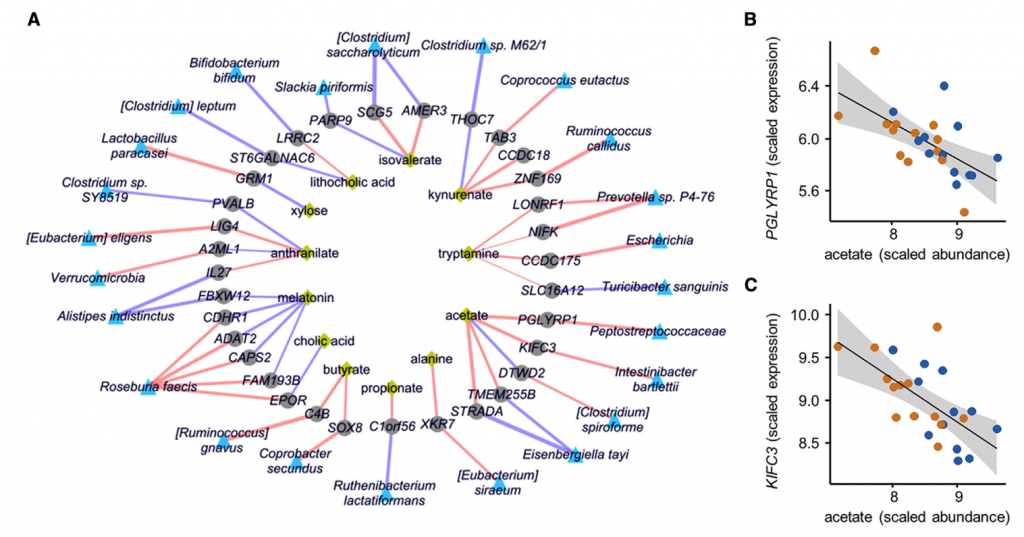
九 微生物组和代谢组学数据与转录组学和表观遗传学差异的整合揭示了IBS中新型的宿主-微生物组相互作用
对于大多数慢性疾病,IBS的病理生理是多因素的,其来自宿主途径,微生物途径和宿主-微生物共代谢。 为了确定微生物代谢对宿主功能的影响,我们首先比较了在结肠活检组织中观察到的转录和表观遗传学变化。 还通过构建跨组学相关网络,将转录组数据与代谢物和微生物群的丰度相集合,从而以无针对性的方式,使用这些数据来确定推定的宿主-微生物-代谢相互作用。

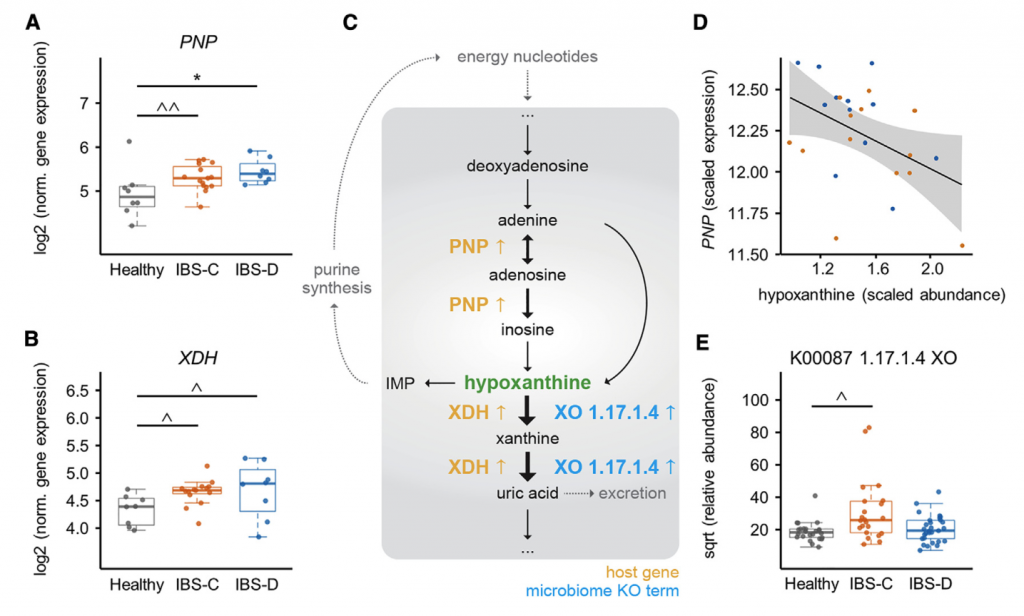

十一 多组学集成确定结肠上皮中的嘌呤饥饿是潜在的新机制IBS
前面确定了IBS-C和IBS-D中粪便次黄嘌呤的含量显着降低,确定了微生物次黄嘌呤的降解导致肠道次黄嘌呤的水平降低,并确定了功能性变化,表明IBS-C粪便中微生物组导致嘌呤降解的增加。 然而,由于次黄嘌呤是宿主-微生物共代谢物,因此其库可同时受到微生物和宿主代谢的影响。
其实,肠上皮细胞的嘌呤从头合成能力有限,而是主要依靠挽救途径进行腺苷酸的生物合成,因此,为了确定由于次黄嘌呤池的消耗而导致宿主的继发效应,需要进一步确认嘌呤挽救途径中可能的转录变化。嘌呤挽救途径中的第一个基因嘌呤核苷磷酸化酶(PNP)在IBS-C和IBS-D中均表达高2倍。在IBS患者中PNP表达呈与次黄嘌呤水平呈负相关。 重要的是,宿主遗传学的变异不负责基因表达的这些差异,因为Illumina全局筛选阵列显示XDH和PNP中的单核苷酸多态性(SNP)在IBS亚组和HC之间没有差异分布。总之,这些发现提出了一种模型,其中微生物群和宿主的嘌呤核苷酸在结肠组织中诱导代谢应激。 反过来,这可能会通过增加嘌呤挽救而导致代偿性反应。 使用这种多组学观点,我们建议低水平的嘌呤核苷酸可能导致较低的上皮能量状态和粘膜修复能力,这可能部分是IBS的病理生理基础。

研究结论
在这项研究中,我们描述了在不同IBS亚型患者的宿主生理情况下,对肠道微生物组,代谢组,宿主表观基因组和转录组进行综合纵向多组学分析的结果。IBS-D患者活检中基线结肠分泌增加,这表明上皮运输的固有变化或促进液体分泌的代谢产物增加。 观察到的促分泌素(例如主要的BA CDCA和细菌代谢物类胰蛋白酶)的增加表明,较高水平的微生物群相关分泌化合物可能会导致IBS-D分泌增加。 三组结肠活检样本之间对色胺的分泌反应缺乏显着差异,这进一步得到了支持,如果结肠上皮存在固有缺陷,这是可以预期的。
先前的研究表明,BA吸收不良驱动了IBS-D的肠道分泌增加,但是在该研究中,继发性BA与原发性BA并存的增加并没有增加,这表明原发性BA的微生物生物转化减少可能至少部分地驱动了这种作用。通过进一步有针对性地整合多个宿主和微生物组数据层,确定了嘌呤代谢的宿主-微生物途径,这可能在IBS的病理生理中起重要作用。
研究意义
这是首次将次黄嘌呤与IBS发病机制联系起来,包括先前对动物模型进行的致生菌研究。 这说明了在人类中采用多组学测量以鉴定可能依赖于基因表达中人类特异性反应的潜在疾病机制的相关性。由于黄嘌呤氧化酶抑制剂别嘌呤醇(用于治疗痛风)和硫嘌呤(用于优化炎症性肠病治疗)的可用性,次黄嘌呤是有吸引力的药物靶标。
该研究为将来的研究提供了多个新的治疗靶标。IBS-D患者中BA明显减少的微生物生物转化可以使用确定的微生物菌群进行治疗,同样,在IBS-C患者中,细菌SCFA和/或色胺的产生增加可能是可行的治疗策略。
最后,在肠道内局部刺激微生物次黄嘌呤的产生或抑制黄嘌呤氧化酶将是一种增加腔次黄嘌呤的量而没有全身作用的新方法,并且可能对独立于疾病亚型的IBS有益。
研究的局限性
研究存在一些局限性。本文主要关注结肠微生物组,但我们知道小肠可能在IBS症状的产生中起重要作用。 需要专门针对小肠微生物组的纵向研究来补充发现并增进对IBS的理解。
福利活动和技术推广
本文的浅宏基因组测序方案是针对16s分辨率和宏基因组高成本之间的一个折中方案,通过降低测序深度,但是物种的分辨率并没有低于一般宏基因组(普遍5~10G数据量)。
经过几个月的研发的测试,谷禾推出浅宏基因组测序分析服务,每个样本数据量不低于100万reads,不通过拼接组装,直接基于kraken2等kmer,或MetaPhlAn2等标记基因的参考基因组方法进行种属丰度分类。结合其到菌株的物种分类和丰度数据可较16s方案下的PICRUST更加准确的预测基因构成。周期在:2-3周左右,尤其适合粪便样本, 特别推荐,目前在推广,价格非常实惠,之比谷禾16s测序价格稍高一点,欢迎咨询和合作。
浅宏基因组分析内容

科研路漫漫,谷禾伴左右!

目前,关于肠道菌群的研究越来越多,相关科研文献数量每年递增。早期对微生物组的研究重点在于对微生物进行分类,使用临床前动物模型来了解表型等,而现有的研究更多地展示了肠道菌群的功能及其作用机制,推进基于菌群治疗技术的发展。
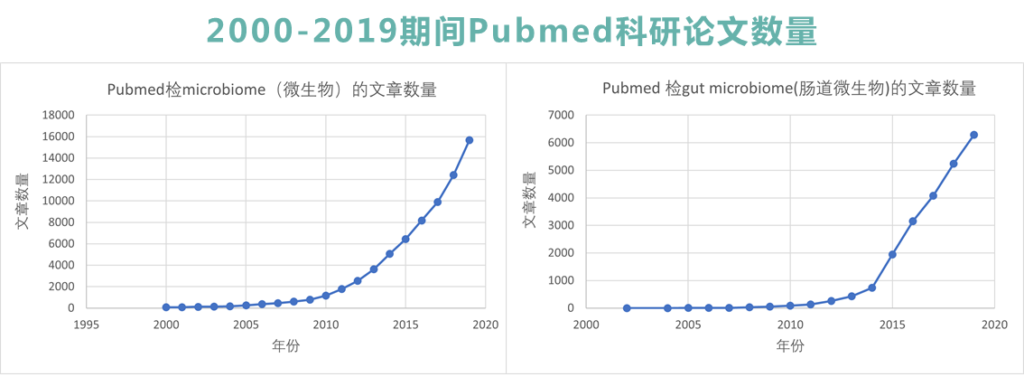
我们也有很多文章介绍了目前肠道菌群的最新研究进展,在向大家展示目前研究进展的同时,我们也一直着力于微生物组在临床上的应用。
这次,我们整理了一些谷禾数据库中关于菌群检测应用于多疾病临床辅助诊断的案例。
我们从常见的儿童疾病中选取了4例较常见的病例,分别是便秘,睡眠障碍,腹泻,自闭症。这些病例从临床症状诊断开始,结合肠道菌群检测结果进行有针对性的临床干预,取得了明显的康复效果。
孩子不吃饭,孩子不排便…这些对于家长来说都是比较头疼的事。宝宝排便情况一定程度上反映着身体健康状况。
我们知道,良好的肠道微生态环境有助于排便,改善结肠传输时间,改善便秘症状。因此,我们需要帮助孩子创建良好的肠道微生态环境。
家长也不用过于焦虑,只要通过合理调理,基本可以改善。我们选取了一个4岁患者的案例,来详细看下:

肠道菌群明显失衡,变形菌门(Proteobacteria)扩张,不动杆菌属(Acinetobacter)中约式不动杆菌滋生严重,比例达71.607%。
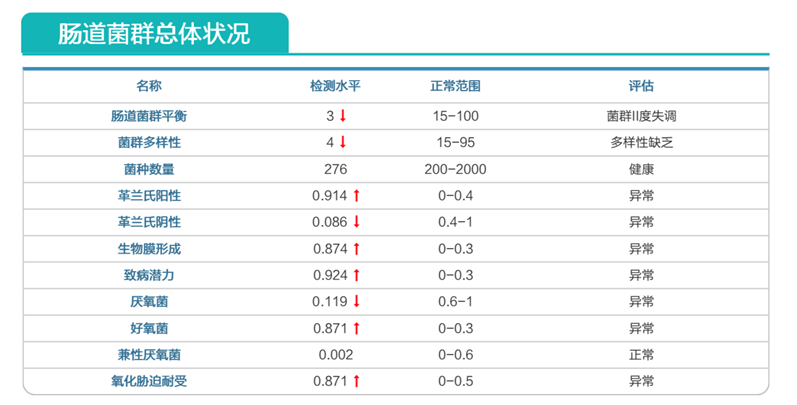
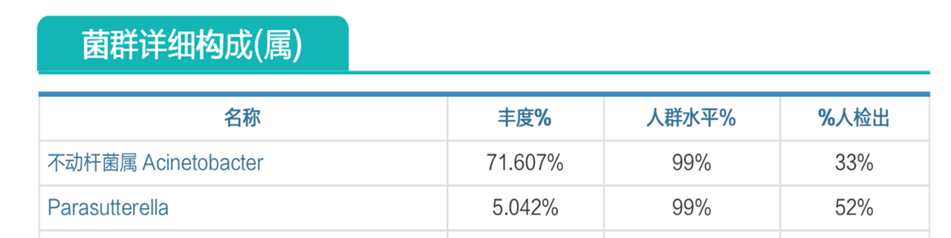
营养评估里面有明显缺乏项,如下:
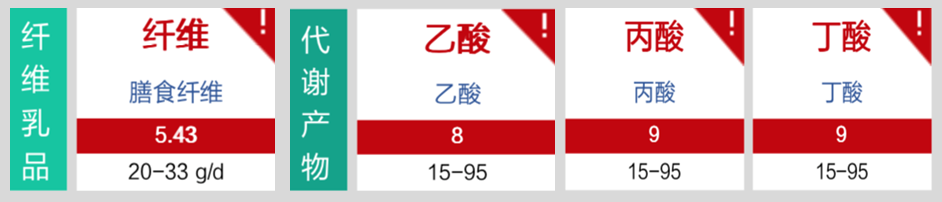
优先解决不动杆菌感染问题;
临床用抗生素治疗。
增补膳食纤维;
混合膳食纤维10g/天;
特定益生菌补充;
清淡饮食,控制饮食中的油脂、肉类总量, 引入粗纤维食材、蔬果等。
2个月后复查菌群,结果如下:
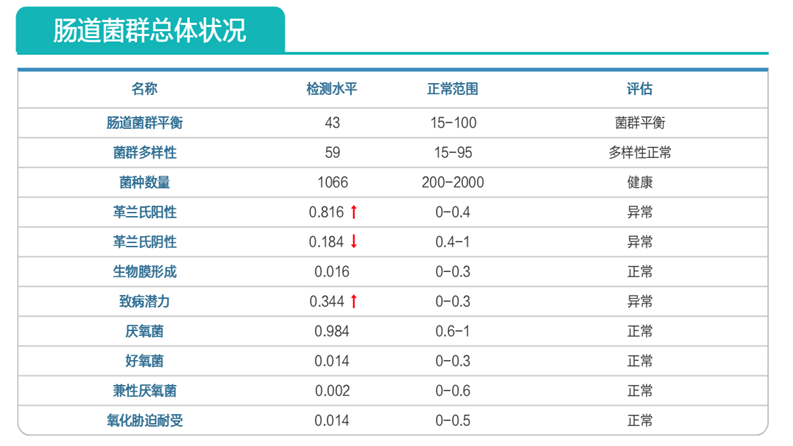
约式不动杆菌感染问题已解决;
菌群结构明显改善。
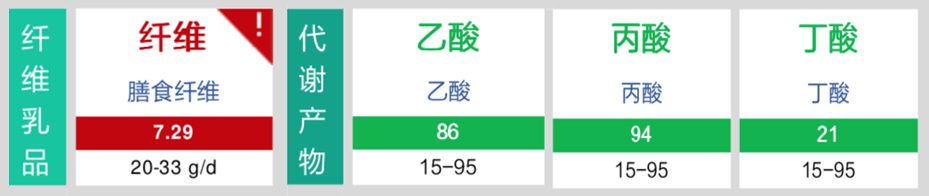
膳食纤维总量提升
短链脂肪酸合成正常

便秘问题明显改善,目前1-2天一便,且形态气味正常。
情绪改善,注意力更集中。
体格发育明显,身上明显更结实。
目前再未发现腹胀、腹痛的情况。
对于宝宝来说,睡眠质量直接影响其身体健康和发育。有些睡眠障碍不仅给孩子身高、免疫力等发育带来影响,还会影响记忆力、智力等潜在发育,更是让家长深受困扰。
以下这个案例是一个11个月宝宝的睡眠障碍问题,进行菌群检测后发现营养缺乏严重,我们来看下具体情况:

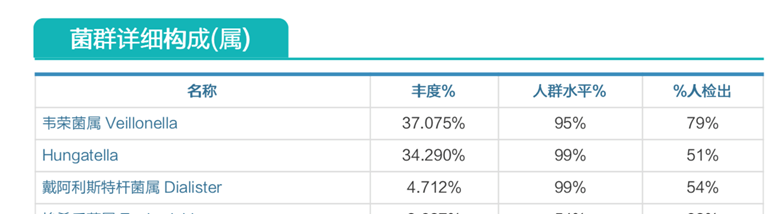
肠道菌群明显失衡,韦荣菌属、Hungatella、戴阿利斯特菌属病理性滋生;

酵母菌感染。
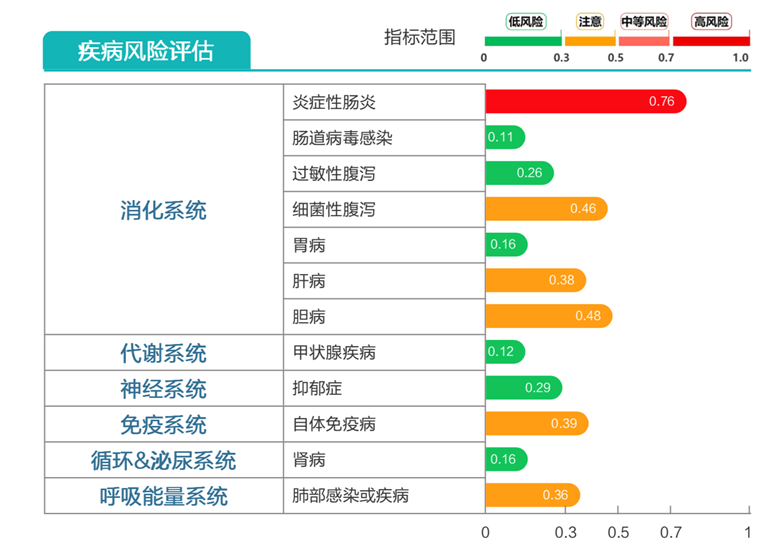
炎症性肠病高风险。
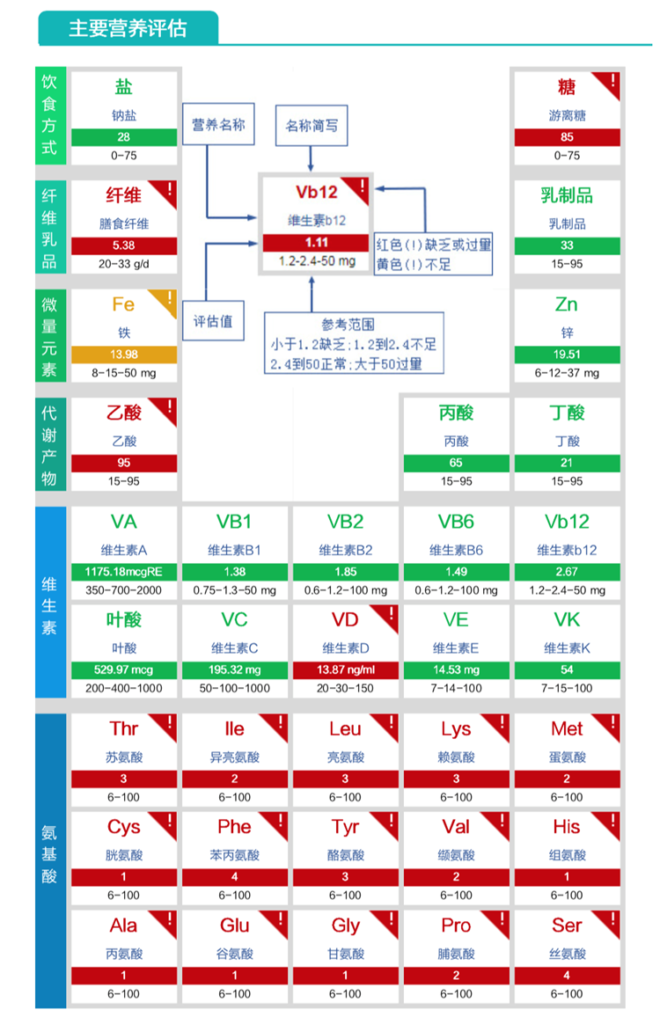
膳食纤维缺乏、VD缺乏、氨基酸成分严重缺乏。
经菌群检测后,补测血液免疫指标,见抗链O超标,提示感染存在。
考虑到目前情况,未见肝功异常,且同时存在细菌、真菌异常。
处理微生物问题;
抗生素治疗
益生菌补充;
由于患儿小龄,特定的益生菌组合;
维生素D补充;
氨基酸奶粉补充。
肠炎备选治疗方案。

在用抗生素的当晚,近2月的睡眠障碍直接改善。
睡眠稳,仅见腹部咕噜声;无夜醒、无夜哭。且后无复发。
益生菌、VD、氨基酸奶粉补充后,大便正常、残渣消失;目前处香蕉软便状。
未到复查期,但身体已基本恢复正常。
在医院每天都会有家长咨询关于宝宝腹泻的问题,宝宝的不正常便便让家长十分紧张,比如说突然开始腹泻,反反复复……
这时候有些家长情急之下根据以往的经验就开始给宝宝吃药,这是比较冒险的选择,如果不对症,容易引起宝宝肠道损伤。
有些家长怕宝宝接受各种检查不舒服,其实随着现代化医疗水平的发展,有很多检测项目可以选择。例如肠道菌群检测,下面这个就是关于4个月婴儿反复腹泻的临床案例。

初次肠道菌群检测结果:
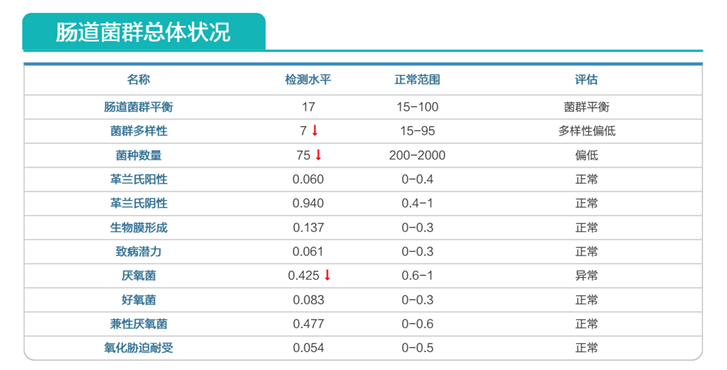
肠道菌群多样性降低


链球菌感染、艰难梭菌感染;
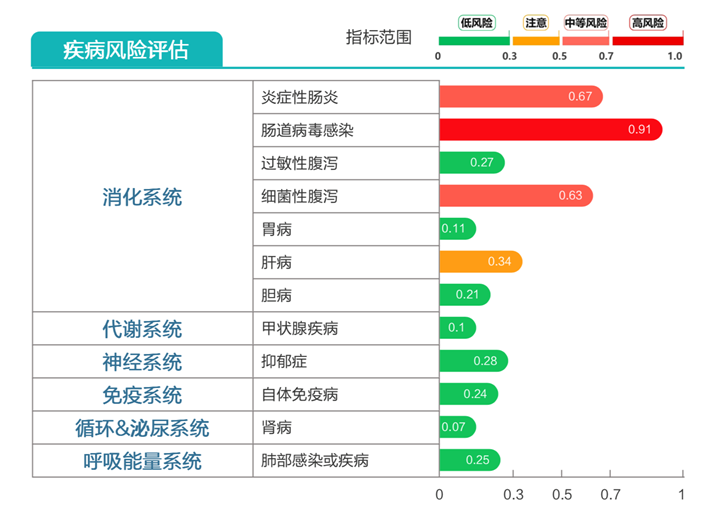
炎症性肠病高风险;
病毒性腹泻、细菌性腹泻高风险。
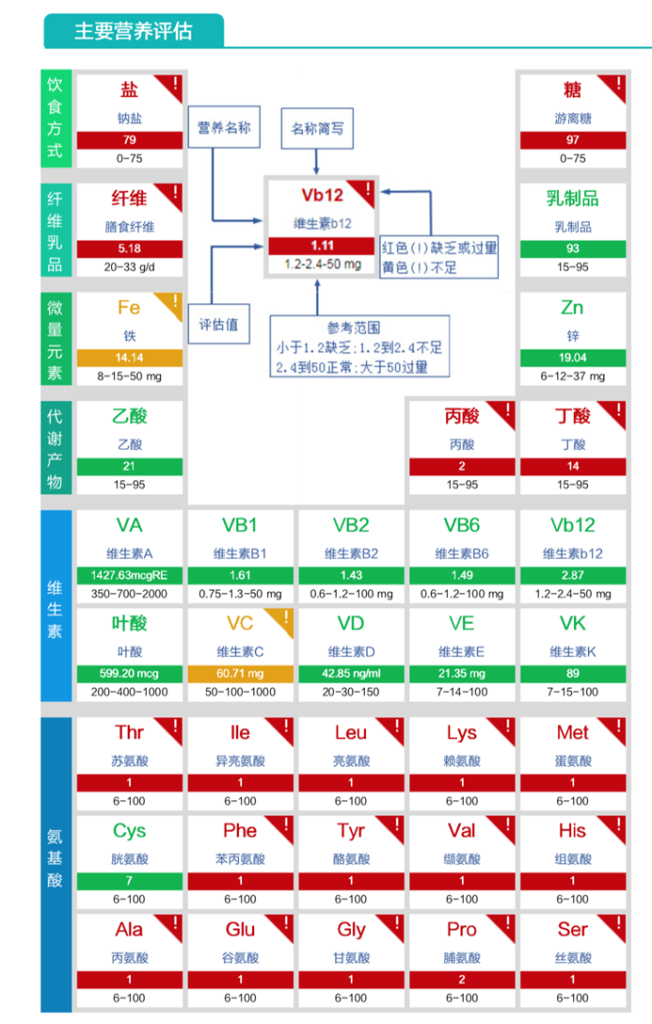
膳食纤维缺乏、丙酸与丁酸缺乏、氨基酸成分严重缺乏。
处理微生物问题;
抗生素治疗
益生菌补充;
由于患儿小龄,特定的益生菌组合;
氨基酸奶粉补充。
营养以及特定维生素补充。
治疗后1个月后复查菌群,结果如下:

链球菌感染已解决,但艰难梭菌仍超标。

菌群结构明显改善;营养状态改善。
考虑到肠道症状的明显改善,与生长发育的改善。认定先前的肠道问题以链球菌感染为主,艰难梭菌为辅。
目前未见肠道问题且患儿明显改善,决定暂时对艰难梭菌姑息治疗。待患儿身体更佳时再行复查治疗。

抗生素治疗4天腹泻止,一周后复查便隐血无。
抗生素治疗与益生菌补充后,消化正常,无腹泻,大便成形,但微臭。
益生菌、VD、氨基酸奶粉补充后,大便正常、残渣消失;目前处香蕉软便状。
孤独症谱系障碍又称为自闭症,自闭症其实并不算罕见,《中国自闭症教育康复行业发展状况报告III》中的数据显示,在我国,基于比较保守的推算,自闭症发生率为1/100,其中儿童约占300万左右。
看起来1%的发病率,落到一个孩子,一个家庭上,就是巨大的阴影,多少父母在孩子确诊后崩溃地痛哭……
对于自闭症,虽然目前尚未有完全治愈自闭症的方法,但是早发现、早干预对于预后发展是非常重要的作用。自闭症治疗的黄金时段是1-3岁,一旦错过最佳时期,难度就加大了。
接下来我们这个案例是一个3岁的患者,在被诊断为自闭症的同时,也伴有一些其他症状。

初次肠道菌群检测结果:
报告中可以看到,肠道菌群失衡明显。


存在肺炎克雷伯式菌感染问题;戴阿斯特菌属病理性滋生。
营养状况差
短链脂肪酸合成异常。


意识明显清醒,注意力集中。
能坐住,情绪好,无尖叫情况。
康复机构反应配合度高,进步大。
益生菌、膳食纤维等补充后,大便正常。目前处香蕉软便状。
氨基酸奶粉补充后,面色正常。
目前治疗后3个月,整体稳定。计划复查持续治疗。
肠道菌群临床应用治疗一般路径:

精准检测+精准干预应该是未来肠道菌群临床应用和发展的趋势,目前国家正在加大在肠道菌群研究上的科研资金和人才投入,肠道菌群真正应用于临床并造福病人需要扎实的临床数据和更多的临床积累。我们会积极探索和与更多临床科室合作,将谷禾多年的菌群检测与临床需求相结合,科学和精准的推进临床诊疗的应用落地。
本期分享的多例儿童临床案例展现了肠道菌群与临床相结合的一些应用和实践,未来随着数据和案例的积累,我们还会在更多科室和应用场景见到肠道菌群为临床提供多种视角和更精确化的干预方案。
感谢湖南省妇幼保健院和齐鲁医院提供的病例。
相关阅读:
国庆前实验室的收样时间截止9月30日,客户的样本必须在9月29日前送到实验室会安排节前上机。国庆期间10月1日至10月8日实验室无法收样。
原定国庆期间出具报告的样本报告将延后到10月9号后出具。

杭州谷禾信息技术有限公司
2020年9月14日

谷禾健康
最近,欧洲心脏病学杂志《European Heart Journal》发表了荷兰由阿姆斯特丹大学研究的最新成果:“Associations between gutmicrobiota,faecal short-chain fatty acids, and blood pressure across ethnic groups: the HELIUS study(不同民族群体间肠道菌群、粪便短链脂肪酸和血压之间的关系)”,这是首个评估不同种族肠道菌群组成与血压关系的研究。研究人员发现肠道菌群组成和血压之间存在一致的联系,而年龄和种族之间的解释差异很大。

摘要
文章主要调查了不同种族人群肠道菌群、粪便SCFA水平和血压之间的关系。研究人员纳入了来自6个不同种族的4672名受试者(平均年龄49.8±11.7岁,女性占52%)。使用16S rRNA基因扩增子测序对肠道菌群进行分析。利用机器学习预测模型评估菌群组成和室血压之间的关系。在相关性最大的亚组中,比较了200名收缩压较低或较高的受试者的粪便SCFA水平。结果表示,粪便微生物群组成可解释总收缩压方差的4.4%。对收缩压最好的预测因子有Roseburia spp.、梭状芽孢杆菌属、Romboutsia spp.和瘤胃球菌科。微生物群落组成的解释方差在荷兰人中最高(4.8%),但在南亚苏里南人、非洲苏里南人、加纳人、摩洛哥人和土耳其人后裔中很低(解释方差<0.8%)。在低收缩压的年轻的荷兰受试者中,粪便SCFA水平,包括醋酸(P<0.05)和丙酸(P<0.01)水平较低。
背景
高血压是心血管疾病发病率和死亡率的主要可改变危险因素,因此是全世界可预防死亡的最重要危险因素。原发性高血压的发病机制尚不完全清楚,目前被认为是遗传和心血管危险因素复杂的相互作用造成的。来自动物和人类研究的初步证据表明,肠道菌群组成和菌群衍生代谢物的水平,包括短链脂肪酸(SCFAs),都与血压(BP)有关。肠道菌群产生的主要代谢物是短链脂肪酸(SCFAs),这是膳食纤维在肠道发酵的最终产物。动物研究指出,通过肾脏和血管中的SCFAs受体介导,粪便中的SCFAs与血压之间存在直接联系。在人类研究中,证明粪便中SCFA水平与血压之间的关系的证据很少且粪便SCFAs的高低都与较高的血压有关。假设肠道菌群和SCFAs确实与高血压有关,这将为高血压的发病机制和治疗提供新的视角。
实验设计
受试者研究:
随机抽样年龄在18岁到70岁之间的人,按种族分层(荷兰人、南亚苏里南人、非洲苏里南人、加纳人、土耳其人或摩洛哥人)。只选择有可用的血压测量、体重指数(BMI)和粪便样本的参与者。所有参与者都被要求戒烟。体重指数根据身高和体重计算。在仰卧位休息至少5分钟后测量血压,使用经过验证的半自动振动装置连续测量的两次平均值。在静脉血标本中测定空腹血糖和肌酐水平,并使用CKD-EPI公式计算肾小球滤过率(eGFR)。从清晨尿样中测定尿白蛋白/肌酐比值,蛋白尿的定义为大于等于30 mg/mmol。糖尿病的定义是空腹血糖水平升高(≥7 mmol/L)或服用降糖药物。高血压定义为收缩压SBP >140 mmHg或舒张压(DBP)>90 mmHg或使用了降血压药物。
样本采集及16S rRNA扩增子测序
粪便样本采集后需在6小时内处理,如若不能,-20℃最多存放一天,在这期间必须转移至-80℃存放。在采集前一周内出现腹泻或在采集前3周内使用抗生素的参与者的样本不予使用。使用Illumina MiSeq测序16S rRNA基因的V4区来确定粪便微生物群的组成。
粪便短链脂肪酸测定方法
采用高效液相色谱(HPLC)紫外检测粪便中SCFA的含量。对于所有样品,在均质粪便冷冻干燥24小时后测定干重。由HPLC测量得到的所有浓度都根据每个样品的湿重和干重的差异进行了校正。
统计分析
使用机器学习模型来评估肠道菌群组成和血压之间的关系。对全部研究人群和按年龄(<50岁,>50岁)、性别和种族的亚组进行了分析。模型是使用迭代流构建的。在每次迭代中,数据集被随机分成包含20%的参与者的测试集和包含剩余80%的训练集。之后,严格在训练集内进行五次交叉验证,以拟合和优化模型超参数。最后在测试集上对得到的模型进行了评估。在每次迭代期间,两个随机变量被添加到预测器数据中作为基准。Mann-Whitney U检验比较高血压组和低血压组之间粪便SCFAs浓度和丰度。
主要结果
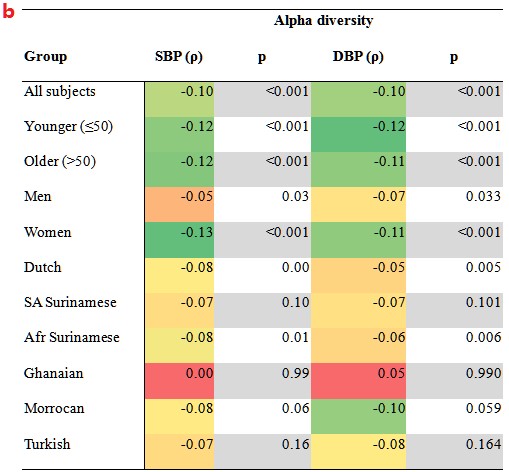
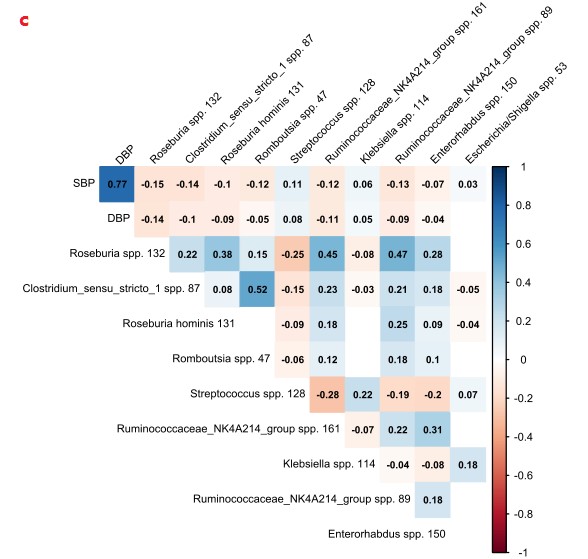
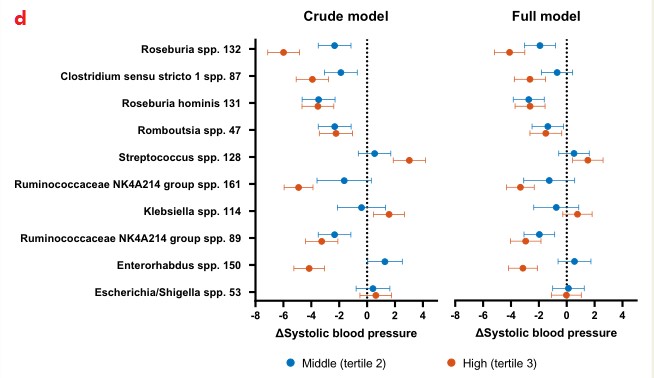
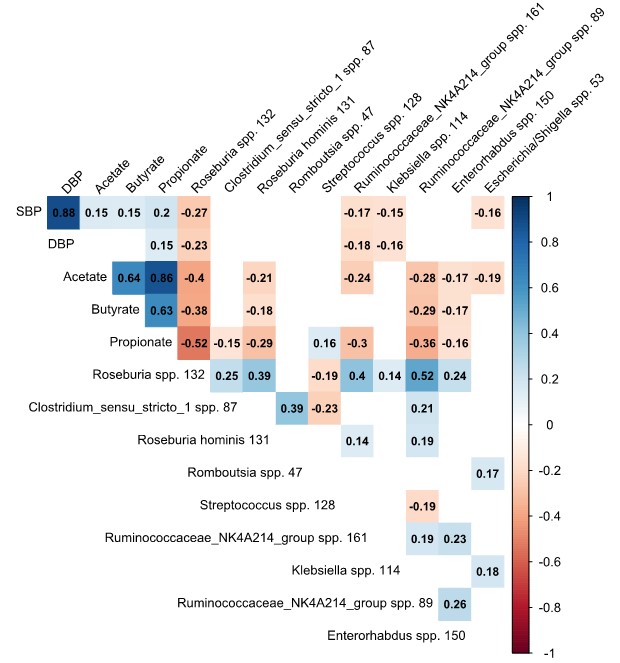
1.肠道菌群的组成与血压有关,而血压在不同种族之间存在很大差异。
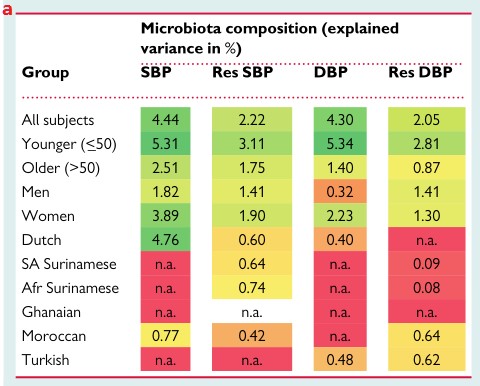
a.解释了不同亚组中的肠道微生物组成百分比的变化对血压的影响。在整个队列中,基于肠道菌群组成的机器学习模型可以解释SBP和DBP的4.4%和4.3%的方差,而在年轻人、女性和荷兰人亚组中解释的差异最高。颜色表示解释方差的水平。Afr Surinamese:非洲苏里南人;DBP:舒张压;n.a.:解释这些模型的方差为负;Res:根据年龄,性别,BMI调整的残差;SA Surinamese:南亚苏里南人;SBP:收缩压。
b.不同亚群中微生物群落的香农指数与血压的相关性。(p):相关系数;p:相关性的显著性。在年轻人、女性和荷兰人亚组中显示出与血压的相关性更强。
c.预测到的前10个物种与收缩压的关联图(P<0.0 5,Spearman),除链球菌和克雷伯菌外,其余物种均与SBP和DBP均呈负相关。格子中的数值表示每个物种的相对丰度与收缩压(SBP)和舒张压(DBP)之间的相关系数。红色为负相关,蓝色为正相关,颜色越深,相关性越强。
d.在回归分析中,这些物种的影响效应介于SBP降低6.0 mmHg和升高3.0 mmHg之间,大多数物种的效应大小随着丰度的增加而增加。Roseburia spp对血压的绝对影响最大:中/最高值与收缩压分别为2.3 mmHg (95%CI 1.2-3.5)和6.0 mmHg (95%CI 4.9-7.1)。
Crude model:粗略模型(根据年龄和性别进行校正);Full model:对体重指数、吸烟、使用降压药和糖尿病病史进行额外校正,校正BMI和其他协变量后,效应影响减弱到2-4 mmHg,这表明BMI只是造成这种影响的部分原因。
2.虽然产生SCFA的微生物与较低的血压相关,但粪便中SCFA水平的增加与较高的血压相关。产生SCFA的微生物与粪便SCFA水平呈负相关。因此推测,较高的SCFA上调了肠道对SCFA的吸收,从而导致粪便中SCFAs排泄水平相对较低。
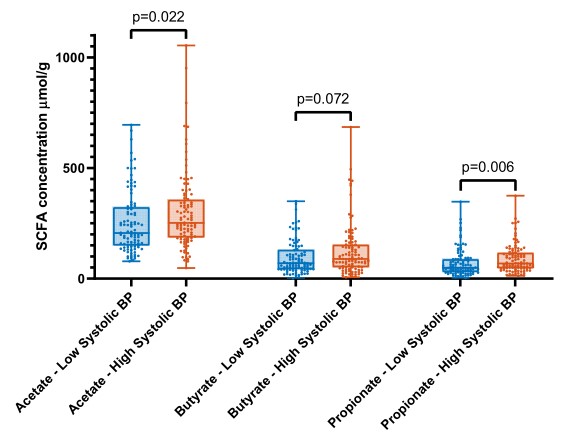
将荷兰参与者的年龄、性别和BMI进行配对,结果有100名参与者的收缩压较低,100名参与者的收缩压较高,对这200名受试者进行高、低血压(BP)与短链脂肪酸(SCFA)水平的比较(盒形图),Mann-WhitneyU统计差异(P<0.0 5)。低收缩压受试者粪便中醋酸(P=0.022)和丙酸(P=0.006)水平显著降低,丁酸水平也有降低趋势(P=0.072)。此外,粪便SCFA水平与前10位物种呈负相关,与SBP、DBP呈正相关(关联图)。
结论
这是首个评估不同种族肠道菌群组成与血压关系的研究。研究人员发现肠道菌群组成和血压之间存在一致的联系,而年龄和种族之间的解释差异很大。观察到的产生SCFA的微生物与血压之间的关联,为SCFAs在血压调节中发挥作用的假设提供了进一步的证据。研究人员认为未来在研究肠道微生物区系与血压的关系时应该考虑到种族差异。用SCFAs进行干预研究,可以更深入地了解这些代谢物对血压的潜在机制。
欢饮关注谷禾健康,专注做肠道菌群检测

世界卫生组织(WHO)已将癌症确立为一种全球威胁,每年夺去大量生命。 仅在2018年,它就造成960万人死亡,是全球第二大死亡原因。癌症仍然是主要的健康灾难。
最近的研究已指出人类共生肠道微生物群参与调节化学疗法和免疫疗法的结果。 它主要是通过调节药物的代谢和宿主免疫反应来实现的。
在过去的十年中,在诸如外科手术,化学疗法,放射疗法,免疫疗法和激素疗法之类的针对癌症的治疗方式的进步上的不懈而巨大的努力已经成功地改善了大多数患有该疾病的个体的临床结果。
然而依然会发现许多不利因素,例如,肿瘤复发和转移的频率增加以及新兴的癌症耐药性,此外,大多数抗癌药物对正常细胞仍具有攻击性。这些都影响了生活质量,且癌症患者的死亡人数仍然居高不下。

我们需要对肿瘤发生基础的多因素病因有更清楚的理解,这有助于增强抗癌治疗的有效性。值得关注的是,一些研究表明,人体中存在的微生物是致癌作用的关键决定因素,可以影响癌症的发生,进展,最重要的是对治疗的反应。
人体是数万亿种微生物的生态家园,它们与宿主健康的维护密切相关。诺贝尔奖获得者约书亚·莱德伯格(Joshua Lederberg)于2001年将这样的微生物群落称为“微生物组”。
微生物遍布全身,其中肠道微生物群是最受欢迎和研究最深入的系统。人的肠道微生物主要包含细菌,病毒,真菌,古细菌和小型原生动物的异质等。
最新研究强调了肠道菌群对宿主健康的不同作用。 肠道内的微生物通过调节大量的基本生物学过程,在宿主系统内提供保护并维持体内平衡。 这些可能包括监测上皮的发育,营养吸收,代谢功能和先天免疫反应,包括免疫细胞的活化和成熟,防止全身性渗透和肠道病原体排出。
相反,对这种自然存在的原有菌群的扰动,被称为微生物失调,与各种病理状况有关,例如糖尿病,肥胖症,炎性疾病,代谢综合症,肝硬化甚至各种癌症。
宿主和肠道微生物群共同努力的结果是,全身功能(如能量平衡,营养,代谢,认知功能,心血管功能,昼夜节律,炎症,先天性和适应性免疫)之间的微妙平衡。
肠道菌群的各种成员,包括拟杆菌属,乳杆菌属和双歧杆菌属,与某些食物的消化密切相关。肠道微生物群除了影响脂类和蛋白质的稳态以及必需营养维生素的合成外,还有助于维持能量平衡。
此外,肠道体液和细胞黏膜免疫系统的正常发育是由肠道菌群分泌的代谢物和信号分子介导的。
肠道微生物群可调节多种生理功能
肠道微生物通过调节大量的系统功能,在维持宿主正常健康方面起着关键作用。它对中枢免疫系统、消化系统和其他系统有很大的贡献。肠道微生物群本身会受到多种外部因素的影响,如饮食、抗生素的使用和不同的治疗模式。这种修改反过来又会影响其监管功能。
随着宏基因组学以及涉及下一代测序(NGS)和16S rRNA扩增子计算分析的多学科方法的出现,人们对肠道微生物组多样性和丰富度有了更多的了解,宏基因组测序已揭示癌症患者中微生物群落的显著改变。
胃癌:
从胃癌患者提取的组织中检测到厚壁菌、变形菌、放线杆菌和梭杆菌。此外,胃癌症患者表现出21个细菌类群的显著富集,包括核梭杆菌、微小微胞菌、血管紧张链球菌和消化链球菌口炎,并减少了10个分类群。
胰腺癌:
一项宏基因组研究还表明,口腔中存在嗜血杆菌、卟啉单胞菌、瘦肉杆菌和梭杆菌属物种与胰腺癌的风险增加有关。
16srrna基因测序预测卟啉单胞菌、放线菌、奈瑟菌、链球菌、类双歧杆菌和梭杆菌在胰腺癌的发生发展中起重要作用。
结直肠癌:
研究表明,大肠埃希菌、脆弱类杆菌和厌氧消化链球菌具有致癌潜力,可诱导遗传毒性应激、胆固醇生物合成和激活Th1免疫反应。宏基因组分析发现,在结直肠肿瘤患者中,除了明显的病毒组特征外,微小单胞菌、消化链球菌、梭杆菌和卟啉菌都有明显的积累。
另有更详细的研究表明,CRC相关菌群可分为三种不同的模式。

肝细胞癌:
肝癌发生发展涉及慢性肝细胞死亡、炎症和肝组织修复诱导的纤维化等多个阶段。肠道菌群的变化趋势如下:
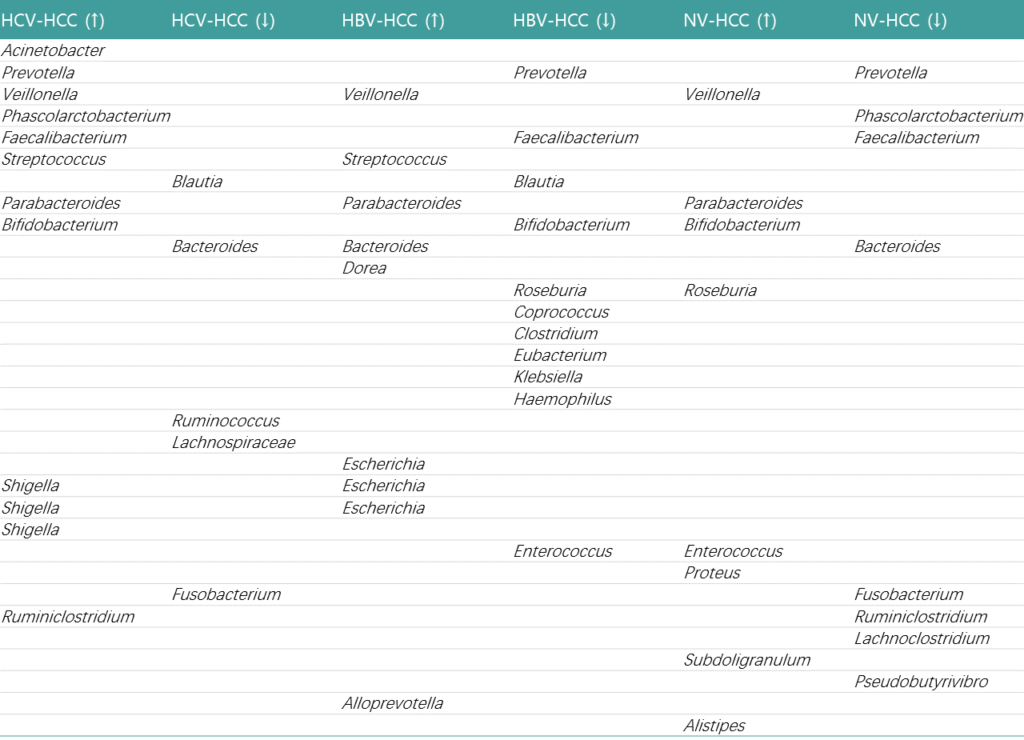
注:HCC-肝细胞癌;HBV-HCC: 乙肝感染引起肝细胞癌;HCV-HCC: 丙肝感染引起肝细胞癌;NV-HCC: 非病毒性肝细胞癌
癌变起因于肠道微生物群的生态失调
良好平衡的肠道微生物群对健康生活十分重要。而肠道微生物群的失调会加剧不同癌症的致癌发展。
几项使用无菌小鼠模型的临床前研究揭示了肠道微生物组通过不同机制在癌症发生和进展中的作用。
肠道微生物群积极参与肿瘤的发生和发展

癌症的发生是一个动态的过程,许多内在因素促成了它的发生。肠道微生物群在决定转化细胞的命运方面起着至关重要的作用。微生物失调可能会促进肿瘤的发生,并导致肿瘤转移。
促癌微生物最突出的例子是幽门螺杆菌,它会感染胃并刺激胃癌的形成。幽门螺杆菌是唯一获得IARC认可的I类人类致癌物的细菌。 其主要作用方式包括分泌毒力因子,主要是空泡细胞毒素A(vacA)和细胞毒素相关基因A(CagA).
这些已被证明可以激活致癌途径,从而异常转化细胞增殖,细胞周期转变和细胞死亡。 可以诱发癌变的其他间接机制包括氧化应激的产生。
这有助于促进突变的基因组不稳定性和宿主炎症和免疫反应的操控,从而帮助肿瘤细胞逃避免疫监视. 例如,幽门螺杆菌和粪肠球菌成功诱导氧化应激,从而导致基因组损伤并最终导致肿瘤发生。
参与肿瘤发生的肠道菌群列表

其他毒素,例如大肠杆菌产生的大肠杆菌杆菌毒素和细胞致死性扩张毒素(CDT)表现出DNase活性,为DNA损伤铺平了道路,最终导致异常的细胞周期,基因组攻击和致瘤性进展。肠杆菌科的Colibactin类似地在宿主细胞中诱导DNA双链断裂。
致病性弗氏志贺氏菌是肠道微生物的另一个例子,其酶肌醇磷酸磷酸酶D(IpgD)和半胱氨酸蛋白酶样毒力基因A(VirA)介导宿主p53降解。
另一方面,梭菌梭状芽胞杆菌(Clostridium scindens)参与胆酸向脱氧胆酸(DCA)的转化,所述脱氧胆酸起肿瘤诱导剂的作用。DCA还参与了花生四烯酸的释放,花生四烯酸被COX-2和脂氧合酶转化为炎症分子前列腺素和DNA损伤剂活性氧(ROS).
粪肠球菌可促进细胞外超氧化物(O2-)的产生,从而引入DNA双链断裂和点突变。
某些炎性细菌,例如沃兹沃氏菌(Bilophilia wadsworthia)参与了肿瘤诱导剂的生成,例如牛磺胆酸。
核梭状芽孢杆菌的FadA通过凝集素和宿主上皮细胞的E-钙粘着蛋白的结合诱导β-连环蛋白。β-catenin的核易位通过激活c-MYC癌基因诱导细胞增殖。
具核梭杆菌的另一种细菌致病因子Fap2抑制T淋巴细胞和自然杀伤(NK)细胞的作用,从而阻止了髓样抑制细胞在肿瘤部位的募集。
肠道菌群通常有助于产生短链脂肪酸(SCFA),例如甲酸,乙酸,丙酸和丁酸。这些SCFA通常参与多种生理功能,例如激活G偶联受体,抑制组蛋白脱乙酰基酶(HDAC)以及将T细胞分化为效应T细胞(例如Th1和Th17细胞),从而赋予整体抗肿瘤功能。
肠道菌群负责循环中性粒细胞的成熟以及循环单核细胞的昼夜波动。通过分泌白介素(IL)-10和转化生长因子(TGF)-β参与促炎反应下调的调节性T细胞(Tregs)也被某些肠道菌群激活。例如,脆弱的共生拟杆菌(Bacteroides fragilis)有助于Treg细胞的成熟和抗炎细胞因子IL-10的分泌。
重要的是,丁酸和丙酸参与了CD8+ 细胞毒性T淋巴细胞的调节表达,而CD8+ 细胞毒性T淋巴细胞是抵抗肿瘤活性的主要哨兵。已知微生物配体的产生会诱导核因子κB(NF-κB)的活化,从而驱动促炎性细胞因子,例如肿瘤坏死因子(TNF)-α或IL-1的分泌。共生菌在肠道内的定植还导致了来自Paneth细胞的重要抗菌肽的表达。
脂多糖(LPS)和肽聚糖是革兰氏阴性细菌外膜的重要组成部分,它们通过激活宿主Toll样受体(TLR)导致肠道免疫调节,而Toll样受体主要由肠上皮细胞和树突状细胞表达(DC)。这些TLR积极参与介导针对肿瘤细胞的T细胞反应。
除此之外,细菌产物诱导IFN-γ的表达,从而影响中性粒细胞的存活和成熟。低水平的细菌LPS可能会对髓样细胞的活化产生巨大影响,从而引发增强的炎症反应。
更具体地说,细菌产生的吡哆醇可用于刺激宿主免疫监视。几种活细菌,如果摄入足够的量,它们能够给宿主带来健康益处,因此可能发挥益生菌的作用。此类益生菌微生物有助于保护宿主肠道稳态,并在很大程度上调节宿主生理和免疫力。这些结果揭示了健康肠道微生物群的日常功能,这是维持宿主内正常内环境平衡的必要条件。
一些证据清楚地表明,调节肠道菌群可以提高治疗效果,减轻化疗药物的副作用。
肠道菌群对化疗药物疗效和毒性的调节作用

上表总结了几种常用的治疗各种恶性肿瘤的化疗药物及其与肠道微生物的关系。
细菌通过多种机制影响化疗药物和免疫检查点抑制剂的疗效,如下图:
肠道细菌调节抗癌药物疗效的机制
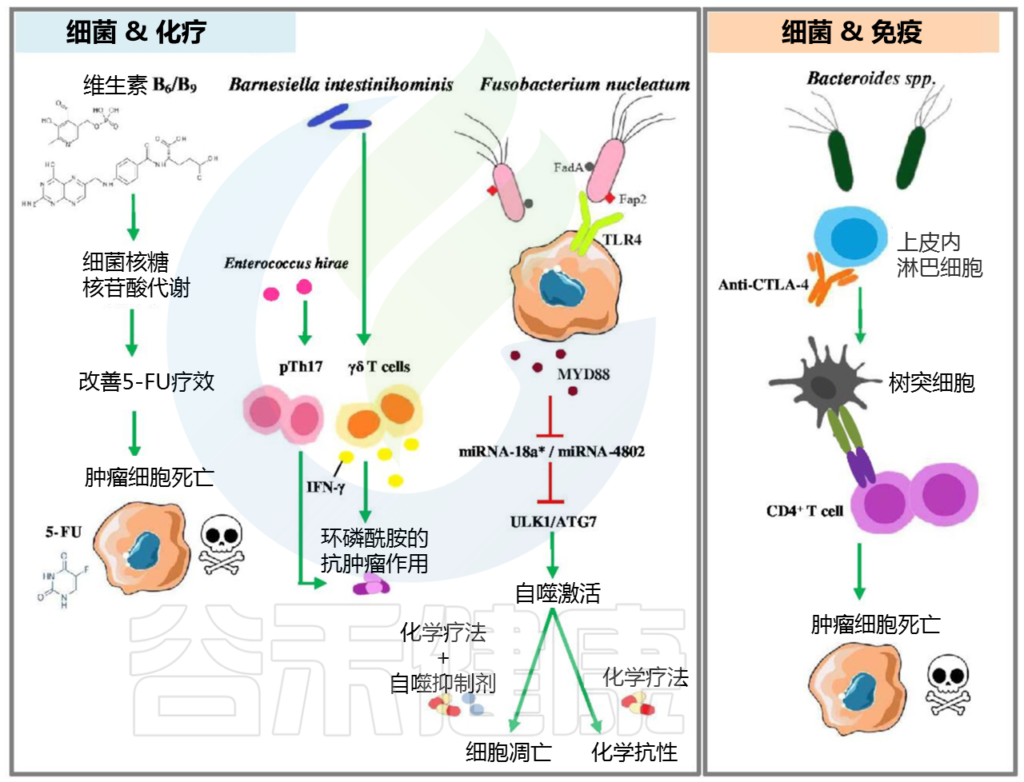
微生物转化的代谢物一旦进入循环,就可以到达人体内遥远的器官,影响那里的癌症发生。例如,在肝癌中,肠道定植者代谢胆汁酸,胆汁酸经过再循环,调节免疫细胞向癌区募集。
肠道微生物的雌激素代谢也改变了绝经后妇女患乳腺癌的风险。肠道失调加上分泌β-葡萄糖醛酸酶的微生物水平增加,如瘦肉梭菌和球菌,显著激活雌激素受体,刺激靶细胞(主要是乳腺和子宫内膜)的细胞增殖。雌激素摄取的增加与乳腺癌的发生直接相关。
肠道微生物群的变化是否会导致癌症的发生,或者致癌转化是否会刺激微生物组的这些变化,仍然是个模棱两可的问题,因此需要进行深入的研究。
细菌素是主要由所有细菌核糖体合成的阳离子肽。癌细胞膜的主要负电荷使细菌素优先结合到癌细胞而不是健康细胞上。
革兰氏阴性菌的细菌素分为微球菌素、大肠杆菌素和泰洛霉素。牛链球菌HC5的牛维素HC5抑制MCF-7等乳腺癌细胞的生长。
由大肠杆菌和其他肠杆菌科合成的大肠杆菌素,特别是大肠杆菌素E1和A,可以抑制乳腺癌细胞系MCF7、ZR75、BT549、BT474、MDAMB231、SKBR3和T47D等多种乳腺癌细胞株的生长,对结肠、骨和子宫等恶性肿瘤也有抗肿瘤作用。
肺炎克雷伯菌分泌的大肠杆菌素microcin也具有很好的肿瘤抑制和凋亡功能,在Jurkat、HeLa和结直肠癌细胞系中都有观察到。然而,它对正常细胞没有任何毒性。
对HeLa和HT29细胞株特异性的细胞毒性作用与从Pediococcus acidlicati中提取的pediocin有关。
细胞溶血素A是一种细菌毒素,可引起胱天蛋白酶介导的细胞死亡。用大肠杆菌或鼠伤寒沙门氏菌治疗的小鼠,可以产生细胞溶血素A,已经显示出很有前景的抗癌机制。
同样,革兰氏阳性菌的侧凸蛋白10(LS10)对MCF-7乳腺癌细胞的抑制活性最高。
此外,Nisin是世卫组织批准的乳酸乳杆菌Ⅰ类细菌素,可显著抑制人肝细胞癌、头颈癌和乳腺癌细胞的侵袭和转移。
铜绿假单胞菌产生的一种含铜金属蛋白Azurin(14kda,128个氨基酸),通过抑制肿瘤细胞中cop1介导的泛素化和蛋白酶体降解,增强p53的细胞内稳定性。Azurin对乳腺癌细胞株MCF7、ZR-75-1、T47D、MDA-MB-157、MDD2和MDA-MB-231也具有潜在的抗癌活性。
此外,肺炎链球菌分泌的Pep27anal2可诱导胱天蛋白酶非依赖性和细胞色素依赖性凋亡,从而显著阻断白血病、胃癌和乳腺癌细胞系的细胞增殖。
肠球菌产生的Entap对三阴性乳腺癌细胞株MDA-MB-231具有良好的抗增殖活性。
白喉毒素(DT)由白喉棒状杆菌产生。交叉反应物质197(CRM197)是白喉毒素的无毒突变体,通过与肝素结合的表皮生长因子结合促进细胞凋亡和抑制血管生成,从而抑制人肾上腺皮质癌的增殖。CRM197和顺铂的组合方法触发胶质瘤细胞凋亡介导的死亡。
肉毒梭菌的A型肉毒毒素(BoNT-A)通过激活程序性细胞死亡阻止前列腺增生的生长和增殖。这些研究代表了一些在肿瘤发生中具有独特抑制作用的微生物代谢物的显著例子。
临床前小鼠模型和癌症患者的测序数据是微生物组学研究中有价值的工具,有助于癌症患者新疗法的开发。
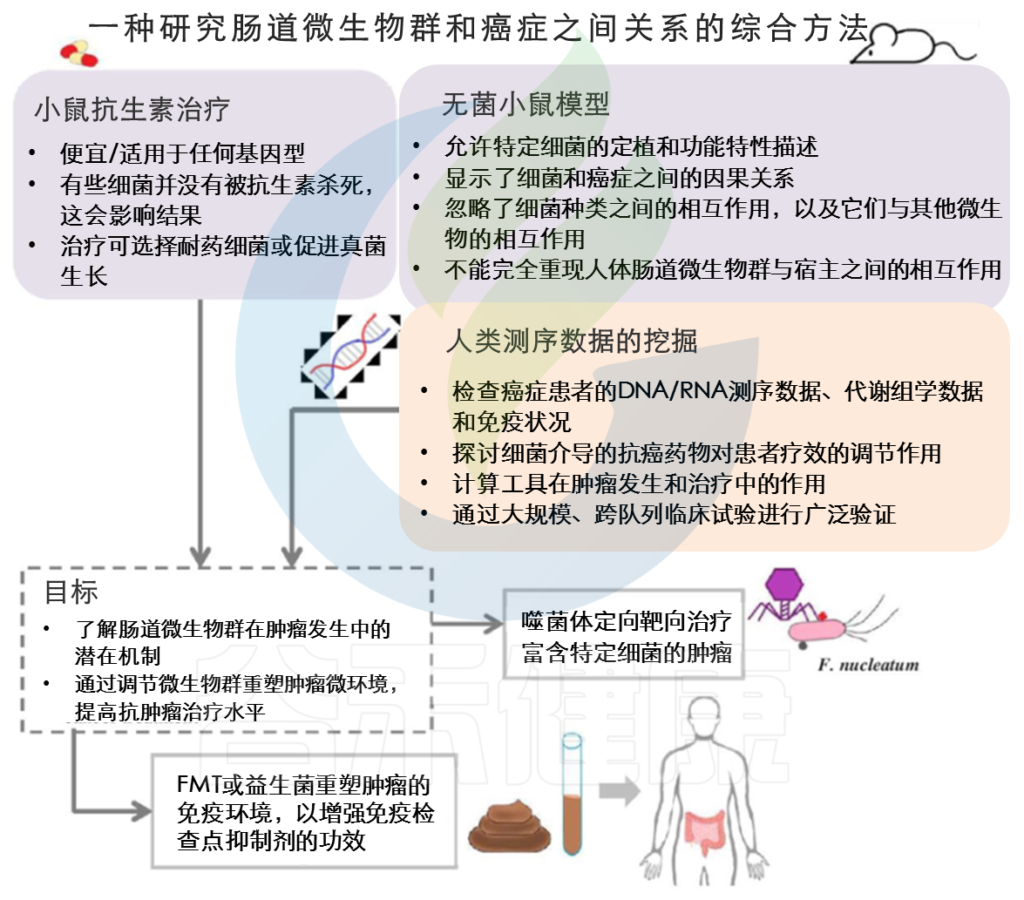
临床前小鼠模型是在没有微生物(无菌小鼠)或存在有限数量的微生物(抗生素治疗)的情况下剖析特定细菌机制的有价值工具。
然而,由于选择偏差等局限性,这些临床前模型无法完全重现人类肠道微生物群与癌细胞之间的相互作用。抗生素治疗可能选择耐药菌或促进真菌生长,这与实验结果相混淆。
其他因素,包括居住环境、饮食和遗传背景,也会影响小鼠体内的微生物群落及其与肿瘤细胞或抗癌药物的相互作用。为了补充这些临床前模型,癌症患者的测序数据在抗癌治疗前后根据宿主基因组、代谢组和免疫谱进行检查。
总之,小鼠模型和人类测序数据的META分析为肠道微生物群和癌症治疗之间的关系提供了见解。通过选择性地用噬菌体靶向癌相关细菌、通过施用益生菌或进行FMT来调节肠道微生物群,可以重塑肿瘤微环境和宿主免疫反应,从而增强抗癌药物的疗效,改善癌症患者的预后。
抗生素用于治疗多种疾病,从常见感染到更严重和更严重的疾病,清楚地说明了抗生素在我们日常生活中的重要性。
抗生素对于预防术后或免疫功能低下患者的致病微生物的生长极为有用,然而,不加控制地使用抗生素可能会在不同程度上改变我们的肠道共生菌群。这有时可能会对健康造成有害影响。
多项研究表明,由于抗生素的使用,免疫治疗的益处可能会大大中断。艾哈迈德等人研究表明在抗PD-1治疗期间使用抗生素会对患有各种癌症的个体的治疗结果产生不利影响,包括黑色素瘤、头颈部癌、肺癌、肾癌、肝癌和尿路上皮癌。
事实上,没有接受任何广谱抗生素治疗的病人完全受益于免疫治疗。根据Huemer等人的观点抗生素和免疫检查点抑制疗法的引入削弱了免疫治疗的益处。然而,也有一些相互矛盾的报道,表明在这方面计划周密的临床试验对于阐明抗生素和免疫治疗之间的确切联系是非常重要的。
益生菌参与改变肠道微生物群,增强肠道屏障的完整性,抑制致病菌的生长,并降低原癌物质的代谢。
一些临床前研究和临床试验已经确定了益生菌在改善传统肿瘤抑制模块的风险、严重程度和相关毒性方面的整体功能。给癌症患者服用益生菌的主要目的是重新填充受损的肠道微生物群,恢复微生物群落的正常功能。
一项针对CRC患者的前瞻性干预研究显示,嗜酸乳杆菌NCFM和乳酸双歧杆菌Bl-04的使用改变了患者的微生物特征。益生菌增加了产生丁酸盐的细菌(例如粪杆菌属和梭状芽孢杆菌)的数量,同时降低了CRC相关属(包括梭菌属和消化链球菌)的数量。
除了改变微生物特征外,研究表明益生菌还可以抑制癌症的发展。
益生菌在抗癌反应和治疗中的作用

尽管益生菌通常是安全的,但在免疫功能受损的癌症患者中引入益生菌,有时可能会促进机会性感染的潜在风险和抗生素耐药性的转移。
大多数益生菌产品是从乳酸产生菌(LAB)中获得的,它们属于乳酸杆菌和双歧杆菌。酪乳杆菌和嗜酸乳杆菌已被证明能增强肿瘤细胞的凋亡。鼠李糖菌GG株还具有抗胃癌和结肠癌细胞的增殖作用。
人类肠道微生物组是遗传多样性不可缺少的资源来源,是宿主免疫系统的重要组成部分,是调节代谢、影响药物相互作用和疾病结果的功能实体。
肠道微生物的双重作用体现在其诱人的益生菌和有益的特性上,它们可以预防或治疗某些疾病,而肠道微生物的失调似乎是癌症等疾病发展的关键决定因素。
目前正在进行的临床试验主要关注肠道菌群在治疗不同癌症中的作用,如下表:

这些数据清楚地强调了癌症患者在接受不同的抗癌治疗策略时所遇到的各种临床挑战。同时也指出了共生微生物在避免这些并发症方面的潜在用途。
应用微生物组学诱导抗肿瘤反应在肿瘤治疗中具有潜在的应用前景。益生菌/抗生素与手术、放疗和化疗的组合方法可能被认为是未来新的抗肿瘤策略。
目前,大多数与微生物组效应有关的研究都是在小鼠肿瘤模型上进行的,在人类身上的重复性是一个需要深入研究的领域。
了解微生物组特征和个体微生物特征可能有助于个性化治疗。微生物组学领域的研究进展为宿主和微生物群之间复杂的相互作用,调节癌症发生带来大量信息,可以说是挖掘出了一座金矿。
控制肠道微生物群可以推动癌症系统朝着理想的方向发展。确定化疗和免疫治疗药物、肠道微生物和宿主之间复杂的相互作用途径,以及我们对系统性微生物致癌作用的进一步理解,可能会为癌症的管理和控制带来前所未有的机遇。
最近的研究结果支持微生物标志物或肠型在癌症诊断和预后方面的潜力,噬菌体疗法在靶向输送癌症药物方面的潜力,以及FMT或益生菌在重塑肿瘤微环境或增强抗癌免疫方面的潜力。
而延长患者寿命,改善患者生活质量的合理解决方案可能在于我们能够利用微生物群对癌症进行控制及长期管理。
相关阅读:
菌群最新资讯 | COVID-19 消毒剂正在改变微生物群;利用微生物群来提高癌症免疫治疗的疗效?六位科学家分享见解
【 参考文献 】
[1] Chattopadhyay I, Nandi D, Nag A, The pint- sized powerhouse:Illuminating the mighty role of the gut microbiome in improving the outcome of anti- cancertherapy, Seminars in Cancer Biology (2020)
[2] Cheng, W. Y., Wu, C.-Y., & Yu, J. (2020). The role of gut microbiota in cancer treatment: friend or foe? Gut, gutjnl–2020–321153.
[3] Wei Jia, et al. Gut microbiota alterations are distinct for primary colorectal cancer and hepatocellular carcinoma. Protein & Cell, August 14, 2020.


谷禾健康
在世界各地,包括亚洲,特应性疾病的患病率已经上升。这一增长与快速的城市化和相关的生活方式变化相吻合,如抗生素过度使用、超卫生的生活条件、气候变化和空气污染。从传统饮食向西化饮食的转变会引起肠道微生物群的组成和功能变化,并被认为是发展中国家“西方生活方式”疾病发病机制的基础。一项涉及从东南亚移民到美国的亚裔少数民族的大型队列研究表明,生活在西化环境中与肠道微生物多样性、本土肠道菌群物种和植物纤维降解功能的丧失有关。这些变化可能与亚洲传统饮食中普遍存在的主要植物性食物的摄入减少有关,或者与西化饮食中的基质纤维总体缺乏有关。

亚洲传统饮食的特点和降低特应性风险的潜在机制
特应性疾病(atopic diseases)主要包括特应性皮炎、变应性鼻炎以及哮喘,属于遗传过敏性疾病,即过敏性体质对环境中常见抗原产生IgE类抗体应答的倾向性,是特应性疾病的发病基础。
传统饮食与西化饮食对肠道微生物群的影响及其与特应性皮炎的关系在非洲已有报道儿童。流行病学有证据表明,坚持传统的地中海饮食是以大量食用水果、蔬菜为基础的,怀孕和儿童时期的鱼和橄榄油对儿童哮喘和过敏性疾病有有益的作用,但结果是矛盾。肠道微生物群和代谢组学研究证实,高水平食用符合地中海饮食的植物性食品与肠道中纤维降解微生物和短链脂肪酸(SCFA)生成有关。有趣的是,生活在英国的亚裔移民儿童,如果他们保持一种独特的亚裔饮食,他们患支气管高反应性的风险比那些采用西化饮食的儿童要低。这个保护作用呈剂量依赖性,与地中海饮食或饮食类型的SCFA产量和依从性水平之间的正相关一致。
与地中海和西方饮食相比,传统亚洲饮食的另一个显著特点是大豆和豆制品(如豆腐、味噌和纳豆)的摄入量较高。大豆食品富含益生元、益生菌、非动物蛋白、不饱和脂肪和高含量的多酚,被认为具有抗氧化、抗炎和抗过敏特性。在人类和动物的研究中,食用大豆增加了双歧杆菌和乳酸杆菌的水平,并抑制了肠道中潜在的致病肠道菌群。大豆异黄酮-染料木素和大豆苷元在小鼠模型中有预防花生过敏和过敏的作用。功能性食品也是传统亚洲饮食不可或缺的一部分。泡菜(泡菜)、大黄(凝乳或酸奶)以及豆豉(发酵大豆)分别是中国、韩国、印度和马来群岛的本土发酵食品,它们有助于丰富多样的、富含益生菌的饮食。
关于亚洲国家儿童肠道微生物群和饮食模式的研究数据很少,主要来自东亚、东南亚和南亚人群。一般来说,城市化或西化饮食中动物蛋白、糖和脂肪含量高与拟杆菌的优势有关。相比之下,传统的农村饮食与普雷沃氏菌(Prevotella)的增加有关,普雷沃氏是一种祖先发酵的细菌,擅长复杂的碳水化合物代谢和SCFA的产生。食物过敏,特别是树坚果和花生过敏与类杆菌过度生长相关,与普雷沃氏菌呈负相关,而IgE介导的牛奶过敏儿童拟杆菌相对丰富。
微生物源性SCFAs,特别是丁酸盐,对特应性有内在的抗炎和免疫调节作用。正如儿童和牧场队列研究所证明的,高丁酸水平的婴儿不太可能发生特应性敏化,而在斑贴和糖尿病免疫研究中,患有湿疹的婴儿丁酸盐水平降低。饮食干预旨在增加SCFA产生菌群和丁酸盐浓度,这是一种有吸引力的减少过敏的策略风险。这个可包括高消耗的丁酸基料,如抗性淀粉、含丁酸盐的食品(如南亚烹饪中使用的酥油或澄清黄油),以及活的生物疗法。在牧场研究中,食用酸奶(每100克酸奶中含有0.1克丁酸盐)且一岁时粪便中丁酸盐含量高的婴儿在6岁时被发现不会对食物和吸入性过敏原过敏。
目前有些国家新的过敏预防护理标准正在形成,其基础是提倡有意识地接触过敏原以诱导免疫耐受。建议包括在4-6个月大时及时引入潜在致敏蛋白,并为所有婴儿(包括有可能患上特应性疾病的婴儿)提供饮食多样性。后者促进肠道微生物多样性,并增加代谢底物的可用性,以支持SCFA生产物种在婴儿肠道中的优先生长。当补充喂养期间引入新的食物时,婴儿肠道微生物群迅速扩张,进而引发强烈的T调节细胞生成或“断奶反应”。在这一关键时期,如果错过断奶反应,可能会导致免疫系统的病理印记,并增加宿主对日后过敏性炎症的易感性。
目前从观察性研究中获得的证据提供了有说服力的推论来支持“饮食-微生物群-疾病”假说,但在指导临床实践方面存在固有的方法论局限性。需要设计良好的人体干预试验来确定饮食和过敏风险之间的因果关系,并解决饮食干预的剂量、时间、持续时间和频率。由于具有不同微生物组学特征和危险表型的个体对饮食干预的反应可能不同,还需要使用集成多组学方法进行的未来研究,因为具有不同微生物组特征和风险表型的个体对饮食干预的反应可能不同。
更好地了解祖先肠道微生物群的特征及其与营养成分和宿主特应性状况的关系,可能会为提供新颖的干预措施,其中包括新一代的益生菌和益生菌食物来重新填充或保存亚洲微生物组。 在精准营养研究方面取得足够进展之前,采用文化适应饮食策略来调节儿童肠道菌群可能是减轻特应性风险的合理方法。
主要参考文献:
Ismail IH, Lay C, Majid NH, et al. Dietary patterns in childhood and their effect on gut microbiota – an Asian perspective on atopy risk [published online ahead of print, 2020 Aug 26]. J Allergy Clin Immunol. 2020;S0091-6749(20)31175-1. doi:10.1016/j.jaci.2020.05.057
Mahdavinia M, Rasmussen HE, Botha M, et al. Effects of diet on the childhood gut microbiome and its implications for atopic dermatitis. J Allergy Clin Immunol. 2019;143(4):1636-1637.e5. doi:10.1016/j.jaci.2018.11.034
Masilamani M, Wei J, Bhatt S, Paul M, Yakir S, Sampson HA. Soybean isoflavones regulate dendritic cell function and suppress allergic sensitization to peanut. J Allergy Clin Immunol. 2011;128(6):1242-1250.e1. doi:10.1016/j.jaci.2011.05.009
De Filippis F, Pellegrini N, Vannini L, et al. High-level adherence to a Mediterranean diet beneficially impacts the gut microbiota and associated metabolome. Gut. 2016;65(11):1812-1821. doi:10.1136/gutjnl-2015-309957