 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

嗜黏蛋白阿克曼菌(Akkermansia muciniphila, 简称A. muciniphila, Akk菌)的缺乏或减少与多种疾病(如肥胖、糖尿病、肝脂肪变性、炎症和对癌症免疫治疗的反应)有关。
关于AKK菌,我们之前的一篇文章也有详细介绍过,点击详见:
肠道重要菌属——Akkermansia Muciniphila,它如何保护肠道健康
谷禾肠道样本大数据库显示A. muciniphila缺乏或未检出情况在人群中很常见,尤其是那些有肠道问题的人。在健康个体中其约占肠道微生物群总数的0.5%–3%。
现如今,关于AKK菌的研究正在从动物模型转向人类验证试验,AKK菌与疾病之间的研究不仅仅停留在相关性,更是开始向因果性及具体产生作用的机制方面深入探讨。
– A. muciniphila –
本文我们将依次介绍A. muciniphila的起源,主要特性,以及它与不同疾病间的联系,并解释产生有益作用的主要机制。
一所在瓦格宁根(Wageningen)的微生物实验室的研究人员使用一种专门用于分离优势细菌的策略,即稀释到消亡(即基于连续稀释的分离),从一名健康成人身上分离出一株高度丰富的粘液降解菌株。
该菌株似乎是疣微菌门(Verrucomicrobiota)中一个新属的新种,被命名为嗜黏蛋白-阿克曼菌(Akkermansia muciniphila, A. muciniphila, Akk菌),并以典型菌株MucT为代表。
粘液主要由粘蛋白组成,粘蛋白是一种由粘多糖组成的保护肠道细胞的糖蛋白。
长期以来,粘液的降解被认为是一种可能导致宿主紊乱的不良特性。然而,对于结肠微生物群来说,粘蛋白在肠道中大量分泌,因此提供了持续的宿主产生的碳、能量和氮源。粘蛋白的代谢转换需要一组酶,如唾液酸酶和硫酸酯酶,这些酶参与顺序降解。
粘蛋白降解“专家”
A. muciniphila 是人类早期生命中存在的独特的粘蛋白降解“专家”。此外,对无菌小鼠的单体型关联研究表明,A. muciniphila MucT不会损害宿主,并在结肠中显示出特异性的代谢和免疫信号。其2.7Mb的基因组预测了粘蛋白降解的酶机制,比较生长分析表明,A. muciniphila是体外利用粘蛋白最有活性的菌株。
A. muciniphila MucT也可以利用人乳寡糖作为能量来源。值得注意的是,在纯培养中,只有少数其他底物被发现能刺激其生长,包括二甲双胍、甜菜碱和色氨酸。
由于A. muciniphila是人类肠道中疣微菌门的唯一代表,许多报道这一门的16S rRNA基因序列调查往往代表A. muciniphila 。最近的一项研究分析了2,000多个Akkermansia基因组,表明A. muciniphila是迄今为止具有高度相似(超过98%同一性)16S rRNA 序列的优势物种。
非工业化人群A. muciniphila下降
在这个大型宏基因组数据库中对四个已确定的A. muciniphila亚种的详细分析表明,它们的基因组通常存在于西方和中国人群中。对哈扎部落和其他非工业化人群的肠道微生物群与工业化世界个体的肠道微生物群进行分析比较,发现拟杆菌纲和疣微菌门微生物群的丰度减少。这些结果表明,非工业化种群的A. muciniphila丰度水平有所下降,但这一观察结果是否与粪便样本保存、DNA提取或测序深度的技术问题有关仍有待调查。
值得注意的是,A. muciniphila宏基因组已在非人类灵长类动物中发现,包括野生和圈养。类似地,与模式菌株MucT具有高度基因组同源性的A. muciniphila已从同样生活在野外的各种动物中分离出来。
部分A. muciniphila菌株产维生素B12
长期以来,A. muciniphila型菌株MucT是唯一可用的人类分离株然而,在过去的 5 年中,从不同的肠道环境中分离到了其他A. muciniphila菌株,包括野生哺乳动物和圈养哺乳动物,特别是人类。在临床前试验中报告了人类相关 A. muciniphila菌株之间的一些变异性,但尚不清楚观察到的差异的稳定性和可重复性如何。
迄今为止,观察到的菌株之间最显著的代谢差异是产生维生素B12的能力,而维生素B12是产生丙酸盐所必需的。大约三分之一的A. muciniphila分离株能产生类似于A. glycaniphila的维生素B12。多种结肠微生物可以产生可供A. muciniphila利用的维生素B12,正如霍氏真杆菌(Eubacterium hallii)(重命名为Anaerobutyricum soehn genii)所显示的那样,在共培养实验中,发现该细菌与菌株MucT形成微生物网络,导致从粘液中产生丙酸盐和丁酸盐。
代谢紊乱
由于观察到益生元补充剂(即低聚果糖)对肥胖发育的保护作用与啮齿动物疣微菌门的主要繁殖相吻合,因此引起了人们对A. muciniphila和代谢紊乱的兴趣。随后在人类和啮齿动物上进行的观察研究都表明,与瘦小的对应物相比,患有肥胖症的个体肠道中的A. muciniphila反复出现表达不足。代谢紊乱,包括肥胖、T2DM、非酒精性脂肪性肝病(NAFLD)和心血管疾病,都与Akkermansia spp.丰度减少有关。
研究发现,11名超重者和38名肥胖者体内A. muciniphila的丰度与更健康的代谢状态以及热量限制后较好的临床结果呈正相关。通过在小鼠和人类身上注射该模式菌株,研究了A. muciniphila在肥胖过程中的因果作用及其潜在的有益影响。首次证明,小鼠每天服用活的A. muciniphila MucT可以逆转高脂饮食引起的代谢紊乱,包括脂肪增加、代谢内毒素、脂肪组织炎症和胰岛素抵抗。
在合成培养基中生长的A. muciniphila MucT的巴氏杀菌增强了它减少小鼠脂肪团发育、胰岛素抵抗和血脂异常的能力。事实上,A. muciniphila MucT可以降低小鼠的胆固醇水平和血清甘油三酯水平。
代谢健康背景下黏质阿克曼菌的代谢效应及主要影响因素
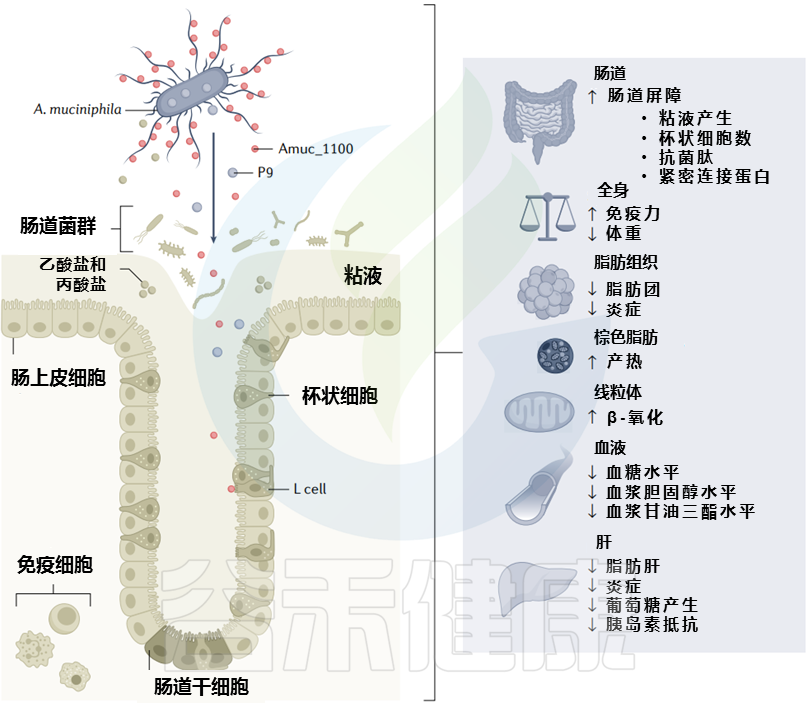
Cani PD, et al. Nat Rev Gastro Hepat. 2022
影响肝脏脂肪代谢
研究发现A. muciniphila MucT补充剂通过调节与脂肪合成有关的基因的表达(例如,降低肝脏中固醇调节元件结合蛋白的表达)和不同的炎症标志物(例如,降低IL-1β和IL-6的表达,ALT和髓过氧化物酶活性),可以积极地影响小鼠的肝脏脂肪代谢,预防非酒精性脂肪性肝病。
减轻动脉粥样硬化
在动脉粥样硬化发展的小鼠模型(载脂蛋白E缺陷(ApoE−/−)小鼠)中,A. muciniphila MucT的注射似乎减轻了动脉粥样硬化的损害。
降低糖尿病发病率
有趣的是,除了T2DM,在啮齿类动物和人类中,A. muciniphila通过降低肠道通透性、减少炎症和胰岛炎症的机制减少了T1DM的发病,从而有助于胰岛的保存。早期应用万古霉素可增加非肥胖型糖尿病小鼠(T1DM小鼠模型)的A. muciniphila丰度,降低糖尿病发病率。
神经退行性疾病
2016年至2020年间发表的几份报告表明,A. muciniphila在帕金森病和多发性硬化症中的作用,因为其相对丰度与受影响患者的疾病严重程度呈正相关。然而,尽管将患者的粪便微生物移植到无菌小鼠体内会导致疾病某些方面的发展,但这些研究都没有检测到受体小鼠粪便中的A. muciniphila,从而表明其他细菌可能参与了该病的发生表型。
多发性硬化症
对于多发性硬化症,在一项纳入62名复发缓解性疾病患者的研究中,作者发现脑脊液中的抗-Akkermansia IgG水平高于健康同行,并且局部脑脊髓特征与残疾评分呈正相关,而在同一个人的血液中检测到IgG水平没有明显的改变。
虽然在这些研究中观察到的抗-Akkermansia IgG水平的增加与肠道中嗜粘蛋白A. muciniphila丰度的改变无关,但另一项研究提供了支持 A. muciniphila在多发性硬化症中的积极和有益作用的机制解释。
这项研究表明,在多发性硬化症实验性自身免疫性脑脊髓炎小鼠模型的粪便和未治疗的多发性硬化症高峰期患者的粪便中发现的A. muciniphila的大量繁殖与miR-30d的富集有关。
有人发现,从这些小鼠或人类身上收集的粪便的转移导致A. muciniphila的丰度增加,并有利于调节性T (Treg)细胞的扩增,进而控制效应T细胞以抑制疾病症状。研究人员表明在患有多发性硬化症的小鼠中接种A. muciniphila可降低疾病评分、减少轴突损失的脱髓鞘和增加Treg细胞群。
相反,A. muciniphila衍生肽被确定为环境因素,与多发性硬化症(即HLA-DR15单倍体型)最强的遗传风险易感因素相结合,可以介导免疫调节介导的患者自身反应性T细胞的激活。
更具体地说,从患者体内分离出的 HLA-DR-SP反应性 CD4+ T细胞可以被某些外来因子(例如Epstein-Barr病毒和从A. muciniphila中分离出的一些肽)激活,然后对血液中的潜在致病多肽或自身抗原(如髓鞘碱性蛋白)产生反应,可能还会在脑脊液和/或脑中发生交叉反应,从而针对脑组织。
帕金森病
文献中关于阿尔茨海默病和A. muciniphila的发病机制存在差异,相关研究显示阿尔茨海默病患者的A. muciniphila含量较高,而干预研究清楚地报告了这种细菌在病理学中的有益作用。阿尔茨海默病是一种疾病,其最强的病理标志之一是淀粉样蛋白β肽42 (Aβ42)在老年斑中的积累。
由于肥胖和T2DM是痴呆的重要危险因素,一项机制研究探讨了在喂食高脂肪饮食的阿尔茨海默病小鼠模型中施用A. muciniphila的影响。除了抗肥胖作用外,无论饮食如何,接种都能显着减少大脑中的 Aβ并改善认知测试的表现。A. muciniphila给药还恢复了生命早期(生命3周时)暴露于高脂肪饮食的小鼠的认知能力下降和海马发育障碍。
癌症免疫治疗反应
免疫疗法是一种利用免疫系统对抗肿瘤形成细胞的癌症疗法,并已发展成为治疗各种癌症的成功方法。
肠道微生物组的相关性是增强对检查点抑制剂治疗的临床反应的标志物和辅助剂。
该疗法通过阻断程序性死亡受体1(PD1)等免疫检查点来恢复对抗癌细胞的活性。对100名对抗-PD1抗体反应良好的非小细胞肺癌和肾细胞癌患者的微生物组进行了详细的表征,结果显示A. muciniphila富集。此外,在疾病进展迅速的个体和后来死亡的个体中,A. muciniphila的患病率最低(34%)。
A. muciniphila菌株在用抗-PD1 药物治疗后,在移植无应答者粪便的无菌小鼠和预先暴露于抗生素的小鼠中改善了抗肿瘤活性。一项具有统计学意义的研究旨在专门评估338例非小细胞肺癌患者的A. muciniphila 基线检测与临床反应之间的关联。证实了A. muciniphila的存在与临床反应之间的密切关联。
在另一项研究中,42名主要使用抗-PD1药物治疗的转移性黑色素瘤患者的肠道微生物群也被证实富含多种分类群,包括Akkermansia。2020 年发表的一项研究确定肌苷是抗癌细胞活性的潜在因素,尽管这种核苷是由许多其他细菌产生的。
总之,这些研究表明,A. muciniphila是一种有望提高对检查点抑制剂免疫疗法的临床反应的候选菌。
肠道屏障和肠道炎症
最初发现A. muciniphila MucT 可以通过恢复小鼠的粘液层厚度以及抗微生物肽Reg3g的肠道表达来改善肠道屏障功能,这在肥胖和代谢紊乱期间都会发生改变。后来,在A. muciniphila MucT补充剂中观察到的粘液层厚度增加与小鼠粘液产生细胞数量的增加有关。
此外,来自A. muciniphila MucT (AmEVs)的细胞外囊泡,也显示通过调节小鼠的紧密连接来降低肠道通透性。
肠道炎症的情况下保护的肠道屏障
已有研究表明,与健康人相比,克罗恩病 (n = 26)和溃疡性结肠炎(n = 20和n = 15 ) 患者相比,A. muciniphila显著减少。这种相关性已在临床前模型中进行了因果研究。
改善结肠炎
已发现A. muciniphila MucT在结肠炎中的有益作用,AmEVs可保护葡聚糖硫酸钠 (DSS) 诱导小鼠结肠炎的进展。
随后,几项研究观察到A. muciniphila MucT细胞恢复肠道屏障功能并改善了:
改善衰老引起的变化
衰老是另一种肠道屏障减少和炎症增加的情况。各种人类研究报告称,与年轻成人(<50岁)和百岁老人相比,老年人(>65岁)的A. muciniphila丰度较低。
这一发现导致了旨在评估A. muciniphila MucT给药对不同衰老小鼠模型中几个年龄相关参数的影响的研究。
总之,这些研究表明,施用A. muciniphila MucT改善了一些与年龄相关的变化,包括炎症、屏障完整性和行为。
代谢综合征
在啮齿动物中,A. muciniphila被认为是健康的生物标记物。在啮齿类动物中,许多对A. muciniphila种群具有生长促进作用的膳食补充剂因其促进健康的作用而受到广泛关注。
在患有代谢综合征的人类中,给药被证实是可行的、安全的和有良好的耐受性。事实表明,与炎症、血液学、肾脏、肝脏和肌肉功能相关的任何标志物的变化,都可以用任何A. muciniphila MucT制剂来观察。这一结果是在不考虑所使用的形式以及短期(即2周)和长期(即3个月暴露)的情况下观察到的。
巴氏灭菌Akk菌比活菌效果好
以前的结果表明,高压灭菌灭活A. muciniphila可消除其对小鼠代谢综合征的保护作用。对植物乳杆菌或干酪乳杆菌菌株进行的研究表明,不剧烈的热诱导灭活,如巴氏杀菌,可以使细菌在稳定它们的同时保留部分有益的特性。
因此,有人在相同的饮食诱导肥胖小鼠模型上,通过比较活菌和巴氏灭菌菌的给药效果,检验A. muciniphila巴氏灭菌的效果。结果是,接受巴氏灭菌菌株的小鼠在体重、脂肪质量增加、血脂和胰岛素抵抗标志物方面的降幅甚至比接受活细菌的小鼠更大。除了提高A. muciniphila粘液的有效性,巴氏杀菌还具有提高菌稳定性和延长其保质期的好处,从而便于给人服用。
在未经治疗的患者中,给予巴氏灭菌A. muciniphila MucT成功地防止了与代谢综合征相关的参数的自然恶化。与补充安慰剂的志愿者相比,补充已过活的A. muciniphila MucT显著改善了胰岛素敏感性,降低了胰岛素血症和血浆总胆固醇水平。
为了进一步评估巴氏灭菌A. muciniphila MucT的安全性,对大鼠进行了一项强有力的毒理学长期评估。结果表明,口服90天,即使在测试的最高剂量(每公斤体重9.6×1010A. muciniphila MucT细胞,没有观察到不良反应的水平)下,也没有转化为亚慢性毒性,而体外遗传毒性试验显示阴性结果。
如前面所述,A. muciniphila可能有多种作用模式,所有这些都已用 MucT菌株进行了研究。当使用巴氏杀菌细菌时,可以观察到A. muciniphila MucT的几种有益效果和令人惊讶的功效增加。
产短链脂肪酸,作用于宿主代谢
最明显的答案是短链脂肪酸(如丙酸盐)的一般作用,因为A. muciniphila MucT在维生素B12存在下被称为丙酸盐生产者。虽然A. muciniphila对肠道中丙酸盐总水平的贡献可能相对于其他主要的丙酸盐生产者(例如拟杆菌)相对较低,尤其是在禁食条件下。但 Akkermansia似乎在动物和人类中都上调,并且可能对生产这种短链脂肪酸做出重大贡献。
在这种情况下,某些影响可能与肠道上皮细胞和肠道黏膜中存在的不同类型免疫细胞上表达的FFAR3和FFAR2受体(也分别称为GPR41和GPR43)有关。然而,值得注意的是,巴氏杀菌的 A. muciniphila MucT也可以作用于宿主代谢,不会改变丙酸盐的产生。
通过外膜上的蛋白质Amuc_1100发挥作用
2017年,有人确定了A. muciniphila MucT可以在宿主健康中发挥作用的特定和独特的分子机制。他们发现存在于A. muciniphila外膜中的一种特定蛋白质,称为Amuc_1100,概括了这种细菌的有益作用。A. muciniphila的所有有益作用是否都可归因于Amuc_1100目前尚不清楚,但其每个细胞的生产水平足以解释临床前模型中的作用。
重要的是,他们发现这种蛋白质在用于巴氏杀菌的温度下仍保持其活性构象,从而解释了为什么巴氏杀菌的A. muciniphila MucT在小鼠和人体实验中保持活性。
此外,发现Amuc_1100可激活Toll样受体2 (TLR2),单独给药可复制A. muciniphila MucT细胞的大部分有益作用,包括在肠道炎症和结肠癌的特定疾病模型中的作用。
这一发现表明,即使死亡(即巴氏杀菌后),A. muciniphila MucT仍然可以改善宿主健康,并反对需要潜在的分泌代谢物来观察细菌的有益作用。
外膜上的蛋白质 P9,刺激GLP1水平增加
2021年的一项研究确定了A. muciniphila MucT产生的另一种蛋白质。发现A. muciniphila处理的饮食诱导的肥胖小鼠在口服葡萄糖挑战期间表现出循环GLP1水平略有增加。
通过体外实验,作者鉴定了一种84kDa的蛋白质,命名为蛋白 9(P9;由早期鉴定的 Amuc_1831 基因编码),它负责体外刺激GLP1。
在体内,他们测试了 8周以非常高的剂量口服P9的效果,发现体重增加和脂肪量增加都有所减少,胰高血糖素前体(即GLP1的前体)的肠道表达增加。
这些影响怎么与较高的循环 GLP1 水平联系起来?
研究发现P9的药理作用激活 ICAM2,这些作用与可能的GLP1分泌有关,因为抗-ICAM2抗体在体外部分消除了P9对GLP1分泌的影响。
此外,A. muciniphila MucT增加了小鼠回肠中IL-6的表达。除了证实IL-6是一种促炎细胞因子外,这种细胞因子还在体外剂量依赖性地增加GLP1的分泌。
因此,有人假设A. muciniphila MucT也可以通过 IL-6-GLP1信号传导发挥作用。为了进一步支持他们的发现,研究人员使用了IL-6敲除小鼠,发现这些小鼠对P9诱导的GLP1分泌没有反应,而阻断GLP1受体也消除了P9对产热的影响。尽管这些发现是相关的,但应评估其他因素,例如P9的生理剂量和位置(可能被分泌)。
与Akkermansia或相关分子在疾病中的作用相关的主要机制
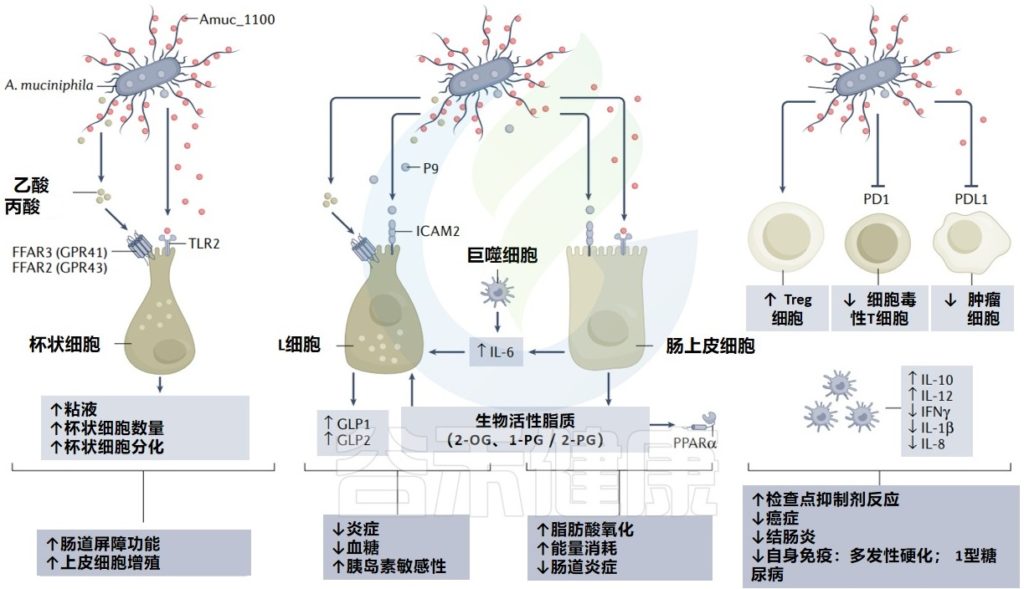
Cani PD, et al. Nat Rev Gastro Hepat. 2022
A. muciniphila MucT表达的酶潜在益处
一项研究证明天冬氨酸蛋白酶Amuc_1434*通过TRAIL介导的细胞凋亡途径抑制LS174T细胞活力。然而,没有进一步的位置、热稳定性或体内数据报告,因此尚无法评估这一发现的潜在和生理相关性。
第二项研究表明,A. muciniphila MucT表达的β-乙酰氨基己糖苷酶Amuc_2109*保护小鼠免受DSS诱导的结肠炎;然而,尚未报告热稳定性数据。
此外,已在人类身上表明,活的或巴氏杀菌的A. muciniphila MucT 改善了几种心脏代谢风险因素,包括胰岛素抵抗,而不增加 GLP1 的循环水平,也不影响 DPP4 活性,DPP4 是一种参与 GLP1 降解的酶。
有趣的是,无论使用何种形式的A. muciniphila MucT——活的或巴氏杀菌的,甚至是蛋白Amuc\U 1100,文献中的所有数据都通过作用于不同的关键标记物来强化肠道屏障。
事实上,所有的治疗都指向更高的粘液产量,紧密连接蛋白的恢复,抗菌因子的恢复,以及最终加强肠道屏障。
特异性调节
此外,一部分人通过对用活的或巴氏杀菌的 Akkermansia治疗的人体进行脂质组学和代谢组学分析。已经发现A. muciniphila MucT治疗诱导了不同生物活性脂质的特异性调节,这些被鉴定为 PPARα 激动剂(2-PG和1-PG)。
重要的是,在人类中使用非靶向代谢组学分析,他们已经能够重建一条指向通过β-氧化激活脂肪酸氧化的代谢途径,并且所有鉴定的代谢物都在PPARα的控制下趋向于增加线粒体活性,这些数据也在啮齿动物身上得到了证实。
除了对肠道屏障的影响,这可能涉及对几种疾病(即糖尿病、肥胖症、NAFLD和/或非酒精性脂肪性肝炎、炎症性肠道疾病、多发性硬化症)的保护作用,A. muciniphila对癌症的作用也是与依赖免疫系统的其他机制有关。
例如,使用检查点抑制剂(抗-PD1)的免疫疗法与动物数据中涉及 IL-12 依赖性效应的特定机制方面有关。此外,数据表明A. muciniphila菌株对抗-PD1反应的辅助作用增加了特定T细胞向肿瘤床的募集。
在炎症性肠病、T1DM或肠癌的小鼠模型中,A. muciniphila MucT或特定蛋白增加Treg细胞群的分化或降低结肠中浸润性巨噬细胞和CD8+细胞毒性T淋巴细胞的水平。
A. muciniphila MucT的代谢和抗炎作用是强大的,因为来自不同研究团队的许多结果已经证实了A. muciniphila菌株的各种健康特性。
A. muciniphila的生理和有益作用是多效性的(例如,能量、脂质、葡萄糖代谢、炎症、免疫、脑功能),重要的是要强调有许多汇聚的作用模式,可能是由于其特异性特性与其粘蛋白代谢的特化有关。
事实上,已经确定了几种常见的途径,都指向调节肠道屏障功能(即粘液产生和免疫系统)。肠道屏障的恢复,也有助于恢复几种改变的途径的正常功能,包括例如线粒体活性、肝脏代谢、脂肪组织和大脑活动。
最后,A. muciniphila MucT的有益作用已从临床前观察转化为代谢综合征背景下的人类干预。这种情况是独一无二的,是其他下一代微生物无法比拟的。
需要注意的是,虽然A. muciniphila具备各种有益特性,但是该菌丰度并不是越多越好,要保持在合适范围。谷禾肠道菌群检测结果中曾经有案例,发现该菌丰度过高,占比超50%。
该菌过量将过度消耗粘液蛋白而存活下来,这是大多数其他细菌所缺乏的生存优势,该菌增殖异常,从而可能导致肠道屏障损伤,诱发肠道炎症、LPS 进入血液的增加、自身免疫性疾病有关。
该样本检测报告也显示菌群多样性低,肠炎和几项慢病注意风险:
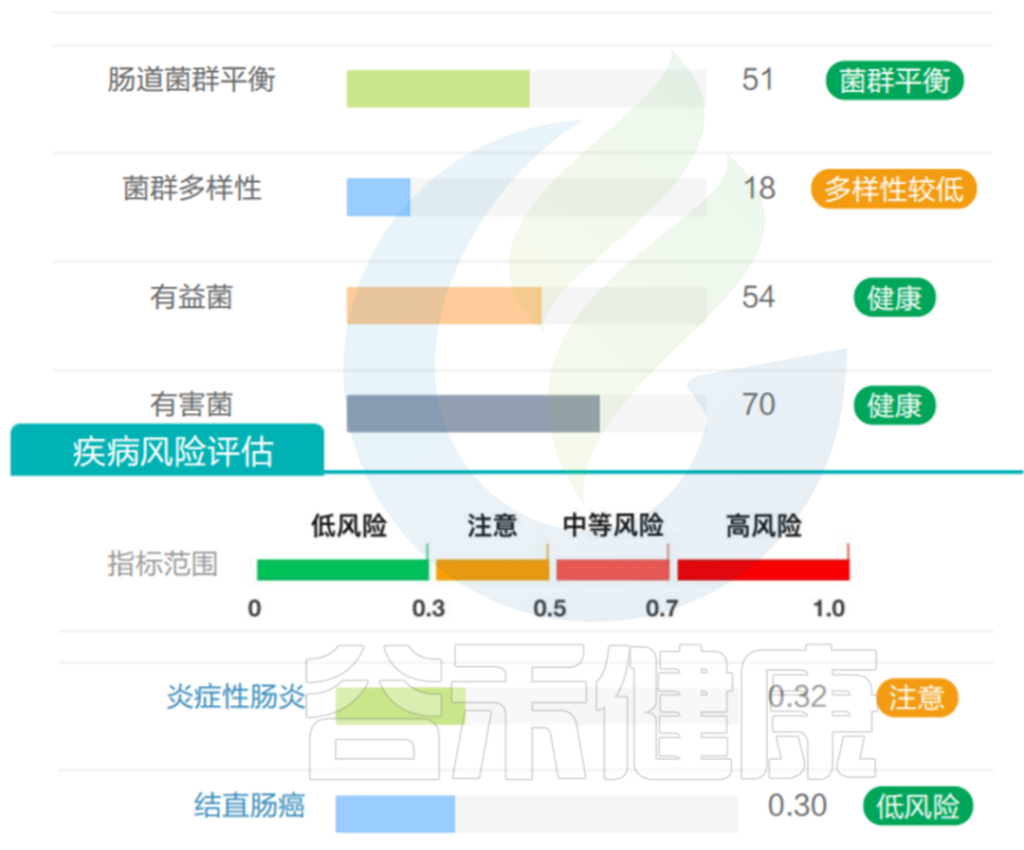
<来源:谷禾健康数据库>
总的来说,在合理范围内,A. muciniphila 带来有益影响。
当然也需要更多的研究来支持A. muciniphila的有益特性及临床治疗应用:
主要参考文献
Cani PD, Depommier C, Derrien M, Everard A, de Vos WM. Akkermansia muciniphila: paradigm for next-generation beneficial microorganisms. Nat Rev Gastroenterol Hepatol. 2022 May 31. doi: 10.1038/s41575-022-00631-9. Epub ahead of print. PMID: 35641786.
Kostopoulos I, Elzinga J, Ottman N, Klievink JT, Blijenberg B, Aalvink S, Boeren S, Mank M, Knol J, de Vos WM, Belzer C. Akkermansia muciniphila uses human milk oligosaccharides to thrive in the early life conditions in vitro. Sci Rep. 2020 Aug 31;10(1):14330. doi: 10.1038/s41598-020-71113-8. PMID: 32868839; PMCID: PMC7459334.
Yin J, Song Y, Hu Y, Wang Y, Zhang B, Wang J, Ji X, Wang S. Dose-Dependent Beneficial Effects of Tryptophan and Its Derived Metabolites on Akkermansia In Vitro: A Preliminary Prospective Study. Microorganisms. 2021 Jul 14;9(7):1511. doi: 10.3390/microorganisms9071511. PMID: 34361945; PMCID: PMC8305782.
Paone P, Cani PD. Mucus barrier, mucins and gut microbiota: the expected slimy partners? Gut. 2020 Dec;69(12):2232-2243. doi: 10.1136/gutjnl-2020-322260. Epub 2020 Sep 11. PMID: 32917747; PMCID: PMC7677487.

谷禾健康
神经免疫,菌群,心血管疾病
最新的《中国心血管病健康和疾病报告2019》数据显示,中国居民心血管病现患人数已达3.30亿,拐点尚未到来,且7-17岁儿童青少年高血压患病率呈现上升趋势。
心血管疾病(CVD)仍然是全世界发达国家死亡和残疾的主要原因。此外,广泛存在的心血管危险因素,如代谢综合征、糖尿病、肥胖和性类固醇激素代谢紊乱,有效预防策略已成功减少急性心血管事件和死亡的影响。
大脑和其他器官系统之间的双向通信对于大脑健康和生物体的整体健康至关重要。曾经被认为具有免疫特权的大脑现在被认为是一个高度免疫特化的器官,拥有自己的大脑驻留免疫细胞。这些细胞形成神经元回路和淋巴系统,这些系统调节免疫细胞的复杂流出,以及从脑脊髓空间与循环的其余部分交换的液体。
而共生微生物群是个体间异质性的重要来源,可以通过调节宿主免疫来影响人类健康。人们越来越认识到 CVD 的许多潜在原因,包括免疫和肠道菌群失调可能是 CVD 的致病因素,提出了对新的免疫调节治疗策略的需求。
本文总结了免疫、炎症的神经调节以及肠道菌群如何参与 CVD 的发病和进展,并探索菌群-神经免疫通讯是否为 CVD 的潜在治疗靶点。
本文缩略词:
CVD: 心血管疾病 (cardiovascular disease )
心血管疾病,又称为循环系统疾病,是一系列涉及循环系统的疾病,循环系统指人体内运送血液的器官和组织,主要包括心脏、血管(动脉、静脉、微血管),可以细分为急性和慢性,一般指心脑血管疾病。
ANS: 自主神经系统 (autonomic nervous system)
自主神经系统是脊椎动物的末梢神经系统,由躯体神经分化、发展,形成机能上独立的神经系统,是外周传出神经系统的一部分,能调节内脏和血管平滑肌、心肌和腺体的活动,又称植物性神经系统、不随意神经系统,故名自主神经系统(参考自:百度百科)。
SFO: 穹窿下器神经元 (Neurons of the subfornical organ )
穹窿下器官,室周器官,位于第三脑室前背侧壁、海马连合腹侧穹窿柱分歧处、适平室间孑L平面。
OVLT: 下丘脑终板血管区(Organum vasculosum laminae terminalis)
终板就是第三脑室前缘的隔膜。下丘脑终板血管区,内生致热原作用于血脑屏障外的脑血管区,即下丘脑终板血管区,该区位于第三脑室壁的视上隐窝处。
PVN: 下丘脑室旁核 (paraventricular nucleus)
下丘脑室旁核 位于第三脑室下丘脑部的上端两侧,呈长楔形轮廓,是下丘脑前区最显著的核团之一,与神经内分泌活动和植物性功能等有关的复合体结构,参与体内电解质与体液平衡,心血管活动调节及其它多项生理功能的调控。
NTS: 孤束核 (nucleus tractus solitarius)
孤束核为延髓内重要内脏感觉性核团,为一般内脏感觉和味觉传导通路上的第一级中继站。随着神经解剖学和神经生理学研究方法的不断发展,人们对孤束核的认识日趋深入,近年来HRP和ARG技术有关孤束核的大量的研究证实了孤束核不但与低级中枢(脊髓、脑干)具有传入、传出神经联系,而且与高位中枢(前脑、小脑)也具有复杂的往返联系。
DMV:迷走神经运动背核 (dorsal nucleus of vagus nerve)
迷走神经背核是2014年经全国科学技术名词审定委员会审定发布的人体解剖学名词。位于延髓室底灰质内,迷走神经三角深面的神经核。属一般内脏运动核,支配颈部、胸部所有内脏器官和腹腔大部分内脏器官的平滑肌、心肌的活动和腺体的分泌。
神经和免疫系统通常通过特定的大脑区域、传入和传出周围神经以及神经激素通路进行交流(下图)。
大脑和周围器官之间的通讯途径
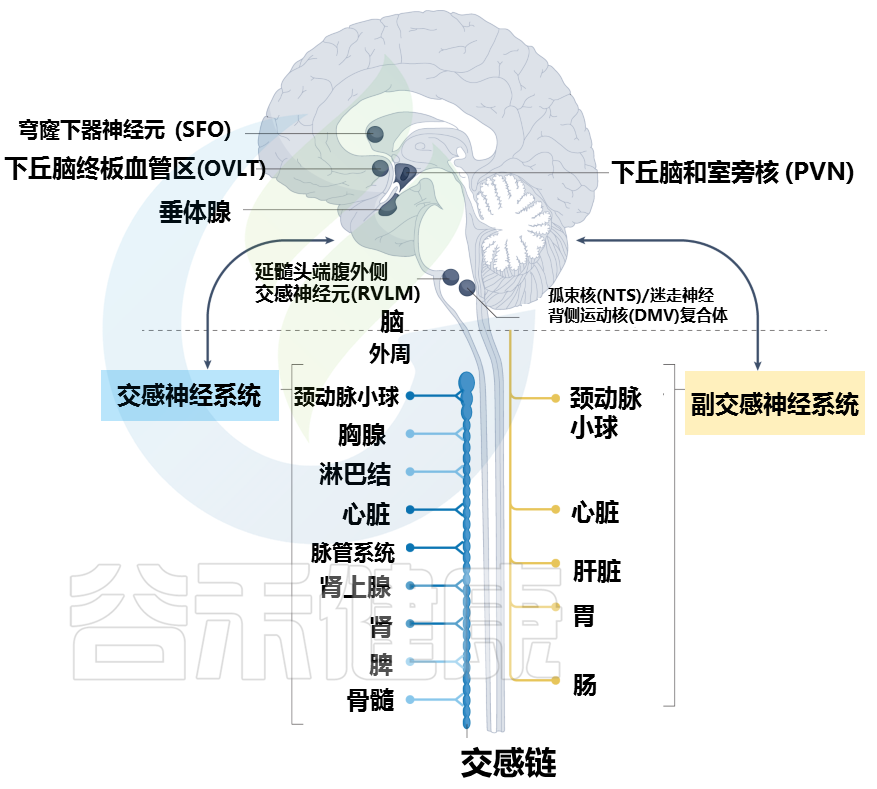
Carnevale D. Nat Rev Cardiol. 2022
大脑通过不同的途径与周围器官和组织相连。特定的大脑区域,统称为脑室周围器官,与周围形成自然的大脑界面,内衬有渗漏的血脑屏障。神经网络从脑室器官延伸到周围神经系统,并建立重要的神经解剖学连接。
穹窿下器官 (SFO) 和终板血管器官 (OVLT) 的神经元密集表达 1 型血管紧张素 II 受体和渗透压感受器,并为下丘脑的室旁核 (PVN) 提供神经支配。反过来,PVN 与延髓腹外侧 (RVLM) 的交感神经元相连,RVLM 具有调节外周交感神经活动的重要功能。
PVN 的其他神经元连接到孤束核 (NTS) 和迷走神经背运动核 (DMV) 的复合体,它们负责通过迷走神经传递的外周胆碱能神经支配。
所有主要的外周器官通常都有交感神经支配(包括心脏、脉管系统、肾脏和颈动脉体)和副交感神经支配(包括心脏、颈动脉体、肝脏、胃和肠)。
交感神经支配是免疫器官(以浅蓝色显示)和内脏组织的神经控制的主要途径。大脑、心血管系统和免疫器官之间的进一步整合轴是由神经内分泌系统通过下丘脑-垂体-肾上腺轴形成的。
循环物质,如细菌源性肽、宿主源性细胞因子和组织代谢物,向特定的大脑区域发出信号,这些区域的特点是存在渗漏的血脑屏障。
脑室周围器官由穹窿下器官(SFO)、终板血管器(OVLT)和末梢区组成,是监测周围组织并在神经免疫过程中发挥关键功能的大脑区域。同时,脑室周围器官在心血管疾病中起着至关重要的作用。
穹窿下器官富含血管紧张素II受体1型,它是肾素-血管紧张素-醛固酮系统的关键介质。
OVLT的神经元同时表达血管紧张素II受体1型和渗透压感受器,它们对感知细胞外钠/盐负荷浓度至关重要。
它们共同传递有关血容量、血压和细胞外液渗透压的外围信息。
有趣的是,从穹窿下器和OVLT投射到下丘脑室旁核(PVN)的神经元也被描述过,脑室旁核也接受后脑的投射,这表明它具有整合功能。虽然它们位于脑室周围器官之外,但孤束核(NTS)和迷走神经背侧运动核(DMV;心血管功能最有效的调节器之一)接收来自末梢区的输入。
大脑通过在脑室旁核和脊髓中间外侧细胞柱之间建立直接投射,或通过延髓头端腹外侧间接连接,来控制周围交感神经反射反应。外周的稳态扰动由延髓头端腹外侧感觉到,并通过蓝斑的去甲肾上腺素能神经元以反射反应传递。
作为补充,神经元表达细胞因子受体,这有助于神经免疫串扰和脑与身体的相互作用。
当细胞因子在各种生理和病理生理环境中的外周组织中分泌时,神经元活动就会改变。虽然神经元细胞因子受体的生理功能仍在研究中,但细胞因子在脑发育、外周组织损伤和动物行为方面的作用已被证明。这些观察表明存在由细胞因子介导的脑-体双向轴。
接下来进一步的讨论这些信号是如何在心血管疾病中启动、传播和转移到大脑的。
投射到中枢神经系统之外的神经被称为外周神经系统,它双向连接大脑和外周器官和组织。
外周神经系统分为两个部分:
躯体神经系统和自主神经系统(ANS)
躯体神经系统与中枢神经系统交换感觉和运动信息,而ANS调节非自愿功能,并在神经免疫和心血管相互作用中起决定作用。
ANS由传入和传出神经元组成,将大脑与周围内脏器官和组织连接起来。历史上,ANS被定义为平行的交感和副交感臂,分别负责所谓的“逃跑或战斗”和“休息和消化”反应。
ANS作为大脑与外周沟通的关键途径的概念不断发展,有证据表明,ANS也发挥了神经免疫调停者的作用。生理和心血管反应的改变都受到ANS的深度影响,ANS的失衡是许多心血管疾病的典型特征。
我们对ANS如何调节心血管功能的理解有了实质性的进步,这得益于实验方法的发展,使直接分析神经系统活动成为可能。
实验性和临床性的显微神经学被用来测量指向心血管系统的节后交感神经传出的电活动。例如,骨骼肌血管的显微神经造影术成为评估人类区域交感神经活动的金标准方法。
应用于动物实验的类似程序有助于确定ANS调节心血管功能的解剖路线和分子机制。在过去5年中,已经制定了直接评估调节免疫系统的ANS臂的实验方案,从而能够定义神经免疫机制如何促进心血管疾病的发病和进展。
神经系统和免疫系统之间的进一步相互作用是通过神经内分泌系统进行的,主要通过下丘脑-垂体-肾上腺轴进行调节。下丘脑-垂体-肾上腺轴通常对心理压力敏感,是免疫反应和心血管功能的有效调节剂。
神经元顺行和逆行追踪技术已被用于通过周围神经系统的传入和传出臂绘制大脑和免疫器官之间的连接(下图)。
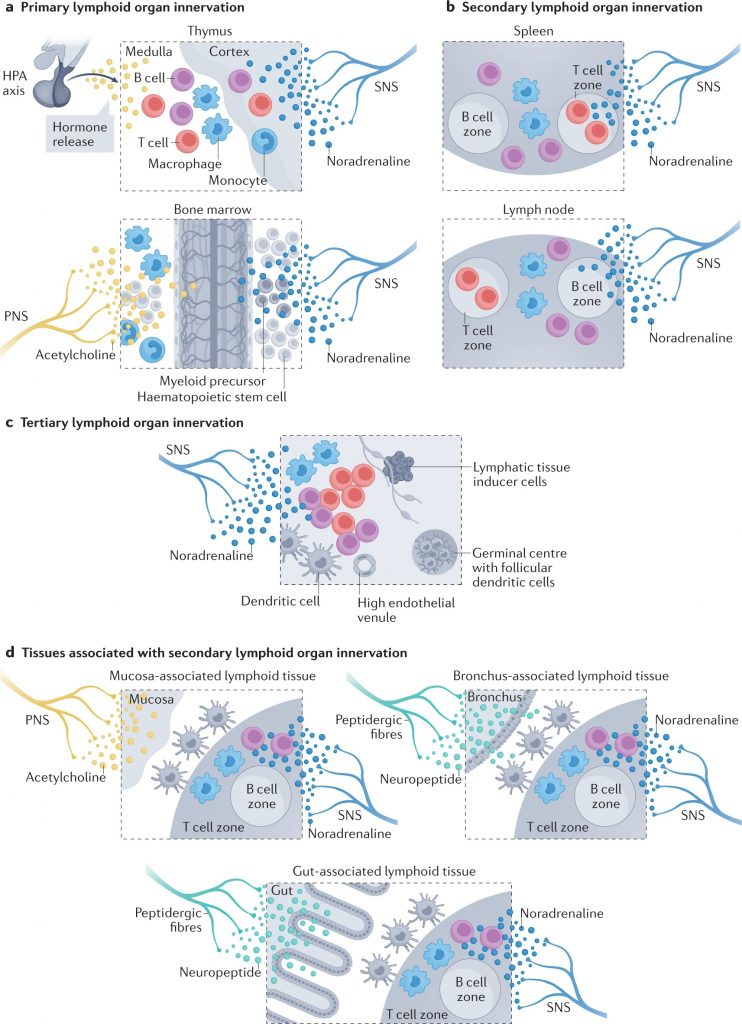

Carnevale D. Nat Rev Cardiol. 2022
a |初级淋巴器官神经支配。胸腺主要由去甲肾上腺素能纤维支配。虽然不存在直接的胆碱能神经支配,但交感神经与下丘脑-垂体-肾上腺(HPA)轴之间的相互作用已被证实。相反,骨髓神经支配更为复杂,包括交感神经系统(SNS)、副交感神经系统(PNS)和与大脑建立双向通讯的感觉纤维。骨髓的造血和免疫功能受到这种神经网络的严格调节。
b |次级淋巴器官包括脾脏和淋巴结,由去甲肾上腺素能纤维密集支配,其起源于大脑,已通过神经调节研究确定。淋巴结也有一个明显的感觉神经网络,可以严密监测外周免疫状态。
c |三级淋巴器官是为了应对非淋巴器官的病理挑战而形成的,具有独特的组织特异性组织。控制第三淋巴器官神经支配的神经纤维仅在少数解剖部位被发现。
d |粘膜相关淋巴组织在粘膜组织(如支气管或肠道)中形成,以响应稳态的扰动,并由神经网络严格控制,包括SNS、PNS和肽能感觉纤维。
神经元追踪确定外周器官神经支配路线
神经元连接性的研究需要对轴突进行双向追踪,包括从神经元细胞体到轴突终末的顺行追踪,以及从终末到胞体的逆行追踪。神经解剖学追踪是一种通过追踪神经元在突触前或突触后水平的连接来识别神经元的常用方法。神经解剖学追踪技术在确定包括免疫器官在内的外周器官的神经支配途径方面变得特别有用。
原始追踪研究的基础是将氟金注射到免疫器官中,使研究人员能够逆行识别节前神经元,或注射生物素化葡聚糖胺以顺行识别神经元连接。几十年来,这些单独使用或联合使用的示踪剂使研究人员能够研究连接大脑和周围器官的神经回路。
随后的技术进步利用伪狂犬病病毒(一种高度传染性的神经营养性α疱疹病毒,Pseudorabies virus,PRV)的能力来定义中枢神经系统中的多突触回路。病毒的逆行扩散只发生在突触相连的神经元链中。在将伪狂犬病病毒注射到感兴趣的器官或组织后,更高阶的神经系统结构在稍后的时间点被标记。通过这种方式,可以定义神经元连接的精确路径,从外周器官开始,追溯到大脑。此外,伪狂犬病病毒在神经元细胞体中复制的过程具有自我放大的能力,这使得在受感染动物的大脑中识别二级、三级甚至四级神经元成为可能。
初级免疫器官包括胸腺和骨髓,它们参与淋巴细胞的产生和初始选择。胸腺在新生儿和青春期前发育阶段活跃,逐渐退化,只有残留的淋巴细胞生成持续到成年期。骨髓包含在骨腔中,从未成熟的造血祖细胞开始产生红细胞和免疫细胞。
胸腺神经支配和神经元调节
不同类型的细胞参与胸腺器官发生,这需要神经嵴细胞的协调相互作用。基于旧追踪技术的初步研究显示,交感神经纤维错综复杂,主要释放去甲肾上腺素,并在胸腺中形成血管周围神经网络。使用经典单突触逆行和顺行示踪剂的类似方法并没有识别胸腺的副交感神经支配。
后续的研究使用伪狂犬病病毒(PRV)的逆行跨神经元多突触追踪,来确定负责交感神经流出到胸腺的中枢神经系统区域。PRV感染的神经元分布在脊髓、延髓、脑桥、下丘脑室旁核、去甲肾上腺素能细胞A5组、延髓头端腹外侧核和中缝尾侧核。
值得注意的是,PRV感染的动物在DMV中没有PRV阳性细胞核,这与之前的观察结果一致,之前的观察排除了支配该区域胸腺的迷走神经纤维的存在。
虽然连接胸腺和大脑的硬连线路径的证明来自动物研究,追踪技术是可行的,但报告显示人类存在类似的胸腺神经支配模式,为这些发现提供了转化相关性。
神经样纤维和垂体激素通过人胸腺的免疫组织进行化学鉴定。胸腺糖皮质激素通过调节儿茶酚胺释放和肾上腺素受体表达,对胸腺细胞的存活和分化以及交感神经系统功能都很重要。相反,接受肾上腺切除术的动物胸腺去甲肾上腺素水平显著降低。
典型的感觉神经肽,如P物质和降钙素基因相关肽(CGRP),已在胸腺中被发现,但没有明确的报告表明,这些神经肽可以为大脑提供感觉通路,这意味着交感神经支配可能是调节胸腺免疫功能的唯一神经通路。
骨髓神经支配和神经元调节
骨髓神经支配沿着主动脉传导,并通过血管丛穿透骨髓。实质以神经纤维树枝状排列为特征,末端靠近造血细胞和淋巴细胞。大多数纤维支配骨髓血管系统,但其他一些神经末梢支配实质性和血窦元素以调节造血和细胞迁移。
酪氨酸羟化酶是去甲肾上腺素合成的限速酶,存在于大动脉周围的所有神经中,并延伸至骨髓实质。除了主要的去甲肾上腺素能神经支配外,还确定了神经肽Y的免疫反应性,从而表明骨髓的去甲肾上腺素能神经支配和肽能神经支配是混合的。
在很久以前发表的研究中也检测到对 P 物质和 CGRP 呈阳性的神经纤维,但感觉神经元的功能直到最近才被发现。CGRP感觉纤维与去甲肾上腺素能神经一起延伸到骨髓,在那里它们与酪氨酸羟化酶神经元合作,控制造血干细胞的动员。这些发现表明大脑通过硬连接的交感神经和感觉连接控制骨髓的免疫和稳态功能。
随后的研究还发现了支配骨骼和骨髓的副交感神经纤维。尽管在造血生态位附近检测到合成乙酰胆碱的胆碱乙酰转移酶的免疫反应性,但仅在骨中发现了明显的功能性副交感神经支配,其中胆碱乙酰转移酶调节骨重塑。
后来的研究表明,骨髓神经支配与昼夜节律密切相关。骨髓中去甲肾上腺素的释放依赖于昼夜振荡,进而调节与控制白细胞和造血干细胞的保留和排出过程相关的基因表达。尽管这种构成过程在生理上是相关的,但神经介导的白细胞和造血干细胞转运的节律过程在疾病背景下可能特别重要。
未来的研究将有必要澄清清晨急性心血管事件的高发病率是否与神经调节白细胞和造血干细胞运输的影响有关。
次级淋巴器官包括淋巴结、脾脏和与粘膜相关的淋巴组织,通常由交感神经和感觉神经支配。
淋巴结神经支配和神经调节
淋巴结的结构包括血管系统和淋巴管,它们穿透髓质实质,在 T 细胞区域中被复杂的去甲肾上腺素能纤维网络缠绕。相比之下,富含B细胞的生发中心缺乏神经支配。
在稳定状态下,去甲肾上腺素的释放依赖于昼夜节律的激活,进而通过β2-肾上腺素受体信号调节淋巴细胞的生理日常再循环。
通过使用各种技术,从整体免疫标记到逆行神经元追踪、单细胞基因组学和光遗传学,研究人员发现了支配淋巴结的独特感觉神经元阵列。将腺相关病毒注射到淋巴结后,四种类型的神经元被追溯到背根神经节。对这些不同的神经元群体进行的单细胞RNA测序确定了肽能伤害感受器的密集表达,形成了与大脑的双向通讯途径,并持续监测周围免疫环境。
脾神经支配和神经调节
脾脏是最大的次级淋巴器官,监测血液传播的物质和抗原。脾脏主要由去甲肾上腺素能脾神经支配,通常通过神经信号调节免疫功能。
脾神经从腹腔神经节分支,从脾门进入脾脏,沿着脾动脉外侧走行。去甲肾上腺素能神经分布穿过边缘区,伸入白髓,在白髓中,T细胞、B细胞和树突状细胞附近可以发现神经末梢。相反,红髓的神经支配似乎稀疏而分散。通过组织学和追踪的方法,在脾脏中没有发现直接的胆碱能神经支配。
白髓,位于脾脏内部,包含着一种特殊的白细胞,这些细胞聚集在血管周围,当血液流过脾脏的时候,白髓中的淋巴细胞辨认并吞噬掉任何侵入的细菌和病毒,以此方式过滤人体血液,防止机体被病菌感染。
红髓,动物体内最大的淋巴器官。位于左上腹胃的背面,胃与膈之间,呈内侧向内凹陷的扁椭圆形或条索状等。
一项使用完整全组织3D成像的研究提供了有关脾脏神经支配的额外信息。实质内交感神经支配的结构被揭示为圆锥状结构,这在其他免疫器官中是不存在的,这表明独特的神经调节功能发生在脾脏中。
在脾脏中发现了具有独特特征的神经胶质细胞,这又增加了复杂性。自主神经支配通常包含非髓鞘神经胶质细胞。虽然神经胶质细胞在由周围神经系统支配的内脏器官中的特定功能尚未得到充分研究,但它们在免疫器官中的存在可能在神经细胞和免疫细胞之间起着中介作用,这需要进一步研究。
使用逆行示踪剂和后来的跨神经元多突触PRV追踪的研究明确证明,脾脏神经支配完全是去甲肾上腺素能的,起源于腹腔神经节。
通过对脾脏注射PRV后较长时间点的分析,确定了脑干、桥脑和下丘脑的运动前脑核团。随后,光遗传学领域出现了一种追踪神经元回路的完全创新工具,它在功能上映射直接投射到腹腔神经节的DMV胆碱能神经元。
当DMV神经元被光激活时,会诱发脾神经放电,从而直接证明腹腔迷走神经和脾神经之间的解剖联系。
粘膜相关淋巴组织神经支配
身体内的粘膜,如呼吸道和胃肠道的粘膜,有分散的粘膜淋巴组织区域,这些区域共同构成了最广泛的淋巴组织,这些区域统称为粘膜相关淋巴组织,保护机体免受各种挑战。
虽然传统的次级淋巴器官是在胚胎发生过程中发育起来的,但淋巴滤泡,如支气管相关淋巴组织或肠道相关淋巴组织,在出生后会因炎症或感染而聚集。尽管如此,这些异位淋巴组织与传统淋巴组织在结构上有许多相似之处。
粘膜相关淋巴组织的一个典型特征是广泛的神经支配。早期研究描述了支气管相关淋巴组织和肠道相关淋巴组织的交感神经和肽能神经支配,这些淋巴组织含有大量神经肽,如P物质、血管活性肠肽和生长抑素。通常情况下,神经纤维沿着小血管排列,然后在与淋巴细胞接触的粘膜组织的实质中分支,在含有T细胞的区域,神经占优势。
随后的研究通过专门检测和解码各种有害外周刺激的伤害感受器,确定了粘膜相关淋巴组织神经支配的感觉通路。
支配肠道相关淋巴组织的伤害感受器感知胃肠道的扰动,并建立具有保护功能的神经反射。虽然肠道相关淋巴组织的感觉神经支配在抵御微生物方面的作用越来越明显,但对心血管疾病中肠道神经系统的影响仍不清楚。
支气管相关淋巴组织的神经支配作用研究较少,但交感神经、胆碱能神经和感觉神经纤维已被确定。
三级淋巴样器官是指在成年期由淋巴样新生在随机、典型的非淋巴样和非粘膜部位形成的淋巴样组织,以应对慢性炎症。这些组织在自身免疫性疾病、微生物感染、慢性同种异体移植排斥反应、癌症甚至动脉粥样硬化中都被观察到。
在几种转基因小鼠模型中诱导第三淋巴器官,可以表征炎症细胞因子和淋巴趋化因子的模式,这些细胞因子和趋化因子是其发育和调节所必需的。
虽然已经描述了三级淋巴器官的形态、细胞和血管成分,与第二淋巴器官(如B细胞和T细胞室的独特组织、含有滤泡树突状细胞的B细胞滤泡和生发中心)有相当大的相似性,他们在疾病进展中的参与是有争议的,并且仍然是研究的主题。
例如,在微生物感染期间,三级淋巴样器官会在局部保留病原体,从而阻碍它们进入生物体的其他部位。相反,自身免疫性疾病的进展可能因同时存在三级淋巴器官而加剧。通过选择性地去神经支配肠道交感神经或胆碱能神经,迷走神经在三级淋巴器官形成中的重要作用已在实验性结肠炎中得到证实。目前还尚不清楚ANS是否有助于其他器官中第三淋巴器官的发育、组织和功能。
神经免疫相互作用是对挑战体内平衡的应激源做出快速反应的基本适应机制。这一概念首次出现时,脾脏神经支配在细菌内毒素血症(对身体最危险的疾病之一)期间被观察到具有保护功能。
去甲肾上腺素能纤维和淋巴细胞之间的直接神经免疫相互作用被描述,同时确定在脾脏中引起去甲肾上腺素能放电的神经回路,该回路在抑制脂多糖诱导的细胞因子负荷和对抗感染性休克方面有效。
神经免疫相互作用已被确定为心血管危险因素和心血管疾病病理生理学的潜在机制。
神经免疫相互作用促进心血管危险因素的发生及进展
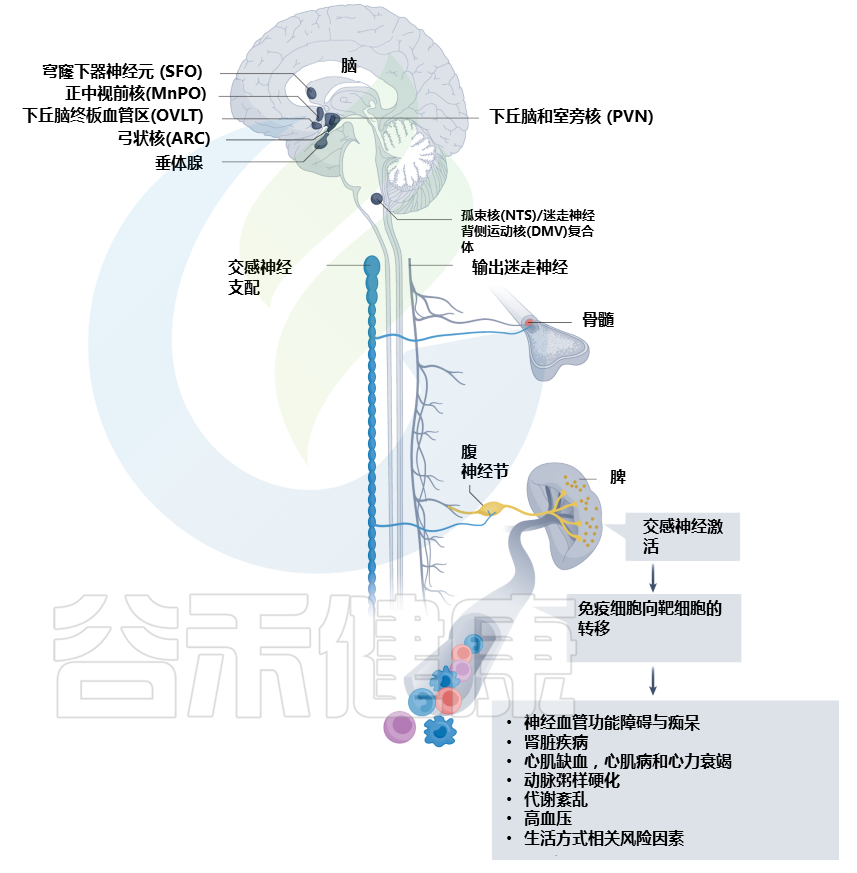
Carnevale D. Nat Rev Cardiol. 2022
大脑中的环室器官被心血管系统的挑战激活。通过一系列中枢和周围神经系统的解剖连接,大脑在免疫器官中建立神经反射来控制和调节免疫功能。心血管危险因素,如高血压、代谢紊乱和动脉粥样硬化,是常见的神经免疫机制改变的基础。心血管疾病,例如心肌缺血、压力过载心肌病、心力衰竭、肾脏疾病和神经血管功能障碍,其特征在于受影响的心血管组织中局部和免疫器官中的神经免疫改变。ARC,弓状核;DMV,迷走神经背运动核;MnPO,正中视前核;NTS,孤束核;OVLT, 终板的血管器官;PVN,下丘脑室旁核;SFO,穹窿下器官。
高血压
与高血压相关的炎症和免疫反应最早出现在20世纪70年代。然而,这些过程大多被认为是高血压导致靶器官损害的结果。
免疫系统在高血压中的机制作用的第一个证据,来自缺乏 T 细胞和 B 细胞且典型的高血压刺激不会增加血压的Rag1 -/-小鼠的研究。通过过继转移重建Rag1 -/-小鼠中的 B 细胞或 T 细胞池,这项研究表明,血管紧张素II或脱氧皮质酮醋酸盐(DOCA)仅在小鼠具有成熟 T 细胞时才会诱发高血压。
随后大量研究调查了特定的T细胞亚群是否对高血压的发展至关重要,发现血管紧张素II给药不会增加Cd8 -/-小鼠的血压,但会增加Cd4 -/-小鼠的血压。免疫系统在血压升高中所起作用的细胞和分子机制仍有待研究。
与血压稳态有关的基本生理变量,如血管张力和肾脏钠排泄,依赖于严格的神经控制。因此,神经调节系统、免疫器官和心血管功能之间建立的关系值得研究。
重要的研究揭示了大脑和免疫系统之间的联系可能对高血压至关重要。首先,在动物模型中,脑室内注射血管紧张素II可通过交感神经系统诱导外周细胞因子的释放。此外,选择性的脑室周围器官损伤阻碍了小鼠对血管紧张素II的典型血压升高反应。
有趣的是,脑室周围器官受损的小鼠无法激发T细胞并促进T细胞在血管系统中的浸润,这表明高血压患者的神经系统和免疫系统之间存在关系。
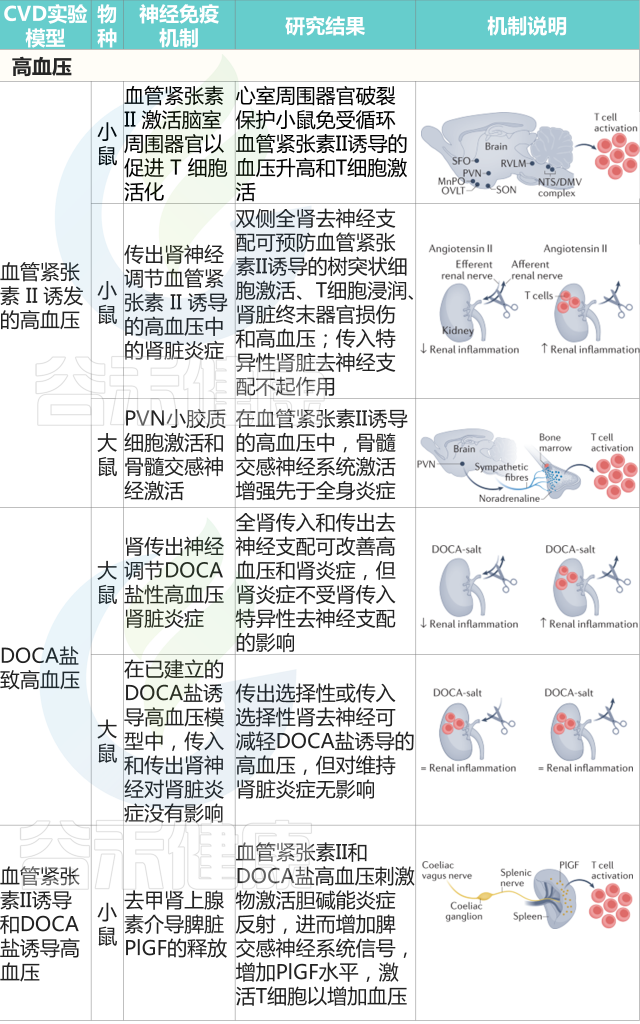

Carnevale D. Nat Rev Cardiol. 2022
高血压患者免疫系统的直接神经控制随后被证实。利用小鼠脾神经的显微神经学检查,血管紧张素II和DOCA盐均能增加神经放电,促进脾脏中去甲肾上腺素的释放。选择性脾脏去神经可防止血压升高以应对任何一种高血压刺激,脾切除术也重现了这一效应。
逆行追踪法,加上在测量脾神经放电时进行的选择性去神经手术,阐明了腹腔迷走神经输出是由高血压刺激激活的节前神经元。
在分子水平上,脾脏中的去甲肾上腺素释放是促进胎盘生长因子激活所必需的,胎盘生长因子是一种血管内皮生长因子家族的血管生成生长因子,也具有对血压升高至关重要的免疫调节功能。
高血压患者的神经免疫另一个相互作用的水平被称为双向脑-骨髓轴,即骨髓中交感神经流出增加先于全身炎症。
有关高血压患者肠道失调的证据正在迅速积累,来自小肠的激活免疫细胞已被证明与血压升高和大脑靶器官损伤有关。目前还不清楚是否存在相反的途径,即神经信号控制与高血压发病和进展相关的肠道和免疫机制。
动脉粥样硬化
脂质在动脉壁的积聚是动脉粥样硬化的一个典型特征,并伴随着免疫细胞的进行性浸润,导致斑块的形成。这一过程以慢性低度炎症为特征,逐渐增加动脉粥样硬化斑块的大小并导致动脉阻塞。
尽管有很多工作研究了导致斑块形成和决定斑块稳定性的机制,但神经免疫通讯的潜在作用才刚刚开始研究。
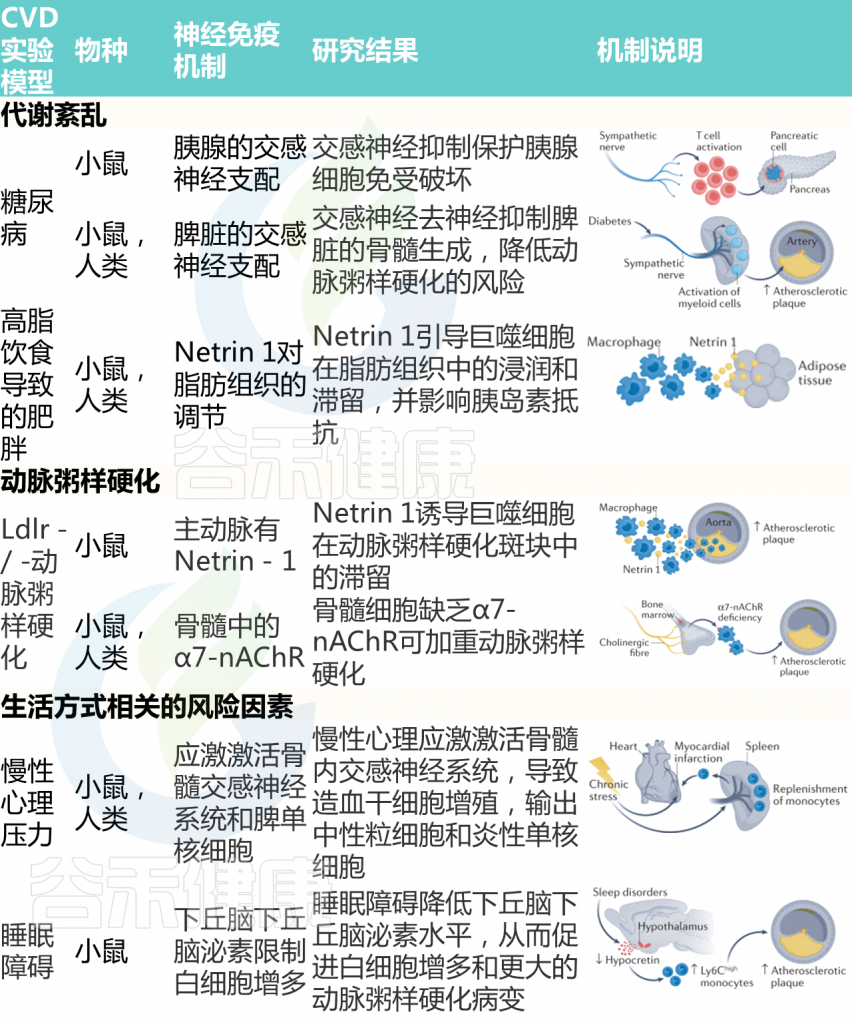
动脉粥样硬化斑块没有神经支配,但在斑块形成和进展过程中调节免疫反应的神经线索已被确定。Netrin 1首先被确定为指导轴突生长锥的神经信号,在人和小鼠动脉粥样硬化动脉的巨噬细胞中也发现了Netrin 1,它通过趋化因子驱动的迁移过程抑制巨噬细胞的排出。
巨噬细胞中的Ntn1缺失阻碍了小鼠的动脉粥样硬化过程,促进巨噬细胞从斑块中流出。
另一种蛋白质通常存在于神经元中,与胆碱能途径有关,可调节高胆固醇血症Ldlr–/–小鼠的动脉粥样硬化过程。在骨髓来源的细胞中,编码α7烟碱型乙酰胆碱受体(α7-nAChR)的Chrna7被切除会恶化小鼠动脉粥样硬化的进展。值得注意的是,人类动脉粥样硬化病变的特征是存在α7-nAChR+免疫细胞,表明该受体的通用相关性。
对受动脉粥样硬化影响的动脉周围三级淋巴器官的鉴定表明,神经机制可能与这些淋巴聚集相互作用,以控制和/或调节动脉粥样硬化疾病的进展。

Carnevale D. Nat Rev Cardiol. 2022
代谢紊乱和肥胖
代谢综合征通常指可能单独或合并发生的一系列疾病,总体上增加了CVD的风险。除了血压升高,通常还包括高血糖和肥胖。
已知ANS失衡和免疫系统激活是代谢综合征的特征。在小鼠中发现了自身免疫性糖尿病的神经免疫机制。由CD8+T细胞介导的对胰腺β细胞的攻击诱导,糖尿病的发病取决于完整的胰腺神经支配的存在。
事实上,6-羟基多巴胺的化学消融或去甲肾上腺素能胰腺纤维的手术去神经支配阻碍了这些小鼠糖尿病的发病。在分子水平上,这种效应是由α1-肾上腺素能受体信号诱导的,因为使用哌唑嗪而不是普萘洛尔可以重现胰腺去神经支配的保护作用。
神经信号还可以控制与高脂饮食诱发的肥胖相关的糖尿病。患有肥胖症的小鼠和人类的脂肪组织被免疫细胞密集浸润,这些细胞导致脂肪组织炎症和胰岛素抵抗。
值得注意的是,脂肪组织中存在神经免疫指导线索netrin 1,这表明netrin 1可能调节巨噬细胞向脂肪组织的动员。此外,选择性缺失小鼠造血细胞中的Ntn1可有效促进巨噬细胞从脂肪组织中排出,减少炎症,并改善胰岛素敏感性。
这些发现确定了靶组织中的神经免疫相互作用,但免疫器官的神经控制也参与了疾病相关炎症状态的系统调节。例如,由脾交感神经驱动的神经通路已被确定为糖尿病的关键。通过手术或使用6-羟基多巴胺实现的选择性脾脏去神经支配,阻碍了糖尿病小鼠的过度脾脏骨髓生成。
一种连接大脑和脂肪组织的新型神经免疫途径已经被描述。在小鼠的脂肪间充质细胞附近发现了交感神经,交感神经控制着一个特定免疫细胞亚群的活动:2型固有淋巴细胞。
反过来,2型固有淋巴细胞通过释放神经营养因子来调节脂肪组织的稳态和肥胖。重要的是,通过在小鼠身上使用逆行追踪技术,结合外科手术和化学遗传学操作,定义了一个新的神经回路,通过交感主动脉-肾回路将脂肪组织中的2型固有淋巴细胞连接到高阶脑区,如室旁核。未来的研究应该调查这种新发现的神经免疫回路是否与肥胖和胰岛素抵抗的心血管并发症有关。
生活方式相关的危险因素
众所周知,生活方式相关的风险因素对CVD的发病率有着深远的影响,同时也对免疫系统构成挑战。此外,心理或身体上的应激状态与ANS的紊乱有关。对生活方式相关风险因素对心血管系统有害影响的潜在相关神经免疫相互作用的研究可以揭示创新的治疗机会。
正如在人类身上经常观察到的那样,慢性应激状态会增加小鼠的血压。值得注意的是,Rag1–/–小鼠对应激诱导的高血压具有抵抗力,并能减轻靶器官损伤。
除了血压升高,慢性应激还会增加动脉粥样硬化和心肌梗死的易感性。经过反复和各种应激性挑战的小鼠显示出造血干细胞增殖增加,导致产生高水平的促进疾病的炎性白细胞。这种效应是由骨髓交感神经纤维释放的去甲肾上腺素增加介导的,而去甲肾上腺素又反过来调节造血干细胞增殖、中性粒细胞和炎性单核细胞的排出。
睡眠障碍对心血管健康构成了重大挑战。小鼠正常睡眠节律的改变会增加动脉粥样硬化,与过度造血和促炎性单核细胞积聚有关。
在分子水平上,研究发现,睡眠碎片化可下调小鼠130的下视黄醇水平。下视黄醇是一种下丘脑神经激素,在控制睡眠、觉醒和觉醒方面具有重要功能。鉴于下视黄醇通过减少巨噬细胞集落刺激因子1的产生来限制骨髓生成,睡眠不良引起的下视黄醇水平降低与白细胞增多有关。
流行病学数据显示,健康的生活方式,如定期的体育活动,可以降低患CVD的风险。尽管许多观察分析都支持这种关联,但很少有机制研究调查这种有益关系的根本原因。有趣的是,习惯性自愿性跑步会降低小鼠的造血活动。在动脉粥样硬化小鼠中,运动抑制了慢性白细胞增多,但不影响紧急造血。通过降低脂肪-瘦素水平,这种效应促进造血生态位静止,改善心血管炎症和预后。
心肌缺血、心肌病和心力衰竭
ANS通过控制血管张力和各种心肌细胞特性,如收缩力、传导和频率,调节心脏功能。交感神经流出增加是慢性心力衰竭不良后果的最强预测因子之一。此外,非心肌细胞,尤其是常驻和非常驻免疫细胞,在应对各种挑战的心脏重塑中起着至关重要的作用。神经、免疫和心脏机制之间的相互作用值得研究。
急性缺血性心脏损伤通过增加骨髓中的交感神经信号与脾髓样细胞的生成增加有关。从脾脏部署的一部分单核细胞积聚在缺血心肌中,并参与心脏重塑。心-脾轴也被发现参与慢性心肌缺血的长期免疫反应,这总体上有助于不良的心脏重塑。脾脏的神经控制是否与这些表型有关仍有待阐明。
慢性高血压和肾功能衰竭会对心肌造成压力或容量过载,如果没有得到充分补偿,最终会导致心力衰竭。
在舒张功能不全的小鼠中,由于单核细胞募集和骨髓和脾脏造血增加,心脏巨噬细胞的数量增加。当巨噬细胞进入心肌时,会产生促纤维化细胞因子IL-10,进而促进胶原沉积和心肌僵硬,进一步加重舒张功能损害。
然而,其他巨噬细胞群体可以通过依赖于多器官相互作用的机制,促进慢性压力超负荷的适应性重塑。受到横向主动脉收缩以诱导心脏压力超负荷的小鼠增加了肾交感神经流出,由此去甲肾上腺素刺激粒细胞-巨噬细胞集落刺激因子的分泌,并对心脏巨噬细胞产生旁分泌作用。这项研究表明,心肌对慢性压力超负荷的适应取决于肾脏和心脏的神经和免疫反应之间的整合。
随后的研究阐明,心肌在稳定状态下含有大量不同的免疫细胞,对挑战的反应取决于常驻和招募的免疫细胞群体之间的整合。
鉴于ANS通过从颈上神经节、星状神经节和胸上神经节分支的纤维直接支配心肌,可以想象,参与心脏重塑的免疫反应的神经调节可能发生在心脏局部。
值得注意的是,尽管颈上神经节的去神经支配对心肌缺血引起的急性心脏重构没有影响,但从长远来看,这一过程减少了炎症浸润,减轻了心力衰竭。
肾脏疾病
肾钠处理、肾素分泌和肾血管张力受ANS的严格调节。肾传入和传出神经支配构成了最广为人知和研究最广泛的心血管反射系统之一。此外,炎症和免疫浸润通常伴随肾脏疾病。
急性肾损伤或慢性肾脏疾病均可导致肾功能衰竭,总的来说会增加心血管疾病的风险。促炎症环境和ANS平衡改变是肾病的特征,但神经系统和免疫系统之间的相互作用才刚刚开始澄清。
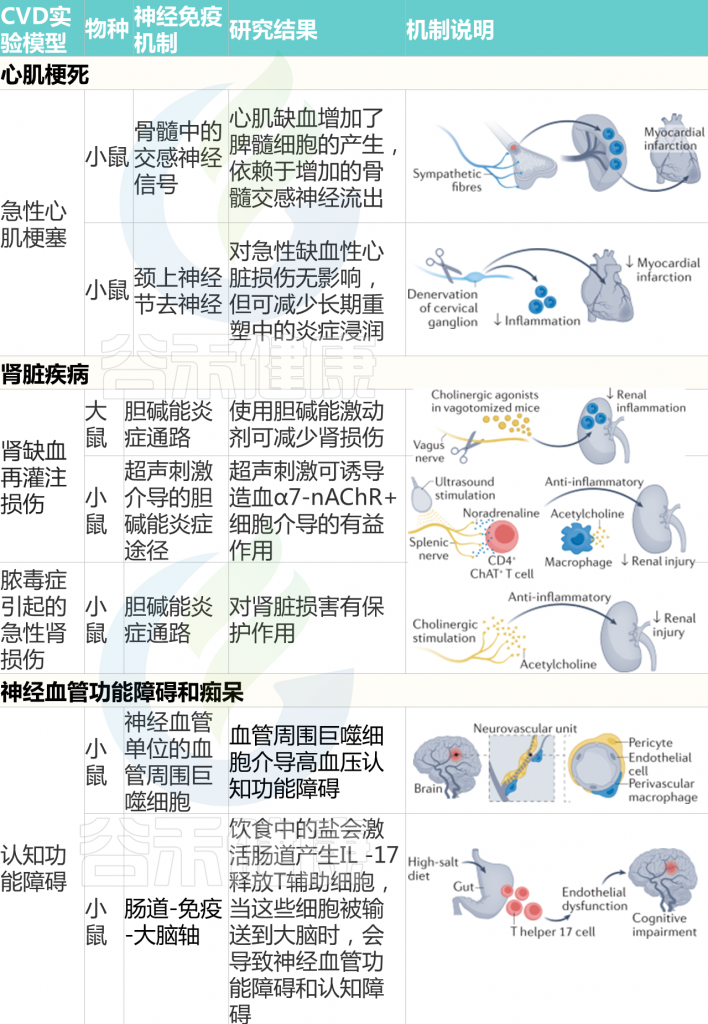
已经证实神经免疫调节在急性缺血再灌注反应中对肾损伤的重要作用。当用能引起胆碱能炎症反射的胆碱能激动剂进行预处理时,患有双侧肾缺血-再灌注或细菌内毒素血症的啮齿类动物对肾损伤的敏感性较低,这意味着神经反射调节由不同原因引起的肾损伤引起的炎症过程。
鉴于在类似的肾缺血再灌注损伤小鼠模型中,通过超声激活胆碱能炎症反射通过抑制炎症减轻了结构和功能损伤,该发现具有转化相关性。
2021发表的一项研究确定在小鼠急性肾损伤期间连接肾脏、大脑和脾脏的神经通路。通过光遗传学,迷走神经的传出或传入纤维被选择性地刺激,表明两者都对肾脏损伤有保护作用。通过激活传入的顺行感觉纤维,可以描绘出从肾脏追溯到延髓头端腹外侧的神经回路,以补充迷走神经-脾反射。
肾脏也是高血压损害的主要目标,这是心血管疾病不良后果的一个强有力的独立风险因素。浸润肾脏的活化免疫细胞和ANS失衡是高血压性慢性肾病的特征。
在动物模型中,肾脏去神经支配可有效对抗过度的肾交感神经流出和血压升高,并抑制T细胞聚集和由此引起的炎症反应、肾纤维化和蛋白尿。
在分析传入和传出肾神经支配的差异贡献时,在DOCA盐大鼠中,传入特异性肾去神经支配降低动脉血压和交感神经活动的程度与总(传入+传出)肾去神经支配的程度相同,但对血管紧张素II诱导的高血压没有影响。
有趣的是,在随后的一项研究中,同样的研究人员对已建立高血压和肾炎症的DOCA盐大鼠进行了传入特异性或全肾去神经支配。在这些动物中,虽然传入特异性和全肾去神经支配在降低血压方面仍然轻微有效,但两种治疗均未显着改变已确立的肾脏炎症。
总之,这些研究表明,肾神经(传入神经和传出神经)和炎症在高血压和肾脏炎症的发病机制中存在密切联系,但是,在确定高血压后,去肾神经支配不是抑制炎症过程的有效治疗,是通过其他机制维持的。
内脏器官炎症由ANS调节的观察可以追溯到之前研究肾传入和传出神经支配的作用。
一项初步研究表明,肾脏去神经支配可有效预防大鼠实验性肾小球肾炎,从而减少蛋白尿、系膜血管溶解、肾小球胶原沉积和转化生长因子-β的表达。这些数据表明,来自肾脏神经输入的信号分子可能在各种疾病环境下引发肾脏炎症和纤维化,进一步导致终末器官肾损伤。

Carnevale D. Nat Rev Cardiol. 2022
神经血管功能障碍和痴呆
大脑由于没有能量储备,一直依赖于通过循环提供的营养,必须根据动态区域激活来适应其需求。因此,大脑对循环系统的改变特别敏感。
多种细胞类型构成脑实质和血管周围组织,包括免疫细胞。正如在其他器官和组织中观察到的那样,大脑中含有常驻免疫细胞(主要是小胶质细胞和血管周围巨噬细胞),当挑战干扰血脑屏障通透性时,这些细胞可以与招募的免疫细胞相互作用。
心血管风险因素会影响血脑屏障的完整性,改变脑血管内稳态,增加患痴呆症的风险。在小鼠和人类中,高血压会导致进行性脑血管损伤,并伴有典型的认知障碍症状。
免疫系统在高血压发病中的作用已得到明确证明,但免疫细胞如何参与高血压诱导的脑损伤才刚刚开始研究。
血管紧张素II诱导的高血压小鼠脑血管周围巨噬细胞的耗竭抵消了血管氧化应激和神经血管损伤,表明免疫的关键作用。
相反,在小鼠中,募集的免疫细胞会导致由血管危险因素(例如过度盐摄入)引起的脑损伤。脑血流、内皮功能和认知能力的损害取决于T淋巴细胞产生的IL-17,而IL-17是通过摄入肠道中的盐激活的。随后的一项研究还阐明了辅助性T淋巴细胞17对大脑有害影响的机制,表明肠道免疫轴对神经的调节非常关键。
外周神经系统的解剖结构和组织结构对轴突亚群的选择性和精确治疗提出了挑战,轴突亚群在特定器官中发挥独特的调节功能。因此,研究人员试图开发出越来越复杂的电极,以刺激更靠近目标组织的较小神经。这种方法有助于获得有关生理学和疾病中免疫神经调节的病理生理学基础的信息。
值得注意的是,靶向脾神经并直接测量其活性的技术的发展,使我们能够确定该免疫器官是神经系统和心血管系统之间串扰的中枢介质。相反,选择性去神经提供了有关该通路在CVD发病和进展中的相关性的机制信息。
研究表明,ANS调节免疫功能的功能障碍是心血管风险和CVD进展的重要组成部分。免疫器官自主神经外流的靶向调节是将这些发现转化为患者治疗的一种可能性。
值得注意的是,神经免疫通讯的机制研究被认为与一系列临床条件有关,如克罗恩病、类风湿性关节炎和原发性干燥综合征,所有这些都涉及免疫和炎症过程的失调。在临床前模型以及随后的炎症和自身免疫性疾病的人类临床试验中进行了探索,以非侵入性方式针对神经免疫机制的可能性也可能成为CVD的一种可能性。
对心血管疾病中调节免疫反应的神经通路的分子和电生理成分的临床前和临床研究为创新疗法提供了理论基础。能够对涉及心血管疾病的神经免疫反射进行精细调节的工具将有助于设计针对组织靶向免疫调节作用的策略,而不会增加感染风险或导致其他不良反应的普遍免疫抑制。根据特定疾病的特定背景和炎症环境,可以通过设计对腹腔迷走神经传出神经的生物电子刺激的选择性模式来微调脾脏的迷走交感神经激活。迄今为止,只有临床前工具已被开发并证明可有效调节免疫细胞从脾脏排出的过程。相反,通过手术切除腹腔神经节或热消融脾动脉周围的交感神经纤维,可以减弱脾交感神经流出的过度激活。
到目前为止,迷走神经刺激的研究主要集中在使用颈部植入装置,这些装置会触发传出和传入神经通路的混合,并产生潜在的不良影响。因此,尽管在自身免疫性疾病的临床试验中取得了有希望的结果,但迷走神经刺激方案具有引起脱靶刺激的局限性。
为了克服这一缺点,已经实施了改进的实验性迷走神经刺激方案,以选择性地刺激腹腔传出迷走神经并诱发脾神经流出。有趣的是,一系列研究提供了交感神经介导的脾神经控制的证据。特别是,通过腹腔神经节与脾神经相连的内脏神经已被证明可调节脾介导的炎症反应。具体作用是整合的还是单独作用的,取决于具体的病理生理学背景。
对腹腔迷走神经刺激后的脾脏免疫细胞的分析显示,特定的生物电子调节模式促进选择性T细胞亚型的排出,这表明可能会发展出靶向免疫调节。
使用活体和离体制剂对小鼠、大鼠、猪和人脾神经进行神经解剖学和功能比较,表明将临床前发现转化为临床相关工具的可行性。然而,尽管这种方法需要在实验模型中进行进一步研究,以揭示CVD中神经免疫通讯的病理生理学基础,但临床应用可能会受到该过程侵入性的限制。
肠道微生物群决定下丘脑-垂体系统的激活水平。特别是,肠道微生物群是心血管疾病发病机制中神经免疫介质的重要来源。
心肌缺血、心肌病和心力衰竭
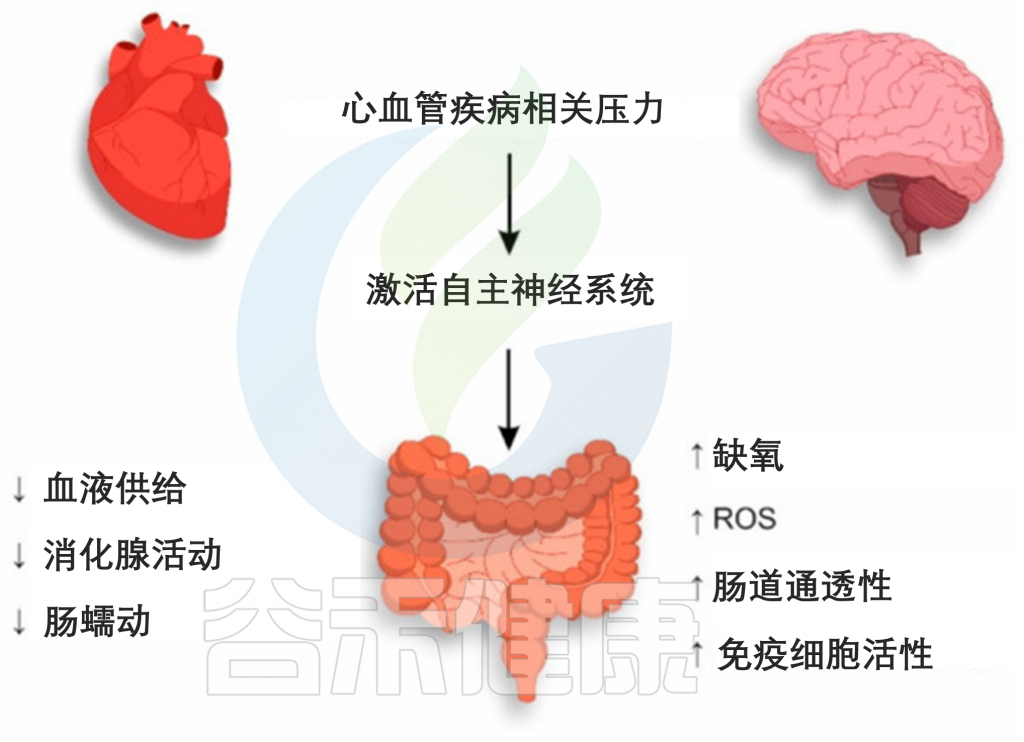
与 CVD 相关的压力通过激活 ANS 的交感神经分裂来影响整个生物体,包括胃肠道。在 ANS 的影响下,肠道内微生物群的血液供应减少,从而降低了消化腺的活动,胃肠道的肠道蠕动减慢。上述机制决定了由于 CVD 相关应激导致的肠上皮细胞的进一步紊乱。
CVD相关应激期间肠道上皮损伤的机制

Suslov, Andrey V,, et al. J Clin Med. 2021
肠壁由肾上腺素能交感神经纤维支配,在刺激期间增加水和钠的吸收,伴随着肠道通透性的增加。同时,在大肠迷走神经的影响下,肠上皮杯状细胞产生的粘液减少。
值得注意的是,一方面,粘液为肠道上皮细胞提供保护,使其免受共生体及其代谢产物的影响,另一方面,粘液阻止免疫细胞的过早激活。因此,粘液层的减少和肠壁通透性的增加可导致肠道细菌的紊乱和肠上皮细胞的空间分离。
在Wistar大鼠中显示,出生后早期有限的筑巢压力会导致高皮质类固醇激素血症,增加肠道通透性,减少粪便微生物多样性,导致肠道微生物群组成失衡。肠道血供减少不仅是由于ANS交感分裂的影响,也是由于CVD的致病影响。
几项研究表明,肠道供血衰竭伴随着多种类型的CVD:心肌梗死、严重动脉粥样硬化、慢性心力衰竭、糖尿病和肥胖。因此,CVD期间肠道内的血供衰竭是由多种机制同时决定的。
肠血供减少伴有组织缺氧,而肠粘膜对缺氧最为敏感。
肠粘膜是一种支持粘液层以及微生物群与上皮下组织空间分离的解剖结构。在缺氧期间,有氧和无氧分解代谢循环中的葡萄糖转化会在中间阶段损害能量的生物合成。这导致活性氧(ROS)的释放。
由于活化免疫细胞的积累和 ROS 的产生,再灌注会增加缺血性损伤的破坏性影响。活性氧对蛋白质、脂质、碳水化合物和核酸具有高反应性,导致肠上皮完整性受损。至于肠道菌群与缺血性肠道损伤之间的关系,在大鼠模型中显示,肠道缺血-再灌注损伤导致肠道菌群发生显著变化,大肠杆菌和口腔普氏杆菌数量增加,随后在愈合阶段乳酸杆菌数量增加。
同时,在急性心肌梗死大鼠模型中证明,肠道微生物群的改变会导致肠道炎症和细胞凋亡的发展,也就是说,肠道缺血不仅会导致肠道微生物群失衡,反之亦然,肠道微生物群的变化会导致肠道损伤。
除粘液层外,肠上皮层在提供肠屏障功能方面也起着重要作用。肠上皮层由与紧密连接蛋白连接的上皮细胞组成,特别是紧密连接蛋白、封闭蛋白、钙粘蛋白和粘附分子。
紧密连接蛋白作为肠-脑轴结构中肠屏障的重要元素。研究表明,脑肠肽ghrelin可以减轻动物模型脑出血后激活紧密连接蛋白 zonula occludens-1 和 claudin-5 的肠道屏障功能障碍。
一些研究通过改变紧密连接蛋白证明了肠道微生物组变化与肠道屏障损伤的关系。例如,植物乳杆菌增强上皮屏障刺激基因的表达,这些基因参与紧密连接zonula occludens-1、zonula occludens-2 和 occludin 的信号通路。
在小鼠模型的另一项研究中也证明了相同的效果,其中用乳酸杆菌、双歧杆菌和链球菌的混合物治疗增加了紧密连接 zonula occludens-1 和紧密蛋白的表达。紧密连接完整性的改变可导致与代谢宿主状态受损相关的细菌或细菌代谢物的流入增加,表现为心脏代谢疾病。
肠上皮和粘液屏障位于肠道环境、肠道细菌和免疫系统之间。
众所周知,肠上皮层包括不同类型的细胞:
肠细胞
杯状细胞
肠内分泌细胞
潘氏细胞
簇状细胞
M细胞
以及多种专业免疫细胞,如
淋巴细胞
树突状细胞
巨噬细胞
均位于肠粘膜表面附近
上皮内淋巴细胞是第一个对致病因素做出反应的免疫细胞,它侵入上皮并传播树突以检测肠腔抗原。
其他细胞位于有组织的淋巴结构中,如派尔斑和隐斑,或分散在固有层内。
与巨噬细胞和树突状细胞等专业免疫细胞类似,肠上皮细胞表达先天免疫受体,如模式识别受体,包括 Toll 样受体 (TLR) 和核苷酸结合蛋白,含有寡聚化结构域 (NOD)。
潘氏细胞合成抗菌分子受 TLR4/MyD88 和 NOD2 信号传递的调节,这些信号传递受肠道微生物的控制。
TLR 通过激活促炎信号通路以响应微生物抗原,在先天免疫系统中发挥着重要作用。
肠道免疫细胞通过细胞因子或直接的细胞连接支持肠道黏膜的屏障功能。因此,由 Th17 细胞或 3 型先天性淋巴细胞 (ILC3) 产生的 IL-17 和 IL-22 会增加肠上皮细胞分泌的 AMP 和 Reg3 家族蛋白 。
此外,上皮内淋巴细胞产生的 IL-6 可增强肠上皮细胞增殖并促进损伤后黏膜的修复。然而,其他促炎细胞因子,如 TNF-α 和 IFN-γ,通过抑制 β-连环蛋白/T 细胞因子 (TCF) 信号传递来抑制上皮细胞增殖 。
肠上皮细胞还通过分泌细胞因子和趋化因子来调节宿主免疫反应。
在用革兰氏阴性细菌大肠杆菌和变形杆菌的鞭毛蛋白刺激肠内皮期间,TLR5 / MyD88 信号促进 IL-8 的产生,IL-8 将中性粒细胞募集到固有层中。
前面CVD中提到的胆囊收缩素、胰高血糖素样肽 (GLP) 和血清素由肠道内分泌细胞分泌,影响肠道免疫系统的活动。
胆囊收缩素通过 CD4+ 细胞和 B 细胞调节细胞因子的分化和产生。值得注意的是,交感神经系统调节的消化腺活性的降低间接影响免疫细胞的活性。
有趣的是,微生物群对上皮肠屏障的影响不仅取决于免疫成分,还取决于其他影响。特别是,由肠道微生物群合成的短链脂肪酸被用作上皮细胞的能量来源,并间接增强上皮屏障。微生物代谢产物吲哚通过激活孕烷-X 受体具有防御屏障作用,并增加胰高血糖素样肽-1 的分泌。
无法保存肠上皮的复杂解剖和功能特征会降低上皮屏障的抗菌、免疫调节和再生能力。粘膜的破坏导致共生细菌及其代谢物从肠腔转移到上皮下组织,导致促炎细胞因子的分泌。反过来,这会导致器官功能障碍,并伴有肠粘膜炎症。
现在越来越多的证据表明,肠道细菌的代谢物在炎症过程中通过被破坏的肠道屏障进入循环。
微生物组介导疾病的三个因素:
首先,肠道细菌的代谢物是慢性免疫反应的永久激活剂,会在肠道以及整个生物体中引起持续性炎症。
其次,先天免疫系统成熟期肠道微生态失调导致免疫耐受性受损,随后表现为自身免疫和自身炎症性疾病。
第三,微生物组可以影响控制肠道远处组织特异性免疫的免疫因素。
考虑到肠道微生物群在神经免疫网络形成中的作用。脑源性神经营养因子 (BDNF) 是一种应激蛋白,是神经营养因子家族的成员,可增加大脑中神经元对功能障碍的抵抗力,并提供神经系统的可塑性。
BDNF 控制了广泛的过程,包括微生物群-肠-脑轴参与心脏代谢疾病的发病机制。研究表明,BDNF 信号可能介导间歇性禁食对血糖调节和心血管功能的影响 。此外,研究表明,用高剂量益生菌治疗可以调节斑马鱼的行为,导致一些大脑相关基因的表达发生显着变化,例如 BDNF。因此,BDNF 可能代表了微生物-肠-脑轴的分子机制。
神经免疫轴:微生物群-肠-脑-CVD
肠道粘液膜的缺氧损伤、微生物群转移到上皮下组织、肠上皮屏障功能的破坏、肠道细菌代谢产物和炎症细胞因子的合成使肠道成为最大的内毒素源。炎症介质通过全身血液和淋巴循环到达神经系统中心。
血脑屏障
血脑屏障 (BBB) 在妊娠期间形成,充当大脑和血液循环系统之间的选择性过滤器。肠道微生物群和微生物代谢物在血脑屏障形成中的重要性已在不可知菌小鼠身上得到证实。在没有肠道微生物的情况下,与正常动物的血脑屏障相比,小鼠的血脑屏障变得具有渗透性。
研究发现,大脑的淋巴系统流入脑脊液,进入蛛网膜下腔,并进一步进入颈深淋巴结。脂质的溶解度、蛋白质的三级结构、浓度、分子质量和化合物的电荷决定了介质从外周血供应和淋巴系统到大脑的通道。
外周血中的细胞因子主要是亲水性的,可以调节神经系统的免疫功能。研究还表明,静脉注射吲哚(类似于色氨酸的细菌代谢产物)可以克服BBB。
LPS(脂多糖)的神经炎症效应通过外周组织中的TLR激活发挥作用,通过血脑屏障阳性的促炎细胞因子在神经系统中引起继发效应。
血脑屏障和淋巴血管系统被认为是信号进入大脑的入口。例如,循环免疫细胞和炎症介质(包括宿主和细菌的激素和神经递质)以及迷走神经刺激代表了有助于直接或间接微生物信号从肠道传输到大脑的机制 。
炎性细胞因子也是激活中枢神经系统的一个重要因素,作为对各种刺激的反应,包括在肠道病理过程中激活下丘脑-垂体-肾上腺轴的促炎性细胞因子。
肠易激综合征患者的皮质醇和促炎细胞因子白细胞介素IL-6和IL-8显著升高。IL-1α细胞因子在中枢神经系统水平上刺激机体的整个葡萄糖代谢;IL-6、IL-1、TNF-α和IFN细胞因子相互独立地刺激下丘脑-垂体-肾上腺轴(HPA轴)。
除了炎性细胞因子外,炎症期间环氧合酶系统合成的前列腺素也参与HPA轴的激活。多项研究发现炎性细胞因子(TNF-α、IL-1和IL-6)在HPA轴激活中的作用。任何炎性细胞因子的注射都会刺激HPA轴,并导致循环皮质酮水平升高。值得注意的是,在LPS穿透后,任何细胞因子的阻断都不会阻断HPA轴的激活,也就是说,如果肠上皮屏障功能停止,LPS进入血液,那么细胞因子激活HPA轴的复制效应就会实现。那么接下来就是神经免疫性疾病和靶器官损伤了。
因此,所有炎症介质都会促进HPA轴的激活,而阻断任何一种细胞因子都不能减少HPA轴的刺激,因为它们之间存在重复效应。
因此,下丘脑-垂体-肾上腺轴的激活是大脑介导的对疾病的基本反应之一。HPA 轴被认为是神经内分泌系统的基础,它在心理和生理压力(包括感染)的影响下调节机体的稳态,促进对压力的充分反应。
所考虑的机制在慢性应激中非常重要。由于情绪唤醒的阈值不足以在CVD期间形成压力,因此神经系统中形成全值压力反应,随后通过肠内炎症介质持续激活HPA,激活ANS的交感分裂。
值得注意的是,机体的整个复杂病理变化是通过急性应激途径发展起来的,而情绪成分(情绪刺激)与慢性应激阈值相对应或完全缺失。这个问题需要进一步研究。因此,综述的机制对神经系统中心(包括ANS中心)有激活作用,ANS中心反过来又支配内脏器官,包括微生物群居住的肠道。
结合有关肠道微生物群的机制及其与神经系统通过肠-脑轴发育紊乱的关系,可以初步得出结论,在CVD期间,来自肠道的介质通过血流和淋巴进入大脑,并激活下丘脑核团。然后,只要下丘脑是ANS的节段上整体中心,ANS的交感神经分裂就会被激活。
因此,来自肠道的介质到达ANS的节段上中心,并激活交感和副交感分裂的工作,从而关闭肠道微生物群参与CVD发病机制的病理循环。许多发表的研究报告表明,微生物群介导的炎症介质的增加会加重CVD的病程和预后。
研究还发现,恢复CVD患者的肠道菌群可以改善疾病的预后。使用增加阿克曼菌属、双歧杆菌、乳酸杆菌、拟杆菌和普氏杆菌的细菌数量的复合治疗制剂可改善CVD的病程。
众所周知,双歧杆菌和乳酸杆菌属的细菌对肠壁具有局部抗炎作用。肠上皮屏障功能的恢复是因为肠壁炎症的减少,这意味着炎症介质在体循环中的水平降低,因此它们对神经系统的激活作用降低。
尤其是,高血压与肠道微生物群紊乱和肠脑轴失调有关。在高血压大鼠模型中证明,长期开菲尔治疗可降低IL-6和TNF-α蛋白密度,并消除在下丘脑室旁核和延髓头端腹外侧区观察到的小胶质细胞激活,保护心脏调节核免受肠道介导炎症的影响,从而提供开菲尔的降压作用。在小鼠缺血性中风或脑缺血模型中进行的一些研究表明,缺血性中风脑损伤通过增加促炎反应和细胞因子、趋化因子和免疫细胞浸润大脑结构,促进肠道失调的发展,这与不良预后有关。
CVD患者肠道菌群与神经系统的相互作用
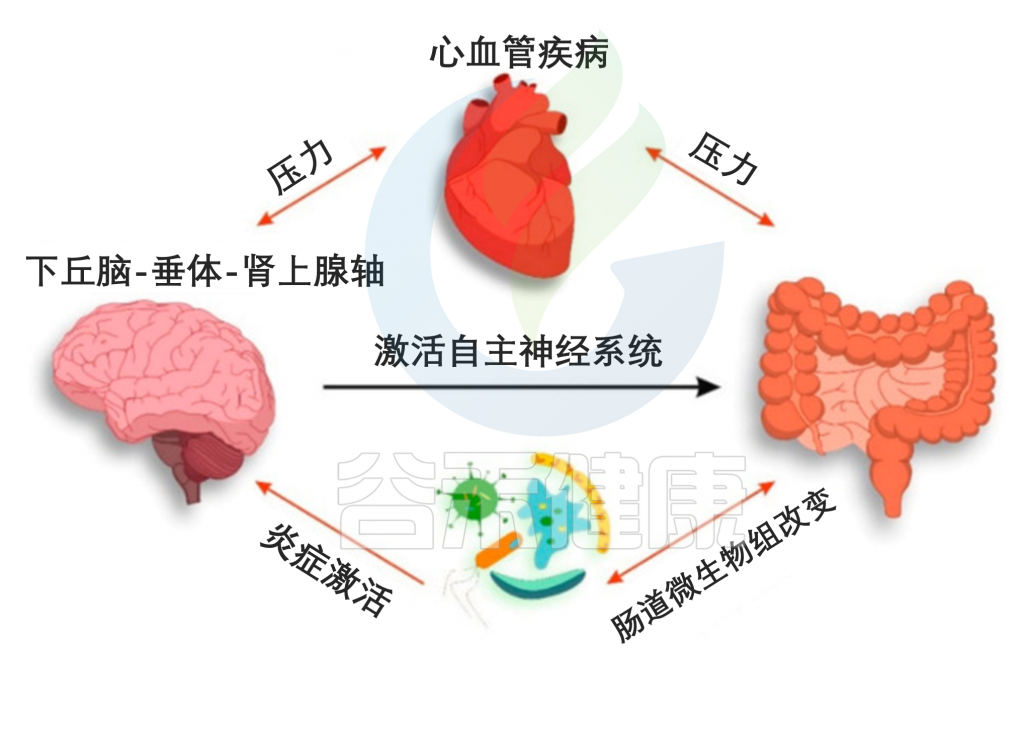

Suslov, Andrey V,, et al. J Clin Med. 2021
肠道微生物群参与了 CVD 的发病机制并决定了 HPA 轴的炎症激活。
一些研究调查了微生物组靶向制剂可改善 CVD 病程,减少动脉粥样硬化的进展和主要 CVD 并发症的风险 。
在这里,我们可以假设基于微生物组治疗的有益心脏保护机制是由于其对微生物组-肠道-脑轴的影响。
通过阻断左前冠状动脉诱发心肌梗死的大鼠中显示,与安慰剂组相比,使用基于瑞士乳杆菌和长双歧杆菌组合的益生菌可降低与心肌梗死相关的不同脑区的凋亡倾向。
另一项针对小鼠的研究表明,在实验性中风后,抗生素调节肠道微生物群可降低缺血脑内的LPS水平和神经炎症。一项针对冠心病患者的研究发现,益生菌鼠李糖乳杆菌与益生元菊糖复合物对抑郁、焦虑和炎症生物标志物具有有益作用。
建议所有成年人每周至少进行150-300分钟的中等强度或75-150分钟的高强度有氧运动,或两者的同等组合。当然要视身体状况而定,如果自身基础不太好,在能力和条件允许的情况下尽可能保持一些低强度活动。
减少久坐时间,适当进行轻度体力活动是有益的。
饮食对人类健康的多个方面都有重大影响,不健康的饮食模式(例如高脂肪的西式饮食)与动脉粥样硬化、代谢综合征和肥胖症等一系列慢性疾病的风险增加有关。免疫系统正在成为这种关系的关键中介,通过食物诱导调节与慢性炎症相关的促炎/抗炎因子以及增加/减少各种病理结果的风险。
支持这一观点的大型流行病学研究表明,以高摄入饱和脂肪和低纤维为特征的饮食模式与促炎生物标志物水平升高有关,例如 C 反应蛋白 (CRP) 和白细胞介素 IL- 6。相反,摄入大量水果和蔬菜和/或经常食用鱼类的饮食模式与较高的脂联素血清浓度相关,脂联素具有抗炎特性。
这些观察性研究得到了干预试验的进一步支持,干预试验表明饮食可能会影响血清炎症生物标志物谱。例如,高胆固醇食物的饮食干预增加了对胰岛素敏感的参与者的 CRP 和血清淀粉样蛋白 A 浓度。
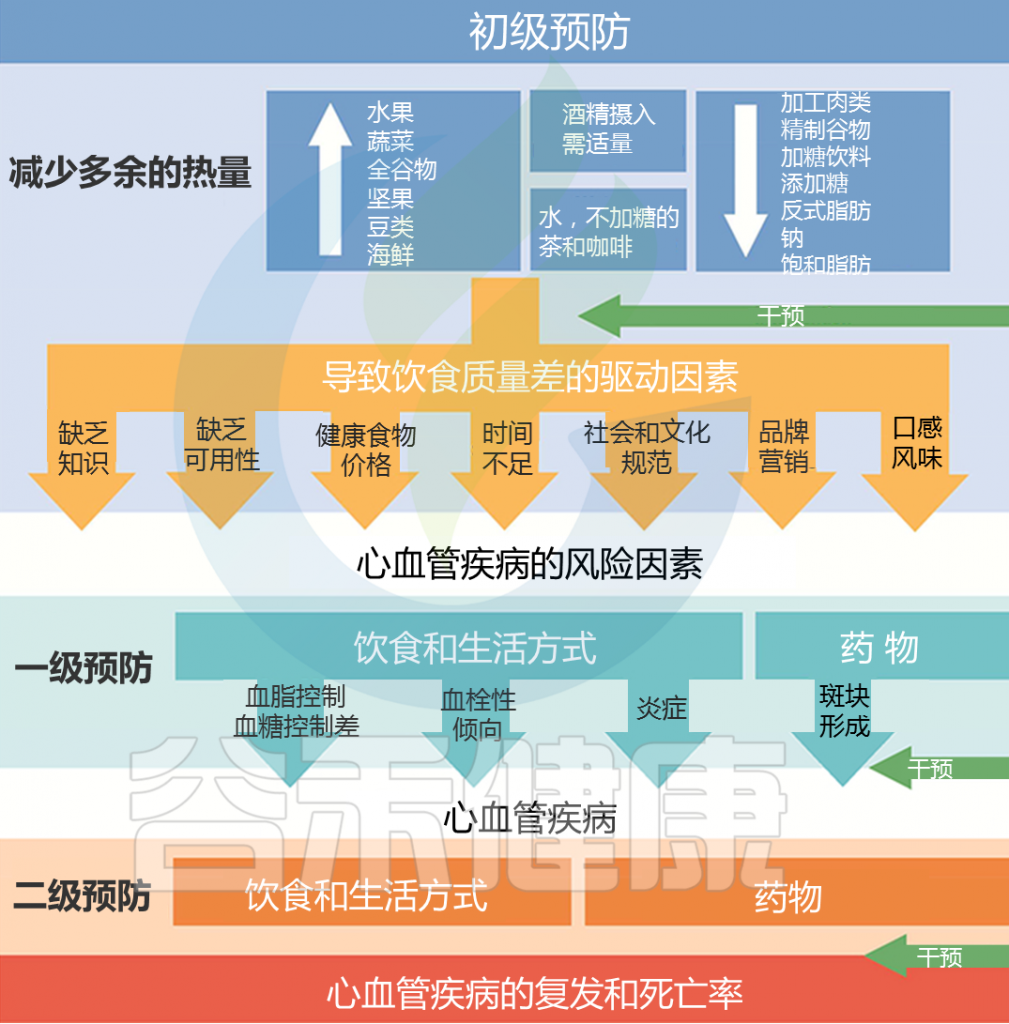

Yu E, et al.,J Am Coll Cardiol. 2018
健康的饮食可以降低心血管疾病和其他慢性疾病的风险。从更多荤食(以动物为基础的)饮食模式转变为素食(以植物为基础的)饮食模式,可能会减少心血管疾病。
建议饮食中多吃水果、蔬菜、坚果等;少量食用低脂乳制品和海鲜;而且尽可能少摄入加工肉类、含糖饮料、精制谷物、盐等。
戒烟可迅速降低心血管疾病风险,是预防动脉粥样硬化性心血管疾病最具成本效益的策略。
建议限制饮酒或戒酒,每周最多饮酒100g。
通过改变生活方式来达到和保持健康体重,对这些指标可产生有利影响(如血压、血脂、血糖等),并降低CVD风险。
当饮食和体力活动改变以及其他常规的非侵入性干预措施效果不佳时,应考虑对高危人群行减重手术;也可以考虑使用具有心血管保护作用的抗肥胖药物。
新指南提出心理压力与动脉粥样硬化性心血管疾病风险相关,需要加强对心理障碍患者的关注和支持,对其进行生活方式和药物干预,方式包括呼吸练习、冥想、写日记、适当锻炼、与大自然接触、与他人建立联系等,尽可能改善压力症状和生活质量,可改善心血管疾病。
通过对血压,血糖,血脂等指标的日常监测来了解健康状况,也可以通过肠道菌群健康检测等方式来了解慢病风险,阻断这类慢病的进程,预防控制代谢紊乱,从根本上预防心血管疾病的发生。
本文主要基于研究阐述免疫、炎症的神经调节以及肠道菌群如何参与 CVD 的发病和进展。
在CVD的初始阶段,肠道微生物群在其发病机制中的作用是次要的,这意味着细菌的定性和定量变化不像在随后的阶段那么重要。
然而,后来,当肠道微生物群决定了下丘脑-垂体-肾上腺轴的炎症激活水平时,肠道微生物群的变化对CVD的发展具有重要意义。
在CVD进展过程中,肠道细菌与肠壁的病理过程密切相关,成为CVD发病机制中的关键因素之一。在这方面,试图确定与CVD进展过程最相关的肠道细菌,可能是开发CVD诊断、预防和治疗新相关方法的重要一步。
此外,注意通过饮食衍生的微生物代谢物、炎症反应转变、校准神经免疫从而影响CVD干预和治疗反应。
·
具体基于肠道菌群的饮食调节,以及CVD 进展中的饮食-微生物群串扰的机制,菌群代谢产物的作用等详见本次推文的第二篇:
《 饮食-肠道微生物群对心血管疾病的相互作用 》主要参考文献:
Carnevale D. Neuroimmune axis of cardiovascular control: mechanisms and therapeutic implications. Nat Rev Cardiol. 2022 Mar 17. doi: 10.1038/s41569-022-00678-w. Epub ahead of print. PMID: 35301456.
Yu E, Malik VS, Hu FB. Cardiovascular Disease Prevention by Diet Modification: JACC Health Promotion Series. J Am Coll Cardiol. 2018;72(8):914-926. doi:10.1016/j.jacc.2018.02.085
Suslov, Andrey V et al. “The Neuroimmune Role of Intestinal Microbiota in the Pathogenesis of Cardiovascular Disease.” Journal of clinical medicine vol. 10,9 1995. 6 May. 2021, doi:10.3390/jcm10091995
Thaiss CA, Zmora N, Levy M, Elinav E. The microbiome and innate immunity. Nature. 2016 Jul 7;535(7610):65-74. doi: 10.1038/nature18847. PMID: 27383981.
Huh JR, Veiga-Fernandes H. Neuroimmune circuits in inter-organ communication. Nat Rev Immunol. 2020 Apr;20(4):217-228. doi: 10.1038/s41577-019-0247-z. Epub 2019 Dec 17. PMID: 31848462.
Frank L J Visseren, François Mach, Bryan Williams,et al., ESC Scientific Document Group, 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies With the special contribution of the European Association of Preventive Cardiology (EAPC), European Heart Journal, Volume 42, Issue 34, 7 September 2021, Pages 3227–3337

谷禾健康

在持续的肠道菌群检测实践过程中,我们收到很多新的问题反馈和对肠道菌群检测在具体问题中的疑问。在此谷禾基于长期和大规模样本群的经验以及实验分析,对部分常见问题进行汇总和整理。

一次肠道菌群检测好比一场健康考试,你拿到报告的那一刻,等同于拿到了你考的那张卷子,那么你首先会关心自己考了多少分。
在肠道菌群检测报告中,同样也有基于肠道菌群的健康评估分数,即健康总分。
基于大数据和整体性评估,报告中会给出健康总分这项指标。这个健康总分是如何计算得出的?
还是拿我们最熟悉不过的考试举例,一场语文考试可能包括了拼音词语、阅读理解、写作等模块,所以最后你的总分是综合各个模块的测试之后得到的(比如说拼音写错了扣1分,阅读理解错了一题扣5分……),通过各模块测评后得到的总分反映的是你的综合能力。
健康总分也是一样,综合计算了三个部分:肠道菌群健康状况、疾病风险情况和营养饮食均衡情况综合评估计算。总分100分,采取扣分制,疾病风险和营养不均衡以及菌群失衡都会相应的减分。
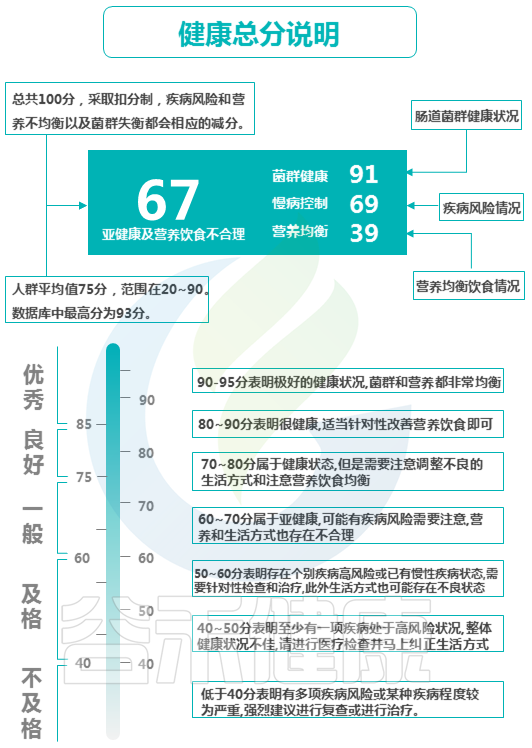
以上是具体的评分标准。
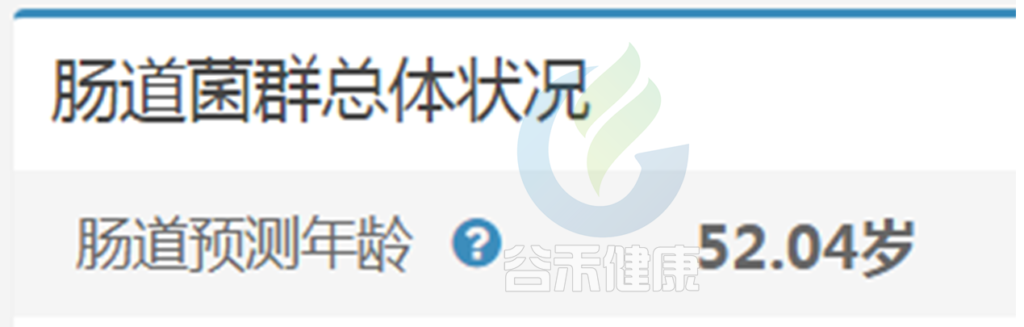
健康总分可以说是非常直观的一个指标,除此之外,整体性评估指标还有一个:肠道预测年龄。
生理年龄是指人达到某一时序年龄时生理和其功能所反映出来的水平,是从医学、生物学角度来衡量的。
谷禾肠道预测年龄是基于超过6万人群队列的深度学习模型构建的,对健康人群的肠道年龄预测与真实生理年龄吻合度很好。
肠道预测年龄和生理年龄就像齿轮运作,井井有条匹配状态,身体这个系统运作起来相对健康轻松。
疾病人群或菌群紊乱人群,肠道年龄会较大偏离真实年龄,也就是这个齿轮系统出现一些偏差问题。
如果肠道菌群多样性下降,且以大肠杆菌为主,可能会被预测为10岁以下儿童,也就是预测年龄远小于真实年龄。
如果存在较多病原菌,则预测年龄会偏向远大于真实年龄。
如果菌群预测年龄和实际生理学年龄相差很大,如何解读?
还是用考试来说,每个年龄段都应具备该年龄段的能力。如果你是一个初中学生,那么就应该答出初中阶段学生该会的题,这时候给你做个测评,发现还停留在幼儿园水平或者已经到了大学生水平,要么太幼稚要么太早熟,都不符合健康的身心发展规律。
肠道预测年龄同样,如果肠道预测年龄偏离实际年龄很大,两种情况,一种是偏大,另一种是偏小。
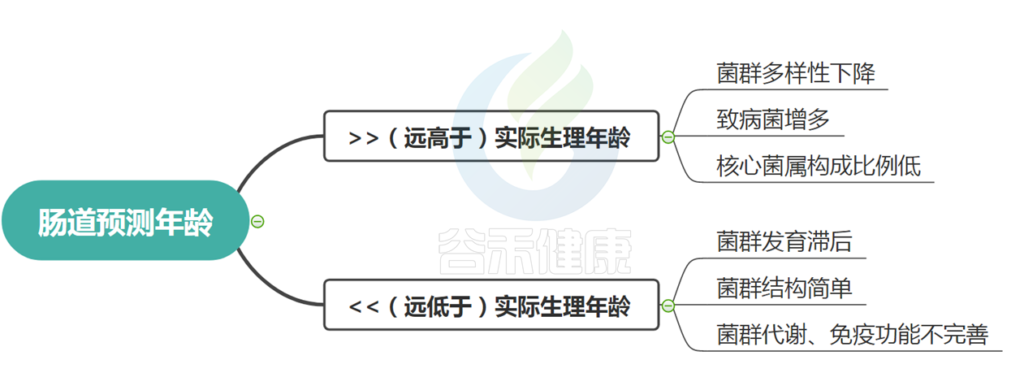
这两种情况均表明菌群发育成熟偏离了实际生长发育,我们均认为其代表菌群状况不太好,存在菌群异常或不健康状况。
如果偏小,即肠道年龄远小于生理学年龄,一般菌群发育滞后或者偏幼龄,菌群构成简单,代谢以及免疫功能不完善。
如果偏大,即肠道年龄远大于生理学年龄,一般菌群多样性下降,变形菌、肠杆菌等致病菌增多,核心菌属构成比例低等。
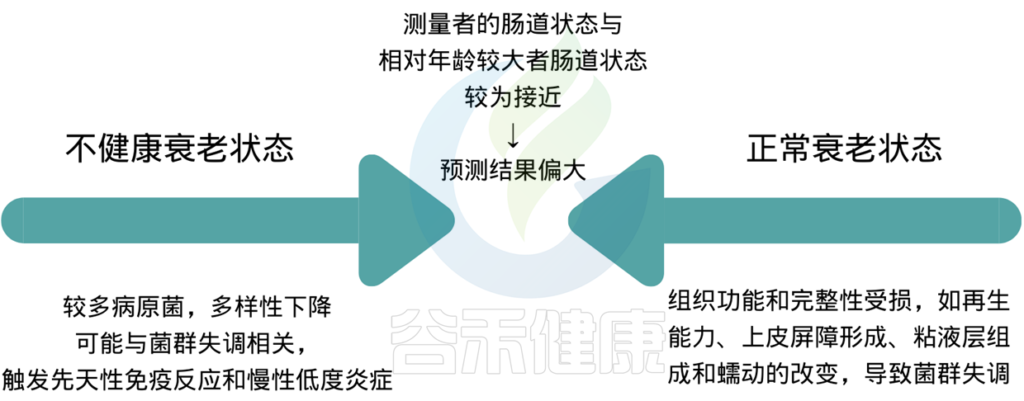
而在正常范围内,肠道预测年龄小于生理学年龄,那么表示菌群发育正常,菌群构成和代谢偏向于更年轻,比较好。那么什么是正常范围呢?
谷禾肠道年龄预测如下范围内表示正常:
0~2岁:偏差小于3个月
3~5岁:偏差在6个月以内
6~15岁:偏差在1岁左右
16~50岁:偏差在3岁以内
50岁以上:偏差在5岁以内
真实年龄与肠道预测年龄在范围内的差异可以反映其肠道菌群的发育和衰老状况。以下情况可能会导致肠道预测年龄完全偏离真实年龄,包括:
▪ 肠道菌群紊乱
▪ 菌群结构过于单一
▪ 近期服用可能严重干扰菌群的药物(如抗生素)
▪ 病原菌感染或者处于疾病状态
▪ 长期补充益生菌
由于肠道年龄考虑了整体的肠道菌群结构,如果肠道年龄严重偏离真实年龄,通过干预调整或去除上述干扰因素肠道年龄是能够恢复正常范围,但该干预周期一般需要1个月以上。
有益菌
有益菌包括益生菌,益生菌主要来自两个菌属:
分别是双歧杆菌属和乳杆菌属,目前已获得批准的有效益生菌菌株均来自这两个细菌属。
其中双歧杆菌可有效改善肠道状况,而特定的乳杆菌菌株可以改善精神健康,包括焦虑和情绪,也能改善肠道健康。双歧杆菌和乳杆菌也是人体肠道菌群中常见的菌。
虽然说是常见菌,却不见得它们数量多。在成年人肠道菌群中,双歧杆菌的比例较低,在1%左右,乳杆菌更是低于1%,甚至很多人(20~40%)的肠道菌群中比例低至万分之一。
下表是谷禾检测的益生菌列表,列出了主要的常见益生菌。

除了上述益生菌,有益菌还包括下列种属,这些菌属是构建肠道菌群的核心菌属,在评估有益菌水平时根据菌属对肠道菌群结构的重要性会给予不同的权重。
Faecalibacterium、Ruminococcus、Roseburia
Phascolarctobacterium、Prevotella、Parabacteroides
Oscillospira、Megamonas、Lachnospira
Lachnoclostridium、Gemmiger、Eubacterium
Coprococcus、Dorea、Dialister
Clostridium、Blautia、Bacteroides
Akkermansia、Alistipes、Agathobacter
通常益生菌的检出率比较低,一般在益生菌补充一周左右在报告中可以体现。从大数据来看,益生菌检出的同时,菌群的相关指标也会有所提升,比如说有害菌降低,改善菌群平衡状况。
有害菌
有害菌和肠道内的其他共生菌共同构成菌群微生态,也是大部分人群肠道内常见的菌群。
有害菌是相对而言的,正常肠道菌群也包含许多这些菌属的菌,但有害菌比例或个别菌属丰度超标可能预示着肠道菌群的健康状况受到破坏。这些菌过多会影响肠道内环境,如pH值,含氧量以及肠道内毒素等,可能会导致出现一些机会感染和机会致病菌入侵,进而诱发炎症和疾病。
我们报告中的有害菌包含了致病菌和条件致病菌,以及属内主要菌种为致病菌的属。为便于统计,我们在计算的时候统一按照属层级进行计算比例。
报告中的有害菌包括了以下的菌属:韦荣氏球菌属、葡萄球菌科、变形菌属、弓形菌属、弯曲菌属、螺杆菌属、厌氧螺菌属以及弧菌属等。
在肠道菌群检测报告中会有对有益菌,有害菌的整体评估。
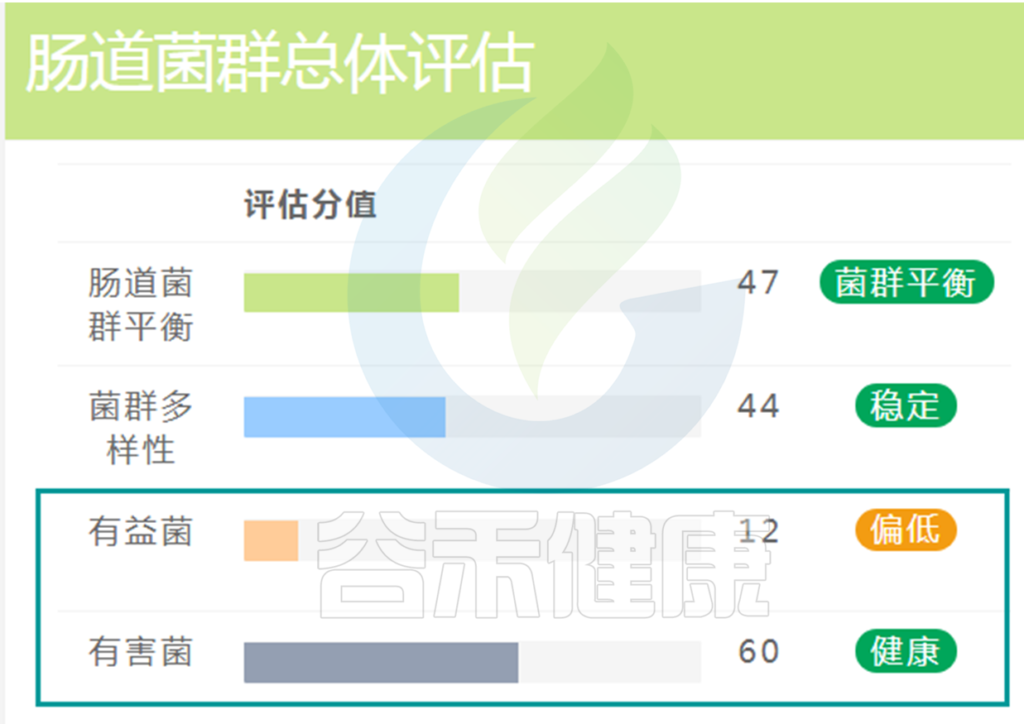
如果有害菌过多,通常建议服用益生菌或益生元的方式首先增加有益菌的比例,相应的有害菌比例就会降低。想要持久的改善菌群结构降低有害菌水平就需要改善生活方式,适当增加抗性淀粉等膳食纤维并规律饮食和睡眠,增加运动等。
整个生态系统平衡对于地球而言十分重要,同理,肠道菌群平衡对于我们人体健康也很重要。健康的肠道菌群丰富且多样性高。
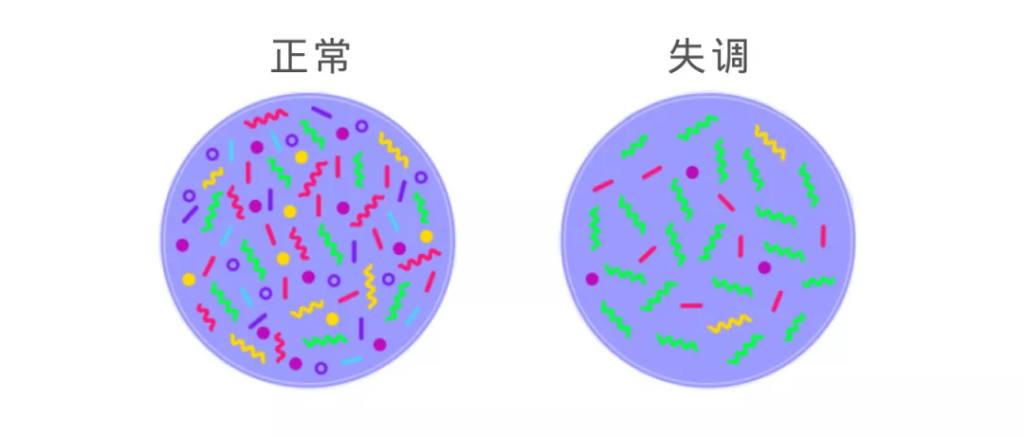
菌群失调是指体内微生物群不平衡,这可以表现为某些细菌的出现率较高,细菌的出现率较低,细菌的多样性不足,有害菌,有益菌比例失调等。
通常临床上采用大便常规检查,通过显微镜下观察统计染色细菌中杆菌和球菌以及革兰氏阴性和阳性菌的比值是否超标来判别的。
其中致病菌多为球菌和革兰氏阴性菌,而肠道有益菌多为杆菌和阳性菌,因而在传统临床上简单比较两者的比值评估是否菌群紊乱,是相对比较粗放的。
谷禾菌群检测报告中的菌群失调:
基于高通量测序可以精准的检测低至万分之一水平的菌,甚至可以分类到种水平,因此可以更加精细化评估菌群是否出现紊乱和异常。
基于谷禾超过30万人群的菌群数据库分析结果,我们将在90%的人群都有检出,且人群平均丰度1%以上的菌属做为核心菌属。这些核心菌属通过长期与人类共生,在帮助消化复杂碳水化合物和产生短链脂肪酸外还影响整个肠道环境,抑制病原微生物的定植生长。因此当这些核心菌属占总肠道菌群比例低于60%时,肠道菌群很可能处于紊乱状态。
【谷禾健康菌群数据库】
如果出现菌群严重失衡,例如致病菌占了相当大比例,那么首先应考虑针对致病菌使用相应的抗生素治疗,然后再通过益生菌补充及饮食、生活方式的改变进行调理,直到菌群恢复平衡。
多样性包含两个维度。
一个是肠道菌群种类,人群中肠道菌群的种类参考范围在100~2000种,种类数量越多多样性越高。
另一个维度是均匀性,即各个菌种的含量丰度较为均一没有出现单一菌种占据绝大部分的情况。
多样性的评估一般通过一个叫做香农-维纳多样性指数的指标来进行评估,计算公式为:
H=-∑(Pi)(log2Pi)
其中Pi为每个菌的占比例,值越大代表物种种类越多,均匀性也更好相应的多样性也越高。正常人群中香浓指数在2~9之间,一般大于3以上表明具有一定多样性。
换句话说,肠道菌群多样性表现在:微生态系统的稳定性,以及面对外界致病菌等入侵的抵御能力。
在一定范围内,更高的多样性通常代表饮食更加丰富多样,同时也意味着更健康的身体状况。
菌群多样性高可能与下列情况有关:
环境,农村儿童比城市儿童菌群多样性高;
饮食,低脂饮食与菌群多样性较高有关;
年龄,长寿老人的菌群多样性较高;
……
多样性低不代表一定有疾病,但是更容易受到饮食,环境或疾病的影响,包括更易发生水土不服或更容易因饮食不洁导致腹泻等。
多样性低可能与下列情况有关:
分娩方式,剖腹产宝宝菌群多样性较低;
饮食营养,营养不良的孩子菌群多样性会下降;
药物,抗生素的使用会大幅降低菌群多样性,并且需要一段时间才能恢复。其他药物也会降低菌群多样性,如治疗胃溃疡和反酸的质子泵类药物也会导致菌群多样性降低;
环境,医院的ICU病房、更衣室等消毒严格,可能导致环境菌群多样性下降。
此外,神经系统、代谢、免疫等慢性疾病也与多样性下降有关。
你可以通过在饮食中增加纤维素,从高脂饮食逐渐转为低脂饮食来提高菌群多样性,另外规律运动也可增加多样性。
另外,我们在实际检测中会发现有这样一种情况:
多样性指标虽然很高,但是整体看起来健康总分并不理想。甚至还有很多慢性疾病风险,这是为什么呢?
这种情况可能是核心菌群丰度不够,核心菌群在代谢、免疫等方面都发挥重要作用,一旦核心菌群丰度下降,则可能造成外源物质侵入。感染、旅行等可能会出现这种情况。
看过我们检测报告的可能会发现,报告里有包括肠道致病菌和病原菌,分别代表什么?

<篇幅关系,此处仅展示部分>
肠道致病菌列出了最主要和常见的感染类肠道致病菌。(注意这里重点是肠道)

病原菌中给出的包括几十种人体的致病菌,不仅仅是肠道的。<如果没有检出就没有列出>
病原菌和条件致病菌的区别是什么?
病原菌一般极少存在于健康人的肠道菌群,正常范围很小,条件致病菌一般会在正常人群的肠道内存在,丰度较高或菌群结构单一到一定程度会引发疾病。如大肠杆菌和肺炎克雷伯氏菌正常人群中都会有检出,但当丰度较高是就会导致肠道菌群紊乱或疾病。
报告中如果出现病原菌超标的情况,不一定直接认为有病,需要结合症状。
如果出现相应的腹泻等症状,需要考虑是不是因为这些病原菌导致的。单纯超标如果没有症状只是表面有病原菌摄入,注意一下饮食和生活卫生,无须过于担心。
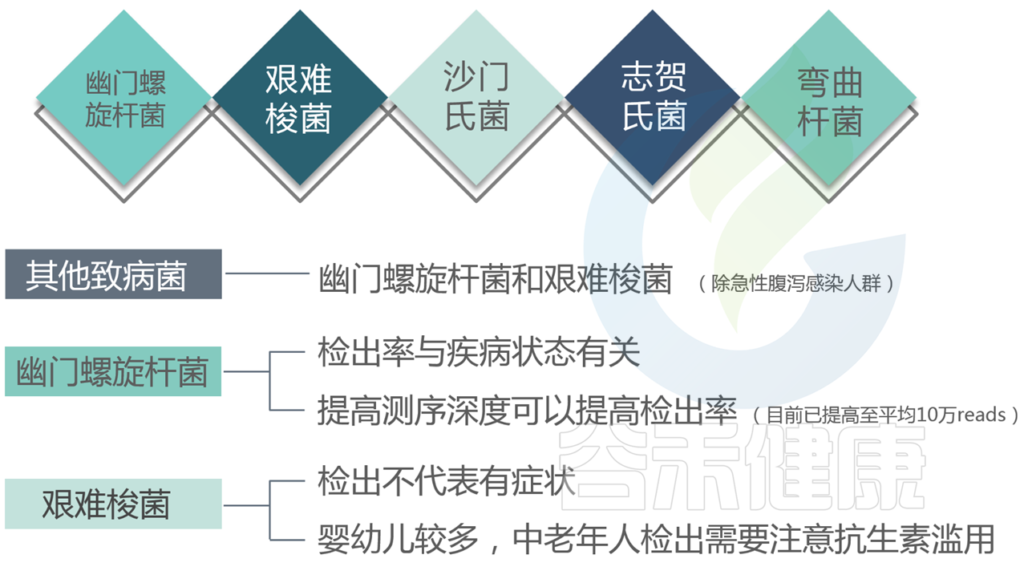
★ 幽门螺杆菌
为什么在医院检查出幽门螺杆菌感染,而报告中并未显示?
注意:本检测未检出并不代表完全不存在该致病菌感染,可能由于比例或其他因素未能达到检测丰度或未检出。
如果肠道菌群检测报告中检出幽门螺杆菌,是否需要去医院进行幽门螺杆菌呼气检测?
如果肠道菌群检测报告显示该项为超标,且同时存在胃部不适或其他胃酸、胃胀等症状,建议前往医院进行幽门螺旋杆菌检测,及早发现治疗。
★ 沙门氏菌
在食物中毒案例中,通常伴随着沙门氏菌,沙门氏菌粘附到肠上皮表面是发病机制中重要的第一步,并且是其在肠道定植的核心。
关于沙门氏菌的治疗及预防详见:食物中毒一文
扩展阅读:细菌大盘点(二) | 葡萄球菌、沙门氏菌、弯曲杆菌
通过以上部分,我们大概了解了菌群的构成及其扮演的角色,那么我们能利用检测到的这些菌的信息,给我们的健康带来什么帮助呢?
很重要的几个点:
第一,也就是前面所述的,菌群的构成本身就可以反映你的肠道内的环境是不是健康菌群,如果紊乱,它会带来很多的问题,比如说儿童菌群紊乱,可能会营养不良,因为菌群紊乱本身会影响营养吸收。
第二,对病原物的抵抗,也就是说身体是不是比较容易出一些状况,比如说腹泻,感染等问题。
第三,它还会诱发一些长期的慢性疾病,比如说糖尿病,实际上当然饮食是一个问题,但是有一些炎症相关的菌群,会诱发慢性的持续的炎症,从而导致慢性疾病的发展。
这就是我们接来下要讲的,疾病风险这块内容。
目前我们疾病风险检测部分包括16类主要疾病,根据疾病检测准确度和稳定性,我们将检测疾病的水平分为三个等级:低风险、中风险和高风险。
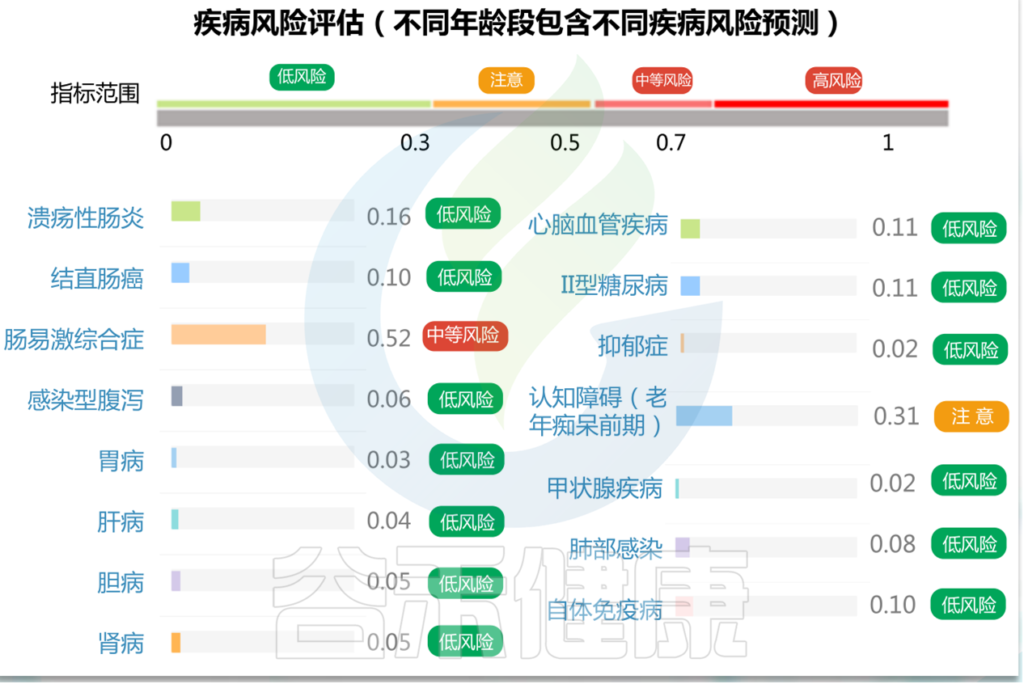
根据每种病的分值,0~0.3归为低风险,0.3~0.5评估为注意,0.5~0.7为中等风险,超过0.7为高风险。
目前报告中提供的疾病均经过大量病例样本检验并且准确率超过90%,虽然不作为疾病的诊断依据,但是其分值的高低仍然具有很强的指示作用。
0-0.3
如果某种疾病的风险值低于0.3以下表明菌群状态提示疾病风险较低,不同身体条件和生活方式下会有0.05的波动。
0.3-0.5
如果某种疾病的风险值位于0.3~0.5之间我们认为属于疾病前期阶段,通过饮食调理和相应的注意就可以降低风险。
0.5-0.7
如果某种疾病的风险值位于0.5~0.7之间表明可能患有该疾病或处于疾病风险阶段,这时候我们建议最好前往医院相关科室进行检查,如果不便前往医院也可根据建议先进行饮食调理和相应的注意,一般一个月后再进行一次检测查看疾病风险是否下降到正常范围,如果仍然较高甚至升高建议最好前往医院复查。
0.7- 1
如果某种疾病的风险值超过0.7表明有很大可能已患有该疾病,且分值越高表明风险越高。因此我们强烈建议去医院进行相应检查并听从医生建议。
注意:本检测目前尚不属于医疗诊断,疾病分值作为提示,低分值不代表完全没有疾病,只表示风险较低,也可能存在一定的未检出。高分值只表示存在很大疾病风险,疾病的确诊和精确诊断需要通过进一步的医疗检查确认。
说到这里,可能有人对以上这个0.3,0.5…这些风险值有所不解,风险值是你们自己确定的吗?如何计算得出这个值的呢?有参考依据吗?
这里我们来了解一下风险值的计算。
通过模型的构建和大规模人群队列的测试和学习,现在大概已经有几十种病,我们可以比较好的通过菌的构成,来预测到底有没有这个疾病。虽然现在它还做不到直接确诊,但它可以起到一个很好的提示作用,以及对病程进展的评估。
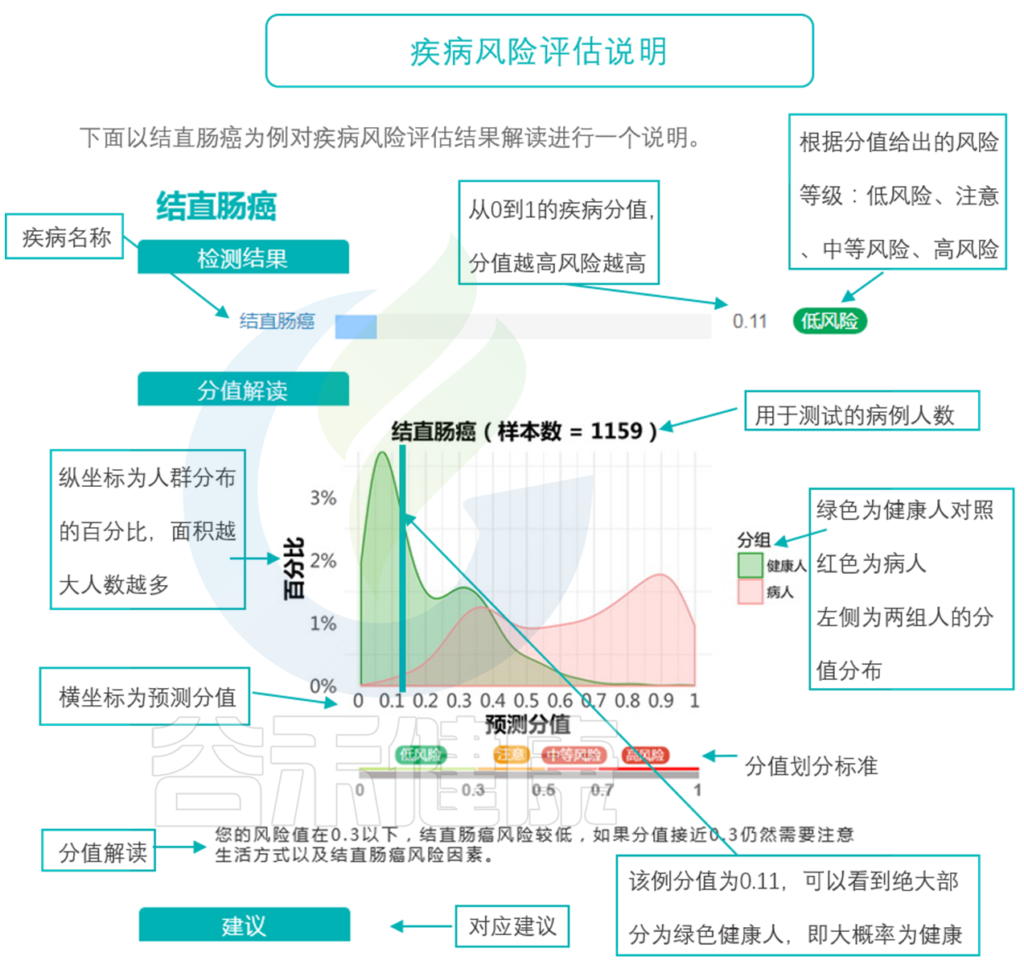
那么,具体哪些方面的疾病跟菌群有重要的关系,并且能够用菌群来预测和评估呢?
消化系统疾病
首先当然是消化道疾病,这很好理解,因为菌群本身就在消化道环境内。像肠炎,就包括克罗恩病,溃疡性结肠炎之类的,还有消化性的腹痛、腹胀这些问题,可能是由于菌群的特征变化造成。
炎症性肠病中的菌群失调
详见:炎症性肠病一文
还有过敏性腹泻,有人可能对一些食物过敏,吃完之后会导致一些腹泻,菌群特征变化很明显,包括甚至一些肠道病毒的感染,比如说诺如病毒、轮状病毒的感染。它也会体现出非常特定的菌群变化特征。
在肠道菌群检测报告中,这类疾病风险呈现如下:
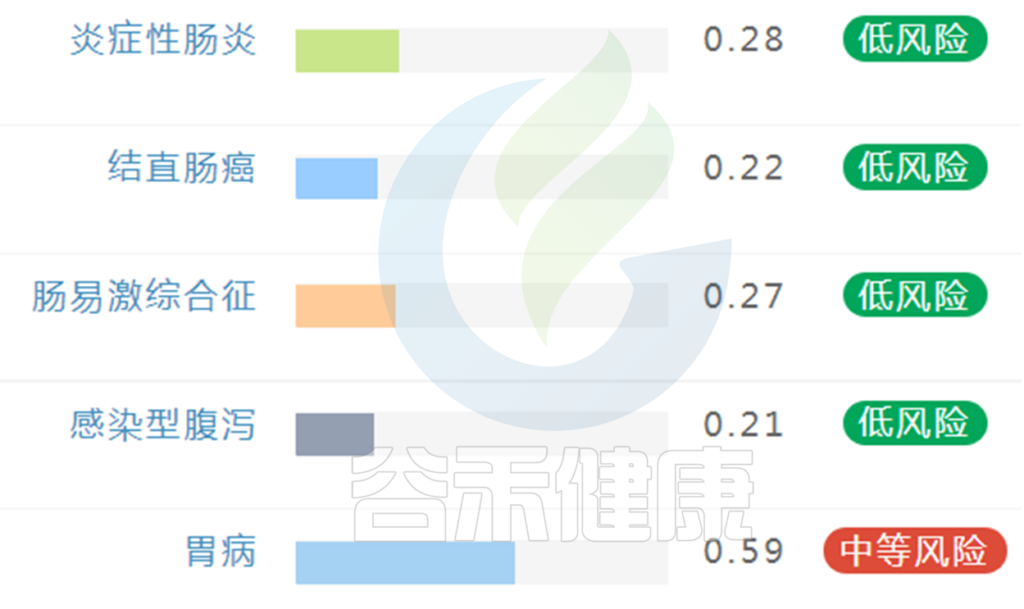
上图样本可以看到胃病有中等发现,其备注信息里有填:胃痛,可能要开始注意这方面的疾病隐患,通过饮食等调理一段时间,或前往医院就诊。
★ 胃癌
胃部更严重一点的疾病就是胃癌,胃癌与肠道菌群之间也有很大关系,最近,在“谷禾开放基金项目”中,也有相关论文也已发表。
肠道菌群在区分胃癌患者和健康人方面具有高度的敏感性和特异性,表明肠道微生物群是胃癌诊断的潜在无创工具。
胃炎与胃癌具有某些微生物群特征,化疗降低了胃癌患者的微生物丰度和多样性。乳酸杆菌Lactobacillus和巨球菌Megasphaera,是胃癌的预测标志物。
★ 结直肠癌
现在已经有多项研究表明,通过菌群可以做一个很好的标志物。虽然做不到所有的结直肠癌患者都能够被检出,但是最终的准确率相对来说还是挺高的,甚至比一些,包括肿瘤标注可能还要更高一些。
我们现在大概能做到70%多的肿瘤患者是能被筛查出来。并且准确度其实能够到90%,作为普筛或者健康评估来说,已经是一个比较有效的标志物了。
化疗与手术会大幅降低风险分值,但仍比健康人高。
此外,结直肠癌会经历从息肉到腺瘤到癌症多个阶段,应结合年龄和家族史判断息肉和结直肠癌。
肝胆类疾病
肝脏类疾病,比如说非酒精性脂肪肝跟肠道菌群有相当大的关系。
不同肝病有不同的菌群特征,尤其是脂肪肝的严重程度,肝功能异常的严重程度。
扩展阅读:深度解析 | 肠道菌群与慢性肝病,肝癌
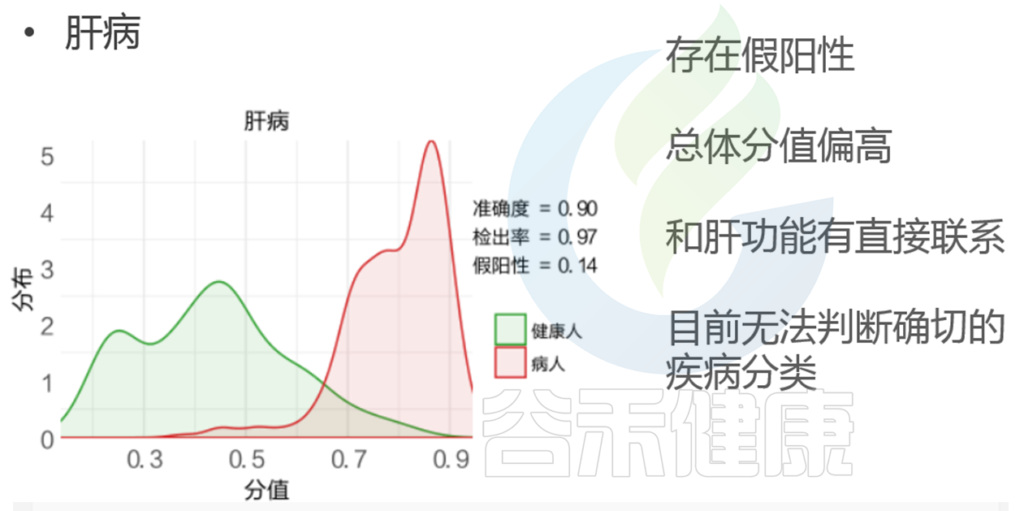
因为菌群会产生大量的刺激代谢物,这些代谢物本身可能会加重肝脏的负担,并且诱发一些肝脏的疾病,但反过来肝脏的代谢能力的减弱和一些慢性肝脏疾病进展又会反映在菌群的构成上,所以它们是相互的。当然也可以用菌群的构成来反映具体肝病的特征。

由于不同阶段肝功能异常,脂肪肝等情况都统一归类在肝病这个大类,因此目前还无法判断确切的疾病分类,后续如果有更多细分疾病的样本用于建模,报告也会随之迭代更新。
代谢类疾病
代谢类疾病,比如糖尿病,肥胖等,都与肠道菌群有密切关联。
★ 2型糖尿病
2型糖尿病的发病率越来越高,也有更多人开始关注菌群与2型糖尿病的关系。很多文献都有报道它们之间的关联性。
2型糖尿病人群中个体微生物群的差异
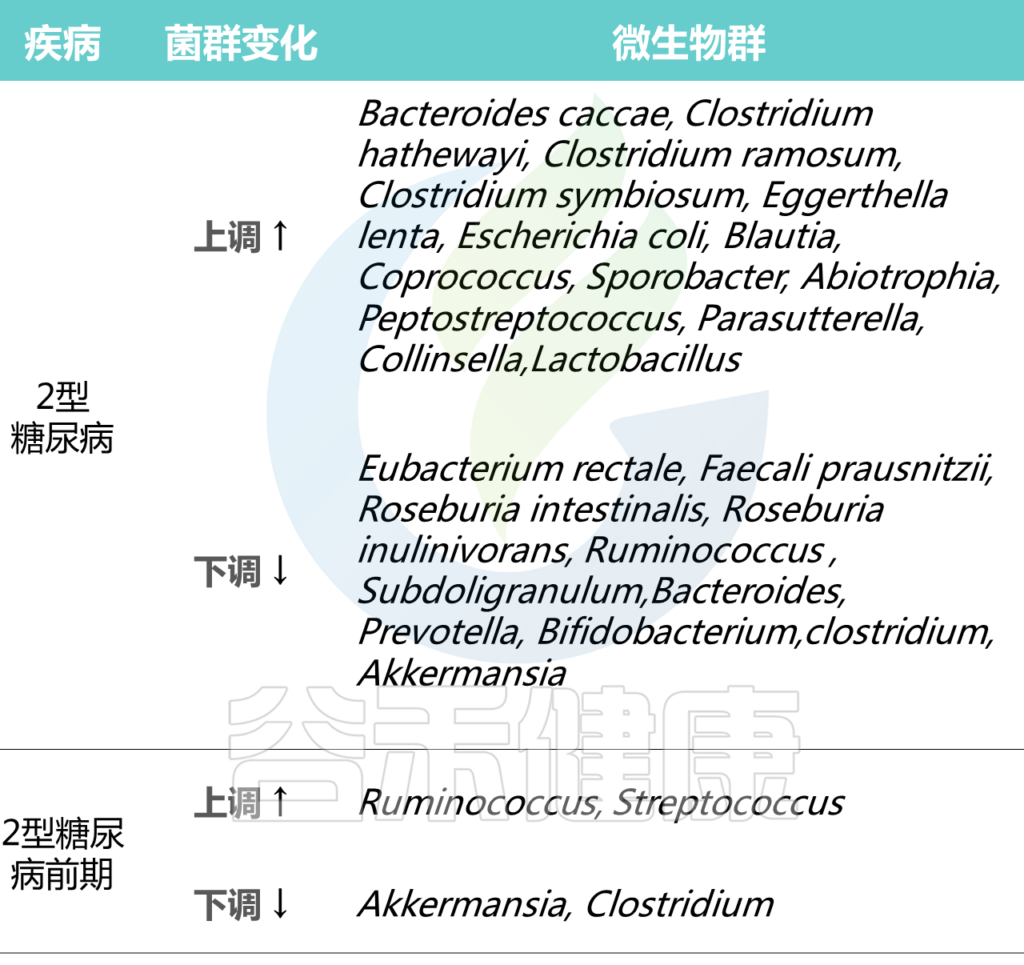
Cunningham A L et al., Gut Pathog, 2021
在2型糖尿病患者普遍具有相对高丰度的特定属:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
2型糖尿病患者中,产生丁酸菌特别缺乏,特别是梭菌目,包括:
Ruminococcus、Subdoligranulum,Eubacterium rectale、Faecali prausnitzii、Roseburia intestinalis 、
Roseburia inulinivorans
通过肠道菌群检测,一方面健康人群可以查看是否有患病风险,另一方面如果已经患病人群,也可以查看菌群是否异常,推测是否是因菌群显著变化导致的,从而能进行更有针对性的干预。
肠道菌群检测报告中疾病风险预测如下:
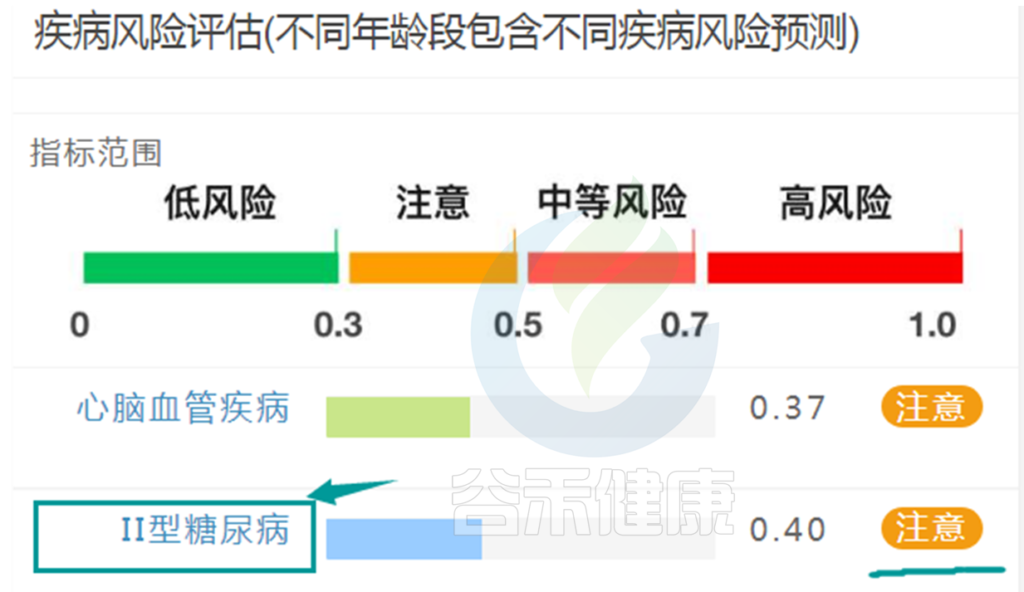
2型糖尿病的检出率相对较高,可以达到95%以上,准确的也较高,可以预测早期糖尿病风险。
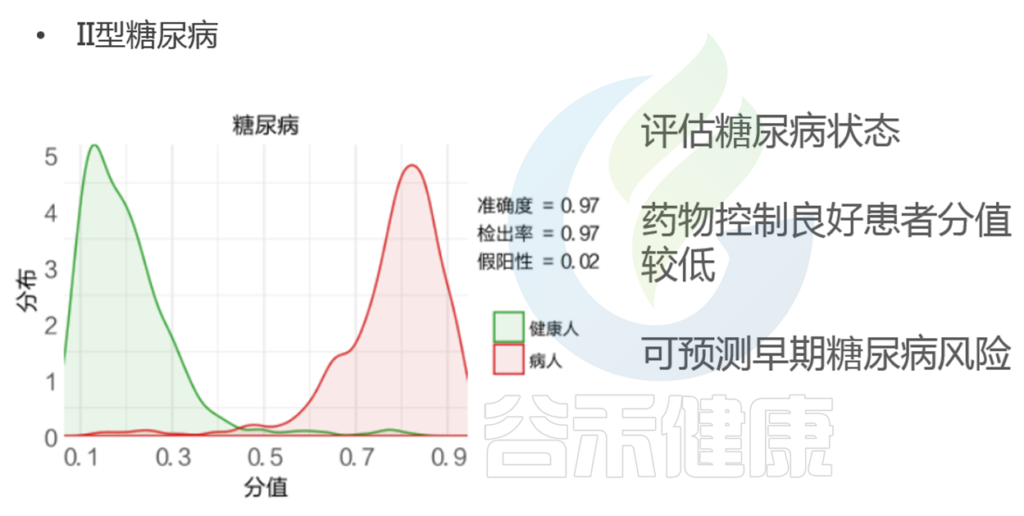
★ 肥胖
目前已有很多关于肠道菌群和肥胖之间关系的研究。
人体摄入大量营养素、肠道菌群与肥胖的关系
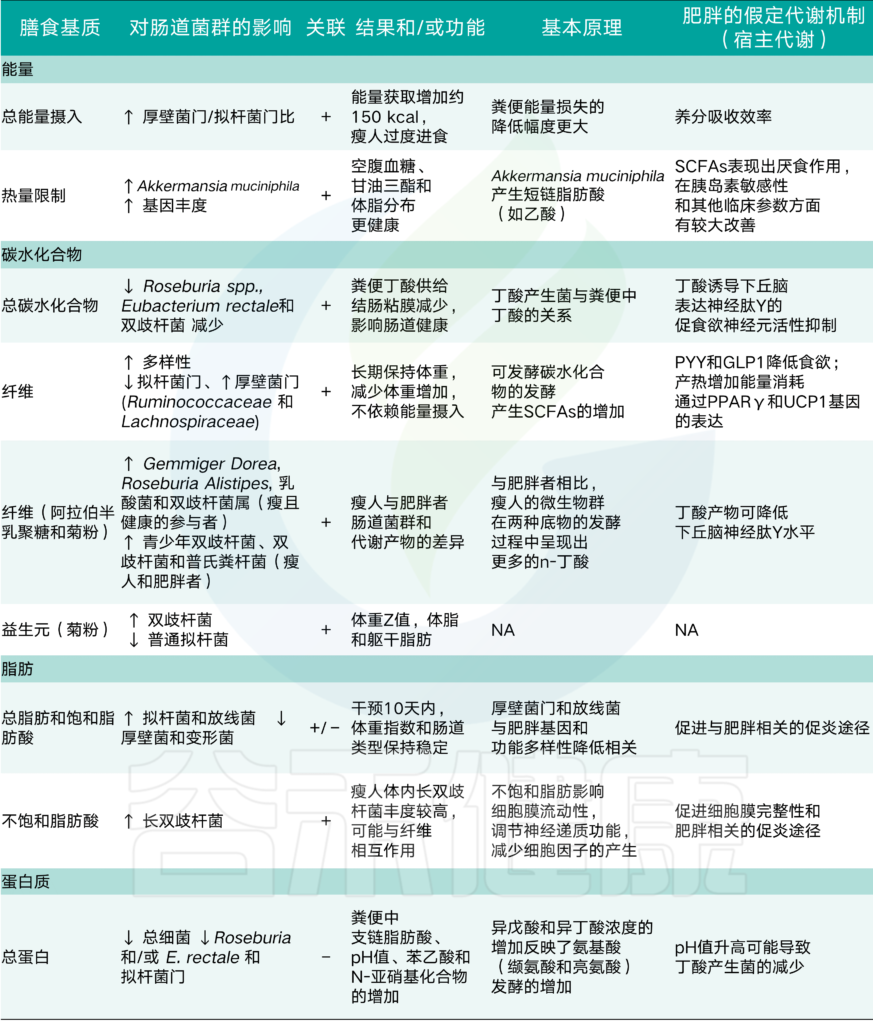
↑, 增加;↓,减少;NA,不可用;第三列:营养物质和/或饮食基质与肠道微生物群之间的关系
有人说,为什么我们的肠道菌群报告没有判别测试者是否肥胖?
首先,肥胖不肥胖这个症状是肉眼可见的,也就是说测试者自身已经了解,这种情况下用模型来判别没有意义。
而我们更希望通过肠道菌群检测来可以告诉你,可能是什么因素造成的肥胖,饮食结构的,还是某些菌属代谢问题。
通过菌群知道营养构成,以及是否存在一些特定代谢菌的异常,比如说Akk菌,它是一种在一定程度上帮助减肥的菌群。
如果在你的肠道内该菌特别少,那么可能同样减肥,控制饮食,别人一个月假设瘦十斤,你就不一定能达到这个效果。这些都是菌群可以提供的一些信息。
在肠道菌群检测报告中,会列出肥胖正负相关菌群,及其是否超标。
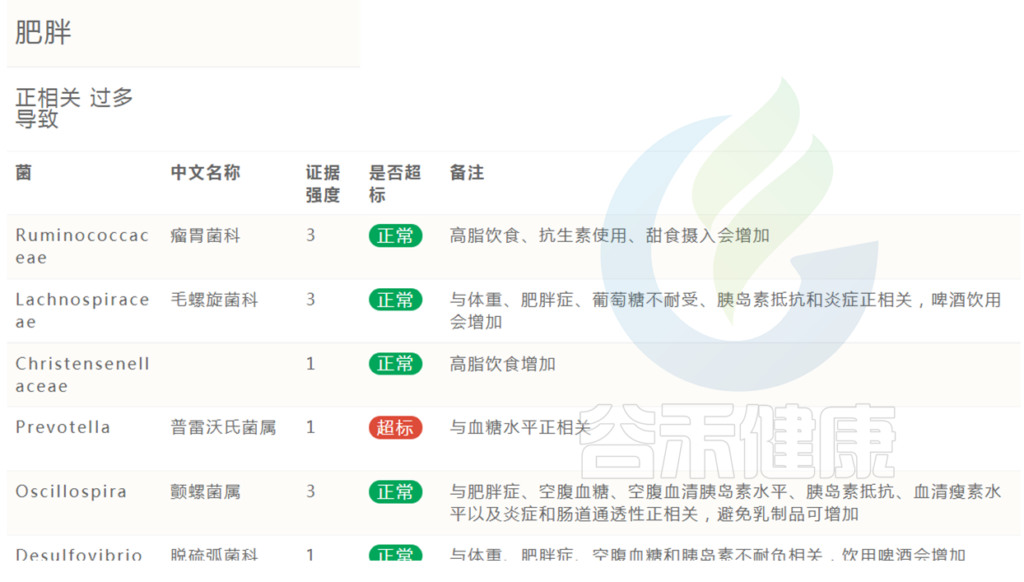
同理,其他各类肉眼可见的症状(包括腹泻、便秘、腹胀、过敏、皮肤状况等)正负相关菌群都会在报告中呈现,此处就不一一列举。
神经系统疾病
听起来神经系统好像没什么关系,但实际上很多肠道菌群能代谢产生大量神经递质及其他代谢产物。
肠道菌群会影响HPA轴的发育,该轴调节压力反应并参与皮质醇的释放。在抑郁和长期处于压力下的人中,HPA轴可能失调,导致过量的皮质醇(一种压力激素)被循环。
肠道菌群的部分代谢物质也会通过免疫系统影响神经系统。促炎性细胞因子的失衡可导致慢性炎症和自身免疫性疾病,通常与抑郁症同时发生。
通过肠道菌群检测,可以了解体内血清素水平及激素水平,同时也可以了解神经系统相关疾病风险,包括自闭症,抑郁症,阿尔兹海默症等。

肺部疾病
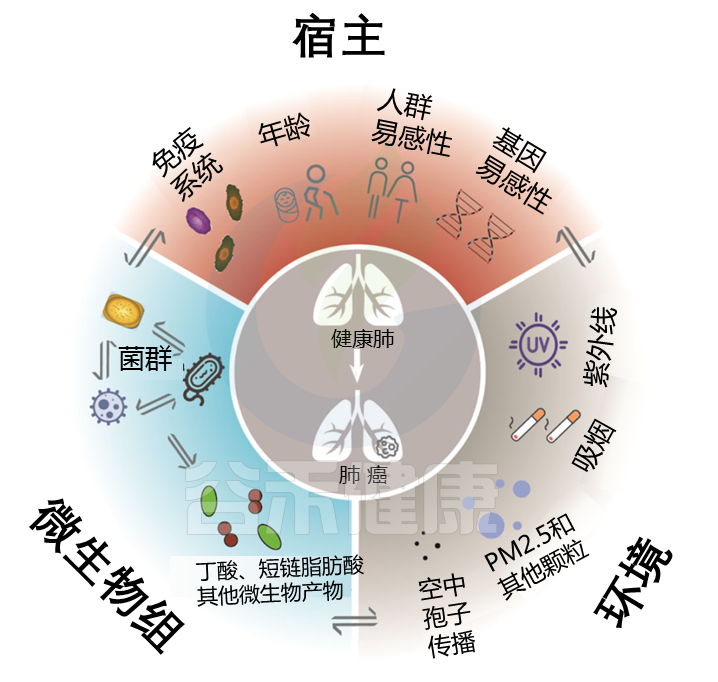
宿主,微生物组和环境之间的三重相互作用在健康功能中维持了肺稳态。
Liu NN, et al., NPJ Precis Oncol. 2020
在大量的临床样本数据当中可以发现,肺部感染,包括社区性肺炎,慢性阻塞性肺疾病,通过血氧浓度和全身的免疫反应,一定程度上是可以反映在肠道菌群上。
另外像肺部的感染,比如说在肺炎链球菌之类的感染中,肺部的病原菌可以通过痰或者是呼吸进入到肠道,所以我们在肠道当中是能检测到这些肺部的感染菌,并且随着其严重程度和感染进程,菌群的丰度会越来越高。
肠道菌群检测报告中也有对肺部相关疾病风险提示。

免疫疾病
肺部感染会出现咳嗽等症状,但咳嗽不一定仅是肺部感染,也可能是哮喘。
★ 哮喘
在哮喘中,微生物群是导致肺和肠道之间相互作用的重要因素。肠道微生物可以影响肺部的免疫反应,而肺部刺激可以导致肠道反应。
在一项研究中,来自加拿大的三个月大婴儿哮喘高风险的粪便样本中观察到 Lachnospira, Veillonella, Faecalibacterium, Rothia显著下降。这种菌群特征在1岁时不再明显,同时伴随着粪便乙酸的减少和肝肠代谢物失调。
肠道微生物对哮喘的影响部分是由细菌代谢物介导的,1岁时粪便中含有大量丁酸和丙酸的儿童,其特应性敏感性明显降低,3至6岁之间哮喘的可能性较小。此外,哮喘患者的粪便中Akkermansia muciniphila 菌水平均有所降低。
★ 过敏
已知的婴儿期与过敏性疾病相关的微生物群改变如下:
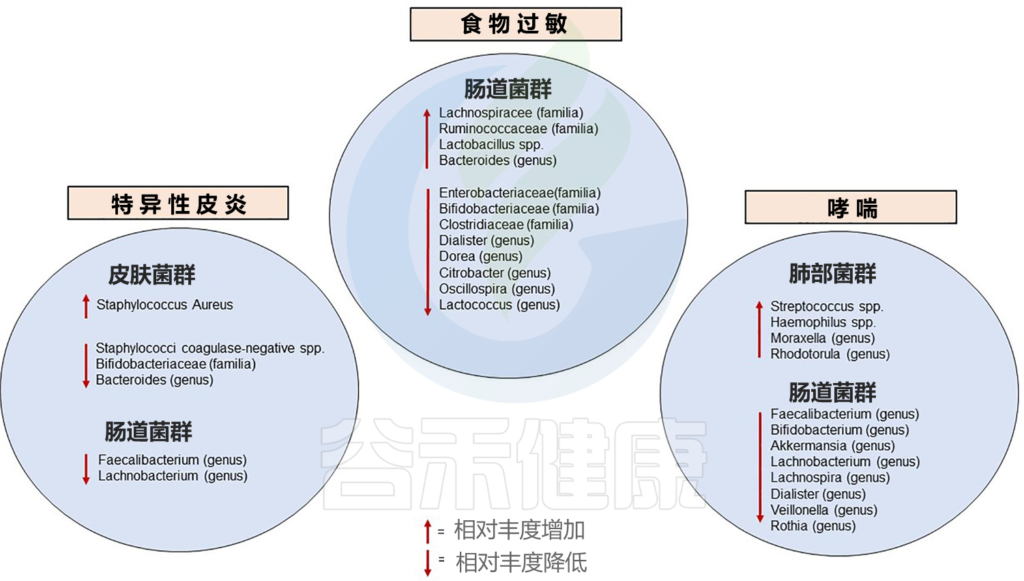
Diego G. Peroni et al, Front.Immunol. 2020
肠道菌群检测报告中有列出与过敏正负相关菌群,及是否超标。
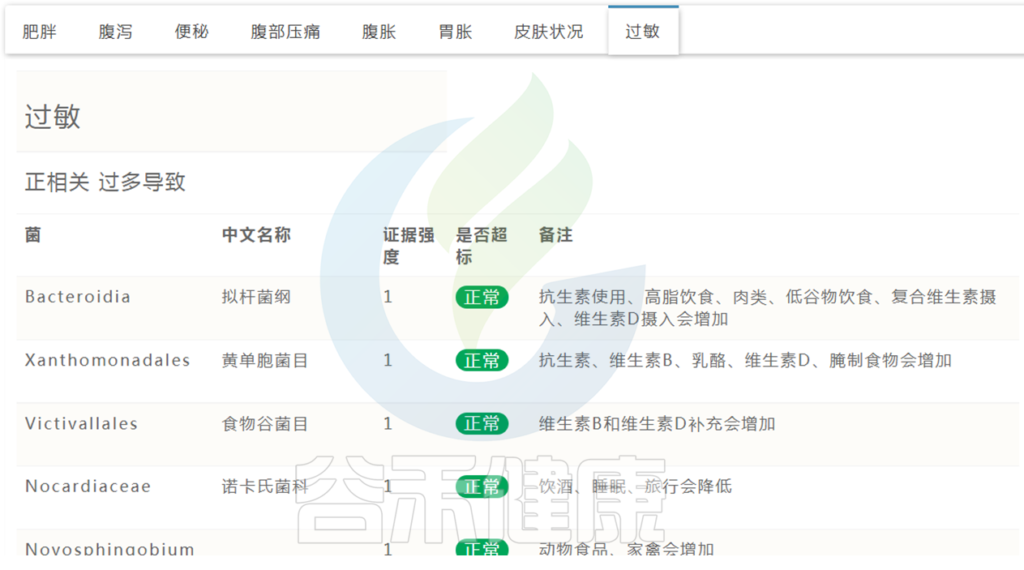
< 篇幅关系,此处仅展示部分 >
菌群生长需要养分,它的食物来源取决于你的肠道,有句话叫:you are what you eat (在我们这篇文章中有详细解释它们之间的关系 深度解读 | 饮食、肠道菌群与健康)。
也就是说,你吃的食物会帮助构建你的专属菌群。有的菌擅长代谢碳水化合物,有些菌擅长代谢脂肪,所以饮食结构不同,也就是食物来源比例不同,最后会塑造不同的菌。
那反过来,如果知道你的菌群的构成,就可以相对数量化的去了解你的饮食构成,包括营养摄入具体是什么样子,所以菌群很大的另外一个作用就可以反映你的营养饮食摄入状况。
这部分内容在我们报告中的呈现如下:
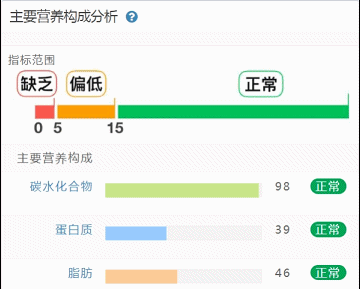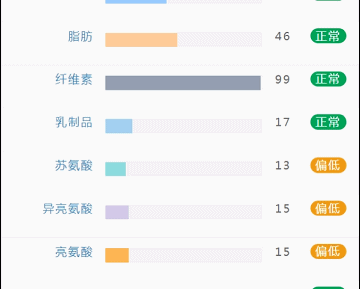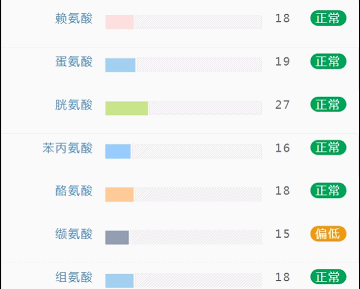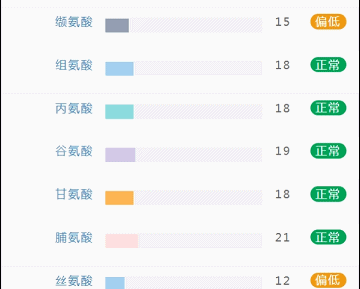
那么这里可能又会有疑惑,以上这些数值是什么意思,如何计算的呢?
不同的细菌有不同的代谢能力,需要不同的营养物质进行繁殖。通过评估特定营养供给下的偏好菌群的比例,即可反映不同营养物质的摄入比例。所以报告中的主要营养代谢分值评估的是主要营养物质摄入的比例在人群中的分布水平。
因此不会出现所有主要营养物质均高或均低的情况,也因此主要营养指标的最佳分值在70,且更关注不同营养物质的均衡性。
单项营养物质的分值低于5,表明摄入比例在人群中属于最低的5%,评估为缺乏,低于15评估为偏低。
而如果某项指标达到或超过95,则表明该项可能摄入比例偏高,通常对应会有其他营养成分较低。只需要针对性的增加缺乏或偏低的营养成分摄入,维持不同营养成分相对一致即达到营养均衡的目标。
为什么会出现所有的营养指标都很低?
这可能是菌群失调引起的。营养指标的评估是基于菌群构成特征和菌群代谢生成特定营养素的途径来评估的,如果菌群结构异常,将导致后续的预测失常,例如大量氨基酸都评估缺乏的情况。
这时候需要先调节菌群,等菌群指标恢复到一定水平后再次检测,评估营养指标。
我们日常摄入的除了上一小节提到的宏量营养素之外,还包括微量元素和维生素等。有些维生素比如说B族维生素中有相当一部分,甚至百分之六七十需要通过肠道菌群对初始原料进行代谢之后才会产生,也就是说有些细菌会代谢我们食物中的一些成分,转换成B族维生素。
而你的菌群构成和代谢B族维生素的能力,会直接决定是否缺乏该类维生素。当然也有部分受基因影响,因此肠道菌群相应的基因和代谢途径的丰度水平也会直接反映这些维生素的摄入水平。
总的来说,菌群在这其中起重要作用。在我们报告中呈现如下:

微量营养元素和维生素的评估分值与主要营养物质不同,是通过调查人群的单项营养成分水平,然后寻找与该项成分异常相关的菌群,并基于这些菌群和代谢途径计算丰度并转换为人群分布后的值。
简单来说,报告中的微量营养元素的分值即代表该营养元素的摄入水平。
菌群检测营养状况与血液检测有什么区别吗?
通过肠道菌群评估的维生素一般反映一段周期内的维生素状况,因为肠道菌群在没有突发疾病的情况下相对稳定,受一段周期的饮食影响为主,一般是2周。B族维生素是水溶性维生素,每日摄入后会通过尿液代谢排出,通过血液检测,不同时间检测波动较大。
菌群评估营养和血液检测营养趋势是一样的,在极端缺乏和极端过量是吻合的,中间档可能在数值上不是完全吻合,血液反映的营养水平比较及时。
★
当了解了体内的营养素和维生素是否缺乏,以及哪方面的缺乏,就可以进行有针对性地补充。菌群也是需要营养物质的,这就离不开我们的日常饮食,那么该如何补充呢?
我们的肠道菌群检测报告中有个体化饮食推荐表。

<篇幅关系,此处仅展示部分>
以上食物推荐表是怎么来的?
这是经过综合考虑疾病风险和营养缺乏状况计算得到的。主要是计算每种食物的营养构成与目前营养状况的匹配度,以及特定疾病需要避免的食物。
该表推荐的食物分数从-100~100,排序为不推荐到强烈推荐,日常饮食可以参考这个推荐表。推荐分值,表示基于目前的菌群和营养状况对食物的推荐指数,正数分值越大,建议优先选择,同时也是对改善最有帮助;负数分值越大,并不表示不能吃,而是目前状况下不优先推荐或尽量少吃。
p.s. 如果有特殊疾病需要忌口的,优先遵医嘱。
该表包括几百种日常食物,如下图。

<个体化饮食推荐,建议用电脑查看,目前手机端展示不太美观>
对于长期调理菌群而言,饮食无疑是最主要的驱动因素之一。
下一步我们将利用更全和详细的菌群结构,食物营养,人群膳食构成以及营养数据库推出个性化膳食营养升级方案,特别会针对个别菌属的异常和失衡状况以及营养元素异常和缺乏问题。
前面章节我们知道,通过菌群可以反映你的饮食状况,那么反过来,如果你吃了一个东西,会对菌群检测造成影响吗?是不是菌群就变了,那检测就不准了?
这也是比较重要的一部分,也就是肠道菌群检测的准确性,它能允许多大范围内的变化?什么因素会影响?
其实,菌群变化算快,也不算快。饮食对菌群是有一定影响没错,但这种影响呢,一般来说是前一天的饮食会影响第二天的菌群结构的百分之十几,也就是说,假设你昨天吃大餐,大量吃肉,蛋白摄入非常高,而你之前是以碳水化合物为主的,那么第二天饮食当中,你的蛋白质相关的这部分菌的比例可能会有15%,最高到20%可能会有,但一般来说是在15%以内,会有一个波动。
然而,总体的核心菌群构成,不会因为你今天一顿大餐,就直接从素食的变成肉食的菌群结构,核心菌是相对稳定的,那么多久会发生变化呢?
一般来说坚持两周,饮食结构的变化,核心菌群就会发生一个迁移改变。但两周只是一个短暂的周期,如果你两周后又换回先前的那种饮食方式,菌群也会随之改变到之前的状态。那要怎么样才能持久改变菌群呢?
这个时间线可能要拉长到两个月。
这是在我们的菌群干预中,很多人会遇到的一个周期性的问题。也就是如果你想有效改善菌群,至少需要两周会见到相对明显的菌群结构变化,那如果把干预延伸到持续两个月的周期,甚至是持续干预周期更长,那效果会更好。
取样前饮食会不会造成影响?
前面我们知道,菌群会受检测前一天饮食的影响,造成15~30%的菌群改变,同样也会反映在营养状况的评估上,因此建议检测前一天尽量保持近期正常饮食,这样能更好的反映真实的营养饮食状态。
此外,如果你是在调理一段时间后再次检测,想要和上次比较的话,最好在检测前保持饮食大体相似(意思是不要突然吃和平时不一样的食物或者吃完大餐后取样)。
取样过少会怎么样?
取样不能太少,如果太少的话,可能会影响DNA提取,另外会导致一些低丰度的菌检测不到。
取样过多会怎么样?
如果说取样太少导致样本不合格可以理解,那么取样过多为什么也会有问题呢?
我们的采样管中有保存液,可以将菌群固定在采样的瞬间,但是如果取样过多的话,可能导致部分粪便无法完全溶解于粪便,这部分样不能正常保存可能会使其中的大肠杆菌等兼性厌氧菌开始在管内繁殖。
正确合格取样量(黄豆大小,约200mg,如果是稀便,反复沾取)

只需棉签沾取少量,混匀于保存液,固体粪便取样不能超过管子1/5体积(右图刻度线)。且保存液带有粪便颜色即可。(右图所示)

详见:肠道菌群取样方法
注 意 事 项
如3天内使用过抗生素类、质子泵类胃药、阿片类精神药物请停药3天后进行检测(如果长期服用某种药物,如降压、降血糖药等,不建议停药,检测反映的是用药控制的菌群和身体状况)。
感冒、腹泻或其他症状期间不影响取样,拉稀或稀便可以用棉签反复沾取粪便至取样管。
★
总的来说,取样虽然很重要,但也只是其中一个环节。每一个样本的结果呈现都凝聚了我们与你共同的努力。那么,从取样到结果报告呈现的那一刻,中间经历了什么?
在你取完样之后,把样本用快递寄到我们这里之后,它会经历提取->测序->分析->报告到你手上。下图绿色标注部分是你需要完成的。
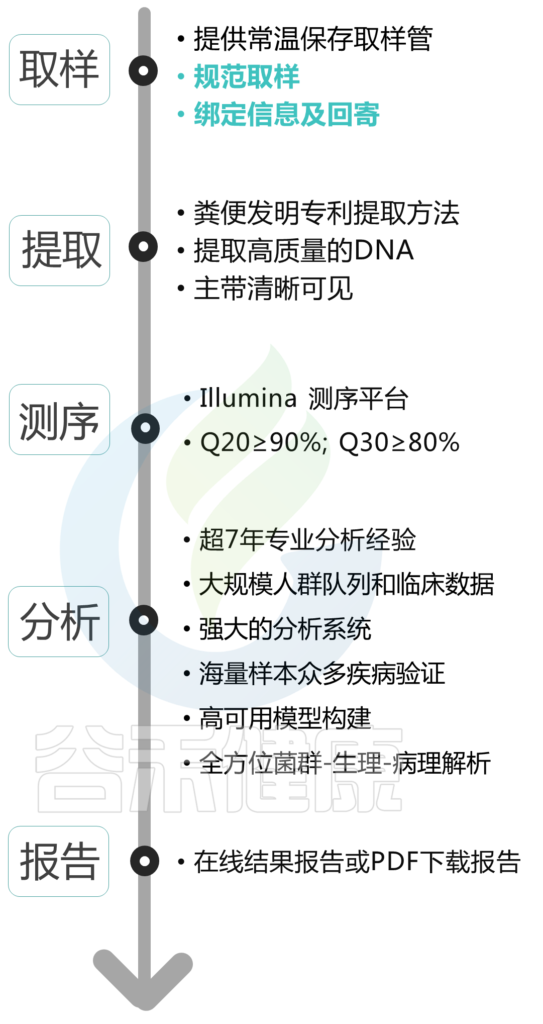

近年来,我国将全面健康和预防作为国家重点领域。我们致力于将信息技术(IT)与生物技术(BT)相融合,发展推动肠道菌群基因检测进入成为精准和预防医学时代下的“生命健康新基建”,尽管目前的菌群检测,包括疾病关系,算法,数据库,后端干预均在成长积累阶段,但是菌群检测正在进入大数据时代,菌群基因中蕴藏海量对人体生命和健康的重要数据,我们致力于将这些数据和实际应用相结合,最终转化为疾病预防、改善健康的有效方案。
前沿技术正在不断创新发展,报告也在迭代更新中,谷禾肠道菌群健康检测在辅助判别慢病风险、精准营养、亚健康管理、临床治疗干预中显示出其广泛的社会需求和指导价值。
你问我答
不同部位间的样本(如前段/中段/后段),检测结果差异性有多大?
答:会有不同的,不过主要反映在具体的菌种丰度上,有无这种菌的差异不大。另外慢病的评估也影响不大慢病模型中使用了高维特征,丰度的变化波动对结果的影响没那么大。营养和代谢部分受菌群丰度影响相对大一些,同一个人的前后两天的取样最大可能有15%左右的差异。
肠道菌群在肠道内不同部位以及粪便的不同部分其实都存在差异,含水量、连续几餐的饮食构成和排便周期的长度都会对菌群各个菌种的丰度造成影响。单纯从绝对丰度上来看是一个动态变化的过程,各个菌属在继承之前的构成比例的情况下因各种因素的变化增长或降低。因此并不存在一个绝对的菌群构成以及完全准确的单一指标。肠道菌群检测获取的丰度含量本身信息量很大,但是稳定性和一致性并不很高。
更高层级的菌群相对比例顺序则相对稳定一些,之后具体包含的菌种也相对稳定。目前我们使用的疾病预测模型主要通过高维的菌群结构特征,并不单纯依靠每个菌的绝对丰度来评估,稳定性很高。针对一些特定的病原菌或问题菌,需要通过与人群范围比较,在正常范围内并无问题。
日常多添加有益菌或益生菌的酸奶,可以改善肠道菌群状况吗?
答: 大范围人群调查显示添加益生菌的酸奶可以改善肠道健康,但效应因人和状态而定。总体而言我们支持服用益生菌酸奶有益,但需要注意酸奶饮料可能包含果糖,游离糖等,其作用仍然非常有限。
同一份样本,不同批次的实验环节如上机测序,差异有多大?这种差异率是否有一个范围呢?
答:不同批次上机影响很小,菌群数据相关性不低于98%。我们会在每轮设置一个阳性对照,一个上轮检测样本对照,一个阴性对照。评估污染,轮次比对。理论上不同的实验室,扩增引物,方法都会带来对不同菌丰度的系统误差,我们尽力保证本实验体系下各个轮次之间最小化的实验误差。另外使用的引物是经过大量验证的标准化引物。
实际患者建不建议送检,我们这个产品主要针对健康体检,还是也可以辅助诊断和预后治疗呢?
答:产品主要针对健康体检,如果临床诊断判断可能菌群异常或疾病症状与菌群相关,产品可以通过菌群检测提供临床参考,用于辅助诊断和治疗方案的评估。产品关于疾病和菌群相关指标的评估仅限于菌群相关方面,以临床诊断为准,不适用于单独使用产品进行疾病诊断。
抗生素是如何影响菌群的,菌群的敏感性和抗性基因是什么?
答:广谱抗生素会杀死细菌,但是部分细菌在抗生素选择或滥用的情况下会在抗生素靶点基因产生突变或携带耐药基因,从而对特定抗生素产生耐药。不同菌目前的耐药菌比例以及携带的耐药基因水平不同,对应的抗生素耐药水平和种类也有不同。
有在吃富含某种事物或者相关营养素,为什么报告显示缺乏?
答:营养指标的评估是基于菌群构成特征和菌群代谢生成特定营养素的途径来评估的,直接的营养素补充会反映在相关菌群构成上,但部分营养素因为吸收部位不同以及菌群代谢途径上下游的影响,预测可能有一定差异。另外菌群构成异常的情况也会导致营养指标预测失常,如大量氨基酸都评估缺乏的情况。
有人说长期服用益生菌,会让肠道自己产生的益生菌的能力减弱或者可以说是肠道自主平衡的能力减弱,不能长期服用。这种说法是否有依据?长期服用一种益生菌,也容易产生耐药性,那么是否建议定期更换或者调整益生菌的菌种和数量呢?
答:持续服用单一或特定组合的益生菌确实会存在效力减退的情况,主要是菌群具有适应性,如果不配合生活方式和饮食结构的改变,会较快失效。可以根据菌群检测结果来调整益生菌的方案。
样品的稳定性对于那些数据的影响是比较大的哪些是影响比较小的?
答:越是直接和具体菌相关的指标变化越快越大,和菌群结构相关的指标,比如一些慢病风险还有总体饮食结构一类的变化较稳定。
从波动性排序来看,具体菌丰度>多样性>微量营养(锌 铁 氨基酸 维生素)>消化道疾病风险评估 (受当前状态影响较大)>肠龄>宏量营养素(碳水 蛋白 脂肪 纤维素 乳制品)>抗生素水平 >菌属是否出现>其他慢病风险
中大龄儿童小孩检测到自闭症风险高,如何解读?
答:肠道菌群在1-3岁期间主要是菌群发育滞后会影响神经发育和营养,3~6岁左右菌群参与的神经递质代谢异常会加剧自闭症的程度,但这个年龄段已有的神经发育滞后不光靠菌群改善就能解决了。
所以如果是0~2岁的如果这个风险值较高,不管有没有症状都建议改善菌群。如果是3~6岁甚至6岁以上,如果就风险值高没有相应的神经或行为异常,就问题不大,可能是菌群代谢构成不太好,不会导致自闭症的。如果有症状那改善菌群有助于改善症状。
肠道菌群平衡,为何多样性指数是低的?
答:菌群平衡和多样性指数是2个不同指标;
多样性仅仅评估肠道菌群的种类数量和丰度分布,与具体是有益和有害无关。多样性主要与饮食摄入,药物如抗生素类以及疾病状态有关。
菌群平衡对应的异常称为肠道菌群失调,临床上有I度失调和更严重的II度失调。大便常规检查是通过显微镜下观察统计染色细菌中杆菌和球菌以及革兰氏阴性和阳性菌的比值是否超标来判别的。本报告同时提供了另一评估算法,通过有益菌/有害菌的总体情况来评估菌群平衡状态,低于2为重度失衡,低于5为失衡,同时分值也提示菌群平衡水平,越高越正常。
菌群失衡如何调整?
从菌群失衡的评估角度来看,首先就是快速增加有益菌特别是双歧杆菌的丰度可有效改善该项指标。因此临床上通常提供多联的益生菌制剂来快速补充益生菌,可以短期有效改善菌群平衡比例。
菌群平衡和多样性分值都高的,但是肠道年龄预测比实际大,年龄预测模型是不参考多样性和平衡性参数的?
答:肠道年龄是靠机器学习和人群大队列做的,不是只根据菌群平衡和多样性,每个年龄段都有核心和标致的菌群特征,比如婴儿的双歧杆菌,老年人瘤胃球菌等,这几个指标都是表征菌群的状态和健康的。
END
声明
谷禾专注于提供肠道菌群基因检测和基于此的健康评估咨询,肠道菌群对人体健康的影响和关联性已被广泛研究和认可,但基于对健康的慎重和法规,谷禾重申其提供的肠道菌群基因检测目前不用于临床疾病诊断,仅作为菌群状况构成检测和健康评估以及基于菌群的科研。分析报告中疾病风险和健康相关评估来自于公开研究数据和谷禾构建的大人群队列数据分析的预测评估结果,涉及临床诊断和医疗建议请遵照临床诊断和医生的医嘱。由于技术进步和样本数据不断积累,报告中可能存在尚未完全涵盖的因素或状况,不可避免的存在一定概率部分风险未被完全检出的情况。

谷禾健康
疾病表现、进展和治疗反应的可变性一直是医学的核心挑战。尽管宿主因素和遗传学的变异性很重要,但很明显,在迈向个性化治疗的过程中,必须考虑肠道微生物组具有巨大的遗传和代谢多样性。
疾病表现、治疗反应和治疗不良反应的个体差异是有效管理疾病和患者安全的主要挑战。这种认知是精准医学的基础,其最简单的形式可以这么说,用个性化方法为合适的患者确定合适的治疗方法,无需反复试验。
将肠道微生物组与人类遗传学区分开来的一个方面是它代表了我们健康的动态组成部分,通过复杂的网络不断与宿主和环境因素相互作用。虽然存在潜在挑战,肠道微生物组的可塑性也提供了一个独特的机会,使其成为精准医学的一个有吸引力的目标。
本文支持使用肠道微生物组作为精准医学工具的当前证据,并建议未来需要将微生物组作为个体化治疗或干预工具的工作。
该研究团队选择了六个广泛的疾病组,这些组具有相对较强的证据表明肠道微生物组的作用。 尽管每个疾病组都有不错的发展,但在考虑临床影响时,不同疾病组的前景和成熟度各不相同(下图)。
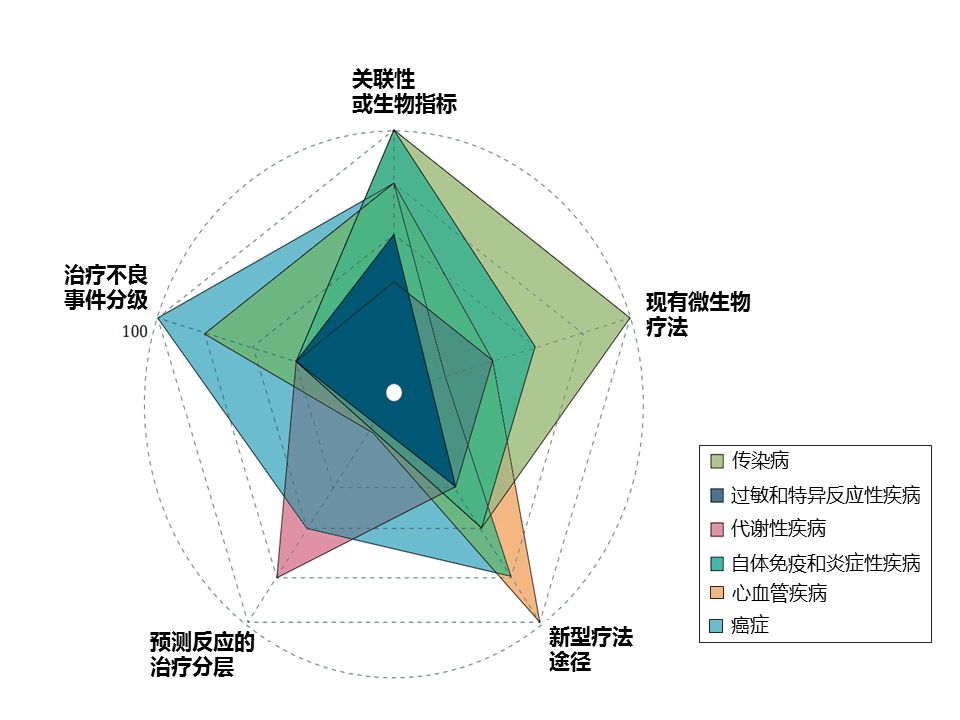
抗生素诱导的肠道微生物组破坏会促进机会性和医院感染的机制。最常见的院内腹泻感染艰难梭菌为例,强调可能解释临床结果的个体差异的微生物组和病原体特异性特征。
复发性艰难梭菌感染 (CDI) 一直是微生物组研究的中心焦点。CDI 出现最常见的原因是使用抗生素,但矛盾的是,CDI 的一线治疗也包括抗生素。
抗生素对一般人相当有效,但为什么部分患者出现治疗失败,或是成功治疗后复发?
这可能与宿主特征(例如高龄)或药物的使用(例如质子泵抑制剂)有关, 以及肠道微生物组中特定病原体的特征有关。
除了宿主因素外,肠道微生物群的破坏也是 CDI 的关键因素。
· 与健康对照个体相比,CDI患者的肠球菌、韦永氏菌、乳杆菌、γ-变形菌属的相对丰度较高,而拟杆菌属、毛螺菌科、瘤胃球菌科的含量较低。

谷禾健康
普雷沃氏菌属存在于人类中,帮助分解蛋白质和碳水化合物食物。也可作为条件致病菌,引起牙周和牙齿、肠道炎症、类风湿性关节炎、细菌性阴道炎等问题。


普雷沃氏菌(Prevotella)是革兰氏阴性菌、非运动性、杆状、单细胞,可在厌氧条件下生长。
Prevotella是一个大属,包括50多个不同的物种。大多数可以从口腔和肠道中分离出来。


普雷沃氏菌有助于分解蛋白质和碳水化合物食物。
普雷沃氏菌可以通过结合或附着在上皮细胞以外的其他细菌上定植,在以前感染的区域产生更大的感染。
普雷沃氏菌的另一种生存机制是天然抗生素抗性基因,防止被消灭(TIGR)。


接下来,我们从肠道、口腔、阴道三个部位,来了解普雷沃氏菌与人体健康或疾病的关系。
普雷沃氏菌通常被认为是一种与健康的植物性饮食相关的菌,在人体中发挥“益生菌”的作用。普雷沃氏菌属的减少与某些疾病相关。
自闭症
被诊断患有自闭症的儿童的普雷沃氏菌属丰度较低。婴儿普雷沃氏菌水平的下降与两岁时的行为问题有关。
过敏
研究人员分析了从2010年到2015年收集的数据,这些数据观察了怀孕36周的母亲以及她们1个月、6个月和12个月大的婴儿的粪便样本。有食物过敏的儿童(58名)与没有食物过敏的儿童(258名)进行了比较。
他们发现,20%没有过敏的婴儿的粪便样本中含有P.copri,而过敏婴儿的粪便样本中只有8%含有P.copri:母亲的粪便样本中含有P.copri,意味着婴儿产生过敏的风险更低。
多发性硬化症
在多发性硬化症患者的肠道微生物群中,缺乏Prevotella histicola。
2019年开展的一项研究表明,单独使用Prevotella histicola治疗转基因小鼠或与多发性硬化药物Copaxone联合治疗,减少了与该疾病相关的促炎症反应。
因此,该菌可能在多发性硬化症(MS)患者中有潜在的治疗作用,多发性硬化症是一种影响大脑和神经的自身免疫性疾病。多发性硬化症患者通常表现为微生物群失衡。
普雷沃氏菌是健康肠道生物群中必不可少的菌。然而,这种细菌是不是越多越好?
答案是否定的。

谷禾健康
感觉疲惫?沮丧?容易出汗?经常感冒?免疫力下降?骨痛?脱发?…
这些都可能与维生素D缺乏有关。
维生素D对人体健康很重要。然而流行病学研究表明,全世界近十亿人口受维生素D缺乏症的影响。
一项针对北京和上海50-70岁人群调查显示:

注:VD水平缺乏(低于20ng/ml);VD水平不足(低于30ng/ml)
首先我们来看下维生素D在人体中扮演怎样的角色。
维生素D
· 维生素D是脂溶性维生素
· 参与钙和磷的吸收,骨骼健康以及肌肉的生长和发育(生理过程)
· 刺激肌肉细胞的增殖和分化(影响肌肉系统)
· 其充足的供应可预防呼吸道感染,间接参与具有抗生素特性的化合物的生产(免疫系统)
· 其最佳含量对皮肤的状况和健康以及男性和女性生殖过程的调节都有积极的作用(皮肤)
为什么会有这么多人出现维生素D缺乏?
1. 饮食摄入和/或吸收减少
某些吸收不良综合症,如腹腔疾病,短肠综合症,胃搭桥,炎性肠病,慢性胰腺功能不全和囊性纤维化,可能导致维生素D缺乏。老年人中口服维生素D摄入量较低的情况更为普遍。
2. 减少阳光照射
大约50%-90%的维生素D通过阳光通过皮肤吸收,其余的来自饮食。为了防止维生素D缺乏,每天需要20分钟的阳光照射,皮肤暴露在40%以上。维生素D的皮肤合成随着年龄的增长而下降。黑皮肤的人皮肤维生素D的合成较少。在住院或长期住院的患者中减少的日光照射也会导致维生素D缺乏。持续使用防晒霜的人的有效日晒量降低。
3.内源性合成减少
患有慢性肝病(例如肝硬化)的个体可能具有缺陷的25-羟化作用,导致活性维生素D缺乏。1-α25-羟化作用的缺陷可见于甲状旁腺功能亢进,肾衰竭和1-α羟化酶缺乏症。
4.肝分解代谢增加
某些yao物会诱导肝p450酶,从而激活维生素D的降解。
5.维生素D 抵抗
在遗传性抗维生素D佝偻病中可以看到维生素D受体抵抗。
维生素D缺乏症的大多数患者无症状。
轻度的慢性维生素D缺乏症,也可能会导致慢性低钙血症和甲状旁腺功能亢进,特别是在老年人群中,可能导致骨质疏松,跌倒和骨折的风险。
长期严重维生素D缺乏症患者会出现与继发性甲状旁腺功能亢进有关的症状,包括骨痛,关节痛,肌痛,疲劳,肌肉抽搐(束缚)和无力。脆性骨折可能是由于长期缺乏维生素D导致骨质疏松所致。
在儿童中可能产生的症状:烦躁,嗜睡,发育迟缓,骨骼变化或骨折等。
其他一些症状可能会被忽视,其实也与维生素D缺乏有关,例如:
感到疲惫,免疫力下降,反复感染,容易出汗,脱发,伤口愈合慢,头晕,心脏问题,超重或肥胖,情绪低落,认知功能障碍等。
25(OH)D是血中维生素D的主要存在形式, 而且血清或血浆中25(OH)D受机体调节的影响较小, 可以在较长时间内维持稳定,可以体现膳食摄入维生素D和阳光维生素D的总量,这是评估维生素D水平是否正常的首选临床措施。
临床上,血清25(OH)D水平标准如下:
足够: 大于20–30 ng/ml 或50–75 nmol/L
安全上限: 不超过60 ng / ml 或 150 nmol/L
有毒: 高于150 ng/mL 或 375 nmol/L
毒 副 作 用
高维生素D水平是由于过量摄入而不是由于过度日光照射引起的。
急性中毒可导致急性高钙血症,可引起混乱,厌食,呕吐,多尿,多饮和肌肉无力。
慢性中毒可导致肾钙化和骨痛。
维生素D缺乏与许多非传染性疾病的发生有关,如结肠癌,乳腺癌,卵巢癌,肾癌,胰腺癌,精神分裂症,阿尔茨海默,多发性硬化,骨软化症,佝偻病,骨质疏松,糖尿病等。
4.1 呼吸道疾病
一些研究表明,维生素D补充剂可以增强免疫反应并预防呼吸道感染。
一项来自14个国家/地区的11,321人的研究表明,补充维生素D可以使维生素D缺乏和适当水平的人降低急性呼吸道感染(ARI)的风险。
来自三项随机对照试验的Meta分析研究中,发现补充维生素D可以降低维生素D水平低于25 nmol / L的患者慢性阻塞性肺疾病恶化率。
4.2 新 冠 肺 炎
与呼吸道疾病相关的,例如COVID-19。
最近的一项研究表明,血液中25(OH)D的浓度至少为30 ng / mL有助于住院的COVID-19患者减少临床预后不良和死亡的可能性。
研究分析了235例COVID-19患者的住院资料。与维生素D缺乏症患者相比,在40岁以上的患者中,维生素D含量适当的患者发生不良后果(包括失去知觉,缺氧和死亡)的可能性降低51.5%。
在疫情期间,我们可能常听到这样的词:“细胞因子风暴”。而维生素D缺乏会增强细胞因子风暴的过程。
注:细胞因子是蛋白质,是免疫系统不可或缺的一部分。它们可以同时具有促炎和抗炎作用,并发挥重要作用,有助于预防感染和疾病。但是,在某些情况下,细胞因子也会引起组织损伤。
细胞因子风暴是指响应感染或其他因素而发生的促炎性细胞因子的失控释放。细胞因子的这种失调和过度释放会导致严重的组织损伤,并增强疾病的进展和严重程度。
细胞因子风暴是导致多器官功能衰竭和急性呼吸窘迫综合征(ARDS)的主要原因,也是导致COVID-19进程和严重程度的重要因素。例如,已显示严重病例COVID-19的患者释放大量细胞因子,尤其是IL-1和IL-6。
维生素D缺乏与免疫功能降低有关,并可能增强细胞因子风暴。当然该领域还在研究中。
需要特别注意,单独服用补充维生素D并不能让你免受COVID-19的侵害。不过,缺乏维生素D可能会损害免疫功能,从而增加感染风险和对疾病的敏感性。
4.3 自 闭 症
自闭症是遗传和环境因素共同作用导致的神经发育异常,自闭症人群中维生素D的缺乏较常见,而维生素D能够促进儿童的大脑神经发育,因此可能在自闭症的病因学上起着重要作用。
采用随机双盲对照临床试验(RCT)设计,纳入109名自闭症儿童(85名男孩和24名女孩;年龄为3-10岁)。将自闭症患儿随机分组,分别接受维生素D3或安慰剂治疗4个月。结果发现,自闭症儿童可很好地耐受高剂量的维生素D3,且临床疗效较好。
这项研究是第一个证明维生素D3补充剂有益于自闭症患者的随机双盲对照试验,但是仍需更大规模的随机对照试验来严格验证维生素D对自闭症患者的疗效。
4.4 癌 症
对包括57,000多名受试者的18项随机对照试验(RCT)进行的荟萃分析发现,每天摄入维生素D补充剂可降低总死亡率。补充钙和维生素D降低了罹患总癌症,乳腺癌和结直肠癌的风险。
一项RCT显示,钙和维生素D可以大大降低绝经后妇女的所有癌症风险。
近几年来的人群研究还发现,机体维生素D水平与肠道菌群之间也存在密切联系。
生命早期生长发育与维生素D有关
我们知道,婴儿在出生6 个月内身体生长发育迅速,所以需要充足的营养。维生素D 缺乏是婴儿早期营养不足的主要原因之一,维生素D 补充不足会严重影响婴儿的骨骼发育。
有研究显示,婴儿体重与维生素D 缺乏具有明显关联性。婴幼儿缺乏维生素D 也会影响肠道菌群的定植能力和数量平衡,导致消化系统功能失调造成吸收功能障碍。

婴儿期肠道菌群数量的改变受多种因素影响。研究显示,维生素D可通过信号传导来增强肠道结构屏障的完整性和提高肠道免疫反应能力,进而稳定菌群在肠道的定植和数量平衡。
婴儿在1 岁以内是肠道内菌群定植、演替和达到平衡的主要阶段,特别是肠道内双歧杆菌、大肠杆菌、乳杆菌等主要菌体在婴儿出生半年内完成定植、演替和数量的平衡,对增强机体免疫力和促进消化吸收起到了重要作用。
在最近对3-6 个月大的婴儿肠道微生物群的研究中,研究人员发现脐带血维生素D 水平与乳球菌减少有关。

正常成年人补充维生素D 后,普氏菌属(Prevotella)的丰度随维生素D 的摄入量增加而增加,嗜血杆菌(Haemophilus)和韦荣氏球菌(Veillonella)的丰度随维生素D 的摄入量增加而降低,粪球菌属(Coprococcus)和双歧杆菌属(Bifdobacterium)的丰度与血清25-OH-D 水平呈负相关。
上述资料表明从婴儿期到成人期,维生素D 对肠道菌群的组成具有调节作用。
维生素D减少与肥胖有关
有研究显示,饮食中类固醇类物质的缺乏会影响肠道菌群的定植和平衡状态,使菌群数量明显增加,可能与肥胖的发生均有一定关系,但仍需进一步研究证实。
维生素D 还可促进脂肪细胞内Ca2 + 的吸收,使脂肪酸合成酶的活性增强进而减少脂肪的分解,增强脂肪细胞的储脂能力。所以体内维生素D 含量减少时,体内脂质代谢会明显增强和细胞内储脂能力降低,导致肥胖发生。
国内学者发现,超重和肥胖患者血清中维生素D 水平明显低于正常水平,且维生素D 与BMI 和腰围指标呈独立负相关性。
维生素D 缺乏的婴儿体重和BMI 指标明显高于维生素补充充足的婴儿。肠道菌群数量的增加与肥胖具有密切联系,特别是乳酸杆菌和双歧杆菌以及肠球菌能增加体重和引起肥胖。
该研究发现,观察组婴儿补充维生素D 后乳酸杆菌、双歧杆菌、肠球菌含量明显低于对照组。
活性维生素D代谢产物
多项研究表明,肠道菌群会改变肠道维生素D的代谢,而益生菌补充剂会影响循环中的维生素D水平。维生素D缺乏会降低防御素的生成,防御素是一种对于维持健康肠道菌群非常重要的抗菌分子。正如研究人员期待的那样,口服合成防御素分子能够恢复肠道菌群平衡,降低血糖水平,并改善脂肪肝症状。

最近Nature Communications上发表的一项横断面研究,对567名老年男性的血清维生素D代谢产物及粪便菌群进行深入分析后发现,8种特定肠道细菌分类群与维生素D活性形式——1,25(OH)2D的水平相关,而更高的1,25(OH)2D水平与更健康的肠道菌群(更多的丁酸盐产生菌)相关。同时,1,25(OH)2D水平较高的男性具有更大的多样性。
这些结果提供了强有力的证据,表明宿主维生素D信号和老年人肠道菌群健康之间存在重要的相互作用。肠道中CYP27B1-和CYP24A1-24-羟化酶的共定位表达可能会被存在的微生物群增强或抑制。
无论是通过饮食干预和/或在临床上给合适的人群补充维生素D,发现与更有利的肠道微生物多样性相关的活性维生素D代谢产物(包括已知的丁酸盐生产者的特定微生物)可能会为临床提供潜在的干预目标。
自闭症儿童维生素D水平较低现象
大量研究证实,自闭症儿童的维生素D 水平低于同龄健康人群,并且足量、规范地补充维生素D 可改善其自闭症核心症。
动物实验研究表明,发育早期维生素D 缺乏会导致永久性的大脑发育异常,如神经生长因子(NGF)表达减少、侧脑室增大、神经结构或神经递质相关基因(如MAP2, NF-L,GABA-Aa4)表达降低、脑组织氨酰胺水平普遍降低、去甲肾上腺素和丝氨酸水平升高、多巴胺水平升高、5-HT 水平下降等。
维生素D——神经保护剂
而维生素 D的存在,可以改善由于脑部炎症和神经毒性引起的脑损伤,促进NGF表达,延缓神经元细胞死亡。因此,维生素D 可以作为一种神经保护剂保护大脑皮层神经元避免兴奋性毒性。
自闭症儿童肠道患病率更高
自闭症儿童存在免疫系统功能紊乱,胃肠道紊乱患病率高于正常发育儿童。一项超过14,000 例自闭症患者的多中心研究显示,自闭症患者炎症性肠道疾病患病率为0.83%,而全院患者患病率为0.54%;自闭症患者其他胃肠道紊乱疾病患病率为11.74%,而全院患者患病率为4.5%,表明自闭症肠道患病率更高。
Wang L 等研究发现,在自闭症患者和正常人群中发现鲍氏梭状芽孢杆菌存在明显差异。自闭症患者肠道中的脱硫菌属比正常人群明显增多,且普通拟杆菌属含量丰富,自闭症患者与对照组正常人群肠道中的放线菌及变形菌属含量也有差异。
还有研究观察到自闭症患者肠道中有更高水平的萨特菌和瘤胃球菌属。国外通过自闭症小鼠模型肠道菌群宏基因组的研究发现,其脆弱拟杆菌属、梭菌属比例较对照组明显异常,口服脆弱拟杆菌可改善自闭症样行为症状。
维生素D通过影响Th17/Treg细胞平衡改善菌群紊乱
维生素D 可调节Th 细胞以及Treg 细胞功能,可抑制Th17 细胞,并促进Treg 细胞的增殖。Th17/Treg细胞平衡可能是维持正常的机体整体免疫功能和肠道免疫屏障功能中关键的因素。
维生素D 通过影响Th17/Treg细胞平衡调节自闭症肠道的菌群紊乱,进而通过脑肠轴作用改善神经系统的发育。
这些研究提示,自闭症存在肠道微生物生态失衡,肠道微生物失衡的改善很有可能作为自闭症治疗新的发展方向。
VD与肠道菌群相互影响,从而影响肠道疾病
结直肠癌
2009 年Volker Mai 团队研究了非裔美国人结直肠癌高于白种美国人,研究发现非裔美国人饮食中的环杂胺明显增高,维生素D 摄入量明显减少,两组人群的粪便微生物群组成也存在差异,推测环杂胺、维生素D 与肠道菌群的组成有相互影响,从而影响肠道环境促进结直肠癌的发生。
克罗恩病
维生素D 缺乏与克罗恩病(Crohn’s disease,CD)的发病有关,研究表明补充维生素D3 会改变CD 患者肠道细菌组成,参与者口服维生素D3,从第1 天至第3天每天服用20000 IU,然后每隔一天服用一次,共4 周,CD 患者口服一周后,Alistipes 菌、Barnesiella 菌、紫单胞菌科(Porphyromonadaceae)、Roseburia 菌、Anaerotruncus 菌、Subdoligranulum 菌和Ruminococaceae(均为厚壁菌门)的丰度显著增加。
炎症性肠病
1,25-OH2-D3 治疗还可在炎症性肠病中改变肠道菌群的组成,从而对小鼠有保护作用。
在肠道性疾病中肠道细菌组成多发生改变,补充维生素D 则可调节已经发生改变的肠道菌群组成。通过补充维生素D可以改变肠道内不同菌种的含量,调节肠道菌群的组成,增加双歧杆菌,拟杆菌,降低大肠杆菌和肠球菌的含量和比例。
肠炎
此外,益生菌治疗沙门氏菌肠炎的研究显示益生菌在维生素D 受体(VDR)缺陷小鼠中没有显示出保护作用,而在野生型小鼠中可抑制沙门氏菌诱导的炎症和损伤。
VDR基因消融降低肠道中DEFA5和MMP7表达,肠道通透性增加,肠道内环境紊乱,维生素D参与ß-防御素-2的表达,通过ß-防御素-2的表达与肠道菌群相互作用,改善肠道环境以及影响肠道炎症,并且存在剂量关系。溃疡性结肠炎急性期用维生素D能够缓解急性期症状,改善肠道粘膜和肠道菌群。此外,推测益生菌对个体起效可能依赖于VDR 基因。
以上,我们看到在各种肠道疾病的条件下,补充维生素D在一定程度上能改善肠道菌群。那么在缺乏维生素D的健康个体中,补充维生素D对肠道菌群是否有益?
近日,一项研究对80位健康维生素D缺乏的女性进行补充维生素D的治疗。

该研究主要是解决两个问题。
1. 补充维生素D对受试者的肠道菌群的影响
补充维生素D可显着增加肠道微生物多样性。具体而言,拟杆菌/厚壁菌的比例增加,益生菌类Akkermansia和双歧杆菌的丰度增加。拟杆菌属和普氏杆菌属显著变化,表明补充后肠型发生了变化。
2. 评估受试者菌群是否与他们的无反应状态有关。
注:无反应状态指一部分人群口服高剂量的维生素D也无效。
已有研究表明,Bacteroides acidifaciens可以预防肥胖和提高胰岛素敏感性,也是大肠中促进IgA抗体产生的主要共生菌之一。在该研究中,无反应者中较低的Bacteroides acidifaciens以及补充维生素D后的额外消耗表明,这种细菌可能与补充维生素D的反应有关。
因此,研究人员有这样一个设想,维生素D的补充促进有益菌生长,以维持免疫微生物的体内平衡。当然,需要开展更大队列的实验研究,以充分代表有反应者/无反应者,来证实该研究的发现。
6.1 鱼 类
鲑鱼
鲑鱼是一种受欢迎的脂肪鱼,也是维生素D的重要来源。

根据USDA食物成分数据库显示,一份3.5盎司(100克)大西洋鲑鱼每份含526 IU维生素D。
一些研究发现野生鲑鱼的含量更高,每份高达1300 IU。而鲑鱼养殖平均含量为250 IU。
鲱鱼
鲱鱼也是维生素D的最佳来源之一。每100克新鲜大西洋鲱鱼可提供216 IU,如果不是新鲜的鱼,腌鲱鱼也是维生素D的良好来源,每100克提供112 IU。

其他鱼类包括沙丁鱼,大比目鱼和鲭鱼等,都是维生素D的良好来源。
金枪鱼罐头
每包100克可含多达268 IU的维生素D,然而金枪鱼罐头中一般含有甲基汞(甲基汞是许多鱼类中发现的一种毒素)。可以选择淡金枪鱼(通常比白金枪鱼更好),每周不超过170克,可以防止甲基汞过多。

鱼肝油
鱼肝油每匙(4.9毫升)含维生素D约448 IU。同时也富含维生素A,omega-3脂肪酸等,但是不要服用过量。
6.2 蛋 黄
不吃鱼的人应该知道,海鲜不是维生素D的唯一来源。全蛋是另一种良好的来源,也是一种营养丰富的食品。
鸡蛋中的蛋白质大多在蛋清中,而脂肪、维生素和矿物质主要在蛋黄中。一颗标准的蛋黄含有37 IU的维生素D。

蛋黄中的维生素D含量取决于阳光照射和鸡饲料中维生素D的含量。当使用相同的饲料时,在阳光下漫游的牧场饲养的鸡所产卵的水平要高3-4倍。
从饲养的鸡中选择鸡蛋,或者从市场上购买富含维生素D的鸡蛋,可以满足日常需求。
6.3 蘑 菇
蘑菇是维生素D的唯一良好植物来源。蘑菇有点像人类,蘑菇在暴露于紫外线时也可以合成维生素D。不同的是,蘑菇产生维生素D2,而动物产生维生素D3。
某些野生蘑菇每100克包装含维生素D高达2300 IU。总的来说,只有野生蘑菇或经紫外线照射的蘑菇才是维生素D的良好来源。

6.4 强化食品
注:强化食品指向食品中添加一定量的食品营养强化剂,以提高其营养价值。
牛奶
有些牛奶中富含维生素D。每杯牛奶(237毫升)通常含有115-130 IU。
豆浆
通常会含维生素D以及牛奶中常见的其他维生素和矿物质。一杯(237毫升)通常含有107-117 IU的维生素D。
橙汁
一杯(237毫升)强化橙汁,包括高达100 IU的维生素D,当作早餐开启一天的活力。

燕麦片
半杯(78克)可提供维生素D量为54–136 IU。
注意以上食物中维生素D计算是强化食品中的含量。
最后,要提醒大家的是,“过犹不及”。维生素D虽然好,但不能补充过量。一旦维生素D过量,就会对身体带来伤害。
大剂量的维生素D服用一开始没有症状,但过几个月或几年就开始显现了,严重的情况下甚至可能导致肾脏衰竭和动脉钙化。
每天摄入1000-4000IU(25-100微克)的维生素D应该足以确保大多数人的最佳血液水平。
附 录 : 特殊人群维生素D补充剂量
维生素D缺乏引起的骨软化需要起始每日使用3000-40000IU的维生素D,随后使用每日400IU的维持剂量。
肠道吸收不良或肝脏疾病引起的维生素D缺乏通常需要每日使用40000IU(成人)治疗,每日10000-25000IU(儿童)。
甲状旁腺功能减退引起的低钙血症需要使用每日最多100000IU维生素D
——参考自:《DK家庭用药指南》
相关阅读:
参考文献:
Sizar O, Khare S, Goyal A, et al. Vitamin D Deficiency. [Updated 2020 Jul 21]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan
Nair R, Maseeh A. Vitamin D: The “sunshine” vitamin. J Pharmacol Pharmacother. 2012 Apr;3(2):118-26.
Holick MF. Vitamin D: important for prevention of osteoporosis, cardiovascular heart disease, type 1 diabetes, autoimmune diseases, and some cancers. South Med J. 2005 Oct;98(10):1024-7.
Czernichow S, Fan T, Nocea G, Sen SS. Calcium and vitamin D intake by postmenopausal women with osteoporosis in France. Curr Med Res Opin. 2010 Jul;26(7):1667-74. [PubMed] 4.
Naeem Z. Vitamin d deficiency- an ignored epidemic. Int J Health Sci (Qassim). 2010 Jan;4(1):V-VI.
Singh Parul,Rawat Arun,Alwakeel Mariam et al. The potential role of vitamin D supplementation as a gut microbiota modifier in healthy individuals.[J] .Sci Rep, 2020, 10: 21641.
Thomas MK, Lloyd-Jones DM, Thadhani RI, Shaw AC, Deraska DJ, Kitch BT, Vamvakas EC, Dick IM, Prince RL, Finkelstein JS. Hypovitaminosis D in medical inpatients. N Engl J Med. 1998 Mar 19;338(12):777-83.
Gröber U, Kisters K. Influence of drugs on vitamin D and calcium metabolism. Dermatoendocrinol. 2012 Apr 01;4(2):158-66.
Pereira-Santos M, Costa PR, Assis AM, Santos CA, Santos DB. Obesity and vitamin D deficiency: a systematic review and meta-analysis. Obes Rev. 2015 Apr;16(4):341-9.
Elliott ME, Binkley NC, Carnes M, Zimmerman DR, Petersen K, Knapp K, Behlke JM, Ahmann N, Kieser MA. Fracture risks for women in long-term care: high prevalence of calcaneal osteoporosis and hypovitaminosis D. Pharmacotherapy. 2003 Jun;23(6):702-10.
Kennel KA, Drake MT, Hurley DL. Vitamin D deficiency in adults: when to test and how to treat. Mayo Clin Proc. 2010 Aug;85(8):752-7
Palacios C, Gonzalez L. Is vitamin D deficiency a major global public health problem? J Steroid Biochem Mol Biol. 2014 Oct;144 Pt A:138-45.
Zadka K, Pałkowska-Goździk E, Rosołowska-Huszcz D. The State of Knowledge about Nutrition Sources of Vitamin D, Its Role in the Human Body, and Necessity of Supplementation among Parents in Central Poland. Int J Environ Res Public Health. 2018;15(7):1489. Published 2018 Jul 14.
Sordillo JE, Zhou Y, McGeachie MJ, et al. Factors influencing the infant gut microbiome at age 3-6 months: Findings from the ethnically diverse Vitamin D Antenatal Asthma Reduction Trial (VDAART) [J]. J Allergy Clin Immunol, 2017, 139(2):482-491.
Luthold RV, Fernandes GR, Franco-de-Moraes AC, et al. Gut microbiota interactions with the immunomodulatory role of vitamin D in normal individuals[J]. Metabolism, 2017,69:76-86.
Mai V , Mccrary Q M , Sinha R , et al. Associations between dietary habits and body mass index with gut microbiota composition and fecal water genotoxicity: an observational study in African American and Caucasian American volunteers[J]. Nutrition Journal, 2009, 8(1):49.
White JH. Vitamin D deficiency and the pathogenesis of Crohn’s disease[J]. Steroid Biochem Mol Biol, 2018,175:23-28.
Schäffler H, Herlemann DP, Klinitzke P, et al. Vitamin D administration leads to a shift of the intestinal bacterial composition in Crohn’s Disease patients, but not in healthy controls[J]. Journal of Digestive Diseases, 2018, 19(4): 225- 234.
Ooi JH, Li Y, Rogers CJ, et al. Vitamin D regulates the gut microbiome and protects mice from dextran sodium sulfate-induced colitis[J]. J Nutr, 2013,143(10):1679-1686.
Shang M, Sun J. Vitamin D/VDR, Probiotics, and Gastrointestinal Diseases[J]. Curr Med Chem, 2017,24(9):876-887.
李子傲. 母乳喂养对肠道菌群的影响[J]. 营养与健康,2016, 10( 8) : 97-99.
汪英,袁莉,李广利,等. 肥胖与血清维生素D 水平的关系研究[J]. 中华内分泌代谢杂志,2011,27 ( 7) :589-590.
祝海波,周苗苗,王海,张晓宇.婴儿早期维生素D补充水平对生长发育和肠道菌群的影响[J].中国食物与营养,2018,24(12):87-89.
李苹,昌雪莲,尚煜,刘雅静,陈晓宇,梁爱民,齐可民.婴儿早期维生素D补充对生长发育及肠道菌群的影响[J].公共卫生与预防医学,2018,29(01):12-16.
杜琳. 维生素D介导的Th17/Treg细胞稳态调节对孤独症大鼠肠道菌群失调作用的研究[D].吉林大学,2019.