 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

日常生活中大部分人都可能碰到过食用了不卫生或过期变质食物以及水源后,出现过恶心、腹痛,并伴有腹泻、食欲不振、呕吐等症状?如果有就要当心,这可能是病原体感染引起的胃肠道炎症。
但是,即使食用了同样食物水源,不同人表现不一样。有的人表现无严重症状,有的人却症状严重,那么是什么因素导致病原体进入肠道后定植或无法定植,什么因素影响其进一步的感染?

胃肠道感染,也称作胃肠炎,是指病毒、细菌或其他病原微生物侵入消化道,引起的一系列消化系统症状的疾病。
这些微生物主要是通过食物或水进入人体后,在胃肠内繁殖并产生毒素,导致黏膜损伤和免疫细胞浸润,进而引发一系列病理生理变化。胃肠道感染的症状包括腹泻、腹痛、恶心呕吐以及食欲减退等。严重时还可能出现脱水、电解质紊乱甚至死亡。
有人可能会问:我们胃肠道中有那么多的微生物,为什么稍微一点外来的微生物就会让我们生病呢?的确,人体肠道内栖息着大量微生物,包括数万亿细菌,统称为肠道微生物群。微生物群的各种细菌成员在多个复杂层面上参与合作和竞争的生理网络。在过去10年中,测序技术领域的进步极大地增进了我们对共生微生物群影响的各种生理和病理过程的理解。
越来越多的人类疾病,如炎症性肠病、2型糖尿病、肥胖、心血管疾病、过敏和结直肠癌等被发现与微生物群组成的改变有关。此外,关于健康个体中人类微生物群的组成、其随时间和不同人之间的差异以及环境因素(即饮食)和遗传背景如何塑造微生物群的也正在变得更加清晰。
正常、健康的肠道微生物群可以在肠道中产生不利于肠道病原体定植的条件,这被称为定植抗性。肠道微生物群通过多种机制提供针对感染的保护,包括抗菌物质的分泌、营养竞争、上皮屏障完整性的支持、噬菌体和免疫激活。这些机制共同有助于抵抗外源微生物的定植。
当微生物群稳态受到干扰时,定植抗性可能会暂时受到破坏,病原体就有机会生长到高水平。这种破坏可能是由接触抗生素、饮食变化、益生菌和药物的应用以及各种疾病引起的。定植抗性的减弱会促进内在病原体的定植或增加对感染的易感性。
病原体扩张的后果之一是引发宿主炎症反应和病原体介导的疾病。同时在肠道炎症患者中,通常会观察到微生物群组成异常,称为“生态失调”。这通常的特征是兼性厌氧细菌(例如肠杆菌科、芽孢杆菌)的相对丰度增加,同时,拟杆菌属等专性厌氧细菌的减少。不过到目前为止,尚不清楚生态失调是肠道炎症的原因还是结果,但我们有充分的理由证明两者之间存在显著的相关性。
除了肠道微生物外,宿主营养通过影响宿主免疫系统和病原体资源的可用性,进而影响感染结果。从宿主角度看,维持活跃的免疫反应需耗费大量精力。营养状况的降低可能削弱宿主抵抗感染的能力,并在其他条件不变的情况下增加病原体的危害。
另一方面,从病原体角度看,宿主营养的数量(食物量)和质量(特定营养成分)的变化可能影响感染期间病原体生长资源的可用性和类型。在此情况下,生长较快的病原体或更高的病原体适应性/负载量可能导致更大的毒力。
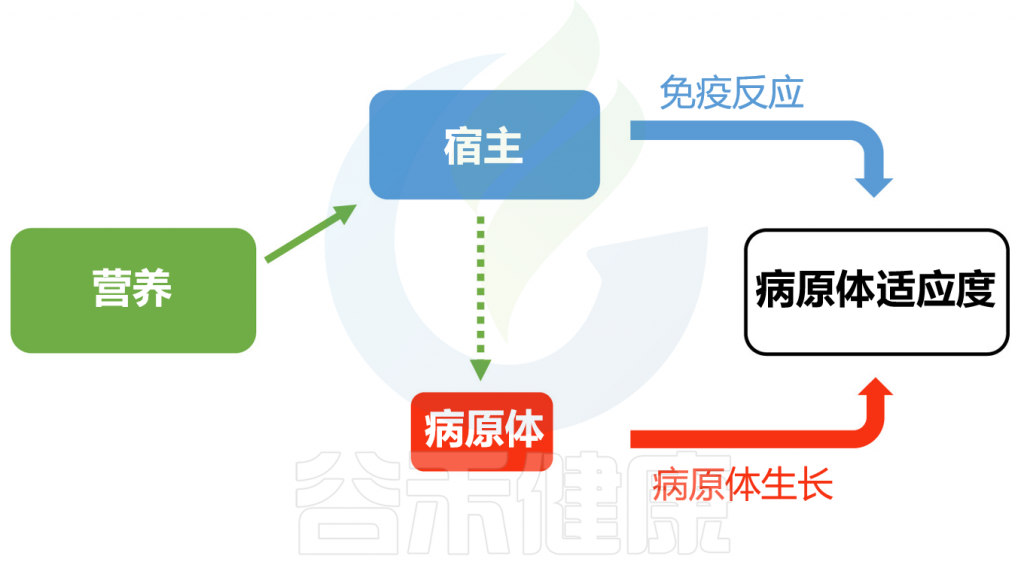
Pike VL,et al.Proc Biol Sci.2019
在本文中,我们将讲述健康人体肠道微生物的抗感染作用;讨论了营养与感染的关联。此外,本文重点关注肠道感染中炎症与微生物群的双向作用、发炎肠道中肠道病原体和肠道微生物群的竞争,以及最后提出了通过营养与微生物作用有助于预防和治疗感染的方法。
▸ 如何区分病原菌和共生菌
在感染医学中,共生菌和致病菌之间的区分仍然是一个重要标准,有益的共生现象和对立的致病性代表了细菌行为范围的两个极端,尽管很少有细菌微生物组成员表现出真正的致病行为。多细菌物种或菌株可以根据其环境背景和宿主生理状态动态改变其作为共生体或病原体的能力。
例如,微生物组失调和宿主免疫缺陷,可以将肠球菌(Enterococcus faecium)从一个几乎无害的肠道微生物组成员转变为血流感染的原因。
单个水平基因转移事件可以改变共生生活方式和致病生活方式之间的平衡,例如,当预测的编码毒素成为肠出血性大肠杆菌或皮肤定植和口咽定植的白喉杆菌的主要毒力因子时。这意味着,原本可能是相对无害的微生物,在获得某些特定基因后,其生物学性质和行为可能发生显著变化,从而增加了其致病潜力。这种基因的转移和表达可以使这些微生物在宿主体内表现出更强的侵袭性和病原性,从而对宿主健康构成更大的威胁。
扩展阅读:
在这篇文章中,我们将常规引起感染的外来细菌称为病原体,而不常引起感染的细菌称为共生菌,越来越多的证据表明,一些共生细菌对人类健康至关重要。
▸ 稳定的肠道共生菌对健康至关重要
而健康的肠道内有一个稳定的微生物群落,可以抵抗外来细菌和病原体的侵袭,这就是所谓的“定植抵抗”,这个概念至少从上世纪50年代就被认识到了。
不成熟的微生物群落(比如婴儿的微生物群落)或者受到抗生素或者饮食破坏的微生物群落可能会失去这种保护作用。
在健康个体中,共生稳定的肠道微生物群通过多种机制提供针对感染的保护,包括抗菌物质的分泌、营养竞争、上皮屏障完整性的支持、噬菌体和免疫激活。这些机制共同有助于抵抗外源微生物的定植。
肠道微生物介导的定植抵抗机制
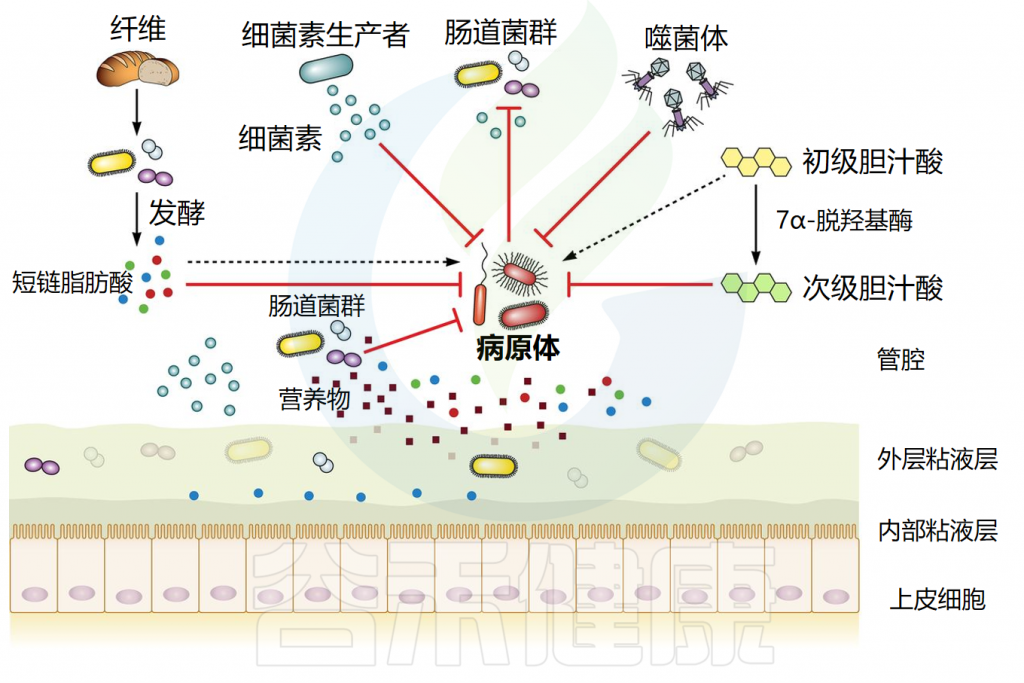
Ducarmon QR,et al.Microbiol Mol Biol Rev.2019
肠道微生物群能产生各种具有抗菌作用的产物,包括短链脂肪酸、次级胆汁酸和细菌素。每一种都以特的方式抵抗外源微生物的定植。它们的作用机制如下所述。
// 短链脂肪酸影响细胞内pH值和代谢功能来抑制细菌生长
短链脂肪酸(SCFA)主要由细菌通过不易消化的碳水化合物发酵产生。三种主要的SCFA是乙酸盐、丙酸盐和丁酸盐,占总量的90%至95%。在稳态条件下,丁酸盐是肠上皮细胞的主要营养物质,并通过β-氧化进行代谢,可以维持肠道内的厌氧环境。
短链脂肪酸通过影响细胞内pH值和代谢功能来抑制细菌生长。研究表明,SCFA浓度与肠道不同区域的pH值呈负相关。在较低pH值下,短链脂肪酸以其非离子形式更为普遍,这些非离子酸可以穿过细菌膜,扩散到细胞质中。在细胞质内,它们解离,导致阴离子和质子积聚,从而降低细胞内pH值。
短链脂肪酸已被确认为抑制鼠伤寒沙门氏菌(Salmonella typhimurium)生长的关键因素,并且对致病性大肠杆菌和艰难梭菌具有抑制作用。这些SCFA主要由拟杆菌和梭菌等厌氧共生细菌产生,这些细菌是成年哺乳动物微生物群中的重要成员。
短链脂肪酸还可以影响病原体的毒力:例如,丙酸和丁酸可以抑制鼠伤寒沙门氏菌的毒力因子。短链脂肪酸还可以作用于宿主,降低氧气浓度,为病原体生长创造一个不利环境。
// 胆汁酸具有抗菌作用,减少病原体定植
胆汁酸是分泌到小肠中的两亲性胆固醇衍生分子。它们的主要功能是乳化脂肪和脂溶性维生素以供吸收,但它们也具有抗菌特性。
大部分结合的初级胆汁酸(50%至90%)在远端回肠中被重吸收,而其余部分可以在结肠中进行细菌代谢。一些细菌(主要是梭状芽胞杆菌)通过复杂的生化途径进行 7α-脱羟基作用,将解离的初级胆汁酸转化为两种主要的次级胆汁酸:脱氧胆酸和石胆酸。
一些胆汁酸对许多细菌具有杀菌作用,包括金黄色葡萄球菌、多形拟杆菌、艰难梭菌等。证据如下:
-其中一种细菌,C. scindens ,通过产生次级胆汁酸与对艰难梭菌的定植抗性相关。C.scindens能够保护小鼠免受艰难梭菌的侵害,并恢复次级胆汁酸水平。
-使用HT-29细胞系,石胆酸已被证明可以增强肠上皮中抗菌肽LL-37的转录。
-此外,初级胆汁酸鹅去氧胆酸通过激活小肠FXR受体,间接启动先天防御机制,具有保护作用。
// 细菌素通过多种机制发挥其抗菌作用
细菌素是由特定细菌物种产生的短有毒肽,能够抑制其他物种的定殖和生长。细菌素通过多种机制发挥其抗菌作用,主要方式包括直接杀死目标细菌或抑制其生长。这些机制具体如下:
-细胞膜破坏:许多细菌素可以通过插入到细菌的细胞膜中,形成孔洞。这些孔洞破坏了细胞膜的完整性,导致细胞内容物的泄漏,最终引起细菌细胞的死亡。
-干扰细胞壁合成:某些细菌素能够干扰细菌细胞壁的合成。例如,它们可能会抑制细胞壁的主要构建块(如肽聚糖)的形成,从而阻止细胞壁的正常建造和修复,导致细菌无法在分裂或生长过程中维持其结构的完整性。
-抑制核酸合成:直接或间接影响DNA和RNA的合成或功能。例如,它们可能会阻止核酸的复制或转录,或者干扰核酸的修复过程,从而抑制细菌的生长和繁殖。
-蛋白质合成抑制:细菌素还可能通过抑制蛋白质的合成来发挥作用。这通常是通过与细菌的核糖体结合,阻断蛋白质合成的关键步骤来实现的。
-代谢途径干扰:此外,一些细菌素可能会干扰细菌的代谢途径,如阻断能量产生的关键酶的活性,从而削弱细菌的生存能力。
细菌会在肠道中竞争营养物质,这对于同一物种的不同菌株尤为重要,因为它们通常需要相同的营养物。多项研究使用不同的大肠杆菌菌株已经证明了营养竞争在细菌定植抵抗中的重要性。以下是一些研究证据:
// 利用相同营养物的菌株竞争有助于抑制病原菌
本土大肠杆菌菌株与致病性大肠杆菌O157:H7 竞争氨基酸脯氨酸。在粪便悬浮液中,高脯氨酸利用率的菌株通过耗尽脯氨酸池抑制致病菌的生长,而添加脯氨酸可逆转此抑制效果,证实了菌株间的营养竞争。
除氨基酸外,不同的大肠杆菌菌株还利用肠粘液中的不同糖类。当小鼠肠道中存在两种大肠杆菌菌株共同利用与O157:H7相同的糖时,O157:H7无法在小鼠中定植。但若只有一种共生菌株存在,O157:H7则能成功定植,显示这两种共生体能共同耗尽所有致病菌所需的糖。
营养竞争还涉及微量营养素,如铁。已知鼠伤寒菌在感染过程中从发炎的肠道吸收大量铁。益生菌大肠杆菌Nissle能高效清除铁,单次给药可显著降低鼠伤寒菌的水平。对铁的竞争可能是大肠杆菌Nissle 能够减少鼠伤寒沙门氏菌在小鼠体内定植的另一种解释。
总之,这些研究表明,通过营养竞争吸收病原体所需的关键营养物质,可以有效地抵抗病原体定植。因此,未来的策略可能会集中在培养能在特定营养素上胜过病原体的益生菌菌株,这在肠道微生物群紊乱时尤为重要,如抗生素治疗期间及其后,因为这是外源细菌最易定植的时期。
// 对粘附位点的空间竞争可以预防感染
除了基于营养的功能性生态位外,细菌还必须竞争物理空间。有些物种更喜欢以内腔或外粘液层的食物为生,或更罕见的是上皮表面的食物。
与上皮细胞的密切身体接触是某些病原体生活方式的重要组成部分(例如弯曲杆菌、某些致病性大肠杆菌、鼠伤寒沙门氏菌),因此对粘附位点(通常是聚糖结构)的物理竞争有助于预防感染或病理。
定植抵抗的直接和间接机制
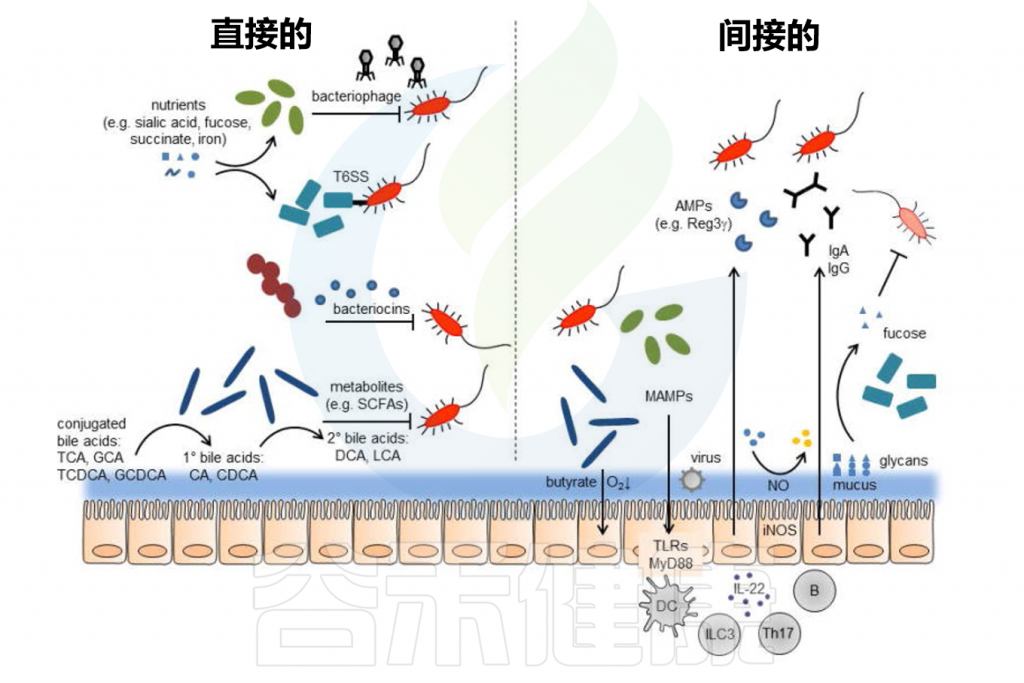
Pickard JM,et al.Immunol Rev.2017
肠道屏障由内外粘液层、上皮屏障及其相关的免疫屏障组成。内部粘液层不可穿透且牢固地附着在上皮层上,形成了一道防止细菌直接接触上皮层并引发潜在炎症的物理屏障。
// 缺乏可利用营养物质时粘液降解细菌会消耗外粘液层
共生肠道微生物居住在非附着的外粘液层中并代谢营养物。粘液层变薄会增加对病原体定植的敏感性,这可能由于西式饮食中缺乏微生物可利用的碳水化合物(MAC)引起。
当MAC稀缺时,粘液降解细菌如Akkermansia muciniphila和Bacteroides caccae会消耗外粘液层,使细菌更接近上皮层。宿主通过增加粘蛋白(MUC2)的表达来适应,但这种适应往往不足。
然而,内粘液层的损伤可以通过施用长双歧杆菌逆转,这可能因其刺激粘液生成。
// 肠道微生物对于维持粘液屏障的完整性非常重要
一方面,有益的微生物如乳酸菌和双歧杆菌可以通过产生短链脂肪酸等代谢产物来增强粘液层的保护作用,这些代谢产物能刺激粘液的产生和分泌,从而增强屏障功能。
另一方面,某些条件下如不健康的饮食习惯导致有益微生物减少,而粘液降解细菌的比例增加,可能会导致粘液层被过度消耗,粘液屏障变薄,从而使肠道更容易受到病原体的侵袭。
总之,粘液层是抵御外源微生物定植的首要屏障。研究已证明饮食是维持屏障正常功能的重要因素,这表明通过饮食干预或特定的益生元和益生菌可能成为未来的治疗选择。
目前,肠道微生物影响全身免疫反应的最佳机制可能是其对适应性免疫系统T细胞的影响。
// 肠道微生物影响T细胞的分化、影响炎症反应
研究表明,胃肠道微生物群可以影响T细胞群分化为辅助性T(Th)Th1、Th2和Th17细胞或具有调节表型的T细胞。具体来说,丁酸盐作为短链脂肪酸促进外周诱导的调节性T细胞的分化,并以这种方式能够抑制全身炎症的发展。
SCFA还能够重新编程细胞的代谢活动,从而诱导调节性B细胞并通过戊酸抑制Th17细胞的生成,这可能与炎症性肠病和自身免疫性疾病有关。
此外,微生物来源的ATP可以诱导Th17细胞的扩增,色氨酸分解产物可以导致上皮内CD4+ CD8αα+ T细胞的增加,细菌来源的多糖可以启动调节性T细胞。通过其诱导调节群体的能力,微生物组可以支持抑制炎症反应。
噬菌体是地球上最丰富的微生物,也在人类肠道中大量存在。噬菌体已被提议作为抗生素的潜在替代品,因其高度特异性,仅针对单一或少数细菌菌株,从而极大地减少对微生物群共生成员的影响。
// 使用噬菌体有效减少了霍乱弧菌感染
在实验中,使用小鼠和兔子的预防性噬菌体混合物可以有效控制霍乱弧菌感染。这种预防性混合物在体外能够杀死霍乱弧菌,减少其在小鼠肠道中的定植,并预防兔子的霍乱样腹泻。
研究表明,肠道中噬菌体的浓度是预防感染成功的关键因素,噬菌体的给药时间与霍乱弧菌接种的时间间隔与治疗效果密切相关。空肠弯曲杆菌在鸡体内的定植也通过噬菌体混合物显著降低。
// 噬菌体为肠道共生细菌提供竞争优势
噬菌体还可以提供共生体竞争优势。例如,粪肠球菌V583含有能够感染并杀死其他粪肠球菌菌株的噬菌体,为粪肠球菌V583创造了竞争优势。
噬菌体在排除特定肠道细菌方面发挥重要作用,对肠道健康具有潜在贡献。噬菌体的人类治疗应用尚未广泛进行,主要是因为缺乏足够的安全性和有效性证据。然而,最近的病例报告显示,噬菌体治疗在对抗多重耐药细菌方面展现出明显的潜力。
VI 型分泌系统(T6SS)是在一些革兰氏阴性细菌中发现的蛋白质易位复合物,其与一些噬菌体蛋白质具有相似的机制,具有注射毒素到邻近细胞的能力,这一功能使其在微生物间的竞争以及宿主与病原体间的相互作用中发挥关键作用。
T6SS的结构类似于细菌噬菌体的尾部,能够将效应蛋白直接转运到靶细胞中,这些效应蛋白能够破坏靶细胞的细胞结构或功能,从而抑制或杀死竞争对手。
T6SS 示意图
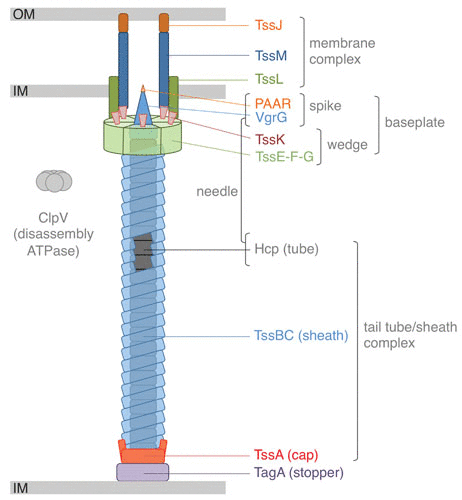
Cherrak Y,et al.Microbiol Spectr.2019
// T6SS通过注射毒素杀死或抑制病原细菌
在抵抗病原体感染方面,T6SS可以被视为一种防御机制。一些非病原性或共生细菌利用T6SS对抗侵入的病原细菌,通过直接向病原体注射毒素来抑制其生长或直接杀死这些病原体。
注:这种机制不仅限于细菌间的相互作用,也可能影响更高级生物的细胞,如真核宿主细胞,进而影响病原体的感染能力和宿主的免疫反应。
最近,在拟杆菌门成员中发现了一个新的T6SS蛋白家族,该门与厚壁菌门一起在哺乳动物肠道中占主导地位。多项研究表明,T6SS及其相关效应子和免疫蛋白的存在在小鼠肠道内拟杆菌属物种之间的竞争中发挥着重要作用。重要的是,T6SS 介导的竞争是接触依赖性的,可以涉及效应子和免疫蛋白的多种组合,并且可以具有比其他杀伤机制更广泛的目标范围。
// T6SS能够调节宿主的免疫系统
此外,T6SS还能够调节宿主的免疫系统。一些研究表明,T6SS可以通过调控炎症反应和影响免疫细胞的活性来影响宿主的免疫环境。例如,T6SS可以影响巨噬细胞的吞噬作用和炎症因子的释放,从而调节宿主的免疫反应。
因此,T6SS不仅是细菌间相互作用的武器,也是细菌与宿主互作的重要因素,对于维持微生物群落的平衡、抵抗病原体侵袭以及调节宿主免疫反应具有重要作用。
通过进一步研究T6SS的具体机制和作用,可以为开发新的抗感染策略提供理论基础和潜在靶点。
营养与感染之间存在密切的相互关系。首先,营养直接影响人体免疫系统的发展。此外,营养状况还会影响感染的发生,包括胃肠道感染、食物中毒、肠道疾病以及其他全身性传染病。
营养与感染的关系可分为以下几种:
(1)营养对人体免疫系统发育的影响;
(2)营养对感染(如胃肠道感染)、食物中毒、肠道疾病(如微生物性腹泻)和全身感染性疾病(如布鲁氏菌病、伤寒)发生的影响;
(3)营养不良与感染的关系;
(4)严重联合免疫缺陷患者的营养;
(5)暴饮暴食与感染的关系。
// 营养对免疫系统的发育至关重要
营养从胚胎阶段起就对人体免疫系统的发育产生影响。怀孕期间,尤其是前三个月,如果母亲摄入足够的蛋白质、维生素和矿物质,胚胎组织将得到良好的发育。胎儿营养不良会对免疫系统的正常发育造成不利影响,如果免疫系统在这一关键时期未能有效发展,将来对抗病原体的能力会受到影响。
// 营养不良抵抗病原体的能力会受到影响
母乳喂养是建立强健免疫系统的关键步骤。未经母乳喂养的营养不良婴儿,容易因缺乏蛋白质和维生素而易感染疾病,并且对疫苗的反应也不佳。因此,良好的营养是提高人体对环境病原体防御能力的基石。
广泛的研究已经证实了营养在增强抵抗感染能力方面的重要作用。例如,研究显示,相比仅接种结核疫苗的儿童,饮食充足的儿童患结核病的风险更低。同时保证营养健康和接种疫苗的人,患结核病的风险显著减少。
进行了一项研究来显示儿童感染与营养不良之间的关系。结果显示,营养不良的儿童经常出现腹泻。这些儿童的腹泻发生率和严重程度较高。结果表明,营养不良程度与腹泻风险之间存在直接关系。另一项研究评估了婴儿从出生到24个月大期间腹泻的影响。结果显示,腹泻发生率每增加 5%,生长障碍就会增加(约16%)。
营养不良和菌血症风险之间存在可变关系,营养不良儿童更有可能患革兰氏阴性菌血症。在坦桑尼亚进行的一项血培养研究结果表明,假单胞菌属、肠杆菌属和金黄色葡萄球菌的患病率很高。
溶组织内阿米巴寄生虫引起的阿米巴病与营养不良儿童腹泻的发生率和严重程度增加之间存在密切关系。据观察,溶组织内阿米巴感染可导致发展中国家儿童腹泻的发生率为2%–10%。全球每年由阿米巴病引起的死亡率和感染率估计分别约为100000例和5000万例。分泌性抗体(免疫球蛋白A)可促进针对溶组织阿米巴腹泻的免疫保护。营养不良儿童中IgA分泌细胞的减少会增加溶组织内阿米巴感染的发生率。
// 受污染的食物和水会导致人体发生感染
食物是人体的主要能量来源,但如果受到微生物污染,可能会引发消化系统疾病和食物中毒等问题。在不同季节,人们可能会遭遇不同程度的食物中毒。尤其在炎热天气中,肠道疾病的发生率较高。
// 受霍乱弧菌污染的食物会使人感染霍乱
其中霍乱是最危险的一种,霍乱是由一种叫做霍乱弧菌(Vibrio cholerae)的细菌引起的急性肠道传染病。这种病主要通过饮用或食用被霍乱弧菌污染的水和食物传播。人们在卫生条件差、饮用水处理不当或个人卫生习惯不佳的环境中更容易感染霍乱。
// 布鲁氏菌病
此外,通过水和食物传播的微生物污染可能导致儿童严重腹泻和传染病。布鲁氏菌病是通过摄入受布鲁氏菌(Brucella)污染的食物和水引起的传染病,这是人类和动物之间的常见疾病。
布鲁氏菌可感染绵羊、山羊、牛、猪和狗,人类则可能通过食用未经高温消毒的牛奶或未煮透的感染动物肉类而感染。密切接触受感染动物的分泌物也可能将病菌传播给人类。
// 其他可能通过食物导致人体的感染
阿米巴原虫病主要通过摄入受污染的水和食物引起,而弓形虫病则是通过食用生或未煮熟的肉类传播。当寄生虫包囊进入人体胃部,胃酸作用下释放,通过肠粘膜传入肝脏和淋巴结。
蛲虫感染是一种通过食物传播的寄生虫病,在全球范围内普遍存在,儿童的感染率高于成人。其他如带虫病和钩虫感染也常由不良营养引起。
注:由于病原体可能具有抗生素耐药性,这给治疗带来了挑战。
1968年,世界卫生组织报告就指出,感染可能会加剧人类营养不良,这种现象被称为协同作用。感染通常会对人的营养状态产生负面影响,从而导致营养不良,反过来又可能加重感染。
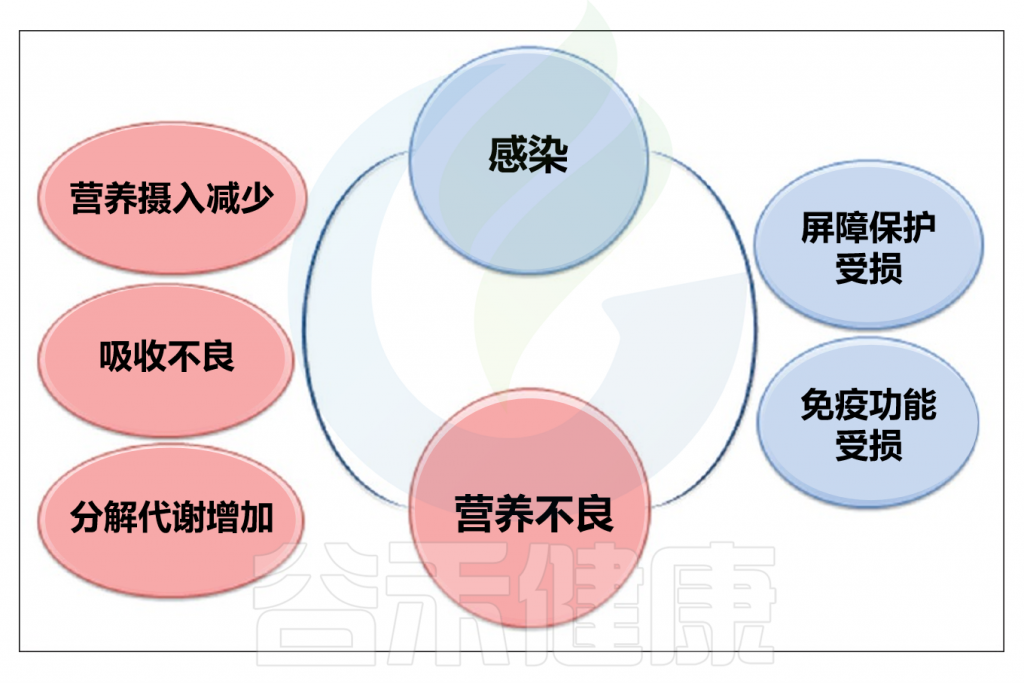
// 感染期间代谢和吸收功能会被削弱
多种因素可能削弱人体对抗感染的能力并引发营养不良。例如,厌食可能导致营养不良,从而削弱免疫系统。某些传统行为也会加剧营养不良和感染问题,如在一些文化中,发烧或腹泻的人被禁止进食。肠道感染可能导致肠道吸收功能降低,蛋白质、碳水化合物和脂肪的吸收量可能分别减少43%、42%和72%,具体数值取决于感染类型。
感染期间,如蛋白质丢失等代谢损伤会增加膳食蛋白质的需求。脂质和碳水化合物的代谢紊乱(如脂肪酸自身代谢紊乱、酮体和甘油三酯的变化)在各种感染中可见。此外,感染期间,通过糖异生途径,氨基酸可转化为葡萄糖。在呼吸道感染期间,血液中的维生素A浓度可能降低,肝炎、急性扁桃体炎、类风湿性关节炎等疾病也会降低血清维生素A浓度。
// 感染时体内许多营养素过低
感染时,血液中维生素C浓度降低,而尿液中维生素C浓度增加,即使是接种过麻疹和天花疫苗的人也会出现。感染后,体内维生素B2(核黄素)含量会减少,这种减少具有统计学意义。
铁是感染期间体内减少的另一种营养素,铁的有效利用有助于降低病原体活性并治疗感染。锌和铜是感染时浓度可能降低的其他元素,研究显示感染中铜和锌的平衡呈负值,尽管血液中铜浓度可能增加,但感染者体内铜水平可能显著降低。
有人说,营养不良会增加感染的风险,那我尽量多吃行不行,其实这也是不可取的。
// 暴饮暴食会降低抗感染能力
暴饮暴食可能会对人体的免疫系统造成负面影响,从而降低抗感染的能力。当人体摄入过量的食物,尤其是高脂肪、高糖的食物时,可能会导致炎症反应增强,肠道微生物失衡,这些都可能削弱身体的免疫功能。
因此,暴饮暴食不仅对健康有害,还可能增加感染的风险,包括消化系统的感染如胃肠炎等。合理的饮食习惯和适量的食物摄入对维护免疫系统和预防感染至关重要。
此外,肥胖的人有患糖尿病的潜力,所有糖尿病人都对感染敏感。一些研究还表明,超重的人患呼吸道感染的风险更大。
炎症和感染之间存在密切的关系,炎症通常是身体对感染的一种防御反应。当病原体如细菌、病毒或寄生虫侵入人体时,免疫系统会激活,产生炎症反应以抵抗感染。这种反应包括血液中的白细胞和其他免疫分子到达感染部位,以消灭病原体。
人类肠道微生物群的组成表现出很大的个体差异。而感染和肠道炎症可导致肠道微生物群组成发生改变,称为生态失调。
关于微生物群如何参与肠道炎症发病机制,人们提出了不同的理论:
(1)导致粘膜屏障功能缺陷(例如粘液层、先天杀伤、抗菌肽)的突变涉及共生细菌的过度易位和促炎信号的触发;
(2)宿主免疫调节异常会引起针对内在共生菌的过度免疫反应;
(3)不明病原体的存在会导致疾病的诱发;
(4)失调的微生物群,其特征是“有益”和“潜在有害”共生细菌之间的不平衡,是疾病的触发因素或驱动因素。
慢性结肠炎或肠道病原体感染过程中的炎症可能会破坏正常的微生物群组成,诱发生态失调,并有利于病原体和共生菌的过度生长,并增加毒力潜力。因此,菌群失调不仅被认为是肠道炎症的原因,而且也是肠道炎症的结果。
炎症相关的菌群失调有哪些特点?越来越多的证据表明,感染病原体导致肠道微生物群落的扰动可能会助长丰度较低的有害细菌大量繁殖,从而进一步加剧肠道炎症。
这些研究使用分子、独立于培养的技术,如16S rRNA 基因测序和宏基因组学。
事实上,远端肠道的生态失调通常以特定专性厌氧革兰氏阳性菌(如瘤胃球菌科、毛螺菌科)的丰度降低,同时兼性厌氧菌(如肠球菌和链球菌)以及革兰氏阴性变形菌(特别是肠杆菌科成员)也随之增加。
已提出将人类肠道中丰富的丁酸盐生产菌——普氏栖粪杆菌(F. prausnitzii)的减少作为活动性疾病的微生物标志物。
// 肠杆菌的大量增加可能是肠道炎症的一个重要标志物
肠杆菌科(Enterobacteriaceae)是革兰氏阴性兼性厌氧菌的一个大家族,由于它们对从上皮屏障扩散的氧气具有相对较高的耐受性,因此通常位于靠近肠道上皮的位置。事实上,肠杆菌科仅占远端肠道微生物群落的一小部分,大约为0.1%。然而,它们在各种肠道炎症环境中过度生长,例如炎症性肠病、乳糜泻和结肠癌。
肠道炎症是由病原体感染后产生的,炎症引起的环境和营养变化可能赋予肠杆菌科细菌生长优势。例如在克罗恩病(CD)和溃疡性结肠炎(UC)(炎症性肠病的两种主要形式)患者中观察到肠杆菌科细菌(包括粘附性侵袭性大肠杆菌)的患病率增加。
// 许多肠道病原体利用炎症环境来促进自身生长
许多肠道病原体能够利用炎症反应来谋取自身利益。在健康的肠道中,复杂的厌氧微生物群有效地阻止主要人类肠道病原体的定植和感染。这种“定植抵抗”在肠道炎症存在时会减弱,从而使病原体过度生长。
一个典型的例子是啮齿类柠檬酸杆菌(Citrobacter rodentium),一种引起鼠类传染性结肠增生的病原体;空肠弯曲杆菌;以及引起人类小肠结肠炎的鼠伤寒沙门菌(S. Typhimurium)。
许多研究已经表明,其他病原体如肺炎克雷伯菌、奇异变形杆菌、霍乱弧菌、艰难梭菌和肠球菌属也可能从肠道炎症环境中获益。因此,肠道中的炎症环境能够改变肠道病原体及其相关共生物种的存活、附着或生长情况。
细菌转录组的分析揭示了炎症对微生物功能及其在炎症环境中生存能力的影响。
// 病原菌粘附能力的增强使之持续存在并诱导肠道炎症
粘附性侵袭性大肠杆菌(AIEC)能够通过常见的1型菌毛粘附素FimH粘附到回肠肠上皮细胞,并识别在克罗恩病(CD)回肠上皮细胞上异常表达的癌胚抗原相关细胞粘附分子6(CEACAM6)。
最近的DNA序列分析表明,AIEC菌株主要表达带有新近氨基酸突变的FimH。这些新突变显著增强了AIEC对表达CEACAM的肠上皮细胞的粘附能力,使其能在遗传易感宿主中持续存在并诱导肠道炎症。
// 在不同炎症条件下表达特定的蛋白来促进生存
在另一项研究中,分析了从IBD和非IBD儿科患者中分离的粘膜相关大肠杆菌菌株的FimH基因突变模式,发现了每种大肠杆菌特征(即状态、门群和粘附类别)的不同FimH突变模式。溃疡性结肠炎(UC)患者的大肠杆菌菌株显示出突变数量增加,而克罗恩病(CD)患者的分离株显示出突变率增加,但出现了不同的FimH突变。
这些结果表明,在特定的选择压力下,FimH蛋白会发生选择性氨基酸突变以维持细菌的生存,并暗示大肠杆菌在不同炎症条件下(如CD和UC)采用独特的生存策略。
因此,可以想象,炎症环境可能会选择表达特定的微生物蛋白,从而促进细菌存活并进一步维持炎症。
许多文献已经提出了导致发炎肠道中一些有害细菌大量繁殖的机制,包括营养变化、粘蛋白利用、抗菌剂的产生、无氧/有氧呼吸和金属利用。我们这里主要以肠道炎症中的标志物种肠杆菌(Enterobacteriaceae)为例来介绍。
// 炎症下的营养变化使病原菌更具竞争优势
居住在远端肠道的微生物群落竞争有限的食源性碳水化合物或宿主粘液源性聚糖。因此,饮食对肠道微生物群的组成起着关键作用,饮食的变化可能导致肠道微生物群落结构的扰动。
在健康肠道中,专性厌氧梭菌和拟杆菌仍然保持对兼性厌氧肠杆菌科的主导地位。在正常情况下,梭状芽胞杆菌和拟杆菌利用糖苷水解酶分解复杂的碳水化合物,并通过结合蛋白质增加其表面的碳水化合物浓度,最终通过主动转运系统将碳水化合物转运穿过梭状芽胞杆菌的细胞质膜和拟杆菌的外膜。相比之下,肠杆菌科因缺乏糖苷水解酶,其分解复杂碳水化合物的能力较差,只能通过外膜扩散通道被动运输寡糖。
因此,在健康状态下肠杆菌科细菌在与专性厌氧菌竞争高能营养物质时处于劣势,这种竞争性生长劣势解释了健康远端肠道中梭状芽胞杆菌和拟杆菌对肠杆菌科细菌的优势。
而在炎症过程中,肠上皮损伤导致死亡上皮细胞脱落增加,增强了上皮细胞膜衍生磷脂(如磷脂酰胆碱和磷脂酰乙醇胺)的可用性。特别是,乙醇胺可被变形菌门中的某些细菌及病原菌(如沙门氏菌和假单胞菌)作为唯一的碳或氮源利用。这种利用乙醇胺的能力有助于这些细菌在肠道中成功定植并维持其致病机制。
// 粘蛋白的分解促进发炎肠道中病原菌的定植
肠杆菌科细菌在发炎肠道中扩张的另一个机制是利用粘蛋白。粘液层覆盖肠上皮,分为两层;外层可移动,被细菌定殖,通常限制共生菌的定殖,而内层牢固地附着在上皮上,基本上无细菌。
分泌的凝胶形成粘蛋白MUC2是人结肠粘液的主要成分。值得注意的是,MUC2缺陷小鼠表现出细菌对表面上皮的粘附增强、肠道通透性增加以及发生自发性或DSS诱导的结肠炎和结直肠癌的易感性增加。
最近的一篇论文强调了粘蛋白衍生的唾液酸在DSS治疗诱导小鼠肠道炎症期间促进肠杆菌科细菌扩张的作用。唾液酸是粘蛋白中的主要碳水化合物之一,可以被无法从头合成这些糖的细菌(如大肠杆菌)摄取,并掺入细菌荚膜和脂寡糖中。
此外,鼠伤寒沙门氏菌和艰难梭菌在肠道内扩张期间,采用了一种常见策略来分解代谢微生物群释放的粘膜糖,如岩藻糖和唾液酸。这些观察结果表明,唾液酸的分解代谢可能为发炎肠道中肠杆菌科细菌的生长提供优势。
// 肠杆菌产生大肠杆菌素来抑制其他细菌
肠杆菌科细菌还可以通过产生抗菌分子来战胜其他细菌,更利于自身在肠道中的繁殖。例如,大肠杆菌素是由某些大肠杆菌菌株产生的细菌素,对系统发育上的近亲致命。在发炎肠道中,大肠杆菌素Ib(col1B)的产生赋予鼠伤寒沙门氏菌相对于敏感大肠杆菌菌株的竞争优势。
col1B的表达受到低铁可用性和SOS反应的正向调节,这两种情况通常由中性粒细胞募集和氧化应激诱导的DNA损伤在发炎肠道中引发。
因此,肠道中的炎症环境似乎创造了一种有利的条件,可以增强大肠杆菌素的作用,大肠杆菌素作为适应因素,为肠杆菌科细菌的大量繁殖提供竞争性生长优势。
// 肠杆菌科的呼吸灵活性使其在炎症条件下更好地生长
导致肠杆菌科细菌在发炎的远端肠道中扩张的进一步机制是宿主在这种基本上厌氧的环境中诱导的生长条件的变化。
炎症期间血流量和血红蛋白升高而产生的高水平氧气,可以为兼性厌氧菌(如肠杆菌科)提供比专性厌氧菌(如梭菌属和拟杆菌属)更有利的生长优势。肠道炎症期间产生的新呼吸电子受体可能通过无氧呼吸(包括硝酸盐呼吸)支持细菌生长。
已经证明硝酸盐是作为宿主炎症反应的副产物而产生的。这种源自宿主的硝酸盐的富集可以为肠杆菌科(例如大肠杆菌和鼠伤寒沙门氏菌)带来适应性优势,因为编码硝酸还原酶的基因存在于大多数肠杆菌科细菌中,但在属于梭菌属和拟杆菌属的专性厌氧菌中基本上不存在。
由宿主炎症反应产生的活性氧(ROS)可以与内源性硫化合物(即硫代硫酸盐)反应,产生一种新的呼吸电子受体,称为四硫酸盐。这种新产生的电子受体为伤寒沙门氏菌提供了选择性生长优势,而不是发炎肠道中竞争的发酵肠道微生物。这些观察结果表明,病原体可以利用宿主反应来超越肠道微生物群。
肠杆菌科的呼吸灵活性使它们能够对肠道内不同的氧气供应量做出反应。例如,在没有氧气的情况下,大肠杆菌可以使用硝酸盐、亚硝酸盐、三甲胺-N-氧化物(TMAO)、二甲基亚砜(DMSO)和富马酸盐作为电子受体,而在氧气存在下,大肠杆菌表达使用氧作为电子受体的末端氧化酶。
此外,链霉素治疗导致小鼠体内产生丁酸的共生梭状芽孢杆菌的耗竭,导致丁酸水平降低,上皮氧合升高,伤寒沙门氏菌有氧繁殖。鼠类柠檬酸杆菌(C.rodentium)使用III型分泌系统(T3SS)促进小鼠结肠隐窝增生,这反过来增加了表面上皮的氧化,并促进了C.rodentim在结肠中的有氧扩张。
鼠类柠檬酸杆菌(C.rodentium)感染是常用的模型之一。
// 许多病原体进化出了高亲和力的金属摄取机制
肠杆菌科细菌在肠道炎症中大量繁殖的另一机制是金属获取。铁是宿主和病原菌重要的营养物质,大部分储存在细胞内,使得病原体难以获取。
然而,为了克服这种铁限制,许多病原体已进化出高亲和力的铁摄取机制,与宿主的限制性铁环境竞争。这些机制包括释放铁螯合铁载体、血红素获取系统和转铁蛋白/乳铁蛋白受体。
例如,大肠杆菌能产生肠杆菌素,一种儿茶酚铁载体,有效抑制中性粒细胞的杀菌髓过氧化物酶,使大肠杆菌在发炎肠道中具有明显的生存优势。因此,大肠杆菌释放的铁载体既能获取铁,也能抵御宿主源性氧化应激。
此外,粘附性侵袭性大肠杆菌(AIEC)生长依赖铁,chuA(血红素铁获取)的存在与其在巨噬细胞内持续存在的能力相关。这些结果支持铁载体需氧菌素增强巨噬细胞内存活及AIEC NRG857c (O83:H1)在小鼠肠道中的定植,该菌株是从CD患者回肠分离的AIEC临床菌株。
总体来看,这些研究突显了铁获取在促进发炎肠道中毒性更强的肠杆菌科细菌扩张的关键作用。肠杆菌科细菌也进化出了获取其他金属(如锌和锰)的策略,以利于它们在发炎肠道中的生长。
!
注意
肠道炎症通常会促进毒性更强的肠杆菌科细菌的出现,这些细菌已进化出多种策略来逃避宿主免疫反应、战胜共生细菌,并在发炎的肠道中茁壮成长。
众所周知,营养对肠道微生物群和免疫系统具有显著影响,在健康与疾病的发展中扮演着关键角色。例如,西方饮食通过诱导骨髓祖细胞的表观遗传和转录重编程,与炎症反应的增强有关,这直接影响了多种疾病的发展。
增强对肠道微生物群、宿主反应及其他微生物间关系的理解,为通过营养调节这三者之间的互动提供了可能,帮助维护肠道稳态和抵抗感染。
应考虑到不同的饮食成分,如矿物质、碳水化合物、维生素、脂质和蛋白质,它们具有特定的功能特性,能够以直接或通过微生物组间接的方式影响宿主与病原体的相互作用。在这些营养素之间建立机制联系为影响健康提供了多种可能。
因此,饮食干预应视为一种调节感染风险、预防病原微生物入侵、减轻感染严重程度及支持感染治疗的重要手段。尽管已知多种营养化合物对宿主微生物组和免疫系统有影响,但膳食纤维、益生元和益生菌仍然是研究的热点。
益生元是不易消化的食物成分,通过选择性刺激结肠中一种或有限数量的细菌的生长或活性,对宿主产生有益影响。典型的益生元是人乳低聚糖、菊粉、低聚果糖和低聚半乳糖。
膳食纤维不是典型的益生元,但具有益生元特性,例如,β-葡聚糖、阿拉伯木聚糖、果胶和抗性淀粉。益生元和特定的膳食纤维通过充当发酵底物促进肠道中有益细菌的生长,同时通过生态位排除抑制病原体的生长。
// 益生元与膳食纤维的代谢产物具有抗菌活性有助于预防胃肠道感染
主要发酵产物是短链脂肪酸,如上所述,它对免疫系统具有重大影响,因此可以抑制感染的发展。除短链脂肪酸外,益生元和膳食纤维还可以通过排除和抗菌活性直接预防胃肠道感染。
// 与免疫细胞作用预防感染、并减轻感染后的炎症
此外,益生元和膳食纤维与上皮细胞和免疫细胞的直接相互作用也有助于预防感染。β-葡聚糖和阿拉伯木聚糖等膳食纤维已被证明可以激活CLR dectin-1,这是一种参与诱导训练免疫的重要受体,可增强针对继发感染的免疫反应。
人乳低聚糖、阿拉伯木聚糖和果胶还与Toll 样受体 (TLR)相互作用,从而提高树突状细胞(DC)的功效,通过肠上皮细胞诱导耐受性DC,并保护胃肠道免受过度的TLR信号传导影响,而且还支持解决胃肠道感染后的炎症。
饮食改变与肠道炎症相关的肠道微生物群
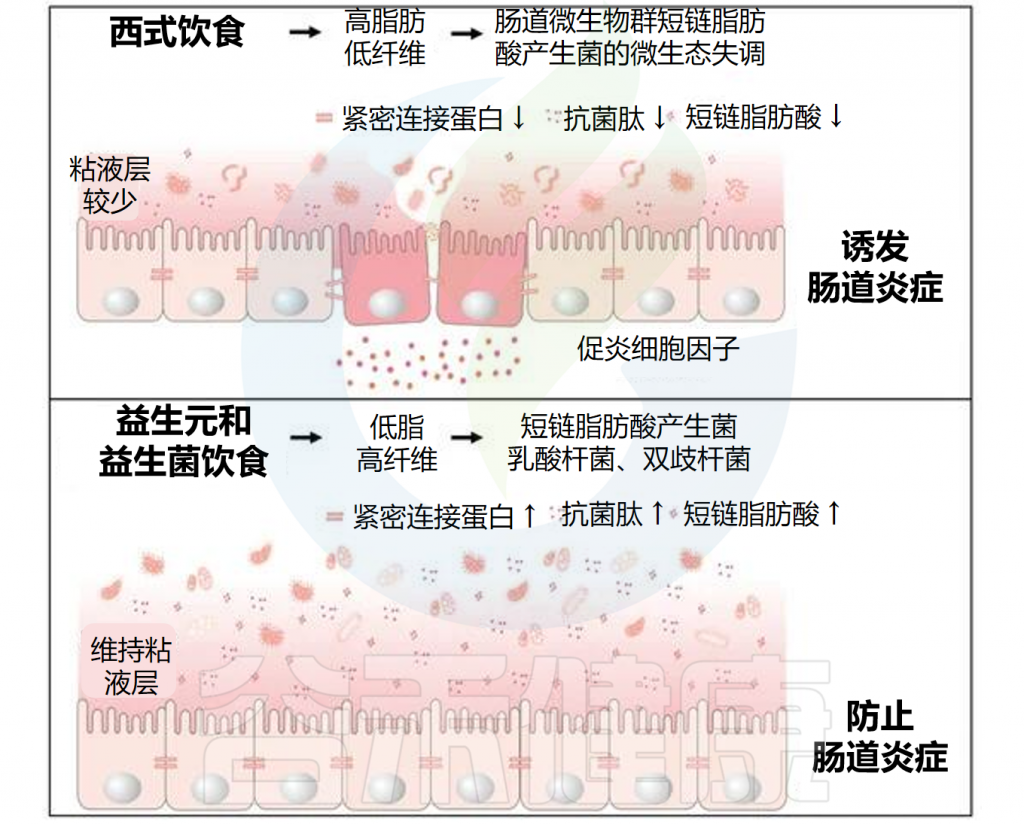
Lobionda S,et al.Microorganisms.2019
益生菌是活细菌,当摄入足够量时,可为宿主提供健康益处。使用益生菌的基本原理主要是基于它们改变肠道微生物群的能力,支持共生菌的生长而不是致病菌的生长。它们能够通过提供短链脂肪酸、维生素和其他通过粘蛋白降解产生的食物来源等代谢物来刺激常驻细菌的生长。
在一项关于益生菌治疗急性腹泻功效的研究中,益生菌通过缩短急性感染性腹泻的持续时间和减少平均排便次数具有明显的积极作用。
许多研究探讨了益生菌在预防和治疗感染方面的潜在作用,包括以下几种机制:
// 竞争性抑制
益生菌可以与病原菌竞争肠道黏膜的结合位点。通过占据这些位点,益生菌阻止病原菌的附着和进一步的入侵。此外,益生菌还能竞争肠道内的营养资源,限制病原菌的生长和繁殖。
// 产生抗菌物质,营造病原菌生存不利的环境
许多益生菌能产生抗菌物质,如细菌素、过氧化氢等。这些物质能直接杀死或抑制病原菌的生长,帮助清除肠道中的感染。
乳酸菌(LAB)可以通过产生抗菌肽(例如细菌素)来防止病原体入侵,抗菌肽可以通过在细菌细胞壁上形成孔并抑制细胞壁合成来消灭病原菌。此外,益生菌通过产生乳酸和乙酸来降低pH值,创造酸性环境,具有抗菌作用,不利于细菌病原体的生长。
// 增强肠道屏障功能
肠道完整性的损害可以解释胃肠道感染的发展。因此,益生菌增强肠道屏障的能力可能会对感染提供一些保护。
据报道,乳酸杆菌通过调节参与紧密连接信号传导的基因表达来改善肠道屏障功能。VSL3(益生元和益生菌的混合物)治疗可促进MUC2的表达和粘液分泌,有助于增强肠道屏障。这种屏障的增强有助于减少病原体的侵袭和内毒素的吸收,从而减轻感染的严重程度。
乳杆菌(尤其是L.reuteri)和动物双歧杆菌亚群,通过乳酸产生促进粘液粘附的蛋白质,称为粘液结合蛋白(MUBs),增强益生菌与宿主之间的相互作用。
// 调节免疫系统
宿主免疫系统和细胞因子谱的调节可能是益生菌有益的主要机制之一。益生菌和宿主免疫系统之间的相互作用在微生物相关分子模式中可见,包括细胞壁成分,如多糖、肽聚糖、脂蛋白和脂磷壁酸,这些成分可被上皮或宿主免疫细胞中表达的模式识别受体 (PRR) 识别。
Toll样受体2(TLR2)是一种跨膜受体,可在多种细胞类型(包括小胶质细胞、单核细胞、巨噬细胞和树突状细胞)中表达,在先天免疫反应中起着重要作用
益生菌还可以刺激肠道免疫系统产生特定的抗体(如IgA),这些抗体能够中和病原体,减少其感染性。
// 调节炎症反应
益生菌能够调节宿主的炎症反应,减少由过度免疫反应引起的组织损伤。它们通过产生抗炎细胞因子(如IL-10)和降低促炎细胞因子(如TNF-α)的水平来实现这一点。
除了单独使用益生元和益生菌外,还有将益生元和益生菌组合成合生元混合物的营养概念。考虑到上述临床研究的局限性,合生元已显示出临床成功,因此有望成为未来的治疗选择。
!
通过营养治疗感染需要注意的
与药物化合物的靶向作用相比,饮食治疗可能更加多因素。个体对营养化合物的反应受到个体遗传特征的影响。例如,炎症基因(如IL-1B、IL-6和TNF-α)中的单核苷酸多态性(SNP)会导致不同的炎症反应,这可以部分解释观察到的对营养化合物反应性的差异。
此外,越来越多的证据表明,每个人的肠道微生物群都是独一无二的,这种多样性使得个体对营养和治疗感染的反应存在显著差异。
研究显示,肠道微生物的组成可以影响营养物质的吸收和代谢,同时也会影响宿主的免疫系统功能。因此,了解个体的肠道微生物组成对于制定个性化的营养和治疗策略至关重要。
通过针对特定肠道微生物群优化的营养干预,可以更有效地预防和治疗各种感染,提高治疗的精准性和效果。这一新兴领域的研究不仅有助于推动精准医疗的发展,同时也为临床实践提供了新的视角和方法。
肠道感染仍然在全世界范围内造成沉重的疾病和经济负担。如何更好的预防和治疗胃肠道感染成了许多百姓和临床工作者关心的问题。
大量研究表明营养不良与感染之间存在双向作用。总体而言,营养影响人体免疫系统发育,而某些因素会导致营养不良并削弱人体抵抗感染的能力。包括厌食、肠道吸收减少、代谢损伤、脂质和碳水化合物代谢紊乱、维生素、铁、锌、铜减少。需要注意的是暴饮暴食可能也会增加感染风险。
与此同时,肠道微生物群在抵抗肠道病原体定植、生长和促进宿主免疫系统成熟以及影响宿主代谢方面发挥着不可或缺的作用。一些人类疾病被确定与特定微生物群的改变具有相关性或因果关系。
越来越多的人类疾病被确定与特定微生物群的改变具有相关性或因果关系。肠道中的炎症免疫反应(炎症性肠病和病原体诱导的)也可以直接塑造微生物群的组成并引发菌群失调。这一发现具有深远的影响。它从根本上改变了我们对人类肠道炎症发病机制的理解。
肠道微生物群在帮助宿主应对全身感染方面可能还有许多其他功能尚未被发现。越来越多的证据表明肠道菌群失调与慢性肠道炎症相关疾病的表现有关,尤其是炎症性肠病。抑制肠道炎症、利用益生菌或调整营养变化(如益生元和金属)可能是未来限制肠杆菌等致病细菌大量繁殖的潜在方法。
主要参考文献
Stecher B. The Roles of Inflammation, Nutrient Availability and the Commensal Microbiota in Enteric Pathogen Infection. Microbiol Spectr. 2015 Jun;3(3).
Pike VL, Lythgoe KA, King KC. On the diverse and opposing effects of nutrition on pathogen virulence. Proc Biol Sci. 2019 Jul 10;286(1906):20191220.
Cristofori F, Dargenio VN, Dargenio C, Miniello VL, Barone M, Francavilla R. Anti-Inflammatory and Immunomodulatory Effects of Probiotics in Gut Inflammation: A Door to the Body. Front Immunol. 2021 Feb 26;12:578386.
Ducarmon QR, Zwittink RD, Hornung BVH, van Schaik W, Young VB, Kuijper EJ. Gut Microbiota and Colonization Resistance against Bacterial Enteric Infection. Microbiol Mol Biol Rev. 2019 Jun 5;83(3):e00007-19.
Wiertsema SP, van Bergenhenegouwen J, Garssen J, Knippels LMJ. The Interplay between the Gut Microbiome and the Immune System in the Context of Infectious Diseases throughout Life and the Role of Nutrition in Optimizing Treatment Strategies. Nutrients. 2021 Mar 9;13(3):886.
Lobionda S, Sittipo P, Kwon HY, Lee YK. The Role of Gut Microbiota in Intestinal Inflammation with Respect to Diet and Extrinsic Stressors. Microorganisms. 2019 Aug 19;7(8):271.
Farhadi, Sedigheh1; Ovchinnikov, Roman S.2,. The Relationship between Nutrition and Infectious Diseases: A Review. Biomedical and Biotechnology Research Journal (BBRJ) 2(3):p 168-172, Jul–Sep 2018.
Cherrak Y, Flaugnatti N, Durand E, Journet L, Cascales E. Structure and Activity of the Type VI Secretion System. Microbiol Spectr. 2019 Jul;7(4).
Pickard JM, Zeng MY, Caruso R, Núñez G. Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease. Immunol Rev. 2017 Sep;279(1):70-89.

谷禾健康

拟杆菌门细菌是革兰氏阴性菌的代表,具有外膜、肽聚糖层和细胞质膜。它们无氧呼吸的主要副产物是乙酸、异戊酸和琥珀酸。是最耐氧的厌氧菌之一。
参与人体结肠中许多重要的代谢活动包括碳水化合物的发酵、含氮物质的利用以及胆汁酸和其他类固醇的生物转化。大多数肠道细菌是糖酵解的,这意味着它们通过碳水化合物分子的水解获得碳和能量。
多糖而不是单糖是拟杆菌的主要能量来源,拟杆菌是肠道生态系统中非常成功的竞争者,表现出相当大的营养灵活性和对宿主和肠道环境施加的压力做出反应的能力。
很难说肠道拟杆菌是否对宿主产生负面或正面影响。拟杆菌能够通过预防可能定植和感染肠道的潜在病原体感染来使宿主受益。但是,拟杆菌衍生的代谢物——羧酸和单糖也可能对宿主产生损害。例如,肠出血性大肠杆菌(EHEC) 通过感觉拟杆菌属作为标志性生物体,沿着胃肠道寻找感染生态位。
特别是,对拟杆菌衍生的琥珀酸和岩藻糖的检测会启动转录级联,导致肠出血性大肠杆菌代谢的转录重编程和毒力因子的诱导。
在发炎的肠道中,拟杆菌衍生的短链脂肪酸(SCFA)不再发挥保护功能,而是可能被兼性厌氧病原体利用作为无氧呼吸的碳源。类似的,在抗生素引起的生态失调时,通过拟杆菌属的代谢活动从复杂多糖中释放出琥珀酸和单糖,交叉喂养肠杆菌和艰难梭菌。
本文再次聚焦拟杆菌门,拟杆菌属,及其代表菌种多形拟杆菌(B.thetaiotaomicron),以多形拟杆菌讲述了一个基于动态环境下共生菌群或菌种与其他菌互作及其生存进化的复杂故事范例。请注意拟杆菌,不仅交叉喂养病原体,而且在健康的肠道环境中交叉喂养益生菌物种,这有助于抵抗定植。
“
拟杆菌属细菌属于人类肠道微生物群中最普遍和最丰富的成员。虽然偶尔充当肠道外的病原体,但这些细菌被认为是结肠腔和粘膜层的共生定殖者,并且长期以来已知可提供针对肠道病原体的定殖抵抗力。然而,基于粪便微生物组学的相关性研究经常会得出关于它们对宿主健康与疾病的贡献相互矛盾的结果,尤其在肠道感染中的作用比预期的更加微妙。
我们结合谷禾大量检测实践,越来越认识到拟杆菌介导的定植抗性背后的复制和矛盾性,以及不同肠道病原体利用它们来建立感染的可能性。
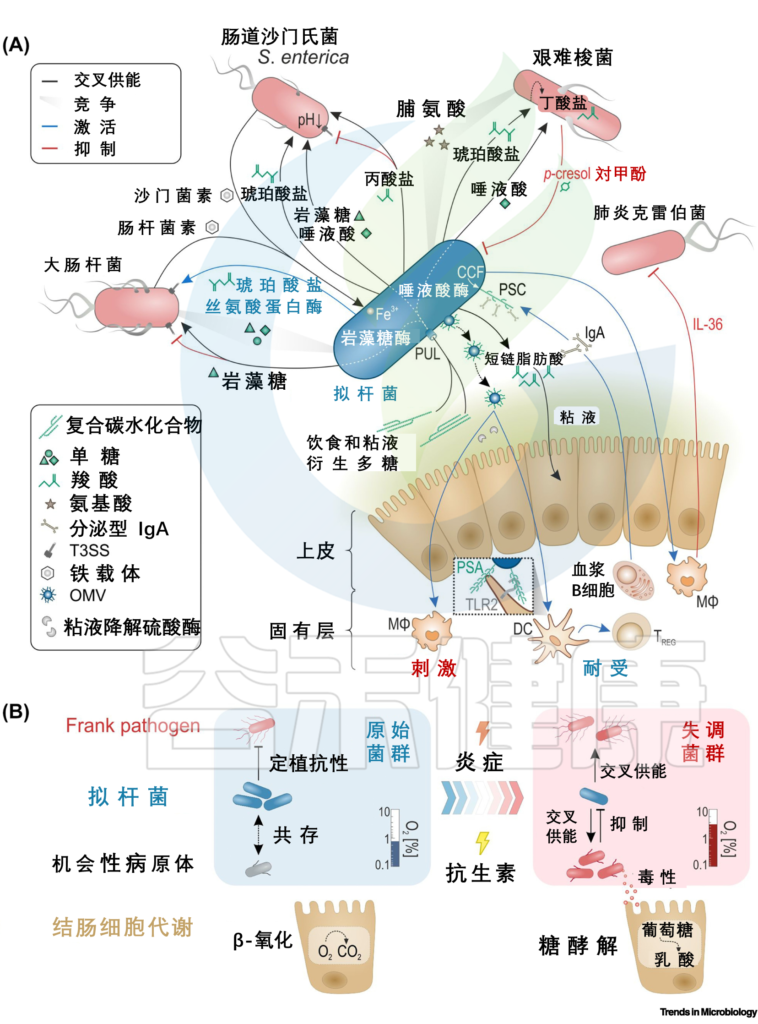
DOI: 10.1016/j.tim.2021.11.009
A) 互利拟杆菌属的相互作用。与肠粘膜以及与直接病原体肠出血性大肠杆菌(EHEC)和鼠伤寒沙门氏菌以及机会性病原体艰难梭菌和肺炎克雷伯菌有关。根据最近的文献汇编。肠道拟杆菌属也可能相互影响,例如,通过分泌的抗菌蛋白或通过某种“共享物”。
(B)通过病原体诱导(炎症)或治疗诱导(抗生素)破坏微生物群滋养免疫力,从原始微生物群向生态失调转变的简单化观点。
结肠细胞线粒体中的β-氧化会消耗氧气,造成管腔厌氧,而糖酵解则不消耗氧气,从而导致上皮氧合增加。拟杆菌属,不仅交叉喂养病原体,还在健康的肠道环境中交叉喂养益生菌物种,这有助于抵抗定植。
“
多形拟杆菌(Bacteroides thetaiotaomicron,B. thetaiotaomicron)是成人肠道的主要组成部分,已被用作研究人类细菌共生的有用模型。
降解植物多糖
它对人类的代谢不可忽缺功能是降解植物多糖,这是人类肠道非常重要的能力。此外,在产后母乳和富含植物淀粉的饮食之间的过渡过程中,这一点也有非常重要。
由于多形拟杆菌感应潘氏细胞发出微生物信号,它可以刺激肠道内的血管生成(从现有血管中生长出新血管)。B. thetaiotaomicron 通过为其他微生物帮助处理的营养物质提供足够的吸收能力来使其宿主受益。
塑造肠道粘膜屏障
多形拟杆菌介导的肠道内另一个出生后发育过程是肠粘膜屏障的形成,它通过调节物种特异性蛋白质抗生素的表达来帮助保护宿主免受病原体入侵。B. thetaiotaomicron 中存在的环境感知“调节装置”允许适应性食物寻找,从而稳定食物网,进而有利于群落的稳定和长寿。这种适应性“觅食”的能力是生物技术感兴趣的领域。
有异常大的“糖生物组”
多形拟杆菌是人类肠道远端的厌氧共生体,具有异常大的糖生物组,参与多糖获取和代谢的基因库。当膳食多糖受到限制时,这种糖生物组使 B. thetaiotaomicron 能够转向宿主多糖。B. thetaiotaomicron 不仅可以水解宿主衍生的聚糖,还可以主动确定肠道上皮细胞产生的聚糖的类型。
促进微生态系统稳定
B. thetaiotaomicron 诱导宿主衍生的聚糖可能具有适应性功能,为自身创造一个其他亲糖生物可以利用的生态位,从而促进生态系统的稳定性和功能多样性。这些独特的特征促使 B. thetaiotaomicron 被定性为关键物种。
B. thetaiotaomicron 可能稳定微生物生态以实现健康的宿主-微生物群关系的另一种机制涉及其能够诱导抗菌肽血管生成素,从而杀死机会性或致病性生物体,与此同时不能杀死 B. thetaiotaomicron 或其他共生体。
抵抗炎症变化
此外,B. thetaiotaomicron 通过过氧化物酶体增殖物激活受体-γ (PPARγ) 依赖性核因子-κB 亚基 p65 的核输出来抑制促炎基因的转录,从而潜在地抵抗可能破坏共生微生物群稳定的炎症变化。
例如,细胞毒性 T 淋巴细胞蛋白 4 (CTLA4) 阻断免疫疗法依赖于特定拟杆菌属物种(多形拟杆菌和脆弱拟杆菌)。这些结果表明,深入了解对拟杆菌类群的肠道微生物群特定成员的免疫反应,可能有助于为癌症治疗奠定基础。
“
根据微生物群滋养免疫概念,宿主应用栖息地过滤器来主动塑造其微生物群并维持互利共生状态。其中一种栖息地过滤器是上皮缺氧(关于这个详细的介绍我们在氧气与肠道共生菌那篇文章里讲过,详见:肠道漏氧会发生什么,健康的肠道是什么样?),这是成熟结肠细胞中线粒体β-氧化的结果。
粘膜表面的低氧浓度促进了专性厌氧细菌(包括拟杆菌属和一些产丁酸菌)的优势。反过来,这些细菌积极调节其肠道环境并影响宿主生理(例如,负责的免疫调节分子至少部分地通过外膜囊泡细菌表面衍生的双层球体,可以通过粘液屏障扩散)递送至真核靶细胞。
确保“正确的微生物”做“正确的事”
宿主栖息地过滤器不仅确保“正确”的微生物保留在肠道中,而且还确保它们做“正确的事情”。例如,血浆 B 细胞产生针对具有促炎潜力的拟杆菌表面结构的免疫球蛋白(主要是 IgA) ;这些免疫球蛋白减轻粘膜炎症,维持细菌分类群的多样性(关于IgA调节菌群多样性和菌定植的详细介绍可以参考我们以前的文章,详见对抗病原菌,帮助共生菌定植的“重要开关”),并调节拟杆菌代谢。
有趣的是,最近的发现表明某些拟杆菌属,增选 IgA 反应。例如,脆弱拟杆菌有意表达 IgA 反应性表面多糖C,使其被抗体修饰,从而改善粘液粘附,使细菌能够进入确定的空间生态位并促进与宿主的长期共生。
“
枢纽
拟杆菌属对宿主生态位的抢占、免疫系统的教育以及“益生菌”细菌的交叉喂养提供了针对病原入侵者的定植抵抗力。此外,拟杆菌与病原体竞争宿主来源的氨基酸(特别是脯氨酸和羟脯氨酸)和单糖(包括核糖、岩藻糖、阿拉伯糖、鼠李糖和果糖)并产生短链脂肪酸(SCFA),可以直接对抗发病机制。
从机制上讲,后者最好是丙酸盐,其质子化形式扩散到肠沙门氏菌(可能还有其他肠杆菌科)中,酸化受体的细胞质并减缓生长。此外,肠道拟杆菌属产生共生定植因子(CCF),即物种特异性碳水化合物利用系统,以强化肠道免疫屏障,保护宿主免受肺炎克雷伯菌定植和传播。
然而,拟杆菌衍生的代谢物——羧酸和单糖也可能对宿主产生损害。例如,肠出血性大肠杆菌(EHEC) 通过感觉拟杆菌属作为标志性生物体,沿着胃肠道寻找感染生态位。
特别是,对拟杆菌衍生的琥珀酸和岩藻糖的检测会启动转录级联,导致肠出血性大肠杆菌代谢的转录重编程和毒力因子的诱导。
肠出血性大肠杆菌(EHEC) 和其他病原体分泌的效应蛋白引起上皮炎症,在此过程中结肠细胞的能量代谢从β-氧化转向无氧糖酵解。这破坏了宿主栖息地过滤器,并开辟了新的生态位,这些生态位优先由肠杆菌科成员填充。
在发炎的肠道中,拟杆菌衍生的短链脂肪酸(SCFA)不再发挥保护功能,而是可能被兼性厌氧病原体利用作为无氧呼吸的碳源。类似的,在抗生素引起的生态失调时,通过拟杆菌属的代谢活动从复杂多糖中释放出琥珀酸和单糖,交叉喂养肠杆菌和艰难梭菌。
反过来,艰难梭菌释放抑菌化合物来抑制革兰氏阴性竞争者(包括拟杆菌属)的生长。然而,拟杆菌属已经进化出适应与肠道发炎、菌群失调相关的新环境的机制。例如,多形拟杆菌,利用其“异铁载体利用系统”(由xusABC_操纵子编码)来劫持沙门氏菌和大肠杆菌。大肠杆菌铁螯合剂,使其在结肠炎期间能够接触到这种必需的辅助因子。
拟杆菌属对于肠道感染来说是一把双刃剑
在提供针对病原体入侵的初始定植抵抗力的同时,它们可以被相同的病原体利用作为炎症和抗生素治疗期间的“利基”指标和资源提供者。
截至目前,我们还不完全了解除了感染剂量之外还有哪些因素会导致这些接触的结果对宿主有利或有害,但随着微生物分子组学发展包括转录组学领域的最新进展可能会成为这个任务中的改变者。
“
以多形拟杆菌为例,因为多形拟杆菌是研究最广泛的人类肠道共生体之一。2001有研究就使用与多形拟杆菌单一关联的无菌小鼠,并通过DNA 微阵列分析全局宿主转录反应。发现多形拟杆菌定植后上调的宿主基因包括:
这些基因共同证明共生细菌可以帮助强化宿主上皮屏障。受与多形拟杆菌单关联影响的其他宿主基因涉及出生后成熟(腺苷脱氨酶)、营养吸收和代谢(SGLT-1、辅脂肪酶和 L-FABP)以及血管生成处理(血管生成素-3)的调节。这项研究证明了单一物种的共生生物如何恢复以前无菌宿主的许多结构、代谢和发育缺陷。
随着B. thetaiotaomicron基因组被测序了解后,人们对驱动这种共生关系的分子机制有了更深入的了解。B. thetaiotaomicron含有 4,779 个成员的蛋白质组,缺乏与已知粘附素同源的蛋白质。然而,它已经进化出两种外膜多糖结合蛋白(SusC和SusD)的163个旁系同源物、226个预测的糖苷水解酶和15个多糖裂解酶。
B.thetaiotaomicron的全基因组转录分析揭示,与在由基本培养基组成的肉汤中生长相比,当把B.thetaiotaomicron引入无菌小鼠肠道时,B.thetaiotaomicron表达不同的碳水化合物和葡萄糖(MM-G)利用基因。
通过比较采用标准富含多糖的食物饮食或缺乏可发酵多糖的简单糖饮食的无菌小鼠的细菌基因表达,发现富含多糖的饮食诱导了碳水化合物利用基因(如木聚糖酶、阿拉伯糖苷酶和果胶酸裂合酶)的上调,而仅葡萄糖和蔗糖饮食则导致参与从粘液聚糖中回收碳水化合物的不同基因子集的表达增加,如己糖胺酶、α-岩藻糖苷酶和唾液酸酶。这些基因还可以介导细菌附着于粘液聚糖,以避免细菌从肠道中流失。
在荚膜多糖合成(CPS)位点中发现了体外与体内生长期间以及饮食控制过程中另一个值得注意的基因表达变化,这表明B. thetaiotaomicron能够改变其表面碳水化合物,作为宿主免疫逃避策略改变聚糖觅食行为。
B. thetaiotaomicron讲述了一个基于营养代谢的宿主-细菌互利共生的复杂故事范例。具有从宿主无法消化的营养物质回收能量的能力为细菌维持在宿主肠道中的驻留提供了进化驱动力。尽管缺乏粘附细胞器,B. thetaiotaomicron可以通过其外膜聚糖结合蛋白的全部介导将自身附着到营养支架(食物颗粒、粘液层和脱落的上皮细胞 )上。
由于其灵活的聚糖觅食能力,当膳食多糖变得稀缺时,B.thetaiotamicron通过转向宿主多糖来赋予肠道生态系统稳定性。这种非常成功的人类肠道共生体已经进化出一个复杂而庞大的基因组,可以针对不断变化的营养环境调动功能多样的适应性反应,从而保证与宿主的永久和互惠关系。
“
铁是许多生物体和细胞的必需营养素和生长限制元素,同时也是促炎剂。在人体内,大多数铁与原卟啉 IX (PPIX) (PPIX) 形成亚铁或三价铁络合物,此处简称为“血红素”,它在 O2和电子的运输和存储中发挥着多种作用,并且在催化作用中。
在检测到入侵病原体后,作为人类和动物先天免疫反应的一部分,促生长铁以血红素和非血红素形式被螯合。因此,环境微生物和病原微生物,包括经过充分研究的假单胞菌属、卟啉单胞菌属和葡萄球菌属成员,都进化出了多种机制来释放和同化血红素和非血红素铁的不同化学物质。
虽然许多兼性病原体大量产生和消耗血红素铁,但大多数胃肠道厌氧菌是血红素营养缺陷型微生物。拟杆菌是许多健康胃肠道菌群中的优势细菌群。其中B. thetaiotaomicron是一种共生血红素营养缺陷型,是该群体的代表,该菌优先使用并最终以血红素形式超积累铁,但是似乎不会从添加非血红素铁中获得进一步的生长益处。
胃肠道微生物组可能拥有足够的铁储备,足以替代人类几天的典型营养铁需求,构成大量的铁储存库和潜在的贫血缓冲剂。生物信息学分析表明,hmu操纵子编码拟杆菌门成员中血红素摄取和代谢的厌氧机制,在拟杆菌门中广泛存在,但仅限于拟杆菌门。
来自该操纵子的基因同样广泛存在于从健康人类收集的宏基因组样本中。因此,我们预计拟杆菌,特别是hmu介导的血红素代谢将构成代表微生物组和宿主从宿主饮食血红素中调动铁的主要机制。这种机制必须是稳健的,因为粪便中检测到的血红素通常归因于宿主衍生的潜血,可以诊断下消化道出血 。
营养研究表明,与典型的植物源性非血红素铁复合物相比,血红素是人类膳食铁的生物利用度更高的来源;然而,即使是血红素铁也不能被宿主完全吸收,这表明它必须与微生物组共享。
拟杆菌门对血红素的优先使用可能使它们在胃肠道环境中具有选择性优势。血红素促进拟杆菌的强劲生长。由于血红素依赖性富马酸还原酶增强了富马酸向琥珀酸的转化,从而发酵葡萄糖。反过来,相对于另一个优势门厚壁菌门的成员,复含血红素密集红肉的宿主饮食与结肠微生物组中更大比例的拟杆菌门相关。
拟杆菌密集的微生物群和红肉饮食都与结肠癌的诱发有关。目前尚不清楚这些宿主病理是否与血红素或卟啉本身的促炎特性有关,它们是否是由微生物组中受血红素刺激的部分的其他代谢活动引起的,还是两者的某种组合。
简而言之,拟杆菌门在共生环境中优先积累血红素,而不是直接促进发病机制,反而可能导致物种失衡(生态失调)以及随后对宿主生态系统的生化破坏。
这些例子说明了肠道病原菌和拟杆菌属之间从稳态到病理学之间复杂的种间相互作用。这也是谷禾健康不断积累和迭代不同人群样本库,以及长期纵向追踪不同人群疾病发生或症状改善以及与微生物群的潜在因果关系的价值所在。通过研究更大、更多样化的人群,检查不同疾病甚至同一疾病亚型内的微生物群组成,我们可以更全面、更准确地了解微生物群反馈及其对健康的影响。
分析肠道微生物群不仅仅涉及检测单个细菌种类或属。确定每种细菌的正常阈值需要全面了解大样本全局微生物群落以及种间互作等。
附录:
以下为本门当中比较著名的种属及其所属的纲目
主要参考文献:
Bornet E, Westermann AJ. The ambivalent role of Bacteroides in enteric infections. Trends Microbiol. 2022 Feb;30(2), pp.104-108.
A gut commensal-produced metabolite mediates colonization resistance to Salmonella infection. Cell Host Microbe, 24 (2018), pp. 296-307 e7
Commensal Bacteroidetes protect against Klebsiella pneumoniae colonization and transmission through IL-36 signalling. Nat. Microbiol., 5 (2020), pp. 304-313
Microbiota-liberated host sugars facilitate post-antibiotic expansion of enteric pathogens. Nature, 502 (2013), pp. 96-99