 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

随着国家卫生健康委发布2024版食养指南,以及前几天在上海举办的临床医学与营养食品论坛,越来越多的人开始重视日常膳食的营养与健康。
而说到脂肪,很多人都会“谈脂色变”,想要避免脂肪的摄入,这其实是不正确的。脂肪作为人体必需的基本营养素之一,是不可缺少的。缺乏脂肪会导致人体营养不良、激素失衡,皮肤受损、免疫力下降等一系列问题。
需要明确的是,并非所有脂肪都对健康产生相同的影响,它们之间存在着显著的差异。饱和脂肪和反式脂肪,常见于高加工食品、烘焙食品、油炸食品和一些红肉中,过量摄入这些脂肪可能会导致肥胖、增加心血管疾病和其他健康问题的风险。
而相对优质的不饱和脂肪,对人体健康有着多方面的益处。例如Omega-3脂肪酸能降低血液中的低密度脂蛋白,同时提高高密度脂蛋白水平,从而减少心血管疾病的风险。
2022年底,国家心血管病中心专家委员会心血管代谢医学专业委员会发布了《Omega-3脂肪酸在心血管疾病防治中的作用中国专家共识》,该共识全面、科学地呈现omega-3脂肪酸(高纯度鱼油)在心力衰竭、心肌病、高血压和猝死等多个方面的详细知识,为中国人群的omega-3脂肪酸在预防和治疗心血管疾病中的临床应用提供参考。
此外还具有支持大脑和神经发育、产生抗炎作用、改善认知、抗忧郁、使皮肤更显年轻、调节视网膜健康等作用。
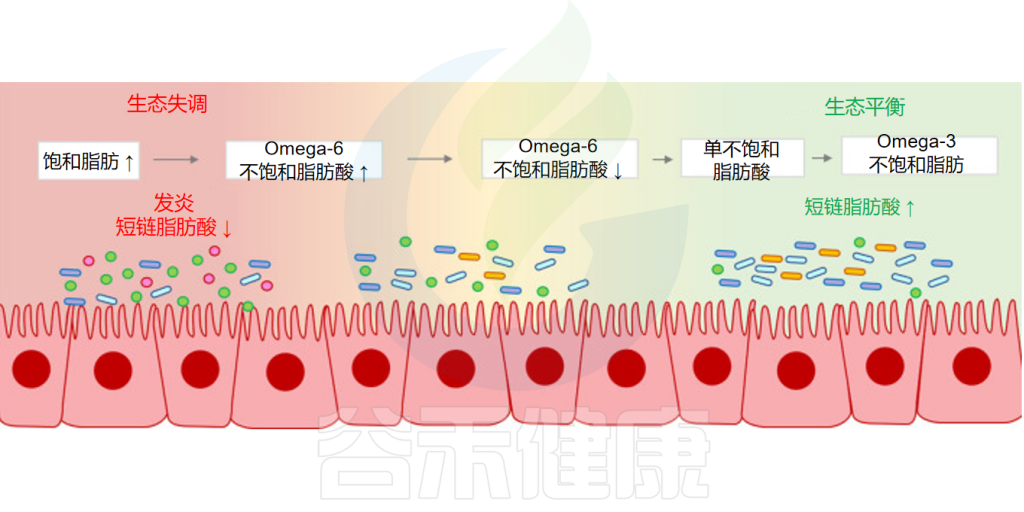
目前的研究认为功效范围从最不健康到最健康:饱和脂肪(SFA)<Omega-6不饱和脂肪酸<单不饱和脂肪酸 (MUFA)<Omega-3不饱和脂肪酸。
特别需要注意的是,人体不饱和脂肪酸Omega-6与Omega-3的比率可能是心血管疾病风险的重要标志。尽管都是人体所必需的重要不饱和脂肪酸,但是在对待炎症方面却展现出了截然不同的作用。Omega-6不饱和脂肪酸促进炎症的发生,引起身体的“失火”;Omega-3不饱和脂肪酸则恰恰相反,缓解并抑制炎症,从而预防重大疾病的发生。
可见他们两者的平衡是非常重要的。这种不平衡可能导致多种疾病,包括血栓形成、炎症、哮喘和炎症性肠病等。
肠道微生物群是我们消化系统中不可或缺的一部分,而不饱和脂肪酸作为一种重要的营养物质,其在消化和吸收的过程中必定有微生物的参与作用。
已经有一些研究发现摄入Omega-3不饱和脂肪酸有助于恢复抗炎肠道微生物群,而健康和多样化的微生物群可以在一定程度上增加Omega-3不饱和脂肪酸的体内转化和代谢。
鉴于不饱和脂肪酸对人体的重要性,以及其作为当前人们关心的重要营养素。本文将以Omega-3脂肪酸为例来讲述这类不饱和脂肪酸对人体的健康益处,可能存在的一些安全隐患。以及主要的饮食来源,日常生活中该如何补充Omega-3不饱和脂肪酸。希望能够在人们日常饮食和临床补充中提供一定的帮助,以此来更好地针对自身情况调节膳食。
我们经常在一些食品或添加剂中听到富含不饱和脂肪酸,那么究竟什么是脂肪酸?什么又是不饱和脂肪酸呢?
脂肪酸是一类含有羧基的脂肪族化合物,通常存在于动植物的脂肪和油中。脂肪酸是构成脂肪分子的基本单元,你可以简单理解为脂肪是由许许多多的脂肪酸分子构成的。
脂肪酸在人体中起着重要作用,包括提供能量、构建细胞膜、合成激素、帮助脂溶性维生素的吸收和保护身体脏器等。
▸ 脂肪酸可分为饱和脂肪酸和不饱和脂肪酸
脂肪酸根据碳氢链饱和与不饱和可分成两类:一类是分子内不带碳碳双键的饱和脂肪酸,如硬脂酸、软脂酸等;另一类是分子内带有一个或几个碳碳双键的不饱和脂肪酸,如亚麻酸、亚油酸、油酸。
饱和脂肪酸通常是固态的,而不饱和脂肪酸则通常是液态的。
饱和脂肪酸(Saturated fatty acid),指不含不饱和双键的脂肪酸。一般来说,动物性脂肪如牛油、猪油比植物性脂肪含饱和脂肪酸多。但也不是绝对的,如椰子油、可可油、棕榈油中也含有丰富的饱和脂肪酸。奶制品(如奶油、奶酪和全脂牛奶)中也有较多的饱和脂肪酸。
一般较常见的饱和脂肪酸有辛酸、癸酸、月桂酸、豆蔻酸、软脂酸、硬脂酸、花生酸等。
▸ 过量食用饱和脂肪酸会增加心血管疾病风险
饱和脂肪酸摄入过多是导致血胆固醇、三酰甘油、低密度脂蛋白胆固醇(LDL-C)升高的主要原因,继发引起动脉管腔狭窄,形成动脉粥样硬化,增加患心血管疾病的风险。
根据世界卫生组织和其他健康机构的建议,应该适度摄入饱和脂肪酸,并将其与不饱和脂肪酸(如单不饱和脂肪酸和多不饱和脂肪酸)相结合,以维持健康的饮食平衡。
不饱和脂肪酸就是指含有不饱和键的脂肪酸,是构成体内脂肪的另一种不可缺少的脂肪酸。根据双键个数的不同,分为单不饱和脂肪酸和多不饱和脂肪酸二种。
▸ 单不饱和脂肪酸
单不饱和脂肪酸(MUFA)是一类含有一个不饱和键的脂肪酸,它们在橄榄油、芥花籽油、花生油等植物油中含量丰富。单不饱和脂肪酸的主要代表是油酸(ω-9脂肪酸),它在橄榄油中的含量可达84%以上。
油酸具有多种健康益处,包括降低低密度脂蛋白(LDL)胆固醇水平,提高高密度脂蛋白(HDL)胆固醇比例,从而有助于预防动脉硬化。此外,单不饱和脂肪酸还具有抗氧化功能、降血糖功能、调节血脂功能和降低胆固醇功能。
▸ 多不饱和脂肪酸
多不饱和脂肪酸(PUFA)指含有两个或两个以上不饱和键的脂肪酸,根据双键的位置及功能又将多不饱和脂肪酸分为Omega-3系列和Omega-6系列。
Omega-3脂肪酸(Ω3)
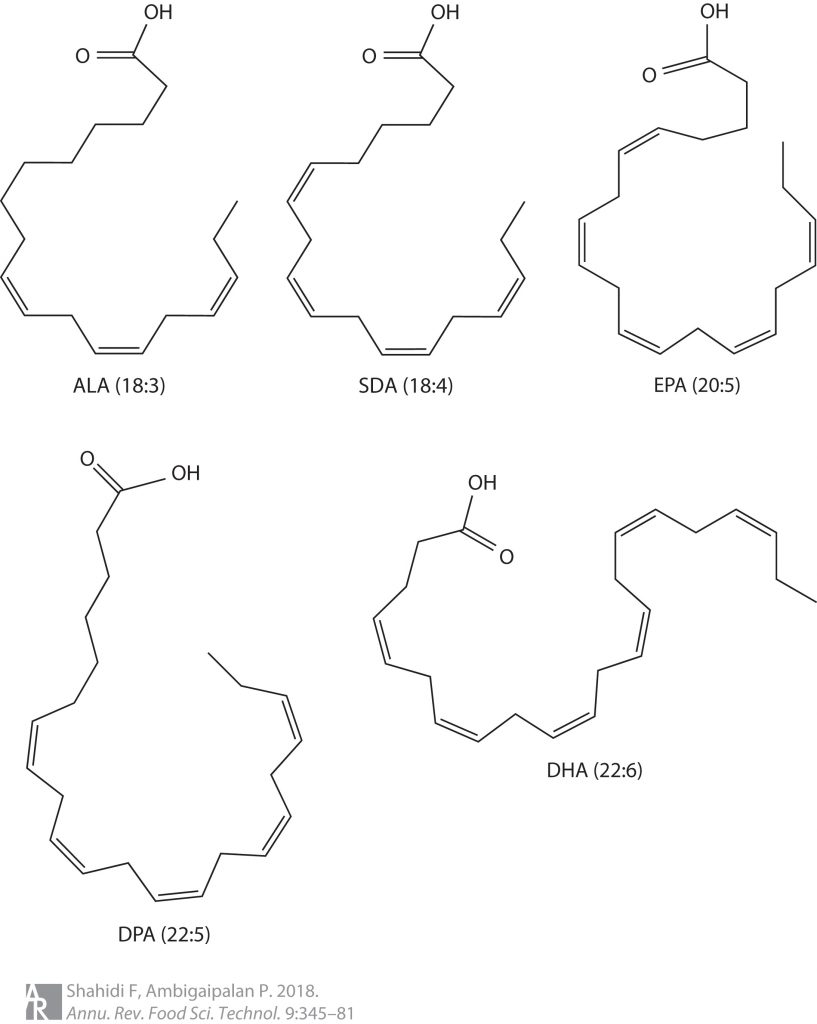
需要注意的是,Omega-3脂肪酸并不单指一种物质,而是一组多不饱和脂肪酸。因其第一个不饱和键位于甲基一端的第3个碳原子上,故名Omega-3。
Omega-3脂肪酸主要有α-亚麻酸(ALA)、十八碳四烯酸(SDA)、二十碳五烯酸(EPA)、二十二碳五烯酸(DPA)和二十二碳六烯酸(DHA)。
注:ALA是Omega-3脂肪酸的母体,可去饱和并延伸形成其他Omega-3脂肪酸。
omega-3多不饱和脂肪酸的化学结构
Omega-3必须靠食物来获取
Omega-3是一种对人体健康非常重要的不饱和脂肪酸,它对心脏健康、大脑发育和炎症反应有着重要作用。
Omega-3不饱和脂肪酸同时也是人体合成各种激素及内生性物质必要的营养素,但人体无法自行合成,因此必须通过饮食来获取。Omega-3主要存在于深海油性鱼类(如三文鱼、鲭鱼、沙丁鱼)和一些植物性食物(如亚麻籽、奇亚籽、核桃)中。
Omega-6脂肪酸(Ω6)
同理,不饱和键位于第六个碳原子上的脂肪酸,则称为Omega-6脂肪酸。Omega-6脂肪酸在人体内也至关重要,胆固醇必须与Omega-6的亚油酸(LA)相结合,才能正常运转和代谢;人脑中的不饱和脂肪酸Omega-6和Omega-3各占一半。
Omega-6不饱和脂肪酸的食物来源非常丰富,玉米、大豆等植物及其加工产品如炒菜离不开的玉米油、大豆油等植物油以及我们常吃的猪肉、牛肉、羊肉里,Omega-6不饱和脂肪酸的含量都不少。
Ω3与Ω6的平衡对于炎症至关重要!
尽管都是人体所必需的重要不饱和脂肪酸,但是在对待炎症方面却展现出了截然不同的作用。Omega-6不饱和脂肪酸促进炎症的发生,引起身体的“失火”;Omega-3不饱和脂肪酸则恰恰相反,缓解并抑制炎症,从而预防重大疾病的发生。可见他们两者的平衡是非常重要的。
▸ 拓展:反式脂肪酸又是什么?
在生活中我们还能听到一些食品因含有反式脂肪酸而被认为是不健康的产品,反式脂肪酸(trans fatty acid,TFA)是含有反式非共轭双键结构不饱和脂肪酸的总称。
如果与双键上2个碳原子结合的2个氢原子在碳链的同侧,空间构象呈弯曲状,则称为顺式不饱和脂肪酸,这也是自然界绝大多数不饱和脂肪酸的存在形式。反之, 双键上两个碳原子结合的两个氢原子分别在碳链的两侧,其空间构象呈线性,则称为反式不饱和脂肪酸。
与不饱和脂肪酸不同,反式脂肪酸往往对身体有许多危害。研究发现,反式脂肪酸与心血管疾病发生风险之间存在正相关关系。除此之外还会影响生育和胎儿发育、降低记忆、促进肥胖和血栓的形成、影响神经行为。
鉴于对人体的重要性,以及其作为当前人们关心的重要营养素。本文将具体讲述Omega-3不饱和脂肪酸对人体的健康益处,以及可能存在的一些隐患。
首先我们需要清楚的是,Omega-3脂肪酸包括了一类多不饱和脂肪酸,并不单单指一个物质。主要有α-亚麻酸(ALA)、十八碳四烯酸(SDA)、二十碳五烯酸(EPA)、二十二碳五烯酸(DPA)和二十二碳六烯酸(DHA)。而ALA是Omega-3脂肪酸的母体,可去饱和并延伸形成其他Omega-3脂肪酸。
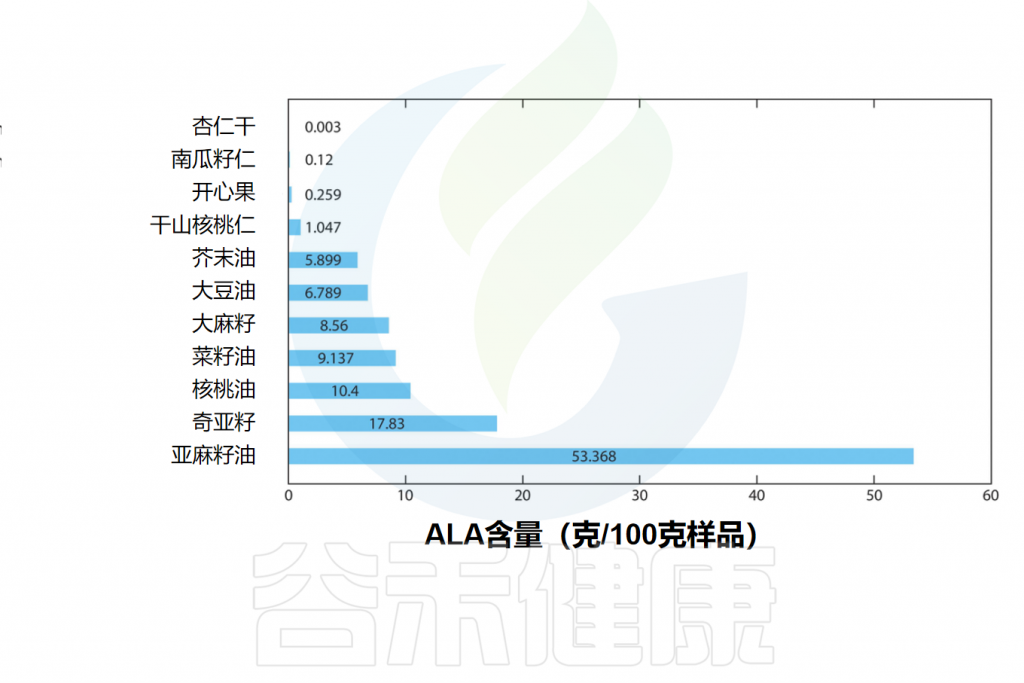
▸ α-亚麻酸主要来自植物
α-亚麻酸(ALA)的主要来源是植物,主要集中在一些种子和坚果以及植物油中。亚麻籽、奇亚籽、核桃和蓝蓟籽油是ALA的良好来源,而红花油、向日葵油、玉米油和大豆油则富含亚油酸(18:2 ω-6)。
亚麻籽及其油通常含有45-55%ALA形式的不饱和脂肪酸。大豆油、菜籽油和核桃含有5-10%ALA形式的不饱和脂肪酸。
一些含有α-亚麻酸(ALA)的食物
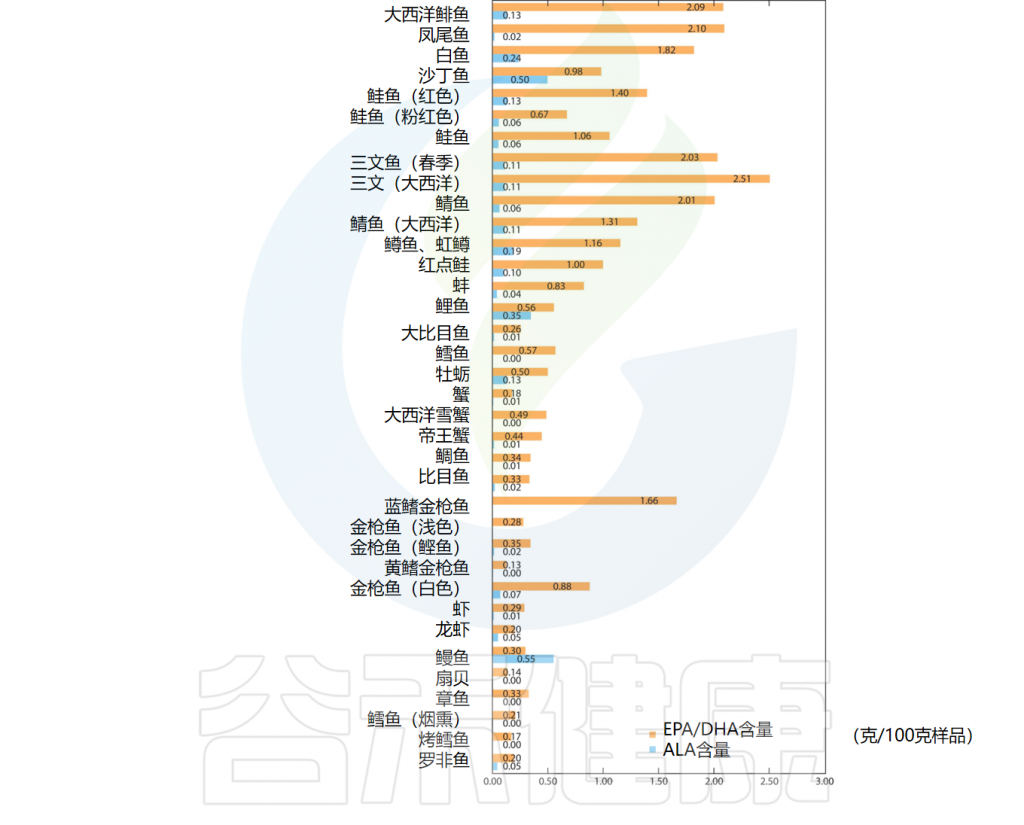
▸ 深海鱼中含有较多的EPA和DHA
尽管人体能以ALA为前体合成EPA和DHA。然而,ALA生物转化为EPA和DHA的能力有限;因此,我们需要从饮食中摄取。
EPA和DHA最重要的饮食来源是油性深海鱼类(例如鲑鱼、金枪鱼、鲱鱼、沙丁鱼、鲭鱼)和海豹、鲸鱼等海洋哺乳动物的脂肪。除此之外,龙虾、雪蟹、扇贝、章鱼等动物也含有一定量的Omega-3脂肪酸。
一些含有DHA/EPA、ALA的食物
▸ 一些藻类和真菌也可以合成Omega-3
微藻和一些微生物(真菌)也含有Omega-3脂肪酸。据报道,海藻是生物圈中Omega-3脂肪酸(DHA)的主要生产者,许多藻类已被确定为DHA的来源。
寇氏隐甲藻(Crypthecodinium cohnii)和裂殖壶菌(Schizochytriumsp)是DHA的两个主要藻类来源,其含量分别占总脂肪酸的55%和40%。
Omega-3脂肪酸,特别是EPA和DHA,其实是由浮游植物合成,最终通过食物网转移并沉积到鱼类和海洋哺乳动物的脂质中。
注:最近,十八碳四烯酸(SDA)受到了关注,在饮食中补充SDA比补充ALA更能提高EPA水平。紫草科的植物,如玻璃苣、Echium vulgare和Buglossoides arvensis、大麻油和鱼类,都是SDA的良好来源。然而,SDA并不是人类饮食的主要成分。
Omega-3可以以乙酯(EE)、三酰甘油(TAG)、游离脂肪酸(FFA)或磷脂(PL)形式存在。研究人员表明,各种形式的Omega-3的消化和吸收高度依赖于膳食中的脂肪含量,这会增强胰酶的活性。
膳食脂肪消化
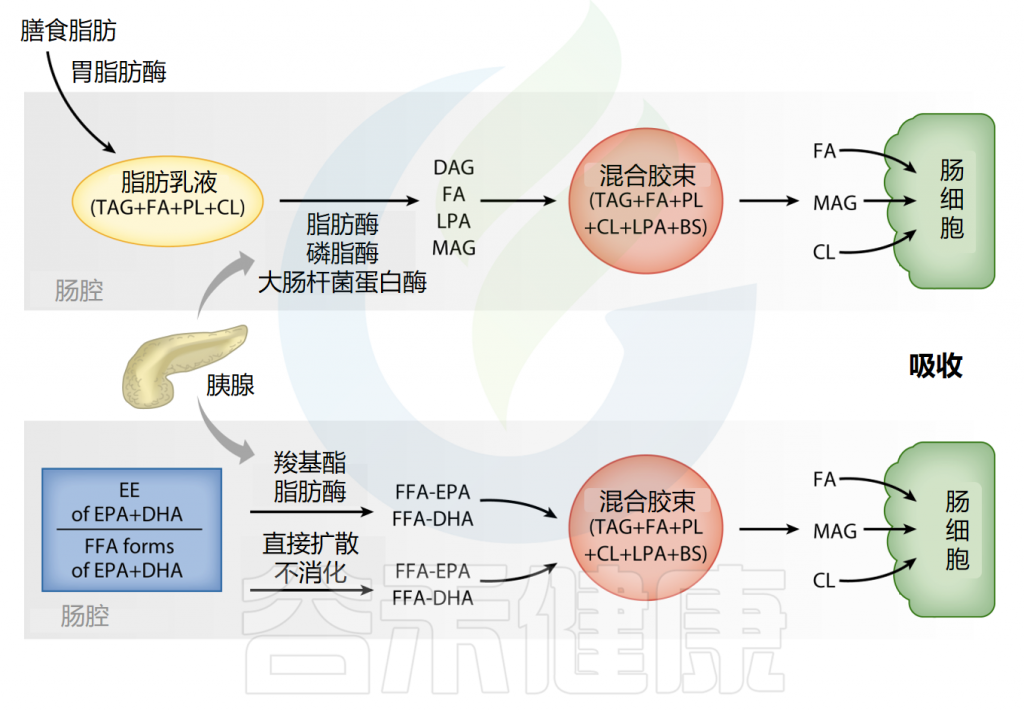
Shahidi F,et al.Annu Rev Food Sci Technol.2018
α-亚麻酸(ALA)被称为必需脂肪酸,因为人类不能从头合成ALA,植物性食品是ALA的主要膳食来源。尽管不能合成ALA,但人体可以通过进一步的去饱和和延伸过程来代谢它,这些过程被认为主要发生在肝脏中。
▸ ALA在人体可代谢转化成EPA、DHA
从膳食ALA合成其他Omega-3脂肪酸的代谢途径如图所示。SDA是从ALA合成的第一个代谢物,随后导致EPA、DPA和DHA的合成。
从ALA合成Omega-3不饱和脂肪酸的代谢途径
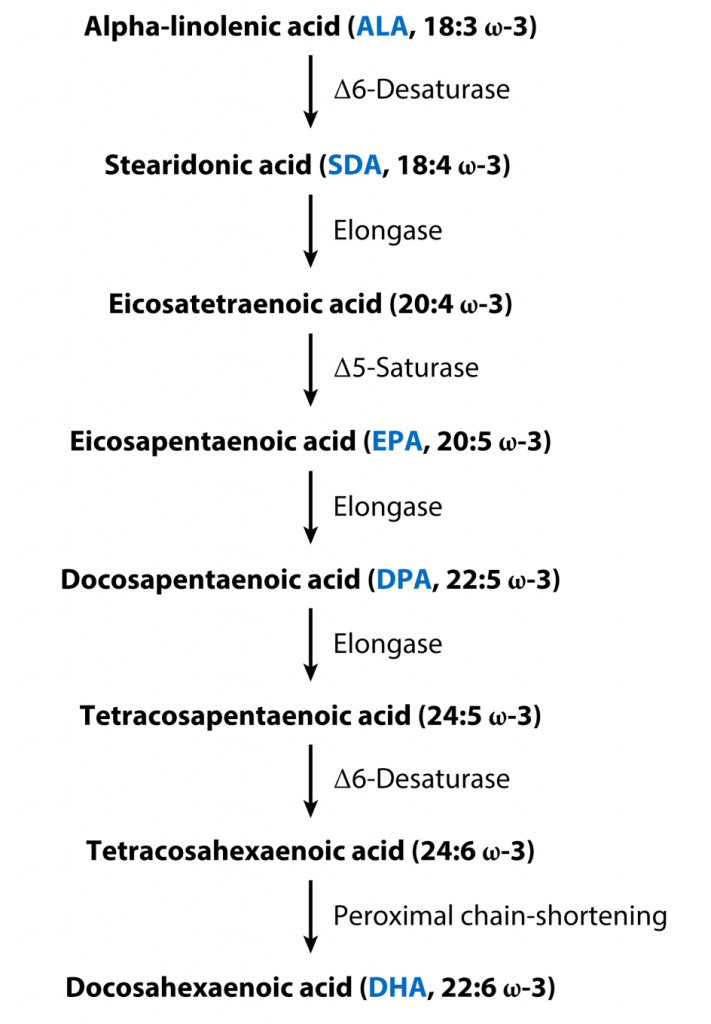
Shahidi F,et al.Annu Rev Food Sci Technol.2018
另一个主要途径涉及从亚油酸合成Omega-6不饱和脂肪酸,其中花生四烯酸是主要的最终产物。
▸ 胰岛素和矿物质水平会影响转化率
由于人类饮食中的α-亚麻酸(ALA)水平通常低于亚油酸,因此Omega-6脂肪酸的血浆和细胞水平往往高于Omega-3脂肪酸。
观察到,摄入ALA显著增加血浆和母乳中的EPA和DPA水平,而仅观察到DHA的轻微增加。另一项使用稳定同位素的研究表明,从ALA转化为EPA、DPA和DHA的效率分别为0.2%、0.13%和0.05%。
该转化需要去饱和酶(Δ5和Δ6)、微粒体系统的延长酶以及过氧化物酶体中的氧化以缩短链。一份报告显示,胰岛素水平低以及蛋白质和矿物质(铁、锌、铜和镁)缺乏可能会降低Δ6去饱和酶活性,从而抑制亚油酸和ALA转化为Omega-6和Omega-3。
▸ Ω6和Ω3对于许多激素的合成至关重要
Omega-6和Omega-3不饱和脂肪酸对于一些激素的合成至关重要,例如前列腺素(PG)、前列环素(PGI)、血栓素(TX)、白三烯、氢过氧四烯酸、羟基二十碳四烯酸等。
这些物质参与多种生理作用,包括促/抗炎、促/抗血小板聚集、血管舒张、血管收缩、免疫反应以及细胞生长和增殖。
不同脂肪酸衍生的物质其功能有时相反
例如,源自花生四烯酸的前列腺素的功能与源自 EPA的前列腺素不同。由花生四烯酸形成的PGE2和TXA2在血小板中产生,并通过有效的化学活性和血小板聚集促进炎症,并充当血管收缩剂。
然而,EPA衍生的PGE和TXA仅起到血管扩张剂和抗聚集剂的作用。因此,Omega-6和Omega-3不饱和脂肪酸在生理功能中起着重要作用,这种不平衡可能导致多种疾病,包括血栓形成、炎症、哮喘和炎症性肠病。
此外DHA已被证明是大脑灰质的主要成分,其磷脂形式已被证明是视网膜、睾丸和精子的主要成分。
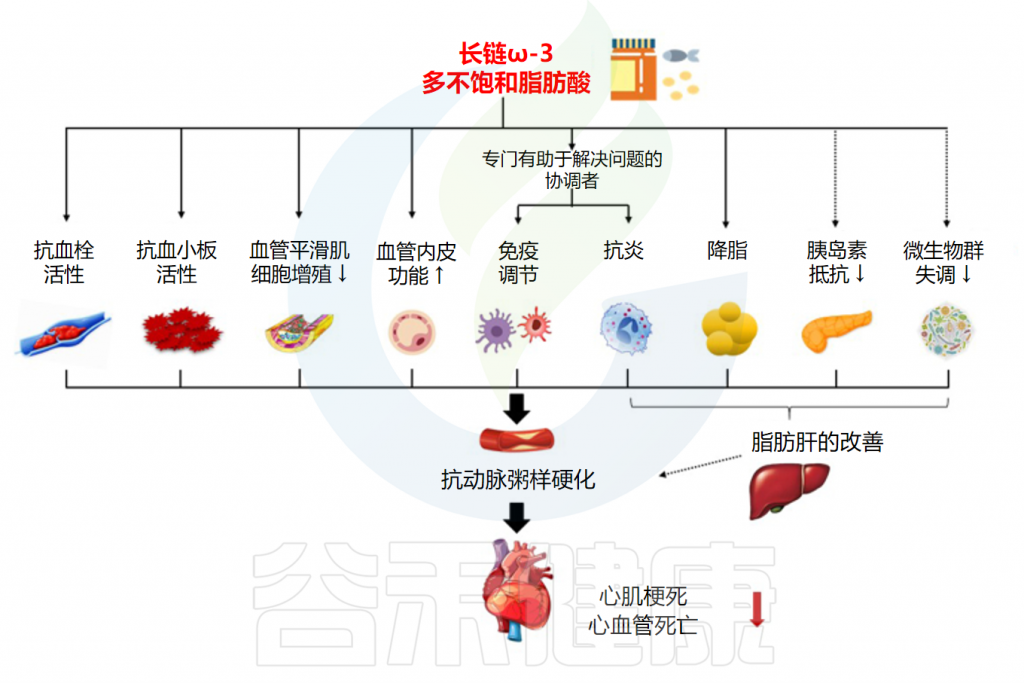
作为一种重要的不饱和脂肪酸,Omega-3脂肪酸对我们的健康产生着深远的影响。它被认为是一种必需的营养物质,能够帮助维持心血管健康、影响大脑和视力功能、改善炎症、睡眠等。
了解Omega-3脂肪酸对人体健康的积极影响至关重要,跟着谷禾一起探索Omega-3脂肪酸如何成为我们健康生活的重要组成部分。
• 维护心血管健康
Omega-3可以帮助降低心脏疾病风险。它们通过降低血液中的甘油三酯水平、低密度脂蛋白(LDL)中不良胆固醇,减少血小板聚集(降低血栓形成风险)、降低血压同时提高高密度脂蛋白(HDL)中良性胆固醇量来实现这一点。这些作用共同帮助维护心血管系统的健康。
• 抗炎作用
Omega-3脂肪酸可以通过影响炎症介质的产生来调节炎症反应。具体来说,它们能够减少前列腺素E2(PGE2)和白三烯B4(LTB4)等促炎因子的生成。
Omega-3脂肪酸还通过影响多种信号通路来发挥抗炎作用,包括抑制核因子κB(NF-κB)信号通路。
• 调节大脑健康
Omega-3脂肪酸,特别是DHA,是大脑和神经系统正常发育和功能所必需的,是构成脑细胞膜的成分,也是维护脑部健康的重要功臣。它对儿童大脑发育至关重要,有助于提高学习能力和注意力。在成人中,足够的Omega-3摄入量与降低认知衰退和阿尔茨海默病的风险有关。
• 眼部健康
DHA是视网膜的主要成分,对维持视力至关重要。Omega-3的摄入与降低年龄相关的黄斑变性风险有关,这是老年人失明的一个主要原因。
黄斑变性是指由于年龄、遗传、不良环境、慢性光损伤等各种因素的影响,使眼部视网膜处的黄斑发生萎缩,或代谢异常,导致患者出现视力异常的疾病。
• 抗抑郁和焦虑、消除偏头痛
研究表明,Omega-3可以帮助改善抑郁和焦虑症状。尤其是EPA,被认为在调节情绪和抗抑郁中起着重要作用。
Omega-3还能帮助抑制导致疼痛和发炎的“不良”前列腺素的分泌。它也能减少血液的粘度,以促进脑部的血液循环。这将会减少偏头痛的发作次数,亦能减低其严重程度和待续时间。
• 使皮肤更显年轻
Omega-3能令皮肤均衡保湿及保持健康。它能强化围绕于每一个细胞周围的纤柔细胞膜,使细胞获得充足滋养,同时能有效地把细胞内的废物予以排除。它能使真皮层分泌出更强力的胶原和弹性纤维,帮助消除皱纹和细纹,并挺实渐呈松弛的皮肤。
• 改善睡眠质量
一些研究表明,Omega-3的摄入与改善睡眠质量有关,可能通过影响睡眠调节的神经传递物质和激素实现。例如DHA,被认为可以调节褪黑素的产生。褪黑素是一种重要的睡眠调节激素,它帮助调整人体的生物钟和睡眠周期。
此外,Omega-3脂肪酸还可能带来其他潜在健康益处。为了提供更有力的证据,谷禾综合了大量研究资料,探讨了Omega-3不饱和脂肪酸对各种疾病的影响,旨在帮助大家更深入了解Omega-3不饱和脂肪酸。
1
心血管疾病
由于高脂肪饮食,世界范围内的心血管疾病和相关死亡率越来越高。已经对Omega-3不饱和脂肪酸对主要心血管疾病的影响进行了大量研究,如心肌梗死、中风、先天性心脏病、心律失常、心房颤动、亚临床动脉粥样硬化、冠心病、心力衰竭、心源性猝死、瓣膜病和外周动脉疾病。
• 大量人群数据显示较高的Omega-3摄入量的心血管疾病风险较低
格陵兰岛、加拿大北部和阿拉斯加食用传统饮食的原住民,尽管膳食脂肪摄入量较高,但心血管疾病(特别是冠心病)死亡率远低于预期。饮食中的保护成分被认为是由于定期摄入鲸鱼和海豹肉、鲸脂和多脂鱼而含有大量的Omega-3不饱和脂肪酸。
日本人的传统饮食也具有较低的心血管死亡率,这种饮食富含海鲜,包括富含脂肪的鱼类,有时还包括海洋哺乳动物,其中含有大量的EPA和DHA。从前瞻性和病例对照研究中积累的大量证据表明,西方人群中较高的EPA和DHA摄入量与较低的心血管疾病风险相关。
• Omega-3降低心血管疾病风险的具体作用
Omega-3不饱和脂肪酸,尤其是DHA和EPA,通过改变脂质和止血因素(例如血小板聚集和出血时间)来降低心血管疾病的临床风险。
DHA已被证明具有抗血小板聚集、降低三酰甘油作用和抗心律失常作用。在控制高脂饮食的多变量男性模型中,饱和脂肪酸的血清水平较高与冠心病风险增加相关,而Omega-3不饱和脂肪酸中DHA和DPA与冠心病风险呈负相关。
据报道,Omega-3不饱和脂肪酸还可以降低心脏对室性心律失常的敏感性,延缓动脉粥样硬化斑块的生长(通过减少粘附分子表达和血小板衍生生长因子并具有抗炎作用)。降血压,并发挥抗血栓形成和低甘油三酯(空腹和餐后)作用,因此具有心脏保护作用。
Omega-3对心率和血压的影响归因于一氧化氮生成率的增加,减轻对去甲肾上腺素和血管紧张素II的血管收缩反应,增强血管舒张反应,改善动脉顺应性。
Ω3脂肪酸减少心血管疾病风险的机制
Bae JH,et al.Adv Nutr.2023
下图总结了Omega-3对心血管健康的生理影响:

编辑
Shahidi F,et al.Annu Rev Food Sci Technol.2018
• Ω6与Ω3的比率可能是心血管疾病风险的重要标志
此外,Ω6(亚油酸和花生四烯酸)与Ω3(EPA、DHA和亚麻酸)的比率被认为是分析心血管疾病风险的重要生物标志物。然而据报道,组织中的Ω3水平在心血管风险评估中可能比Ω6或AA/EPA比率具有更好的预后和诊断效用。
对之前发表的文章进行了系统综述分析,了解Omega-3不饱和脂肪酸对心血管健康的影响。谷禾将其整理在下图中。


Shahidi F,et al.Annu Rev Food Sci Technol.2018
2
糖尿病
多项研究表明,补充Omega-3不饱和脂肪酸或鱼油对2型糖尿病具有有益作用。研究发现,食用Omega-3不饱和脂肪酸饮食八周后可增加老年人的胰岛素敏感性,并显著降低血清C反应蛋白。
• Omega-3对糖尿病的影响还存在争议
回顾了以前的一些研究,发现Omega-3不饱和脂肪酸对2型糖尿病或代谢综合征患者的血浆三酰甘油(TAG)水平有有利影响,但对总胆固醇、高密度脂蛋白 (HDL)、低密度脂蛋白(LDL)、空腹血糖或糖化血红蛋白水平没有直接影响。
关于Omega-3不饱和脂肪酸在糖尿病和胰岛素抵抗中的作用仍然存在争议。因此,需要进一步的临床研究来确定Omega-3是否影响人类糖尿病和胰岛素抵抗。
omega-3与糖尿病的研究结果总结

Shahidi F,et al.Annu Rev Food Sci Technol.2018
3
癌症
在过去的十年中,多项实验和流行病学研究表明,Omega-3不饱和脂肪酸可以降低患癌症的风险。
据报道,Ω3不饱和脂肪酸具有抗癌作用,而饱和脂肪酸和Ω6不饱和脂肪酸可能会促进癌症的发展。Ω3不饱和脂肪酸已被证明可以影响多种类型的癌症,包括前列腺癌、结肠癌、乳腺癌、肺癌、结直肠癌、卵巢癌、胰腺癌、皮肤癌和胃癌。此外,Ω3被证明可以提高化疗的疗效和耐受性。
• Omega-3可能的抗癌机制
提出了一些关于Omega-3抗癌作用的分子机制:
(a)减少花生四烯酸衍生的类二十烷酸的生物合成,这导致对癌细胞的免疫反应、炎症调节、细胞增殖、细胞凋亡、转移和血管生成改变;
(b)影响导致新陈代谢、细胞生长和分化变化的转录因子的活性;
(c)改变雌激素的代谢活性,随后雌激素刺激的细胞生长减少;
(d)自由基和活性氧产生的改变;
(e)调节胰岛素敏感性和膜流动性。
据报道,Omega-3不饱和脂肪酸通过降低环加氧酶 COX-2和PGE2水平侵入并抑制肿瘤细胞生长,因此可以作为天然COX抑制剂。
此外,Ω6与Ω3的比率低于5被认为可减缓癌症进展。同时,增加Ω6的摄入量被证明会促进动物和人类患乳腺癌、前列腺癌和结肠癌。
Ω6促肿瘤作用背后的机制包括脂质过氧化、17-β-雌二醇(E2)环氧化后产生致癌物,以及通过增强其他化合物(例如染色质)的基因毒性作用而产生致癌作用。
• 每天适当补充Ω3对癌症患者有积极作用
最近的一项研究表明,将Ω3与1α,25-二羟基维生素D3结合可显著增加乳腺癌细胞系的细胞凋亡。膳食补充Ω3不饱和脂肪酸、α-生育酚、亚麻酸、纤维和植物雌激素对乳腺癌患者具有积极作用。研究表明亚麻籽对乳腺癌患者具有抗增殖活性,并建议绝经前妇女每天摄入25克亚麻籽。
还有研究发现,使用Ω3作为接受放射治疗的头颈癌患者的营养补充剂,有助于他们通过增加蛋白质热量摄入来维持体重并耐受抗癌治疗,从而提高他们的生活质量。
!
一些因素会影响Ω3对癌症的效果
某些因素可能会影响Ω3不饱和脂肪酸对癌症的不一致结果:Ω3不饱和脂肪酸的来源、类型(ALA、DHA或EPA)、形式和含量的差异以及Ω6与Ω3的比率和遗传因素,例如COX和脂氧合酶修饰基因的多态性。
需要更多的临床试验来找出针对特定癌症病理的Ω3有效剂量和配方。
4
阿尔茨海默病和认知能力
多项流行病学研究表明,较低的Ω3不饱和脂肪酸摄入量会增加认知能力下降或痴呆的风险,尤其是阿尔茨海默病。
有足够的临床证据表明Ω3不饱和脂肪酸可以预防阿尔茨海默病。DHA是大脑中膜磷脂的主要成分,特别是在大脑皮层、线粒体、突触体和突触小泡中。
• 不饱和脂肪酸影响脑功能的机制
不饱和脂肪酸对脑功能的作用机制包括改变:
(a)膜流动性;
(b)膜结合酶的活性;
(c)受体的数量和亲和力;
(d)离子通道的功能;
(e)神经递质的产生和活动,以及信号转导,控制神经递质和神经元生长因子的活动。
Omega-3不饱和脂肪酸可导致人体淋巴细胞增殖、TNFα产生、自然杀伤细胞活性以及白细胞介素IL-1 和白细胞介素IL-2产生减少。
• 不饱和脂肪酸的缺乏会影响儿童神经系统
研究人员调查了317名足月婴儿的脐动脉和脐静脉 脂肪酸组成以及早期新生儿神经系统状况,并报告说,较低的胎儿DHA、花生四烯酸(AA)和必需脂肪酸水平会对早期产后神经系统状况产生负面影响。此外,早期新生儿缺乏不饱和脂肪酸可能导致亨廷顿舞蹈症、精神分裂症、高血压和成年后食欲信号增强。
多项研究表明,必需脂肪酸,尤其是Omega-3不饱和脂肪酸的缺乏会导致注意力缺陷多动障碍 (ADHD)。而服用Omega-3不饱和脂肪酸可显著改善缺陷多动障碍儿童的生活质量、注意力集中能力、睡眠质量和血红蛋白水平。
• Ω3脂肪酸的摄入对老年人的认知有益
摄入鱼类和Ω3不饱和脂肪酸已被证明对健康老年人具有积极的认知健康作用,而在考虑阿尔茨海默病患者时,补充Ω3还可以使患有记忆障碍或轻度认知障碍和阿尔茨海默病的老年人受益。
5
抑郁症
据世界卫生组织称,抑郁症可能成为全球第二大疾病。多项流行病学研究表明,食用鱼类与降低抑郁症风险相关。
• 早期发育时缺乏DHA会增加成年后患抑郁症风险
研究发现补充Ω3(EPA+DHA的混合物)对精神分裂症孕妇有积极作用。EPA已被证明可以作为一种抗抑郁剂,引起大脑结构变化,包括大脑侧脑室容量减少和神经元周转减少。
基于28项临床试验的荟萃分析研究提供的证据表明,EPA在治疗抑郁症方面可能比DHA更有效。此外,早期发育过程中DHA的缺乏可能会影响中枢神经系统,并增加成年后患抑郁症的可能性。摄入或补充鱼油/Ω3不饱和脂肪酸已被证明可以保护青少年(15-25 岁)免受重度抑郁症。
• Ω3脂肪酸作为抗抑郁药的机制
使用Ω3脂肪酸作为抗抑郁药的可能作用机制包括:
(a)调节炎症细胞因子的分泌,因为其可能会引发重度抑郁症的体征和症状;
(b)膜流动性增加,导致内皮细胞转运血清素(5-HT)增加;
(c)额叶皮质中DHA浓度增加,这可以增加多巴胺浓度和(多巴胺)D2受体结合;
(d)与神经元细胞膜受体和第二信使相互作用,导致情绪改变。
然而,关于Ω3不饱和脂肪酸潜在抗抑郁能力的一些发现存在矛盾;因此,需要进一步的随机对照试验来研究使用EPA占主导地位的Ω3不饱和脂肪酸制剂的诊断或临床显著抑郁症患者。
6
大脑、视觉发育、妇幼保健
• Omega-3不饱和脂肪酸对大脑发育至关重要
多项研究报告了膳食Omega-3不饱和脂肪酸对大脑发育的重要作用。膳食Ω3摄入量低会增加产前或产后发育期间大脑花生四烯酸 (AA)/DHA的比例。
该比率的变化减少了神经元迁移、神经发生、胚胎皮质板扩张、突触修剪、脑葡萄糖摄取和代谢的延迟,并导致谷氨酸和单胺突触功能受损。
• Omega-3脂肪酸与孕妇及儿童健康相关
DHA是视觉系统中视网膜感光器和皮质灰质的重要结构成分;怀孕期间补充DHA有助于视觉系统的成熟。在妊娠后半期,DHA在神经皮质组织和视网膜膜突触中迅速积累。
大量流行病学研究表明Omega-3脂肪酸与孕期孕产妇健康和儿童健康相关。Omega-3脂肪酸影响妊娠时长、出生体重、围产期抑郁、妊娠高血压/先兆子痫、产后神经发育、认知发育、自闭症谱系障碍、多动症、学习障碍、特应性皮炎、过敏和呼吸系统疾病等。
怀孕期间补充Omega-3脂肪酸已被证明与高等级立体敏锐度、词汇理解力、接受性词汇、言语智商以及从婴儿期到9岁的较高认知分数呈正相关。
Omega-3脂肪酸作为一种重要的营养物质,被广泛认为对人体健康有益,而肠道微生物群则是我们消化系统中不可或缺的一部分。它们之间是否存在某种联系?让我们一起来了解下。
一项使用来自876名同时测得16S微生物组和Ω3不饱和脂肪酸的数据研究表明,在调整混杂因素后,总Ω3不饱和脂肪酸和DHA的血清浓度与微生物组α多样性(香农指数)显著相关。
在调整膳食纤维摄入量后,这些关联仍然显著。对2型糖尿病患者进行的一项随机对照试验显示,与沙丁鱼饮食相比,2型糖尿病患者的厚壁菌门与拟杆菌门的比率显著下降。
补充Ω3脂肪酸可以增加产短链脂肪酸细菌的丰度
健康志愿者补充8周的Ω3不饱和脂肪酸导致产生短链脂肪酸的肠道微生物群持续且可逆地增加。然而,发现微生物多样性缺乏显著变化,这与小鼠研究一致,其中α-多样性没有变化或只有微小变化。
值得注意的是,短期饮食干预无法改变肠道微生物组的主要个体差异。
总而言之,Omega-3不饱和脂肪酸可能通过影响肠道微生物组和连接肠道与脂肪组织、肝脏和胰腺的代谢物来减轻高血糖和胰岛素抵抗。因此,补充Omega-3不饱和脂肪酸可能有助于通过肠道器官轴的有利变化恢复葡萄糖稳态。
膳食中摄入Ω3不饱和脂肪酸(例如DHA和EPA)可以改变肠道微生物群,但膳食补充剂的持续时间或改变肠道微生物群的剂量尚不清楚。多项人类和动物研究表明,DHA和其他Ω3不饱和脂肪酸摄入量的增加与有益肠道细菌的增加相关。
然而,这些研究不仅物种组成的变化不同,而且对生物体的功能益处也不一致。尽管如此,大多数研究表明,虽然参与者和DHA来源存在异质性,但更多的DHA摄入量会增加细菌α多样性以及双歧杆菌等抗炎细菌的丰度,而促炎细菌的丰度则会减少。
Ω3脂肪酸摄入量对肠道微生物群影响的研究
编辑
编辑
Kerman BE,et al.Curr Opin Clin Nutr Metab Care.2024
有助于抑制炎症因子
此外,补充DHA可恢复肠道屏障。在患有炎症性肠病的小鼠中,摄入DHA会特异性抑制促炎细胞因子,促进血液中的抗炎细胞因子,并减少大脑中小胶质细胞的激活。
编辑
来自喂食DHA的小鼠的粪菌移植表示,微生物群赋予移植小鼠抗炎作用。在一项针对HIV感染认知障碍参与者的研究中,摄入DHA24周并没有改善认知能力,尽管它对肠道微生物群有积极作用并降低了血清炎症标志物水平。
总之,一些证据表明增加Ω3不饱和脂肪酸摄入量对人类和动物有恢复作用。
一项针对不吃海鲜的素食主义者和纯素食者的队列研究显示,尽管Ω3不饱和脂肪酸血液水平较低,但痴呆或认知能力下降的风险较低。
居住在加利福尼亚州洛马琳达的人群,食用不含红肉、鸡肉或海鲜的植物性饮食与较低的心血管疾病和神经退行性疾病有关。
与吃肉的人相比,素食主义者的黄嘌呤、组氨酸、支链脂肪酸、乙酰化肽、神经酰胺和长链酰基肉碱等代谢物的水平较低。而这些代谢物许多与胰岛素抵抗、心血管风险增加和炎症有关。
• 更稳定的肠道微生物有利于将ALA转化为其他Ω3脂肪酸
英国的一项前瞻性研究(196名杂食者、231名素食者和232名纯素食者)报告称,随着时间的推移,素食者和纯素食者中的Ω3不饱和脂肪酸水平保持稳定,这表明ALA的内源性转化为EPA和DHA可能足以在多年内保持Ω3不饱和脂肪酸水平的稳定。
植物性饮食产生这些有益效果的方法之一是促进肠道微生物组更加多样化和稳定。例如,与杂食动物相比,素食主义者和素食者的某些拟杆菌门数量明显更高。纤维可以增加乳酸菌的丰度。植物性食物中富含的多酚可以增加肠道中双歧杆菌和乳酸菌的丰度,并具有抗炎特性。高植物纤维摄入量还支持纤维发酵成短链脂肪酸。
我们推测,在海鲜摄入有限且DHA与EPA水平较低的群体中,对Omega-3脂肪酸的缺乏反应可能受到饮食习惯和肠道微生物组成的影响。
• 多样而稳定的微生物群有助于缓解Omega-3摄入不足带来的负面影响
在摄入高纤维植物性饮食的人群中,多样而稳定的微生物组有助于促进抗炎状态,其丰富的短链脂肪酸、抗氧化剂和长链脂肪酸(如Ω6)可能补偿DHA或EPA水平低下的负面效应。
相反,在缺乏Omega-3脂肪酸、偏好加工肉类、低纤维植物饮食和不健康生活方式的西方饮食背景下,较低的微生物多样性和菌群失衡可能促进炎症性疾病,如阿尔兹海默病(AD)的慢性炎症途径激活。
编辑
Kerman BE,et al.Curr Opin Clin Nutr Metab Care.2024
开展了PreventE4(NCT03613844)研究,这是一项针对365名根据APOE4基因型分层、认知正常个体进行的为期两年的2克DHA与安慰剂对照的随机双盲试验。
PreventE4的主要目标是补充DHA六个月后,根据APOE4基因型,脑脊液(CSF)DHA水平的变化。次要目标包括脑成像结果的变化,而探索性目标则包括在基线、干预后6个月和24个月时评估的肠道微生物组及脑脊液和血浆的代谢组指标。研究人员预期,DHA补充将通过肠道微生物组成和代谢组的变化,部分解释对脑脊液DHA水平、成像和认知结果的影响。
• 补充Ω3脂肪酸有助于微生物群更健康、多样化
DHA补充将把西方饮食诱导的微生物表型转变为更健康、多样化的微生物群,这将与脑脊液DHA水平的显著提升、血浆和脑脊液中炎症标志物的降低以及成像和认知测量的改善相关联。
相比之下,DHA补充后未发生变化的西方饮食微生物表型可能不会对DHA补充产生有益反应。
最后,尽管Ω3/Ω6水平在血液和脑脊液中有所提高,但在基线时就拥有多样化和健康微生物群的个体可能只会显示较小的临床结果变化。
Ω3脂肪酸,作为一种对人体至关重要的脂肪酸,它在维持人体健康方面扮演着极其重要的角色。这种脂肪酸不仅对心血管健康有益,还能在许多其他方面促进身体健康,如改善大脑功能、降低炎症等。
然而,任何物质的摄入都应当遵循一个基本原则,那就是“过犹不及”。正如所有营养素一样,Ω3脂肪酸也需要适量摄入。既不应该摄入过少,以免身体无法获得必要的营养支持,也不应该过量摄入,因为这可能会导致一些不良的健康影响。
Omega-3脂肪酸可能会影响血小板功能,减少血小板计数和反应性,延长出血时间,并增加抗凝剂与促凝代谢物(分别为前列环素和血栓素)的比例。
除了融入血小板膜外,Omega-3脂肪酸(EPA和DHA)还与花生四烯酸竞争代谢转化的环氧合酶和脂氧合酶途径,从而降低血栓素A2的产生。
血小板功能的调节取决于 EPA 和 DHA 的剂量,主要发生在剂量大于 2 克/天时。这些影响似乎主要是由 EPA 的作用介导的。由于这些影响,有人担心长链 omega-3 PUFA,尤其是高剂量使用时,会不利地促进出血并延长出血时间。
• 当前的研究还没有发现Omega-3和失血过多存在相关性
关于Omega-3脂肪酸可能导致出血过多的可能性,一项研究汇总了来自19项精心设计的临床试验的证据,这些患者接受了重大手术(冠状动脉搭桥术、颈动脉内膜切除术和股动脉插管术)。
根据这些数据,得出的结论是,无论是单独使用EPA/DHA还是使用抗血栓/抗血小板药物治疗的患者,长链Omega-3脂肪酸都不会增加临床上显著出血的风险。
2018年的出版物报告了之前未发表的8项肠内营养临床试验数据,其中包括鱼油作为Omega-3脂肪酸的来源;这些试验针对不同的患者组(N=600名患者)提供了不同剂量的 EPA+DHA(1.5-10.2 克/天),持续时间不同(8天至52周)。Omega-3不饱和脂肪酸对凝血参数没有影响,并且Omega-3不饱和脂肪酸组和安慰剂组在出血事件方面没有差异。
Omega-3不饱和脂肪酸增加出血是理论上的考虑;然而,可能还需要更多的人体临床试验来证明其安全性,以打消人们的顾虑。
一些临床试验表明,Omega-3脂肪酸可能与患房颤(AF)的可能性增加有关,特别是对于心血管风险高或血脂升高的人群。
一些试验提供了不同剂量和不同配方中Omega-3脂肪酸对房颤的影响,较高的Omega-3脂肪酸补充可能会增加房颤的风险。
基线时没有心血管疾病、癌症或心房纤颤的参与者被随机分配接受840毫克/天Omega-3 不饱和脂肪酸(460毫克EPA和380毫克DHA)或橄榄油作为安慰剂。5.3年后,两组之间的房颤事件发生率没有较大差异(3.7%与3.4%)。
然而,使用较高剂量的Omega-3不饱和脂肪酸的试验发现,房颤风险增加。例如,每天3.2克EPA+DHA作为游离脂肪酸的治疗导致3.5年后发生心房纤颤的可能性更高(2.2%对比1.3%)。
在REDUCE-IT实验中,与对照组相比,随机接受每天近4克纯化EPA乙酯的患者在中位4.9年后发生房颤的风险显著增加。OMEMI 试验中约1.6克/天的Omega-3脂肪酸(930 毫克EPA和660毫克DHA)中间剂量也导致治疗组与安慰剂相比发生更多房颤。
包括2012年至2020年间发表的7项随机对照试验。在81210名患者中,72.6%参加了每天测试≤1g Omega-3不饱和脂肪酸的试验,27.4%参加了每天测试>1g Omega-3不饱和脂肪酸的试验。随访时间为4.9年。使用较高剂量的Omega-3脂肪酸与房颤风险增加相关。
因此,大多数最近试验的荟萃分析表明,Omega-3不饱和脂肪酸可能会增加房颤的风险,特别是在高剂量使用时。
最近的研究认为,Omega-3不饱和脂肪酸对房颤的影响是U形的:中等剂量时它们会降低房颤风险,但高剂量时会增加风险。
鉴于Omega-3不饱和脂肪酸改善心血管的能力,2019年,美国心脏协会更新了之前的建议,即每天使用2-4克EPA+DHA来降低甘油三酯。
作为单一疗法或作为其他降甘油三酯疗法的辅助疗法。欧洲心脏病学会和欧洲动脉粥样硬化学会发布了《血脂异常管理临床实践指南》的更新版,特别建议“在患有甘油三酯的高危患者中尽管使用他汀类药物治疗,但其水平在1.5至5.6mmol/L(135–499 mg/dl)之间,Omega-3不饱和脂肪酸应考虑与他汀类药物一起使用。”
美国脂质协会声明称,“对于年龄≥45岁患有临床动脉粥样硬化性心血管疾病(ASCVD)的患者,或年龄≥50岁患有糖尿病且需要药物治疗且有≥1个额外危险因素的患者,空腹甘油三酯为135至499 mg/dl高强度或最大耐受他汀类药物治疗,建议使用Omega-3不饱和脂肪酸以降低ASCVD风险”。
美国心脏协会重申了之前对心血管疾病患者使用EPA+DHA的支持并扩展它,指出对于患有流行性冠心病(例如近期发生心肌梗死)的患者的建议基本保持不变:对于这些患者来说,补充Omega-3不饱和脂肪酸治疗是合理的。即使该临床人群的冠心病死亡率可能略有下降(10%),也可以证明采用相对安全的疗法进行治疗是合理的。
Omega-3可以通过饮食和补充剂获得。饮食来源主要包括富含Omega-3的鱼类,如三文鱼、鲭鱼、鲑鱼和金枪鱼。对于不常吃鱼或希望通过补充剂摄入Omega-3的人,可以考虑鱼油补充剂、藻油补充剂(适合素食者)或亚麻籽油补充剂。
定期检查健康状况,特别是心血管健康指标和血脂水平,可以帮助评估Omega-3补充的效果,并根据需要调整摄入量。
Omega-3脂肪酸,作为一类不饱和脂肪酸,主要包括α-亚麻酸(ALA)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),对人体健康具有重要影响。
许多研究已经证明,Omega-3脂肪酸对心血管健康具有显著益处,能有效降低心血管疾病的风险,包括降低血压、减少甘油三酯水平及抑制炎症。
此外,Omega-3脂肪酸对大脑健康也至关重要,特别是DHA,它是大脑结构的重要组成部分,对维持认知功能、预防认知衰退有重要作用,还能在一定程度抗抑郁。
在孕妇和婴儿的营养中,Omega-3脂肪酸对神经系统的发育同样不可或缺,还有助于提高视力和认知能力的发展。
尽管Omega-3脂肪酸的健康益处众多,但它们在人体内不能自主合成,必须通过饮食来获取。这就需要通过富含Omega-3的食物如三文鱼、鲭鱼、鲑鱼和沙丁鱼等深海鱼类;此外,亚麻籽、奇亚籽、核桃以及高品质的亚麻籽油和藻类油也是优质的植物性Omega-3来源,或是通过补充剂来确保足够的摄入量。
Omega-3不饱和脂肪酸与肠道微生物群的多样性相关,足量的Omega-3有助于抑制炎症因子修复肠道屏障,同时更稳定健康的肠道微生物有利于将α-亚麻酸转化为Ω3脂肪酸,维持Omega-3的稳定水平,增加健康益处。
需要注意的是,补充Omega3脂肪酸时也应适度适量,无论是饱和脂肪酸还是不饱和脂肪酸,如果摄入量超过了人体的能量需求,多余的脂肪酸就会在体内转化为脂肪储存起来,导致人体肥胖,以及可能存在的一些未被发现的隐患,重要的是根据每个人自身的需求来制定精准的日常膳食。
主要参考文献
Kerman BE, Self W, Yassine HN. Can the gut microbiome inform the effects of omega-3 fatty acid supplementation trials on cognition? Curr Opin Clin Nutr Metab Care. 2024 Mar 1;27(2):116-124.
Djuricic I, Calder PC. Pros and Cons of Long-Chain Omega-3 Polyunsaturated Fatty Acids in Cardiovascular Health. Annu Rev Pharmacol Toxicol. 2023 Jan 20;63:383-406.
Shahidi F, Ambigaipalan P. Omega-3 Polyunsaturated Fatty Acids and Their Health Benefits. Annu Rev Food Sci Technol. 2018 Mar 25;9:345-381.
Li JJ, Dou KF, Zhou ZG, Zhao D, Ye P, Zhao JJ, Guo LX. Role of omega-3 fatty acids in the prevention and treatment of cardiovascular Diseases: A consensus statement from the Experts’ Committee Of National Society Of Cardiometabolic Medicine. Front Pharmacol. 2022 Dec 12;13:1069992.
Patel D, Evanchuk J, Wang R, Dunbar CL, Munhoz J, Field CJ. Regulation of immune function in healthy adults: one-stop guide on the role of dietary fatty acids, gut microbiota-derived short chain fatty acids, and select micronutrients in combination with physical activity. Appl Physiol Nutr Metab. 2023 Aug 1;48(8):554-568.
Yan Y, Jiang W, Spinetti T, Tardivel A, Castillo R, Bourquin C, Guarda G, Tian Z, Tschopp J, Zhou R. Omega-3 fatty acids prevent inflammation and metabolic disorder through inhibition of NLRP3 inflammasome activation. Immunity. 2013 Jun 27;38(6):1154-63.
Bae JH, Lim H, Lim S. The Potential Cardiometabolic Effects of Long-Chain ω-3 Polyunsaturated Fatty Acids: Recent Updates and Controversies. Adv Nutr. 2023 Jul;14(4):612-628.
Samrit T, Osotprasit S, Chaiwichien A, Suksomboon P, Chansap S, Athipornchai A, Changklungmoa N, Kueakhai P. Cold-Pressed Sacha Inchi Oil: High in Omega-3 and Prevents Fat Accumulation in the Liver. Pharmaceuticals (Basel). 2024 Feb 7;17(2):220.
Rinninella E, Costantini L. Editorial: Polyunsaturated fatty acids and gut microbiota. Front Nutr. 2023 Jul 28;10:1256817.

谷禾健康

银屑病,又叫牛皮癣,会导致出现皮疹伴发痒的鳞状斑块,最常见于膝盖、肘部、躯干和头皮。通常呈周期性发展,发作数周或数月,然后消退一段时间,长期的发作和复发会给患者带来很大的痛苦和困扰,严重影响到生活质量和日常工作。银屑病影响着全球超过 6000 万成人和儿童。
银屑病是一种免疫介导的炎症性皮肤病,涉及遗传和环境因素之间复杂的相互作用。免疫学和遗传学研究确认IL-17和IL-23是银屑病发病机制中的关键驱动因子。然而,由于银屑病的反复发作和难治性质,目前还没有简单治愈方法。
在有遗传倾向的个体中,非遗传因素也是触发牛皮癣发病和复发所必需的,其中包括感染、皮肤和肠道微生物群失调、脂质代谢失调、性激素失调、精神疾病等,其他环境因素也可能诱发牛皮癣,例如皮肤创伤、不健康的生活方式和药物。
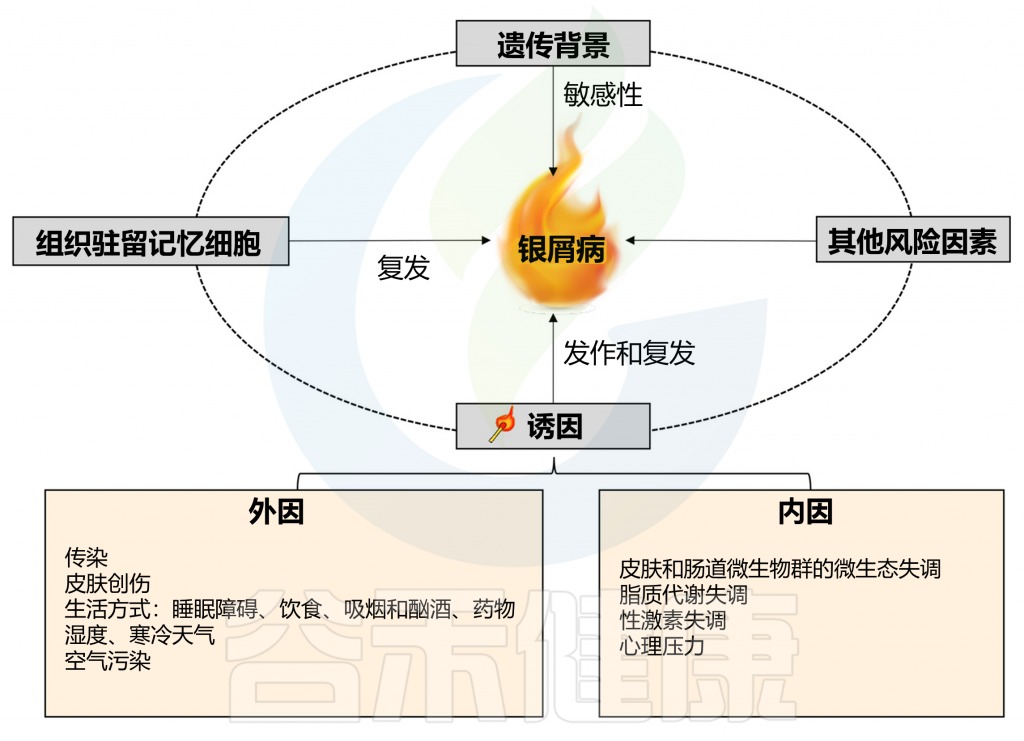
Liu S, et al., Cell Communication and Signaling, 2024
大量研究发现,银屑病不再被认为是仅影响皮肤的疾病,而是被视为一种全身性炎症性疾病,这与多种共病相关,包括结肠直肠癌、代谢综合征、肥胖、克罗恩病和溃疡性结肠炎等。微生物感染被认为是银屑病的重要病因,尤其是链球菌上呼吸道感染。
肠道和皮肤之间存在很强的双向联系,在肠道-皮肤轴中,皮肤炎症会影响肠道健康,而肠道微生物群也会影响皮肤健康,与健康对照相比,牛皮癣患者的肠道菌群失调,多样性降低,Firmicutes/Bacteroidetes(F/B)异常,大肠杆菌水平往往更高,Lachnospira、Akkermansia muciniphila、Blautia、Faecalibacerium减少,这种变化与人类结肠微生物群中丁酸盐代谢和产丁酸菌相关。丁酸与调节多种炎症因子有关,包括脂多糖、TNF-α、IL-10、IL-1β等。
扩展阅读:
其他菌群变化也与银屑病患者中与炎症相关标志物的程度相关联,特别是IL-2受体,其与Phascolarctobacterium呈正相关,与Dialister呈负相关。Phascolarctobacterium和Dialister的相对丰度可作为银屑病活动的预测指标。详见:
肠道核心菌属——考拉杆菌属(Phascolarctobacterium)
近日,来自华中科技大学同济医学院附属协和医院皮肤科的研究人员,总结了牛皮癣发病和复发的触发因素,发表在《Cell Communication and Signaling》上。

本文结合牛皮癣与肠道菌群的关联,更新了有关这些因素如何引发该疾病的潜在机制的当前证据。了解这些触发因素如何在银屑病的发病和复发中发挥作用,可以深入了解银屑病的发病机制,并更好地进行临床治疗。
银屑病是一种常见的红斑鳞屑性皮肤病,具有多种皮肤表现和全身参与,可影响任何皮肤部位,发生于任何年龄和任何地理区域。
在牛皮癣患者中,免疫系统错误地攻击了健康的皮肤细胞,导致皮肤细胞生长过快,形成皮肤表面的鳞屑。
银屑病的常见体征和症状包括:
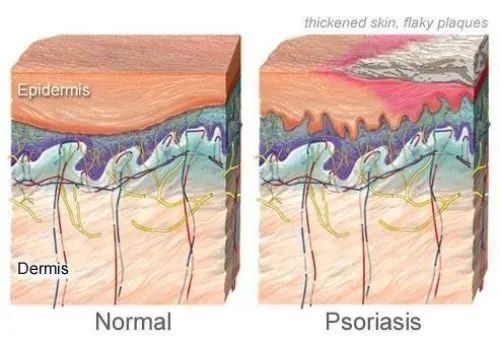
图源:WebMD
根据银屑病临床表现的不同,通常分为以下类型:
其他还包括:
牛皮癣和湿疹一样吗?
牛皮癣和湿疹是两种不同的皮肤病。这两种情况都会引起类似的症状,如皮肤变色、皮疹和瘙痒。
牛皮癣会传染吗?
牛皮癣不会传染。接触他人的牛皮癣皮疹不会感染牛皮癣。
牛皮癣是一种慢性炎症性皮肤病,世界卫生组织最近的报告指出,牛皮癣的患病率正在上升,在发达国家从 1.5% 到 5% 不等。
据统计,中国的牛皮癣发病率在1.3%-2.4%之间,约有1000万-2000万的患者。男性的发病年龄在30-39岁和60-69岁,而女性的发病时间大约要早十年,年轻人群体中发病率也有上升的趋势。
许多银屑病患者可能持续数年毫无症状,直至某种环境因素诱发这种疾病。常见的银屑病诱发因素包括:
银屑病关节炎
一般来说,银屑病越严重,患银屑病关节炎的风险就越高。2015 年欧洲一项研究发现,十分之一的银屑病患者患有未确诊的银屑病关节炎。未确诊的银屑病关节炎患者的生活质量受到很大影响。
心血管疾病
研究表明牛皮癣与心血管疾病之间存在联系,慢性炎症可能是心血管疾病和中风风险增加的原因,因为随着时间的推移,炎症会对动脉造成损害。
代谢综合征
根据一项研究,患有牛皮癣的人患代谢综合征的风险,是其他没有牛皮癣的人的六倍。
肥胖
研究表明,与一般人群中的其他人相比,牛皮癣患者更有可能肥胖。
炎症性肠病
牛皮癣和炎症性肠病 之间存在联系。《JAMA Dermatology》杂志 2018 年的系统综述和荟萃分析结果表明,牛皮癣与炎症性肠病相关。
抑郁症
抑郁症是银屑病的首要合并症。患有皮肤问题会导致抑郁。对于某些人来说,治疗牛皮癣可以帮助减轻抑郁症状并提高生活质量。
以上我们了解了关于银屑病的基本情况,接下来,我们从感染,微生物群失调,脂质代谢失调,心理压力和精神障碍,性激素失调,其他环境因素等方面来了解银屑病的相关触发机制。
多种微生物是银屑病的触发因素,见下表。
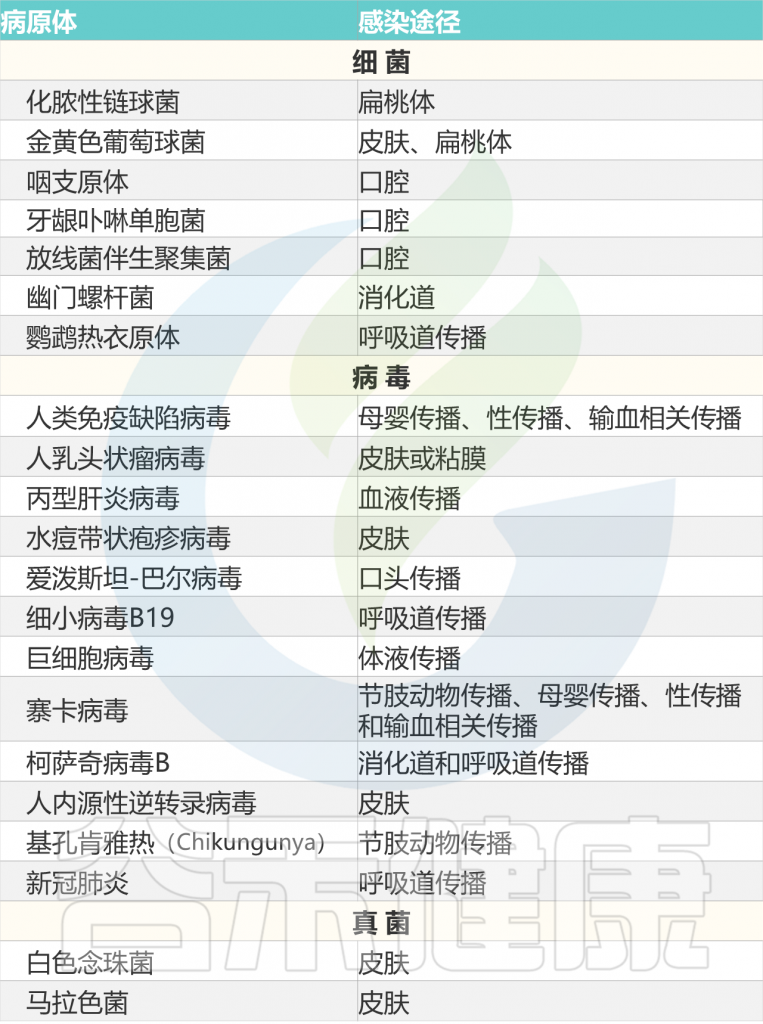
Liu S, et al., Cell Communication and Signaling, 2024
化脓性链球菌引起的扁桃体感染,可引发或加剧斑块状和滴状银屑病中的银屑病皮肤病变。
研究人员通过遗传关联研究将链球菌咽喉感染与银屑病联系起来,表明公认的银屑病风险等位基因HLA-C06:02是链球菌扁桃体炎的风险因素,而推断的银屑病风险单倍型HLA-C06:02/HLA-B*57:01是扁桃体炎最强的风险因素。
儿童银屑病与复发性扁桃体炎密切相关
一项临床队列研究还报道,年龄从10岁-11岁的儿童银屑病与复发性扁桃体炎密切相关。在银屑病患者的皮肤和扁桃体组织中发现了相同的T细胞克隆,提示在链球菌感染后的疾病中扁桃体内产生致病性T细胞。因此,建议将扁桃体切除术作为解决银屑病的干预措施,这可以减少循环T细胞的数量。
但仍应进行长期随访,验证扁桃体切除术的适应症和长期益处。同时,没有确凿的证据表明抗链球菌干预措施的有效性。有趣的是,肛周链球菌感染也会引发喉结型银屑病,但它不如喉咙感染常见。
化脓性链球菌喉咙感染和银屑病之间发病联系
链球菌扁桃体炎可能通过以下多种机制来引发牛皮癣:
a) 化脓性链球菌(SP)的M蛋白模仿人类 K17
CD8 + T细胞识别银屑病患者中链球菌M蛋白和人角蛋白17(K17)共享的表位,K17可以成为CD8的自身抗原和靶点 + 以HLA-C*06:02限制性模式浸润银屑病皮肤病变的T细胞。
b) SP超抗原激活IL-12的释放,然后促进CD4+T 细胞中皮肤归巢CLA的表达
皮肤寻求性皮肤淋巴细胞相关T细胞(CLA + T细胞)与化脓性链球菌的相互作用,为理解银屑病的免疫发病机制提供了新的概念。通过刺激IL-12的产生途径,化脓性链球菌超抗原诱导T细胞上皮肤特异性归巢受体(CLA抗原)的表达,并促进CLA+ T细胞向皮肤的迁移。
此外,在携带HLA-C*06:02的银屑病患者中,如果他们患有化脓性链球菌引起的扁桃体炎,其CLA+ T细胞和表皮细胞的培养中观察到高Th17反应。化脓性链球菌能够在斑块型和滴状银屑病中诱导循环CLA+ T细胞产生IL-17,这进一步在CLA+ T细胞迁移到皮肤后诱导银屑病自身抗原(如ADAMTS样蛋白5和LL-37)的产生。在体外银屑病模型中,化脓性链球菌提取物诱导CLA+ T细胞产生IL-9,从而上调IL-17A的产生。
c) 化脓性链球菌肽聚糖 (PG) 的辅助作用
含有PG的巨噬细胞与PG特异性CD4+密切接触银屑病病变中的T细胞,然后是PG特异性CD4 + T细胞以HLA-DR等位基因限制的方式增殖并产生IFN-γ。此外,PG固有识别的改变增强了T细胞对化脓性链球菌的反应,并诱导银屑病。
图2 感染和皮肤微生物失调可能诱发银屑病
Liu S, et al., Cell Communication and Signaling, 2024
金黄色葡萄球菌在大约60%的银屑病患者的皮损和鼻孔中,而在5%至30%的健康个体中定植。
从22名银屑病患者中的11名患者的喉咙中分离出金黄色葡萄球菌。
一项研究显示,与健康对照组相比,银屑病受试者对超级抗原毒素的炎症皮肤反应增加,银屑病表皮中TNF-αmRNA水平增加。
然而,在银屑病病变中没有发现表达特异性T细胞受体Vβ的T细胞的选择性扩增,这是超抗原刺激的标志。这种T细胞依赖性反应可能是由于角质细胞中HLA-DR的高表达,增强了皮肤对超级抗原的炎症反应。
此外,银屑病的严重程度与葡萄球菌肠毒素的产生显著相关。
牙周炎患者患银屑病的风险较高
牙周炎期间,口腔微生物群可能影响银屑病的发展和恶化。一项涉及13项研究的荟萃分析显示,牙周炎患者患银屑病的风险高于对照组。
口腔微生物(尤其是咽支原体)在银屑病发展中的作用
一名患者最初患有滴状银屑病,后来发展为斑块型银屑病,其皮肤感染了咽支原体(Mycoplasma faucium),属于口腔软壁菌门,这种细菌出现在银屑病棘层角质形成细胞中,以及银屑病损害上层真皮的细胞外。
与对照组(骨关节炎)相比,在银屑病关节炎(PsA)患者的血清和滑液中也发现了更多种类和更高浓度的口腔细菌(牙龈卟啉单胞菌和Prevotella nigrescens)DNA。
牙龈病原体(尤其是牙龈卟啉单胞菌)在牙周炎与银屑病发病机制中的桥梁作用
牙龈卟啉单胞菌和放线菌聚集杆菌(Aggregatibacter actinomycetemcomitans)是与牙龈炎相关的病原体,可激活人CD14 + 单核细胞在体外增强Th17分化和IL-17产生。牙龈卟啉单胞菌蛋白酶可以通过降解其他关键细胞因子如IL-12,增强Th17系列反应,而髓样抗原呈递细胞(APCs)被触发产生与Th17相关的细胞因子IL-1β、IL-6、IL-23。然而,与健康受试者相比,牙周炎患者的牙龈组织中IL-17+细胞的频率增加,而在外周血中没有增加。
牛皮癣的皮肤炎症可以通过宿主的抗病毒免疫反应失调由病毒感染引发。
视黄酸诱导基因I (RIG-I)是病毒的主要细胞质传感器。通过激活RIG-I抗病毒信号传导,病毒感染可以在遗传易感个体中触发CD11c+树突细胞产生IL-23的表达,从而导致银屑病的发展。
HIV
与普通人群相比,人类免疫缺陷病毒(HIV)患者的银屑病标准化发病率更高。HIV可以直接作为超抗原或抗原呈递的共刺激因子触发银屑病,在HIV感染期间,活化的CD8 +T细胞产生更多的IFN-γ。神经肽物质P可以从HIV感染的免疫细胞中释放,然后调节炎症和免疫反应,刺激角质细胞的增殖。
HPV
人乳头瘤病毒(HPV)也与银屑病相关。一项针对66274名HPV感染患者的全国性人群队列研究显示,HPV感染后银屑病的患病率更高。
SARS-CoV2
严重急性呼吸综合征冠状病毒2型(SARS-CoV2)也被认为是银屑病恶化的原因。在严重急性呼吸系统综合征冠状病毒感染患者的血浆中炎性细胞因子水平升高,粒细胞集落刺激因子和TNF-α的浓度与疾病严重程度相关。
此外,一些接种新冠肺炎疫苗的患者患有慢性免疫介导的皮肤病,如牛皮癣,但皮肤反应通常轻微且自限性的。
NLRP1炎症小体
NLRP1是已鉴定的炎症小体形成模式识别受体(PRRs)之一,先天免疫系统可以通过该受体检测病原体。在正链RNA病毒感染过程中产生的长双链RNA(dsRNA),例如Semliki Forest病毒,可以结合并激活人类角质形成细胞中的NLRP1炎症小体。NLRP1炎症体在促进银屑病发病的过程中发挥作用,无论是通过增加对银屑病的易感性,还是通过促炎细胞因子(包括IL-1β和IL-18)的失调释放。
同样,NLRP1具有感知细菌病原体外毒素的能力,如铜绿假单胞菌分泌的外毒素A和白喉棒状杆菌分泌的白喉毒素,并诱导细胞死亡和IL-1β / IL-18分泌。
注:NLRP1,核苷酸结合域和富含亮氨酸重复pyrin结构域的蛋白质1(NLRP1),一种在人体免疫系统中发挥作用的蛋白质。
银屑病皮肤中的多种真菌已被鉴定为通过遗传易感个体的先天免疫系统激活银屑病。
白色念珠菌
来自白色念珠菌等微生物的超级抗原可能导致感染患者银屑病的恶化。接触白色念珠菌也可在银屑病皮肤中引发对IL-17的临床相关反应。银屑病CLA + T细胞/表皮细胞共培养物通过增加IL-9、IL-17A和IFN-γ的产生,对白色念珠菌提取物产生反应。
此外,皮肤白色念珠菌感染通过产生IL-17的CD4 + TRM诱导复发性银屑病。在小鼠模型中,CD4 + TRM在感染30天后成为IL-17的主要来源。
除白色念珠菌外,马拉色菌可能与头皮银屑病的恶化有关。
幽门螺杆菌
与对照组相比,幽门螺杆菌感染在中度和重度银屑病患者中显著增加,但在轻度银屑病患者中没有增加。在幽门螺杆菌感染的银屑病患者中,银屑病面积和严重程度指数(PASI)评分较高,银屑病相关细胞因子IL-1β、IL-6、IL-8和TNF-α的粘膜水平也较高。然而,2015年的一项发现表明,银屑病患者的幽门螺杆菌患病率没有比健康对照组增加。还需进一步研究。
目前,许多研究都致力于人类微生物组在银屑病发病机制中的作用,特别是皮肤和肠道微生物组之间的关系,即“肠道-皮肤轴”。
银屑病患者厚壁菌门增加
几位研究人员推测,银屑病可能与宿主皮肤微生物群的失调密切相关(图2)。与非病变皮肤和对照组相比,银屑病病变皮肤的细菌载量更高,但细菌多样性更低。厚壁菌门和放线菌门分别是银屑病患者和健康对照组中最常见的细菌门,病变皮肤中厚壁菌的增加和放线菌的相应减少是显著的。然而,另一项研究报道了银屑病病变中放线菌门和厚壁菌门都增加。这种差异可能是由于采样方法、皮肤部位、药物和分析方法的多样性。
棒状杆菌丰度与银屑病严重程度相关
根据新的证据,与未受影响和健康的皮肤相比,银屑病病变的棒状杆菌(Corynebacterium)浓度更高,Cutibacterium更低。棒状杆菌丰度与疾病严重程度相关,大多数种类的棒状杆菌在小鼠皮肤中诱导强烈的IL-23依赖性反应。在小鼠皮肤上涂抹假白喉棒状杆菌后,皮肤IL-1β蛋白水平升高,真皮中γδT17细胞增多。
银屑病耳朵皮肤显示葡萄球菌过度表达
较低丰度的表皮葡萄球菌和痤疮丙酸杆菌可能促进金黄色葡萄球菌在银屑病中的定植,这可以刺激小鼠模型中的Th17极化并引发IL-17介导的皮肤炎症。
为了解释银屑病的发病机制,提出了从屏障破坏到微生物群紊乱,再到病变加重的循环来解释银屑病的发病机制。
具有表皮屏障缺陷的小鼠具有增加的细菌载量和抗微生物肽(AMP)表达。在施用局部抗生素后,通过减少皮肤上的细菌负荷,以及减少IL-17和IL-22的产生,可以缓解小鼠的银屑病样表型。
除了皮肤微生物群的微生态失调外,紊乱的肠道微生物群也会影响银屑病的病理生理学(图3)。与健康对照组相比,银屑病患者的肠道微生物群在组成和功能潜力方面都发生了变化。银屑病患者的肠道微生物群特征显著紊乱,细菌多样性低,厚壁菌门/拟杆菌门(F/B)比率升高,并与PASI评分呈正相关。除了厚壁菌门和拟杆菌门外,银屑病患者和健康对照组16种属水平上的类群也存在显著差异。
银屑病患者肠道微生物的相关研究

doi.org/10.3390/ijms25041984
肠道屏障完整性与银屑病严重程度呈正相关
肠道脂肪酸结合蛋白(FABP)是肠道屏障完整性的生物标志物,其水平与银屑病的严重程度呈正相关。肠道微生物群失调可能通过减少粘液层的厚度、干扰肠道上皮细胞的增殖和代谢以及影响AMPs的产生来增加肠道通透性,也称为“肠漏”。
肠道微生物失调导致肠漏,促进细菌和抗原转移
肠道细菌可以通过DC通过上皮细胞之间的过程逃逸到血液中,而不影响紧密连接功能,或者通过覆盖在Peyer贴片上的微折叠细胞,将微生物产物呈递给APC。渗漏的肠道促进细菌移位,并允许外部抗原从肠腔进入血液和淋巴循环,从而驱动局部和全身免疫反应。
银屑病患者中细菌DNA易位与全身炎症的增加
与其他患者和健康对照组相比,斑块型银屑病患者血液样本中细菌DNA易位增加,主要是由肠道细菌引起的,包括大肠杆菌、粪肠球菌和弗氏志贺菌。细菌DNA易位的患者也表现出更高水平的全身炎症反应。
另一项研究还报道,在25%的斑块型银屑病患者的血液中观察到细菌DNA,与其他肠道类型的患者相比,肠型2(普雷沃氏菌占优势)的患者更容易发生细菌移位。这些微生物在被重新激活后可能会释放出高效的炎症因子,如脂多糖(LPS)和脂磷壁酸(LTA),这可能会导致宿主机体中的轻度和慢性炎症,银屑病患者会受此困扰。从肠道吸收的细菌内毒素(ET)和PGs也会加剧银屑病,银屑病的治疗已通过阻止其吸收或破坏内毒素来证明这一点。
短链脂肪酸促进Treg分化,调节免疫活性
微生物群可以通过肠道中的微生物代谢产物来改变免疫活性。短链脂肪酸(SCFAs)是肠道微生物组不可消化碳水化合物的主要发酵产物,主要包括乙酸盐、丁酸盐和丙酸盐。其中,丁酸盐可增强Foxp3基因座启动子区的组蛋白H3乙酰化,表明其有可能影响Treg细胞的分化。
微生物群对T细胞分化的影响:叶酸与色氨酸代谢途径
叶酸来自肠道微生物群和饮食,而饮食中的叶酸对维持Foxp3+Tregs有选择性作用。作为宿主色氨酸代谢途径之一,犬尿氨酸途径可以通过吲哚胺2,3双加氧酶将成熟的DC转化为耐受性DC,从而增强Tregs并抑制效应T细胞。这些结果可能表明,微生物群代谢产物通过触发肠道T细胞的分化,成为银屑病的非感染性风险因素。
固有淋巴细胞ILC3的调控:微生物代谢产物的双重作用
近年来,第3组固有淋巴细胞(ILC3)的功能受到了广泛关注。ILC3主要在肠道和皮肤中发现,并通过产生IL-17A和IL-22在银屑病中发挥致病作用。
当身体感染某些细胞外病原体(如柠檬酸杆菌)时,ILC3产生IL-22和/或IL-17,用于对抗病原体的粘膜免疫。ILC3的功能也可以受到微生物代谢产物的调节,如短链脂肪酸。丁酸盐可由厚壁菌门产生,而乙酸盐和丙酸盐主要由拟杆菌门产生。
图3 肠道微生物失调和饮食可能会在银屑病中诱导轻度和慢性炎症
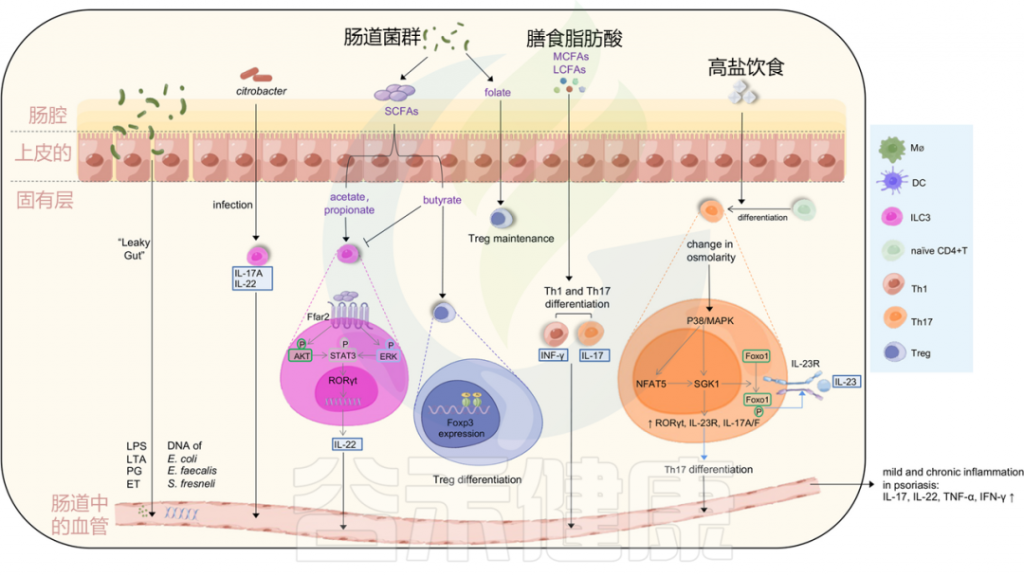
Liu S, et al., Cell Communication and Signaling, 2024
肠道通透性增加导致的“渗漏性肠病”可以诱导脂多糖(LPS)、脂蛋白(LTA)、外毒素(ET)和肽聚糖(PG)等强效炎症介质的释放,以及肠道细菌DNA进入血液。
柠檬酸杆菌感染可以刺激ILC3s产生IL-22和IL-17A,从而有助于黏膜免疫。ILC3s的功能也受到微生物代谢产物短链脂肪酸(醋酸、丁酸和丙酸)的影响。
乙酸和丙酸与结肠ILC3s上的FFAR2受体相互作用,激活AKT或ERK信号通路,并通过STAT3轴释放IL-22;
而丁酸则降低ILC3s的数量,同时,丁酸增强Treg细胞的分化,叶酸有助于维持Treg细胞,中长链脂肪酸支持Th1和Th17细胞的分化。
高盐饮食导致渗透压改变激活P38/MAPK通路,进而上调下游靶点NFAT5和SGK1,这反过来驱动转录因子RORγt、IL-23R、IL-17A和IL-17F的表达,导致Th17分化。上调的SGK1通过磷酸化Foxo1促进IL-23R的表达和稳定Th17分化。
益生菌的治疗已证明在改善银屑病方面具有潜在的益处,尽管尚未制定标准化的治疗方法。粪菌移植提供了另一种可能的治疗策略,因为它们通过允许健康粪便微生物组的“真生物”在受影响患者的肠道中重新定居来缓解自身免疫性疾病。未来更好地了解微生物群失调无疑将有助于缓解银屑病的治疗方法,我们在后面第八章也有具体的介绍。
许多研究已经表明肥胖和血脂异常与银屑病的关系,肥胖是银屑病的一个重要风险因素。而且,肥胖会加重已有的银屑病,这种自身免疫性疾病与肥胖之间的可能联系依赖于脂肪组织。
一般来说,脂肪组织可能通过肥大脂肪细胞分泌大量激素和细胞因子(也称为脂肪因子),包括IL-6、TNF-α和瘦素,在脂质代谢失调的患者中充当免疫器官,这些因子调节炎症途径和免疫细胞的活动。各种银屑病RNA-seq数据集表明,脂质代谢途径与银屑病的发病机制密切相关。
图4 将血脂异常与银屑病联系起来的潜在机制
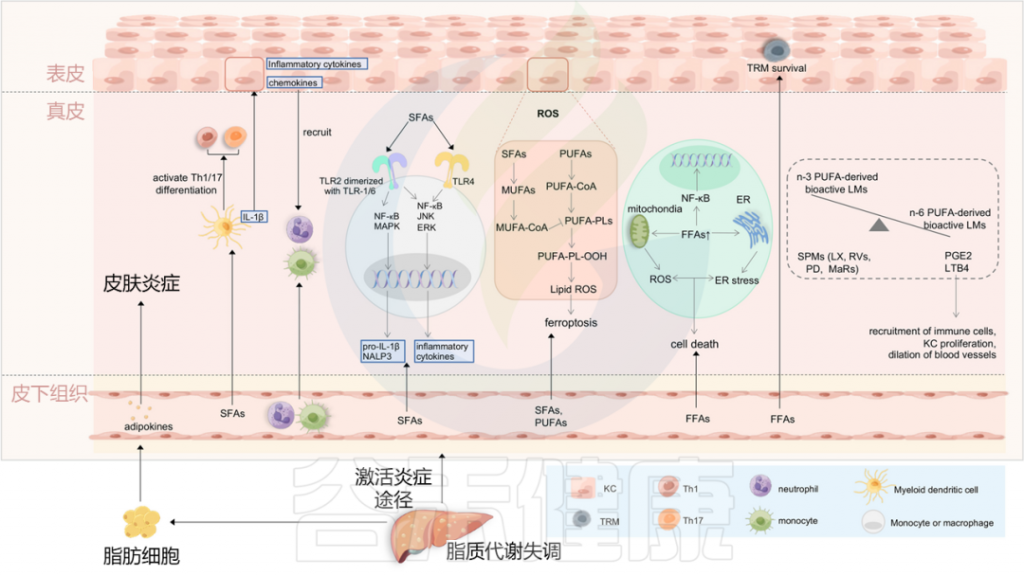
Liu S, et al., Cell Communication and Signaling, 2024
最近的研究表明,与肥胖相关参数无关的饮食成分,可能在银屑病的恶化中发挥关键作用。一项使用小鼠银屑病模型的研究提供了证据,证明饮食中的游离脂肪酸(FFAs),特别是饱和脂肪酸(SFAs),是银屑病皮炎的关键放大器。
饱和脂肪酸:加重银屑病皮炎的可能潜在机制
循环中的饱和脂肪酸被转运到皮肤中,并诱导骨髓源性树突细胞产生各种促炎细胞因子,如IL-1β。这些促炎细胞因子随后促进角质形成细胞分泌趋化因子和炎性细胞因子,导致中性粒细胞和单核细胞募集到皮肤,并导致银屑病皮炎放大。
饱和脂肪酸还可以通过激活TLR2和TLR4,来调节单核细胞或巨噬细胞中的NALP3炎症小体和炎症小体介导的IL-1β分泌。饱和脂肪酸在银屑病皮炎恶化中的另一种机制是通过激活DC来促进Th1/Th17分化。
体内游离脂肪酸的增加可能通过支持表皮中TRM细胞的存活而促使银屑病的复发。此外,膳食游离脂肪酸、中链和长链脂肪酸(MCFA和LCFA)的成分指导肠形Th细胞分化,这与上述丁酸盐诱导的Treg分化相反(图3)。
多不饱和脂肪酸(PUFA)及其衍生的生物活性脂质介质
除饱和脂肪酸外,多不饱和脂肪酸(PUFA)和多不饱和脂肪酸衍生的生物活性脂质介质(LMs)也可介导银屑病的炎症反应。
其中,生物活性LMs来源于两种多不饱和脂肪酸,亚油酸(LA,n-6 PUFA)和α-亚麻酸(ALA,n-3 PUFA),它们分别因其在银屑病中的促银屑病和抗炎特性而闻名。
n-6
作为代表性的n-6 多不饱和脂肪酸衍生的LMs,LTB4有助于中性粒细胞趋化,PGE2有助于角质细胞增殖。
n-3
衍生自 n-3 多不饱和脂肪酸的专门的促分解脂质介质(SPMs),包括脂氧素(Lxs)、resolvins (Rvs)、保护蛋白(PD) 和Maresins (MaRs),在银屑病中具有抗炎和免疫调节功能。
一个研究小组专注于基于液相色谱-串联质谱(LC–MS/MS)分析鉴定人类银屑病中的生物活性LMs和SPMs。根据他们的研究,衍生自n-6 多不饱和脂肪酸的生物活性LMs在银屑病皮肤中丰富,同时resolving D1(RvD1)、resolving D5(RvD5)、保护蛋白D1(PD1)及其双加氧异构体10S,17S diHDHA(又名PDx),阿司匹林触发形式的脂氧素A4和脂氧素B4(AT-LXA4和AT-LXB4)可能是解决银屑病病理生理学中炎症反应的专门的促分解脂质介质。
脂质代谢与铁死亡(Ferroptosis)密切相关,铁死亡促进银屑病角质形成细胞引发炎症,这涉及一系列连续事件,即活性氧(ROS)的积累导致脂质过氧化并进一步诱导铁死亡。
PUFA促进银屑病角质形成细胞铁死亡和炎症的机制
在银屑病期间,脂质过氧化与Th22/Th17通路在单细胞水平上呈正相关,证明了脂质过氧化的增强。
角质形成细胞对铁死亡也具有时间和浓度依赖性。在角质形成细胞的脂质代谢中,循环中积累的PUFA被催化为关键底物PUFA-CoA,最终酯化为PUFA-PLs,当存在生物活性铁时,PUFA-PL-OH可以过氧化为PUFA-PL-OH。随后,PLOOH可以通过产生脂质羟基自由基和脂质过氧自由基使细胞对铁死亡敏感。
MUFA-CoA和Fer-1通过抑制脂质过氧化抑制银屑病铁死亡
相反,来自饱和脂肪酸的单不饱和脂肪酸(MUFA)的产物MUFA-CoA可以通过抑制PUFA-PLs的过氧化来减少脂质过氧化的可用底物,从而抑制铁死亡。
此外,各种研究表明,Ferrostatin-1(Fer-1)是一种有效的脂质过氧化抑制剂,可以抑制铁死亡并阻断银屑病中的炎症反应。
除了氧化应激外,脂质还可以启动内质网(ER)应激,这具有双向作用:
饱和游离脂肪酸通过诱导ROS和ER应激参与银屑病发病机制
在非脂肪细胞中,过量的饱和游离脂肪酸通过脂质代谢和信号通路诱导ROS和ER应激。随后的线粒体和ER功能障碍是导致终末细胞死亡的关键步骤。此外,长期的内质网应激可导致氧化应激,脂质诱导的ROS也可能间接触发内质网应激,尽管确切机制尚不清楚。
脂质抗原激活限制性T细胞促进银屑病炎症反应
脂质自身抗原在驱动血脂异常相关自身免疫性疾病中的作用也引起了关注。银屑病病变含有高水平的磷脂酶A2(PLA2),其参与新脂皮肤抗原的产生。在IFN-α的诱导下,细胞质PLA2组IVD(PLA2G4D)可以以外泌体的形式从银屑病肥大细胞中释放,并转移到邻近的表达CD1a的Langerhans细胞。然后,新脂质抗原被脂质特异性CD1a反应性T细胞识别,释放IL-22和IL-17A。
自身脂质反应性T细胞在高脂血症与银屑病关联中的角色
除了CD1a限制性T细胞外,其他CD1分子(如CD1b和CD1c)限制性T淋巴细胞也对自身脂质产生反应并诱导细胞因子的产生。
在一项研究中,通过皮肤病变中积累的磷脂和胆固醇的一些自身抗原直接激活了CD1b自身反应性HJ1 T细胞。在患有高脂血症血清的小鼠中,CD1b+树突细胞增加了IL-6的产生,以及HJ1 T细胞分泌IL-17A,表明高脂血症和银屑病之间的潜在联系可能在于自身脂质反应性T细胞。
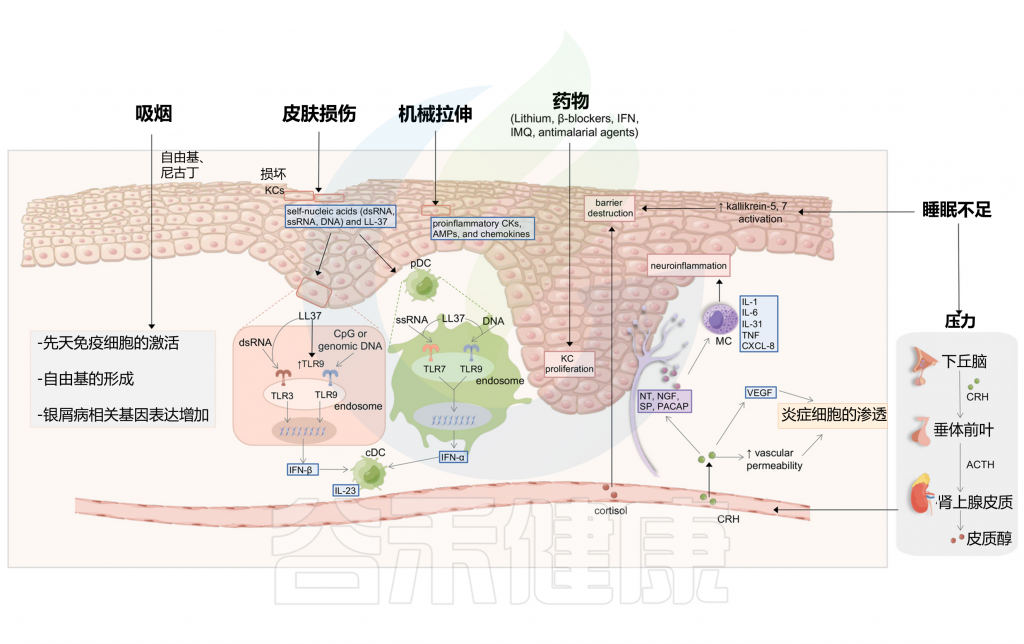
心理压力与银屑病的发病、严重程度和复发之间可能存在相关性
在31-88%的患者报告压力是银屑病的诱因,在过去12个月内经历压力事件的受试者中,银屑病的发病率更高。
另一项病例对照研究利用Holmes和Rahe的社会适应评定量表来评估压力生活事件,得出结论,压力在银屑病的发展中起着重要作用,特别是在复发和延长方面。
然而,一项荟萃分析报告称,没有令人信服的证据表明应激事件与银屑病之间存在这种关联。因此,未来应在基于人群的研究中前瞻性地审查这种关系,利用标准化的压力测量工具,并结合额外的生理和生化压力标志物。
心理压力激活HPA轴促进银屑病发病
压力可能通过下丘脑-垂体-肾上腺(HPA)轴、免疫途径和外周神经系统在银屑病的病理生理学中发挥作用。(图5)
作为对心理压力的反应,下丘脑产生促肾上腺皮质素释放激素(CRH),进一步激活垂体促肾上腺皮质激素(ACTH)和肾上腺皮质醇的分泌。CRH能够抑制角质细胞的凋亡,这是银屑病的典型现象。
另一方面,CRH通过刺激血管内皮生长因子(VEGF)增强血管生成,并增加血管通透性,促进银屑病斑块中炎症细胞的渗透。肥大细胞(MC)也可以被CRH激活,然后释放细胞因子和趋化因子,包括IL-1、IL-6、IL-31、TNF和CXCL-8。
此外,压力刺激皮肤外周神经末梢神经肽的释放,导致MC激活后神经源性炎症的发展。这些神经肽包括神经降压素(NT)、物质P(SP)、神经生长因子(NGF)和垂体腺苷酸环化酶激活多肽(PACAP)。
重度抑郁、PTSD、焦虑
除压力外,重度抑郁障碍或创伤后应激障碍患者患银屑病的风险显著高于对照组。
甚至父母常见的精神障碍(焦虑和抑郁)与后代患银屑病风险之间的关系也已确定。
双相情感障碍
另一项研究报告称,一名患有双相情感障碍的女性随后发展为银屑病,并在每次躁狂发作期间银屑病病变加重。
自闭症
根据自闭症谱系障碍患者银屑病炎症的临床升高,自闭症小鼠模型中高水平全身炎症,表明自闭症与银屑病活动之间存在联系。此外,先前的研究已经证实,严重精神障碍和银屑病之间存在遗传重叠。
越来越多的研究阐明了性激素对皮肤的多种生物和免疫调节作用。银屑病的自然病程似乎受到妊娠、月经和更年期的调节,从而暗示女性激素诱导的机制可能参与调节皮肤炎症。此外,研究表明,与女性相比,男性银屑病的患病率和严重程度更高,尤其是在雌激素充足的年龄,这表明不同性激素对银屑病的调节作用不同。
雌激素对银屑病具有保护作用
研究发现,雌激素通过下调中性粒细胞和巨噬细胞产生的IL-1β,这一过程通过雌激素受体α和β(ERα和ERβ)介导,具有潜在的抗银屑病作用。
同样,一项体内研究表明,雌二醇通过调节中性粒细胞和巨噬细胞的功能,在咪喹莫特(IMQ)诱导的小鼠银屑病炎症中发挥保护作用。体外,17β-雌二醇阻断了10 kDa的IFN-γ/干扰素诱导蛋白(IP-10)的正反馈回路,支持银屑病中Th1介导的炎症。
雌激素在银屑病中也可能具有促炎特性
一些孕妇的银屑病症状有所改善,而另一些孕妇的症状则有所恶化。
一份病例报告表明,一名患者在接受三苯氧胺治疗(一种抗中风药物)后,银屑病症状得到缓解,但在围绝经期症状恶化。值得注意的是,与对照组相比,男性银屑病患者的血清雌二醇水平显著升高,这表明雌激素可能参与银屑病的发展。
此外,一项使用咪喹莫特诱导的银屑病模型的体内研究也表明,雌激素通过Erα诱导IL-23,在银屑病中发挥促炎作用。
总之,这些证据支持雌激素在特定情境下对银屑病有双重影响,这导致了偶尔出现的相互矛盾的观察结果。
孕激素在银屑病中具有保护作用
临床观察证明银屑病通常在妊娠期间改善或消退,但在分娩后再次出现。
一项病例对照研究确定了孕妇受影响体表面积的改善与雌二醇、雌三醇、雌激素与孕酮比例升高之间的相关性。一些研究人员已经证明,角质细胞通过在银屑病皮肤中表达孕酮受体(PR)而成为孕酮的靶标。此外,孕酮在妊娠期间诱导转录改变,这些改变富含与银屑病相关的基因。STAT1和STAT3显著下调,其下游靶点,包括IL-12β、OSM和CXCL10,受到影响。
睾酮
一些研究强调雄性激素在牛皮癣中的作用。他们表明,严重的牛皮癣与低血清睾酮水平有关。无论患者年龄(40 岁以上或以下)如何,总睾酮和游离睾酮与 PASI 之间均呈负相关。
睾酮可以作为一种免疫抑制因子,下调树突状细胞的活性,干扰B细胞的分化,减少促炎细胞因子的释放。此外,在动物模型中,睾酮可以通过降低 IL-17 的水平来充当肝脏炎症的抑制剂,IL-17 是一种已知在银屑病发展中发挥关键作用的白细胞介素。
雄激素剥夺疗法(ADT)在晚期前列腺癌中作为加剧或缓解银屑病因素
一份病例报告显示一名前列腺癌患者ADT后银屑病加重。相反,一项调查发现ADT与银屑病风险降低之间存在相关性。另一项研究显示,无论年龄组如何,总睾酮或游离睾酮与PASI之间存在显著的负相关。
催乳素:刺激角质形成细胞的增殖
催乳素是垂体前叶分泌的一种多肽激素,刺激角质形成细胞的增殖,充当血管生成的诱导剂,并促进 Th1 细胞浸润银屑病病变。
此外,催乳素在调节免疫反应方面具有复杂的作用。它可以作为体液和细胞免疫反应以及 Th1 和 Th17 反应的刺激剂。
催乳素可以刺激角质形成细胞的增殖。最近的一项荟萃分析支持了激素在银屑病发病机制中发挥重要作用,该分析评估了循环催乳素水平与银屑病严重程度之间的关系。该荟萃分析包括 12 项研究,总共涉及 446 名银屑病患者和 401 名健康受试者。银屑病患者的循环催乳素水平显著较高,并且与疾病严重程度呈正相关。
总之,目前探索性激素对银屑病影响的研究主要依赖于观察性研究,缺乏深入的机制探索。这些关于雌激素和雄激素的矛盾发现表明,需要更多高质量的证据来更好地理解性激素与银屑病发病机制之间的复杂联系。
一些触发因素的潜在机制无法归类为感染因素、皮肤微生物群失调、肠道微生物群失调或脂质代谢失调,如下图。
图5 与银屑病发生相关的其他诱因
Liu S, et al., Cell Communication and Signaling, 2024
科布内氏现象与银屑病:皮肤损伤诱发疾病
皮肤创伤或压力可引发银屑病,称为科布内氏现象(Koebner phenomenon,KP)。
注:科布内氏现象,也称同形反应,是指在某些皮肤病患者健康皮肤区域受到损伤后出现的与原发皮肤病相同的皮损。
拔罐疗法与银屑病:传统治疗方法的争议
拔罐疗法作为一种传统的中医药,曾被用于治疗银屑病,但现在却存在争议,因为一些银屑病患者通过同形反应产生局部皮肤病变,而没有达到预期的治疗效果。
在银屑病患者中,拔罐治疗会导致拔罐部位出现同形反应,而Hijama(中东国家进行的一种湿拔罐)只会导致切口区域出现同形反应。
皮肤损伤激活角质细胞和免疫细胞参与银屑病发病
在皮肤损伤过程中,受损的角质细胞释放自身核酸,包括dsRNA、单链RNA(ssRNA)和DNA,并诱导LL-37的表达。
LL-37能够通过TLR7或TLR9在浆细胞样树突状细胞(pDC)中识别ssRNA或DNA,这最终导致IFN-α的分泌。LL-37暴露也可以通过DNA-LL-37复合物非依赖性机制或通过TLR3对dsRNA的识别诱导IFN-β的产生。对于前一种机制,LL-37增加TLR9的表达,从而促进TLR9配体的识别,如CpG或基因组DNA。浆细胞样树突状细胞的IFN-α和角质细胞的IFN-β促进常规树突状细胞的成熟。银屑病在创伤部位的复发归因于创伤部位TRM细胞的积聚和再激活。
机械拉伸与皮肤损伤:银屑病病变潜在触发因素
一份病例报告描述了一名患寻常型银屑病的妇女在插入组织扩张器后发展出新的银屑病病变。机械拉伸被怀疑会触发角质细胞释放ATP(5’-三磷酸腺苷),并随后产生Th17极化细胞因子,如前IL-1β和IL-6。被释放的ATP也可以激活表皮兰氏细胞。
在小鼠皮肤扩张模型中,观察到表皮过度增殖、皮肤屏障功能受损以及表皮角质细胞中银屑病相关细胞因子的上调。在人类角质细胞中,连续拉伸可以导致银屑病相关促炎细胞因子、抗微生物肽和趋化因子的产生。
除了拉伸,角质细胞的抓伤损伤可以通过细胞因子或趋化因子CCL20触发科布内氏现象,在较小程度上,这种触发作用与抓痕线数有关,也与CXCL8有关。
吸烟强度和持续时间与银屑病有关
与普通人群相比,银屑病患者中吸烟患病率更高,并揭示了吸烟开始和戒烟对银屑病的因果影响。吸烟强度和持续时间可能对银屑病的发病率具有剂量依赖性影响。作为银屑病发展的一个独立风险因素,吸烟对银屑病患者有许多负面影响,包括较高的PASI评分、指甲受累增加和心血管疾病的发展。
吸烟可能通过炎症、氧化和遗传机制引发银屑病
尼古丁通过释放炎性细胞因子刺激先天免疫细胞,如DC、巨噬细胞和角质细胞。此外,吸烟会引发自由基的形成,从而激活银屑病相关的蛋白质信号通路。
吸烟上调银屑病相关基因表达
在遗传学方面,吸烟上调银屑病相关基因的表达,包括HLA-C*06:02、HLA-DQA1*0201和CYP1A1。
烟草与银屑病:保护作用or风险因素?
最近的一项研究阐明了烟碱受体基因CHRNA5在银屑病的发展和发病机制中的作用。沉默的CHRNA5可以抑制人类角质细胞的增殖和迁移。有趣的是,吸烟也会增加普通人群患银屑病的风险,但吸烟在银屑病患者中表现出保护作用,这被称为“吸烟悖论”。然而,最近的一项孟德尔随机化研究涵盖了105912名具有生活方式因素、生物化学和基因型数据完整信息的个体,该研究表明吸烟是银屑病的一个独立风险因素,但不是银屑病的因果风险因素。
睡眠障碍:促炎因子显著增加,影响表皮屏障,加剧银屑病
睡眠障碍通常是银屑病的危险因素之一。一个具有全国代表性的基于人群的数据集表明,当发生阻塞性睡眠呼吸暂停时,银屑病和精神分裂症的风险增加。睡眠不足可能通过失眠的心理压力改变屏障稳态和角质层完整性。研究人员发现,银屑病小鼠在睡眠不足后,促炎细胞因子(IL-1β、IL-6和IL-12)显著增加,抗炎细胞因子(如IL-10)减少。
睡眠不足也促进了银屑病皮肤中kallikrein-5和kallikrein-7的活性,从而影响表皮屏障,导致银屑病的发展。此外,皮质醇在失眠等一些睡眠障碍中会增加。皮质醇刺激皮肤MC,破坏皮肤屏障功能,并上调促炎细胞因子,从而进一步加剧银屑病。
饮食因素在银屑病发病机制中的作用
73%的患者在坚持无麸质饮食三个月后出现临床改善,银屑病真皮中的Ki67淋巴细胞也减少了。
除麸质外,氯化钠(NaCl)摄入量的增加被认为对银屑病的发病机制有潜在影响(图3)。在高盐条件下,活化的p38/MAPK通路可以上调下游靶向活化T细胞核因子5(NFAT5)和血清/糖皮质激素调节激酶1(SGK1)。靶基因的上调可以驱动转录因子RORγt、IL-23R、IL-17A和IL-17F的表达,从而导致银屑病Th17细胞从初始CD4 + T细胞分化。SGK1对于通过Foxo1的磷酸化促进IL-23R表达和稳定Th17细胞分化至关重要。
银屑病与饮酒之间存在着复杂的多因素关系
银屑病患者的过度饮酒率高于普通人,酗酒会增加银屑病的严重程度并降低治疗效果。中重度银屑病患者的死亡风险也会增加,酒精是一个主要因素。然而,一项调查报告称,饮酒与银屑病的发展没有显著联系,孟德尔随机化研究也没有发现饮酒与银屑病之间的因果关系。目前还没有足够的证据来确定饮酒是否与银屑病的发病和复发有关。
许多药物都能引发银屑病,如锂、β受体阻滞剂、抗疟药、非甾体抗炎药、血管紧张素转换酶抑制剂、IFN、IMQ、特比萘芬、他汀类药物、贝特类药物和抗程序性细胞死亡蛋白1(PD-1)或抗程序性死亡配体1(PD-L1)抗体。在罕见病例中,TNF抑制剂也可能自相矛盾地诱发银屑病。
银屑病是锂的最常见皮肤不良反应
锂诱发和加重银屑病的发病率范围从3.4%至45%不等。
β受体阻滞剂治疗引发的角质细胞过度增殖及T细胞活性变化
当用β受体阻滞剂治疗时,负责促进细胞分化和抑制增殖的细胞内信使CAMP在表皮显示减少,最终导致角质细胞过度增殖。
此外,银屑病T细胞与对照组在蛋白酪氨酸磷酸化活性方面存在重要差异,蛋白酪氨酸激酶的诱导对包括淋巴细胞和角质细胞在内的细胞的激活和增殖至关重要。
抗PD-1/PD-L1诱导银屑病及潜在疗法
随着抗PD-1或PD-L1抗体在晚期恶性肿瘤治疗中的应用迅速增长,抗PD-1/PD-L1诱导的银屑病病例逐渐被报道。有研究者认为,PD-1的抑制通过加速表皮CD8 + 的浸润而促进皮肤炎症参与与角质细胞致病性串扰的T细胞。他们进一步证明了IL-6靶向疗法对抗PD-1/PD-L1诱导的银屑病的潜在疗效。
其他药物也通过不同的机制与银屑病有关
银屑病也可以由生物制剂引发
这被认为是一种自相矛盾的反应。一项研究显示,216例疑似TNF抑制剂诱导或加重的银屑病报告病例,英夫利昔单抗治疗银屑病的发生率更高,在克罗恩病和类风湿关节炎治疗的第一年最为普遍。对TNF抑制剂诱导的银屑病患者的回顾性分析也得出了一致的结果,表明英夫利昔单抗是主要的触发因子,而克罗恩病和类风湿关节炎是最常见的原发性疾病。这种自相矛盾的反应可能与通过抑制易感个体TNF活性而诱导的免疫改变有关。其发病机制也与IL-23/Th17轴参与TNF抑制的设定有关。
其中一个悬而未决的重大谜团是,在靶向TNF-α、IL-23和IL-17A/IL-17RA的生物制剂停用后,银屑病病变往往在相同的区域复发。目前最流行的观点是,现有生物制剂主要用于抑制致病性免疫细胞的活性,而不是完全消除它们。
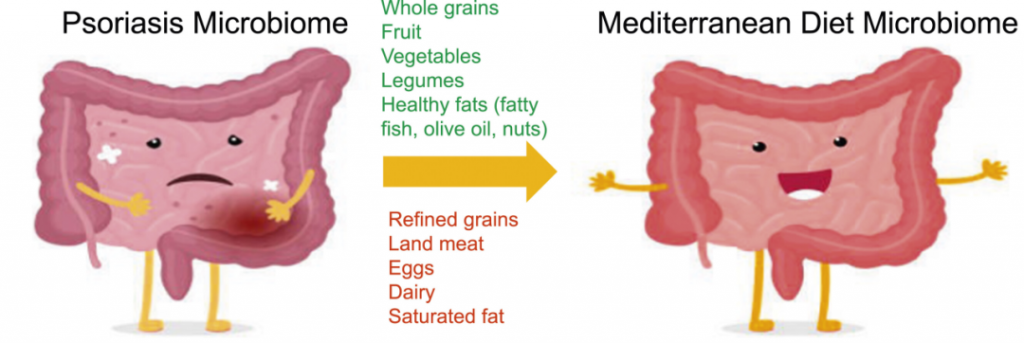
地中海饮食(MeD),因为它具有抗炎作用。重点是增加蔬菜、橄榄油和豆类等富含营养和抗氧化剂的食物的消费,同时限制肉类和奶制品的摄入。
一项针对 3557 名银屑病患者的队列研究发现,与地中海饮食更一致的饮食模式与较低的银屑病严重程度相关。
一种方式是通过增加拟杆菌门细菌来降低F/B比例,从而帮助恢复短链脂肪酸的平衡,并促进丁酸盐的产生,这反过来又可以减轻肠道和全身炎症,对牛皮癣具有重要影响。
肠道中其他产丁酸菌包括Akkermansia和普拉梭菌,地中海饮食通过增加这些细菌也促进了短链脂肪酸的产生。
doi.org/10.1177/24755303241226626
食用特级初榨橄榄油含有高含量的多酚,已在健康患者中显示出能减少IFNy和IL7R的基因表达,表明减少银屑病患者炎症的潜在途径。
间歇性禁食可能为难以遵循低热量饮食的患者提供另一种策略。尽管关于这种饮食的研究仅限于斋月禁食,这增加了几个混杂因素,但总的来说有益处。以减重为重点的饮食改善可能的原因可能是由于腹部脂肪和脂肪率的减少,随后降低脂肪因子水平并减少银屑病进展所依赖的炎症。
血清脂肪因子之一的脂联素与PASI评分呈正相关,IL-22也是如此。肥胖加剧银屑病的机制因此可能是由于脂肪因子诱导Th-17相关细胞因子的增加。对于这些建议,应避免严重的饮食改变,以防止营养不良。低热量饮食和间歇性禁食可能推荐给有适当动机的患者。
无麸质饮食意味着避免摄入小麦、大麦和黑麦中的这种蛋白质,这对患者有益。银屑病患者食用无麸质饮食 3 个月后发表了积极结果,显著改善了PASI 评分。其他研究小组证实,一年的无麸质饮食可以改善抗麦胶蛋白肽 IgA 水平较高的群体的 PASI 评分。
高脂饮食破坏IL-23和胆汁酸信号通路的稳态,促进皮肤的γδT细胞浸润并增强其产生IL-17A的能力来诱发银屑病样皮炎。也会通过改变粘液屏障和肠道微生物群来加剧银屑病皮肤炎症,从而导致全身 IL-17 反应增强,从而加剧银屑病。
极低热量生酮饮食(VLCKD)可以显著减少炎症,是缓解肥胖银屑病患者症状的有效手段,可能与微生物群-肠道-皮肤轴有关,但无论短期还是长期都有一定的副作用。
鱼油已被加入到许多银屑病患者用来缓解症状的补充剂中。2014 年,对几项有关在银屑病患者中补充鱼油的研究进行荟萃分析发现,虽然一些研究显示了中等结果,但其他研究尚未发现任何相关性。
最近,在一大群个体(超过 25,000 名男女登记受试者)中,在他们的饮食中补充了维生素 D(2000 IU/天)和/或 omega-3 脂肪酸(1000 毫克/天),并且该组随访 5 年,记录了银屑病 与其他自身免疫性疾病的发病率。研究结果表明,在补充组中,包括银屑病在内的自身免疫性疾病的发病率降低了 22% 以上。
姜黄素是一种抗炎的天然化合物,口服后会在胃肠道中积聚,并可能通过调节肠道微生物群的微生物多样性和组成来发挥其调节作用。一项人类随机安慰剂对照试验,补充组每天接受6000 mg姜黄提取物,并在治疗开始时和8周后进行微生物群分析。大多数梭菌属、拟杆菌属、柠檬酸杆菌属、Cronobacter、肠杆菌属、肠球菌属、克雷伯菌属、拟副杆菌属和假单胞菌属在反应参与者中均匀增加。
产生丁酸的细菌数量和粪便丁酸水平增加,对银屑病患者口服补充姜黄素12周进行评估,结果PASI评分显著降低,IL-22血清水平降低。
在斑块型银屑病患者的局部光疗的同时口服姜黄素似乎可以诱导对治疗的更快、更渐进的治疗反应。考虑到这些炎症发病机制与银屑病受试者的发病机制相似,补充姜黄素可能代表了该病理管理的未来前景。
白藜芦醇是一种抗炎的非黄酮类多酚化合物。在小鼠实验中也发现了白藜芦醇对肠道菌群的有利效果。口服白藜芦醇能够增强肠道屏障功能,同时减少通透性和炎症。白藜芦醇治疗后肠道菌群拟杆菌属、Alistipes、Rikenella、Odoribacter、Parabacteroides和Alloprevotella分类的丰度水平增加,白藜芦醇治疗恢复了小鼠的菌群失调。
此外,白藜芦醇的给药,8周内每公斤400毫克白藜芦醇,增加了高脂饮食喂养的大鼠中产丁酸菌Blautia和Dorea。因此,白藜芦醇补充可能改善患者肠道微生物多样性。
槲皮素是一种植物黄酮醇,它可能存在于各种水果、蔬菜、叶子、种子和谷物中。以其抗炎、细胞保护和免疫抑制特性闻名。
最近的一项研究针对亚甲基丙烯酰亚胺诱导的小鼠,探讨了槲皮素补充(30、60和120 mg/kg)的效果,显示PASI评分显著降低,银屑病斑块改善。此外,槲皮素成功降低了小鼠血清中的TNF-α、IL-6和IL-17水平,加强了抗炎效果。
此外,研究表明口服补充槲皮素,减少了亚甲基丙烯酰亚胺诱导的小鼠类银屑病样皮炎,显著降低了角质形成细胞的增殖和异常分化,以及炎症细胞的浸润。口服槲皮素后,观察到IL-23/Th17轴上的细胞因子表达降低和Th17细胞反应减少。
其他中草药如雷公藤等,也对银屑病患者有用,改善了他们的临床参数,可作为辅助治疗。
回顾性分析显示,83.7% 的银屑病患者在接受唾液链球菌K-12治疗 24 周后,PASI 评分改善了 100%,并且随着治疗持续时间的延长,疗效持续改善。
一项随机对照试验发现,持续口服婴儿双歧杆菌35624(B.fantis)可显著改善银屑病的进展,并降低C反应蛋白和肿瘤坏死因子TNF-α的表达,显示出免疫调节作用。人体微生物群的作用不仅限于粘膜免疫系统,还延伸到全身免疫系统。
在明确单一益生菌的作用机制后,益生菌的组合应用以及相应的标准和方法仍需探索。不同的饮食和环境,可能会导致肠道微生物群的差异。
一项为期12周的开放标签、单中心临床试验评估了益生菌[印度芽孢杆菌(HU36)、枯草杆菌(HU58)、凝结芽孢杆菌(SC208)、草绿芽孢杆菌(SL307)和克劳氏芽孢杆菌(SC109)]和精确益生元(低聚果糖、低聚木糖和低聚半乳糖)对接受局部治疗的银屑病患者的有效性。接受抗银屑病局部治疗和益生菌及益生元补充的患者,在疾病活动性的测量中表现更好,包括银屑病面积和严重性指数、皮肤病生活质量指数、炎症标志物和皮肤厚度。肠道菌群发生了有利的变化,转变为抗炎的特征。
喂食富含菊粉的高纤维饮食(HFD)降低了咪喹莫特诱导的皮炎的增厚和总严重程度评分,并降低了表皮厚度、炎症浸润,包括Ly6G+中性粒细胞和表皮Ki67+增殖细胞。
富含菊粉的高纤维饮食增加了拟杆菌门和拟杆菌属的相对丰度,增加了血清和粪便中丙酸盐的浓度。膳食菊粉补充剂部分通过丙酸盐改善银屑病样皮炎,可能是一种很有前途的银屑病辅助治疗方法。
当然,何时使用益生菌、益生元以及针对不同个体的精准应用,还需结合肠道菌群检测进一步研究。
FMT是纠正肠道菌群失调、重建肠道微生态平衡的方法。近年来,这种疗法已用于治疗牛皮癣、系统性红斑狼疮、肠易激综合征、帕金森病疾病等。
FMT治疗的效果取决于不同的疾病、移植的形式和数量、给药途径以及所使用的供体。
在一项为期五周的干预性临床试验中,一名患有斑块型银屑病和IBS的受试者通过内窥镜和结肠镜接受了两次FMT。身体表面积、PASI评分、皮肤病学生活质量指数、肠道症状和血清TNF-α水平在干预后都有所改善,没有观察到不良反应。
然而,在周围性银屑病关节炎患者中,FMT在治疗活动性疾病方面并不那么有效。FMT可能在减轻银屑病患者的疾病严重程度方面带来一些益处,但需要更多的临床试验来证明这一点。
其他相关预防干预措施,皮肤护理等详见我们之前的文章:
以上我们了解了银屑病发病和复发的危险因素和潜在病理机制。银屑病的发展是复杂的,可能是由多种触发因素引起的。这些触发事件可能在不同条件下独立发生,或者表现出累积或协同效应。因此,很难确切地将这种疾病归因于特定的诱因。
鉴于银屑病是由遗传基础上的环境风险因素引发的,疾病的预防和管理值得应有的重视。根据这些明确的触发因素,可以制定银屑病风险评估和疾病管理指南,有助于轻症或非典型病例的早期诊断和银屑病的精准管理。例如,感染史(不仅是化脓性链球菌感染,还包括这里列出的其他感染)、肥胖和高血脂水平、过度的心理压力、吸烟、睡眠障碍、高盐饮食、服用特定药物史都应被视为银屑病的风险因素。
从患者的角度来看,消除这些风险因素对于他们个人对疾病的管理至关重要。结合肠道菌群检测报告查看相关菌群超标或缺乏情况例如链球菌,AKK菌,产丁酸菌等,以及整体菌群平衡情况,对于疾病预警有着重要作用。通过及时调整生活方式、饮食习惯和适当药物治疗,可以有效地降低银屑病的发病风险,提高患者的生活质量。
从治疗角度来看,患者可能受益于早期治疗,包括但不限于结合菌群的抗生素治疗、标准化益生菌补充、抗高脂血症治疗等方式。了解触发因素在银屑病发病机制中的作用,与肠道菌群的关联,也将为开发针对银屑病发病和复发期间触发机制的新疗法提供线索。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Zhu Q, Wu K, Yang Q, et al. Advances in psoriasis and gut microorganisms with co-metabolites[J]. Frontiers in Microbiology, 2023, 14: 1192543.
Liu S, He M, Jiang J, et al. Triggers for the onset and recurrence of psoriasis: a review and update[J]. Cell Communication and Signaling, 2024, 22(1): 108.
Kranyak A, Haran K, Smith P, et al. The Mediterranean Diet as a Potential Solution to the Gut Microbiome Dysbiosis in Psoriasis Patients[J]. Journal of Psoriasis and Psoriatic Arthritis®, 2024: 24755303241226626.
Ryguła I, Pikiewicz W, Grabarek B O, et al. The Role of the Gut Microbiome and Microbial Dysbiosis in Common Skin Diseases[J]. International Journal of Molecular Sciences, 2024, 25(4): 1984.
Buhaș, M.C.; Candrea, R.; Gavrilaș, L.I.; Miere, D.; Tătaru, A.; Boca, A.; Cătinean, A. Transforming Psoriasis Care: Probiotics and Prebiotics as Novel Therapeutic Approaches. Int. J. Mol. Sci. 2023, 24, 11225.
Constantin, C.; Surcel, M.; Munteanu, A.; Neagu, M. Insights into Nutritional Strategies in Psoriasis. Nutrients 2023, 15, 3528.
Tampa, M.; Mitran, M.I.; Mitran, C.I.; Matei, C.; Georgescu, S.R. Psoriasis: What Is New in Markers of Disease Severity? Medicina 2024, 60, 337.
Zang C, Liu J, Mao M, Zhu W, Chen W, Wei B. Causal Associations Between Gut Microbiota and Psoriasis: A Mendelian Randomization Study. Dermatol Ther (Heidelb). 2023 Oct;13(10):2331-2343.

谷禾健康

日常感觉疲劳,精力不好,稍微不注意就容易腹泻便秘,一不小心就感冒,更可怕的是,无论使尽各种方法依然减不下去的体重……
有以上状况的小伙伴注意,可能是慢性炎症在体内作怪。炎症是我们免疫系统的自然反应,也就是说身体和病原体斗争,试图自愈的过程。
根据时间和病理特征,炎症可以是急性和慢性的。
急性炎症来势汹汹,通常持续时间很短(几分钟到几天),包括淋巴细胞/嗜中性粒细胞和巨噬细胞迁移到炎症部位,刺激促炎细胞因子的释放【如:肿瘤坏死因子-α(TNF-α)、白细胞介素6 (IL-6)、高运动性蛋白B1(HMGB-1)】,以及细胞聚集,酶分解等。
NOD样受体(NLRs)(如NLRP3、NLRP1和NLRC4)的激活导致高度调节的蛋白复合物(称为炎症小体)的募集,其激活启动下游炎症细胞因子的产生,主要是白细胞介素1β(IL-1β)和白细胞介素18 (IL-18)对细胞应激的反应。
其他中介包括趋化因子、脂质介质、急性期蛋白如C-反应蛋白(CRP)、转录因子包括核因子κB(NF-κB)和主要免疫细胞类型。
然而,急性炎症如果不受控制,则可能发展为永久性疾病,导致组织损伤、血流动力学改变和器官衰竭。
慢性炎症就像温水煮青蛙,带来的损害缓慢,但是持久。事实上,慢性炎症与肥胖等非传染性疾病和相关的共病的发生有关。在这方面,肥胖导致脂肪细胞中的异常脂肪积累、免疫细胞浸润和促炎环境,从而破坏胰岛素信号级联诱导胰岛素抵抗。
炎症和氧化应激相互作用对于理解肥胖症的生理病理学至关重要,包括内质网功能受损、脂肪组织缺氧、线粒体改变和活性氧过度产生。
肠道微生物群与肥胖相关的低度炎症的发展有关,包括脂多糖易位和toll样受体4(TLR-4)结合,从而引发血液内毒素血症。
由此产生的未解决的免疫激活不仅影响局部组织,还影响全身生理学,即所谓的代谢性炎症。
本文讨论了不同营养因素对炎症的影响和最终调节,包括特定营养素(碳水化合物类型、蛋白质来源、结构脂肪酸、矿物质、微量元素)和生物活性化合物(多酚);饮食模式(即西方、地中海和北欧饮食);治疗性饮食(DASH饮食);常见烹饪原料(调味品和草药)等。
与人类炎症结果相关的营养因素

了解日常饮食中的营养物质对炎症的影响和调节,可以帮助我们在日常饮食中有意识地进行相应调整,从而更好地改善健康状况。
纵向和观察性研究表明,膳食维生素摄入量与炎症特征之间存在一些关联。
例如,维生素C和E或胡萝卜素的摄入与血清CRP浓度的概率成反比 > 美国成年人服用3 mg/L。
在横断面KORA研究中,剂量-反应分析显示,经常摄入超过78毫克维生素E/天的参与者的血清CRP水平比未接触任何额外维生素E来源的受试者低22%。
摄入含有维生素E和C以及B族复合维生素(B1、B2、B3、B5、B6、B9和B12)的膳食补充剂与女性血CRP水平降低相关。
饮食维生素K1(叶喹酮)摄入量变化的上三分位受试者(随访1年后)的IL-6和TNF-α血浆浓度比最低三分位组的受试者下降更大。
健康韩国成年人的膳食维生素B5摄入量与血清CRP浓度呈负相关。
消费 > 健康成人每天摄入310毫克的膳食胆碱(通常归入复合维生素B组),血液中CRP、IL-6和TNF-α浓度较低。
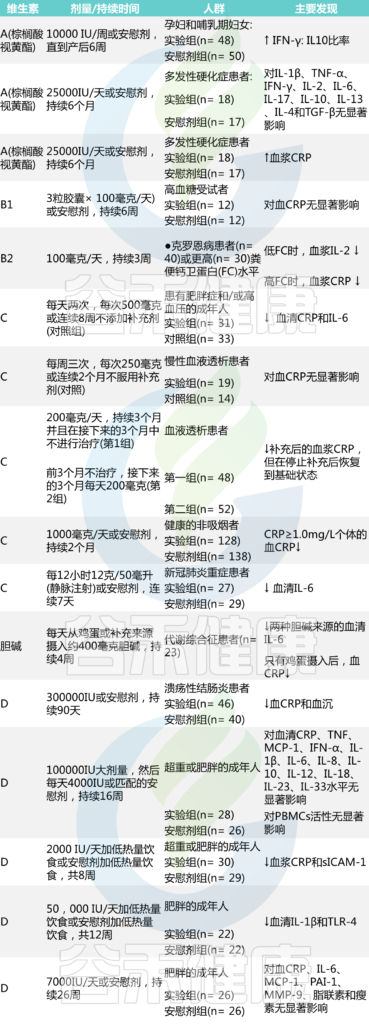
系统总结了探索维生素对炎症状态影响的临床试验结果(下表)。一些研究发现,补充维生素后有助于降低炎症。
表 临床试验:维生素和生物活性化合物抗炎作用

doi: 10.1007/s13679-022-00490-0
矿物质和微量元素对人体的结构、免疫和代谢功能至关重要。
高镁摄入与绝经后妇女体内潜在炎症标志物(CRP、sTNF-R2和IL-6)的血浆浓度降低有关。
在护士健康研究队列中,发现饮食来源的镁摄入量与血浆IL-6呈负相关。
一项嵌套病例对照研究报告,绝经后妇女的饮食锰与血清促炎细胞因子循环水平存在相反的关联。
据报道,淋巴细胞增殖和IL-2R表达的变化是健康男性轻度缺锌的早期标志。
膳食铜摄入量与成人血液CRP浓度直接相关。
反过来,肥胖相关炎症对肠道铁吸收的影响可能会加剧铁缺乏。
还显示了补充某些矿物质对人体抗炎作用的主要结果(下表)。
表 分析某些矿物质抗炎作用的临床试验



doi: 10.1007/s13679-022-00490-0
膳食碳水化合物对健康的影响取决于数量和质量特征。有趣的是,低碳水化合物饮食(总能量的20%)显著改善了糖尿病患者的亚临床炎症状态(血清IL-1Ra和IL-6水平较低)。
值得注意的是,坚持低碳水化合物饮食(占总能量的35%)可以降低肥胖女性的炎症标记物水平。
此外,低碳水化合物饮食的总体效果良好(≤ 30克/天)。此外,如其他地方报道的那样,与低脂饮食(总能量的24%)相比,极低碳水化合物饮食(占总能量的12%)可减少炎症反应。
血糖指数(GI)旨在根据对餐后血糖浓度的影响,从生理学上评估不同食物的碳水化合物质量。
有趣的是,高GI饮食(基于煮熟的意大利面,GI = 35)显著增加了瘦健康受试者单核细胞中NF-κB的激活率。
事实上,在糖尿病患者中,高GI饮食(GI > 70)诱导的负面代谢和炎症反应被低GI饮食(GI < 55)抵消。
此外,DIOGenes试验的结果表明,超重或肥胖受试者在减肥后,低GI碳水化合物(高GI碳水化合物的差异为15分)可以减少通过减肥饮食维持的低度炎症。
膳食纤维可能对健康有益,涉及一些免疫机制。因此,在糖尿病患者中,纤维摄入量等于或大于15 g/1000 kcal与血液CRP水平降低相关。
一项随机干预试验表明,从天然富含纤维的饮食或从补充剂中摄取纤维(30 g/天)可以显著降低瘦削正常血压参与者的循环CRP水平。
此外,中年成人膳食纤维摄入量(平均16.8克/天)和CRP血清浓度之间存在显著的负线性关系。
扩展阅读:肠道菌群与蛋白质代谢
膳食脂肪在生物体内引发许多基本功能;然而,过度消耗脂肪可能导致肥胖和相关的低度炎症过程。
事实上,临床证据表明,高脂饮食(即接近总能量的75%)会导致循环游离脂肪酸的过度生产和全身炎症。
一直以来,低脂饮食(占能量需求的25%)与糖尿病患者血浆IL-6水平降低相关。
越来越多的证据表明,膳食饱和脂肪酸(SFA)在肥胖和炎症之间起着重要的联系。
有趣的是,与摄入正常饱和脂肪的受试者相比,摄入超过10%能量作为饱和膳食脂肪的受试验者血清CRP水平升高(< 7%的热量摄入)。
同样,摄入膳食饱和脂肪酸(100毫升饱和脂肪含量为70%的乳脂)导致女性血浆CRP的脂质诱导升高,与肥胖状况无关。
单不饱和脂肪酸(MUFAs)被认为是一种健康的脂肪,油酸(OA)是日常营养中最常见的MUFA。
在这种情况下,一项针对日本人群的横断面流行病学研究报告,油酸摄入量(平均占总能量的6.94%)与血清CRP浓度之间存在显著的负相关。
对于不同剂量的MUFA治疗炎症特征的进一步对照试验是有保证的。
在过去的几年里,大量证据支持多不饱和脂肪酸(PUFAs)在预防心血管疾病和其他炎症性慢性疾病方面的有益作用。
在这种情况下,健康人n-3 PUFA二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的摄入量与血浆中可溶性TNF受体1和2的水平呈负相关。
此外,总膳食n-3 PUFA与女性CRP和IL-6的血水平呈负相关。
此外,一些临床试验评估了高PUFA饮食处方或通过补充PUFA对炎症结果的影响。例如,鱼油补充(38.2克/天EPA + 90天内的DHA)降低了高血压患者血液中促炎症标记物的水平。
健康的年轻人服用n-3 PUFA(2.5 g/天,2085 mg EPA和348 mg DHA)12周后,血清IL-6水平下降了14%。
在超重成人中,低(1.25 g/天)或高(2.5 g/天)剂量的n-3 PUFA补充4个月可以减少炎症反应(特别是血清IL-6和TNF-α浓度)。
反式脂肪酸(TFA)主要由植物油氢化或反刍动物衍生食品(包括乳制品和肉类)在工业上形成。
反式脂肪酸摄入量与女性血浆炎症生物标志物(包括CRP、VCAM-1、E-selectin)呈正相关。
在同一人群中,反式脂肪酸的摄入与可溶性TNF受体1和2的血浆水平呈正相关,主要是在体重指数较高的女性中。
男性服用TFA(占总脂肪的8%)后血清CRP浓度升高。
胆固醇过高可能会对健康产生有害影响,包括一些影响炎症状态的过程。
例如,在伊朗成年人中,血清CRP浓度的最高四分位数(5.9 mg/L)与饮食胆固醇的摄入量较高(189 mg/天)有关。
在大量具有代表性的中东人群中,发现饮食胆固醇和血浆CRP水平之间存在正相关。
膳食蛋白质的数量和质量是营养价值和身体/内分泌稳态的主要决定因素。
在Framingham心脏研究后代队列的参与者中,膳食蛋白质摄入量(尤其是植物来源的蛋白质)与血清炎症标记物(如IL-6和CRP)呈负相关。
此外,摄入高(总能量的30%)或低(总能量10%)蛋白质饮食会导致病态肥胖个体的血液CRP浓度降低。
关于蛋白质来源,以较高动物蛋白质摄入量(高脂肪和加工肉类水平)为特征的饮食与某些血液促炎标记物(如CRP、IL-6、TNF-a、IL-8、血清淀粉样蛋白a和糖蛋白乙酰化)呈正相关。
此外,RESMENA膳食研究的结果(30%的能量来自蛋白质)表明,动物和肉类蛋白质摄入量与炎症之间存在正相关,而蔬菜或鱼类来源的蛋白质对炎症状态没有显著影响。
扩展阅读:肠道菌群与蛋白质代谢
多酚是一大类生物活性分子,广泛存在于植物性食品中,具有强大的抗氧化和抗炎特性。在这种情况下,据报道,美国成年人的总黄酮摄入量与血清CRP浓度呈负相关。
在多种族队列中,黄烷酮消耗量与血液IL-6浓度呈负相关。同样,异黄酮摄入量较高(最高四分位数 = 1.61–78.8 mg/天)与健康绝经前妇女血浆CRP降低有关。
此外,在黄酮、黄烷酮和总黄酮摄入量较高的女性中,发现血清IL-8水平较低(五分位数最高 = 分别为264 ng/L、273 ng/L和276 ng/L)。
此外,台湾人群总黄酮摄入量和茶叶摄入量的增加与CRP水平呈负相关。
值得注意的是,许多随机临床试验已经测试了几种多酚的抗炎潜力,其结果总结如下:
表 分析某些多酚抗炎作用的临床试验

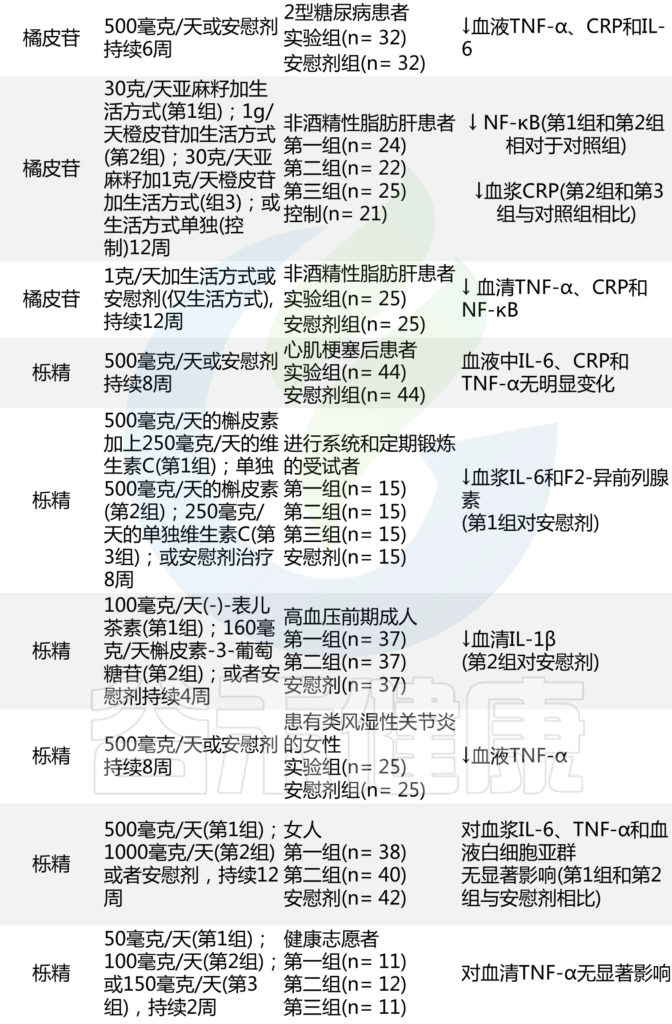

doi: 10.1007/s13679-022-00490-0
扩展阅读:
关于对炎症的影响,总摄入(中位数54 g/天)、未加工(中位数47 g/天)。
在多民族队列研究中,红肉和加工肉消费与血清CRP水平呈正相关。
在英国成年人中,食用加工肉与血清CRP水平增加有关(每天摄入50克以上,差异为38%)。
在调整后的模型中,在大量美国样本中,红肉消耗量与血液CRP显著相关。
在一项针对巴西人的横断面研究中,增加酸奶摄入量(中位数为10克/天)似乎会产生抗炎作用,而奶酪摄入量的增加(中位数10.7克/日)可能会加剧促炎状态。
在体重正常的青少年中,总乳制品和牛奶摄入量与血清IL-6浓度呈负相关。
ATTICA研究的结果显示,每周食用11-14份乳制品的人的CRP、IL-6和TNF-α血水平低于每周食用8份以下的人。
ATTICA研究结果显示,习惯性鱼类消费之间存在独立关联(> 每周食用300克鱼),并降低健康成年人的炎症标记物水平,包括CRP、IL-6、TNF-a、血清淀粉样蛋白a和白细胞计数降低。
在6年的随访中,食用鱼(约100克/周)可降低健康成人的内皮功能障碍和轻度炎症。
在表面上健康的日本人群中,高频率摄入鱼类与较低的外周血白细胞计数(慢性炎症标志物)相关。
事实上,随着每周摄入鱼的频率(0天、1-2天、3-4天或5-7天)的增加,全身炎症的标志显著降低(全身炎症的标志:中性粒细胞/淋巴细胞比率)。
近年来,食用昆虫被公认为具有抗炎和抗氧化特性的高价值食品。
例如,在健康成年人中,蟋蟀摄入量(25克/天)与通过微生物群调节减少全身炎症相关。
然而,需要对人类进行更多的研究来证实这些发现,以便推荐习惯性食用食用昆虫作为消炎疗法。
伊朗女性的水果和蔬菜摄入量与血清CRP水平呈负相关。
中国女性食用大量十字花科蔬菜(最高五分之一 > 140.6 g/天)显示循环中TNF-α、IL-1β和IL-6水平降低。
在一项随机交叉试验中,14天内食用十字花科蔬菜(14 g/kg体重)持续降低健康年轻人的循环IL-6.
在动脉粥样硬化的多种族研究中,经常食用坚果和种子(尤其是每周五次或五次以上)与较低水平的炎症标记物相关,包括IL-6和CRP。
在两个大的美国人队列中,与从未或几乎从未的频率类别的个体相比,每周坚果摄入五次或更多次的受试者的CRP和IL-6血浓度显著降低。
对随机对照试验的系统回顾和荟萃分析显示,摄入亚麻籽和相关营养衍生物系统地降低了肥胖受试者的循环CRP水平。使用同样的方法,急性高油酸花生摄入系统性地导致超重/肥胖男性餐后TNF-α浓度的下调。
研究表明,在健康饮食中添加杏仁(4周内每天56克)可以改善中国糖尿病患者的炎症和氧化应激。
一项随机试验还发现,在健康成年人中,食用杏仁(用杏仁替代对照饮食10–20%等量摄入4周)可以降低血清CRP水平。
事实上,在青少年和青年人中,杏仁喂养(每天56克,持续90天)后,血浆TNF-α和IL-6水平下降。
据报道,每天服用50毫升特级初榨橄榄油(EVOO),为期两周,可降低稳定型冠心病患者的血浆IL-6和CRP水平。
EVOO(50 mL)对正常血压的健康受试者具有急性餐后抗炎和抗氧化作用。
有趣的是,在糖尿病妇女中,谷类纤维的摄入与较低的CRP和TNF-R2血液水平呈负相关。
超重和肥胖受试者食用全麦小麦(8周内每天70克)后,血清TNF-α水平下降,血浆IL-10水平升高。
GRANDIOOS研究的结果表明,食用全麦小麦(每天98克,持续12周)可能会促进超重/肥胖和轻度高胆固醇血症患者的肝脏和炎症恢复力。
在中国中年女性中,食用大豆食品与炎症标志物(如IL-6、TNFα和可溶性TNF受体1和2)的循环水平呈负相关。
与习惯性饮食相比,一项为期6周的富含豆类的饮食营养试验(在所有干预阶段共摄入24包65克)显著降低了糖尿病患者的CRP浓度。
基于豆类的低热量饮食(每天160–235克,持续8周)持续降低超重/肥胖受试者的促炎状态并改善代谢特征。
在肥胖女性中,8周内补充绿茶提取物(450 mg/天)改善了氧化应激生物标记物,降低了IL-6循环水平。
3个月内饮用绿茶(379 mg/天)可降低肥胖、高血压患者的血清CRP和TNF-α浓度。
高咖啡消耗量(每天8杯)对习惯性咖啡饮用者的亚临床炎症产生了有益影响。
一直以来,在健康和糖尿病女性中,饮用咖啡与炎症标记物和内皮功能障碍呈负相关。
在年龄较大的非西班牙裔白人中,大量饮用咖啡(等于或超过2.5杯/天)的人全身炎症较低。
另一方面,来自ATTICA研究的分析报告称,中度至重度咖啡摄入后,炎症标记物(包括IL-6、TNF-α和CRP)增加(> 200毫升咖啡/天),强调剂量对结果的重要性。
补充蜂胶和限制热量饮食8周可以显著改善非酒精性脂肪性肝病患者的血糖稳态、肝纤维化评分和肝功能。
一项双盲安慰剂对照随机临床试验,44名非酒精性脂肪性肝病患者,用蜂胶和热量限制饮食(500千卡/天)干预,发现炎症因子降低,包括肿瘤坏死因子-α (TNF-α)、toll样受体-4 (TLR-4)和单核细胞趋化蛋白-1 (MCP-1)的血清水平以及肝酶和脂肪肝的严重程度显著降低。
现有证据表明,定期食用黑巧克力可能会减少炎症,尤其是对于每3天食用一份(20克)黑巧克力的消费者而言。
在一项随机平行临床试验中,与仅遵循一般生活方式指南的受试者相比,服用黑巧克力(8周内服用30克84%的黑巧克力)并保持健康生活方式的糖尿病患者的炎症标记物(CRP、TNF-α和IL-6)水平较低。
事实上,急性黑巧克力摄入(50克)通过增加IL-10的表达和减弱细胞内促炎性应激反应而引发抗炎症结果。
健康女性在摄入黑巧克力(一周内每天100克)后,CRP的血液水平较低,这在男性中没有发现。
在过去几十年里,几项调查已经确定了香料和草药在预防和治疗各种慢性病方面的有效作用。这些烹饪成分的多种健康特性归因于具有潜在抗炎特性的生物活性成分,如含硫分子、单宁、生物碱和酚类二萜。下表总结了探索香料对炎症状态影响的临床试验结果。
表 分析某些香料和烹饪成分抗炎作用的临床试验
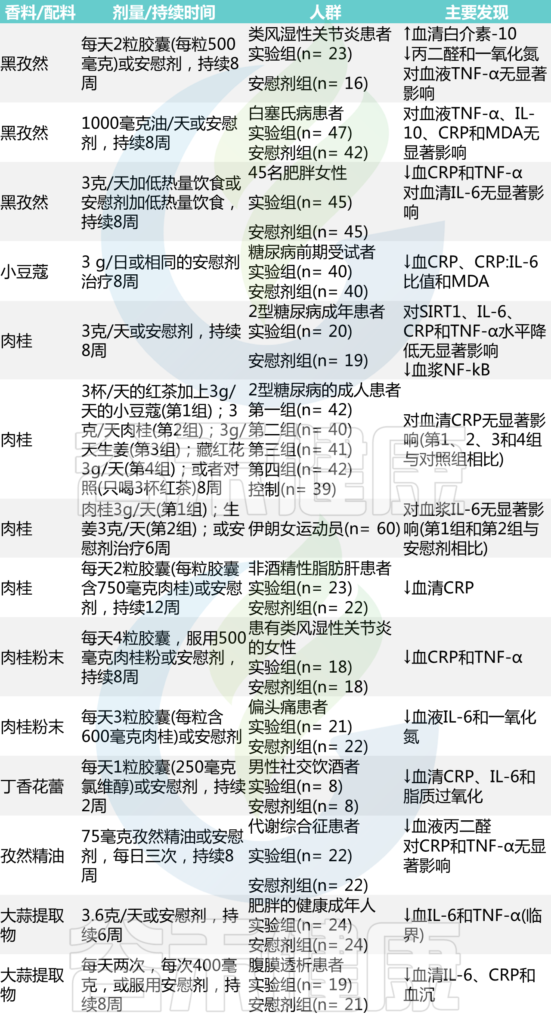

doi: 10.1007/s13679-022-00490-0
益生菌、益生元和合生元是有益的微生物、底物(多糖和寡糖)或最终也可能缓解炎症症状的组合。
对于糖尿病患者,建议补充益生菌和合生元,通过持续降低循环中CRP和TNF-α的水平来减少炎症表现。
关于肠道疾病,最近有报道称,使用益生菌(基于乳酸杆菌和双歧杆菌)和合生元可以促进抗炎反应并平衡肠道内稳态。
短链脂肪酸(称为后生元的非活性细菌产物)的抗炎作用是通过抑制肠上皮细胞中的NF-κB通路、Treg细胞分化和促炎细胞因子阻断来介导的。例如,干酪乳杆菌DG和衍生后生物抑制肠易激综合征患者结肠粘膜中IL-8、IL-1α、IL-6和TLR-4的表达水平。
关于益生菌,益生元在此就不详述了,在前面的文章已有介绍,详见:
总的来说,植物性饮食已经证明可以改善肥胖相关的炎症状态。
值得注意的是,在北美,素食对血液CRP和IL-6水平的有益影响是由BMI介导的。此外,一项系统回顾和荟萃分析显示,素食饮食模式也降低了免疫生物标志物,如纤维蛋白原和白细胞总浓度。
对观察性和干预性试验的系统审查表明,北欧饮食(以北欧国家的主食为基础)对低度炎症缓解有积极影响。潜在机制包括代谢综合征患者的促炎症基因下调,尤其是TNFRSF1A和RELA。
南欧大西洋饮食(SEAD)是葡萄牙北部和西班牙加利西亚的传统饮食,其特点是摄入更多的鱼、牛奶、土豆、水果、蔬菜和橄榄油以及红酒。总体而言,SEAD依从性与炎症标记物(主要是CRP)的血浆浓度降低和心脏代谢风险降低相关。
就亚洲地区而言,健康的日本饮食模式(富含蘑菇、海藻、大豆制品和土豆、蔬菜、鱼类/贝类和水果)似乎可以发挥抗炎作用,改善当地消费者的心理健康。
一些中药已经显示出抑制促炎途径和控制炎症相关疾病。
墨西哥传统饮食(TMexD)已证明可以降低墨西哥裔女性的全身炎症和胰岛素抵抗风险。TMexD的特定食物包括玉米、豆类、辣椒、南瓜、番茄、仙人掌和洋葱,它们富含纤维、维生素、矿物质和辣椒素,具有潜在的抗炎和抗氧化特性。
在一项综合横断面研究中,旧石器时代饮食(基于蔬菜和水果、瘦肉、鱼类、坚果和钙来源的多样性消费)与人类较低水平的全身炎症和氧化应激相关。
在6周内,DASH饮食模式(以水果和蔬菜、低脂乳制品和复合碳水化合物的大量摄入为特征)降低了代谢综合征青少年的CRP循环水平。在女性成年人中,DASH饮食与伊朗人血清CRP水平较低有关,但与IL-17A浓度无关。定量评估显示,随访4周后,DASH饮食使CRP降低了13%。
PREDIMED试验的结果表明,地中海饮食(富含蔬菜和水果、纤维和维生素C和E)具有抗炎作用,因为它下调了动脉粥样硬化形成过程中涉及的细胞和循环炎症生物标记物。
在这个队列中,地中海饮食降低了血清CRP和IL-6水平,以及内皮和单核细胞粘附分子和促炎性趋化因子。此外,在随访1年后,Med饮食(包括EVOO和蔬菜)降低了心血管高危患者的血浆TNFR60浓度。长期(3年),PREDIMED试验通过与对照低脂饮食相比降低IL-1β、IL-6、IL-8和TNF-α水平,证实了Med饮食的抗炎作用。
总的来说,西式饮食(WTD)含有大量不健康的脂肪、精制谷物、糖和盐,会引发慢性代谢性炎症。在这方面,在护士健康研究I队列中,西式饮食与炎症和内皮功能障碍标志物呈正相关。此外,伊朗女性的西式饮食评分与CRP和IL-6促炎标记物呈正相关。
有趣的是,巴西妇女食用含有大量游离糖、总脂肪、膳食饱和脂肪酸、反式脂肪酸和钠的超加工食品(UPF)与血清CRP水平之间存在正相关。同样,超加工食品中上三分之一的巴西青少年(≥ 总能量的30%)与第1三分位青少年相比,循环IL-8浓度增加(≤ 15.9%的总能量)。
此外,瑞典类风湿关节炎患者的不良饮食质量(考虑到习惯性随意饮食,如糖果、蛋糕、软饮料和油炸土豆)与炎症增加有关,如血浆CRP和红细胞沉降率。
生物节律和营养分析(称为“时间营养”)的最新进展表明,一天中进食的时间可能会影响代谢稳态和免疫功能。
在这种情况下,在饮食质量较差的成年人中,不吃早餐与血清CRP浓度升高之间存在显著关联。在一项随机对照交叉试验中,不吃早餐会导致人类外周血单核细胞和单核细胞中NLRP3炎性体的更高活化。
间歇性禁食(IF),即个体连续或隔天禁食,改善了肥胖男性的全身炎症。然而,在超重或肥胖的女性中发现了间歇性禁食后,脂肪组织中巨噬细胞浸润(CD40+)和骨骼肌(CD163 +)的生物标志物短暂升高。
现有证据表明,限时饮食(TRE)是一种基于一天活动期总热量摄入巩固的替代时间营养方法,可能会调节多种代谢疾病风险因素,包括炎症。事实上,已经假设TRE作为定期营养计划的一部分,可能有助于减少炎症,并对免疫系统的某些组成部分产生保护作用。
有趣的是,代谢综合征患者在隔日禁食(ADF)后,血液CRP水平显著下降,ADF包括“禁食日”,热量摄入有限,而“喂食日”则是随意进食。此外,隔日禁食降低了健康非肥胖受试者血浆中sICAM-1(年龄相关炎症标记物)的水平。
此外,据报道,晚吃是指推迟用餐时间(通常是一天的主食或晚餐),可能会增加患心脏代谢疾病的风险。事实上,晚吃与腹部肥胖、炎症生物标志物(如IL-6和CRP)以及儿童的昼夜节律紊乱有关。
对精确变量(年龄、性别、身体表型、习惯性饮食摄入、体力活动水平和生活方式)以及个性化问题(遗传背景、表观遗传特征、微生物群组成、基因表达谱和代谢指纹)的综合分析可能有助于制定更个性化的治疗方案,以改善炎症的营养和药物管理。
例如,有证据表明,遗传变异可能通过与环境因素(如饮食)的相互作用,调节个体对与炎症相关的慢性和急性疾病的易感性,从而易诱发炎症状态。
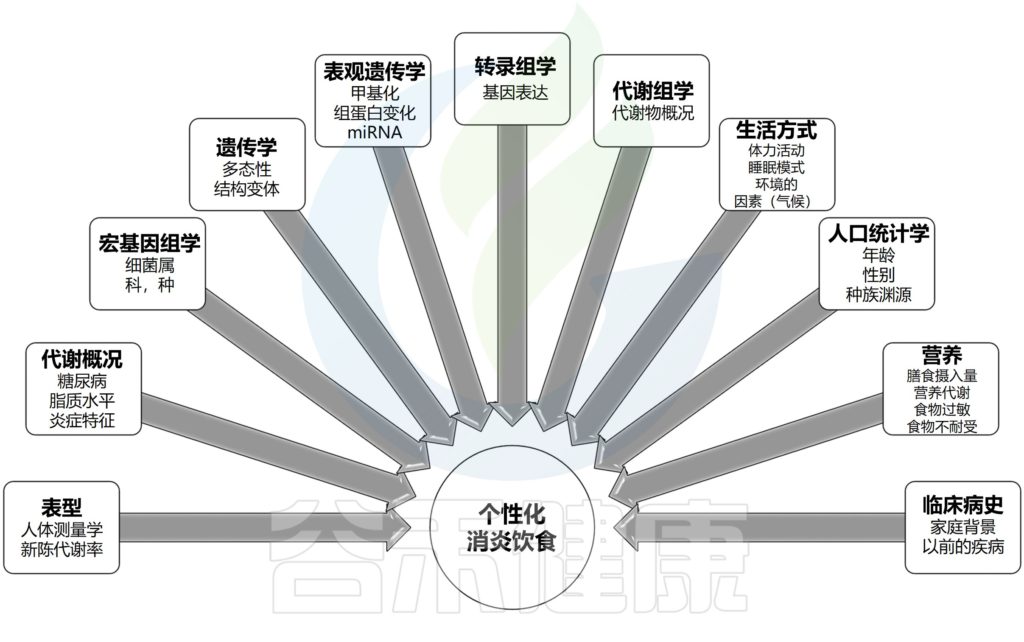
表观遗传标记(包括DNA甲基化、miRNA表达和组蛋白修饰)在炎症基因转录中起着基础作用。
值得注意的是,基于微生物群的回归模型已经能够预测人类肥胖相关炎症状态,这可能是精确管理炎症性的有用工具。
具有促炎和抗炎作用的基因表达最终决定炎症的结果。
代谢组学是一种综合方法,可用于剖析炎症的局部和全身代谢后果,为炎症疾病的调节提供新的见解。
这些应用有助于阐明独特和特异的炎症代谢类型,扩大了我们对人类代谢复杂性和多样性的理解。
总的来说,这些新颖的科学见解正带来精确药物/营养战略,以预防和控制具有炎症背景的流行性慢性病。
营养物质对生命和健康至关重要,不仅有助于疾病预防、健康维护和疾病管理,而且可以抵御内源性和外源性有害因素,包括炎症/氧化应激或免疫系统功能障碍。
促炎
促炎营养因素包括大量食用富含简单碳水化合物、膳食饱和脂肪酸、TFA、胆固醇和动物蛋白的食物,以及习惯性不吃早餐和晚吃暴食。
抗炎
潜在的抗炎化合物包括MUFA、PUFA、抗氧化维生素和矿物质、生物活性分子(多酚)、特定食品(乳制品、全谷物、鱼类、油籽、水果和蔬菜、食用昆虫、豆类、绿茶和咖啡),烹饪香料(肉桂、姜、小茴香、大蒜和姜黄)和一些饮食习惯,包括间歇性禁食和限时进食。
由于研究之间存在不一致和差异,考虑到异质性的关键方面,包括人群类型(祖先)、最低和最高水平以及不利影响、烹饪方法、生理病理状态和干预时间,仍需在该领域进行进一步研究。
目前的证据有助于理解营养与代谢性炎症之间的关系,为慢病的控制和管理提供了新的见解和潜在目标。
主要参考文献:
Ramos-Lopez O, Martinez-Urbistondo D, Vargas-Nuñez JA, Martinez JA. The Role of Nutrition on Meta-inflammation: Insights and Potential Targets in Communicable and Chronic Disease Management. Curr Obes Rep. 2022 Oct 18. doi: 10.1007/s13679-022-00490-0. Epub ahead of print. PMID: 36258149.
Li C, Xu MM, Wang K, Adler AJ, Vella AT, Zhou B. Macrophage polarization and meta-inflammation. Transl Res. 2018 Jan;191:29-44. doi: 10.1016/j.trsl.2017.10.004. Epub 2017 Nov 3. PMID: 29154757; PMCID: PMC5776711.
Nikbaf-Shandiz M, Tutunchi H, Khoshbaten M, Nazari Bonab H, Ebrahimi-Mameghani M. Propolis supplementation in obese patients with non-alcoholic fatty liver disease: effects on glucose homeostasis, lipid profile, liver function, anthropometric indices and meta-inflammation. Food Funct. 2022 Oct 20. doi: 10.1039/d2fo01280d. Epub ahead of print. PMID: 36263703.
Rossi JF, Lu ZY, Massart C, Levon K. Dynamic Immune/Inflammation Precision Medicine: The Good and the Bad Inflammation in Infection and Cancer. Front Immunol. 2021 Feb 23;12:595722. doi: 10.3389/fimmu.2021.595722. PMID: 33708198; PMCID: PMC7940508.