 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
当人还是婴儿时,会从父母那里得到微生物;和宠物玩耍或接触时,也会从宠物那得到微生物;有时候人没有直接和动物玩耍,只是接触动物的粪便,甚至其他环境的微生物,都会交换微生物…
这些其实都与微生物的社会传播有关。社会互动对微生物组成的影响可以从出生延伸到成年。比如说同一家庭内的个体通常共享12%的肠道微生物菌株。
我们知道社会互动会推动病原体的传播,比如说,狩猎和食用森林猎物会增加感染人畜共患病毒的风险,从而将病原体引入人类社交;但与宿主相关的互惠共生体和共生微生物通过社会传播对宿主健康和疾病的贡献还很少研究。
刚刚,来自世界顶级学术殿堂——哈佛大学的人类进化生物学系Amar Sarkar研究团队发表在《Cell》上的综述成果,使用“社会微生物组”的概念——即宿主社会网络中的微生物群落整体,来分析社会微生物传播对宿主健康和疾病的影响。
社交可能带来一些潜在好处:
当然,社交也可能伴随微生物风险:
本文谷禾小编与大家分享此篇文章内容及观点。文章综合论述了社会微生物组概念下微生物的社会传播,研究主要关注肠道微生物组及其对宿主健康的关联,同时也探讨了其他身体部位的微生物组。
文中提出了五个塑造社会微生物组的社会生态力量层面,包括在不同宿主间、网络层面、群体间、物种内以及物种间的微生物交换。
定义了两个维度来分析社会微生物传播与宿主健康和疾病之间的关系,包括更广泛的生态进化过程和特定微生物在宿主间的传播。
这些过程涵盖了定居抗性、毒力和微生物传播性的进化、对生态干扰的微生物组反应、具有显著代谢和免疫效应的微生物传播、跨种传播和人畜共患病溢出、耐抗生素微生物和微生物基因的传播,以及宿主病毒组的病毒传播。
文章描述了这些类别的一系列效应、结果和预测,并提出了实证方法来检验这些预测。
最后,分析了微生物的社会传播在传染病和非传染性疾病(如心血管疾病、自身免疫疾病、代谢性疾病、过敏性疾病、神经系统疾病和癌症)中的作用,并评估了非传染性疾病可能包含由微生物社会传播引起的传染性成分。根据宿主-微生物相互作用的性质和其他宿主因素,这种社会传播的成分可能会减轻或加剧疾病风险和严重程度…
这些内容对于理解健康的社会决定因素具有重要意义。我们一起来详细了解一下吧。
图 1 塑造社会微生物组的社会生态力量以及社会传播微生物对宿主健康和疾病的影响
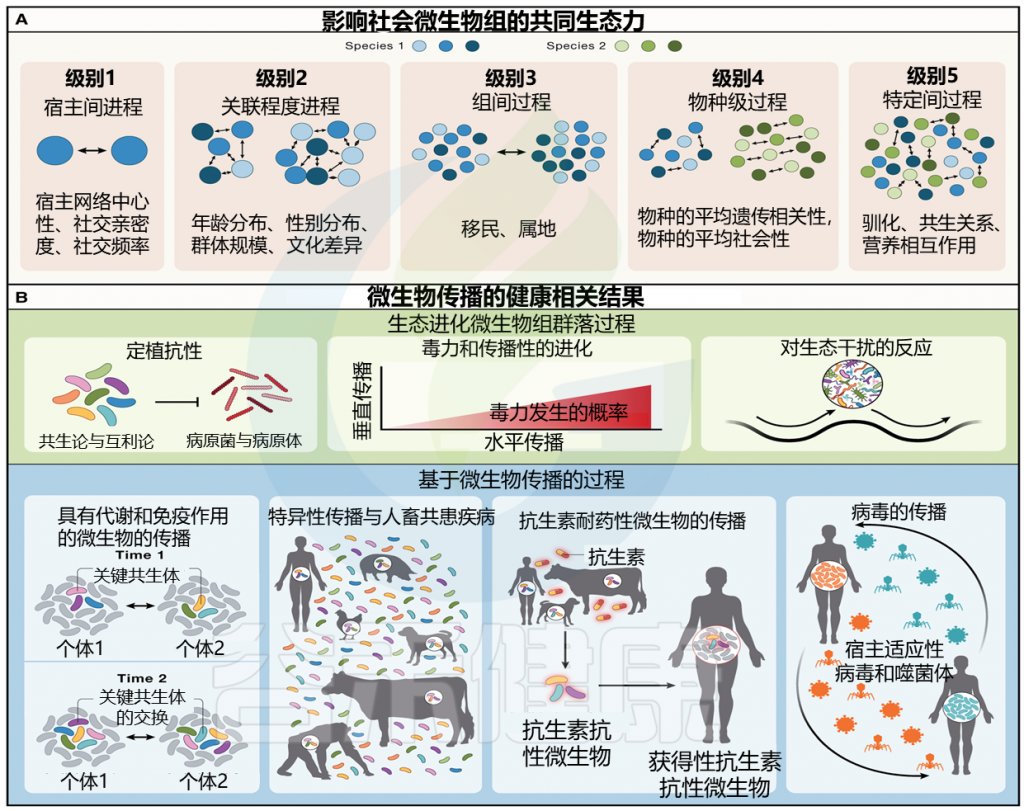
doi.org/10.1016/j.cell.2023.12.014
(A) 不同社会生态尺度的过程影响社会微生物组。蓝色和绿色圆圈表示独特的宿主个体。这些过程不必相互排斥。
(B) 预计受微生物社会传播影响的健康相关过程。这些可以分为两大维度:生态进化微生物群过程和基于微生物传播的过程。
动物肠道微生物组是高度动态的生态系统,它们在不同宿主之间以及随时间在同一宿主内显示出相当大的变化。
微生物的组成受到环境因素的影响,例如饮食和从外部来源的微生物的传播,以及宿主内在因素的影响,如生理和遗传。
如何理解微生物组的动态变化?
群落生态学理论为理解这些动态提供了一个有用的框架。在这个框架下,每个宿主的微生物组是一个“岛屿”,一个由在宿主内部和宿主之间运作的生态过程所塑造的独特群落。
其中宿主内部包括微生物间的相互作用和宿主对微生物的选择作用;宿主之间包括社会传播和外部环境施加的选择,如下图。
图2 社交微生物组中微生物组装和微生物传播
doi.org/10.1016/j.cell.2023.12.014
怎么理解社会微生物组?
社会微生物组指的是动物社会网络(以及其基因和基因产物)的微生物群落整体,其中宿主岛屿网络可以形成独特的生物群岛(上图)。
此外,同一宿主物种的不同社会群体即使栖息在相似的生态环境中,往往也具有不同的社会微生物组。每个微生物组都嵌入在一个社会生态网络中,并通过微生物传播与其他微生物组相连。
如何通过互动影响微生物的传播和变化?
微生物的社会传播可以在五个不同但不相互排斥的递增生态尺度级别上进行分析。这些范围从宿主间到种间互动,可以影响宿主间微生物交换的性质和频率(图1A;表1)。
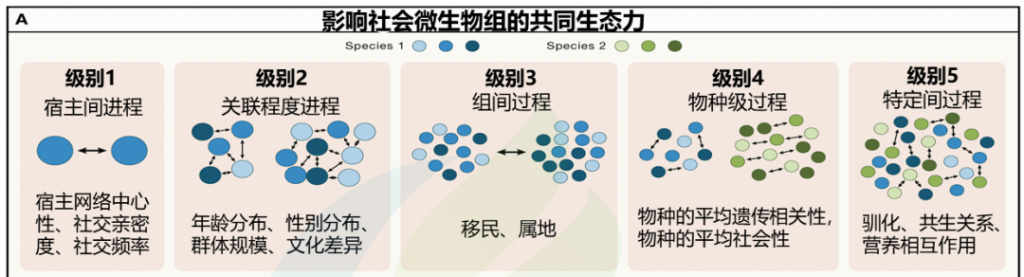

编辑
doi.org/10.1016/j.cell.2023.12.014
重要的是,微生物的社会传播已被显示与宿主社会网络呈共变,并反映宿主社会网络。实际上,社会传播的微生物甚至可以在人类的二阶互动中被检测到。
例如,如果A与B互动,B与C互动,那么C就会带有从A获得的、通过与B的互动获得的共生体和互惠共生体的微生物痕迹。之前已在像结核分枝杆菌这样的病原体中就有这种现象。
然而,如果这样的模式也描述了共生体和互惠共生体的传播,那么它将表明个体的扩展社会网络通过作为社会网络其他部分微生物的储藏库的中介社会伙伴影响微生物组的组成。
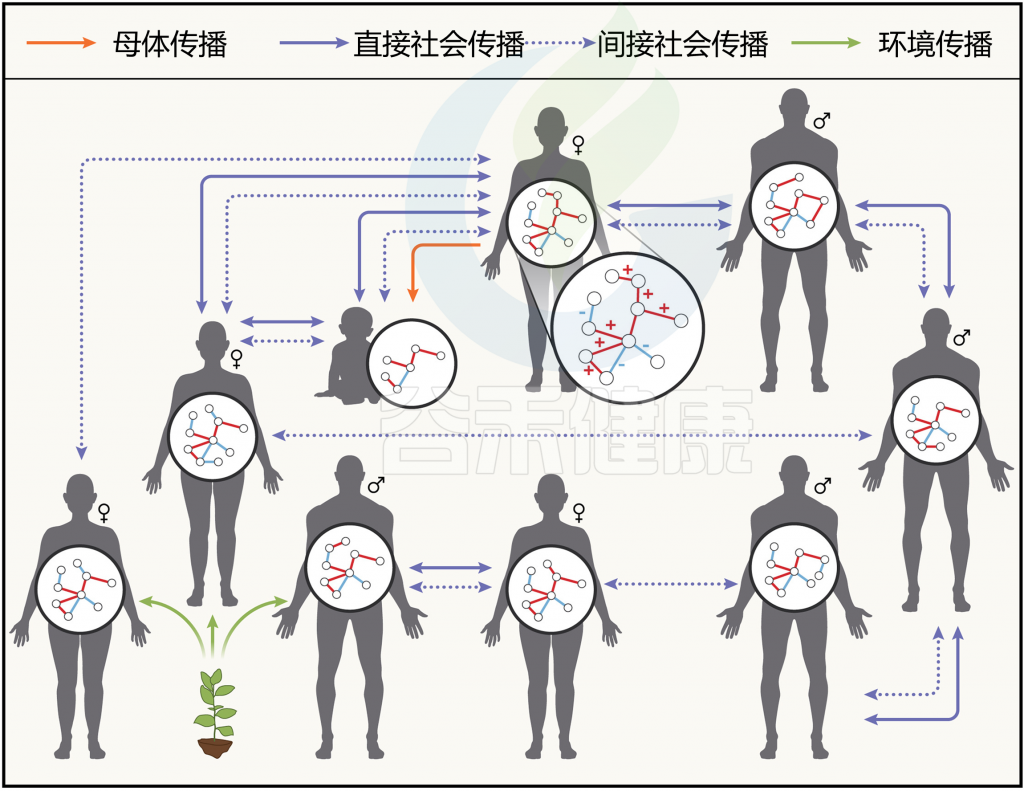
微生物的社会传播有哪些形式?
可以分为三种广泛的形式。
1)早期生活中发生的亲代传播,由于其重要影响,被单独视为一种社会微生物传播形式;
2)直接社会传播,动物通过社会互动水平地获得微生物;
3)在共享环境中的间接社会传播,微生物通过偶然接触粪便或其他具有持久机制的宿主相关微生物在宿主之间传播。
doi.org/10.1016/j.cell.2023.12.014
微生物组的组成受到社会网络内成对关系的影响,社会互动对微生物组成的影响可以从出生延伸到成年。近期的人类案例显示了社会影响对微生物组成的动态和嵌套性质。
个体之间的菌株共享
在同一家庭内,共同居住导致母亲和子女之间、兄弟姐妹之间以及非亲属之间微生物菌株的共享增强。
家庭层面的特征也会影响微生物组成
例如,婴儿肠道中某些细菌属的相对丰度,包括乳杆菌属、梭菌属、肠杆菌属和克雷伯菌属,已显示与家庭大小和兄弟姐妹数量相关。
肠道微生物组在大约三岁时变得更稳定,并显示出更成熟的特征。此后,成对共享的菌株数量不再取决于亲缘关系(母婴、父婴、伴侣之间或兄弟姐妹之间),而是取决于社会环境。
此外,共同居住的影响似乎比年龄对成年双胞胎菌株共享模式的影响更大。这表明成年人观察到的菌株共享模式更多依赖于社会关系而非母源性微生物组。
微生物的社会传播特征在哪些部位体现?
包括肠道、皮肤和口腔。
特定身体部位的微生物可能迁移到新的部位。例如,近期的研究表明,在个体人类中,口腔微生物组到肠道微生物组的传输非常广泛,尽管在某些情况下,这种传输与类风湿性关节炎和炎症性肠病等病理状态相关。
社会传播的特定类群和微生物组的社会结构化程度可能因身体部位而异
例如,一项研究发现,显示肠道微生物社会传播证据的个体并不总是显示口腔微生物社会传播的证据。
相比之下,其他研究发现,通常耐氧的口腔微生物比大多数厌氧的肠道微生物具有更高的传播性,后者不太可能在富含氧气的外部环境中持久存在足够长的时间来感染新宿主。
实际上,共同居住的时间越长(例如,伴侣或父母与子女),个体的口腔微生物组的相似性越大。同样,狗和其主人的皮肤微生物显示出比肠道微生物更强的跨物种传播证据。
总体而言:直接和间接社会传播对微生物组的影响因身体部位而异:
在身体部位内,特定的细菌类群可能更适合或更易于社会传播。例如,在狒狒中,属于双歧杆菌属和梭菌属的肠道细菌显示出比其他细菌类群更强的社会传播证据。相比之下,在人类中,细菌的社会传播似乎与细菌分类无关。
这表明在人类中,大多数微生物类群至少在原则上可能是社会可传播的。尽管微生物在不同身体部位、不同微生物类群以及不同宿主群体间的社会传播程度存在差异,但微生物的社会传播似乎是决定人类和非人类动物微生物组成的一个广泛且稳健的因素。
群居生活有什么适应性优势?
群居生活和不同的社会联系为个体带来了许多适应优势,包括保护免受捕食、增加交配机会以及在获取和防守资源方面的帮助。健康框架的社会决定因素考察了社会性与健康和进化适应性之间的联系。社会环境的各个方面,包括社会等级、社会融入和早期生活逆境,是个体发病率和死亡率最强烈且一致的预测因素之一。
社会环境与生物学健康的联系
社会科学和自然科学共同关心的是连接社会环境与动物健康、疾病结果和死亡风险的生物学过程,如遗传、表观遗传、免疫和内分泌过程,通过这些过程社会环境与个体生理过程相互作用,从而影响健康和进化适应性。
微生物组与社会互动的健康影响
现在开始强调微生物组在介导社会互动与宿主健康状况之间关系的潜在作用。社会可传播的微生物和驱动微生物组成的社会行为因素可能有助于这些效应。
在健康的社会决定因素框架内,社会性对健康的影响之一是接触可传播的微生物。这包括病原体和共生体和互利共生体的影响。
病原体传播与社会性的进化策略
就病原体而言,一个最古老的研究领域长期以来一直在研究病原体传播与宿主社会性之间的联系。例如,生活在较大群体中、社会接触率较高、在特定网络位置或结构中运作、或与同种人接触时间更长、更密切的个体,比孤立的个体面临更高的传染病风险,因此,已经进化出各种社会行为来避免或控制病原体。
微生物传播的社会行为与进化挑战
共生体和互惠体的传播策略目前没有得到充分重视,但如果它们与病原体的传播策略不同,这可能会选择通过微生物传播有益于宿主健康的各种社会行为的进化。这一提议的一个困难在于,致病性和非致病性肠道微生物通常采用相同或相似的传播策略。
因此,尽管广泛的社会行为,包括梳理毛发、共同喂养、口口互动、护理、粪食,被假设可以促进细菌的传播,从而带来代谢和免疫方面的益处,目前还不清楚共生体和互利共生体的传播策略是否与病原体的传播策略有足够的不同,或者是否足够有益,以促进这种传播的社会行为的出现。
社会微生物传播与社会性进化的未来探索
事实上,对于这些行为中的许多行为,都有其他的进化解释,而与它们对微生物传播的影响无关。未来对互利共生体、共生体和病原体传播策略差异的研究和建模工作可能能够揭示社会微生物传播与社会性进化之间的关系。
这方面的一个核心问题是,自然选择的共生体、共生体和病原体的传播策略是否存在足够的变化,以有利于促进有益微生物而非有害微生物传播的社会行为的出现。当然,有利于传播的社会行为的演变还取决于共生和互利共生相对于宿主接触病原体的危害的相对益处,而不仅仅是传播途径的差异。
微生物社会传播的一些影响发生在整个微生物组群落水平,包括定植抵抗、毒力和传播性的演变以及对生态干扰的反应。
殖民抵抗力是指个体微生物组固有的能力,能够抵御入侵性病原体的定植和扩散。
微生物组中的一些常见成员,例如艰难梭菌(以前被归类为梭状芽孢杆菌),是病原体(即机会性致病的微生物),在很多情况下,它们的入侵和致病性取决于生态环境。在这里,作者认为一个典型的或健康的微生物组是指能够减少微生物入侵和在生态位中过度定植的机会的微生物组。预测社会微生物组会影响宿主的殖民抵抗力。
共生和互利的微生物通过各种机制有助于增强殖民抵抗力。这些机制包括直接与其他微生物以及病原体竞争空间和营养、分泌抗菌分子、改变肠道环境的生化特性,以及训练免疫系统区分无害微生物和潜在的危险微生物(下图)。
图3 社会传播肠道细菌与宿主免疫系统之间的相互作用
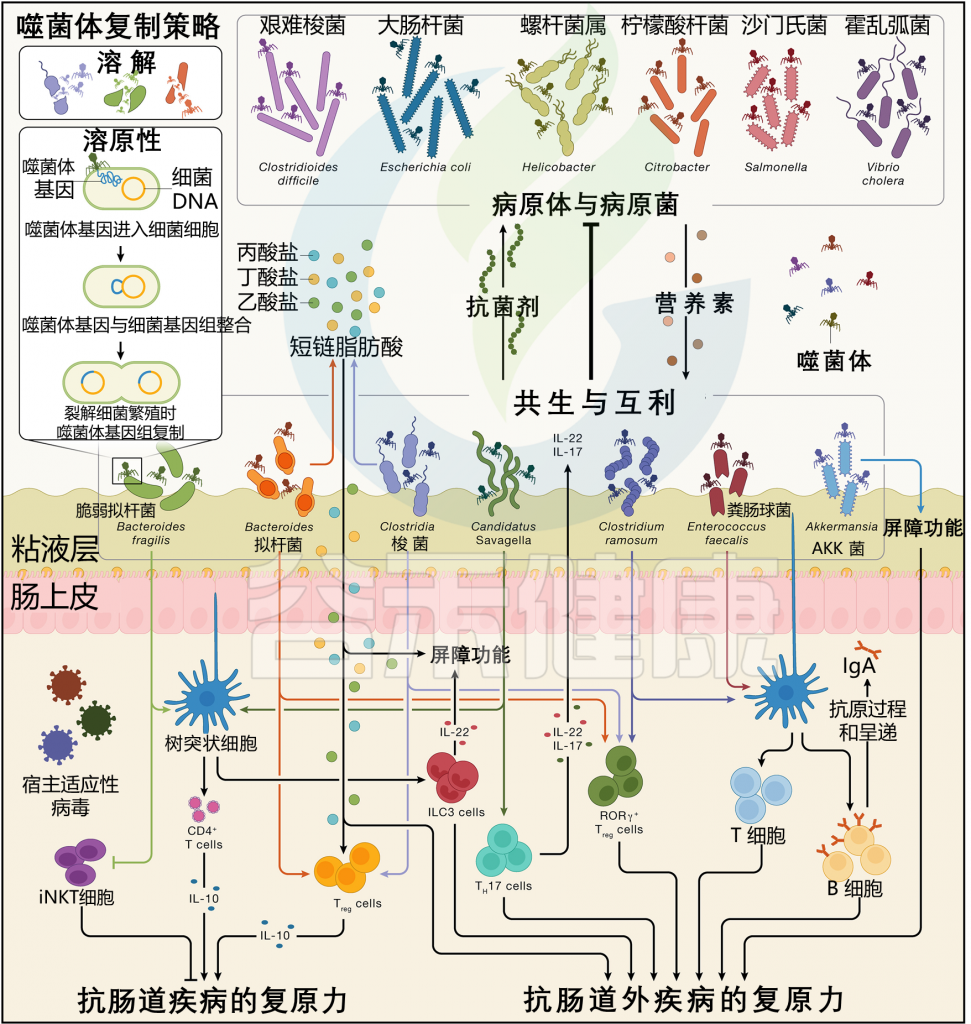
doi.org/10.1016/j.cell.2023.12.014
在哺乳动物中,一些最常见的肠道细菌类群参与维持宿主的定植抵抗力,并且也具有社会传播性。社会传播的微生物可以通过涉及特定类群的过程以及整个微生物组的新兴群落特性来影响定植抵抗力。
影响微生物组定植抵抗力的四个关键属性
这些属性可能受到社会传播过程的影响:
1)对定植抗性重要的特定微生物类群的存在
2)微生物组多样性
3)微生物组稳定性
4)宿主之间微生物组相似性
接下来我们一一看着四个关键属性:
对定植抗性重要的特定微生物类群的存在
共生菌株与病原体竞争资源,抑制病原体生长
一些与宿主相关的微生物通过消耗病原体生存或病原体过度生长(即竞争性排斥)所需的资源,有利于宿主的定殖抵抗。例如,大肠杆菌的共生菌株消耗许多与肠出血性大肠杆菌致病菌株生长所需相同的有机酸、氨基酸和其他营养物质。来自共生菌株的这种竞争抑制了致病菌株的生长。
微生物群以依赖于环境的方式促进定植抵抗
例如,在简单的共培养中,大肠杆菌的共生菌株对肺炎克雷伯菌和肠沙门氏菌的病原体的生长几乎没有影响。然而,作为更加多样化的微生物群落的一部分,它们至关重要,它们有助于其他微生物通过营养消耗战胜这些病原体的能力。
另一个例子,小鼠肠道中的共生微生物消耗膳食氨基酸支持对高度传播的病原体啮齿类柠檬酸杆菌(在小鼠模型中用于模拟致病性大肠杆菌)的定植抵抗,这也依赖于这些氨基酸。
为潜在病原体创造敌对环境,保护宿主
特定的肠道微生物还可以通过改变肠道生态条件,为潜在病原体创造敌对环境,从而保护宿主免受病原体定植。例如,双歧杆菌属可以通过降低局部环境的 pH 值来防止致病性大肠杆菌在肠道定殖。
微生物组多样性对定植抗性的影响
微生物组多样性增强利用生态位空间的能力
微生物组的多样性可能会增强其利用所有可用生态位空间的能力,从而抵抗定植。该假设基于生态理论,即生物多样性与群落的入侵性(即群落对入侵的脆弱性)负相关。
一项研究发现,限生小鼠肠道微生物组的多样性线性增加了微生物组抵抗病原体入侵的能力。
多样化的微生物群落蕴藏着许多相互竞争的微生物,这有助于稳定群落免受扰动并占据可能被入侵者利用的生态位。
多样性与病原体入侵的关联
最常见细菌病原体可能利用的生态位空间可以在高度多样性的微生物组中饱和,共生和互惠的肠道微生物利用大多数可用的营养物质,从而将病原体和致病生物保持在低丰度并限制入侵。与这些理论相似,人类和小鼠的抗生素治疗证据支持这样的假设:微生物组多样性的极度减少会使宿主更容易受到病原体入侵。
关于微生物组多样性与定植抗性之间相关性的一致性和线性性仍存在相当大的争论,以及微生物组多样性和宿主健康之间的关系。
微生物组多样性与宿主健康间的复杂联系:是不是越高越好?
不一定。虽然说微生物组多样性高通常与宿主健康状况良好相关,但多项研究发现,微生物组的高度多样性与不良的健康结果有关或者与健康无关。
重要的是,微生物组多样性可能与某些病原体呈正相关,但与其他病原体呈负相关。同样,社会传播对微生物组多样性的影响比简单的积极社会性-多样性关联更为复杂。
社会传播对微生物组多样性有什么影响?
社交互动有可能增加或减少多样性。
例如,最近在自由生活的红腹狐猴种群中证明了和黄腹土拨鼠社会互动程度与个体宿主内的平均微生物多样性之间存在负相关关系。
为什么可能会有负相关?试想如果特定的微生物谱系在宿主内比其他谱系拥有竞争优势,则可能会出现这种负相关关系。
微生物组多样性的“临界点”与定植抗性
在社会分散的人群中,这种微生物可能只会在少数宿主的微生物组中占主导地位,而在社会联系的人群中,微生物可能会传播到大多数或所有宿主,并在其中增殖。
这些变化暗示了微生物组多样性与定植抗性之间的复杂关系。定植抗性和微生物组多样性之间并非存在一致的正相关关系,而是可能存在多样性减少的“临界点”,它可以使微生物组失去平衡,从而创造有利于病原体入侵的生态位空间。
微生物组稳定性对定植抗性的影响
定植抗性与微生物组的稳定性有着内在的联系。一般来说,稳定的群落比不稳定的群落更能抵抗入侵,因为群落组成的不稳定可以创造生态位空间,从而为入侵提供机会。
不稳定是人类微生物群失调状态的一个方面,与不稳定性相关的扰动可能导致某些致病性类群的过度生长。
不一定只有致病菌过度生长,共生菌过度生长也会失调
事实上,典型共生微生物通过过度生长而产生的机会性发病机制可能是腹泻的致病机制。例如,旅行者腹泻通常没有明显的肠道病原体,而是似乎可归因于与菌群失调相关的共生微生物过度生长。这些不稳定驱动的入侵说明了发病机制是如何由于生态位空间的突然可用性而不是病原体本身的入侵倾向而发生的。
微生物组不稳定与社会关系不稳定相关
微生物组稳定性受社会微生物传播影响的程度是一个尚未得到充分研究的领域。例如,个人在社交网络中的位置是否会影响微生物组的更替(稳定性的常见衡量标准)尚未得到彻底探索,可能是由于缺乏来自自然宿主微生物组系统的详细纵向数据。
一些证据表明社交不稳定可能与肠道微生物组不稳定有关。例如,在野生维罗狐猴中,社会关系更不稳定的个体表现出更高的肠道微生物组更替率。不稳定的社会关系可能会影响微生物组的组成和稳定性,社会压力会导致社会不稳定和微生物组不稳定之间的关联。
不稳定的社会关系会引发荷尔蒙压力反应,进而可能导致成分变化,进而可能导致微生物组稳定性降低。未来的研究可以通过实验操纵模型动物的社会等级,并研究社交网络位置如何与压力和微生物组组成等因素相互作用,从而影响宿主表型,包括定植抵抗力。
宿主之间微生物组相似性对定植抗性的影响
定植抗性可能受到社交宿主之间微生物组相似性的影响。这是因为社交互动增加了宿主之间微生物组的相似性。理论上,宿主之间微生物群落相似性的增强可以增强或减弱定植抵抗力,我们依次讨论每种可能性。
宿主对熟悉菌群的定植可能表现出更强的抵抗力
关于增强定植抗性,由于宿主的免疫系统对那些微生物的预适应,宿主可能对熟悉的微生物的定植表现出更高的抗性。例如,许多通常被认为是共生或互利的微生物在某些条件下可能会致病,例如艰难梭菌就是一个典型的例子。发病机制的转变可能部分取决于宿主对特定微生物的适应程度。人类研究表明,宿主与微生物的相互作用可以训练宿主的适应性免疫,减少由熟悉的微生物引起的发病机制。相反,不熟悉的微生物可能更有可能致病。
因此,社会伙伴之间微生物组的相似程度可能会影响微生物在传播后在新宿主中致病的可能性。例如,想象一个宿主与一个新的社会伙伴互动,该伙伴的免疫系统不习惯宿主的共生和互利共生。相对于具有社会互动和微生物交换历史的宿主之间的相互作用,这种相互作用可能更有可能导致发病机制。这是因为熟悉的宿主预计会有更多相似的微生物组和免疫训练。
微生物组的高度相似性也可能降低定植抵抗力
具体来说,由于社交互动增强了微生物组之间的相似性,这种微生物的相似性也可能赋予病原体优势,这些病原体已经开发出克服或颠覆定植抗性的机制。因此,具有与社会微生物组非常相似的微生物组的个体也可能最容易受到先前成功入侵类似微生物群落的病原体的入侵。
研究病原体通过社交网络的传播,作为个体微生物组和社会微生物组之间相似程度的函数,应该可以深入了解病原体在社会微生物组中传播的速度。这将能够评估传播是否与社交网络中宿主之间的微生物组相似程度呈正相关。
社会生态因素(如群体大小、社会性、与不同微生物接触)都影响着宿主对病原体的定殖抵抗力
所有社会传播对定植抵抗的影响都可能受到社会微生物群背景下的各种社会生态力量的影响(图 1 A)。例如,更大、更异质的群体应该提供最大数量的殖民机会(2级)。
同样,平均而言更具社会性(4 级)的宿主物种可能会经历更高的潜在侵入性传播事件发生率。然而,由于它们传播非病原微生物的机会更多,因此它们也可能具有更强的内在定植抗性。
由于与拥有不同微生物组的其他微生物相互作用也可以通过向宿主引入新微生物来增强多样性,因此在“安全”共享共生和互利微生物与获取更多样化(但可能更危险)的微生物之间存在固有的权衡。
灵长类动物研究表明,在社会伙伴中分配一组熟悉的微生物可能有助于保持多样性,因为任何宿主中因局部灭绝而丢失的微生物都可以通过社会接触重新获得。保持多样性还可以降低通过社会互动获得完全不熟悉的微生物的风险,这些微生物可能具有更大的发病潜力。
肠道微生物的社会传播预计会影响社会微生物组成员的毒力进化。
微生物如何与我们共同成长?
严格的肠道微生物在宿主的垂直传播中创造了一种情况,在这种情况下,微生物谱系的长期适应性取决于宿主。也就是说这些微生物非常依赖我们的身体,因为它们要在我们这里生存得好,就需要和身体相处得很融洽。
在这种情景下,那些严重降低宿主适应性的菌株可能会降低自身的适应性,并且与不那么致病的菌株相比,会遭受进化上的劣势,也就是说如果这些微生物让我们的身体不健康,它们自己也会找不到好的住所,最终可能被其他更友好的微生物取代。
这种现象的一个例子是寄生真菌Ophiocordyceps unilateralis,它控制并最终杀死其蚂蚁宿主以增强其孢子的分布。极端致病性的狂犬病毒和原虫寄生虫弓形虫是微生物介导的宿主损伤的突出例子。
总的来说,微生物对宿主适应性的控制预计只会在非常精确的情况下偶尔进化。因此,微生物对宿主的高度依赖通常应该有利于降低毒力。然而,微生物的社会传播的可能性,尤其是在非亲属之间的传播,可能会使微生物的适应性部分与宿主的适应性脱钩。
有机会殖民多个无关的宿主可能会增加那些施加有害影响的微生物谱系的长期适应性,这些有害影响在高度忠实于宿主谱系的微生物谱系中可能会受到选择的不利。
在这种情况下,如果毒力对于宿主内微生物适应性的积极效应超过了严重宿主疾病或死亡对微生物适应性的负面影响,那么毒力可能会进化。
尽管增加微生物水平(社会)传播的机会可能会促进毒力的进化,但进化理论还预测:
更多社会传播实际上可能降低毒力
增加社会传播在某些情况下,可能会选择降低垂直和社会传播微生物的毒力。例如,高社会传播率会增加宿主人群中微生物的流行率,从而减少进一步的社会传播机会,并降低依赖社会传播的毒力菌株的适应性。因此,社会传播对社会微生物组成员毒力进化的影响肯定比社会传播机会与毒力之间的正线性关系更复杂。
神秘的传播途径:微生物通过看不见的社交网络在宿主间传播
许多微生物(病原体、共生体和互利共生体等)的传播机会可以根据影响社会微生物组的不同社会生态力量来概念化。例如,通过频繁和亲密的社会接触以及更集中的网络个人,传播机会可能会最大化(1级)。在体型较大的群体之间(2级)、迁徙个体数量较多的群体之间(3级)、社会性更强的物种之间、群体内遗传相关性平均值更高的物种之间以及促进密切社会互动的季节和环境中(第4级),以及在物种间接触较多的情况下(5级),传播机会也可能增加。
值得注意的是,其中一些相互作用可能是间接的,是由个体和群体之间的多方联系造成的,正如最近在蝙蝠中观察到的那样。在这些“神秘”的联系中,微生物谱系在从不直接互动的宿主之间进行社会传播。
在宿主社会网络中,微生物更容易适应并传播
社会微生物组也可能影响微生物传播能力的关键特征的进化。病原体的长期适应性是它能够感染的新宿主数量的函数,对于适应肠道的共生菌和互利共生菌也可能是如此。在宿主紧密相连的社会网络中,空间和时间距离之间的潜在宿主得以减少,并允许适应宿主的微生物比在更为孤立的宿主中通过社会网络传播得更成功。
厌氧肠道菌通过亲密接触在宿主间传播
这对肠道微生物组的成员特别相关,其中许多是需厌氧菌,在富氧的外部环境中没有足够的耐受机制来显著持续存在。因此,一个具有许多近距离宿主的密集社会网络应该增加厌氧肠道细菌的定殖机会。事实上,在研究了微生物的直接社会传播的地方,最具社会传播性的细菌类群也是最不可能在需氧的外部环境中持久存在的,拥有较少支持宿主外生存的机制。
孢子菌通过环境间接在宿主间传播
孢子形成等耐力机制有利于细菌在宿主外环境中生存。孢子细菌比非孢子细菌具有明显更高的耐氧性。与专性厌氧菌不同,孢子形成细菌可以很容易地在个体之间传播,不依赖于直接的社会接触。一致的是,通过野生小鼠之间直接社会接触传播的肠道微生物大多是厌氧的,而通过共享环境间接传播的肠道细菌富含需氧孢子形成类群。
含有芽孢细菌的属约占肠道微生物丰度的 30%,并且存在于几个常见细菌家族中,包括毛螺菌科、瘤胃球菌科和梭菌科。值得注意的是,致病生物艰难梭菌会产生代谢休眠且高度耐药的孢子,这些孢子有助于在恶劣条件下在宿主体内持续存在,并通过共享环境进行间接社会传播。
宿主社会性与耐力机制选择强度之间关系的两种假设
微生物耐力机制的进化,例如形成孢子的能力,可能是由宿主物种的社会性程度决定的。关于宿主社会性与耐力机制选择强度之间的关系,人们可以提出两种相互竞争的假设。
1.
首先,在局限于独居或很少有社会伙伴的宿主物种的微生物中,可能会选择诸如孢子形成之类的耐力机制。这是因为社会接触可能非常稀疏,以至于殖民另一个宿主的机会太有限,无法支持耐力机制的进化,从而能够有效地间接向新宿主进行社会传播。
2.
其次,进化压力可能会选择相对于社会宿主物种而言更孤独的宿主物种增强的耐力机制,使微生物能够在环境中持续存在,通过间接的社会传播到达新的、不常见的宿主。当然,从其他同域物种获取微生物也可能影响此类结果。
这些假设可以通过比较与宿主物种相关的微生物谱系之间是否存在耐力机制来进行经验或荟萃分析的检验,这些宿主物种的社会性程度各不相同,同时考虑到与其他同域物种的相互作用。
一般的“生态干扰“”的是指的是引发显著生态系统和生态变化的短暂环境事件(例如洪水、森林火灾、飓风)。
生态恢复力的一个定义是被干扰的生态系统恢复并返回到或类似于其干扰前状态的程度。
从干扰生态学和宏观生态系统的生态恢复力原理也可以有益地应用于理解微观生态过程,包括宿主-微生物相互作用。
微生物组生态的干扰,包括暴露于新饮食、抗生素暴露、疾病或感染,可能导致内源性微生物群落的丧失及其被其他微生物群落取代(下图)。例如,抗生素引起的干扰和随后的微生物丧失使得肠道中的生态位变得可供定殖,使宿主容易受到外来且可能具有病原性的微生物的侵袭,或者使如艰难梭菌这样的病原体的生长失去控制。
图4 肠道微生物组在社会微生物组中的稳定性格局
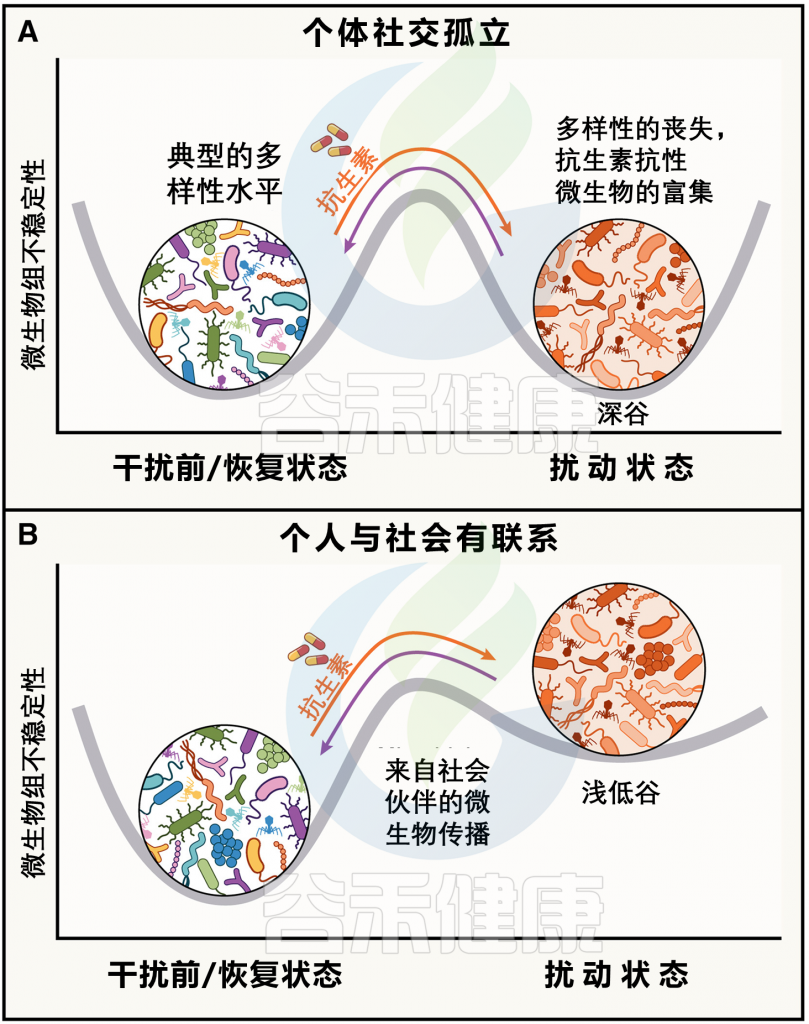
doi.org/10.1016/j.cell.2023.12.014
接触同种的社会网络可能会通过提供来自邻近宿主的社会可用微生物的元群落,以促进干扰后的再定殖,从而增强微生物组的恢复力(上图)。
成年人的菌群被抗生素干扰后有恢复力
例如,在人类中,即使是短期的抗生素治疗也会导致细菌多样性大幅减少,而且在抗生素暴露后数月甚至数年内微生物组可能仍然受到干扰。
尽管早期生活中抗生素引起的肠道微生物组破坏可能会产生终生影响,但在成年人中,抗生素介导的干扰通常是轻微的,微生物组倾向于在停止抗生素治疗后相当快速地恢复到稳定的、基本上是暴露前的状态。
成年人菌群的恢复力,可能与社会微生物的助力相关
成年人肠道微生物组在干扰后恢复到基线状态的能力可能反映了宿主控制的机制,但也可能是由于密集的社会网络提供了大量社会微生物传播的机会而得到促进。
从周围的社会网络和环境中接触到与人类相关的微生物,可能会补偿抗生素治疗后共生和互利微生物群落的损失。然而,这种模式更可能适用于熟悉的社会伙伴。
熟人还是陌生人?社交选择的微生物风险——不熟的社会伙伴可能不助力,甚至导向疾病
相比之下,在抗生素治疗后接触不熟悉的社会伙伴可能导致病理变化,因为可能传播个体缺乏免疫耐受性的新微生物。这些动态可以在实验上易于操作的社会性物种中进行测试,比如在抗生素治疗后将小鼠和蜜蜂这样的动物暴露于熟悉或新的社会伙伴。
来自社会微生物组五个层面的各种社会生态力量可能会影响从干扰中成功恢复的概率
来自同种动物的微生物传播可能与个体在社会群体中的网络化程度以及社会接触的频率和亲密程度(1级)、社交网络的规模(2级)以及社交网络中更远的组成部分之间的互动次数(3级)呈正相关。平均而言,更多的社会物种(4级)可能会经历更快速的干扰后重新定殖。
然而,微生物组通常对扰动具有弹性。因此,一个重要的研究领域是了解与其他生物机制(例如宿主免疫)相比,社会传播对微生物组恢复力的相对贡献。这个问题可以通过将宿主暴露于标准化抗生素治疗同时操纵宿主社会结构(例如单独饲养动物或将动物分成不同大小的群体)来在模型生物中进行实证检验。
社会伙伴有助于抗生素扰乱后肠道菌群恢复力
抗生素引起的蜜蜂微生物组消融增加了死亡率,支持了社会传播在微生物组恢复力中的重要性,但与蜂巢中的其他宿主接触7天后,经过抗生素治疗的蜜蜂的细菌组成部分恢复。
相比之下,与不含抗生素的对照蜜蜂相比,单独饲养的蜜蜂仍然缺乏细菌。
同样,当接受抗生素治疗的小鼠与未经治疗的小鼠(充当微生物库)共同饲养时,抗生素治疗后小鼠肠道微生物组的恢复会加速。
啮齿动物社交网络的菌落模型可用于检查微生物组在更接近自然社会环境的环境中从干扰中恢复的情况。由于微生物传播和获得的增强,具有更多社会互动的更核心的个体可能比更多的外围个体能够更快地恢复。然而,由于更融入社交网络的个人总体上往往拥有更好的健康状况,需要仔细处理才能通过实验解开这两个过程。
尽管社会性微生物传播的一些与宿主健康相关的影响是基于整个微生物组群落水平的过程,但社会性也推动了影响宿主健康和疾病的特定微生物的传播,包括具有代谢和免疫作用的微生物的传播、种间传播、抗生素耐药微生物的传播和病毒的传播。
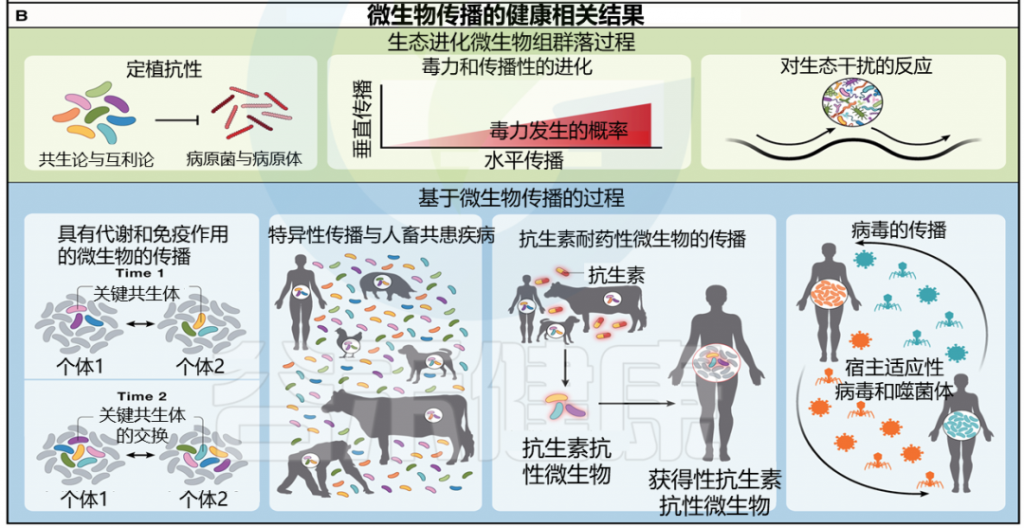
doi.org/10.1016/j.cell.2023.12.014
社交互动可能会促进特定微生物的传播,从而对宿主的新陈代谢和免疫产生明显的影响。例如,一项针对狒狒的研究测试了微生物通过宿主社交和梳理网络的传播。
“核心”微生物群通常有助于为其宿主产生重要的生态系统服务,包括复杂碳水化合物的消化、维生素的合成以及短链脂肪酸的生产,例如丁酸盐,丁酸盐是结肠细胞的主要能量底物。
“核心”微生物群是否也受社会行为的影响?
鉴于它们对宿主的重大贡献,人们认为宿主体内丰富的核心微生物对于宿主健康来说太重要了,不能依赖于宿主的社会互动。
与这一预期相反,这些核心微生物(包括双歧杆菌属和粪杆菌属)的存在和丰度是通过社会群体成员资格和社会行为预测的。
社会传播微生物促进宿主适应新饮食资源
可社会传播的肠道微生物也可能有助于宿主利用特定生态位的能力。例如,沙漠林鼠食用富含单宁的植物,这些植物由粪肠球菌等肠道微生物代谢,可社会传播的分类单元。这些微生物对于单宁的适当降解是必需的,它们的缺乏预示着通常与单宁消耗相关的体重减少和肝损伤。这也是微生物社会传播可能促进宿主适应新饮食资源的一种途径。这一提议可以通过将缺乏能够降解饮食来源的异生物质的微生物的啮齿动物与拥有此类细菌的啮齿动物共同饲养来进行实验研究。
作者预测,缺乏这些细菌的啮齿动物将通过直接和间接的社会传播获得这些细菌,并且能够更好地耐受异生素。这种现象对于理解宿主范围扩张具有重要意义。使宿主能够利用新资源和生态位的社会传播微生物最终可能会促进宿主分散到新的生态系统中。
社交微生物影响宿主免疫健康
微生物组在塑造和调节宿主免疫力方面也发挥着至关重要的作用,特定的社会传播微生物类群可能会影响宿主的总体免疫状态。例如,最近对野生猕猴的一项研究发现,宿主的社交能力与肠道细菌属(例如粪杆菌属)的存在呈正相关,这些细菌具有抗炎和其他对健康有益的作用。
然而,不太善于交际的猕猴表现出链球菌属的水平升高,链球菌属的成员包括多种病原体和病原体。通过短链脂肪酸介导的信号传导、对屏障功能的影响和其他机制,肠道微生物可以调节广泛的宿主免疫细胞群(图 3;表 3),并且微生物组-免疫相互作用可以加剧或保护宿主免受这两种肠道疾病的影响以及各种肠外疾病,包括癌症、自身免疫性疾病和病毒感染(可能包括 SARS-CoV-2)。
社会传播微生物通过代谢物调节宿主免疫
常见的微生物代谢物,如短链脂肪酸(也是由社会传播的微生物产生的)可以对宿主免疫产生显著影响。例如,短链脂肪酸可诱导结肠中Treg细胞,从而赋予小鼠模型抵抗结肠炎的能力。个别细菌种类也会影响不同免疫细胞类型的频率。其中一些微生物还会与药物相互作用,并可以改变药物代谢,从而影响宿主药物反应和治疗结果。
至关重要的是,发挥这些作用的微生物也被观察到具有社会传播性(图3;表3)。这些证据表明社会传播微生物可能产生免疫影响。
表 3 社会传播微生物对宿主免疫的影响

doi.org/10.1016/j.cell.2023.12.014
人畜共患病和人畜共患病溢出效应是生物医学和公共卫生领域长期关注的问题,并且在有关 SARS-CoV-2 起源的争论中占据突出地位。不同物种动物之间的微生物传播很容易被解释为将社会微生物群背景化的社会生态力量的 5 级过程。
种间微生物传播发生在一系列环境中
例如,生活在城市环境中的变色蜥蜴、土狼和麻雀都拥有人类常见的肠道细菌谱系。其他案例包括跨捕食者-被捕食者网络的微生物传播,以及通过与家养动物的相互作用传播微生物。宿主物种之间的这种相互作用具有众所周知的宿主间病原体转移的潜力。例如,在养猪场逗留的时间增加了人类游客体内有害微生物的数量。
物种间微生物传播增加疾病风险
彼此密切接触并可能共享微生物的宿主物种,可以使宿主和肠道微生物适应度脱钩。这种脱钩可能会增强社会微生物组成员中毒力的出现。许多致命的人类疾病,如埃博拉病毒和获得性免疫缺陷综合症(艾滋病),都是其他宿主物种人畜共患感染的结果。许多种相互作用都可能导致此类感染。例如,狩猎和食用森林猎物会增加感染人畜共患病毒的风险,从而将病原体引入人类社交网络。同样,几种人类病毒、细菌和真核病原体可以感染其他物种并引起疾病,包括各种类人猿。
种间微生物传播也有一些潜在益处
尽管这一领域的研究主要集中在人畜共患病和种间微生物传播的负面后果上,但也可能有一些好处。例如,在生活得很近的同域物种中,这种种间传播可能会增强个体和社会群体的微生物多样性。同样,与牲畜的相互作用可能有助于增加人类肠道微生物组的微生物多样性。
如前所述,不同的社会微生物组代表了生态群落,它们可能能够通过定植抵抗更好地抵抗潜在的病原体,还可以通过直接和间接抑制宿主体内的病毒等病原体。
在某些情况下,这些特异性间的相互作用也可能对免疫生理学产生有益的影响
例如,将小鼠暴露在与狗相关的室内灰尘中会丰富有益的约氏乳杆菌,抑制炎症的生物标志物,并保护小鼠免受随后的呼吸道感染和病理变化。可以通过用包含来自其他一些宿主物种的微生物的混合或更多样化的微生物组定植无菌小鼠来研究这些类型的建议,并与用来自单一宿主物种的微生物定植的小鼠(前一组可能对实验引入的病原体表现出更强的抵抗力)。
作者可以类似地测量无菌小鼠的病原体抵抗力,这些小鼠被来自农场、水坑或其他几种动物交换微生物的“自然”混合宿主微生物群样本定植。
此类实验将帮助我们更好地了解包括来自不同宿主物种的微生物在内的微生物组是否具有有益作用。
总体而言,尽管大多数关于微生物种间传播的研究都集中在疾病风险上,但种间微生物传播同时也有可能为宿主带来隐藏的好处,值得进一步研究。
抗生素耐药性的发展是一种古老的适应,使细菌能够相互竞争。然而,用于医疗和农业目的的抗生素的广泛利用正在推动抗生素耐药性的出现,达到造成严重公共卫生风险的水平。
关于抗生素耐药性的许多研究都集中在接触抗生素后宿主体内抗生素耐药性的发展或通过横向基因转移获得抗生素耐药性细菌基因。
在这里讨论如何利用塑造社会微生物组的不同社会生态力量以新颖的方式检查不同水平的抗生素抗性微生物的传播。
抗生素耐药性的多途径传播(5个层级)
例如,在第1级,预计同住一个家庭的个人将从接受抗生素治疗的同居者那里获得抗生素耐药微生物。如果抗生素疗程持续数月或数年,这种情况可能会加剧。
有两个观察结果支持这样的提议。
1.
拟杆菌目细菌是家庭内传播性最强的细菌之一。
2.
拟杆菌门成员充当抗生素抗性基因的储存库。
因此,一些传播性最强的物种和菌株也可能非常有效地传播抗生素耐药性。
在第2级,文化、社会和国家使用抗生素的程度有所不同,从而为抗生素抗性微生物和基因创造了依赖于文化的传播环境。
在第3级,长途旅行的人类可能会不同程度地接触抗生素抗性微生物和基因。
在第5级,已观察到人类和共享环境的其他动物之间存在抗生素抗性微生物和基因的转移。例如,伴侣动物(宠物)是抗生素抗性微生物和基因的潜在来源。
农业动物抗生素使用中的耐药性传播
此外,与接触抗生素的农业动物或在这些动物居住的环境中工作的个人,显示出微生物组重塑和获得抗生素抗性微生物和微生物基因的证据。
至少存在三个主要问题:
所有这些途径都可能导致隐藏的、可社会传播的抗生素耐药性层。当然,这意味着这种传播可能会使未来的抗生素治疗对个人的社会交往和护理人员的效果降低。这种影响的可能性和程度需要进一步的实证研究。
几乎所有生物体都是多种病毒的宿主。除了引起急性疾病的致病病毒(如 SARS-CoV-2 和人类免疫缺陷病毒)之外,多细胞生物还具有内在的病毒群体(病毒体),其由两种不同的成分组成:在宿主细胞中复制的宿主适应共生或条件性致病病毒,以及感染宿主微生物组原核成员的更大的细菌病毒(噬菌体)和古菌病毒(图3)。这些病毒成员也是个体微生物组的一部分,而社会病毒组则构成社会微生物组的一部分。
在人类中适应宿主的病毒组的常见成员
包括内源性逆转录病毒(即与人类基因组整合的病毒基因组的组成部分)、指环病毒、pegiviruses、多瘤病毒和乳头瘤病毒、细小病毒和疱疹病毒。尽管其中一些病毒(特别是乳头瘤病毒和疱疹病毒)与病理有关并引起散发性疾病,包括几种类型的癌症,大多数似乎与任何病理无关。
病毒与宿主的互利共生关系
例如,指环病毒(anelloviruses)——一组神秘的小病毒,具有单链 DNA 基因组,在人类中几乎无处不在 – 尚未被证明会导致任何疾病。一些非致病性或条件致病性病毒在特定情况下甚至可以被认为是互利共生的,因为它们给宿主带来了某些好处。
病毒在宿主免疫发育与社会传播中的作用
例如,人类pegiviruses的双重感染与毒性较低的艾滋病和埃博拉病毒感染有关。一般来说,适应宿主的病毒可能参与宿主免疫的形成。在这方面,指环病毒有助于在发育过程中训练人类免疫系统。此外,用鼠诺如病毒感染无菌小鼠促进了无菌小鼠的典型免疫发育并促进体内平衡,而未感染的小鼠表现出无菌状态特有的异常发育模式。
因此,一些适应宿主的病毒可以模仿宿主细菌定植的发育效应。这些适应宿主的病毒的传播可以通过多种途径发生,并且应该受到社会互动的影响。其中一些病毒,例如指环病毒,可以通过血液传播,因此,它们的传播应该受到塑造社会微生物组的社会生态力量 1-5 级中讨论的几个相同过程的影响。
宿主病毒组的大部分由针对微生物组的病毒组成。细菌种群普遍受到感染它们的噬菌体的控制,宿主微生物组也不例外。尽管微生物组的病毒成分仍未完全表征,但宏基因组学的进步已经导致发现了许多以前未知的噬菌体群体,其中一些噬菌体在人类肠道中非常丰富。
例如,Crassvirales感染拟杆菌门成员,拟杆菌门是人类肠道微生物组的主要组成部分,其中包含难以培养的细菌。培养拟杆菌门成员的挑战意味着其相关的噬菌体群落的特征仍然相对较差。
细菌、噬菌体和宿主的三角互动
噬菌体-原核生物关联具有高度特异性,噬菌体谱系通常感染范围非常窄的原核宿主。在某种程度上,所有微生物组-免疫相互作用(图3)都可以反映各种噬菌体-细菌相互作用。
换句话说,任何细菌不仅参与与宿主相互作用并与其他细菌竞争,而且还参与适应噬菌体的存在并协调抗噬菌体防御。因此,所有或大多数细菌对宿主的影响应在相互作用的三方系统的背景下考虑,包括细菌-宿主相互作用、细菌-细菌相互作用和细菌-噬菌体相互作用。
社会生态影响噬菌体传播
由于噬菌体很可能伴随任何细菌传播,因此噬菌体应经历 1-5 级相同的社会生态过程,从而形成社会微生物组。最近的几项研究发现了这种现象的证据。例如,根据狒狒社会结构肠道细菌群落的发现,宿主社会群体也可以根据其噬菌体群落来区分。
细菌组成的平行结果,狒狒之间的梳理强度预测噬菌体群落的相似性,即使在控制遗传相关性之后。在人类研究中也观察到了细菌和噬菌体动力学之间的这种相似之处。例如,在成年同卵双胞胎的研究中,噬菌体多样性与细菌多样性密切相关。
此外,与细菌一样,婴儿病毒组具有出生模式的特征,阴道分娩的婴儿比剖腹产婴儿表现出更多样化的病毒组。最后,与肠道微生物组的细菌成员一样,噬菌体的组成在衰老过程中也会发生变化。这些发现强调了噬菌体和细菌传播以及社会微生物组的宿主内动态之间的相似性。
噬菌体对宿主健康的有益/有害影响
例如,在感染霍乱弧菌的个体中,那些携带感染霍乱弧菌的噬菌体的个体所患的疾病毒性较低。这些有益的影响也可能扩展到心理领域,例如认知表现。例如,一些噬菌体感染了可以损害宿主认知能力的细菌,从而提高了宿主的认知表现。这种模式已在人类中观察到,并在小鼠和苍蝇中得到实验证明。
相反,噬菌体可能通过感染对宿主有益的细菌,或感染与病原体和致病生物竞争的共生细菌,从而损害宿主健康。
总的来说,噬菌体传播可能是健康和疾病中尚未得到充分研究的一个组成部分。事实上,由于噬菌体在研究中很少被量化或有意控制,因此值得考虑以下可能性:目前归因于微生物组细菌成分的许多生理效应部分源于细菌与其相关噬菌体之间的无数相互作用。
要更全面地了解微生物传播如何影响宿主健康,需要明确掺入病毒组。例如,纳入病毒持久性和复制策略和更广泛的生态过程(例如捕食者-猎物动态)可以进一步增强我们对宿主中微生物传播、组装、演替、恢复力和功能影响的理解。
总体而言,推动宿主之间微生物传播的社会互动类型预计会导致感染这些微生物的噬菌体的伴随传播。病毒的传播意味着社会微生物组还包含一个密不可分的社会病毒组,对宿主健康产生影响,为发现提供了许多机会。
社会传播微生物的潜在影响也可能与传染病和非传染性疾病相关。虽然传染病在流行病学转变期间有所下降,但非传染性疾病却变得更加普遍,目前约占全球死亡人数的 75%。利用本视角中提出的主题和原则,研究人员提出微生物的社会传播可能会增强或降低宿主对传染性和非传染性疾病的易感性(图 5),因此非传染性疾病可能存在未被充分认识的风险。
图5 微生物的社会传播和疾病风险
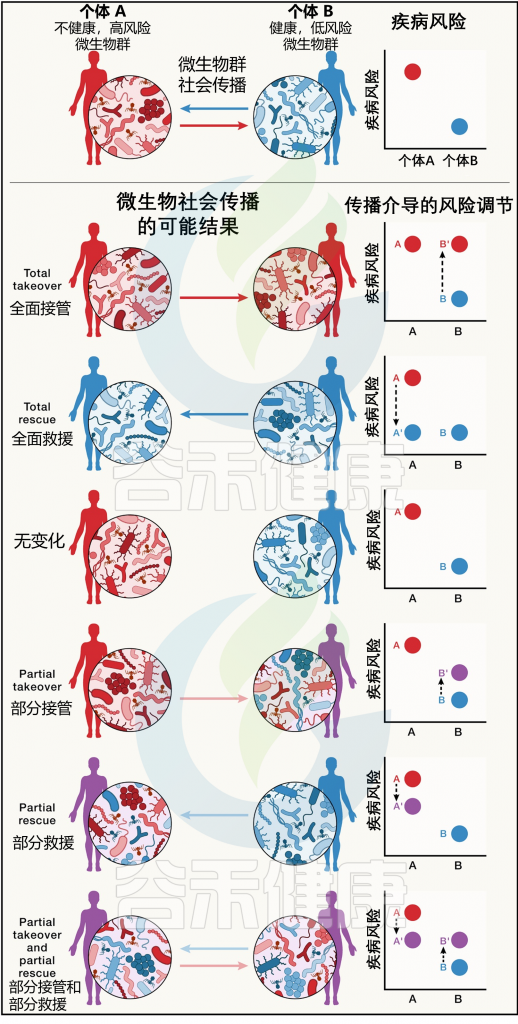
doi.org/10.1016/j.cell.2023.12.014
社会传播的微生物可以调节传染病的风险和影响。例如,微生物可以促进宿主的病毒感染,包括通过增强病毒颗粒与宿主细胞结合时的稳定性或抑制宿主抗病毒反应。就此类微生物的可传播性而言,宿主对病毒感染的反应可能至少部分是社会获得的微生物的功能。
社会微生物调控宿主疫苗反应
由于可传播的肠道微生物与宿主疫苗反应相互作用并调节宿主疫苗反应(表3),因此宿主疫苗介导的对各种细菌和病毒病原体的抵抗力可能至少部分受到社会获得的微生物的影响。
抗生素抗性微生物和微生物基因的社会传播,也可能增强接受者在未来细菌感染期间对抗生素治疗的抵抗力。
非抗生素药物促进耐药性微生物传播
事实上,最近的体外证据表明,即使是抗抑郁药等非抗生素药物也可能在临床相关浓度下导致抗生素耐药性的出现。这可能为耐抗生素微生物的社会传播创造更多机会。
例如,可以想象一个假设的场景,其中一名家庭成员正在接受重度抑郁症的治疗。患者不仅面临产生抗抑郁药介导的抗生素耐药性的风险,而且这些抗生素耐药性微生物也有可能传播给其他家庭成员。通过该途径,非传染性疾病的治疗可能会影响患者社交网络中传染性疾病的治疗结果。
微生物的社会传播也有助于减轻传染病
社会获得的微生物可能有助于定植抵抗,从而保护宿主免受各种细菌病原体的侵害,并降低疾病的风险和严重程度(图3)。
在昆虫中,社会获得的微生物对传染病的保护作用是众所周知的。例如,在熊蜂中,宿主在蛹羽化后通过接触巢友的粪便来获得肠道细菌,这些细菌可以防止有毒的锥虫小虫引起的寄生虫感染。
这一原则最近被扩展到合成益生菌的设计中以保护宿主。给予蜜蜂合成共生体增强了对蜜蜂微孢子虫的抵抗力,蜜蜂微孢子虫是一种经常与蜂群崩溃性疾病相关的微孢子虫寄生虫。至关重要的是,合成益生菌在共同饲养的蜜蜂中传播,这种现象对整个蜂巢的保护具有影响。
抵抗力可以通过微生物群转移
在哺乳动物中,预防疾病已被证明是一种可传播的表型:当来自人类的肠道微生物对肠道感染表现出不同的易感性被转移到无菌小鼠体内时,受体小鼠在暴露于啮齿类柠檬酸杆菌感染时会重现其供体的抵抗特征。
具体来说,当最易感的小鼠(即被来自最易感人类的微生物定植的小鼠)与最有抵抗力的小鼠(即被来自最有抵抗力的人类的微生物定植的小鼠)共同饲养时,易感小鼠变得更加抵抗,但抵抗力强的小鼠并没有变得更容易受到柠檬酸杆菌感染(在图 5)。
内源微生物群体与致病性真核病毒相互作用,可能会抑制病毒感染
例如,在病毒颗粒试图附着在宿主细胞上时干扰病毒颗粒。噬菌体的传播还可以降低某些传染病的毒力,噬菌体对人类霍乱弧菌感染的有益作用就是例证。此外,一些研究表明,来自社会传播细菌属双歧杆菌、乳杆菌和链球菌的细菌(表 3)可能与预防疟疾有关。
与昆虫一样,微生物的社会传播可以保护哺乳动物宿主免受感染或通过多种机制限制其严重程度。此外,为蜜蜂设计合成的、可传播的益生菌也对针对人类的类似方法产生影响,设计可传播的益生菌和治疗方法可能对人类传染病是可行的。例如,某些益生菌可以促进金黄色葡萄球菌去除,对人类健康产生有益影响。如果给予目标宿主的益生菌能够在宿主体内定植并在宿主之间传播,这可能为传染病的管理带来机遇,同时也带来新的伦理困境。
非传染性疾病可能也有微生物传播的成分
通常认为非传染性疾病是由非传染性风险因素引起的,包括遗传和生活方式特征。然而,非传染性疾病也可能具有由微生物的社会传播引起的传染性成分,这可能会加剧和减轻疾病风险。
许多最初被归类为非传染性疾病的疾病现在正在接受微生物相关性和原因的评估,包括代谢疾病、动脉粥样硬化,各种癌症,以及与大脑相关的综合症和病症。将患者粪便移植到无菌动物体内表明,供体微生物可以促使幼稚受体出现一系列临床相关表型。然而,许多这些研究涉及将整个肠道微生物群从供体转移到受体,而不是通过社会互动传播选定的微生物群成员。
此外,一些具有社会传播性的微生物还会干扰用于治疗癌症和各种其他非传染性疾病(包括帕金森病、心血管疾病和抑郁症)的药物的代谢(表 3)。因此,下一步是测试与疾病相关或干扰药物代谢的微生物是否具有社会传播性。
微生物传播对非传染性疾病的双重影响
许多非传染性疾病可能具有传染性成分,因为影响宿主易感性、结果和治疗反应的微生物具有社会传播性,这一普遍假设得到越来越多的实证支持。例如,在自闭症小鼠模型中,怀孕期间分段丝状细菌的社会传播与母体免疫激活相互作用,诱导母体TH17细胞群,进而导致后代的社会行为缺陷。
社会传播的微生物也可能提供一定程度的预防非传染性疾病的保护作用。例如,家庭规模预计与群体内微生物传播呈正相关,但与炎症性肠病的发病率呈负相关。在小鼠研究中也观察到了这种流行病学模式的一种形式,其中与生活在较小群体中的小鼠相比,生活在较大群体中的小鼠对葡聚糖硫酸钠诱导的结肠炎表现出更强的抵抗力。这种保护与微生物组成的变化有关,而微生物组成的变化可归因于群体规模的增加。
微生物传播和生活方式相互作用,影响健康
就代谢条件而言,共同饲养含有与肥胖不一致的人类双胞胎肠道微生物的小鼠,会导致瘦双胞胎衍生微生物的偏向转移,从而保护携带肥胖双胞胎微生物的小鼠免于体重增加(在图5中的“拯救”场景中进行了可视化)。
然而,这些保护作用依赖于饮食,只有当受体小鼠被喂食食物或脂肪含量相对较低、水果和蔬菜含量较高的饮食时才会显现出来。这表明微生物的社会传播和饮食等生活方式因素可能相互作用,从而影响宿主的健康结果。
共同饲养提升黑色素瘤免疫治疗效果,与社会性获得有益微生物相关
当治疗抵抗性小鼠与治疗反应性小鼠共同饲养时,抵抗性小鼠表现出改善的治疗结果,这归因于社会性地从反应性小鼠中获得有益微生物。
值得注意的是,有反应的小鼠并没有对治疗失去反应,在这种情况下,建议在没有明显成本的情况下进行利益的社会传递。
癌症等非传染性疾病的治疗可能至少部分受到社会传播微生物的影响
宿主对癌症治疗的反应与微生物组成有关,而对宿主反应重要的微生物是可社会传播的(表3)。因此,癌症等非传染性疾病的治疗可能至少部分受到社会传播微生物的影响。
当然,并不是说传统意义上的非传染性疾病,应该根据介导疾病的微生物社会传播的可能性重新归类为传染性的,或者来自不太健康个体的微生物必然会使他们的社会接触容易患上疾病。事实上,从生态理论和经验模式来看,与健康相关的微生物组往往更加多样化和有弹性,传播的效果可能更可能发生在“拯救”方向而不是“接管”方向(图5)。
微生物社会传播对健康影响的复杂性
当然,有益的传播也并不总是发生,这种可能性值得进一步调查。非致病微生物的社会传播是否会加剧或减少非传染性疾病风险仍然是一个悬而未决的问题。同样,与人类的相关性仍有待确定,因为迄今为止大多数研究都是在实验室小鼠身上进行的,这些小鼠表现出食粪行为,有望促进高保真度的社会传播。
总体而言,对疾病相关或保护性微生物的社会接触和获得,分别可能丰富或减少发展临床表型的可能性,其调节程度可能与宿主特异性特征(如遗传学和生活方式)相互作用(图5) 。当然,社会传播微生物对宿主健康和疾病的影响可能并不大,这些影响作为健康的社会决定因素的贡献者,以及可能在社会进化中的作用,值得研究。
在本视角中,作者利用大视角和独特的概念应用了社会微生物组概念来研究微生物的社会传播对宿主健康、疾病和社会进化的影响。
社会传播的微生物可以影响与宿主健康相关的广泛过程,这些过程可以分为生态进化微生物群落过程和基于微生物传播的过程。至关重要的是,社会传播的共生体可能会改变传染性疾病和非传染性疾病的疾病风险。
如果非传染性疾病的风险和结果确实会受到社会传播微生物的影响,必须考虑非传染性疾病具有传染性成分的可能性。研究社会传播微生物与人类的相关性以及改变传染性和非传染性疾病发生风险的机制,可能会促进有关这些疾病的知识和疗法的出现。
了解致病性和非致病性微生物的传播生态将是一个重要的研究领域:如果病原体、共生体利用至少在某种程度上不同的传播策略,或者不同地改变宿主行为(例如,病原体引发社会隔离和疾病行为),那么特定的社会结构可能对致病性与共生体的传播产生不同的影响微生物。这提出了自然选择的不同目标,并对社会进化产生影响。
社会微生物组不仅包含细菌成分和社会病毒组,还包含社会古菌组、社会真菌组等。此外,正如人类文化进化产生了抑制病原体传播的行为和实践一样,文化进化也可能有利于行为模式和实践的出现,以促进共生和互惠微生物在人类之间的传播。
所有生物体和环境都通过微生物传播在某种程度上相连,这也是“同一个健康”观对人类、其他动物和环境健康的基本前提。
因此,阐明这些微生物之间的联系也可能在人类疾病背景之外发挥作用,并有助于应对全球健康挑战。最终,通过更广泛的视角(包括共生体、病原体)来观察社会微生物传播,可以帮助我们更好地理解影响健康社会决定因素的微生物信号以及可传播微生物在社会进化中的多效性作用。
主要参考文献:
Sarkar A, McInroy C J A, Harty S, et al. Microbial transmission in the social microbiome and host health and disease[J]. Cell, 2024, 187(1): 17-43.

谷禾健康

本文原创:谷禾健康
自闭症谱系障碍是一种神经发育疾病,其特征是社交和沟通困难、限制性和重复性行为以及异常的感觉反应。
自闭症的具体发病机制尚不能明确,但目前为止许多研究表明,自闭症与肠道微生物组之间存在很大关联性。
最新,Yap等人发表于Cell的一篇题为“Autism-related dietary preferences mediate autism-gut microbiome associations”的论文就自闭症与肠道菌群的关联给出了他们的研究成果。
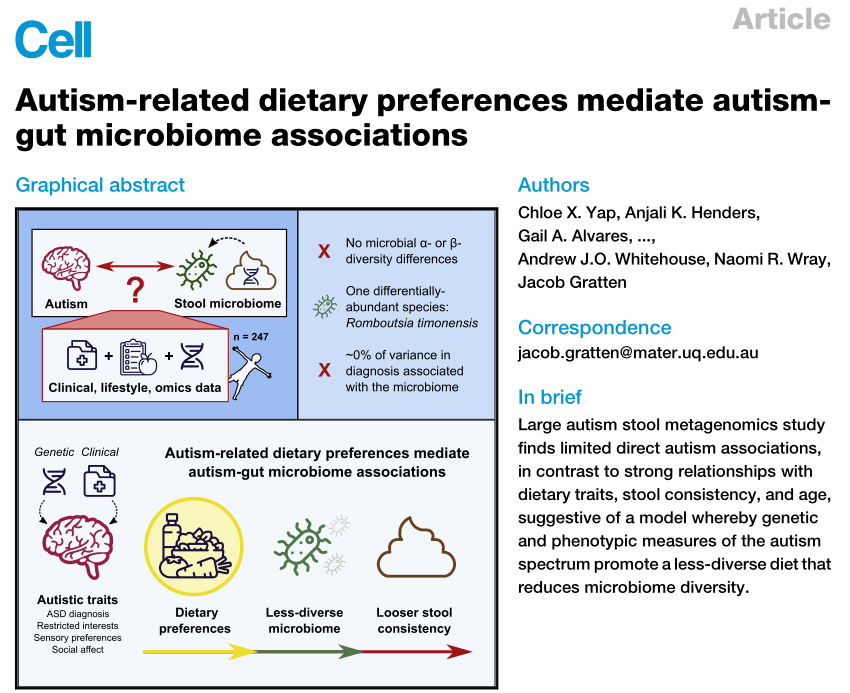
其核心结论是:
肠道菌群与自闭症之间没有直接联系。自闭症儿童与正常儿童的肠道菌群差异是由于自闭症症状导致患儿的饮食多样性下降,饮食类型狭窄,从而导致肠道菌群多样性减少,进而引发便秘和消化道症状。
我们来看看其研究设计情况。
关于肠道菌群这方面的研究,很关键的一个点是研究的样本数量。
首先,这项研究涵盖了共247名儿童(2-17岁),其中自闭症患者99名,51名患者的兄弟姐妹,97名非自闭症儿童,样本来自澳大利亚自闭症生物银行Australian Autism Biobank (AAB)。
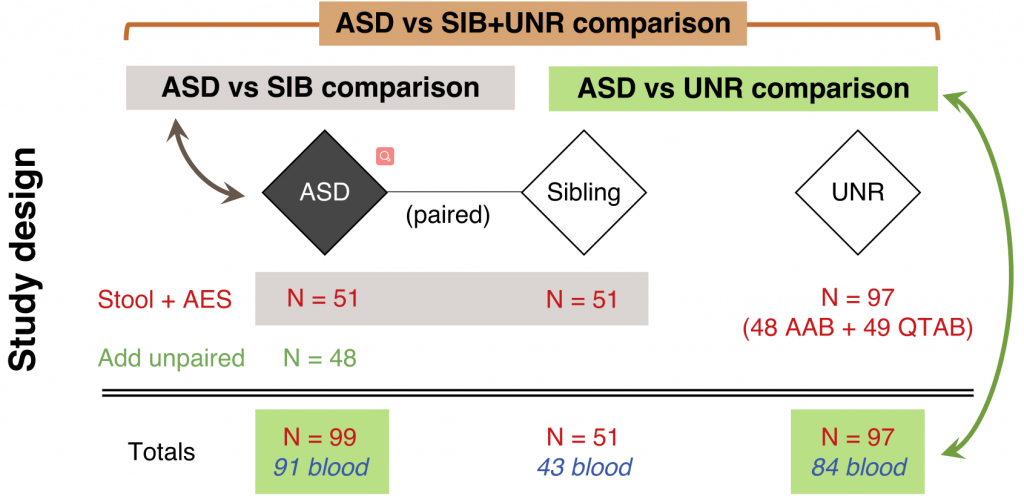

我们观察到样本人群相对于宏基因组来说样本数量还可以,但是99例自闭症患者样本还是让整个研究的统计效力及研究的适用范围有很大限制。
自闭症属于神经发育疾病,虽然其病因复杂,但是疾病的发生阶段绝大部分在出生到3岁左右,主要影响了儿童早期的神经系统发育,导致出现神经发育滞后、刻板行为和社交障碍。
类似的疾病还有注意力缺陷ADHD以及多动症等。越早期的干预其愈后和改善就越明显,因为早期神经系统发育是阶段性的,错过了发育阶段,很难在后期通过行为学等方面获得明显改善。
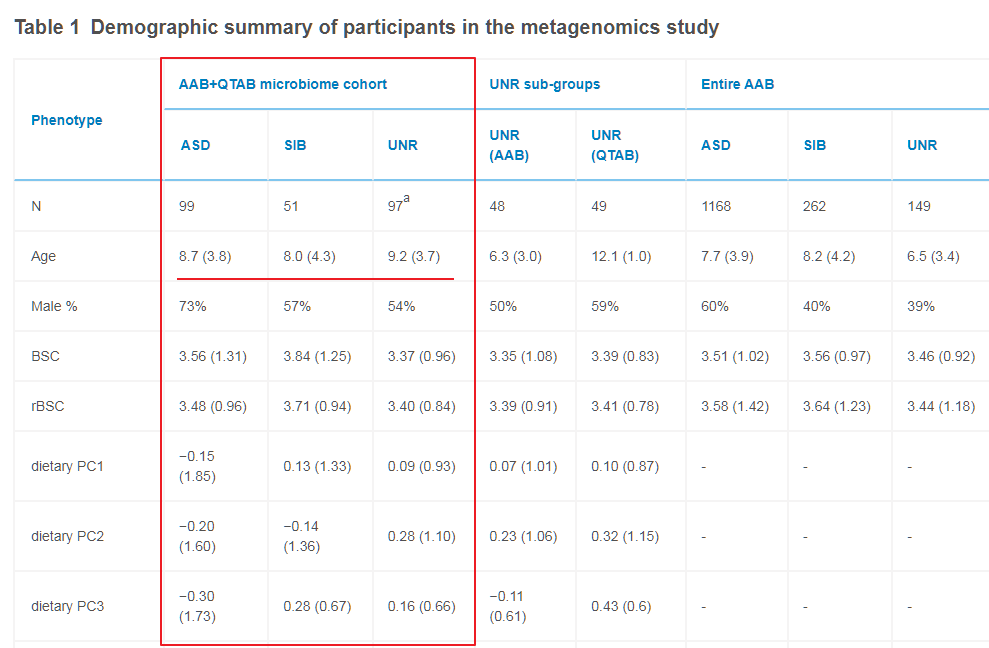
进一步查看研究样本的年龄分布我们发现,该研究的样本年龄均值在8.7岁。
虽然范围在2-17岁,但是和自闭症发病阶段3岁以下的各组样本分别是7例、7例和8例,2岁以下的样本仅有1例。
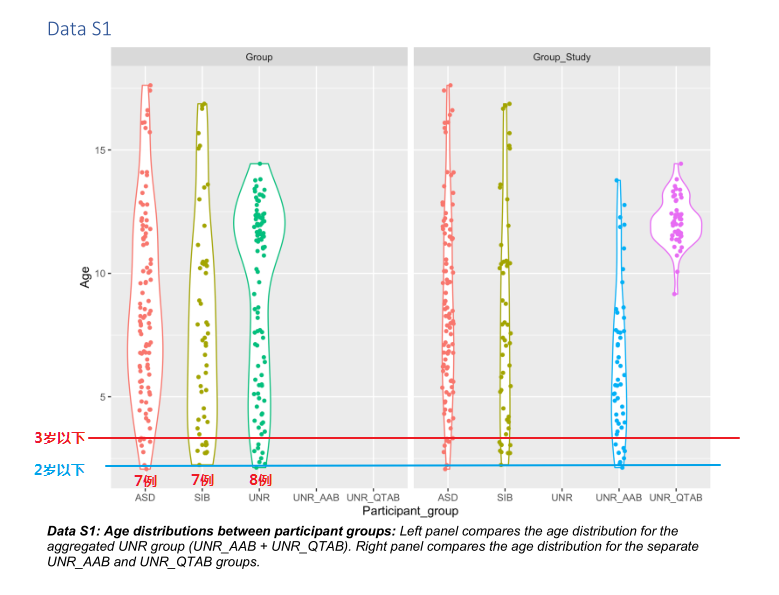
也就是说,研究涉及的自闭症患者虽然仍然有着自闭症的诊断和行为表现,但是绝大部分样本均不是处于神经发育的最核心阶段,而且大部分样本应该是经历过多年的包括行为干预或其他治疗。
因为自闭症与早期行为发育相关,大部分确诊儿童可能其行为表现和社交能力直到成年可能仍然没有完全恢复或达到正常水平,可能在多年后即便其引发自闭症的病因(主要是环境或生理因素)已经消失,但症状或诊断仍然没有变化,这就意味着这些样本可能不能反映真实的自闭症发生时的神经发育和菌群状况,因而也不能说明菌群在自闭症的发病和发展过程中并无联系。
更重要的是肠道菌群的组成变化尤其是生命早期与年龄和发育阶段密切相关,3岁之前的肠道菌群基本上每个月龄都存在变化,3岁之后的肠道菌群会趋向于接近成年人的菌群构成,并逐渐成熟。
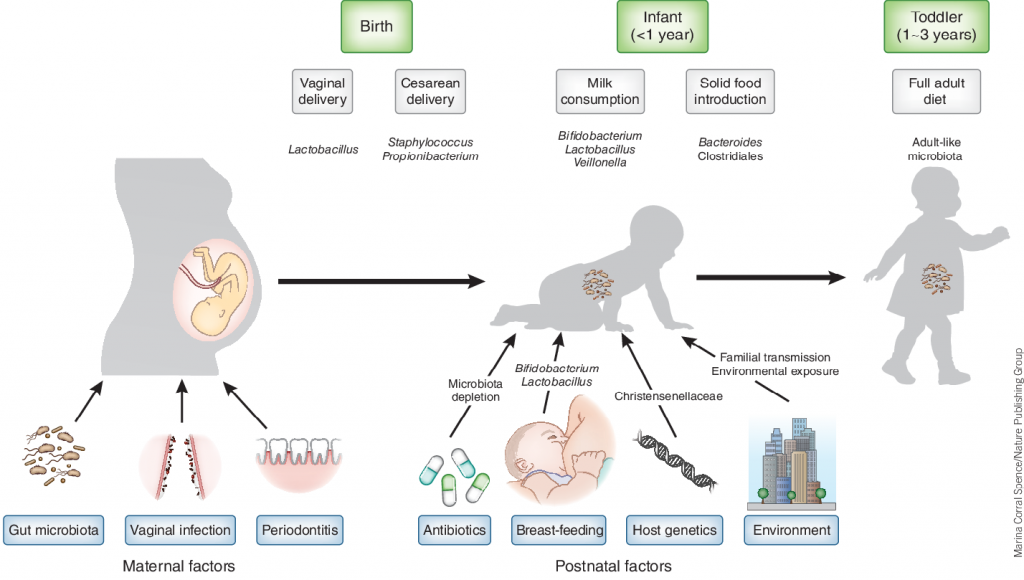
还需要注意的是,在6个月左右,由于固体辅食的引入,婴幼儿的饮食结构会发生重要变化,相对应的肠道菌群也会发生重要的转变,从乳制品代谢为主的韦荣氏菌、双歧杆菌、大肠杆菌为主逐渐进入以碳水化合物和蛋白质代谢为主的拟杆菌或普雷沃氏菌属等成年人常见核心菌群为主的菌群构成。这一变化阶段恰恰是自闭症对应早期神经发育的最重要阶段,而该研究基本没有这个阶段的样本。
研究中也明确提及肠道菌群构成和年龄存在较强的相关性,在分析中是将年龄和性别作为协变量进行控制,但我们认为这种统计方式不足以解决儿童肠道菌群在不同年龄阶段的变化差异,需要进一步对不同年龄阶段或年龄的儿童进行单独分组分析,但是这样该研究的样本数量就严重不足以获得足够的统计效力。
研究中包含有来自同一家庭的非自闭症兄弟姐妹,作为对照能较好的控制包括饮食、生活方式及居住环境等变量,因此很自然我们希望看到针对成对家庭兄弟姐妹的比较分析。
在论文的补充材料方法部分有描述了使用成对样本进行比较的内容,一个102个样本,形成51对样本。对于这样的成对样本分析,比较简单的方式是直接进行成对T检验。
然而,论文中并没有这么做,比较奇怪的将family ID作为随机变量从而控制成对样本的差异检验。但是家庭ID本身除了家庭之外并没有类似年龄或分层等信息量,作为随机变量加入后并不能有效实现成对分析的效果。

另外根据论文的结论,饮食结构单一引起了菌群的变化,进而诱发肠道问题,那么在成对家庭成员样本之间,自闭症儿童相较于同家庭的兄弟姐妹在相同饮食习惯和环境下是否饮食结构明显单一呢?
我们期待看到自闭症儿童的饮食多样性要显著低于其兄弟姐妹,且基本集中于低多样性的区间。
论文补充材料部分的下面这张图显示,同家庭兄弟姐妹之间的饮食多样性是显著相关的。
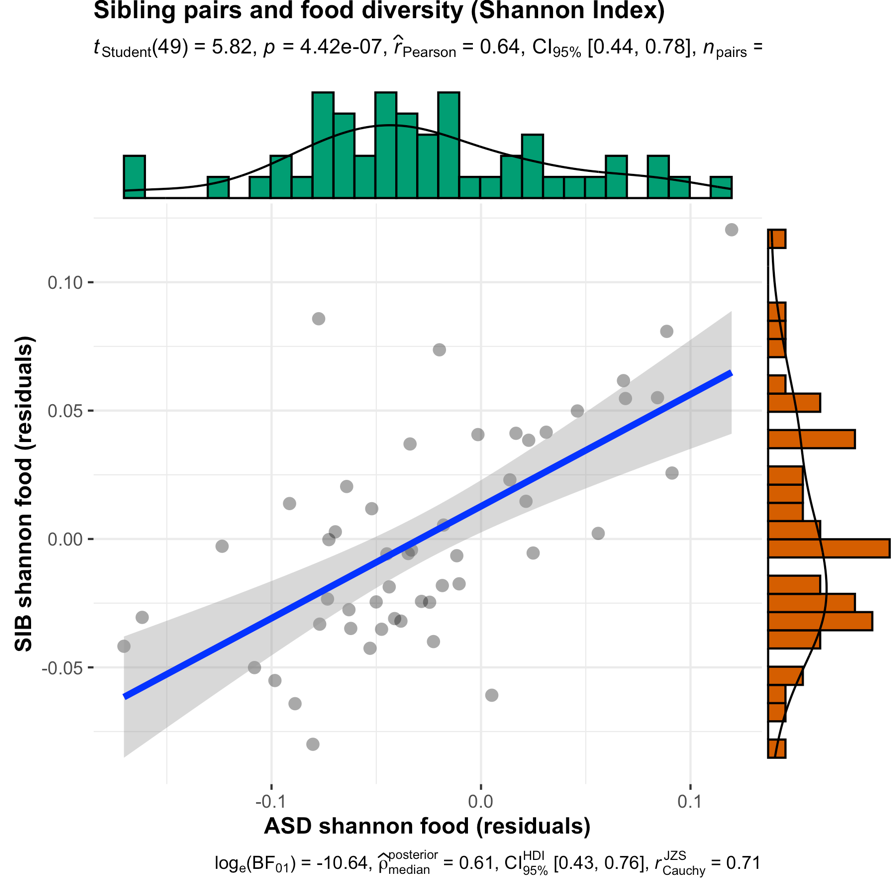
那么对应的菌群多样性呢?下面的图显示,基本没有相关性。
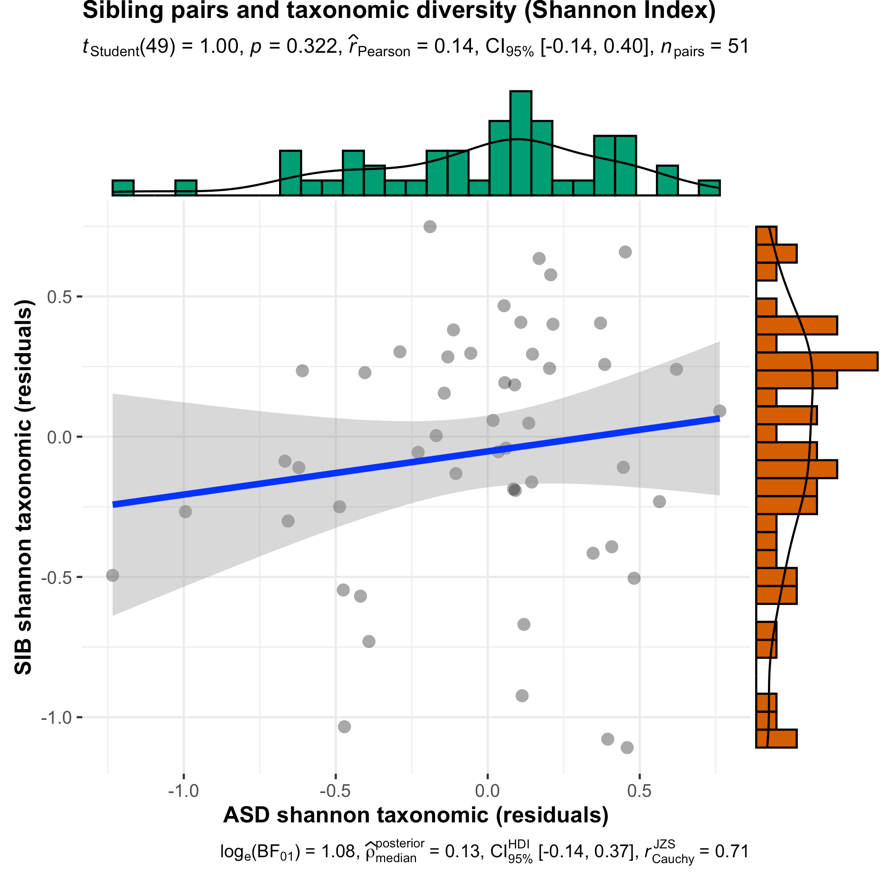
由于论文没有进行成对样本的检验,因此我们尝试下载数据进行单独分析,很遗憾,论文中提供的数据仅包括100例样本的数据,表型和分组等信息只有50例样本的,无法进行单独分析。
针对论文结论的自闭症儿童的饮食类型狭窄的问题,我们认为在早期婴幼儿期饮食构成本身就是相对单一的,而且非自闭症儿童中也存在相当一部分饮食结构单一的,单以饮食结构问题来解释自闭症儿童的菌群差异还不具有足够的说服力。
另外我们注意到,该研究将菌种和后续的基因及代谢途径分为常见和罕见两组,其中种部分中位数大于0的作为常见的,一共96个,其他的有607个种作为罕见。
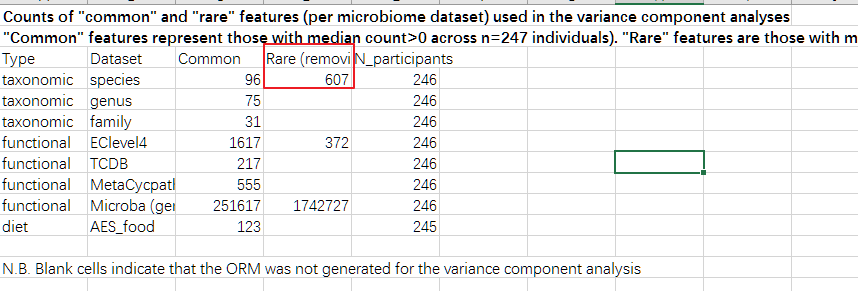

另外在后续对功能基因的分析时也是将分析集中于前面发现的Romboutsia timonensis菌种相关的基因。
当然这是受限于样本数量的因素,聚焦于普遍的高丰度的菌属和基因,但是也有很大可能丢失了可能的联系。
综上,文章否定的是菌群与自闭症之间的直接关联,与之相关文章识别到了自闭症与健康儿童间的差异菌(Romboutsia timonensis,经过年龄、性别、饮食偏好调整之后),以及菌群与重复刻板行为存在显著相关(Fig. 4H)。
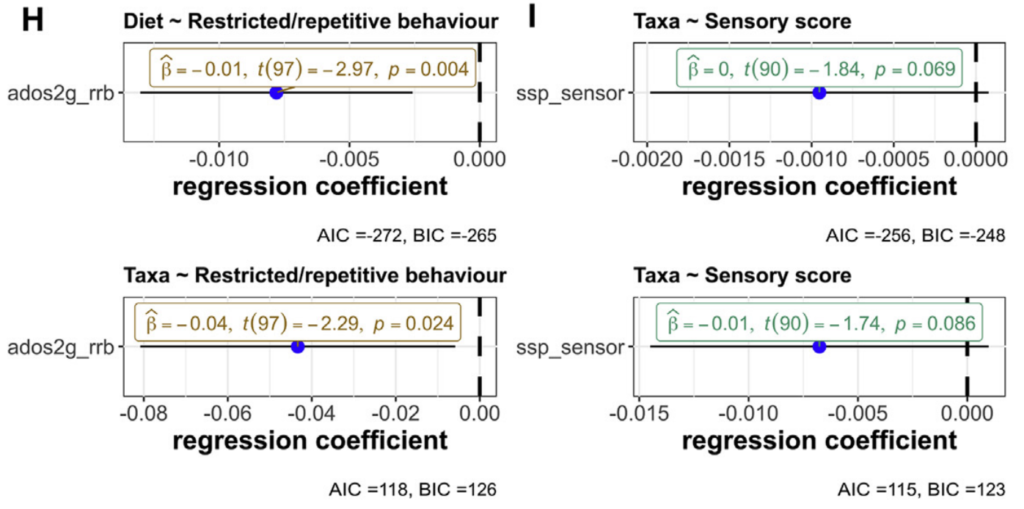
在这样的事实前面,文章依然要强行否认自闭症与菌群的关系,作者的行为很让人费解。
对此,网友们也各抒己见,就该文发表了一些见解:
他们的研究甚至没有试图确定:微生物群是否在自闭症谱系障碍中起驱动作用

他们自己的研究需要收费,这让事情更糟糕。人们必须付费去看他们的研究…
我们认为,以下系列问题仍有待回答
1. 他们的自闭症儿童都属于主要集中在轻度或者边缘程度,这个样本选择是否能代表自闭症的全部群体还存疑;
2. 如果将饮食归因于挑食等问题,那么在临床实践中我们也经常看到正常孩子也有挑食。研究者如果要说明菌群和挑食等行为有关而不是自闭有关,那么应该要设置一组挑食的健康对照儿童,才能彻底屏蔽这个因素的可能影响;因为作者明确表示饮食和自闭症有关,而不认为菌群和自闭症有关;
3. 这些样本的分布是否有跨地区特点?如果有,那么区域也会带来极大的差异,如菌群、饮食习惯等等,如何规避这个的影响?
《cell》原文:doi.org/10.1016/j.cell.2021.10.015