 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康 原创
提到健康饮食,很多人第一反应是“多吃点粗粮,蔬菜,水果”,原因不外乎“补充膳食纤维”,“助消化”等等。
那么,“膳食纤维”是什么?
关于膳食纤维的定义,在前面的“饮食、肠道菌群与健康”一文中有详细阐述过(点此复习)。
简单来说,膳食纤维是一种可以归类为长链的多糖,由于人体胃肠道无法直接消化吸收,但是可以被部分肠道菌群进行代谢利用。
为什么都觉得要补充膳食纤维?
我们都知道膳食纤维对健康起到很多重要作用:比如说增加饱腹感,促进排便,控制血糖,降血脂,维护肠道健康等。
近日,来自意大利巴勒莫大学的研究人员发表在《European Journal of Nutrition》期刊上的一项研究显示,在地中海人群中,摄入较高的膳食纤维总量与全因死亡率降低有关,尤其是可溶性膳食纤维与全因死亡率显著负相关(p=0.007)。每1000kcal能量增加3g蔬菜来源的膳食纤维摄入,全因死亡率降低16%。(研究人员是利用纳瓦拉大学项目(SUN)数据进行研究,数据从1999年开始记录,每2年对参与者的饮食、生活方式、风险因素、医疗条件等进行一次随访。)
作者在文末提倡增加摄入富含膳食纤维食物如蔬菜、水果、全谷物等的食用量,来降低慢性病的发生和死亡风险。
以上可见膳食纤维的重要性。
膳食纤维除纤维素等非常复杂的多糖外,其主要作用可以促进有益菌的生长,并代谢产生短链脂肪酸。
肠道菌群与宿主长期以来通过进化,共生菌适应了宿主的饮食特点,进而具备代谢利用宿主饮食中的碳源的能力,其代谢产生的短链脂肪酸又可以帮助宿主。
短链脂肪酸作为能量底物影响各种生理过程,对身体健康或疾病带来影响。
短链脂肪酸(short chain fatty acid,SCFA)
短链脂肪酸主要包括 乙酸,丙酸,丁酸(比例超过90%)。
短链脂肪酸占人类总能量消耗的2-10%,是大肠上皮细胞的主要能量来源,影响粘液的产生。
短链脂肪酸在生理上影响结肠粘膜的血流、液体和电解质的吸收、自主神经系统和肠道激素的分泌等。




Rivière A, et al. Frontiers in microbiology, 2016
既然膳食纤维能通过肠道菌群的代谢产生短链脂肪酸,而短链脂肪酸对人体健康又有如此重要的作用。看到这里,你是不是想立刻补充一点膳食纤维?先别急,我们再来看一组数据。
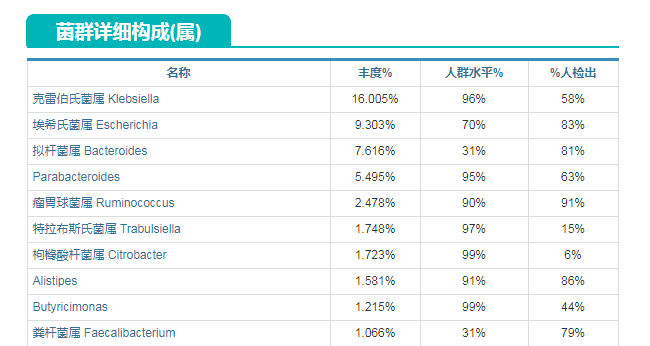

以上是一名检测者,Lily(化名)的菌群检测报告的部分内容。
我们可以看到在她的菌属构成中占比最高的是克雷伯氏菌属,其次是大肠杆菌所在的埃希氏菌属,而正常人体共生菌中最主要的粪杆菌属 Faecalibacterium 仅占比1.066%。
Lily在没有做过检测的时候认为,自己平常有留意到人体需要补充膳食纤维,所以应该尽可能多吃。但是我们的报告却告诉她,这样做并不一定可以带来最有效的干预。为什么呢?
因为肠道菌群在同时有多种碳源可利用的情况下,会优先利用单糖等较易代谢的营养,饮食中摄入游离糖或蔗糖一类简单糖较多不利于益生菌,反而很多病原菌和机会致病菌代谢繁殖优势更大。
在考虑膳食纤维改善肠道菌群时需要考虑现有肠道菌群的构成以及问题菌具体是什么。比如低聚果糖是一类主要的膳食纤维,可以有效的促进双歧杆菌等益生菌的生长,但是肺炎克雷伯氏菌作为另一类常见的肠道机会致病菌也能代谢利用低聚果糖作为碳源,因此在肺炎克雷伯氏菌超标过量的情况下建议食用菊粉作为主要的膳食纤维,因为菊粉无法被克雷伯氏菌利用。
以上,我们不难发现,在了解需要补充膳食纤维的基础上,如果你能更深入了解一些关于膳食纤维如何通过菌群产生短链脂肪酸,这些短链脂肪酸到底是如何产生作用等等知识,你就会更加科学合理地补充你需要的营养。


我们每天所需的热量中10%来自短链脂肪酸,这不仅和我们摄入的膳食纤维的量有关,还与种类有关。
不同来源的膳食纤维产SCFA的比例
不同的膳食纤维经人体肠道菌群代谢后会产生不同量的短链脂肪酸,其中乙酸:丙酸:丁酸的比例和所需时间也有所不同。详见下表:
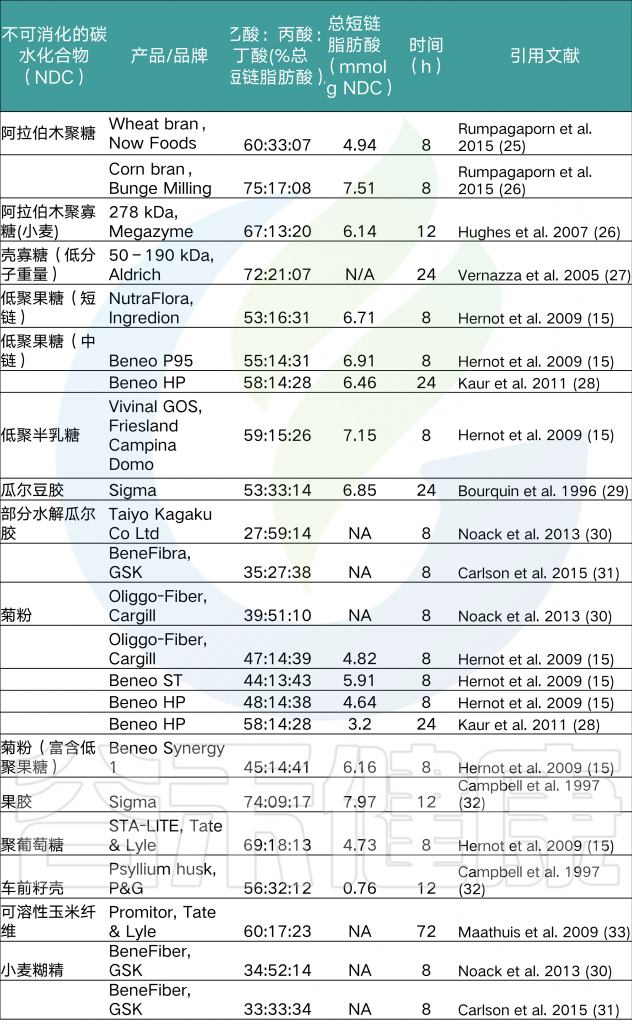

注:上表数据均来自 Alexander C,et al., Advances in Nutrition, 2019,所有品牌不代表谷禾推荐。
在了解了膳食纤维经代谢产短链脂肪酸的量之后,你是不是也想知道一般人体内短链脂肪酸的浓度及比例如何?
我们找了相关数据,下表是已报道过的成人粪便中单个SCFAs(乙酸、丙酸、丁酸)的浓度。
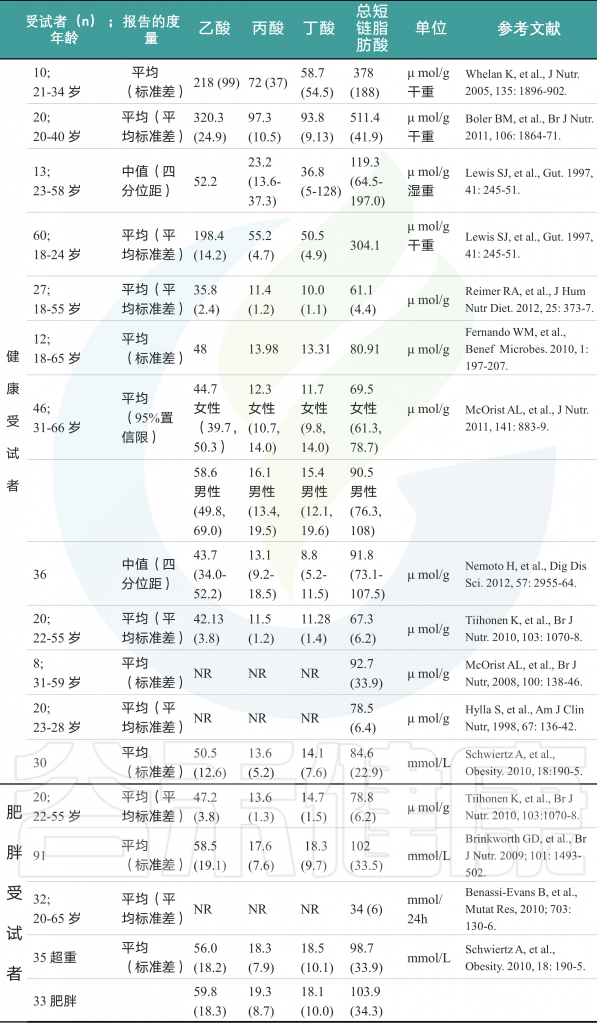

Ohira H,et al., Journal of atherosclerosis and thrombosis, 2017
下表是一些病人的SCFA浓度及比例的相关数据。
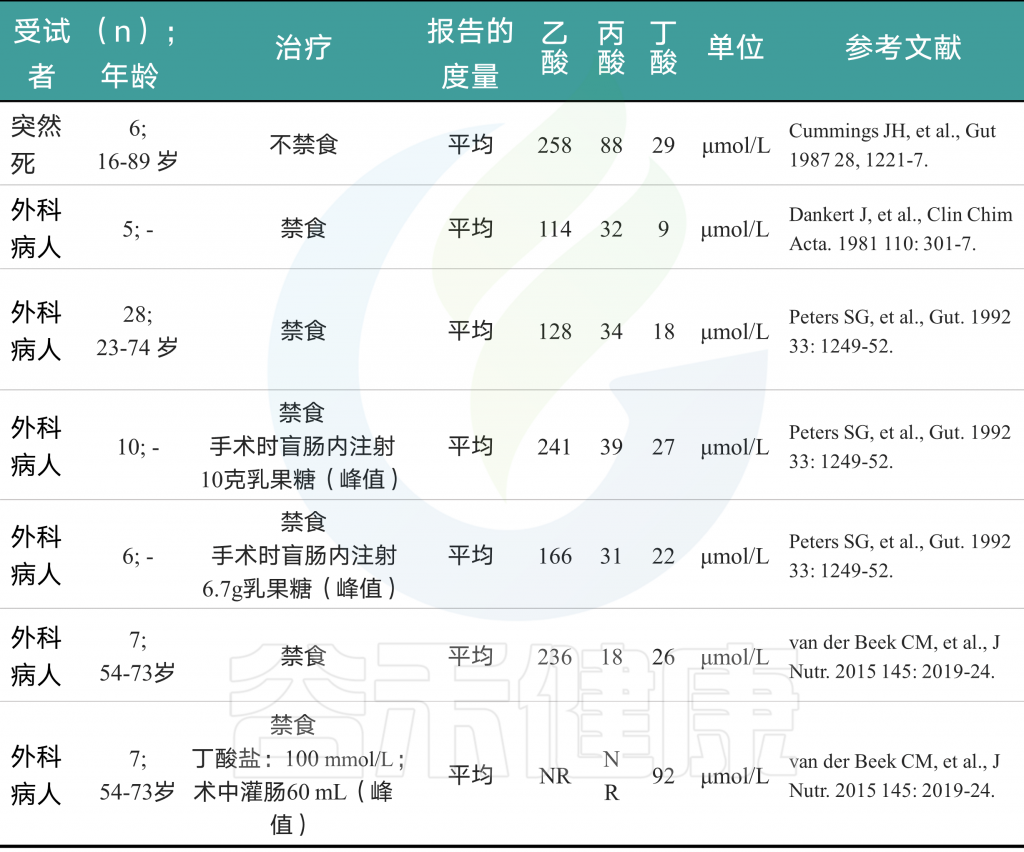

Ohira H,et al., Journal of atherosclerosis and thrombosis, 2017
以上我们对短链脂肪酸的量及乙酸、丙酸、丁酸的比例有了大致的了解。我们的检测报告也有评估短链脂肪酸水平(下面的数字是经过大数据计算之后得出的分数)。
短链脂肪酸评估表

可以看到这位检测者(还是Lily的检测报告)的丙酸是缺乏的,那么就需要相应的选择促进丙酸代谢的菌。如:芒果、高粱、小米、黑麦、荞麦、姜黄等食物就可以促进丙酸代谢菌的生长。
如果我们自己想知道哪些菌与产生短链脂肪酸(乙酸、丙酸、丁酸)有关,那就需要再来深入了解一下产生短链脂肪酸的途径。
短链脂肪酸如何产生?
短链脂肪酸的产生离不开肠道菌群,而肠道菌群的主要能量代谢来源是碳源。
碳水化合物发酵和细菌交叉喂养合成SCFA途径
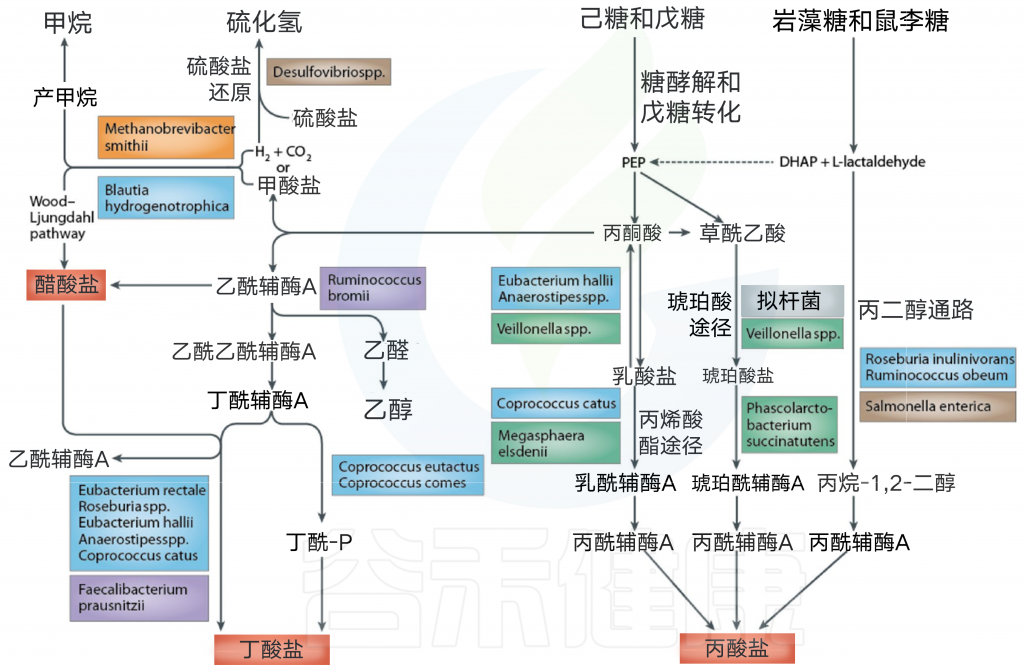

Rowland I et al. European journal of nutrition, 2018
一般而言,碳源中的单糖最易利用,能代谢的菌也最多。而膳食纤维通常是多个单糖构成的,只有特定细菌能代谢,并通过糖解作用进入丙酮酸途径。
接下来,我们通过下表来看看哪些菌群通过什么途径会产生短链脂肪酸(乙酸、丙酸)。


Ohira H, et al, Journal of atherosclerosis and thrombosis, 2017
研究表明,健康个体的粪便样本中丁酸的含量高于患肠病的个体(Basson等,2000)。同样,尽管丙酸水平没有显着差异,但疾病队列的肠道中乙酸水平升高(Weir等人,2013)。
这些结果表明,在三种细菌来源的SCFA中,丁酸盐可能在确定个体的肠道健康状况中起比较重要作用。下面仔细了解一下丁酸是什么,为何如此重要。
丁 酸
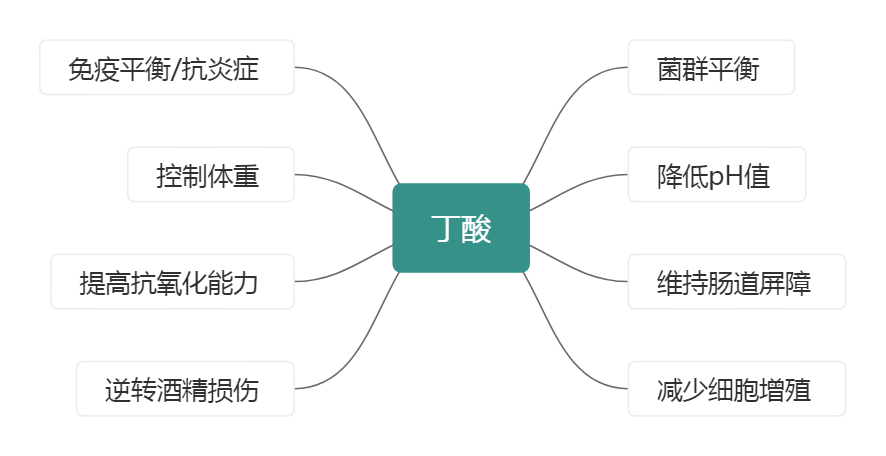
肠道中丁酸对肠道健康具有积极影响
丁酸是结肠上皮细胞的首选能源,在其中它有助于维持肠道屏障,发挥免疫调节和抗炎作用。
研究指出,丁酸的使用可以影响细胞周期蛋白D3的产生,这可能导致细胞在细胞周期的G1期停止生长,并向终末分化转变。实验证明丁酸是组蛋白脱乙酰基酶抑制剂,进一步强调了其通过表观遗传调控在减少细胞增殖中的作用。
丁酸的产生会降低pH值,可防止肠道中诸如肠球菌和大肠杆菌等病原性微生物的生长。

接着再来看,丁酸是怎么来的?
丁酸的产生途径
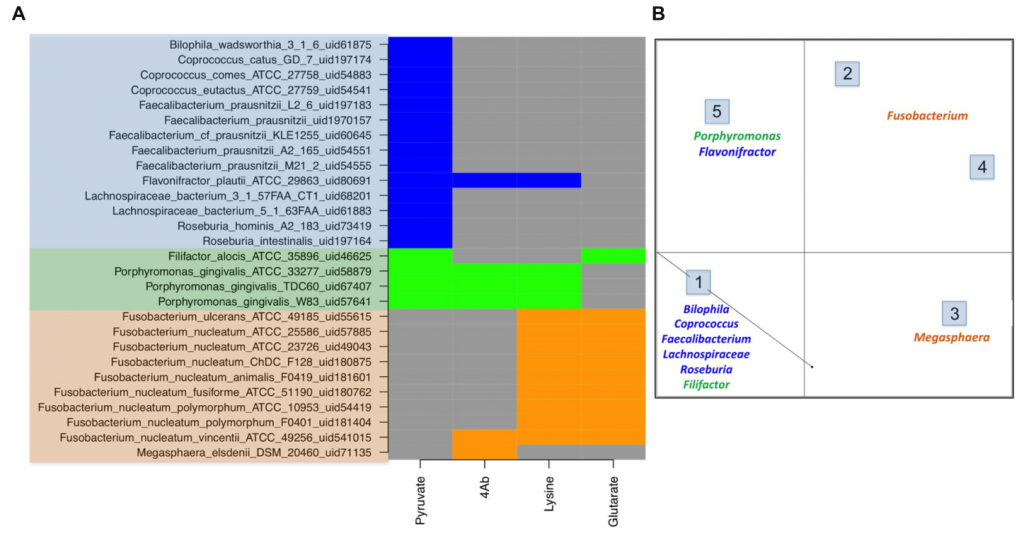
四种丁酸产生途径的示意图
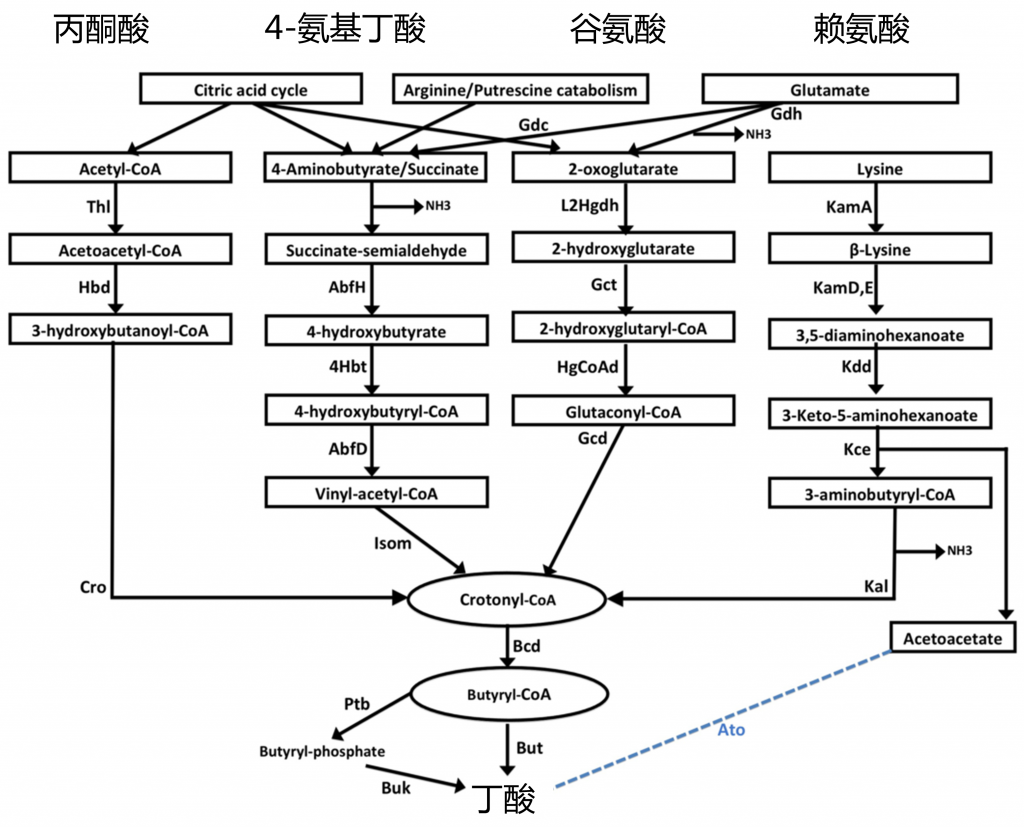

Anand S, et al. Frontiers in microbiology, 2016
上图显示细菌利用四种底物,即丙酮酸、戊二酸、4-氨基丁酸和赖氨酸,通过4种不同途径产生丁酸。
简单来说,这四条途径中的每一条都使用丁酰辅酶A脱氢酶电转铁蛋白黄素复合物(Bcd Etfαβ)催化巴豆酰辅酶A转化为丁酰辅酶A。最终,丁酸的生产由丁酰辅酶A:乙酸辅酶A转移酶(But)或丁酸激酶(Buk)催化。
至此,我们了解了丁酸的产生途径是菌群利用底物通过不同途径产生的,那么菌群又是如何发挥作用的呢?
肠道菌群和丁酸产生途径
研究数据显示,健康人的肠道中,丁酸产生菌如粪杆菌属Faecalibacterium、粪球菌属Coprococcus 和罗氏菌属Roseburia 的出现率较高;而在患有大肠癌、IBD、溃疡性结肠炎、糖尿病等的个体的肠道中,这些属的丰度较低。
为了评价产丁酸菌在人体肠道中的作用,研究人员分析了443名健康人和567名患病者的16srRNA扩增子的公开数据集。
多元分析结果如下:
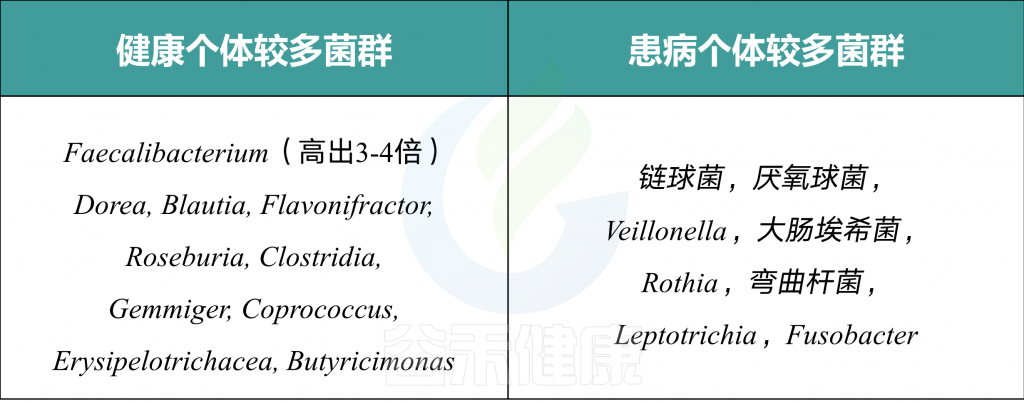

我们可以看到健康个体和患病个体内会有不同的菌占优势。
一个有趣的现象:所有患有CRC(95个样本)和IBD(101个样本)的患者中,Fusobacterium 菌属(唯一的一个产丁酸的菌)出现率高2倍。这是为什么呢?
研究人员对所有已测序的细菌基因组(如前所述)进行了四种不同丁酸生产途径的基因组挖掘。在将健康和患病数据集中显示不同丰度的属映射到每个基因组中丁酸产生途径时,观察到不同的分布。

Anand S, et al. Frontiers in microbiology, 2016
在对可能的致病菌和共生体中各种丁酸生产途径进行深入的比较之后的结果表明,在许多栖息于肠道的Lachnospiracea 菌株缺乏丁酸途径,只有产丁酸的共生体才会释放一部分丙酮酸来产生丁酸。
而与共生细菌相反,在大多数致病菌属中,丁酸生物合成途径未被鉴定。这些肠道相关的梭杆菌菌株(上图A)都缺乏丙酮酸途径来产生丁酸。在疾病条件下,高丰度的产丁酸菌可能与丙酮酸缺乏有关。
而另一类利用氨基酸作为初始底物(谷氨酸,4Ab,赖氨酸,天冬氨酸甲酯)在肠道病原体(如:Fusobacteria 和 Megasphaera)中普遍存在,并导致产生氨气,对肠道健康有害。
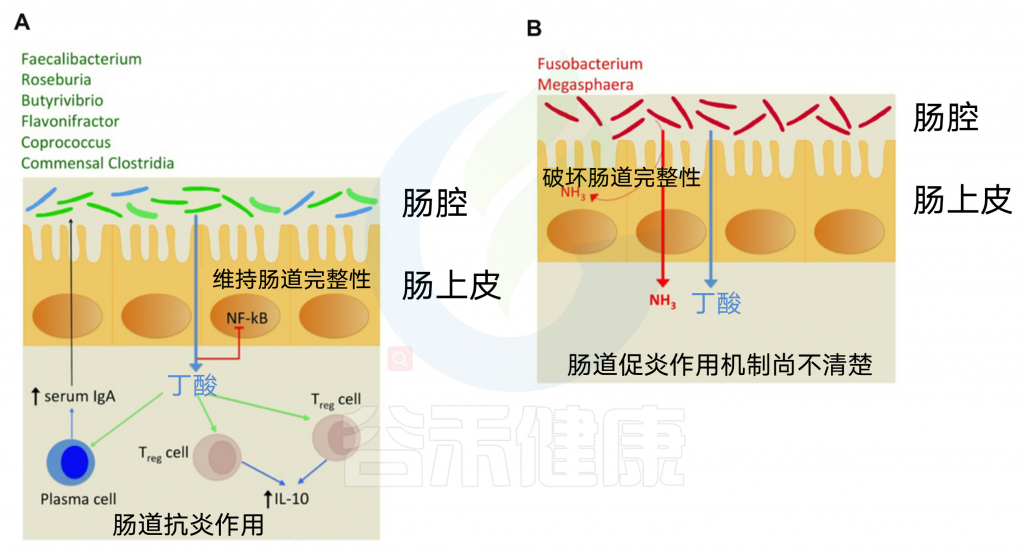
丁酸的免疫调节作用
研究丁酸对抗炎反应的免疫调节作用。它刺激调节性T细胞(Treg)增加IL-10的产生,IL-10是一种抗炎细胞因子(下图A)。
丁酸还刺激血浆细胞分泌血清IgA,从而限制肠道内病原菌的增殖。具有产丁酸途径的病原菌导致伴随氨的产生,从而增加肠道炎症(下图B)。
因此,本研究表明,病原体保留了导致有害氨释放的丁酸途径,这可能会对肠道完整性造成损害,从而导致病原体入侵的可能性更高。

Anand S, et al. Frontiers in microbiology, 2016
以上,我们知道了丁酸对肠道健康很重要,但并不是所有产丁酸菌都是有益菌。因为在细菌中存在多种代谢产生丁酸的途径,其底物和代谢产物有所不同,对应的菌也有差异。
主要的有益健康的产丁酸菌主要通过代谢碳水化合物并通过丙酮酸途径产生丁酸。已知丙酮酸是通过所有细菌中的葡萄糖代谢糖酵解途径生物合成的。
(产丁酸的有益菌,例如:Faecalibacterium,Roseburia 和 lachnospiracea incertae sedis)
如何提高丁酸水平?
丁酸对人体这么重要,你可能会想知道怎样获取。目前的策略通常是补充益生菌和益生元。

那么益生菌、益生元和丁酸之间有什么关系,又是如何对人体健康带来积极影响的呢?
在解决这个问题之前,我们先来了解下概念。
很多人往往会把益生菌和益生元搞混淆,或者认为它们就是同一种东西,其实是不一样的:益生菌是活菌,通常在乳制品如酸奶等食物中会添加,而益生元可以理解为是给益生菌吃的食物。
益生菌
根据国际益生菌和益生元科学协会(ISAPP)的定义,益生菌被定义为“活微生物,如果给予足够的量,可以给宿主带来健康益处”。
目前使用的益生菌有20余种,主要有3类:双歧杆菌属、耐氧的乳杆菌属和兼性厌氧球菌。
乳杆菌和双歧杆菌不产生丁酸,但通过交叉喂养摄入其他共生微生物(如粪杆菌属),可增加肠道中的丁酸水平。
双歧杆菌精选菌株也是常用的益生菌,可以添加到食品补充剂和食品(尤其是乳制品)中。口服双歧杆菌对不同消化问题和疾病有益,包括加快肠道运输时间;改善乳糖不耐症;预防与抗生素有关的腹泻和坏死性小肠结肠炎(对于通常携带双歧杆菌数量减少的早产儿);减轻IBS和IBD症状。
不同的菌对膳食纤维的利用不同,所能转化的短链脂肪酸也不同。双歧杆菌能代谢产生乙酸,而其产生的乙酸在存在产丁酸菌的时候可以被利用生成丁酸。
另一种益生菌——鼠李糖杆菌被发现可以有效改善儿童食物过敏。
来自澳大利亚的一项实验,30名过敏儿童每天服用小剂量的花生蛋白以及剂量逐日增加的益生菌(鼠李糖乳杆菌,Lactobacillus rhamnosus GG),最终益生菌的量相当于每天摄入44磅酸奶的益生菌摄入量。在经过18个月之后,这其中有大约4/5的孩子吃花生之后没有出现过敏反应。
益生菌还能改善肠道屏障作用(刺激粘蛋白产生),产生神经化学物质(如5-羟色胺,催产素等),产生酶类(如胆盐水解酶、乳糖酶等),产生饱腹感的激素等,对健康的影响力不容小觑。
除了直接补充益生菌的方式之外,另外一种方式可以为益生菌提供更好的生存环境,那就是补充益生元。
益生元
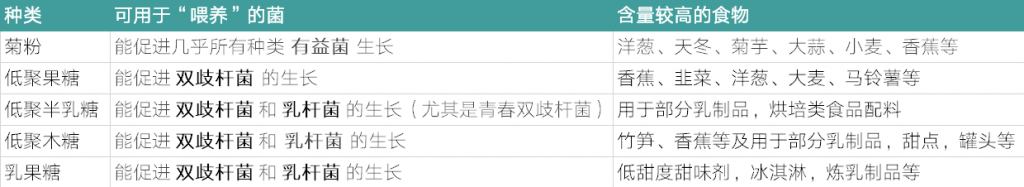
益生元是一些不被宿主消化吸收的有机物质,却能够选择性地促进体内有益菌的代谢和增殖,调节肠道菌群组成和活性,从而对宿主健康产生有益影响。常见的益生元包括菊粉、低聚果糖(FOS)、低聚半乳糖(GOS)、乳果糖、低聚木糖、低聚异麦芽糖、大豆低聚糖等。
通常市面上的婴儿奶粉都会添加益生元,那么益生元是如何对宝宝健康起作用的呢?
这要从宝宝的出生说起。刚出生时肠道会被不同菌群迅速定殖,其中最丰富的要数双歧杆菌。
在生命早期,婴儿的微生物组通常是在人乳中的分子指导下产生的。这主要是通过母乳低聚糖(简称HMO)来实现的,HMO可以为婴儿体内生长中的微生物群提供养分。只有双歧杆菌和拟杆菌显示出代谢的HMO。特别是两歧双歧杆菌和婴儿双歧杆菌是HMO的有效利用者,而它们被短双歧杆菌和长双歧杆菌适度消化。动物双歧杆菌和青春双歧杆菌不能降解HMO。
低聚半乳糖刺激双歧杆菌的生长,尤其是青春双歧杆菌的数量受到影响,并且当低聚果糖作为唯一碳源时,双歧杆菌容易生长。
与母乳喂养相似的比例:
当使用比例为 9 : 1 的 低聚半乳糖 : 低聚果糖 混合物时,不同双歧杆菌物种的比例与母乳喂养婴儿的比例相似。这种 低聚半乳糖:低聚果糖 混合物也被证明是双歧杆菌和乳酸杆菌的最佳生长底物。
当 聚葡萄糖:低聚半乳糖 以 1 : 1 的比例结合使用时,双歧杆菌种类的增加,特别是婴儿双歧杆菌、长双歧杆菌和链球菌双歧杆菌,与母乳喂养的微生物群相似,其中婴儿双歧杆菌、长双歧杆菌和短双歧杆菌占优势。
以上讲到关于益生元促进宝宝菌群中有益菌增殖,从而给宝宝的健康带来的积极影响,那么只有婴儿需要益生元吗?
当然不是,成年人同样需要益生元的补充。成年人的有益菌的数量会逐渐减少,尤其中老年。补充益生元可以帮助有益菌的增殖,充足的益生菌可以竞争性抑制有害菌的生长,从而使菌群结构维持在相对健康的状态,改善肠道环境,改善健康。
然而,不同的益生元具有不同的物质结构,对有益菌的促进作用存在一定的差异。
过去,益生元刺激的目标属是双歧杆菌,如今,人们正在寻找新的益生元来刺激人结肠中其他有益细菌物种,例如丁酸生产者。引起双歧化作用和产丁酸作用的益生元特别令人关注。
菊糖型果聚糖,阿拉伯木聚糖和阿拉伯木聚糖低聚糖是这样的益生元,既刺激双歧杆菌又生产丁酸。
食用菊糖型果聚糖的有益作用包括增加排便频率,增加结肠中膳食矿物质(钙和镁)的吸收,降低蛋白水解活性以及增加饱腹感激素的分泌。
通过饮食补充
有人说,虽然知道需要补充益生元,但是一定要服用益生元制剂吗?可以通过饮食来改善吗?
当然也是可以的。
我们的检测报告中也有相应的食物和益生元的推荐。
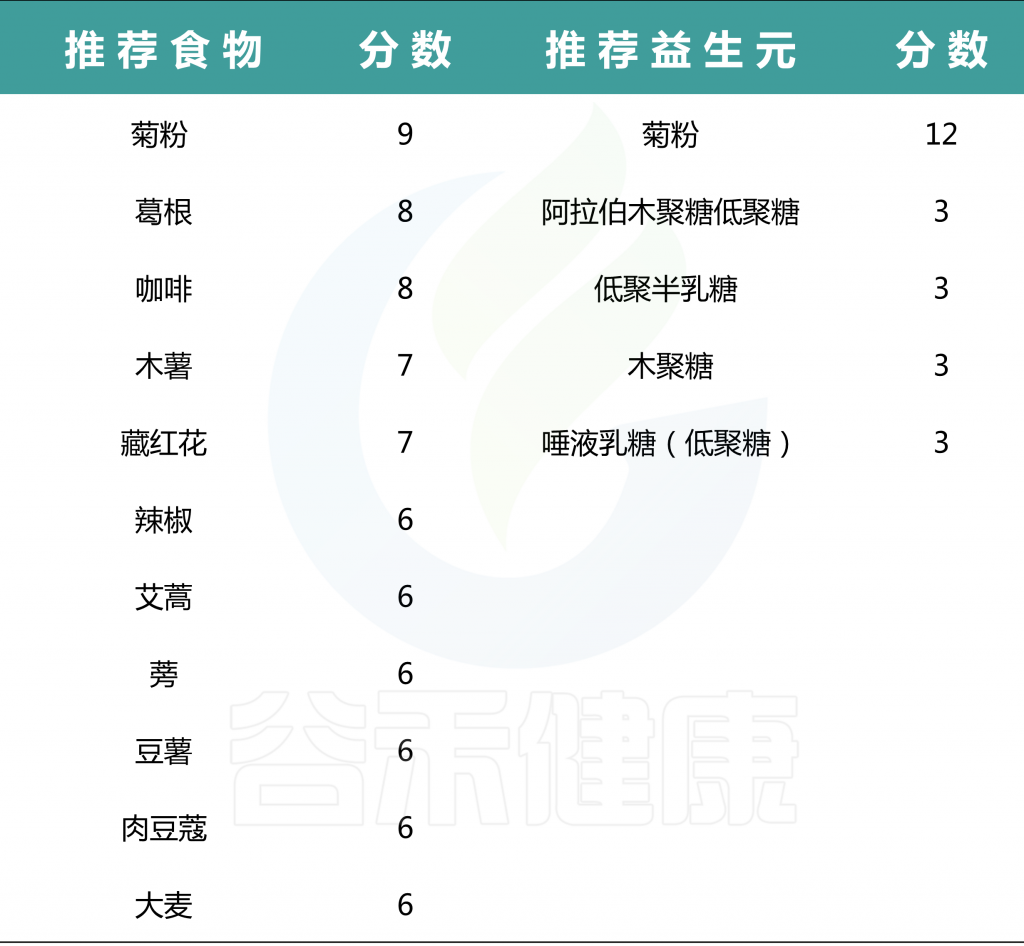

推荐食物的分值说明:
分数的总数是20
每一种食物推荐范围是:-20~20
在前面的文章 饮食、肠道菌群与健康 中也讲到过食物中的膳食纤维(包括菊粉、抗性淀粉、低聚果糖、低聚半乳糖、聚葡萄糖等)对菌群的影响。
一些益生元比如说:菊粉,在许多蔬果中(洋葱、天冬、菊芋、大蒜、小麦、香蕉等)都有不同含量的存在。如果需要补充,可以选择所需膳食成分相应含量高的食物。

抗性淀粉
除了前面提到的乳杆菌和双歧杆菌通过交叉喂养摄入其他共生微生物,可增加丁酸水平之外,另外膳食纤维成分比如抗性淀粉也有助于丁酸增加。
抗性淀粉又称抗酶解淀粉,难消化淀粉,在小肠中不能被酶解,但在人的肠胃道结肠中可以与挥发性脂肪酸起发酵反应。抗性淀粉存在于某些天然食品中,如马铃薯、香蕉、大米等都含有抗性淀粉,特别是高直链淀粉的玉米淀粉含抗性淀粉高达60%。
抗性淀粉含量高的饮食可将主要短链脂肪酸的比例转移至丁酸生产的增加。相比之下,减少饮食中碳水化合物(特别是淀粉)的含量会显着减少产生丁酸的Roseburia 种类的数量,同时减少丁酸的形成。
结 语
每个人的菌群结构,营养状况等各方面都不尽相同,只有在选择对自己真正有益的食物或者益生菌补充剂的基础上,精准干预,才能更有针对性,有效地改善健康状况。

谷禾健康 是谷禾面向健康领域的品牌,通过无创采集微量粪便样品,常温快递运输至谷禾检测中心,经全自动化样品处理和提取后大规模高通量测序获取菌群基因数据并进行分析解读,凭借全球领先的样本积累和业界独有的人工智能算法实现了基于肠道菌群的疾病预测和系统健康风险评估, 以及肠道菌群,病原物感染,重金属污染以及营养物质和激素代谢水平等在内的综合健康风险提示,并提供精准个性化的健康管理方案。公司成立于2012年,总部位于杭州,拥有优秀的研发团队和独立实验室,经过多年的积累,已完成近6万例临床肠道菌群样本检测,并构建了超过20万各类人群样本数据库。
谷禾健康的服务旨在通过持续不断的研发和改进,大量自动化提升效率,降低检测成本,为广大消费者提供更好更有价值的产品。
联系方式:400-161-1580

腹泻症状是大多数患者通过稀便(从可流动到水样),尽管也存在异常频繁的排便(每天2次排便)。腹泻代表肠功能的改变,由于多种原因,肠道对水的净吸收减少,导致粪便含水量高。肠易激综合征(irritable bowel syndrome,IBS)是一组持续或间歇发作,以腹痛、腹胀、排便习惯和(或)大便性状改变为临床表现,而缺乏胃肠道结构和生化异常的肠道功能紊乱性疾病。个体IBS患者中发现产生症状的特定机制是困难的,因为缺乏具有足够敏感性和特异性的测试来鉴定这些原因,并且证明鉴定该机制可以导致迅速而有效率的治疗。
近日,一篇发表发表于《The Journal of Clinical Investigation》来自中国香港特区香港浸会大学中医学院的研究成果:A Clostridia-rich microbiota enhances bile acid excretion in diarrhea-predominant irritable bowel syndrome(富含梭菌的微生物群促进腹泻型肠易激综合征胆汁酸排泄),其结果阐明了富含梭状芽胞杆菌的微生物群可以通过靶向反馈调控粪便胆汁酸的合成来诱导粪便胆汁酸的过度排泄。研究结果还提示了一种新的治疗策略,即以粪便胆汁酸转化细菌为靶点治疗腹泻型肠易激综合征患者的胆汁酸腹泻。研究人员认为,准确描述肠道微生物区系及其代谢物,结合肠道微生物区系的结构和功能特征,将提高现有肠易激综合征基于症状的治疗的精确度。

摘要
粪便胆汁酸(BAs)过多被认为是腹泻型肠易激综合征(IBS-D)的发病机制之一。然而,导致BA排泄过多的因素仍未完全研究。这篇研究证实了富含梭状芽孢杆菌的微生物群导致IBS-D患者BA排泄过多。通过BA相关代谢分析和宏基因组学分析,发现24.5%的IBS-D患者存在总BAs排泄过多和粪便中BA转化菌改变。通过一系列的动物和细胞实验,阐明了富含梭状芽胞杆菌的微生物群可以通过靶向反馈调控BA的合成来诱导BA的过度排泄。研究结果还提示了一种新的治疗策略,即以BA转化细菌为靶点治疗IBS-D患者的BAD。
背景
以排便习惯不规则为特征的肠易激综合征(IBS)影响着全球10%的人口,其中以腹泻为主的IBS(IBS-D)在西方国家和亚洲的患病率较高。临床研究表明,在IBS患者中,粪便总胆汁酸的增加与腹痛和结肠传输加速运动显著相关。动物研究表明,BAs直接诱导结肠运动加速和内脏超敏反应。相反,使用隔离剂减少BA的分泌可以部分缓解IBS-D患者的症状。这些观察结果证明了BA在IBS发展过程中的重要性。然而,过量的BA分泌是如何产生的还不完全清楚。通常情况下,BA主要由限速酶胆固醇7α羟化酶(CYP7A1)合成,然后与肝脏中的氨基酸结合。大部分结合的BA被释放到肠道,从远端回肠被重新吸收,并通过门静脉回流到肝脏,这一过程被称为肠肝循环。少量逃过肠道吸收的BAs最终每日随粪便排出,可通过肝新生合成补充。肝脏和回肠中的BA合成速率受法尼醇X受体介导(FXR介导)反馈机制的可逆控制。肠道菌群在胃肠道中负责初级BAs向次级BAs的转化,并与宿主相互作用以控制BA的合成。
实验设计
1.受试者和样本采集
290名符合罗马IV诊断标准的IBS-D成人患者和91名健康受试者(HC)提供空腹血液和早晨第一次粪便。被要求在抽样前至少一个月停止使用抗生素、益生菌、益生元和其他与肠道菌群相关的补充剂。人体样本(血清和粪便)用干冰运送到实验室,并在-80°C冷冻。其中粪便总胆汁酸排泄量(≥为10.61molmol/g)的71名IBS-D患者归为BA+IBS-D组,剩余219名粪便胆汁酸排泄量正常(<10.61mol/g)的IBS-D患者归为BA-IBS-D组。
2.粪便移植实验
ABX由万古霉素(50
mg/kg)、新霉素(100 mg/kg)、甲硝唑(100
mg/kg)、两性霉素B(1 mg/kg)和氨苄西林(1
mg/mL)组成。成年雄性C57BL/6J小鼠在粪便移植前连续10天给予ABX,诱导为伪无菌小鼠模型(共71只)。HC和IBS-D供体(n=11-12个/组)的粪便样本分别制备为微生物菌群PBS悬液(50 mg/mL)。用2 0 0μL菌群悬浮液每日灌胃,连续5天。在基线(ABX干预前)、FMT前(ABX干预后)和FMT后收集粪便样本,以监测细菌密度。最后,麻醉后收集盲肠内容物检测BA转化菌的丰度和活性。收集其他标本(肝脏、回肠和回肠内容物)以分析BAs和/或BA相关基因和蛋白。
3.菌群定植实验
选用18只成年雄性C57BL/6J小鼠(n=6只/组)。通过16S核糖体序列分析,鉴定出一株典型的BA转化梭菌(C.scindens;ATCC,35704)。该菌株用脑心浸液肉汤(BHI,BD Biosciences)在厌氧条件下培养。在确认其体外BA转化活性后,每天给1组小鼠灌胃1×108cfu/mL的C.scindens菌PBS悬液,连续7天。另一组小鼠给予0.1
mg/mL的万古霉素,并以PBS为对照。
4.
BA对小鼠的干预实验
40只成年雄性C57BL/6J小鼠分为5组(n=8/组)。4个实验组分别以50 mg/kg体重的TCA、TCDCA、TUDCA或它们的混合物(T-bas)灌胃8周。第5组为生理盐水对照组。治疗结束后,取肝、回肠组织标本,用实时定量PCR方法分析FXR、FGF19、SHP和BA合成酶(CYP7A1、CYP8B1)基因。
5.肝细胞和肠上皮细胞制备
L-02(肝细胞系)和NCI-H716(上皮细胞系)分别用含10%Gibco胎牛血清的DMEM培养基和RPMI 1640培养基培养在塑料培养皿中。分别用万古霉素(10μM~40 0μM)和C. scindens (活体和热灭活)处理L-02细胞24h,检测它们对肝脏CYP7A1表达的影响。根据BAS激活FXR的EC50值范围,分别用50μ的M-TCA、TCDCA、TUDCA和T-bAS处理L-02和NCI-H716细胞24h,分析BA-牛磺酸偶联物对FXR、FGF19、SHP、CYP7A1和CYP8B1表达的影响。分别用GUDCA、GCDCA、GCA、CA、UDCA和7-KDCA处理NCI-H716细胞24h,观察其对肠上皮细胞FXR和FGF19表达的影响。
6.粪便宏基因组数据处理和统计学分析
去掉低质量的碱基和人类基因组,剩下83.59%的高质量序列。微生物多样性的测定和分类群的鉴定使用已发表的人类肠道微生物组基因目录数据库对比后分析。通过BLASTP对KEGG基因数据库(V79)进行功能同源基因(KO)预测。根据各自基因的相对丰度计算了门、属、种和KO的相对丰度。Shapiro-Wilk检验,判断人类粪便总胆汁酸的分布。基于Prism 7的斯皮尔曼相关系数分析总粪便总胆汁酸与其他生化和细菌特征的关系。Benjamin-Hochberg方法对微分类群和BA转化基因组进行了分析。临床定量特征、代谢产物和基因的变异,在多组比较时采用非参数Kruskal-Wallis检验,两组比较时采用Mann-Whitney检验。具有统计学意义的差异被定义为P<0.05
主要结果
1.
IBS-D患者胆汁酸合成增强,同时伴有过多的胆汁酸排泄和腹泻症状加重。肠道菌群衍生的胆汁酸的组成(如GUDCA、UDCA、7-KDCA等)发生了变化。BA+IBS-D患者血清和粪便中BA转化菌群异常,提示肠内转化胆汁酸菌群的异常可能是该病的病因之一。

A).正常对照组(HC)和IBS-D患者组的粪便总胆汁酸分布直方图。IBS-D组和HC组的粪便总胆汁酸排泄量呈偏态分布(经Shapiro-Wilk检验,P<0.05)
B)C).分别为血清7-羟基-4-胆甾烯-3-酮(C4)和成纤维细胞生长因子19的浓度在各组间的分布。)。BA+IBS-D组的血清C4升高,FGF19降低。
D)E)F).通过排便频率(D)、布里斯托大便分类法(E)、IBS严重程度评分系统(F)评估BA+IBS-D组和BA-IBS-D组之间的肠道症状严重程度。在BA+IBS-D组中,粪便总胆汁酸水平与血清C4水平和腹泻症状评分(Bristol大便规模和排便频率)呈正相关,而与血清FGF19水平呈负相关。
G)H).粪便中占优势的胆汁酸成分的绝对含量。I).粪便中占优势的胆汁酸成分在各组间占的比例。图例中仅显示了占胆汁酸总数1%以上的成分,I这些组分在BA+IBS-D组中都有显著增加。
显著性标记:与HC组比较(*P < 0.05, ***P < 0.005);与BA-IBS-D组比较(#P < 0.05, ##P < 0.01,
###P < 0.005)
2.在BA+IBS-D组中存在一个特定的富含梭菌的微生物群,具有不同的基因组,用于BA去结合、C7异构化和脱羟基。IBS-D队列中富含梭状芽孢杆菌的微生物群与胆汁酸合成和排泄的增加有关。

A).与HC和BA-IBS-D组相比,BA+IBS-D组的粪便微生物群落表现出更高的Bray-Curtis差异。在BA+IBS-D亚组中,肠道生态系统的不稳定性更大。
B).BA+IBS-D组 厚壁菌门与拟杆菌门的比值显著升高。
C)D)E).分别为转化胆汁酸的基因组和细菌的相对丰度。Alistipes和Bacteroides菌的相对丰度降低主要与cgh基因有关。编码7α-羟基类固醇脱氢酶(7α-hsdh)的hdhA基因丰度增加归因于大肠杆菌、梭菌、布鲁氏菌、瘤胃球菌和梭状芽孢杆菌种类的增加。
F)G). IBS-D队列中细菌丰度与生化指标之间的斯皮尔曼相关性。梭状芽孢杆菌的属和种分类的相对丰度与粪便总胆汁酸和血清C4浓度呈正相关,与血清FGF19水平呈负相关。
显著性标记:与HC组比较(*P < 0.05, ***P < 0.005);与BA-IBS-D组比较(#P < 0.05, ##P < 0.01)。斯皮尔曼相关系数的统计学意义定义为P<0.05
3.移植富含梭状芽孢杆菌的微生物群可以诱导受体小鼠腹泻样表型,促进胆汁酸的合成和排泄,但这些作用可能不依赖于胆汁酸的回肠吸收和肝反馈抑制。

A). ABX诱导伪无菌小鼠粪便微生物区系移植的实验程序(n=6/组)。接受HC供体粪便微生物群的小鼠归为ABX+HC组,接受BA+IBS-D和BA-IBS-D供体粪便微生物群处理的小鼠分别归为ABX+BA+和ABX+BA-两组
B). 小鼠的胃肠道转运时间和粪便含水量。微生物移植一周后,BA+IBS-D微生物群受体小鼠的胃肠道转运时间缩短,粪便含水量增加。这与供体的腹泻症状相似。
C). 基于qPCR分析,供体和受体小鼠粪便中胆汁酸相关细菌的相对水平。受体的胆汁酸转化细菌的粪便特征与BA+IBS-D供体相似,拟杆菌的丰度降低,而厚壁菌门、梭菌集群XIVa和梭状芽胞杆菌的丰度升高。
D)E). 小鼠粪便总胆汁酸和血清C4水平。F). 小鼠肝脏中胆汁酸谱。BA+IBS-D微生物群受体小鼠的粪便总胆汁酸和血清C4增加,肝脏和回肠腔中牛磺酸结合的BAs(T-βMCA、TCA、TCDCA和TUDCA)升高。
G). 胆汁酸合成调节因子在小鼠肝组织中的相关基因表达。在BA+IBS-D微生物群受体中,肝脏组织中Cyp7a1mRNA和Cyp8b1mRNA的基因表达增加,但Shp和回肠组织中Fgf15的基因表达降低。
4.梭状芽孢杆菌的定植对小鼠胆汁酸合成和排泄的调控作用。梭状芽孢杆菌对胆汁酸排泄增加和腹泻样表型的影响参与了法尼醇X受体(FXR)介导的胆汁酸合成的反馈控制。

A).通过导入Clostridium Scindens菌株(C.s)或注射万古霉素(0.1 mg/mL,VAN)来调控梭状芽胞杆菌。对照(CTR)
B). 梭状芽孢杆菌处理小鼠的胃肠道转运时间和粪便含水量。与经赋形剂处理的小鼠(CTR)相比,梭状芽胞杆菌的定植显著降低了粪便稠度。万古霉素的治疗显著降低了胃肠道转运速度。
C). 基于qPCR分析,供体和受体小鼠粪便中胆汁酸相关细菌的相对水平。与CTR组相比,梭状芽胞杆菌定植小鼠的盲肠中的Clostridium
Scindens菌丰度显著增加,经万古霉素处理的小鼠盲肠中梭状芽孢杆菌的数量明显减少。
D)E). 小鼠粪便总胆汁酸和血清C4水平。在梭状芽胞杆菌定植小鼠中,粪便总胆汁酸和血清C4浓度显著增加,但经万古霉素处理的小鼠中,这些都降低了。
F). 小鼠肝脏中胆汁酸谱。牛磺酸结合的BAs(T-βMCA、TCA和TUDCA)在梭状芽胞杆菌定植小鼠中的肝脏和回肠腔中显著增加,而万古霉素处理的小鼠中则显著降低。
G). 胆汁酸合成调节因子在受体小鼠肝组织中的相关基因表达。Cyp7a1mRNA在梭状芽胞杆菌定植小鼠肝脏中表达升高,但在万古霉素处理的小鼠中显著降低。Fgf15mRNA在梭状芽胞杆菌定植小鼠回肠中表达降低。FGFR4和KLB在各组间的表达差异无统计学意义。
5.梭状芽胞杆菌衍生的胆汁酸组分对肠道FXR负反馈信号的有抑制作用。富含梭状芽孢杆菌的微生物群导致某些次级BA(例如UDCA、UDCA结合物和7-KDCA)比例较高,这些BAs可以减弱肠道FXR/FGF19信号,从而促进IBS-D患者肝脏合成和粪便排泄的增强。

A)B). 牛磺酸偶联BAs干预FXR基因及其靶基因在小鼠肝脏和回肠的表达。TUDCA降低了小鼠回肠中FXR基因的表达。TCDCA、TUDCA和T-BAs降低小鼠回肠中Fgf15表达,升高肝脏中Cyp7a1表达。4种BA处理对肝脏FXR表达均无影响,但TUDCA可增加Shp在肝脏中的表达。
C). Western blot显示FXR和FGF19在从小鼠富含梭状芽孢杆菌的微生物群中衍生出的胆汁酸-牛磺酸偶联物处理的肠细胞中的表达。T –BAs是TCA, TCDCA和TUDCA的组合。TUDCA和T-BAs都显著降低了NCI-H716肠细胞中FGF19的表达,这与体内观察结果相似。
D).FXR和FGF19基因在人体富含梭状芽胞杆菌的肠上皮细胞中的表达。E). 在FXR激动剂CDCA和梭菌衍生物胆汁酸的联合作用下肠上皮细胞FGF19基因表达的研究。CDCA和CA激活FXR并显著上调FGF19的表达。其它BAs对FXR无影响,但能有效拮抗CDCA诱导的FXR激活。
结论
这项研究在BA+IBS-D患者中发现了一种富含梭菌的微生物群,其BA转化活性不平衡。富含梭状芽孢杆菌的肠道菌群失调与BA合成/排泄增加有很强的相关性。富含梭状芽孢杆菌的粪便微生物群移植或梭状芽孢杆菌的定植显著促进了小鼠受体BA的合成和排泄。机制实验表明,梭状芽孢杆菌衍生的BAs可减弱肠道BA反馈抑制。研究人员认为,准确描述肠道微生物区系及其代谢物,结合肠道微生物区系的结构和功能特征,将提高现有IBS基于症状的治疗的精确度。

谷禾健康 原创
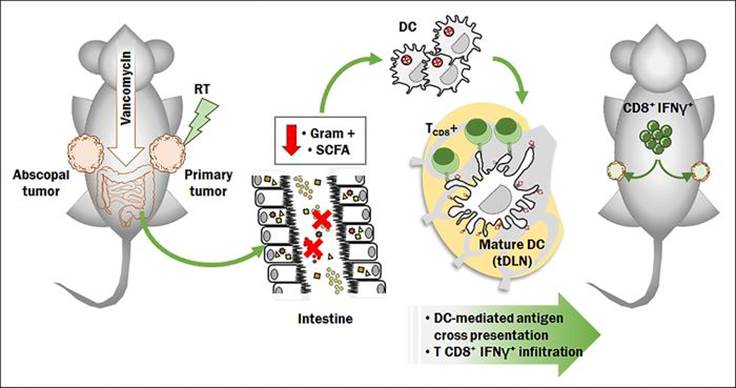
由于肠道菌群会影响T细胞和其他免疫细胞亚群的功能,无论是在肠道相关的淋巴样组织(GALT)内还是在肠道菌群之外,微生物群衍生的信号已被证明在多种疾病的调节及其调控中具有广泛的作用。近日,来自《The Journal of Clinical Investigation》一篇研究结果:“Gut microbiota modulate dendritic cell antigen presentation and radiotherapy-induced antitumor immune response”(肠道微生物群调节树突状细胞抗原递呈及放射治疗诱导的抗肿瘤免疫反应)指出肠道微生物群可以被调节用于改善放疗介导的抗肿瘤反应。并提示了一种新的机制,即消除产生短链脂肪酸的细菌有助于提高万古霉素和放疗介导的抗肿瘤疗效,这同时伴随肿瘤微环境的重塑以及肿瘤中抗原提呈和细胞毒性T细胞浸润的增加。

OVA:全称Ovalbumin,是一个蛋白。这个蛋白作为一个免疫学模型蛋白研究的比较清楚。尤其是小鼠的MHC I and II 展示这个蛋白的哪段多肽,都研究清楚了。比如最常用的C57B6小鼠,MHC-I展示OVA-257-264, MHC-II展示OVA-323-339.
OT-1 和OT-2是两种T细胞受体-TCR转基因鼠(都是B6)
肠道微生物群的改变会影响包括癌症在内的几种疾病的病理生理学。放疗(RT)是一种公认的根治性和姑息性癌症治疗方法,具有很强的免疫调节作用,还有诱导肿瘤相关抗原(TAA)与抗肿瘤CD8+T细胞的交叉诱导及抑癌作用。在这篇文章中,研究人员描述了肠道菌群组成对低分割放疗的影响,发现万古霉素治疗对荷瘤小鼠在放疗中引起的抗肿瘤作用有积极影响,并证明改变肠道菌群可以提高放疗效果。值得注意的是,万古霉素被耗尽的肠道细菌产生的代谢物丁酸盐消除了万古霉素的作用。研究结果表明,革兰氏阳性肠道细菌群落的改变可以引起肿瘤微环境重塑,介导引流淋巴结抗原呈递增加,并提高放疗的抗肿瘤作用。由于万古霉素是一种应用广泛且相对安全的临床药物,这些发现提高了利用这种抗生素在增强癌症患者放疗效果的可能性。
低分割、高剂量放疗可产生免疫原性细胞死亡(ICD),并通过肿瘤相关抗原(TAA)交叉激活诱导适应性抗肿瘤免疫。肿瘤细胞屈服于ICD刺激抗原呈递细胞(APCs),如树突状细胞(DCs),有效地吞噬肿瘤抗原,并将它们交叉呈递给CD8+细胞毒性T淋巴细胞。这一过程最终会产生一种特异性免疫反应,能够影响远距离未受辐射的肿瘤,被称为“abscopal effect”。 RT与免疫疗法的结合最近引起了相当大的临床兴趣,因为它有可能将RT从一种用于治疗局部疾病的方式转变为一种用于治疗全身恶性肿瘤的方式。然而免疫疗法与其他方法的结合只对一小部分患者有疗效,这提出了一个问题,即是否还没有发现RT介导的抗肿瘤免疫反应的重要调节因子此外,肠道微生物群衍生的信号已被证明在调节几种疾病及其治疗中具有广泛的作用,包括癌症及其对化疗的反应。研究人员最近证明了肠道微生物群影响过继细胞疗法(ACT)的抗肿瘤效果。在这篇文章中,研究人员选择万古霉素(一种主要作用于革兰氏阳性菌的糖肽类抗生素)作为特异性干扰肠道菌群的药剂,因为口服万古霉素后吸收非常差,不会进入体循环。
1.实验小鼠准备
6~8周龄C57BL/6雌性小鼠、6~8周龄 Ifng-KO雌性小鼠、OT1小鼠。均为购买。为了确保更换笼子时野生型和Ifng-KO小鼠之间的微生物群同质性,将来自所有使用过的笼子的鼠粪混合添加到干净的未使用的笼子中,以使动物的细菌菌群正常化。6~8周龄C57BL/6雌性小鼠在100μL PBS中双腿皮下注射1×105 TC-1或B16-OVA细胞用于建立B16-OVA黑色素瘤模型和TC-1肺癌/宫颈癌模型。未受辐射的肿瘤(abscopal)在原发肿瘤后3天注射。当肿瘤约为50mm (10-11天)时,使用XRAD320iX辐照器对每只小鼠上的一个肿瘤进行21 Gy单次剂量的RT,同时采取预防措施,通过屏蔽非辐射区域来避免辐射到肠道的任何区域。在对肿瘤进行辐射的前一天,小鼠开始接受含有万古霉素0.5g/L的饮用水。在含丁酸盐的实验中,加入丁酸盐5g/L与饮用水中,并与万古霉素联合使用。在体内CD8耗尽实验中,小鼠接受每周一次(共3个剂量)的抗小鼠单克隆CD8阻断抗体或大鼠IgG2b同型对照的腹腔注射治疗。实验中每组使用5-10只小鼠。
2.所需细胞的细胞培养及分离纯化
TC-1细胞在37°C的5%二氧化碳中增殖;B16-OVA细胞在添加了10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的DMEM中生长;树突状细胞培养,取小鼠股骨骨髓细胞,接种于6孔板中,与10 ng/mL的粒细胞-巨噬细胞集落刺激因子(GM-CSF)和白细胞介素-4(IL-4)共同孵育7d。肿瘤用600U/mL的IV型胶原酶消化,再重悬于HBSS中。从肿瘤和淋巴结中分离出的树突状细胞用CD11c MicroBead UltraPure磁珠分离。瘤引流淋巴结用胶原酶D消化再重悬于HBSS中。OT1小鼠脾细胞中的T细胞使用Pan T Cell Isolation Kit II试剂盒分离。
3.细胞定量分析及基因表达分析
使用流式细胞仪从分离的纯化CD3+T细胞中进行细胞内染色以检测T细胞极化。并用以下针对小鼠标记的单克隆抗体来对T细胞进行表型:抗CD45、抗CD3、抗CD25、抗CD4、抗CD8。酶联免疫法检测IFN-γ水平。qPCR对所选基因的表达水平进行相对定量。利用光电二极管阵列探测器和自Waters Acquity uPLC System对粪便样本中短链脂肪酸进行了定量。用液相色谱高分辨质谱分析瘤引流淋巴结和肿瘤样品中的短链脂肪酸。酶联免疫斑点实验用于测定分泌特异性抗体或细胞因子的单个细胞对特异性抗原的应答能力,及产生应答的细胞数量。从处理过的小鼠中分离出B16-OVA肿瘤,并将这些细胞与从OVA转基因OT1小鼠中纯化的OT1OVA特异性CD8+T细胞共同孵育,用酶联免疫斑点实验检测产生IFN-γ的细胞。
4. 16S rRNA测序
收集小鼠粪便样本并在-80°C下冷冻,提取DNA,针对16S基因的V4-V6区进行PCR扩增。Roche 454GS FLX仪器测序。使用QIIME管线版本1.8使用默认参数处理DNA序列数据。去除了具有2个以上不明确碱基调用的低质量序列读取或长度小于200bp的序列。使用UCLUST选择可操作的分类单元,并使用QIIME中的默认一致分配方法生成分类分配。代表序列与PyNAST比对,并用于与FastTree构建系统发育树。使用QIIME计算每对样品之间的UniFrac距离。使用非参数统计检验(Mann-Whitney,Kruskal-Wallis)比较类群的相对丰度和组内UniFrac距离。
5.统计
双尾学生t检验用于比较指定的数据集。双因素方差分析比较肿瘤进展。对数转化后的双侧t检验比较细菌分类群的相对丰度。置换多变量方差分析(PERMANOVA)评估组间样本差异性。Kaplan-Meier估计器分析随时间变化的生存率。P值小于0.05被认为是显著的。对错误发现率的校正用于对多次比较进行校正。
1. 口服万古霉素治疗可以增强临床前的黑色素瘤和肺/宫颈肿瘤模型中低分割放疗的抗肿瘤作用。
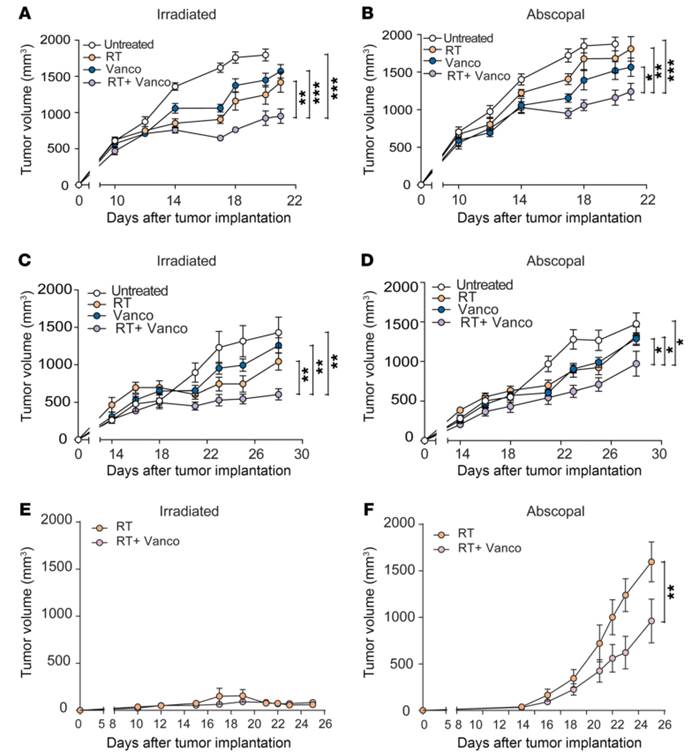

对照(Untreated)、单独万古霉素治疗(Vanco)、单独放疗(RT)、联合治疗(RT+Vanco)
A)和C) 分别来自B16-OVA黑色素瘤模型和TC-1肺癌/宫颈癌模型的受辐射的原发肿瘤(primary tumor)。
B)和D)分别来自TC-1肺癌/宫颈癌模型的未受辐射远端肿瘤(abscopal tumor)
E)和F)分别来自B16-OVA黑色素瘤模型的受辐射原发肿瘤和未受辐射远端肿瘤。发现加入万古霉素和RT作为联合治疗产生的抗肿瘤作用都大于单独使用万古霉素或单独使用RT介导的抗肿瘤作用。对照和单独放疗的队列相比,肿瘤也出现了生长延迟。在图E中无论是否使用万古霉素治疗,RT都控制了原发肿瘤的生长。在图F中,与单独使用放疗相比,在使用万古霉素和RT治疗后远端肿瘤生长显著降低。
2.万古霉素治疗增加了因放疗产生的肿瘤细胞溶解CD8+T细胞的数量。在CD8耗尽的小鼠中,万古霉素的作用被消除。万古霉素通过一种需要细胞溶解CD8+T细胞群的机制来增强放疗介导的全身抗肿瘤效应。
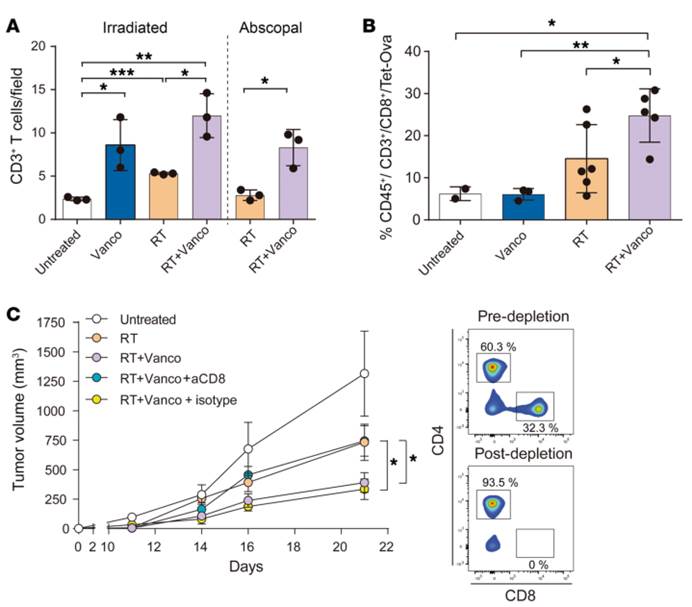

A). 来自B16-OVA黑色素瘤模型的原发肿瘤以及远端肿瘤的各组的CD3+细胞浸润的免疫组织化学定量。在免疫组化分析中发现有可测量的CD3+T细胞浸润,联合治疗后CD3+T细胞浸润明显高于单纯放疗(P<0.05)
B).来自各组原发肿瘤的OVA特异性CD8+T细胞的百分比。联合治疗的小鼠肿瘤中OVA特异性CD8+T细胞(即CD45+/CD3+/CD8+/TETOVA细胞的百分比)明显高于对照组、单独万古霉素治疗组和单纯放疗组的肿瘤(双因素方差分别为P=0.0117,P=0.0028,P=0.0472)
C).CD8耗尽小鼠的肿瘤生长率。在联合治疗前耗尽小鼠内的CD8+细胞影响了联合治疗本该有的抗肿瘤作用,这表示CD8+T细胞群是介导观察到的抗肿瘤作用所必需的细胞(P=0.0120)。
3.联合治疗的抗肿瘤作用是依赖于IFN-γ水平的。万古霉素重塑了肿瘤微环境,增加了肿瘤浸润的OVA特异性CD8+T细胞的功能,而IFN-γ是增强放疗诱导的抗肿瘤免疫效应所必需的组分。
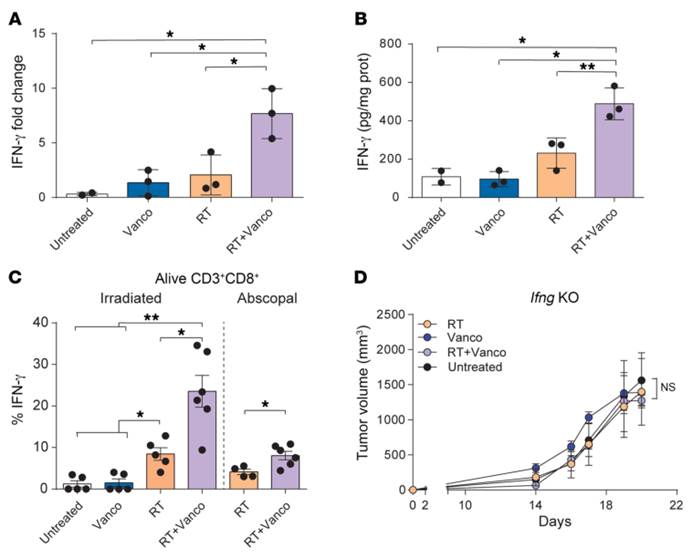
A).放疗后5天B16-OVA黑色素瘤模型中原发肿瘤的Ifng mRNA表达水平。与单独放疗组或单独万古霉素治疗组相比,联合治疗组的Ifng mRNA表达水平显著增加(P=0.0131、 P=0.0293)。
B). 放疗后5天肿瘤裂解物中 IFN-γ 蛋白表达水平的酶联免疫分析。联合治疗组的IFN-γ蛋白表达水平相比其他治疗组显著增加(P=0.0028、P=0.0179)。
C).经过一夜的Kb-OVA肽刺激后,CD8+T细胞内 IFN-γ 的表达。联合治疗小组内的CD8+T细胞的IFN-γ数量明显高于单独治疗的任何一种治疗(两两比较P<0.0 5)。
D).联合治疗对Ifng基因敲除小鼠(Ifng-KO)的抗肿瘤作用消失。(与放疗组和单独万古霉素治疗组相比,分别为P=0.5601、P=0.0911)
4. 万古霉素治疗增加了肿瘤局部TAA(肿瘤相关抗原)交叉呈递,促进了抗原特异性T细胞对肿瘤的识别
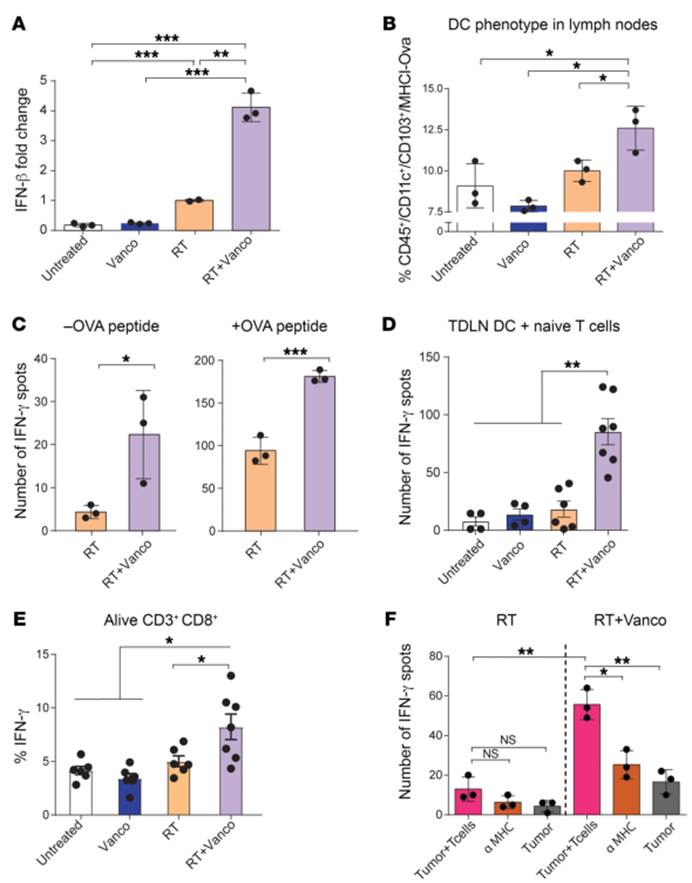

A).辐射后第一天,小鼠TDLNs(瘤引流淋巴结)中Ifnb1 mRNA表达水平。与单独放疗相比,万古霉素治疗在TDLNs中协同增强了Ifnb1基因的表达。(P=0.0032)
B).放疗后第5天,肿瘤浸润细胞CD11c+ CD103+ DCs的抗mhc1 (Kb)-SL8 OVA肽染色。联合治疗组的DCs细胞与单独放疗组相比显著增加(P=0.0396)
C). 用TDLN单细胞悬液和OT1 T细胞(1:5 TDLN细胞/ T细胞)在没有OVA肽(-OVA)或存在OVA肽(+OVA)的情况下进行IFN-γ的酶联免疫斑点试验。放疗处理5天后收集细胞。来自联合治疗的小鼠的TDLNs的IFN-γ产生细胞的数量与只使用放疗的小鼠的TDLNs相比显著增加(分别为P=0.0398和P=0.0010)
D). 将来自各治疗组的TDLN中纯化的CD11c+DCs细胞在IFN-γ 酶联免疫斑点试验(1:10DCs/T细胞)中与幼稚的OT1 T细胞共培养过夜。联合治疗增强了CD11c+DCs细胞的局部抗原提呈功能
E).与每种治疗方法处理的小鼠DCs细胞共培养过夜的OT1细胞表达IFN-γ的百分比。从联合治疗组中分离纯化的CD11c+细胞能特异性的增加未诱导的(Naive)OT1细胞中CD8+T细胞产生IFN-γ的能力。
F). 将单独放疗或联合治疗的B16-OVA模型下的小鼠肿瘤分离并与OT1细胞在IFN-γ酶联免疫斑点试验平板上共培养24小时。与RT组相比,联合治疗可增加IFN-γ的分泌(P=0.0016)。MHC1阻断抗体显著减少了产生IFN-γ的细胞,表明MHC1依赖于CD8+T细胞的激活(P=0.0073)
5. 肠道细菌产生的短链脂肪酸在体外削弱了抗原提呈细胞活性,干扰了交叉启动的活性,在体内消除在放疗中万古霉素增强的抗肿瘤作用。
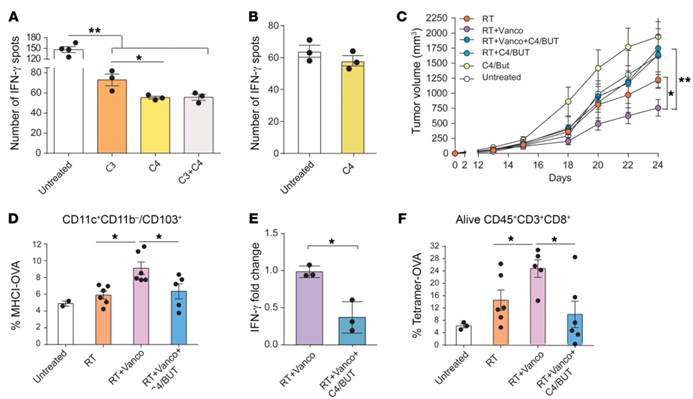

A).骨髓来源的树突状细胞对照(Untreated),用100μM丁酸盐处理(C4),或用100μM丙酸和OVA(100μg/mL)处理24h(C3),然后与OT 1小鼠的T细胞一起接种于酶免疫斑点试验平板上。与对照组相比,经C4或C3处理的骨髓树突状细胞分泌IFN-γ减少,这表明C4有单独抑制树突状细胞的抗原提呈细胞功能,只经C3处理的树突状细胞也表现出对抗原提呈细胞功能的部分抑制,但与C4共同处理时不能增强C4单独诱导的抑制(P=0.0134)
B).纯化的T细胞在IFN-γ酶免疫斑点试验平板中,在有或无100μM 丁酸盐的情况下,用aCD3/aCD28刺激纯化的T细胞。在刺激过程中,C4的存在对T细胞产生IFN-γ没有明显影响。
C)含万古霉素的饮用水中加或不加丁酸盐(C4)对辐射小鼠体内肿瘤生长的影响。万古霉素增强了放疗的抑瘤作用(P=0.0307),但C4的加入消除了这一作用(P=ns)
D) 对小鼠淋巴结中OVA呈递的树突状细胞进行计数,发现用经C4处理的小鼠这一数量显着减少
E)采用qPCR检测辐射小鼠体内 肿瘤中mRNA的Ifng的表达水平。经C4处理的治疗组。万古霉素对Ifng水平的影响降低。
F).肿瘤内抗原特异性T细胞的百分比。经C4处理的联合治疗组降低了肿瘤内抗原特异性T细胞的百分比。
6. 万古霉素处理改变了短链脂肪酸浓度和细菌群落组成。万古霉素治疗优先针对革兰氏阳性细菌群体,包括丁酸盐产生菌,并降低粪便和组织样本中的短链脂肪酸浓度。
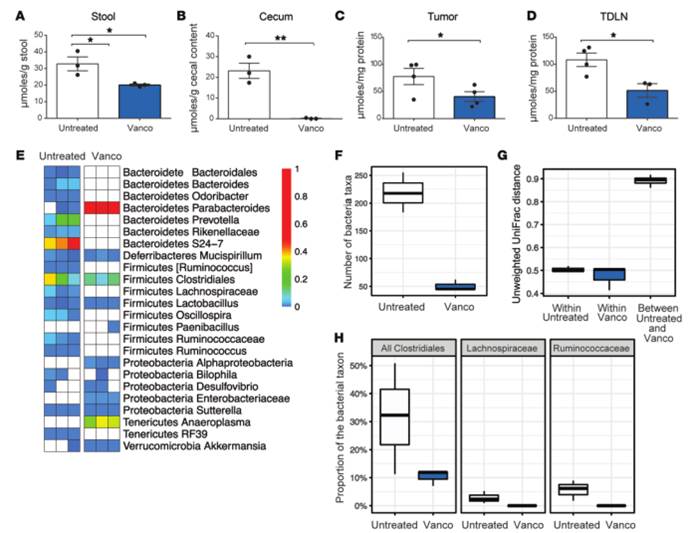

A)B)C)D).粪便、盲肠内容物、肿瘤、瘤引流淋巴结中C4短链脂肪酸浓度。万古霉素显著降低了C4短链脂肪酸浓度。
E).细菌分类群丰度热图。白色方块表示样本中没有观察到的分类群。万古霉素处理引起了细菌群落组成的重大变化,包括大多数革兰氏阳性分类群的消失,并对革兰氏阴性分类群产生了一些影响。
F).细菌群落多样性。万古霉素治疗组中发现的细菌分类群数量比对照组减少了4倍(P=0.01)
G).未加权UniFrac距离的细菌群落差异。万古霉素处理后细菌群落的组成发生了一致的变化,对照组和万古霉素治疗组内样本距离显著低于组间距离(P<0.001)。
H). 已知含有产生丁酸的细菌种类的分类群的相对丰度万古霉素治疗消除了产生短链脂肪酸的梭状芽孢杆菌2个主要科:瘤胃球菌科和毛螺菌科(两个科均P<0.01)
这些数据表明肠道微生物群可以被调节用于改善放疗介导的抗肿瘤反应。并提示了一种新的机制,即消除产生短链脂肪酸的细菌有助于提高万古霉素和放疗介导的抗肿瘤疗效,这同时伴随肿瘤微环境的重塑以及肿瘤中抗原提呈和细胞毒性T细胞浸润的增加。总之,去除对万古霉素敏感的细菌可以增强RT的抗肿瘤活性,这具有重要的临床意义。基于这些发现,研究人员建议以患者特有的方式使用肠道调节,以便将RT的局部抗肿瘤效应转化为可靶向转移性疾病的全身反应。


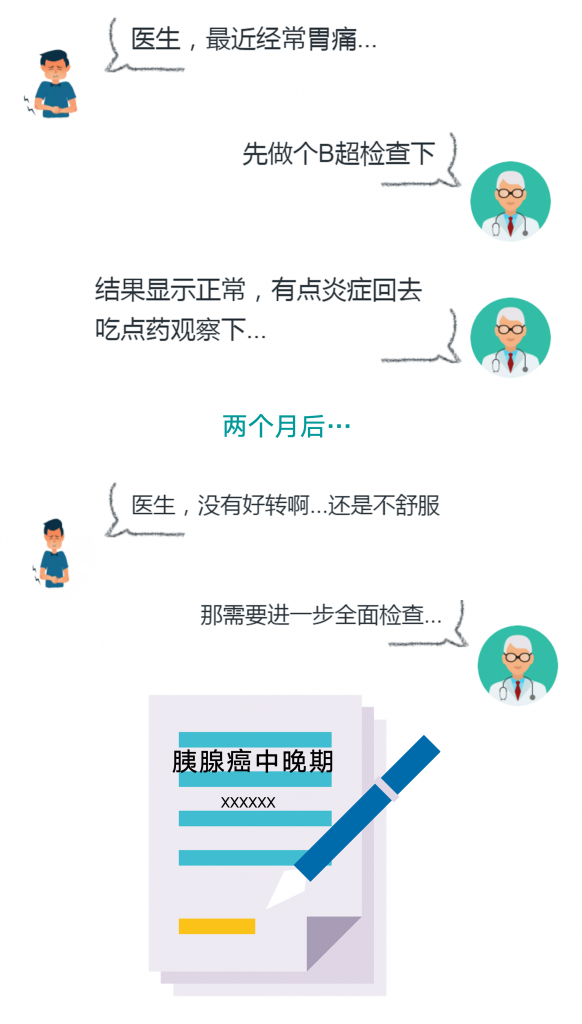
这样令人惋惜的事在医院悄然发生着…
胰腺癌早期症状不明显
易被误诊为胃病等其他疾病
5年存活率不足5%
因此,胰腺癌又被成为“癌中之王”
更好地了解胰腺癌的发生和发展对早期诊断和治疗是非常重要的。
随着现代医学的不断发展,对胰腺癌的研究也有了许多新的方向。近年来的研究表明,胰腺癌的发展可能与微生物群密切相连。
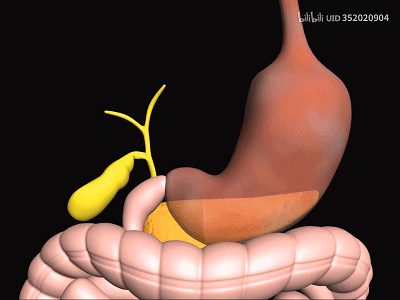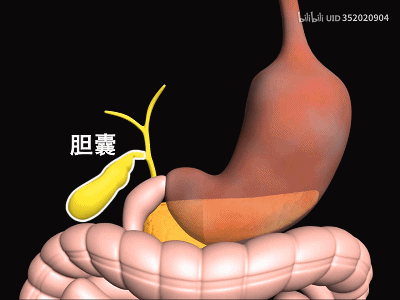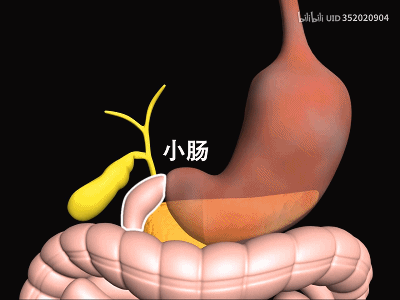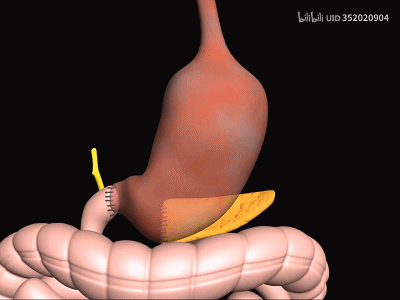

从生理结构上来说,由于胰腺通过胰管与胃肠道进行解剖连接,并通过胆总管与肝脏沟通,胰腺与胃肠道有着密切的关系,这种关系导致了这样一个问题:
肠道微生物,甚至是一种固有的胰腺微生物,是否会向这个器官传递类似的稳态特性,就像它对肠道的影响一样?
正常生理状态的胰腺中也有微生物群
是的,目前对微生物群的研究已经延伸到了胰腺。在正常非病理状态下,已在胰腺中观察到了微生物群的存在。
表1 涉及胰腺疾病的主要微生物组研究综述
Thomas R M, Jobin C., Nature Reviews Gastroenterology & Hepatology, 2019

这些研究通过使用DNA提取试剂盒对照,空白对照,原位检测或细菌培养被严格执行,以解决污染问题。
胰腺微生物群的存在已被证明发生在各种正常和疾病状态下。细菌进入胰腺的途径仍有争议,但有几种机制,如口服途径(1)通过门静脉循环(2)或肠系膜淋巴结(3)从下消化道转位进入胰腺,这些都得到了文献的支持和说明。
图1 胰腺细菌移位和宿主稳态反应的模型
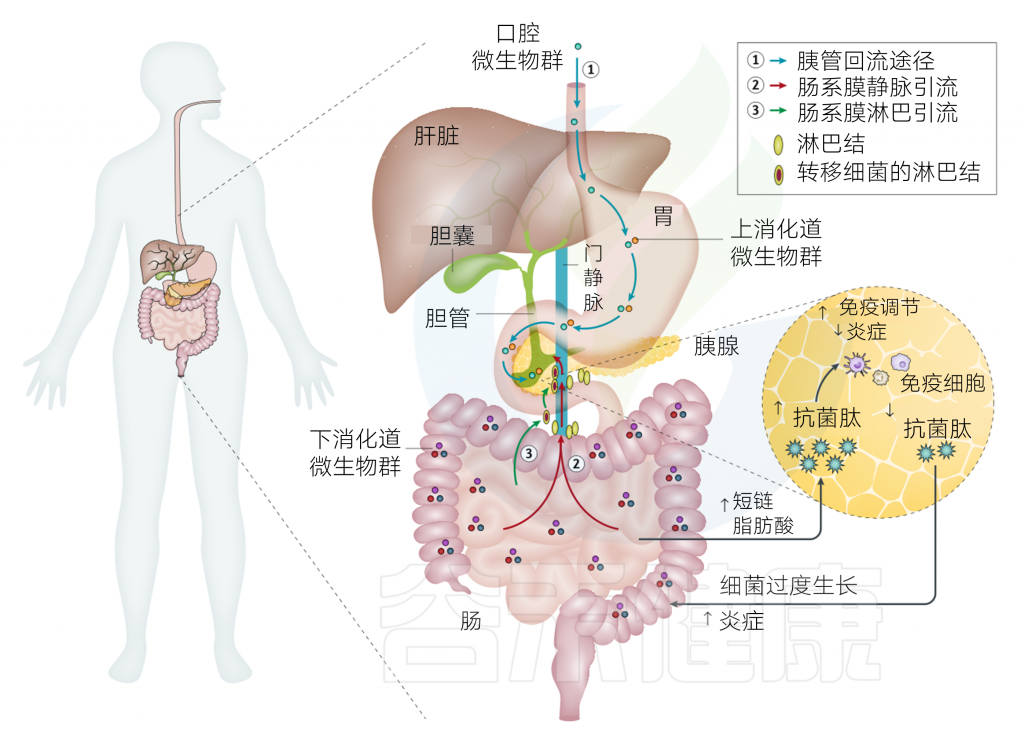

Thomas R M, Jobin C., Nature Reviews Gastroenterology & Hepatology, 2019
胰腺抗菌肽(AMPs)是参与胃肠道抗菌天然免疫的分泌成分,主要由肠道paneth细胞(肠腺的嗜酸性细胞)直接分泌到肠腔体内。它可以与胃肠道进行稳态双向通讯。
这种双向通讯,使胰腺抗菌肽受到肠道微生物的影响,调节胰腺内的免疫细胞,并通过胰液向胃肠道分泌抗菌肽,进而改变肠道微生物群和肠道免疫系统。
例如,胰腺β-细胞产生天冬氨酸相关抗菌肽的过程被证明是由肠道微生物群产生的短链脂肪酸所控制的。这种天冬氨酸相关抗菌肽的产生,作为回报,导致胰腺内巨噬细胞从炎症型转变为调节型,这是通过减少巨噬细胞肿瘤坏死因子的产生和增加转化生长因子-β的产生来实现的。
此外,天冬氨酸相关抗菌肽的产生还会诱导传统的树突状细胞以及胰腺内的调节性t细胞,从而创造一个免疫调节环境。
在一组单独的研究中,阐明了抗菌肽对肠道微生物群落和肠道先天免疫的影响。在C57BL/6小鼠中,ORAI1基因的缺失 (一种钙离子存储通道) 在胰腺腺泡细胞分泌的过程中参与细胞膜孔的形成,导致动物意外死亡,这是继发于细菌过度生长。这种细菌过度生长使胃肠道微生物群转变为促炎症表型,这是继发于抗菌肽 (天冬氨酸相关抗菌肽) 分泌下降。
AMPs是否调节胰腺微生物群尚不清楚,但最终可能通过AMP产生的信号影响免疫稳态。
以上我们可以看到胰腺本身不是无菌的,有其自身的微生物环境,这可能会影响胰腺炎甚至胰腺癌的发生和发展。
急性胰腺炎至少由以下两种标准诊断:腹痛、血清淀粉酶和/或脂肪酶3倍于实验室正常的上限,最常见的诊断方式是静脉造影的计算机断层扫描(CT)。
在急性过程中的成像发现被细分为间质性水肿性胰腺炎,其特征在于局部脂肪炎症,但增强了胰腺对对比成像和坏死性胰腺炎的特征,其特征在于胰腺对造影成像缺乏增强,这意味着该区域内器官的死亡。
慢性胰腺炎是一种长期或反复的炎症过程,同时伴有急性发作的后遗症。

微生物感染常导致炎症。在胰腺坏死中,约30%的病例,虽然最初是无菌的,但会被感染,这引发了一场关于在急性胰腺炎中使用预防性抗生素的争论。在这种情况下,研究发现,培养阳性的主要是葡萄球菌、肠球菌、大肠杆菌和坏死胰腺组织中的克雷伯菌。
这种细菌可能起源于下胃肠道,因为在这个器官中发现了大量的细菌,但在身体的其他地方却没有。虽然细菌可能不是胰腺炎的诱因,但炎症环境可能会使这些微生物进入胰腺,使局部和全身炎症状况恶化,这与临床败血症起源于肠道的理论是一致的。
胰腺炎本身可以增加肠道通透性,可能是通过降低claudin 4 的表达来改变肠紧密连接。理论上,这一过程可以使额外的全身和胰腺细菌易位,导致持续的炎症状态。
一项研究评估了45名急性胰腺炎患者的粪便微生物群,并与44名健康志愿者进行了比较(基于 16S rRNA测序)。研究人员发现了健康人粪便样本比急性胰腺炎患者α-多样性更大(这是对给定样本中不同物种数量和分布的一种测量)。此外,急性胰腺炎患者有更多的拟杆菌门和变形菌门,部分厚壁菌和放线菌比健康对照者多。拟杆菌和变形菌的优势是否导致胰腺炎的坏死过程尚不清楚。比较有意思的是能根据患者的粪便菌群来预测哪些急性胰腺炎患者将随后发展为慢性胰腺炎及其相关并发症。
在Hamada及其同事的一项研究中,他们证明了慢性胰腺炎患者和自身免疫性胰腺炎(简称AIP)患者肠道微生物群的显著差异,这可能有助于深入了解每种情况的致病因素。
在这项研究中,涉及有限的患者队列(8名慢性胰腺炎患者和12名AIP患者),16SrRNA基因测序显示,与AIP相比,慢性胰腺炎中的卵形拟杆菌Bacteroides ovatus, Streptococcus australis, Streptococcus gordonii, Clostridium lactatifermentans 和 Clostridium lavalense 的相对丰度显著增加(p<0.05)。
炎症也是许多癌症发展的危险因素。多项队列研究表明急性胰腺炎也与胰腺癌的发展和进展有关。然而,急性胰腺炎并不是一个直接的因素,但是炎症的慢性延长导致了胰腺癌的发生和发展。接着看下胰腺癌和微生物群之间有哪些相关研究?
在前面表1 我们可以看到与胰腺炎,胰腺癌等涉及胰腺疾病的微生物群的变化,那么微生物群在胰腺癌中的具体作用是什么呢?下表列举了多项相关研究。
表2 微生物群在胰腺癌中作用的人体研究
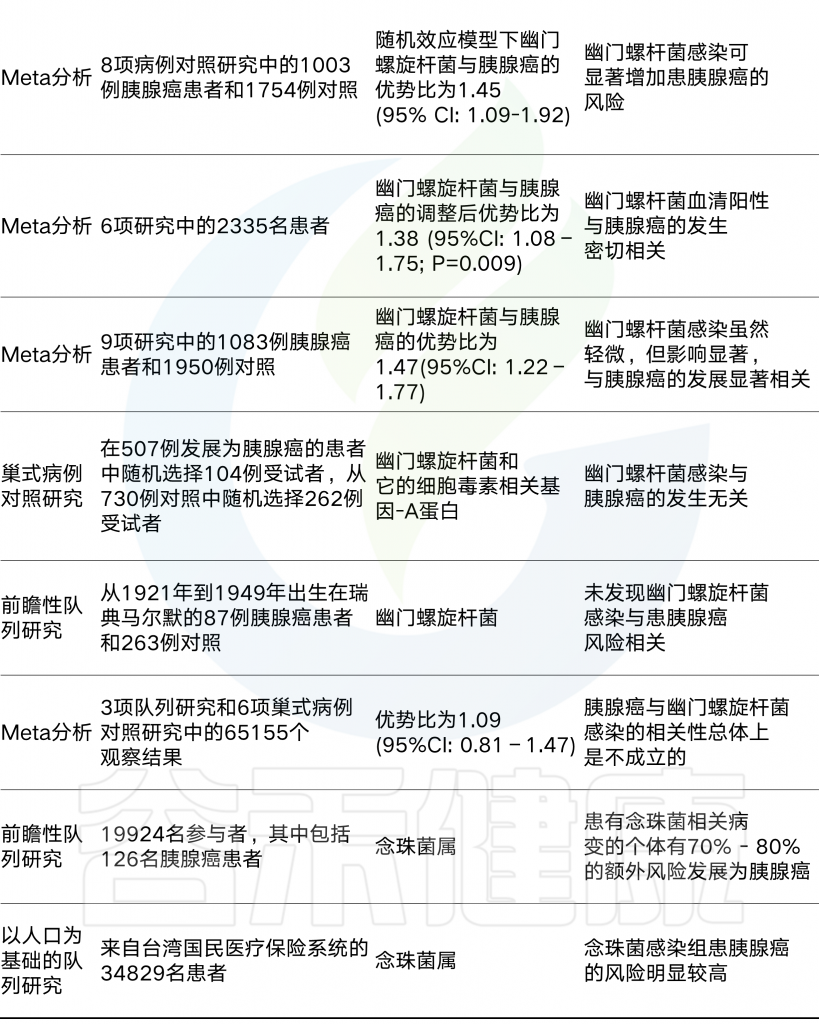



Wang Y, et al.,Molecular Cancer, 2019
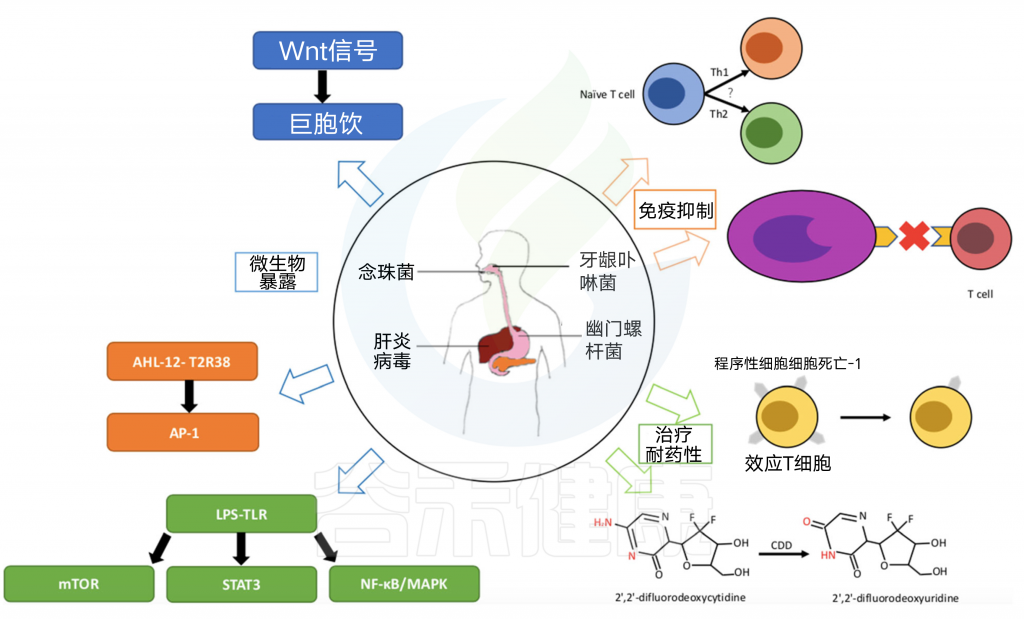
以上是目前有关微生物群在胰腺癌中作用的相关研究,微生物群变化引起的炎症和免疫抑制被认为是与胰腺癌发展相关的机制,总结如下图:
图2 微生物在胰腺癌的发展和治疗中起重要作用

Wang Y, et al.,Molecular Cancer, 2019
注:蓝色箭头表示,微生物群的暴露会激活炎症,促进胰腺癌的发展。橙色箭头显示微生物群导致免疫抑制。绿色箭头显示微生物群影响癌症治疗的效果

肿瘤的发生和发展与免疫系统密切相关,微生物对免疫系统的影响是一个非常热门的话题。
最近,Riquelme等人在短期生存、长期存活或控制供体中使用人-小鼠粪便微生物群移植实验,发现调节肿瘤微生物群落可影响肿瘤生长和肿瘤免疫渗透。
不同的研究强调了微生物群落在免疫系统中的不同作用,包括对免疫成熟和免疫抑制的影响。
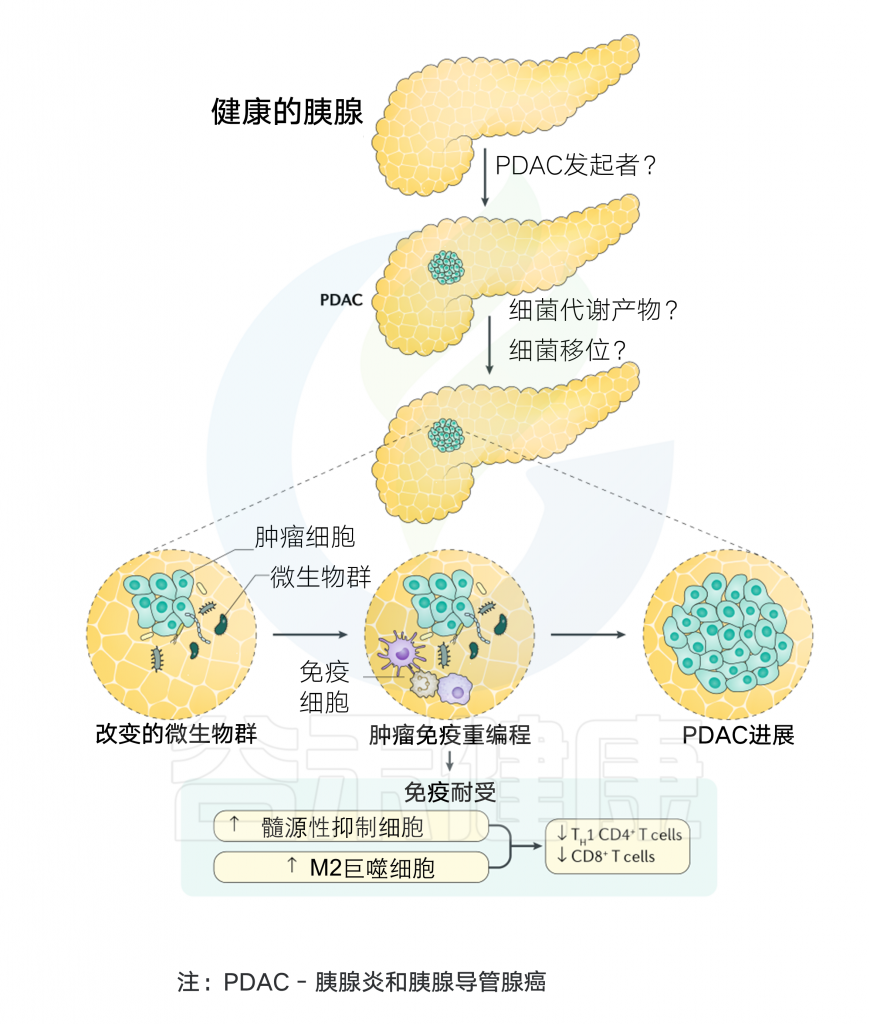
以下是来自Ryan M. Thomas 和 Christian Jobin 教授关于微生物和胰腺癌的中和评论文章中描绘的关于菌群和胰腺癌发生关系的免疫机制。
图3 菌群与胰腺癌发生的关系

Thomas R M, Jobin C., Nature Reviews Gastroenterology & Hepatology, 2019
口腔和/或肠道菌群与胰腺导管腺癌的存在有关,但对加速感染的微生物因素存在争议。尽管胰腺炎与胰腺导管腺癌(简称PDAC)的形成始发事件尚不清楚,但在小鼠模型中,来自远处(即非胰腺)的细菌参与了胰腺癌的加速发生,这也可能是由细菌代谢产物介导的。
另一种可能是,细菌可能从肠道或口腔转移到胰腺,伴有胰腺屏障功能受损,在胰腺内定植,以改变免疫耐受,促进PDAC的进展。值得注意的是,这种免疫重编程涉及增加髓源性抑制细胞浸润和巨噬细胞向M2亚型的转变。这些过程随后导致CD4+T辅助细胞1(TH1细胞)和CD8+T细胞募集减少,从而阻碍肿瘤免疫监视和随后的PDAC进展。
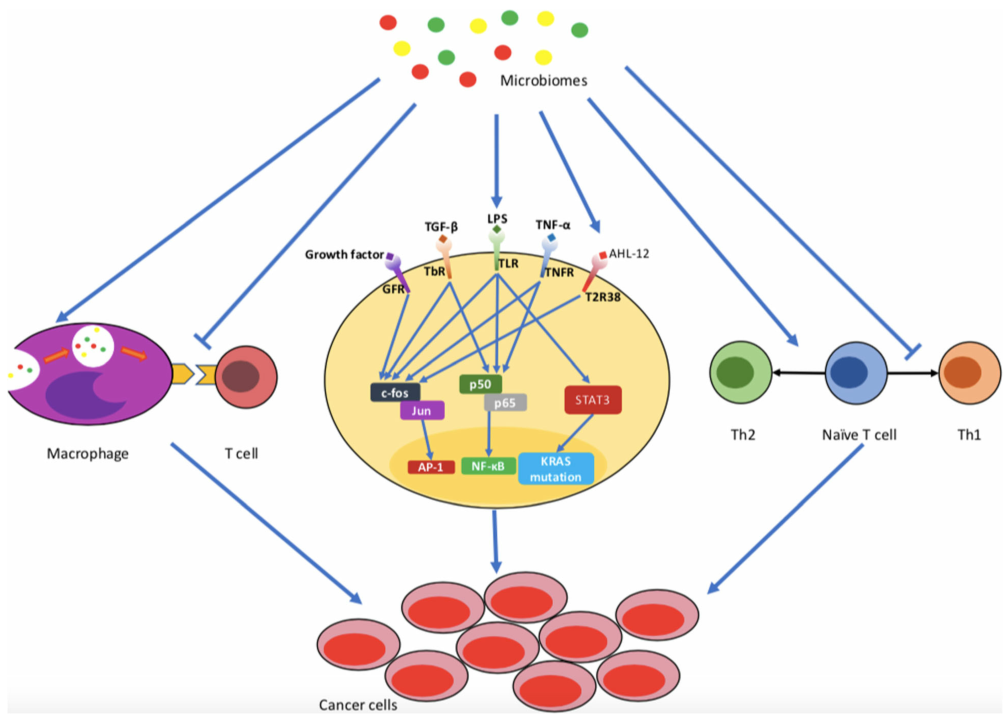
另外,赵玉沛院士团队关于胰腺癌的综述文章中也有关于微生物群和胰腺癌发生之间关系的免疫机制的描绘,见下图:
图4 微生物与胰腺癌的发生有关

Wang Y, et al.,Molecular Cancer, 2019

微生物可以导致炎症的发展,抑制巨噬细胞与T细胞的相互作用,并有利于T细胞反应的Th2极化。所有这些因素都可能导致胰腺癌的发生。
微生物引起人体代谢的变化,导致多种代谢疾病,如肥胖和糖尿病。肥胖和糖尿病也是胰腺癌发展的重要因素。Papamichael等人据报道,幽门螺杆菌是胰腺癌的潜在独立危险因素,它可能与肥胖和糖尿病有关。因此,微生物群落也通过代谢的变化影响胰腺癌的发育。
肥胖通过改变脂肪细胞因子、脂联素、脱氧胆酸和许多其他分子之间的相互作用而影响胰腺肿瘤的进展。此外,肠道微生物群也被认为在连接肥胖和胰腺癌方面发挥着重要作用。


除了微生物多样性的变化外,某些微生物代谢产物可能与肥胖的发展有关。例如,在肥胖个体中富集的短链脂肪酸 (SCFA) 可以通过G-蛋白偶联受体激活MAPK信号通路,并导致癌细胞增殖。此外,肥胖可促进脂多糖从肠道微生物中释放,从而导致内毒素血症。
Ren等人证明,胰腺癌患者具有比健康对照更多的LPS产生菌,支持内毒素血症和胰腺癌之间的潜在关系。事实上,肥胖也是一种炎症状态。如上所述,微生物可通过不同的机制来影响胰腺癌的发育和发展,NF-κB 通路是炎症和癌症的共同途径。Pagliari等人认为,肥胖与多种促炎细胞因子的释放有关,如IL-6和TNF,其激活NF-κB通路并调节下游癌症相关信号。
糖尿病也是胰腺癌的危险因素。在糖尿病患者中,厚壁菌与拟杆菌的比例相对较高,影响碳水化合物的代谢和短链脂肪酸的产生(关于菌群如何利用碳源代谢产生短链脂肪酸,前面文章有详细阐述,点击阅读)。Perry等人证实,血液中乙酸的含量增加导致胰岛素抵抗,而Devaraj等人显示,肠道中丁酸的降低促进了低水平的炎症并导致胰岛素抵抗。丁酸水平降低,肠粘膜上皮紧密连接受损,促进细菌内毒素进入血液。该机制可通过内毒素血症将糖尿病和胰腺癌联系起来。
图5 肠道微生物群与1型糖尿病发病的相互作用
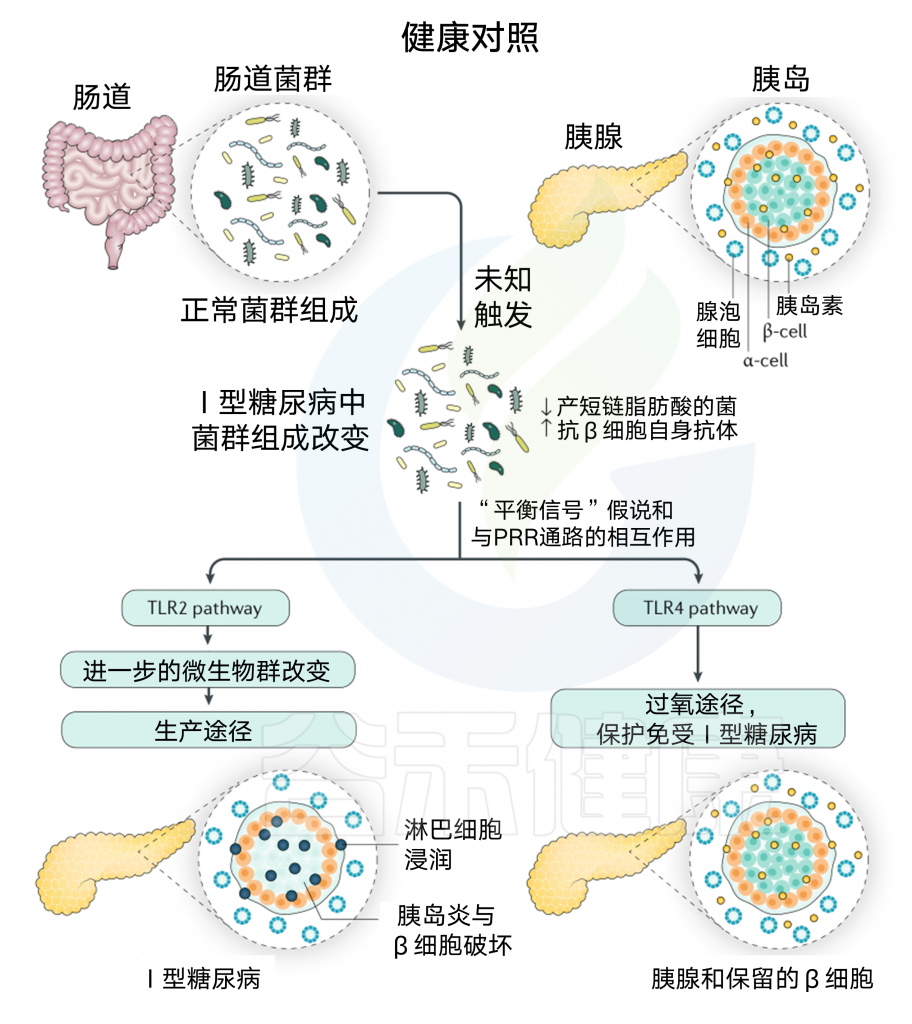

Thomas R M, Jobin C., Nature Reviews Gastroenterology & Hepatology, 2019
除了具有正常微生物群的健康肠道外,用功能性胰岛β细胞产生胰岛素来说明Langerhans的未患病的胰腺和胰岛。随着β细胞的破坏,患者不能产生足够的胰岛素来维持葡萄糖稳态,从而导致1型糖尿病(T1DM)。
在尚未确定的触发因素下,与健康对照组相比,T1DM患者的肠道微生物群中短链脂肪酸(SCFA)的相对丰度较低。SCFA减少的患者,特别是产生丁酸菌,表现出对胰腺β细胞的高水平自身抗体,,这可能导致β细胞的破坏和T1DM的发展。
微生物群还与模式识别受体(PRRs)相互作用,如Toll样受体(TLRs)2和4,通过“平衡信号”假说调节T1DM的发育,在这种假说中,疾病的发展取决于耐受信号和促炎症信号的平衡。
TLR4途径通过连接蛋白MYD88和TRIF,被认为是一种抑制T1DM发生的耐受途径。相反,通过TLR2途径的信号传导改变肠道微生物群,以促进前T1DM表型。这些机制被认为有助于淋巴细胞浸润和胰岛炎伴发β细胞破坏。
以上是微生物群与1型糖尿病发病的相互作用机制。
当然,也需要更多的实验证据来证实微生物群、糖尿病和胰腺癌之间的联系。
利用饮食干预、益生菌和/或益生菌来控制肠道微生物群也可能是影响胰腺疾病的一种方式。
图6 调节微生物群对胰腺疾病影响的临床研究领域
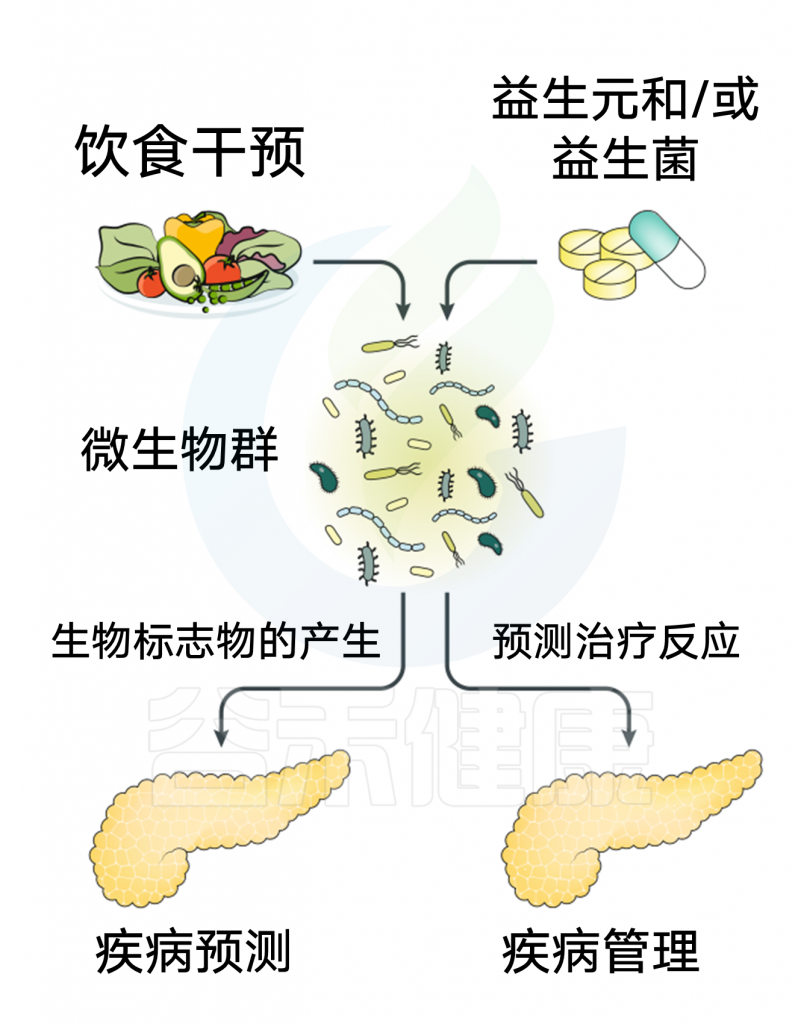

Thomas R M, Jobin C., Nature Reviews Gastroenterology & Hepatology, 2019
一项多中心、随机、双盲安慰剂对照试验,检验益生菌的预防性施用是否能够降低急性胰腺炎患者的感染性并发症,不仅显示出降低感染并发症的风险,而且与死亡风险增加2.5倍(相对风险2.53,95%CI 1.22-5.25)。
微生物群在胰腺癌中的应用提供了潜在的治疗选择,例如产生生物标记物或微生物特征来预测对新辅助治疗和辅助治疗的反应。


尽管许多研究表明口腔微生物失调与胰腺癌之间存在关联,但没有令人信服的证据表明口腔微生物失调与早期胰腺癌有因果关系还是仅仅是其作用。然而,进一步研究牙周病的细菌标志物,如牙龈卟啉杆菌和微生物多样性的变化,可能为非侵入性筛选胰腺癌的生物标志物提供了可能。近年来的研究进展表明,唾液RNA标记可以通过细菌小亚基核糖体RNA(16S rRNA)基因的高通量测序来鉴定口腔细菌。因此,唾液检测,一种口腔生物标志物的无创检测,可能成为未来筛选胰腺癌的一种方便策略。
此外,其它体液可以含有与其它癌症相关的微生物ME的诊断标记。例如,粪便可用作结肠直肠癌的生物标志物,而尿液可含有膀胱癌的生物标志物。因此,其他体液,如粪便、血液和胰液也可能为胰腺癌提供诊断标志。所有这些生物标记物都需要更多的研究来证明它们的潜在价值。
这部分主要讨论微生物群落在吉西他滨治疗、PD-1靶向治疗和抗生素治疗中的作用,目的是强调某些微生物可以作为胰腺癌的治疗靶点。
化疗仍是所有阶段胰腺癌的一线治疗,但在个体患者中治疗效果差异很大。最近的研究表明,微生物组在决定化疗的疗效和副作用方面起着重要的作用。化疗也可能通过多种机制影响微生物。
吉西他滨(2′,2′-二氟脱氧胞苷)是一种具有代表性的化疗药物,广泛应用于治疗包括胰腺癌在内的多种癌症。然而,细菌可以用胞苷脱氨酶将吉西他滨代谢成 2′,2′-二氟脱氧尿苷,一种不活跃的形式。
通过对菌群 16S rDNA 的测序,Geller等人证明,与胰腺肿瘤相关的大多数菌群是γ-变形菌,包括肠杆菌和假单胞菌种。这些微生物可能会产生胞核嘧啶核苷脱氨酶,导致吉西他滨的降解和耐药。此外,通过间接增强这些药物的脱氨作用,由支原体产生的嘧啶核苷磷酸化酶(PyNP)也对化疗药物的治疗功效产生不利影响。用PyNP去除天然嘧啶核苷尿苷、2′-脱氧尿苷和胸腺嘧啶核苷,抑制吉西他滨脱氨反应。

此外,Panos等人发现吉西他滨与大肠杆菌上清液一起孵育变得不太活跃。因此,抗生素和吉西他滨联合可能是提高胰腺癌患者化疗敏感性的新策略。
除了微生物对吉西他滨活性的影响外,药物还能扰乱微生物群。化疗对胃肠粘膜有害,在那里它可能对细胞产生直接的细胞毒性作用或产生肠道微生物的变化。
在吉西他滨治疗的小鼠中,厚壁菌和拟杆菌是肠道微生物的两个优势类群,它们被变形菌和疣微菌门所取代,导致肠道炎症,促进胰腺癌的发展。
虽然在这一领域已经取得了一些进展,但微生物-宿主-药物之间的相互作用仍未得到充分了解。生物复杂性仍然是精确治疗的巨大障碍。需要更多的研究来了解微生物组在胰腺癌化疗耐药中的作用,这有可能改善胰腺癌的不良预后。
免疫治疗对许多恶性肿瘤是有效的。免疫检查点抑制剂通过抑制T细胞抑制受体或其配体对肿瘤细胞的抑制作用而增强T细胞的应答。针对程序性死亡蛋白1(pd-1)的单克隆抗体在黑色素瘤、非小细胞肺癌和肾癌中有着广泛的应用。有趣的是,对抗-PD-1治疗的耐受性已经观察到,并且微生物在该过程中可能具有不可忽略的影响。
在非小细胞肺癌和肾细胞癌中,Routy等人报告抗生素治疗显著抑制了抗PD-1单克隆抗体的效力。他们用宏基因组学方法来探讨肠道微生物的组成,发现Akkermansia muciniphila 患者有较好的预后。他们的结果表明,T辅助细胞1和细胞毒性T淋巴细胞反应与 A. muciniphila 的存在呈正相关。
然而,Pushalkar等人则报道了抗生素在胰腺癌中的作用的相反结果。结果表明,抗生素可通过上调T细胞中Pd-1的表达,增强肿瘤内CD4和CD8细胞的抗PD-1作用。他们认为抗生素治疗可以与检查点导向的免疫治疗相结合,这可能代表了一种治疗胰腺癌患者的新策略。
总之,这些研究表明不同的微生物可以在胰腺癌肿瘤微环境中发挥不同的作用。今后的研究应集中于特定类别的微生物,以提供联合抗生素与PD-1治疗的理论基础。

如上所述,抗生素可能增加肿瘤对抗PD-1抗体和吉西他滨等药物的敏感性。然而,过量接触抗生素可能会导致菌群失调,并促进肿瘤的发生。
根据一项基于人群的嵌套病例对照研究,包括125,441例病例和490,510例匹配对照,使用青霉素与胰腺癌的风险升高有关。风险随着抗生素疗程的增加而增加,但随着时间的推移而减少。相比之下,大环内酯类、头孢菌素类、四环素类、抗病毒药物和抗真菌药物与胰腺癌风险增加无关。此外,抗生素处理的小鼠表现出抗原表达相关基因的下调和适应性免疫反应,但上调了与癌症相关的基因。
显然,在胰腺癌患者中使用抗生素是一项重大挑战。抗生素的使用是否能增强其他治疗或促进肿瘤发展可能取决于微生物的组成和比例。
研究人员对胰腺癌的认识已经逐渐深入,目前已有证据表明胰腺癌的发生、发展和治疗都与体内微生物体有关。研究胰腺肿瘤微环境中的微生物对胰腺癌的治疗也有潜在的意义。益生菌/抗生素的使用可与传统治疗如手术、放疗和化疗以及新出现的靶向疗法和免疫疗法相结合,从而产生新的治疗方案。
参 考 文 献
Thomas R M, Jobin C. Microbiota in pancreatic health and disease: the next frontier in microbiome research[J]. Nature Reviews Gastroenterology & Hepatology, 2019: 1-12.
Wang Y, Yang G, You L, et al. Role of the microbiome in occurrence, development and treatment of pancreatic cancer[J]. Molecular Cancer, 2019, 18(1): 1-13.

谷禾健康 原创
在婴儿出生的最初几天,婴儿肠道微生物群的一部分可以追溯到多种母体来源,包括阴道、皮肤、口腔和肠道微生物群。然而,在这些来源中,在母亲肠道中发现的细菌定植是长期坚持的主要驱动力。事实上,通过垂直传播的细菌(如双歧杆菌、瘤胃球菌、粪球菌)在婴儿肠道中进行接种会导致转录活性定植。婴儿肠道所经历的这种一生一次的生态转变对于塑造婴儿的生长、抵抗感染力量、校准炎症和调节免疫功能产生持久和重要的影响。但是对于婴儿肠道早期病毒定植以及垂直传播是否起作用,人们知之甚少。

近日,一项发表在Microbiome杂志上来自美国亚利桑那州立大学生命科学学院和华盛顿大学医学院儿科合作研究成果:“Discordant transmission of bacteria andviruses from mothers to babies at birth(细菌和病毒从母亲到婴儿的不一致传播),其结果表明虽然母亲和婴儿确实分享了一些肠道微生物群落,但细菌的分享程度比病毒的分享程度更大。此外,在不同的家族之间,甚至在家族内部,共享的比例和特定的分类单元也不同。最后,细菌-噬菌体的相互作用因传递途径的不同而不同。而且,主要微生物群落在婴儿出生时的代际遗传率存在差异,这可能是由于这些微生物的起源可能不同。
文章链接DOI: 10.1186 / s40168-019-0766-7
实验设计和研究方法:
该研究研究选择了28对双胞胎婴儿出生4天内的粪便样本,以及其母亲产后4天内对应的粪便样本,对肠道菌群进行16S V4区扩增测序,同时过滤出病毒后进行扩增建库测序检测病毒组构成。使用MaAslin对队列基本信息和菌群以及病毒组进行相关性统计分析。使用RanodmForest对队列分类信息进行分类预测。
病毒组测序数据经过contig组装后,进一步分析了家庭内部成员之间的病毒转移,主要是母亲和婴儿共享的病毒。此外也分析了跨界的细菌和病毒的互作,使用Pearson相关分析细菌ASV与病毒contig之间的相关。统计方法使用Mann-Whitney U test进行两独立组间统计差异检验, Kruskal-Wallis test和Dunn多重比较用于三组或多组间比较。所有p值均为双尾检验。
结果
婴儿细菌和病毒群落比不相关的婴儿更像其相关双胞胎。我们发现,婴儿细菌微生物组的63%可以追溯到母亲的肠道菌群。相比之下,他们的病毒社区中只有15%是从母亲那里获得的。分娩途径并未确定母亲与婴儿之间共有多少细菌性微生物组或病毒体。然而,细菌-噬菌体的相互作用被传递途径所改变。
1 婴儿双胞胎及其母亲的肠道细菌微生物组
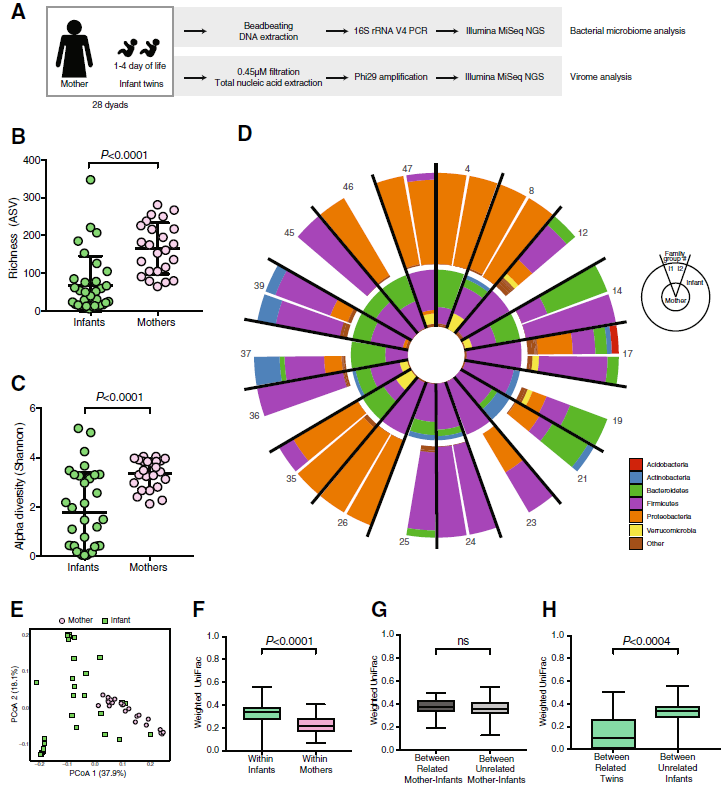

图1母亲和婴儿的细菌菌群分析
a一个研究设计的概述。
b婴儿和母亲中细菌扩增子序列变异体(ASV)的丰富性。通过Mann-Whitney检验评估统计显着性。
c母亲和婴儿中细菌ASV的α多样性。通过Mann-Whitney检验评估统计显着性。
d母亲和婴儿在门水平细菌的相对丰度;I1(婴儿双胞胎1)和I2(婴儿双胞胎2)。
e加权UniFrac距离的PCoA图。
f婴儿和母亲之间的加权UniFrac成对比较。通过Mann-Whitney检验评估统计显着性。
g相关母婴之间(n = 27对)和不相关母婴之间(n = 765对)的加权UniFrac两两比较。通过Mann-Whitney检验评估统计显着性。
h双胞胎之间(n = 11对双胞胎)和无关婴儿(n = 517对)之间的加权UniFrac成对比较。通过Mann-Whitney检验评估的统计学显着性
表明:双胞胎之间的距离与接合性没有差异(附加文件 1:图S1F),表明年龄和环境暴露是细菌群落的更重要决定因素。
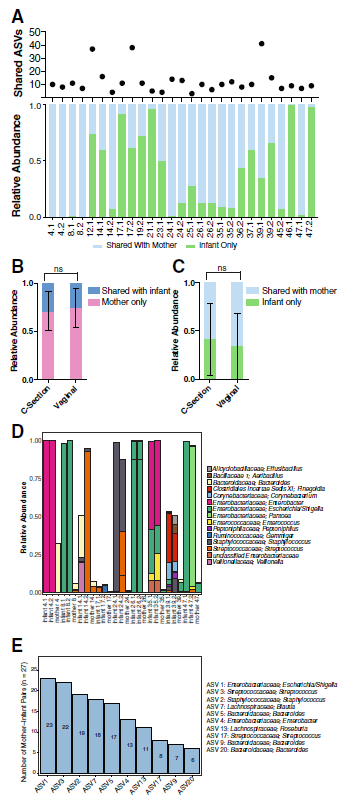

图2 细菌ASV传播分析。
a母亲和婴儿之间共享的ASV数量以及与母亲共享的婴儿细菌微生物组的相对丰度。
b通过分娩途径与婴儿共享的母体细菌微生物组的平均相对丰度。通过Mann-Whitney检验评估统计显着性。
c通过分娩途径与母亲共享的婴儿细菌微生物组的平均相对丰度。通过Mann-Whitney检验评估统计显着性。
d两对双胞胎中都存在ASV的相对丰度(> 0.05)。分类显示在属级别。
e 10个最常发送的ASV的频率图
这些数据共同表明,母亲与婴儿分享的细菌群落比例相对较小,这些共有的分类单元对婴儿的细菌微生物组做出了重大贡献,并且共享(母亲)或接受(婴儿)的数量没有变化运送路线。
2 婴儿双胞胎及其母亲的肠道病毒
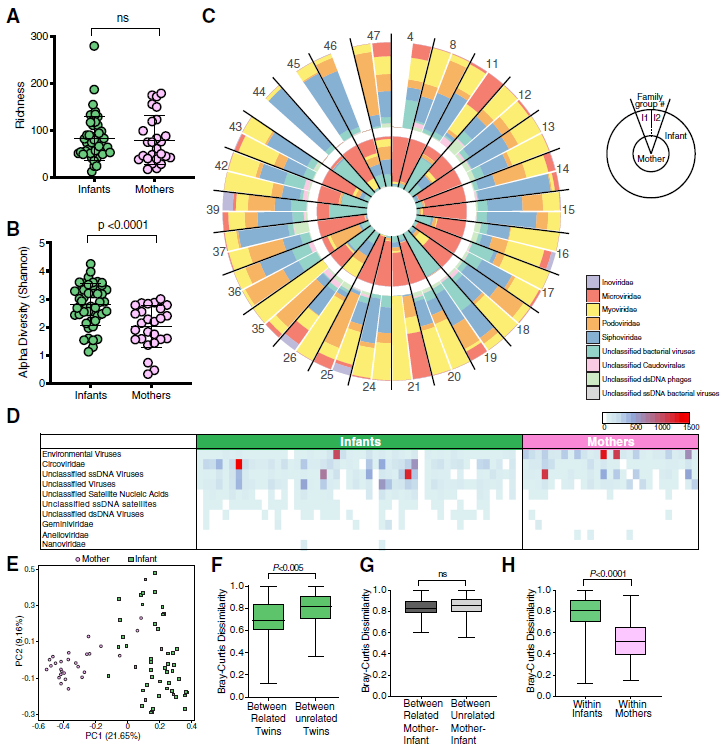

图3. 母亲和婴儿的病毒学分析。
a 一对婴儿和母亲的病毒种类丰富性。通过Mann-Whitney检验评估统计显着性。b使用香农指数的母亲和婴儿病毒物种的阿尔法多样性。通过Mann-Whitney检验评估统计显着性。
c每个家庭中母亲和相关婴儿在家庭一级的噬菌体相对丰度。I1(婴儿双胞胎1)和I2(婴儿双胞胎2)。
d真核生物家庭和婴儿和母亲未分类类别的热图。使用Bray-Curtis距离的
e PCoA图。颜色代表婴儿或母亲的样本类别。
f相关双胞胎之间和无关双胞胎之间的病毒物种的Bray-Curtis距离。通过Mann-Whitney检验评估统计显着性。
g相关母婴之间和无关母婴之间病毒种类的Bray-Curtis距离。通过Mann-Whitney检验评估统计显着性。
h婴儿和母亲体内病毒种类的Bray-Curtis距离。通过Mann-Whitney检验评估的统计学显着性
这些数据表明,年龄相关的病毒学差异很大(即标本来自成人还是婴儿),这可能会使相关母婴对之间家族关系的评估混淆。
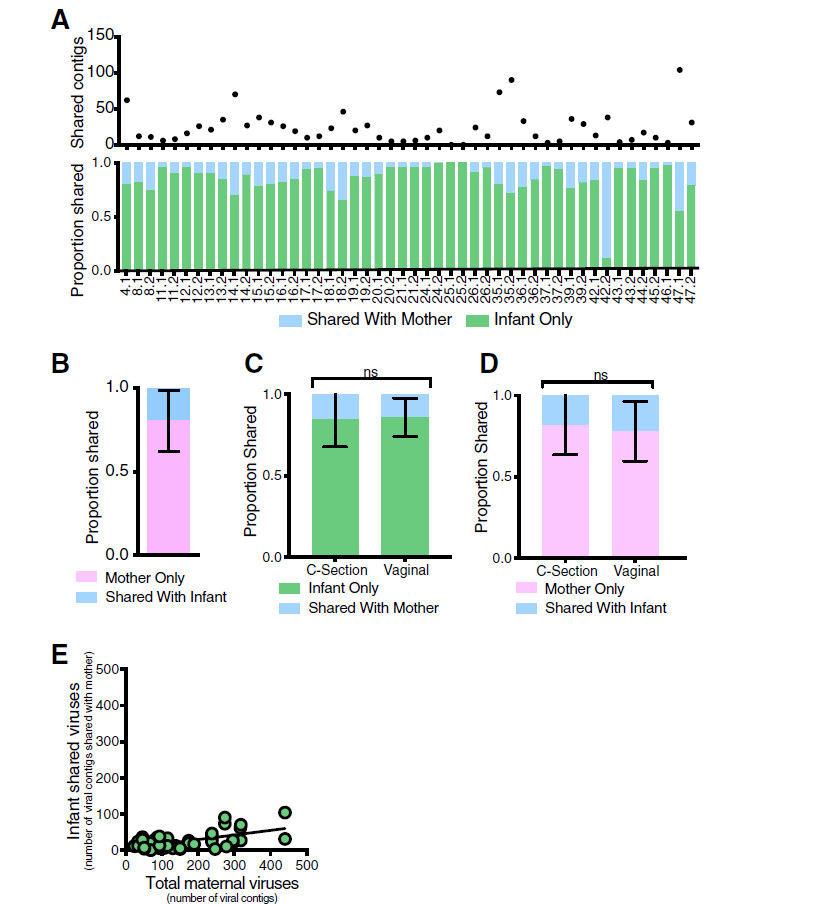

图4病毒重叠群传播分析。
a母婴共享的重叠群的数量,以及母婴共享的婴儿病毒的比例。
b与婴儿共享或仅由母亲共享的母亲病毒的平均重叠群比例。
c通过分娩途径与母亲共享的婴儿病毒的平均重叠群比例。通过Mann-Whitney检验评估统计显着性。
d按分娩途径与婴儿共享的母体病毒的平均重叠群比例。通过Mann-Whitney检验评估统计显着性。
e婴儿共享病毒重叠群数量与母体重叠群总数的关系图。线性回归线拟合数据
表明:与细菌微生物组不同,婴儿与母亲仅分享肠道病毒的有限比例(约15%)。这些结果也通过对VirSorter鉴定的噬菌体重叠群的分析进行了验证。
三 分娩途径影响细菌与噬菌体之间的跨异界相互作用
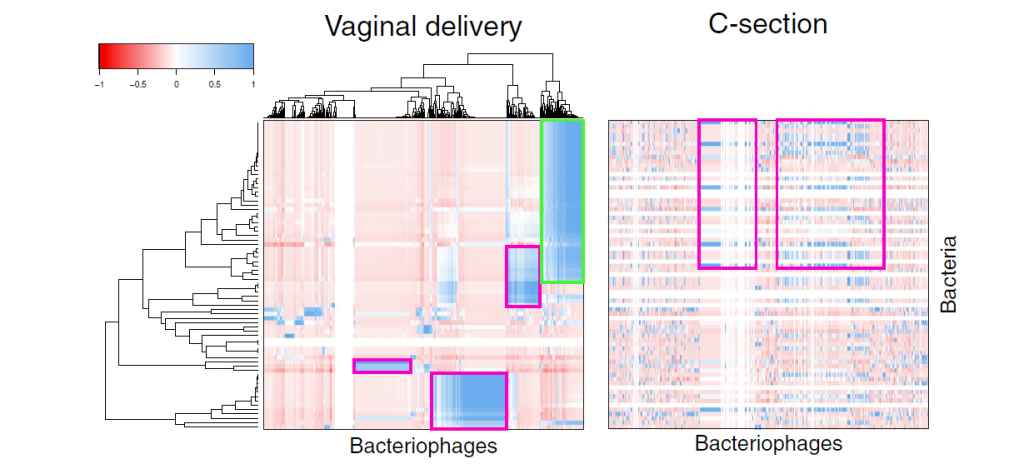

图5细菌和噬菌体之间的跨动相互作用。婴儿和母亲之间共享的细菌性ASV和病毒重叠群的相关性。热图显示了通过分层聚类对阴道分娩(左)的婴儿中的细菌ASV和噬菌体重叠群之间的Pearson相关性。剖腹产婴儿的相关性(右)按照与阴道分娩婴儿相关性相同的顺序进行聚类。用粉红色和绿色勾勒出阴道分娩的孕妇与剖腹产之间的跨性别互动差异的示例。
结论
母体肠道微生物组会显着影响婴儿肠道微生物组的获取。与病毒垂直传播相比,细菌微生物组的垂直传播要高得多。但是,母婴肠道细菌微生物组和病毒体之间的相似程度并没有因分娩途径而异。双胞胎对之间细菌微生物组和病毒体的相似性比无关双胞胎更大,这可能反映了共同的环境暴露。而且主要微生物群落代际遗传率(代际遗传,指两代人之间的遗传关系,)在婴儿出生时存在差异,也表明这些群落的起源可能不同。

尿路感染又称为泌尿系统感染,是尿路上皮对细菌侵入导致的炎症反应,通常伴随有菌尿和脓尿。尿路感染波及面广、诱因复杂以及人体各器官互为影响,让尿路感染形成反复发作、反复治疗,反复用药,最后导致菌群失调,霉菌感染,致使病情更加复杂。
近日,美国纽约威尔康奈尔医学院的一项关于大样本人群尿路感染的研究成果“Gut uropathogen abundance is a risk factor for development of bacteriuria and urinary tract infection(肠道尿路病原体丰富度是细菌尿和尿路感染发生的危险因素)”在线发表在《自然-通讯》(Nature Communications)(doi: 10.1038/s41467-019-13467-w )。
该研究证实大肠杆菌和肠球菌粪便相对丰度的增加与相应生物体未来发生菌尿的风险增加有关。大多数样本中同一受试者的尿液和粪便标本中都存在泌尿系致病基因,如FimH和抗生素耐药基因。该研究结果支持未来可以通过调节肠道微生物群作为预防尿路感染的新策略,特别是在反复尿路感染的情况下。
摘要
研究的主要重点是调查肠道微生物群与发生菌尿或尿路感染(UTI)的风险之间的关系。研究人员使用16S rRNA基因深度测序对168例肾移植受者的510个粪便样本进行肠道微生物谱分析,并对一部分粪便样本和尿液上清液样本进行宏基因组测序,评估了成对大肠杆菌尿液和粪便标本中存在的泌尿系致病基因和抗生素耐药基因。研究人员得出,1%大肠杆菌肠道中相对丰度是大肠杆菌菌尿和UTI的独立危险因素,1%肠球菌肠道中相对丰度为是肠球菌菌尿的独立风险因素。菌种分析在同一受试者的肠道和尿液中发现的物种之间建立了紧密的应变水平对齐。研究结果支持肠道微生物群-UTI轴,表明调节肠道微生物群可能是预防UTI的一种潜在的新策略。
背景
尿路感染(UTI)是世界上最常见的细菌感染之一,而大多数泌尿系统细菌感染的来源通常被推定为肠道。肾移植受者是研究UTI发病机制的独特人群,因为他们经常被诊断为菌尿(尿培养阳性,无临床症状)和UTI(尿培养阳性,有排尿困难、尿频、尿急或发热的临床症状)。尿路感染的发病机制很复杂,肠道尿路致病菌污染尿道周围空间被认为是第一步,随后是尿道和膀胱的定植。在一项对26名肾移植受者的初步研究中,我们进行了一系列肠道微生物菌群分析,我们报告了肠球菌丰度和肠球菌尿路感染之间的联系。在最近的另一项针对UTIs和非UTIs儿童的病例对照研究中, UTIs患儿大肠杆菌的相对丰度明显高于UTIs。这两项研究都评估了UTI发生时肠道菌群是否与UTIs相关,但没有评估肠道菌群是否为菌尿和UTI发生的危险因素。
实验设计
样本采集:
168例肾移植受者在移植后3个月内的510份连续粪便标本,在移植后第1周、第2周、第4周和第12周以及腹泻发作期间以及UTI发作期间收集粪便标本。常规尿培养在每次常规门诊时进行(第一个月每周两次,第二个月每周一次,第三个月每两周一次,最多每月一次至6个月)。其中102名受试者出现菌尿(≥10000集落形成单位[cfu]/mL),归为菌尿组。66名受试者在移植后的前6个月内未出现菌尿症,归为无菌尿组。
测序方法:
对510份粪便标本进行V4-V5高变区16S rRNA基因深度测序,以评估肠道微生物区系与未来细菌尿和UTI发展的关系。在一组有菌尿的受试者中,提取其尿上清液中的游离DNA,通过鸟枪式宏基因组测序评估成对粪便样本,以评估菌株相似性、泌尿致病基因和抗生素耐药基因。
统计分析:
使用双尾Wilcoxon秩和检验比较连续变量的分布;双尾Fisher精确检验比较分类变量的分布;Cox回归风险模型来估计特定有机体的相对粪便丰度是否与同一生物体的菌尿的发展相关,其中粪便相对丰度作为一个随时间变化的协变量,其中假设丰度值直到微生物丰度值第一次超过阈值时才超过;多变量Cox回归风险模型用于评估之前分析过的临床变量以及终末期肾病的原因和计算的群体反应性抗体状态。使用类似的Cox回归风险模型来估计抗生素类别是否与肠球菌或大肠杆菌的相对丰度作为时间依赖性协变量的发展有关。
主要结果
1. 评估了与菌尿相关的五个最丰富的肠道菌属相对丰度和各自菌尿组的时间动态。菌尿组中的肠道中大肠杆菌和肠球菌相对丰度显著高于无菌尿组中的。
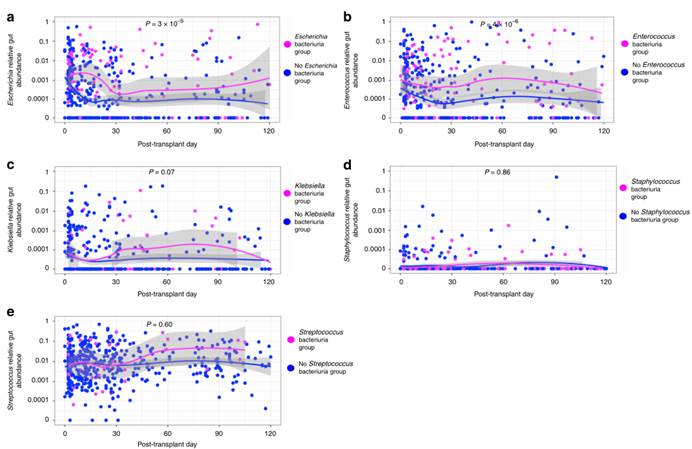

图中使用了1%相对丰度的临界值,这是LOESS曲线的上限。肠道细菌的相对丰度在y轴上(对数标度),移植后粪便标本采集的天数在x轴上。红色的点表示菌尿组,该点反映属于相应的细菌组的一个样本,蓝色的点,反映相应的无菌尿组。95%置信区间(灰色)的拟合曲线是按群体状态创建的。使用Wilcoxon秩和检验进行肠道细菌相对丰度的组间比较。a图表示大肠杆菌状况,b图表示肠球菌状况,c图表示克雷伯氏菌状况,d图表示葡萄球菌状况,e图表示链球菌状况。
2. 1%大肠杆菌肠道中相对丰度与大肠杆菌菌尿的未来发展相关(HR2.8,P=0.002)。1%肠球菌肠道中相对丰度与肠球菌菌尿的未来发展相关(HR:2.4,P=0.01)。
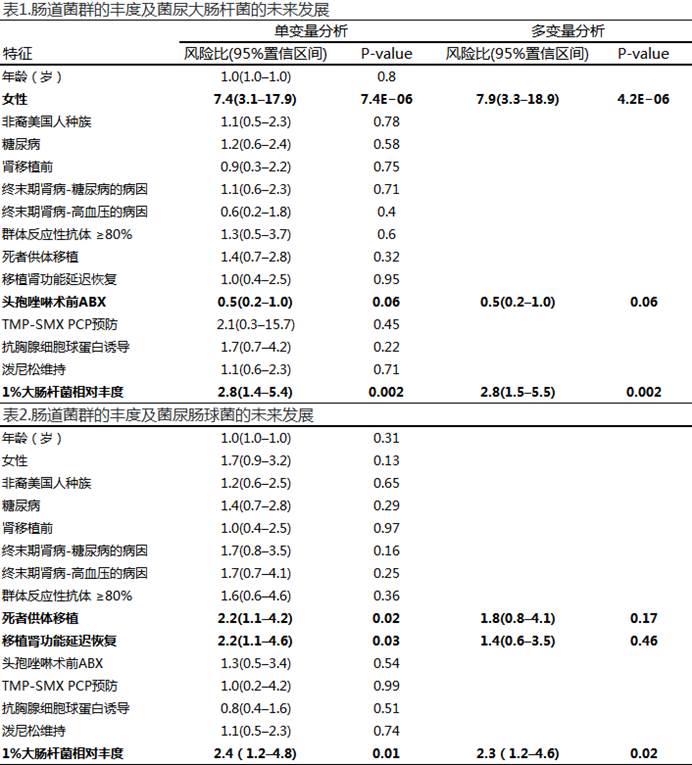

采用Cox比例风险模型评价肠道菌群丰度与菌尿大肠杆菌或肠球菌未来发展的关系。1%的大肠杆菌或肠球菌相对丰度被评估为时间相关的协变量。对所有特征进行单变量分析,并在多变量分析中进一步分析与菌尿中菌株显著相关的特征(P < 0.10)。粗体文字是与菌株未来发展相关的特征。
3. 菌种分析中发现大肠杆菌、粪肠球菌、屎肠球菌这三种菌株,在部分同一受试者的粪便样本和菌尿样本中密切相关。在对大肠杆菌相关的尿路感染致病基因和抗生素耐药基因的评估中发现在配对的尿液和粪便标本中都存在这些基因。这支持来自相同受试者的尿液和肠道大肠杆菌菌株的相似性。
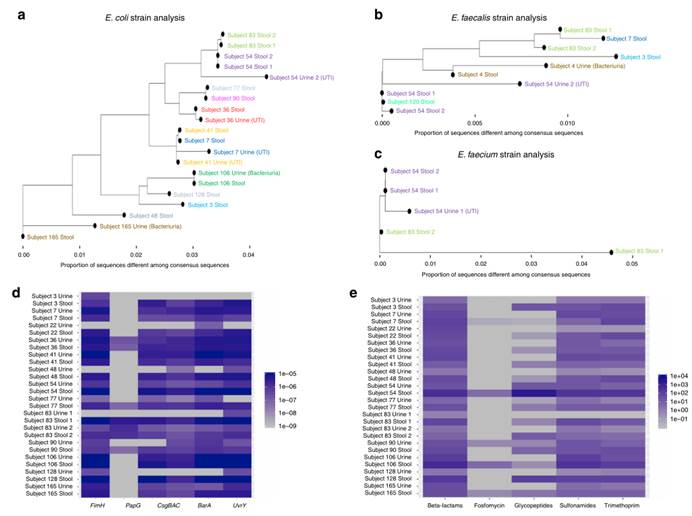

成对的尿便标本中的菌种分析、泌尿致病基因和抗生素耐药基因分析。a、b、c图为分别基于大肠杆菌菌株、粪肠球菌菌株、屎肠球菌菌株比对构建的系统发育树,并在x轴上记录了菌株之间不同的序列比例。每个点代表一种来自尿液或粪便标本的菌株,不同的颜色代表不同的受试者。d图为使用HUMAnN219测定细菌基因后,对尿路致病性大肠杆菌相关基因(x轴)的相对丰度进行估算,y轴为大肠杆菌相关尿标本和配对粪便标本。e图为使用MEGARES抗生素耐药数据库上的Bowtie2确定抗生素耐药基因(x轴),并估计这些基因的表达水平。y轴为大肠杆菌相关尿液标本和配对粪便标本。丰度以蓝色强度、对数比例表示。
结论
证明了大肠杆菌和肠球菌粪便相对丰度的增加与相应生物体未来发生菌尿的风险增加有关。大多数样本中同一受试者的尿液和粪便标本中都存在泌尿系致病基因,如FimH和抗生素耐药基因,进一步支持了菌株比对分析,即肠道中的大肠杆菌与同一受试者尿液中的大肠杆菌相似。虽然,研究中无法评估移植前和移植后肠道微生物群的变化,因为只有5名受试者在移植前提供标本。但结果数据依然支持尿路致病性菌株在肠道丰度的增加是菌尿和尿路感染发展的危险因素。这些结果进一步支持了未来关于调节肠道微生物群作为预防尿路感染的潜在新策略的研究,特别是在反复尿路感染的情况下。

原创:谷禾健康
我们知道肠道微生物群是一个庞大且复杂的微生物生态系统。之前的文章我们讨论过肠道菌群与中枢神经系统,肠道菌群与社会行为等主题。今天要讨论的主要内容如下:
首先介绍已知的微生物群的发育轨迹,并提出:微生物群-肠-脑轴中存在“敏感时期”或“关键窗口”,对神经认知发育有影响。具体而言,假设这些微生物在这些时期的信号对于在整个生命周期内沿着轴建立适当的通信至关重要。因此,在特定的发育窗期内,微生物群的缺失或破坏将对特定功能或整个系统的管理产生不成比例的影响。
然后根据人类和非人类动物的研究为这一假设提供证据,研究微生物群与神经发育之间相互作用的潜在机制,最后讨论了未来发展过程中对微生物-肠-脑轴的研究所面临的挑战。
利用最新的测序技术,一个关于肠道微生物群在整个生命周期内如何发展以及这如何影响宿主的更清晰的画面开始浮现。微生物是否在子宫内定植是目前争论的热点。很明显,微生物群在出生时就迅速繁殖。
这种最初的播种和随后的微生物群落的发展取决于许多因素,但是有明显的成熟期。至少在阴道分娩的婴儿中,大多数早期肠道定植者是从母体微生物群传播的。在最初几天过后,微生物群数量和多样性缓慢增加,从主要是需氧或兼性菌转向更多的厌氧菌。早期的微生物群似乎倾向于提取营养物质,以支持宿主大脑和身体的快速发展。
随着婴儿从纯母乳喂养或配方奶粉摄入转向固体饮食,断奶时微生物群的发展又出现了一次快速爆发。根据一些研究,断奶后微生物群中会出现一段相对稳定的时期。然而,其他研究结果表明,在整个童年中期甚至青春期都存在着持续的变化和可塑性。这些调查显示了一种从童年中期逐渐发展到成人的模式。
有趣的是,微生物群的变化周期与其他身体系统,特别是大脑的快速发展时期一致。这种平行发展很可能是生物相关的,我们假设这些发育窗对应于微生物-肠-脑轴的敏感期。
敏感时期(通常与“关键时期”和“临界窗口”同义)被定义为特定的发育窗,在此期间,系统表现出高度的可塑性,并且对某些环境线索特别敏感。这些提示(也称为“预期输入”)用于以高效的方式调整系统。
微生物-肠-脑轴发育的敏感期
假设来自微生物群的信号对于某些功能是必需的,就像预期的输入来校准微生物-肠-脑轴。因此,在特定发育窗期内,微生物群的缺失或破坏将对特定功能产生不相称的影响,这些功能与破坏的时间窗相关,并可能对整个系统的调节产生不相称的影响。
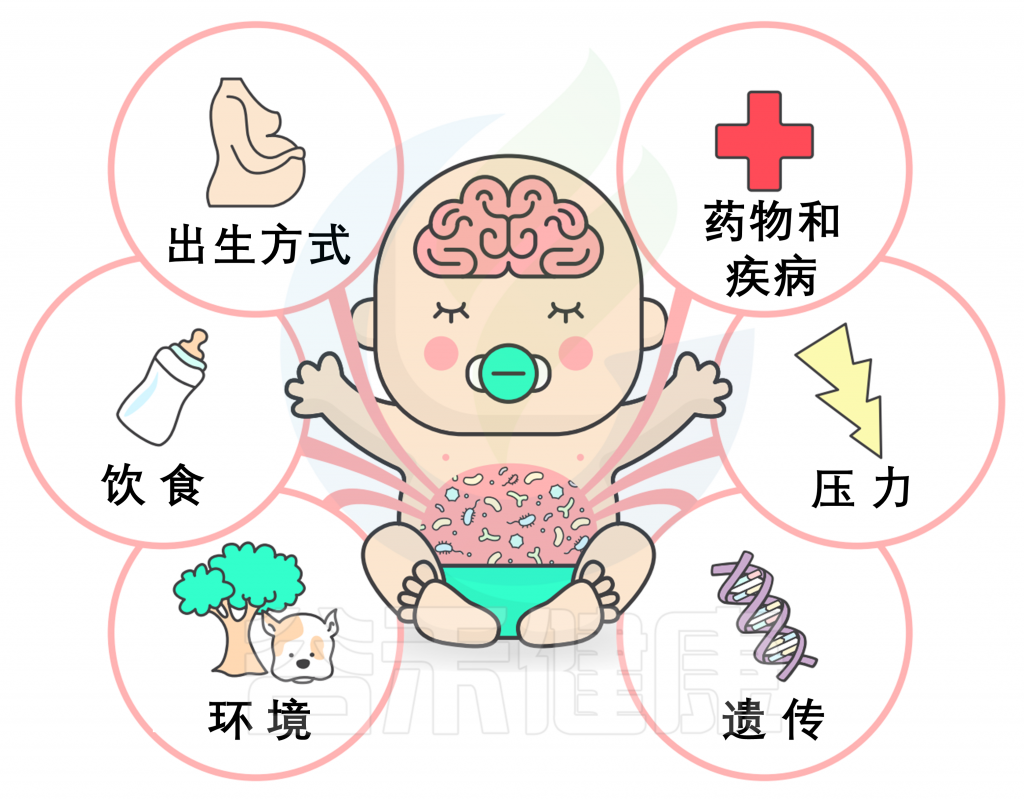

图:许多因素影响微生物群的发育,因此可能改变微生物群-内脏-脑轴的发育轨迹
此外,外部线索,如饮食变化和暴露于环境微生物,可被视为发展中的微生物群的预期输入(见上图)。多个敏感期可能发生在整个微生物-肠-脑轴的发展过程中,正如神经发育每个领域内有多个敏感期(见下图)。
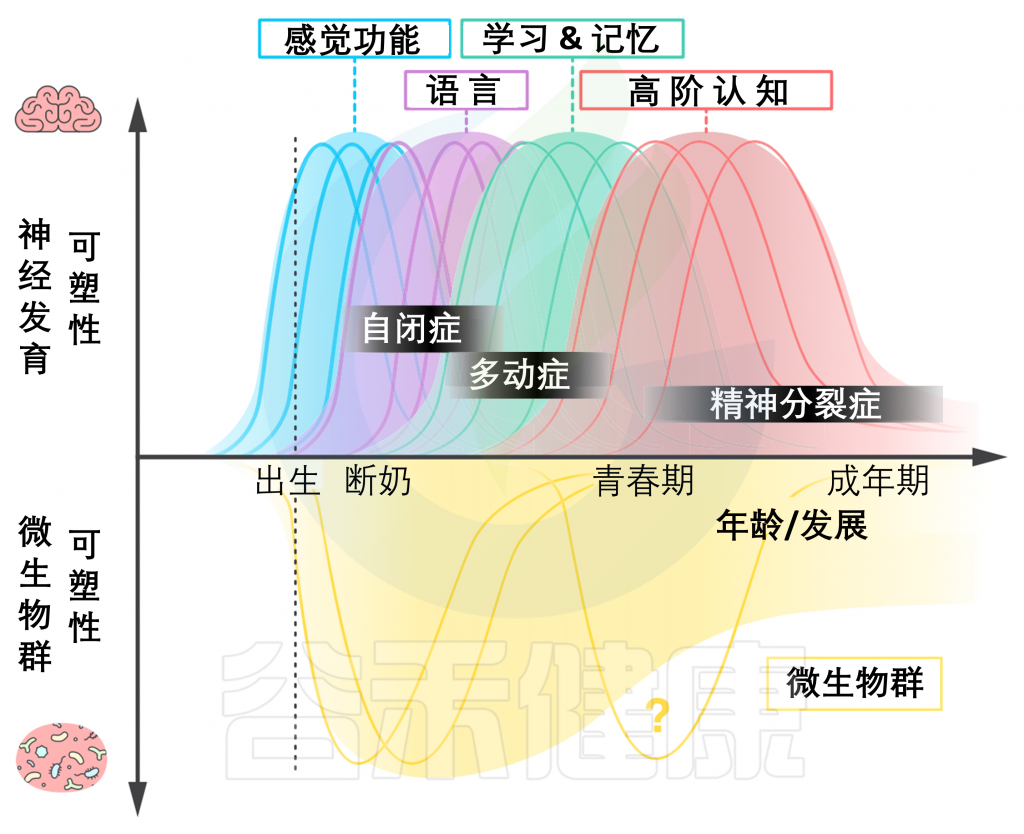

图:敏感期,或高度可塑性的关键窗口,在人类发展过程中以级联的方式出现,多个关键窗口为每个功能域(上轴显示)。微生物的峰值可塑性的时间框架(在出生后早期,断奶时,可能再次在青春期;下轴)与这些轨迹重叠,并且也与神经发育障碍(黑色显示)的峰值相一致。注意,与大脑相比,微生物群在发育期后表现出相对较高的持续可塑性。
微生物群本身似乎对生命早期的破坏特别敏感。尽管它的组成在整个生命过程中仍有一定程度的可塑性。
有人假设,肠道中早期的殖民者或“创始物种”对微生物群的最终稳定组成有着不相称的影响。微生物群成熟轨迹的性质也使其在发育过程中对外界影响的反应更灵敏。出生后的微生物群是相对不稳定的,在成熟过程中获得稳定性,可能是由于微生物群多样性增加。
微生物群不稳定的时期也发生在发育的后期,断奶时有明显的变化,青春期可能出现未充分研究的过渡(上图)。鉴于缺乏对婴儿期后微生物群发育模式的纵向研究,这两者之间很可能存在其他敏感时期。
还有证据表明,微生物群在发育过程中对肠-脑轴特别有影响。最近的研究发现,断奶时微生物群自然成熟的过程对免疫系统的发育至关重要,免疫系统是关键的肠道-大脑途径之一。断奶引起微生物群组成的突然变化,伴随着一种炎症激活的高峰,称为“断奶反应”。使用几种合理的方法改变断奶或抑制断奶反应,证明这种对断奶反应发育适当时间的干扰导致免疫系统的病理印记,增加了各种炎症反应的风险,以响应随后的免疫挑战。
更进一步进入微生物群-肠道-大脑轴,现在有几个例子支持微生物学调节大脑和动物行为的关键窗口的想法。
在不同年龄段,无菌的啮齿动物被“正常”(“正常”即来自特定的无病原体动物)的微生物群重新定殖的研究表明,在恢复无菌缺陷方面,断奶后再定殖比在出生后定殖更有效,至少对于大脑或免疫功能和行为的特定方面而言,断奶后是更有效的。例如,在断奶时重新定殖,而不是在成年后4周后重新定殖,可以使无菌小鼠的社会缺陷逆转。然而,在无菌动物中的其他功能即使在断奶时也不能通过再定殖来恢复,这意味着微生物群对这些功能的影响的窗口在断奶时已经关闭了。
为支持敏感期假说,对儿童期抗生素暴露的两项研究报告称,在生命的第一年接触抗生素,而不是在以后的时间点,对认知发展有负面影响。
人类研究
两项研究,包括最近对芬兰一个大型队列的调查,观察到微生物群组成与非常早期的性格之间复杂的、性别特定的关系,包括外向性、调节能力和恐惧反应。
预测童年焦虑?
胃肠道不适与微生物群的破坏有关,已经被证明可以预测整个童年时期的焦虑,即使是最初的焦虑也是如此。在患有身体疾病的儿童群体中,微生物群调节心理或行为结果的证据是有限和混合的。然而,有一些研究表明,调节微生物群可以改善神经发育障碍的症状(见微生物群和神经发育障碍一节)。
关于人类的认知发展:有一项研究直接测量微生物群和认知表现,这是正在进行的北卡罗来纳大学早期大脑发展研究的一部分。在这组89名婴儿中,1岁时粪便微生物群的组成预测了2岁时马伦量表早期学习综合指数(全球认知指数)的认知表现。这种影响是由接受和表达语言领域的差异所驱动的。1岁时α多样性较低也预示着认知能力的较高,表现为α多样性与2岁时的整体早期学习综合、表达性语言量表和视觉接受量表呈负相关。
出生后第一年接触抗生素影响智商甚至发育?
最后,已经有了一些初步的人类发育研究,检查了与早期生命微生物群相关的神经/认知和行为结果。据报道,出生后第一年使用抗生素对小学期间的总体智商和阅读能力有不利影响。早期接触抗生素也会导致更大的行为困难,更多的对立行为,以及多动症和抑郁症症状。然而,由于研究人员没有直接检查微生物群,也没有收集抗生素使用原因的数据,因此很难确定这些拟议的微生物群——认知和微生物群——行为关系的强度。
随后,该研究小组对两种益生菌进行了安慰剂对照试验,这两种益生菌在怀孕期间和生命的前两年都有应用。在该样本中,抗生素使用率很高(前两年为80%,各治疗组之间相似),益生菌对11岁儿童的认知和行为结果没有显著影响(Slykerman等,2018),尽管早期使用抗生素的效果得到了复制(Slykerman等人,2019)。然而,这项研究又有几个局限性;没有理由选择益生菌菌株、剂量或给药方法,也没有对整个治疗过程中的微生物群进行测量(在这一研究领域常见的问题)。
最近在新生儿重症监护室(NICU)对早产儿进行的一项研究也检查了在妊娠期间给母亲或NICU住院期间给婴儿使用围产期抗生素的效果。在这项排除脓毒症确诊病例以减少感染的混杂效应的研究中,围产期抗生素使用与4-5岁时注意力问题增加相关。服用抗生素的儿童在脑电图(EEG)上表现出更高的delta功率,这是在ADHD中观察到的一种模式,被解释为发育迟缓。
最后,在新生儿重症监护病房(NICU)期间,鼓励父母和婴儿之间进行身体接触(从而传播微生物)的干预措施降低了行为和神经改变的风险(Firestein等人,2019年)。除了这一对人类发育结果的微生物群调节的初步证据外,还有更多的研究使用动物模型来探索认知和行为发育的不同方面。
也许微生物调节动物模型认知和行为的最有力证据来自于对社会互动的研究。
小鼠
无菌啮齿动物通常表现出社交能力和社会刺激记忆的缺陷。在发育过程中抗生素耗尽后也观察到类似的效果,而某些益生菌种类的给药可以增强各种自闭症小鼠模型的社会行为和炎症引起的社会退缩。
果蝇
在果蝇中,发育中和成熟个体都依赖微生物群衍生的挥发性化合物作为社会信号,影响食物和交配偏好。这让人想起上述在人类婴儿身上观察到的微生物群组成和外向性之间的联系。因此,社会行为和跨物种观察到的微生物群之间存在着强有力的关系。有人假设,这种关系有一个进化基础,由宿主和微生物群落的社会互动的共同利益驱动。也就是说,社会互动鼓励微生物向不同宿主繁殖和转移,同时增加任何特定个体微生物群的多样性,对满足宿主的营养和健康需求具有潜在的好处。
之前的文章有详细介绍肠道微生物群调控社会行为的生物学途径。

无菌动物研究表明,在没有共生微生物群的情况下饲养的啮齿动物表现出夸大的条件性恐惧反应,但在成年后的自发交替测试中,恐惧消失、物体识别记忆和工作记忆方面出现了的损害。青春期或成年期服用抗生素对新目标任务有类似影响,损害识别记忆。
抗生素给药对空间记忆性能的影响更为复杂,一项发展性研究发现,尽管有其他证据表明抗生素会慢性损害成年大鼠的空间记忆,但早期抗生素治疗并未改变成年大鼠的空间记忆。这些差异可能归因于抗生素方案和啮齿动物种类的差异;进一步的发育研究将有助于理解这种差异。
饮食或益生菌干预有希望恢复?
饮食干预在减少压力或其他微生物群干扰对整个生命周期学习和记忆结果的影响方面显示出了希望。
在成年啮齿动物中,益生菌补充被用于逆转压力、感染或抗生素治疗后的空间记忆缺陷,甚至在空间记忆、物体识别记忆和长期恐惧记忆方面为健康动物提供益处。
在青春期,饮食中添加ω-3多不饱和脂肪酸和维生素A可恢复慢性社会不稳定应激后盲肠微生物群的组成和新的物体识别障碍。
在发育早期,特定的益生菌菌株(鼠李糖乳杆菌和瑞士乳杆菌)拯救了暴露于早年母体分离应激的幼鼠条件恐惧行为的预期发育模式。压力大的婴儿表现出更持久的恐惧记忆,在恐惧消失后更容易复发,但这两种行为异常都可以通过益生菌治疗逆转。值得注意的是,益生菌治疗甚至可以有效防止这些应激性行为改变的代际传递。
形态学
关于微生物群在人类大脑结构发育中的作用的研究仍然很少。
在成年人中,聚类分析确定了与不同白质和灰质特征相关的不同微生物群组成,包括右海马、左伏隔核、右枕前沟和小脑的区域体积差异。微生物群中的α多样性也与肥胖成人的下丘脑、尾状核和海马的微观结构有关,而特定的放线菌门的相对丰度与下丘脑、丘脑和杏仁核的微观结构变量相关。
在儿童中,只有一项研究检测了大脑结构和肠道微生物群,报告了1岁时α多样性与2岁时左中央前回、左杏仁核和右角回体积之间的正相关。同样的研究还报告了基于微生物群聚类分析的特定区域脑容量差异。
在新生儿重症监护病房早产儿粪便微生物群移植研究中采用了一种更具实验性的方法。与高生长菌群的受试者相比,在NICU中生长不良的婴儿微生物群定植的无菌小鼠在神经元分化、少突胶质细胞发育和大脑皮层髓鞘形成的标记方面表现出大脑发育延迟的迹象。来自低生长婴儿的微生物群也影响各种神经传递途径,增加神经炎症,同时降低生长激素的循环水平。
在微生物群衰竭的动物模型中,同样可以观察到大脑结构发育的如此广泛的变化。
无菌小鼠的大体形态发生改变,包括杏仁核和海马体的扩张。无菌小鼠的形态在神经元水平上也有区域特异性差异,杏仁核和导水管周围灰质的神经元肥大,但扣带回前部皮质和海马的神经元较短、较不复杂。这些结构差异,至少在海马,可能与观察到无细菌和抗生物素治疗小鼠海马神经发生率的增加有关。与微生物群落相关的脑结构变化不仅限于神经元结构;无菌和抗生素诱导的微生物群落耗竭也会导致小胶质细胞成熟和髓鞘形成水平,而白质完整性与饮食诱导的大鼠肠道微生物群变化有关。
在成人中,几项脑成像研究表明,益生菌能够改变大脑对情绪刺激的反应,而某些微生物组分与大脑活动的不同模式相关。微生物群的代谢功能(特别是苯丙氨酸、阿多胺前体的合成)与未患多动症的幼年成人在奖赏预期期的腹侧纹状体活动减少有关。
据所知,只有两项研究发表在去年,这两项研究都发表在儿童大脑功能或活动的微生物调节上。
首先,在睡眠的1岁儿童中评估了各种大脑网络的功能连通性。肠道微生物群α多样性与杏仁核-丘脑、扣带回前皮质-右前岛叶和补充运动区-左顶叶三个独立网络的功能连通性相关。此外,后一组与2岁时的认知评估表现相关,可能为先前描述的微生物群与认知表现之间的关联提供了部分机制。
第二项研究是最近在5到11岁的儿童中进行的一项试验,这些儿童暴露在早期的逆境中(孤儿院的养育)和管理控制。在这个队列中,某些菌群的水平与前额叶皮层对情绪面孔的激活相关。这些分类中的一些在有早期逆境史的儿童中不太常见,支持他们认为微生物群在早期创伤经历和神经发育和心理风险改变之间起着联系作用的想法。
动物研究。本研究很好地拟合了动物早期应激模型中的观察结果。在母性分离后,一种已知会扰乱微生物区系的早期应激啮齿动物模型,大鼠幼犬表现出条件性恐惧反应的加速成熟。在压力期间的益生菌补充足以逆转对这两种行为的影响前额叶皮层的激活。
在压力环境之外,在各种动物模型中,微生物调节大脑功能或活动的证据基础越来越强。例如,对无菌动物杏仁核的转录组分析揭示了差异基因表达、外显子使用和RNA编辑。
最近的一项关于在缺乏微生物群的小鼠中消除恐惧的研究发现,内侧前额叶皮层的基因表达、神经元活动和树突棘重塑发生了显著变化。此外,有许多关于通过操纵微生物群而改变各种神经递质系统的报告,特别是关于5-羟色胺和BDNF(脑源性神经营养因子)。这项工作与脑形态学的研究一起,强调了微生物群对大脑发育的深远影响。
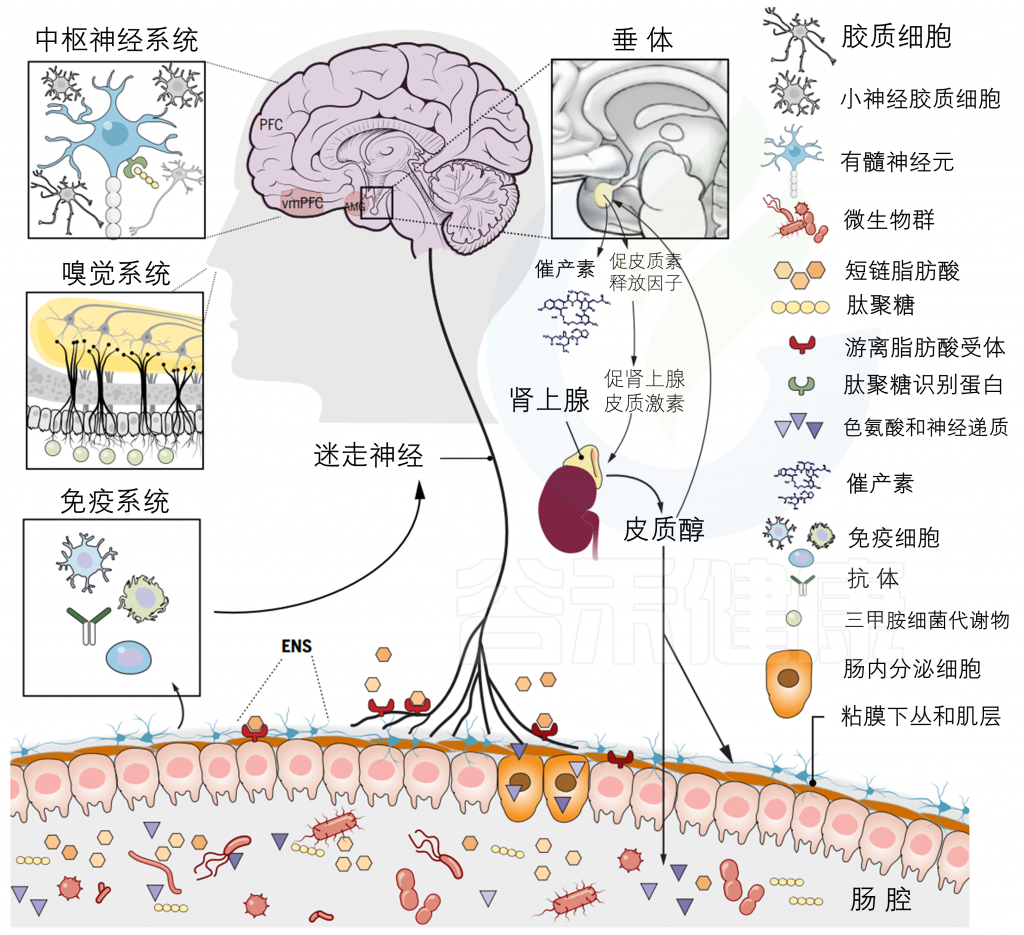
目前,微生物-肠道-脑轴内存在许多已知的通信途径,包括迷走神经、HPA轴、脊髓、免疫系统和代谢产物的外周传输等。这些已在其他地方详细阐述。在这里就提供一个简短的和简单的概述,其中一些路径与一个具体的发展重点(见下图)。
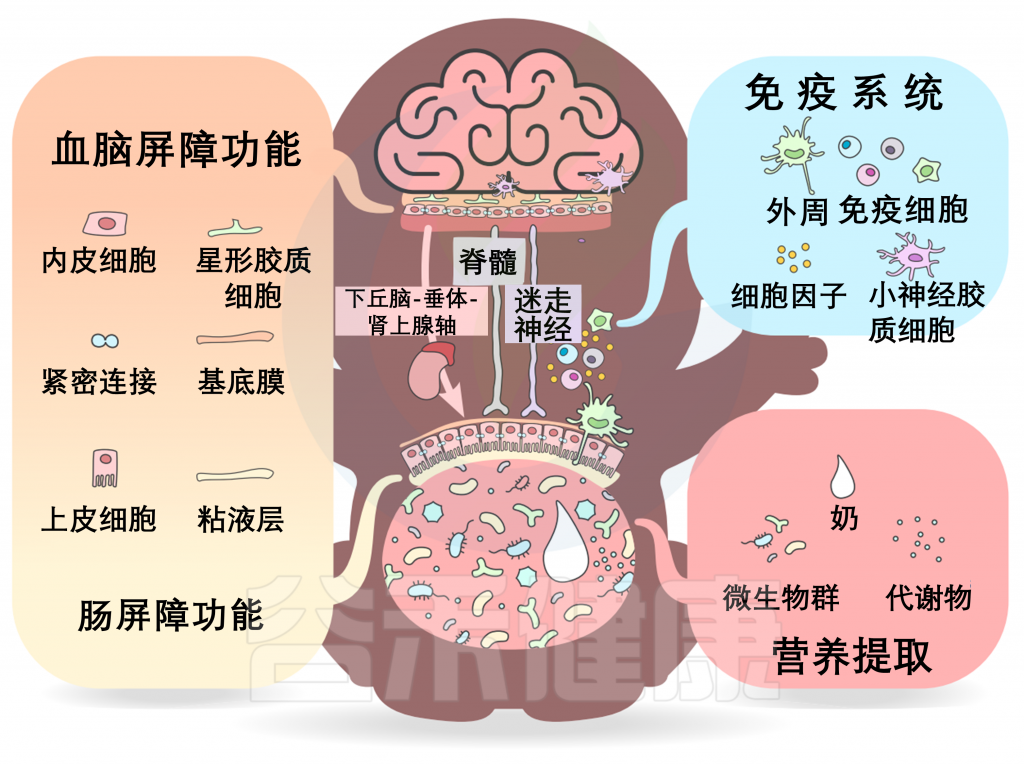

微生物群-内脏-大脑轴由多个通道组成,允许微生物群和大脑之间双向交流。在发育过程中,一些关键的通路包括营养提取、免疫信号和屏障功能,以及沿脊髓、迷走神经和下丘脑-垂体-肾上腺轴(HPA轴)的神经和激素信号。
之前的文章有详细介绍微生物群与大脑之间的通讯途径。
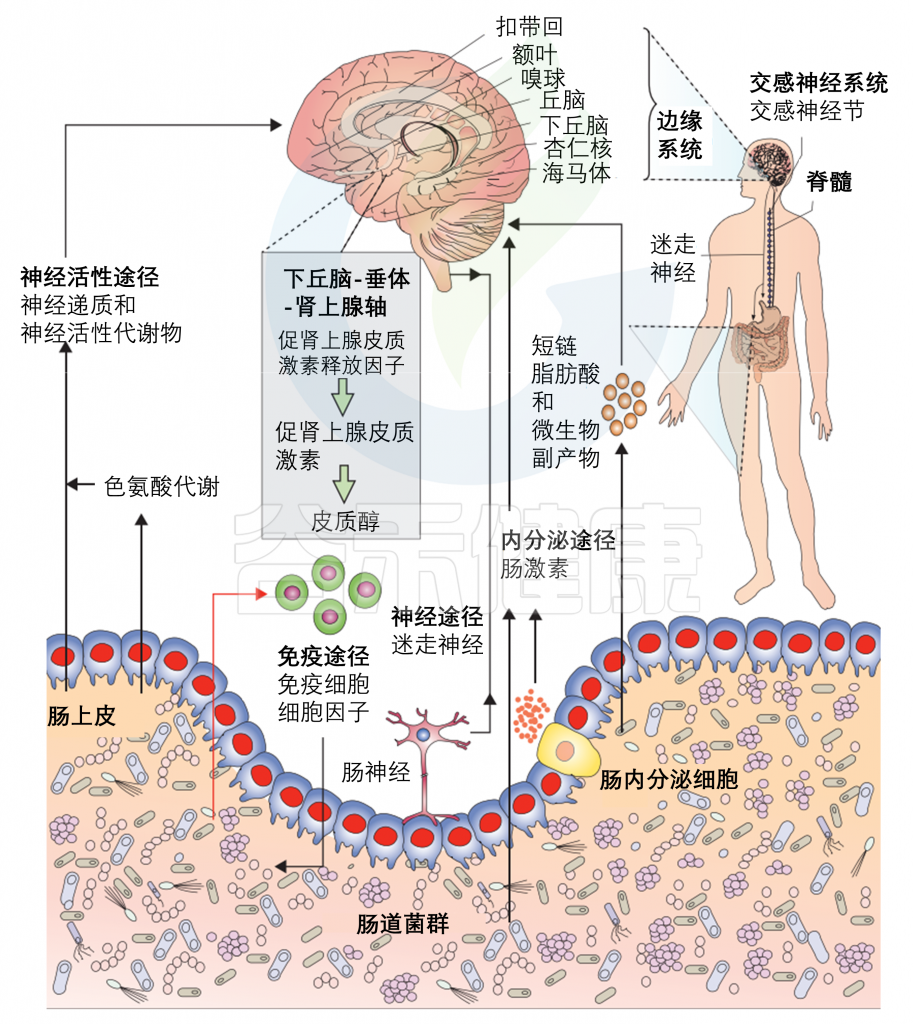

多种直接(如迷走神经)和间接(如短链脂肪酸、细胞因子和关键的膳食氨基酸,如色氨酸、酪氨酸和组氨酸)途径,通过肠道微生物群可以调节肠-脑轴。
也许解释微生物群对神经发育的调节作用的最简洁的假设是,微生物群是生长中的大脑必需营养和能量的关键来源。当然,众所周知,微生物群将原本不易消化的食物成分转化为具有营养或生物价值的产品,营养本身是一种公认的认知结果调节器。
母乳喂养是一种影响微生物群成熟的饮食因素,长期以来一直被认为可以改善认知结果,尽管最近的数据表明,这种影响在很大程度上是由诸如母亲智力或教育水平等混杂变量造成的。
另一方面,特定营养素缺乏和总体饮食质量低都与认知发展的长期负面影响有关,并且对易受伤害人群的营养干预已经被证明可以改善儿童期的认知结果。有人认为,这些影响需要从发展中的微生物群的角度来考虑。
为了支持这一论点,最近对荷兰小学生进行的一项队列研究发现,学龄前饮食与代谢表型之间关系的强度取决于微生物群的组成。
儿童营养不良延缓了微生物的成熟,从营养不良的儿童身上移植到啮齿动物或猪身上的粪便菌群表明,这种改变的菌群在与营养不良相关的发育迟缓和代谢问题中起着因果作用。在这两种动物模型中,通过补充唾液酸化的牛奶低聚糖来解决这些微生物依赖性问题。这些化合物通常存在于母乳中,作为微生物群的益生元,在营养不良儿童的母亲母乳中含量较低。
最近的另一项“微生物导向补充食品”试验发现,与传统食品治疗相比,在动物模型和营养不良儿童中都有很好的效果。
营养物的可利用性、微生物群和代谢发展之间似乎存在着重要的相互作用,通过喂养微生物群,微生物群可以喂养发育中的身体和大脑。
在微生物群和大脑之间,有两大屏障:胃肠道屏障和血脑屏障(BBB)。这些屏障的通透性与微生物来源的代谢产物和神经递质在微生物-肠-脑轴之间的传递特别相关;膜的渗透性越强,传递的信号就越多。这两个障碍有惊人的相似之处。
关于两个屏障:
首先,两者主要功能是防止入侵病原体和毒素。
第二,它们具有一些广泛的结构相似性,由一个细胞层组成,该细胞层与免疫细胞(尤其是肠屏障的T细胞、大脑的小胶质细胞)一起构成主要的物理屏障,这些细胞可以抵御病原体(尽管也有明显的结构差异,包括胃肠道粘膜层的存在)。
第三,尽管这些结构边界以及在这些关键界面上分离内外环境的重要性,但这两个屏障都不是完全不可穿透的。相反,两者对某些生物和化学元素都有选择性的渗透性。在健康状态下,这允许来自胃肠环境的营养物质或信号分子流入血液和/或在大脑和身体之间传递。然而,如果这些受到严密监管的系统崩溃,屏障通透性的增加会导致各种病理形式的脆弱性。
第四,这两种障碍在出生后仍在继续发展,在早期的发展阶段被认为是最易受伤害的。
最后,至少在动物模型中,胃肠道和血脑屏障都是由微生物群调节的。微生物群密切地调节胃肠道的发育,无菌动物在肠屏障中表现出深刻的结构和功能改变。这些变化包括紧密连接蛋白和mRNA(claudin-1和clauddin)的表达改变、微绒毛拉长和粘膜层丢失,所有这些都可能导致肠通透性的增加。
微生物群也与BBB的发展有关。无菌动物的血脑屏障通透性显著增加,从子宫开始一直持续到成年。无菌动物BBB完整性的丧失伴随着紧密连接蛋白(claudin和claudin-5)表达的减少。成年后,无菌动物的肠道和BBB通透性都可以通过再电离恢复,表明屏障功能和肠道微生物群之间存在着终生的联系。
之前的文章有详细介绍血脑屏障如何连接菌群和大脑。
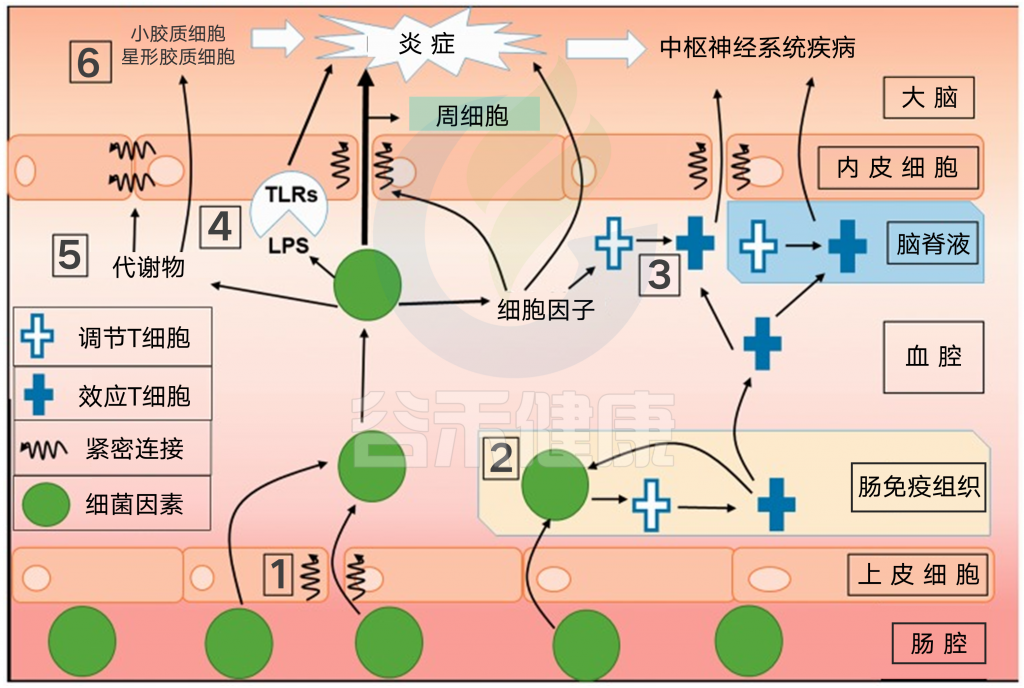

越来越多的文献正在探索“神经免疫轴”作为其自身的双向网络或作为微生物-肠-脑轴的一个组成部分。
除了调节屏障功能之外,炎性信号通过多种机制改变神经活动,包括与HPA轴和迷走神经的相互作用以及细胞因子在脑中的直接作用。
细胞因子是由许多不同类型的细胞产生的,包括大脑中的胶质细胞和神经元,也可以在外周分泌后通过血脑屏障进行主动转运。中枢神经系统中的细胞因子水平可以改变各种神经递质系统的代谢(包括5-羟色胺、多巴胺和谷氨酸)。以这种方式,异常的细胞因子水平可以扰乱许多重要神经回路的功能,包括那些与动机和情绪有关的神经回路。
某些细胞因子还可以作为生长因子和/或激活涉及各种基本细胞功能(生存、迁移、增殖、分化、凋亡)的基因途径,这些功能在发育过程中特别容易受到破坏。因此,异常细胞因子的产生(例如,孕期母体感染或过敏)是神经发育障碍的危险因素。因此,我们可以得出结论,适当的细胞因子信号和免疫功能对神经发育至关重要。
将神经免疫轴延伸到肠道微生物群中
胃肠道是人体最大的免疫界面,暴露于肠道微生物是训练免疫系统辨别有害和无害刺激并随后对这些不同元素产生适当反应的重要环节。无菌动物在先天免疫和适应性免疫方面都表现出深刻的变化,而特定的共生细菌可以调节体外和体内不同类型T细胞的成熟和平衡。
微生物群操作可改变细胞因子的循环和中枢水平以及小胶质细胞发育。此外,人们日益认识到免疫/过敏敏感性与微生物群-肠-脑轴的改变之间的联系。最后,为了与敏感时期假说保持一致,微生物-免疫相互作用和神经-免疫相互作用似乎也有关键的窗口。
下丘脑-垂体-肾上腺(HPA)轴
研究微生物群在脑发育中的作用的一项开创性研究集中于下丘脑-垂体-肾上腺(HPA)轴应激反应。
研究表明,成年无菌小鼠对束缚应激具有夸张的HPA反应,包括升高的ACTH(促肾上腺皮质激素)和皮质酮水平。这种影响可以通过分别与特定的益生菌或病原菌定殖而减弱或加剧。健康小鼠通过粪便微生物群转移的再吸收也减弱了HPA应激反应。
根据敏感周期假设,这种策略仅在6周龄时才有效。在发育过程中所经历的压力方面,微生物群在母体分离模型中已被证实介导了早期生活应激的影响。在这些行为方面,无菌小鼠不受母体分离的影响。用特定细菌(鼠李糖乳杆菌和瑞士乳杆菌)治疗也能有效地逆转母体分离应激对发育过程中糖皮质激素产生的影响,无论是在基础条件下还是在急性应激下。
迷走神经被认为是微生物群信号到达大脑的最直接途径。
胃肠道迷走神经传入的信号到达终纹核,终纹核通过投射到其他脑区(包括许多与行为相关的区域,如下丘脑、杏仁核、腹侧被盖区)充当“中继站”。
迷走神经损伤将阻止某些益生菌的行为影响。最近的研究表明,在一个孤独症基因小鼠模型中,断奶时的迷走神经切断阻止了益生菌治疗对社会行为的拯救。
上述迹象表明,在早期发育过程中,微生物-肠-脑轴的敏感性,对宿主健康具有长期影响,对各种临床状况都有影响。在这里将关注神经发育障碍。
在自闭症谱系障碍(ASD)的研究中发现了微生物群在任何神经发育障碍中作用的最具体证据。有很大一部分患有自闭症的人报告患有共同的胃肠道问题。
一些观察研究报告了自闭症儿童和神经型对照组之间的微生物群差异。新的实验研究证实了ASD症状和微生物群之间更具因果关系,尽管所有的研究都是小规模的,因此在解释时必须谨慎。
将少量自闭症患者的粪便微生物群移植到无菌小鼠体内,导致自闭症症状各方面的相似。三项开放标签的试点研究已经证明,从健康供者体内移植抗生素、益生菌或粪便微生物菌群,作为减轻ASD症状严重程度的策略,具有良好的效果。
另外三项研究使用双盲、安慰剂对照设计来评估不同的微生物群干预措施。对3至16岁患有自闭症的儿童进行为期12周的益生菌治疗的初步试验受到了高辍学率的困扰,但仍表明该治疗对肠功能和行为症状也有一定的益处。
在饮食干预中观察到胃肠道和行为症状的类似益处,该干预评估排除性饮食是否有益生菌的补充作用。
饮食和益生元都导致了与粪便代谢物含量相关的微生物群组成的改变。有趣的是,只在接受排除饮食和益生元的组中观察到行为变化,而胃肠道症状的变化是由排除饮食驱动的。最后,对出生后6个月补充益生菌的初步试验(N=75)发现,治疗具有预防作用,可降低13岁时患自闭症的风险。
除了降低患自闭症的风险外,产后益生菌治疗(鼠李糖乳杆菌GG)还降低了患多动症的风险。长期以来,饮食一直被认为是导致多动症症状的一个因素,而青春期的西式饮食(富含加工过的肉类、精制谷物、脂肪和糖)与多动症症状有关。许多饮食干预措施已在多动症中试用,取得了不同程度的成功,最有效的是排除人工食物染料的消除饮食。
之前的文章有详细介绍肠道微生物群和饮食模式之间的关系。

更直接的微生物群研究表明,与年龄匹配的健康对照组相比,患有多动症的个体具有不同的微生物群特征。使用假设驱动的方法,确定沿多巴胺途径的微生物群预测功能的变化与基于奖励的任务期间的活动相关。这些发现表明,值得进一步评估多动症的微生物群、饮食和症状学之间的联系,特别是在儿童期。
微生物群与精神分裂症之间较复杂
最后,关于微生物群在精神分裂症中的作用有很多猜测。这种关系尤其难以理清,因为抗精神病药物的使用几乎无处不在,众所周知,它们会改变微生物群。尽管如此,一些研究已经发现精神分裂症患者口腔和粪便微生物群的差异,包括与症状严重程度相关的特定分类群。将患者的粪便菌群移植到无菌小鼠体内,可引起小鼠的过度活跃和夸大的惊吓反应以及海马谷氨酸能功能的改变,但未改变社会行为或前脉冲抑制。在人类中,益生菌干预至今还没有显示出对这种复杂的神经发育障碍的症状严重性有任何影响。
目前的研究还没有达到可以在临床环境中推荐使用基于微生物群的药物或诊断的阶段,缺乏对人类特别是儿童的研究。如上所述,证据表明微生物群与神经认知和心理发展之间存在联系,但除少数例外。
对这样一个包含多个器官的复杂全身系统的研究本身就提出了许多挑战。
首先,交互的复杂性要求每个系统中的专家之间的协作。需要胃肠病学家、儿童心理学家/精神病医生、微生物学家和生物信息学家的投入,设计实验并确保正确分析数据。
第二,这个多系统问题使每个系统内的物种差异复杂化,这就给动物模型结果的翻译增加了障碍。在跨物种的微生物-肠-脑轴的每一个组成部分上也有明显的差异。在试图预测模式物种中微生物群的研究将如何转化为人类时,考虑神经发育不同方面的特定发展轨迹是很重要的。
另一个值得进一步关注的因素是性别的影响。当然,神经发育障碍的患病率存在明显的性别差异,自闭症、多动症和精神分裂症在男性中更为常见。有研究表明,与雌性相比,雄性动物的早期微生物群破坏的影响更为显著。
在男孩中,通过饮食干预也显示出更大的改善。另一方面,男孩的微生物群组成与性格之间的关联性更强。因此初步发现男性可能更容易受到微生物群操纵对神经发育的影响,这与观察到的神经发育障碍的性别差异模式一致。
在选择操作人体内微生物群的方法时,需要更多地考虑益生菌、剂量滴定(尤其是交叉开发)、给药方法的选择,和目标人群。
这一领域已经开始缩小我们在理解允许沿着微生物-肠-脑轴沟通的途径方面的差距。需要对性别差异、临床人群和前瞻性纵向队列进行研究,以评估微生物群对神经心理学和临床结果的动态贡献。基于微生物-肠-脑轴的潜在敏感期的证据,着眼于早期发育的研究可能是一种富有成效的方法,用于利用微生物来治疗心理或认知问题的潜力。
参考文献:
Caitlin S. M. Cowan,Timothy G. Dinan,John F. Cryan. “Annual Research Review: Critical windows – the microbiota-gut-brain axis in neurocognitive development”.The Journal of Child Psychology and Psychiatry,2019

谷禾健康是谷禾面向健康领域的品牌,通过无创采集微量粪便样品,常温快递运输至谷禾检测中心,经全自动化样品处理和提取后大规模高通量测序获取菌群基因数据并进行分析解读,凭借全球领先的样本积累和业界独有的人工智能算法实现了基于肠道菌群的疾病预测和系统健康风险评估, 以及肠道菌群,病原物感染,重金属污染以及营养物质和激素代谢水平等在内的综合健康风险提示,并提供精准个性化的健康管理方案。公司成立于2012年,总部位于杭州,拥有优秀的研发团队和独立实验室,经过多年的积累,已完成近6万例临床肠道菌群样本检测,并构建了超过20万各类人群样本数据库。
谷禾健康的服务旨在通过持续不断的研发和改进,大量自动化提升效率,降低检测成本,为广大消费者提供更好更有价值的产品。


原创:谷禾健康
刚刚,来自爱尔兰 APC 微生物组研究所(APC Microbiome Ireland,简称APC)的APC John F Cryan,教授和 Timothy G Dinan教授在 Lancet Neurol《柳叶刀神经病学》上在线发表了综合评论文章:The gut microbiome in neurological disorders(肠道微生物群在神经系统疾病中的作用)。
小贴士:带你了解一下APC
APC (APC Microbiome Ireland) 微生物组研究所在肠道学术和产业方面都颇具国际影响力,集产学研一体,尤其是关于微生物组相关的生物医药和功能食品研发。其在微生物组研究和肠道相关疾病研究中可以排进全球前五,在益生菌研究和细菌素研究中名列第一。
APC 长期致力于微生物组的转化应用研究,在多个领域的产业化方面,包括食品、制药、婴儿营养、医疗食品、诊断、运动营养,以及动物健康等取得进展。
以下是文章内容。
在过去10年中,对肠道微生物群在调节大脑功能方面的作用的研究迅速增加,尽管主要是在动物模型中。
越来越多的临床和临床前证据表明,微生物群可能是神经系统疾病(包括阿尔茨海默病、自闭症谱系障碍、多发性硬化症、帕金森病和中风)的一个关键易感因素。横向临床研究正在支持改变微生物组成的概念,这有助于此类疾病的病理生理学。

然而,这一领域尚处于起步阶段,鉴于微生物组分受饮食和运动等多种因素的影响,对这些数据的解释往往很困难。需要对人体进行纵向研究和随机对照试验,以发现靶向微生物群是否能产生新的治疗策略。系统生物学方法在将此类数据与来自神经疾病临床队列的基因组和代谢组学数据集整合也很重要,可以帮助指导个体化治疗选择。
人们认为,当婴儿在分娩期间接触到母体微生物时,肠道的定植主要是在出生时开始的。早期生活中的各种因素可能影响这种定居,包括分娩方式、母乳喂养、早产、环境、宿主遗传学、抗生素暴露和母体感染、压力或肥胖。
在整个生活中,饮食可能对微生物群的组成产生最大的影响。
越来越多的研究调查了患有特定神经障碍个体与健康年龄匹配个体的微生物群组成。然而,这些研究仅仅提供了一个时间上的快照,纵向队列研究是有必要的。实验模型对于推动人类微生物群-肠-脑轴向前移动的研究是必不可少的。
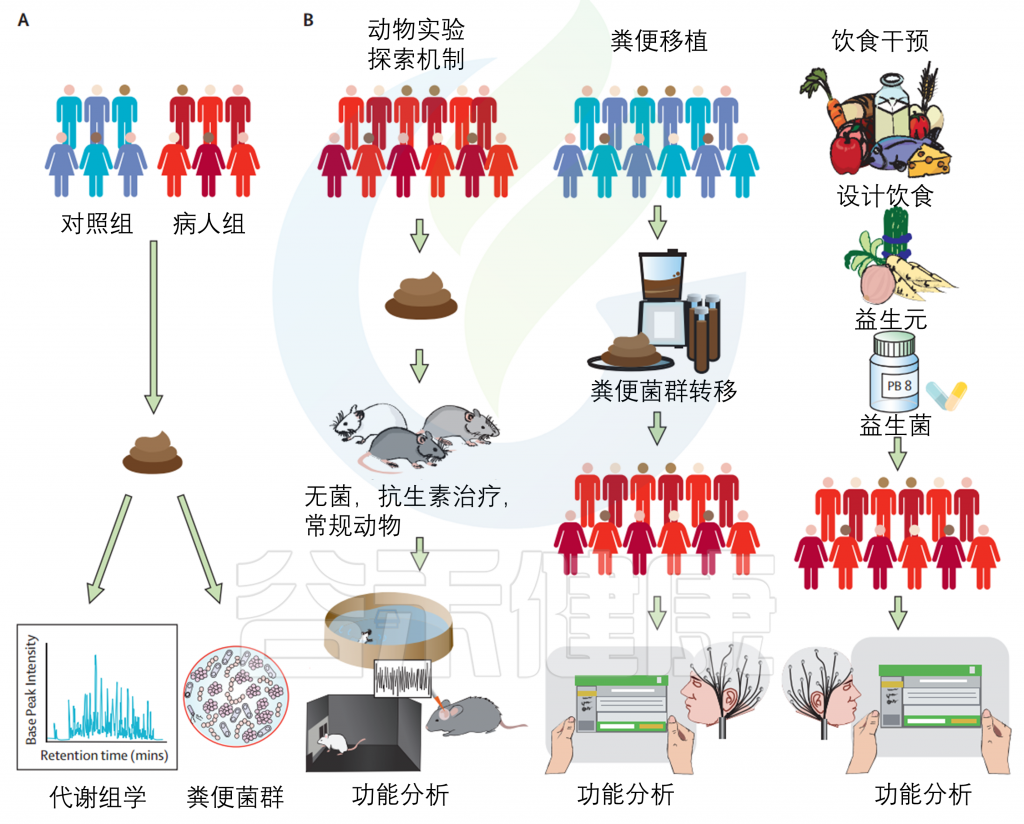

(A)对患者组和对照组的微生物群进行评估,并确定组成(有哪些细菌)和代谢组(他们正在做什么)的差异。注意,粪便样本通常用于微生物组分析,结肠细菌不是小肠微生物组的可靠替代物。
(B)在临床前和临床试验中使用人类微生物组的三种潜在方法,以研究疾病的机制和潜在治疗的效果。
动物实验探索机制:动物可以通过粪便微生物群移植来实现人性化,粪便物质取自人类,用于在啮齿类动物的肠道中重新填充与人类捐赠者相似的成分。这样可以在啮齿动物中重建与供应者人类相似的表型,为在人类中很难研究的机制提供了一种临床前的方法。功能分析可以通过一系列的动物行为测试,以及分子和成像技术进行的体外测试来完成。
粪便移植:如果存在微生物组分的差异,粪便微生物组移植可从对照个体或明确的细菌联合体进行。已报道了一些有前途的临床研究,包括自闭症谱系障碍患者的研究。
饮食干预:可实施选择性饮食、益生元或益生菌等。然而,这主要是在动物模型中进行的研究,现在有必要验证通过选择性饮食,益生元或益生菌对人体进行微生物组靶向的效果。
微生物群与神经发育
越来越多的关注是理解微生物-肠-脑轴在神经发育过程中的作用。
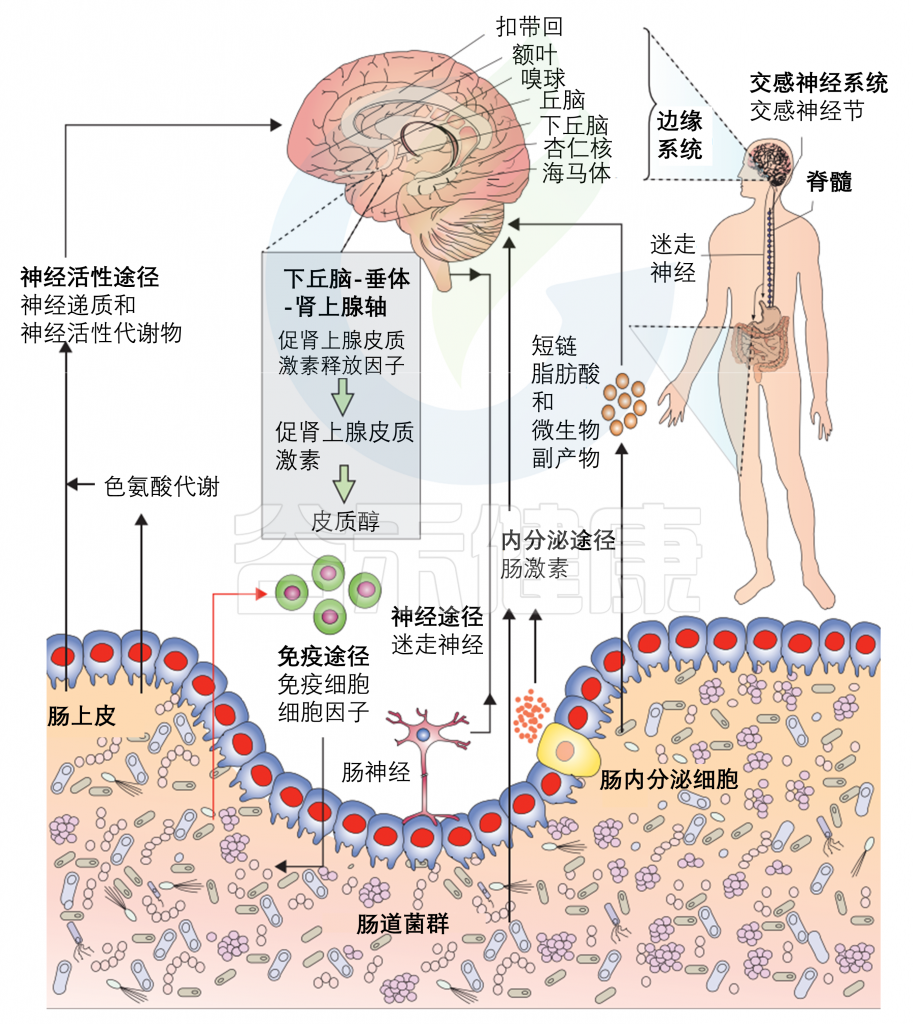

多种直接(如迷走神经)和间接(如短链脂肪酸、细胞因子和关键的膳食氨基酸,如色氨酸、酪氨酸和组氨酸)途径,通过肠道微生物群可以调节肠-脑轴。
它们包括神经活性途径,包括神经递质和神经活性代谢物;免疫途径(包括细胞因子);短链脂肪酸和微生物代谢物;神经途径(迷走神经、肠神经系统和脊神经);下丘脑-垂体-肾上腺轴;内分泌途径。
微生物群可以在动物和人的肠道局部合成神经递质(即GABA、去甲肾上腺素和多巴胺),这是重要的交流途径。神经活性细菌代谢物,以及来自饮食的代谢物,可以调节大脑和行为的方式仍在被阐明,包括影响上皮细胞改变肠屏障功能、肠内分泌细胞释放激素和树突状细胞调节免疫和小胶质功能,在衰老和神经系统疾病中起着重要作用。
然而,所涉及的确切的分子信号传导途径尚未明确。红色箭头表示免疫系统受到腔内容物的刺激,产生负面影响(宿主免疫激活)。
然而,对婴儿的研究很少,大部分是横向研究的。在一项对89名婴儿的研究中,2岁时的认知功能(用马伦早期学习量表评估)与1年前的微生物群组成显著相关。
在39名婴儿的队列中,微生物群α-多样性(一个描述样本内变异性的统计数据)也与支持运动区和下顶叶之间的功能连接有关。重要的是,这种功能联系也与2岁时的认知结果有关。
微生物群在神经发育中作用的最有力证据来自对无菌小鼠(即完全没有微生物群的小鼠)的研究。在这些模型中,基本的神经过程,如发育、髓鞘形成、神经发生和小胶质细胞的激活,已经被证明在很大程度上依赖于微生物群的组成。
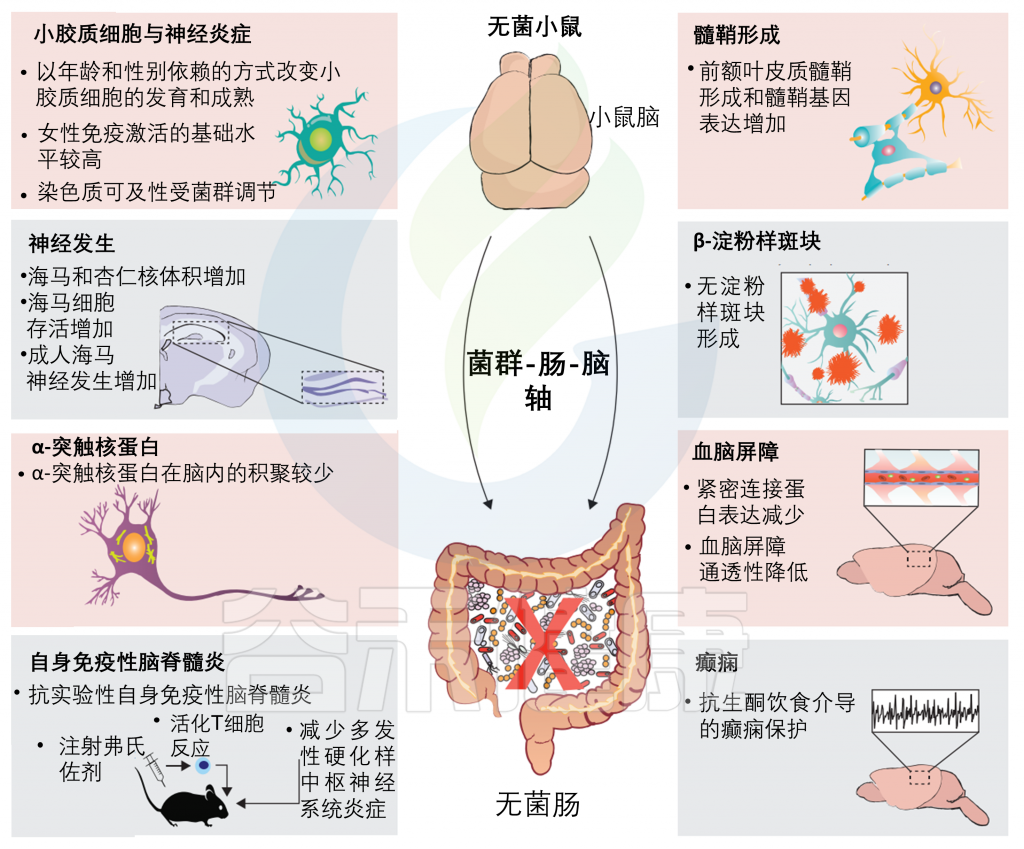

无菌小鼠的大脑无法正常发育;无菌小鼠缺乏微生物群会导致许多与各种神经系统疾病相关的神经生物学变化,包括应激依赖小鼠的行为依赖性改变、无菌小鼠海马体积减少和髓鞘形成减少。
研究报告显示前额叶皮质髓鞘形成增加,海马体神经发生增加,各种神经递质浓度改变,树突树状结构改变。
在功能上,无菌小鼠已经表现出微生物群与脑信号在社交能力、内脏疼痛、免疫功能、应激敏感性和恐惧和焦虑反应中的参与。
来自无菌小鼠的小胶质细胞是神经炎症的重要调节因子,表现出不成熟的表型,对细菌相关分子模式(如脂多糖)没有有效的反应。
无菌小鼠也显示血液-脑屏障的通透性增加。血脑屏障完整性的降低可能会使免疫细胞和细菌成分转移到大脑并影响神经炎症。
无菌小鼠对实验性自身免疫性脑脊髓炎、转基因介导的β-淀粉样斑块形成、α-突触核蛋白形成和生酮饮食诱导的癫痫保护作用也有抵抗力。
年轻大鼠(如产后4-13天)使用抗生素的研究也表明,微生物群在塑造与侵略性和内脏痛相关的神经发育轨迹方面也起着关键作用。。
肠道微生物群与大脑老化之间的关系也备受关注,因为许多神经系统疾病都发生在老年人身上。
年龄在65岁以上的178名爱尔兰Eldermet研究表明,肠道菌群的组成与总体的健康、虚弱和免疫功能指数相关。这项研究表明,微生物的多样性越大,健康结果越好。
值得注意的是,饮食的多样性与肠道微生物的多样性相关,人们吃加工食品,平淡的食物(通常是在养老院)减少了微生物的多样性,而饮食中富含水果和蔬菜的人肠道微生物群的多样性更多。因此,肠道微生物群的多样性是健康老龄化的潜在标志。


一项小型12周、双盲、随机化、安慰剂对照研究,没有随访,将36名健康的韩国人(20名男性和16名女性;60-75岁[SD4·14])分为益生菌饮食组(n=26)和安慰剂组(n=10)。这项小型研究表明,与服用安慰剂的个体相比,使用一种特定的细菌菌株(乳酸杆菌IDCC3801)使认知疲劳测试的每种形式都有所改善。
小鼠研究表明,与年龄相关的行为缺陷与微生物群的变化是同时发生的,并且可以通过针对微生物群的饮食干预(益生素菊粉)来改善与年龄相关的神经炎症。
此外,微生物群还被证明调节微胶质细胞的活动,其具有在衰老和神经变性中的关键作用。
看看微生物群在神经系统疾病中的作用的证据,其中在临床或动物研究中显示了肠道微生物群的作用是关键的。
下面的表格总结了人类对微生物群及其在神经系统疾病中的作用的研究,包括研究的固有局限性。根据微生物群如何影响参与健康神经发育和衰老的关键大脑过程,构建了微生物群与每种疾病之间的关系。从最有证据的疾病开始,以新生领域的描述结束。
鉴于肠道微生物对免疫系统的发育和成熟至关重要,那么要说这些微生物群与多发性硬化(一种免疫介导的神经系统疾病)的发病机制有关也并不奇怪。

横向研究主要显示,与无自身免疫疾病的健康儿童相比,在患有多发性硬化的儿童中,在2年内多发性硬化的儿童与年龄为18岁的健康儿童相比,在2年内多发性硬化的儿童中观察到细微的、离散的分类变化,而不是多尺度差异(描述不同样本之间的变异性的统计)。






两项研究将多发性硬化患者的微生物群移植到两种不同的实验性自体免疫性脑脊髓炎模型中,这是一种经过充分验证的多发性硬化症动物模型。这些研究强调了产生白细胞介素 IL10 的 CD4 T 细胞在肠道微生物群免疫调节作用中的重要性。
在无细菌的小鼠中的早期研究也表明,这些小鼠对发育实验性自身免疫性脑,特别是抵抗正常小鼠的粪便微生物群移植而逆转。此外,胃肠道中存在特异性的革兰氏阳性丝状菌,激活Th17细胞,显著影响实验性自身免疫性脑脊髓炎的严重程度。
多发性硬化症是一种脱髓鞘疾病,来自无菌小鼠和抗生素临床前研究的汇集数据表明,微生物群在调节小鼠前额叶皮质髓鞘生成中起作用。
血脑屏障完整性的丧失也是多发性硬化症的一个特征,而无菌小鼠的研究表明,微生物群在调节血脑屏障方面至关重要。
此外,短链脂肪酸或产生短链脂肪酸的菌群的饮食管理可以逆转血-脑屏障完整性的损失。饮食引起的微生物群组成的变化也被认为是实验性自身免疫性脑脊髓炎的表现。
越来越多的证据支持微生物群是神经炎症的关键调控者,然而,需要进一步的研究来了解这种关系如何有助于多发性硬化的病理生理学。
自闭症谱系障碍的一个重要且常被忽视的特征是与胃肠道症状有明显的共病性。
许多横向研究显示自闭症谱系障碍患者的微生物群组成发生了改变。然而,这些研究大多相对较小且不均匀,并不总是考虑饮食,也不能监测疾病进展的变化。动物研究有助于提供一个机械的理解微生物群如何可能在自闭症谱系障碍中发挥作用。




无菌小鼠在社会行为上有缺陷,重复行为增加表明,正常的社会发展需要适当的微生物组成。将来自自闭症谱系障碍捐赠者的肠道微生物群移植到无菌小鼠体内,发现患有自闭症谱系障碍患者的微生物群的定植足以诱导老鼠自闭症行为。
经流行病学证实的自闭症谱系障碍环境危险因素动物模型(包括母亲暴露于抗惊厥剂丙戊酸盐、孕妇暴露于孕期炎症和孕妇肥胖)报告了微生物群组成的改变。使用单一的细菌菌株,无论是脆弱的细菌或乳酸菌,可以逆转许多行为和胃肠道变化报告在人类研究和动物模型的自闭症谱系障碍。
此外,一些肠道微生物群落易受万古霉素的影响,而万古霉素能促进炎症状态,这与自闭症谱系障碍有关。


一项小型生物群转移治疗定义的微生物群的小规模试验研究表明,自闭症谱系障碍患者的治疗效果良好。
与治疗前相比,接受微生物转移治疗的自闭症谱系障碍儿童的腹痛、消化不良、腹泻和便秘明显减轻,与自闭症谱系障碍相关的行为显著改善,自微生物转移点起至少持续了两年。作者还指出,在治疗后,患者的细菌多样性显著降低,双歧杆菌、普雷沃氏菌和脱硫弧菌丰度显著增加。
α突触核蛋白,是大脑帕金森氏病病理学的标志性蛋白质聚集体,也已在帕金森综合症患者的粘膜和粘膜下神经纤维和神经节中被发现,一些临床前证据甚至表明α-突触核蛋白可以通过迷走神经将肠道中的蛋白转运到大脑。淀粉样蛋白可由菌群产生,并已被证明可增加老年大鼠的α-突触核蛋白病理学。


迷走神经特别适合作为从肠道到大脑的信号管道,可以通过小分子或大分子(如α-突触核蛋白的朊样移位)的运输,也可以通过电信号在神经元上传递。
越来越多的研究显示帕金森病患者的微生物群组成发生了变化。然而还需谨慎,因为这些数据主要来自于小群体,不能提供纵向视角。






当小鼠通过粪便微生物群移植与帕金森氏病患者的微生物群进行殖民时,它们会出现运动障碍和神经炎症,这是帕金森氏病的两个标志性症状。此外,当小鼠接受抗生素治疗时,其行为学症状改善。本研究提示短链脂肪酸是帕金森病动物模型神经炎症过程的驱动因素。
阿尔茨海默病
一些研究表明阿尔茨海默病可能是由微生物引起的。淀粉样蛋白可能在大脑中起抗菌肽的作用得到了精辟实验证据的支持。
然而,要证明阿尔茨海默病患者的神经炎症和神经变性有感染的原因,这在逻辑上和道德上都是很有挑战性的。


与帕金森病一样,肠蛋白与认知健康之间的关系得到了越来越多的关注,表明淀粉样蛋白样蛋白可由菌群产生,并增加迷走神经切断的老年大鼠的α-突触核蛋白的病理学。然而,在帕金森病患者中的确认是突出的。
横向研究表明,阿尔茨海默病患者粪便样本中与炎症介导有关的大肠杆菌和志贺氏菌类群与健康人相比有所增加。此外,阿尔茨海默病患者的微生物群变化与未刺激和未离心血液中的促炎细胞因子浓度有关。






促炎性大肠杆菌和志贺氏菌数量增加,抗炎性大肠杆菌数量减少可能与认知障碍和脑淀粉样变性患者的外周炎症状态有关,提示微生物群失调与全身炎症之间存在联系,后者可能引发或加剧阿尔茨海默病患者大脑中的神经变性。
需要注意的是,这些结果来自于小规模的研究,需要在更大的队列中进行纵向研究,以评估微生物群参与阿尔茨海默病的进展及其因果关系。
对无菌小鼠的精液研究表明,当微生物不存在时,淀粉样斑块的形成和神经炎症明显消失。同样,用抗生素混合物对转基因小鼠进行长期治疗可减少海马区淀粉样斑块周围的小胶质细胞和星形胶质细胞积聚,并减少不溶性淀粉样蛋白β斑块。
这些研究共同强调了微生物群在调节阿尔茨海默病的关键分子成分中的作用。
中风与脑损伤
横向研究报告了与健康、无症状对照个体相比,中风患者的微生物组成失调。肠道菌群代谢产物三甲胺N-氧化物与主要不良心血管事件、妊娠糖尿病、和阿尔茨海默病的风险增加相关,表明通过肠道微生物群的调节治疗疾病治疗的可能性。


在临床前模型中,脑缺血与改变的微生物群组成和胃肠动力和屏障通透性的功能性作用有关。
此外,将中风模型的粪便微生物菌群移植到无菌小鼠中,或将中风患者移植到经过抗生素处理的小鼠中,均加重了缺血性脑病引起的脑损伤体积和功能性缺损。


在缺血性损伤前使用广谱抗生素与小鼠预后明显恶化有关。抗生素诱导的微生物群失调还导致炎症性 IL-17 γδ T 细胞的转运减少和 IL-17 相关的趋化因子表达减少。因此,肠道微生物群似乎影响中风后神经炎症的程度,通过调节肠道T细胞向大脑的运输。
在脑缺血再灌注损伤的动物模型中,给药一种特殊的细菌——丁酸梭菌,具有神经保护作用。
外伤性脑损伤后微生物群组成发生了改变,丁酸梭状芽孢杆菌在这种损伤的小鼠模型中显示出神经保护作用。
已将重点放在开发富含益生元或益生菌的饮食中,以对抗与创伤性脑损伤相关的一些共病,但需要更多的临床试验来了解这种干预的治疗潜力。
癫痫、肌萎缩性侧索硬化和亨廷顿病
与其他疾病相比,与癫痫、肌萎缩性侧索硬化和亨廷顿病相关的微生物群证据要少得多。不过这些领域的研究人员和临床医生也开始关注微生物群在这些疾病中调节生理和行为的潜力。


癫痫:
无菌小鼠的研究表明,微生物群参与了癫痫发生的关键脑区的突触变化,生酮饮食被证明改变了患有癫痫的婴儿(表)和动物的微生物群。
同时也表明生酮饮食的有益作用取决于微生物群。随后的研究可能会更加强调微生物群作为癫痫介质的潜在作用。


肌萎缩侧索硬化:
肌萎缩侧索硬化小鼠模型提示肠道微生物群的改变与该病的发病有关。
例如,与健康小鼠相比,这些模型中产生丁酸的细菌的相对丰度较低,这与肠道通透性的改变有关。然而,人类的横向研究尚未发现微生物群与肌萎缩性侧索硬化疾病进展之间的任何关系。


亨廷顿病:
亨廷顿病患者体内微生物群变化的数据很少,可能是因为这种疾病主要被视为一种遗传性疾病。然而,内在因素(例如,蛋白质同质化的变化、线粒体功能紊乱和不受控制的皮质激素输入)和外在环境因素(例如,种族、地理区域、喝茶和烟酒)可以缓和亨廷顿病的进展。
一项代谢组学研究表明,与对照组相比,在一组患有先天性和早期亨廷顿氏病的患者血清中发现来自肠道微生物群的代谢物改变。
然而,有必要进行更多的研究,以充分了解肠道微生物群及其代谢物在发病、发病过程中的影响。
结论和未来
大量的基础研究表明,微生物群对大脑功能的正常发育和维持具有重要意义。从临床和动物研究中也积累了证据,表明微生物群在神经疾病中起作用。
支持微型生物群作用的最强证据是帕金森病、多发性硬化、和孤独症谱系障碍,在阿尔茨海默病和中风中的作用越来越高。
然而,这仍然是很早的事情,需要谨慎,避免过度解读这些数据。需要更好的控制和精心设计的研究。
为了从纯粹的相关观察研究,转向因果和功能性结果,需要更多地强调使用益生菌菌株、益生元和可能的粪便微生物移植疗法的介入方法。这些研究在设计上应该是纵向的,而不仅仅是横向的,以提供一个时间因素来确定微生物群是一种潜在的疾病生物标志物。
人脑成像和脑电图研究已经检查了微生物菌群变化对健康志愿者大脑功能的影响。这些研究使用有针对性的微生物群干预来支持良好的认知健康,以改善微生物-肠-脑轴的靶向,并为新疗法的发展铺平道路。
当然也需要进一步的研究来了解这些研究在多大程度上可以转化为神经系统的研究。
附 录
APC相当关注饮食-菌群-宿主之间的相互作用
以下是APC发表的部分文章:
【益生菌】一种特定的短双岐杆菌益生菌株可用于减少阿司匹林引起的小肠损伤
Mortensen B, Murphy C, O’Grady J, et al. Bifidobacterium breve Bif195 Protects Against Small-intestinal Damage Caused by Acetylsalicylic Acid in Healthy Volunteers[J]. Gastroenterology, 2019.
【老年】饮食和健康状况,影响老年人的肠道菌群
Claesson M J, Jeffery I B, Conde S, et al. Gut microbiota composition correlates with diet and health in the elderly[J]. Nature, 2012, 488(7410): 178.
【生物精神病学】FOS+GOS帮小鼠抗抑郁和焦虑
Burokas A, Arboleya S, Moloney R D, et al. Targeting the microbiota-gut-brain axis: prebiotics have anxiolytic and antidepressant-like effects and reverse the impact of chronic stress in mice[J]. Biological psychiatry, 2017, 82(7): 472-487.
谷禾健康 是谷禾面向健康领域的品牌,通过无创采集微量粪便样品,常温快递运输至谷禾检测中心,经全自动化样品处理和提取后大规模高通量测序获取菌群基因数据并进行分析解读,凭借全球领先的样本积累和业界独有的人工智能算法实现了基于肠道菌群的疾病预测和系统健康风险评估, 以及肠道菌群,病原物感染,重金属污染以及营养物质和激素代谢水平等在内的综合健康风险提示,并提供精准个性化的健康管理方案。公司成立于2012年,总部位于杭州,拥有优秀的研发团队和独立实验室,经过多年的积累,已完成近6万例临床肠道菌群样本检测,并构建了超过20万各类人群样本数据库。
谷禾健康的服务旨在通过持续不断的研发和改进,大量自动化提升效率,降低检测成本,为广大消费者提供更好更有价值的产品。
联系方式:400-161-1580
微信公众号:谷禾健康
近日, 国际顶级方法学期刊《Science》发表了一篇由瑞士免疫生物研究所的研究成成果:Microbiota-derived peptide mimics drive lethal inflammatory cardiomyopathy(微生物群衍生的肽模拟物可导致致命的炎性心肌病),此项研究表明针对遗传易感性心肌炎患者或通过抗生素进行检查点抑制剂治疗的易感患者的微生物群可能会减轻疾病的严重程度,这可能有助于预防可能致命的炎症性心肌病后遗症。

心肌炎可通过肌球蛋白重链6特异性 T 辅助细胞 (TH)1 和 TH17 细胞的慢性刺激发展为炎症性心肌病。然而,控制心脏特异性 T 细胞心脏毒性编程的机制仍然难以捉摸。
研究人员使用自发性自身免疫性心肌炎的小鼠模型,表明心肌炎向致死性心脏病的进展依赖于由共生拟杆菌肽模拟物在肠道中留下印记的心肌肌球蛋白特异性 TH17 细胞。通过抗生素治疗成功地预防了小鼠的致死性疾病,以及在人心肌炎患者中观察到的拟杆菌特异性 CD4+T 细胞和B细胞反应显著升高,都表明来自共生细菌的模拟肽可以促进遗传易感性个体的炎症性心肌病。通过操纵微生物群抑制心脏毒性 T 细胞的能力,从而将炎症性心肌病转变为可靶向的疾病。
心肌炎期间的急性免疫激活与针对肌球蛋白重链 6 (MYH6) 的自身免疫反应的产生有关。随后的MYH6 特异性辅助性 T 细胞 (TH)1 和 TH17 细胞的慢性刺激诱发炎症性心肌病。
自身免疫性和慢性炎症性疾病的进行性是由遗传易感性和独特的环境条件决定的。炎症性心肌病的易感性可与 HLA-DQB1* 多态性有关,而病原体感染使患者易患主要组织相容性复合体(MHC)II类限制性T细胞,这是由于心肌细胞的死亡和自身抗原的过度呈递导致的。
另外,微生物成分的抗原模拟也可能导致这些疾病。为了评估心脏特异性T细胞是否与微生物组成发生交叉反应,研究人员使用了在其 CD4+T 细胞(TCRM)的 95% 以上的表达 MYH6-特异性T细胞受体的转基因小鼠。
1、自身免疫性心肌炎向扩张型心肌病的微生物依赖性转变。微生物群的存在促进了心脏特异性CD4+T 细胞中 TH17 表型的印记,并有利于髓样细胞在 TCRM 小鼠心肌中的积累。

图A. TCRM 小鼠在 SPF(无特定病原体动物)或 GF 条件下的存活率。所有 TCRM 小鼠都发生了自发性自身免疫性心肌炎,约 50% 的小鼠在 SPF 条件下发展为致命性心肌病,但是缺少共生菌群的 GF 条件下小鼠则会发展为致命性心肌病的结果。
图B. 12 周龄的 SPF 条件和 GF 条件下的 TCRM 小鼠的心脏大体病理。标尺(4mm)
图C. 12 周龄 TCRM 小鼠在 SPF 条件和 GF 条件下的心脏组织学分析。使用 HE 和 EVG 染色。标尺(100mm)
图D. SPF 和 GF 条件下 4 周龄和 12 周龄 TCRM 小鼠的组织病理学疾病严重程度。圆点表示单个小鼠的值,线条表示中间值。ns 表示无显著统计学意义。
图E-G. 在单个小鼠中测定的 SPF 和 GF 条件下 TCRM 小鼠和转基因阴性对照组 (Tg-) 的超声心动图参数,射血分数 (图E),缩短分数 (图F) 和收缩左心室内径 (图G ,LVID sys)。尽管有低水平的心脏炎症,但 GF TCRM 小鼠的心脏功能正常。
图H-Q. 从 4 周 (CoH 4 wk) 或 8 周 (CoH 8 wk) 开始, GF 条件下 TCRM 小鼠被转移到 SPF条件下,并与 SPF 条件下 TCRM 小鼠同住,直到分析。作为比较,使用 GF 或 SPF 条件下的TCRM小鼠。(图H)前瞻性生存分析,箭头指示转移到SPF条件的年龄。(图I)组织病理学疾病进展。心脏浸润细胞计数:CD45+ 细胞(图J),肌球蛋白特异性 CD4+T 细胞 (图K),白细胞介素-17-(图L),IFN-g- 产生心脏浸润 MYH6 特异性 CD4+T 细胞 (图M)。转移后 GF TCRM 小鼠显著加剧心脏炎症。
图N-Q. 用流式细胞术分析心脏浸润髓细胞亚群。(图N)SPF 条件下 TCRM 小鼠心脏中CD11b+ ly6g 细胞的典型t-分布随机相邻嵌入 (t-SNE) 图;(图O)炎症性单核细胞;(图P)MHCII 巨噬细胞;(图Q)CD11b-CCR2- 驻留在心脏的巨噬细胞。共生菌群的存在增加了TH1和TH17 心脏特异性 CD4+ T 细胞的比例,并促进了炎症性骨髓细胞在心脏组织中的积累。
2、MYH6特异性CD4+T细胞与肠道微生物群的相互作用。心脏特异性的CD4+T细胞可以塑造结肠微生物群落,并且不同的细菌群落(在本例中为拟杆菌)提供了可以激活MYH6特异性CD4+T细胞的模拟肽。

图A. 流式细胞术分析来自 SPF 或 GF 条件下 TCRM 小鼠的心蛋白过滤 MYH6 特异性细胞中的整合素 α4β7 和 CCR6。心脏浸润的 CD4+TCRM 细胞在 SPF 条件下的肠归巢受体表达明显高于GF条件。
图B,C. 荧光染料 CFSE 标记的 TCRM 细胞过继转移到 Rag1–/–小鼠后的定位和增殖。(图B)在过继移植后第 3 天对结肠补片进行共聚焦显微镜分析,比例尺(100mm),DAPI(4′,6-diamidino-2-phenylindole)。(图C)MYH6 特异性细胞的增殖。用流式细胞术对指定的器官和指定时间点的荧光染料 CFSE 稀释进行定量。条形表示平均值。nd(不可检测);LN(淋巴结);LP(固有层);MedLN(纵隔淋巴结)
图D,E. 通过 16SrRNA 测序,转基因阴性对照组 (Tg-)、SPF TCRM 和 GF TCRM 小鼠在 SPF条件下 4 周龄时的粪便细菌组成。(图D)主成分分析。(图E)指示的细菌纲和科的相对丰度下的热图。提示 GF TCRM 小鼠获得了 SPF TCRM 小鼠的微生物群落。
图F-H. MYH6 特异性 CD4+T 细胞交叉反应性。(图F)用 MYH6、拟杆菌的 b-gal 肽或阴沟肠杆菌的半胱氨酸水解酶衍生肽进行再刺激后,通过 CFSE- 稀释法测定 TCRM 小鼠的 CD4+ T细胞体外增殖。
图G,H. SPF TCRM 小鼠经 MYH6 或拟杆菌的 b-gal 肽体外再刺激后,心脏和结肠浸润,表达 Vb8 的 CD4+T 细胞产生细胞因子。
图I-L. GF TCRM 小鼠被 B.theta 野生型 (B.theta WT) 或缺失 β-半乳糖苷酶 BT1626 基因(B.theta DB-gal) 的 B.theta 所克隆。对心脏浸润细胞(图I)和对心脏和结肠中 MYH6 特异性细胞因子产生细胞(图J)的流式细胞术分析。带有 B.theta β-gal 的 TCRM 小鼠的重新定殖减少了心肌中免疫细胞的积累,并显著降低了心脏和结肠中肌球蛋白特异性 TH17 细胞的活性。
图K,L. 通过细菌流式细胞术 (K) 和来自单个小鼠的汇集数据来确定 IgA 结合的粪便细菌。SSC,侧边散射;PE,藻红蛋白。在 B.theta β-gal 中缺乏交叉反应表位导致单克隆 TCRM 小鼠的 IgA 反应显著降低。
3、TCRM模型中抗生素治疗对致死性心脏病和免疫反应性的影响。心脏特异性CD4+T细胞与肠道中的微生物成分特异性地相互作用,从而影响系统的免疫反应性。

图A,B. 断奶后小鼠用广谱抗生素组合[磺胺多辛,甲氧苄啶和甲硝唑 (S+T+M) ] 治疗后,TCRM 小鼠的存活率 (A) 和疾病严重性 (B)。在 20 周龄的小鼠中测定疾病的严重程度。圆点表示单个小鼠的值,对应纵轴刻度表示平均疾病严重程度。
图C. 通过定量聚合酶链反应定量粪便中的 B.theta,广谱抗生素不仅降低了粪便样本中的B.theta 水平,而且在过继转移后第 28 天显着改善了心脏病(图D)
图E,F. 接受各种抗生素治疗的 RAG1- /-受体心脏中 CD45+ 免疫细胞 (图E) 和表达 Vb8 的CD4+T 细胞 (图F) 的积累显着减少。
图G. 心脏浸润性MYH6特异性 Vb8+CD4+T 细胞的细胞因子产生。
图H. 用酶联免疫吸附试验 (ELISA) 测定抗 B.theta,B.distasonis,B.vulgatus 和 E.cloacae 的特异性 IgG 反应的热图。抗生素治疗降低了 B.theta 特异性 IgG 抗体水平,但该治疗对针对B.distasonis,B.vulgatus 或 E.cloacae 的 IgG 抗体反应有不同的影响。
4、人类心肌炎患者对拟杆菌和心肌肌球蛋白抗原的免疫反应性。人类的炎症性心肌病至少部分是通过源自肠道微生物群的细菌肽模拟物激活心脏特异性 Th 细胞来驱动的。

图A. AMITIS 队列患者入院时及诊断后不同时间点血清中 B.theta 特异性 IgG 抗体与健康人血清的比较分析。红框和黑框分别表示抗 B.theta 抗体水平高或低的患者。圆点代表个体抗体水平,线条代表平均值, A=吸光度。与健康对照组相比,这些患者显示出明显升高的 B.theta 特异性 IgG 反应。
图B. AMITIS 队列患者在指定时间点的射血分数 (EF%) 和 C-反应蛋白(CRP) 值 (图C)。心肌炎患者的临床改善伴随着抗 B.theta 血清反应性的降低。
图D. 来自 AMITIS 队列的心肌炎患者在初次就诊时具有针对 B. theta 的或低或高 IgG 抗体的综合临床评分,如图A 所示。圆点表示抗-β1-AR 抗体阳性总和的个体临床评分,CRP值≥16和EF≤40,而线条代表中位数临床评分。
图E. AMITIS 队列和健康对照中针对 B.theta,B.distasonis,B.vulgatus 和 E.cloacae 的特异性 IgG 反应的热图。在心肌炎患者和健康对照组之间,IgG 抗体对其他拟杆菌种类的反应性没有差异。
图F. 入院时来自 Micro-DCM 队列患者的血清 B.theta 特异性 IgG 水平。
图G. 抗菌 IgG 反应性的热图。与健康对照组相比,抗 B.theta IgG 抗体明显升高。
图H. 热图代表了计算机预测的 MYH6614-629 肽或 B. theta b-gal11-25 肽与流行的 HLA-DQ 等位基因的结合。
图I. 用人 MYH6614-629 肽或 B. theta b-gal11-25 肽刺激 HLA-DQB1 * 03 健康志愿者(n = 10)或 Micro-DCM 队列患者(HLA-DQB1 * 03,n = 9;其他 HLA,n = 8)后,对外周血单核细胞的 IFN-γ 酶联免疫斑点分析(ELISPOT)与健康对照相比,患者外周血 T 细胞对MYH6和 β-gal 肽的干扰素-g(IFN-g) 反应性显着提高(图4I)。
图J. 具有指示的 HLA-DQB1 等位基因的心肌炎患者和健康人中 MYH6- 或 β-gal IFN-g 产生细胞之间的相关性。圆点代表个体主体。r,Pearson相关系数;r2,决定系数。与健康对照相比,MYH6 和 β-gal 肽反应性之间存在高度显著的相关性,表明心脏特异性 CD4+T 细胞与人心肌炎患者的细菌肽发生交叉反应。
图K,L. 粪便微生物群移植(FMT)后4周,对前 GF 受体小鼠的心脏浸润 CD45+ 免疫细胞(K)和CD4+T细胞(L)进行计数。免疫细胞的积累仅在接受来自 B.theta 阳性患者移植的TCRM小鼠受体的心脏中显著增加。
总体而言,在肠道中引发的交叉反应性 CD4 + T 细胞可进入心肌并加剧由嗜心病毒或亚临床性心肌梗死感染引起的损害。同样,在免疫检查点抑制剂治疗期间对自身和交叉反应性 T 细胞失去控制可能是共享特定 HLADQA1* / B1* 等位基因的患者潜在致死性心脏炎症的原因。因此,针对遗传易感性心肌炎患者或通过抗生素进行检查点抑制剂治疗的易感患者的微生物群可能会减轻疾病的严重程度,这可能有助于预防可能致命的炎症性心肌病后遗症。

全新打造科普小课堂之
——视频系列
生动直观为您呈上
健康科学相关知识
肠道菌群
首先,肠道菌群是什么?
究竟扮演什么样的角色?
人类肠道菌群是如何形成?
与疾病之间又有什么联系?
No. 1

https://v.qq.com/x/page/z0324rg0854.html
来自:腾讯视频, 2016.08.27
肠道菌群建立
人的菌群是如何建立并发展的?
为什么说怀孕母亲
和新生宝宝的微生物组非常重要?
它是如何对母亲和宝宝产生影响?
宝宝又是如何建立自己的肠道菌群?
No. 2

https://v.qq.com/x/page/u3006r5vo0h.html
来自:腾讯视频, 2019.10.10
母体子宫内菌群存在与否?
关于微生物群是何时以及如何建立的,
研究人员提出了两种相反的假设?
详见视频。
No. 3

https://v.qq.com/x/page/f3018t8bxmb.html
来自:腾讯视频, 2019.11.08
肠道菌群的影响
肠道菌群如何影响大脑
改变一个人的精神状态,改善焦虑?
和抑郁症,自闭症有什么样的联系?
关于抗生素的使用是否会影响到
儿童的肠道菌群以及大脑发育呢?
No. 4

https://v.qq.com/x/page/k0893wse9ft.html
来自:腾讯视频, 2019.07.02
肠-脑轴
肠道菌群和你的大脑之间有着密切的关系
它们是如何影响的你的健康?
No. 5

https://v.qq.com/x/page/c0889zmh5um.html
来自:腾讯视频, 2019.06.25
肠道菌群对免疫系统有什么影响?
肠道菌群和癌症之间的关系
肠道菌群受什么影响?饮食?
改变的肠道菌群会引起什么反应?
No. 6

https://v.youku.com/v_show/id_XMTY2MDI3NDY5Ng==.html?spm=a2h3j.8428770.3416059.1
来自:优酷视频, 2016.07.27
食物消化——粪便形成
食物消化过程
前方高能预警
本视频第一视角带你观看
食物进入体内后的运动轨迹
No. 7

https://v.qq.com/x/page/n05309up1jb.html
来自:腾讯视频, 2017.07.27
前方高能预警
粪便形成过程
食物经过消化获取营养后,
剩余的废料和水,
从小肠进入直肠。
怎么形成粑粑排出?
什么情况引起便秘?
。。。

No. 8
https://v.qq.com/x/page/o05305zh7pp.html
来自:腾讯视频, 2017.07.27
肠镜相关知识
肠镜是什么?
仪器是怎么样的?
如何进行肠镜检查?
检查过程需要多长时间?
肠镜有哪些不适?是否会痛?
哪些症状表明需要进行肠镜检查?
来看看你需要了解的所有肠镜知识。
No. 9

https://v.qq.com/x/page/r05303w8449.html
来自:腾讯视频, 2017.07.26
肠道菌群检测
肠道菌群健康检测是怎么做的?
这背后有什么样的技术支撑?
No. 10

https://v.qq.com/x/page/q0870ckhmi3.html
来自:腾讯视频, 2019.05.15
以上几个科普小视频,
看完之后是不是有了更多的认识?
你还想了解什么知识?
可在下方留言互动哦~