 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
冠心病患者的肠道微生物群存在差异,这已成为共识。 研究表明,肠道微生物群与肥胖、糖尿病、血脂异常和高血压有关,这些都是冠心病的危险因素。肠道微生物群通过其代谢产物参与介导胆固醇代谢、尿酸代谢、氧化应激和炎症反应等基本代谢过程,可诱导动脉粥样硬化和冠心病的发生。 干扰肠道微生物群的组成,补充益生菌和粪便捐赠是潜在预防和治疗冠心病的热门研究领域。
研究表明,肠道菌群与肥胖,糖尿病,血脂异常和高血压有关,它们是冠心病的危险因素。
肠道菌群与肥胖
2004年,Bäckhed等人首先报道了肠道微生物群与肥胖有关,因为他们发现肠道微生物群可以调节实验小鼠的脂肪储存。在人和小鼠中都发现了与肥胖相关的相似的肠道菌群。在肥胖的小鼠和肥胖的人类肠道微生物群中,厚壁菌/拟杆菌比例更高。 他们的结果表明,肥胖患者的微生物组从饮食中获取能量的能力更强。 这一发现进一步证实了肠道菌群与肥胖之间的关系。
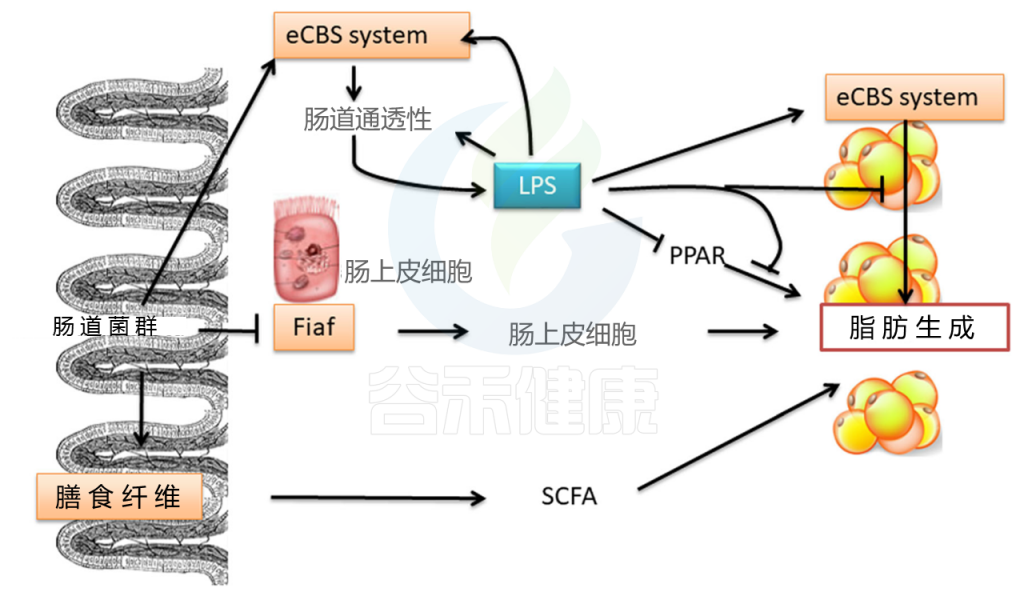
目前的研究表明,肠道菌群可能导致肥胖(图1)。 肠道微生物群会发酵宿主无法消化的物质,将其转化为小分子,例如短链脂肪酸(SCFA),并为宿主提供能量。 肠道菌群抑制禁食诱导的脂肪细胞因子(FIAF)的表达,增加脂蛋白脂肪酶的表达,并促进脂肪细胞中甘油三酸酯的储存(乙酰辅酶A羧化酶[ACC]和脂肪酸合成酶[FAS]是关键的调节剂),因此诱发肥胖。肠道菌群还调节内源性大麻素(CB)系统。
CB调节肠的通透性以及肠粘膜中紧密连接蛋白的定植和分布,从而导致肠通透性增强,脂多糖和炎症反应增加,从而导致肥胖。
图1 肠道微生物群对肥胖的影响

肠道菌群和糖尿病
糖尿病是冠心病的主要危险因素。糖尿病患者的冠心病发病率为55%,是非糖尿病患者的几倍。糖尿病的发病机制与环境因素和宿主遗传有关。 作为重要的环境因素,肠道菌群与糖尿病密切相关。 在人类粪便微生物群的研究中,这些有益细菌与改善胰岛素敏感性和改善糖尿病有关。增加糖尿病风险的细菌是有害的。
对我国345例糖尿病患者肠道微生物DNA的基因组学分析显示,中度菌群失调是2型糖尿病患者正常菌群平衡受到干扰的状态。 为了对2型糖尿病患者的肠道微生物含量进行分析,开展了一个全基因组关联研究(MGWAS),并根据shotgun法对来自345位中国人的肠道微生物DNA进行了两阶段的MGWAS分析。 此外,共生丁酸产生菌数量减少,而条件致病菌的数量增加。
对145名欧洲糖尿病女性的肠道菌群进行的研究也得出了相似的结果:产生丁酸的梭状芽孢杆菌数量减少,而乳酸杆菌属和链球菌属增加。
普氏菌(Prevotella copri)和普通拟杆菌(Bacteroides vulgatus)是支链氨基酸合成与胰岛素抵抗之间联系的驱动因素。 胰岛素抵抗者的血清代谢组的特征是支链氨基酸(BCAAs)含量升高,已证明Prevotella copri可以诱导胰岛素抵抗,加重葡萄糖耐量和增加小鼠BCAA的循环水平。普通拟杆菌可以引起胰岛素抵抗并增加循环支链氨基酸水平,从而介导糖尿病。 许多研究表明,肠道菌群通过影响胰岛素抵抗和胰岛素分泌失调来促进糖尿病(图2)。
图2 肠道微生物群对糖尿病的影响
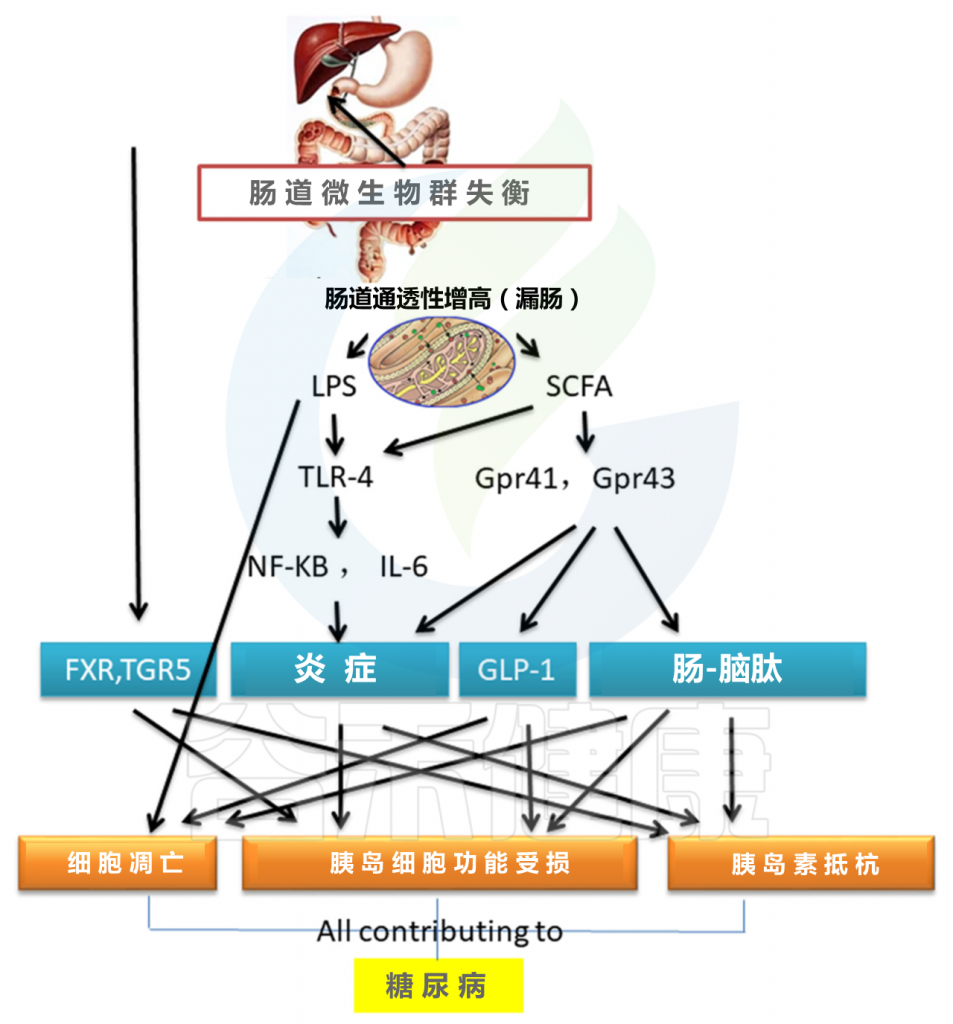

肠道菌群与2型糖尿病之间的重要联系是Toll样受体(TLR)。 肠道菌群的变化通过调节TLR4参与胰岛素抵抗诱导的肥胖。 来自肠道菌群的脂多糖(LPS)通过肠道吸收进入血液循环,这一过程称为代谢性内毒素血症。TLR4缺失对胰岛素抵抗的保护作用与其对代谢性内毒素血症信号转导的抑制有关 。LPS可以促进胰岛B细胞的凋亡并减少胰岛素分泌。
肠道菌群失衡会导致短链脂肪酸(SCFA)失调,这在调节肠道菌群,维持体液平衡,为肠上皮提供能量,抑制炎症因子形成以及促进肠黏膜修复方面起着重要的作用。增加的SCFA可以诱导TLR4信使RNA表达显着增加,并增强NF-κB与白介素(IL)-6结合。
SCFA与G蛋白偶联受体41/43结合也可影响抗炎和脑肠肽激素分泌功能,导致胰岛素抵抗和胰岛细胞功能障碍,并导致胰岛素样生长因子-1(GLP-1)分泌障碍(例如GLP-1可降低血糖和胰岛细胞凋亡)。
此外,肠道菌群的结构和体内稳态的变化会改变胆汁酸的转化,从而导致异常的TGR5和法尼醇X受体(FXR)信号通路。 这种变化会导致代谢紊乱,最终导致糖尿病。
肠道菌群和血脂异常
血脂异常与冠心病密切相关。饮食,肥胖,激素,基因和其他因素会导致血脂异常。
肠道菌群的生理和代谢活动对于调节和维持人类平衡的脂质代谢至关重要。厚壁菌和拟杆菌属是影响血脂改变的主要细菌菌群。 肠道菌群的脂质代谢产物(例如胆碱,三甲胺氧化物[TMAO]和甜菜碱)会促进动脉粥样硬化并增加患心血管疾病的风险。肠道菌群会影响血清甘油三酯和高密度脂蛋白胆固醇的转化。
三种机制很可能导致血脂异常。
首先,肠道菌群产生胆汁盐羟化酶,将结合的胆汁酸转化为二级游离胆汁酸。二级游离胆汁酸可通过G蛋白偶联受体调节肝脏和脂质的代谢,肠道菌群紊乱可导致胆汁酸分泌异常,从而引起血脂异常。
其次,肠道菌群将胆碱和肉碱从宿主转化为三甲胺(TMA),而TMA在肝脏中转化为TMAO。 TMAO可通过影响胆固醇的运输和代谢以及胆汁酸水平而引起血脂异常和动脉粥样硬化斑块。
第三,SCFAs可以抑制肝脏脂肪合成酶的活性,调节血液和肝脏中胆固醇的分布,从而在降低血清3-酰基甘油和胆固醇水平方面发挥作用。
细菌异常会导致SCFA分泌不足和血脂异常。 益生菌可以降低血清胆固醇并增加高密度脂蛋白含量,这表明正常的肠道菌群间接地参与了血脂水平的降低。
肠道菌群与高血压的关系
高血压是导致心血管疾病的关键因素。 本研究表明,除了公认的高血压病因(例如交感神经系统过度活跃,肾素-血管紧张素-醛固酮系统活化以及水和钠潴留),肠道菌群也与高血压密切相关(图3)。
图3 肠道微生物群对高血压的影响
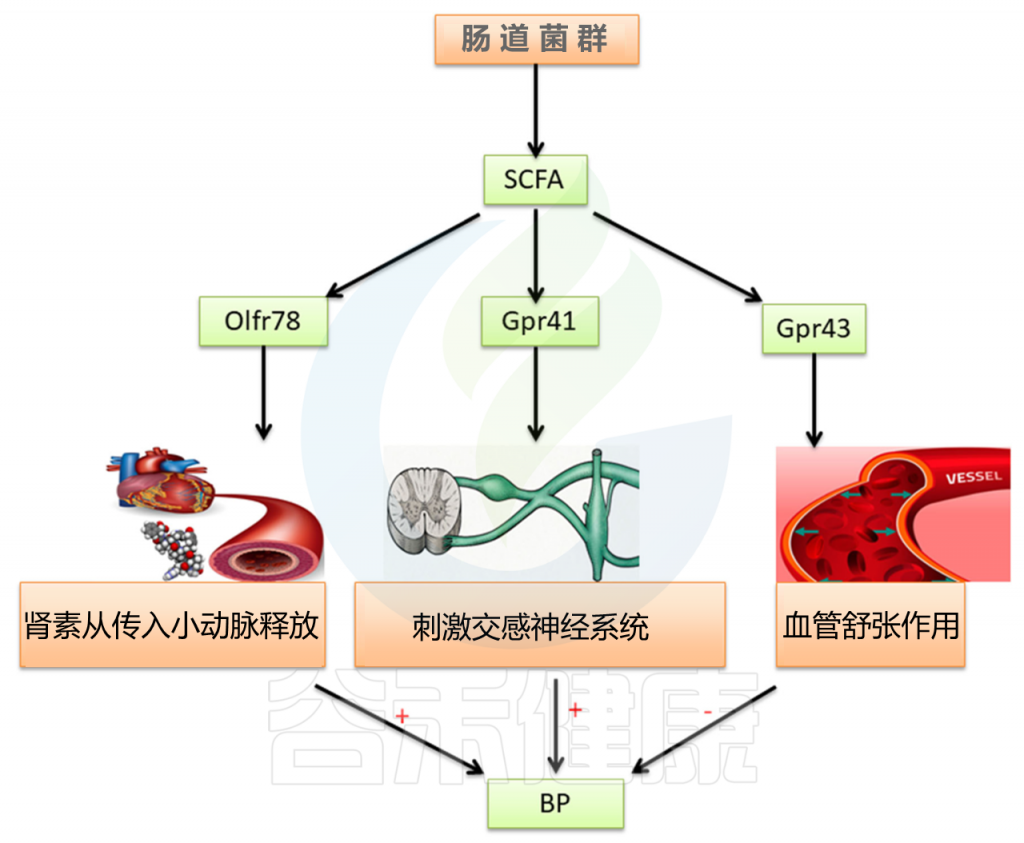

对原发性高血压大鼠粪便细菌的分析表明,细菌数量和多样性明显降低。厚壁菌和拟杆菌的比例增加,SCFA产量降低。
SCFA可通过与嗅觉受体78(OLFR78),G蛋白偶联受体41(GPR41)和G蛋白偶联受体43(GPR43)结合来调节血压。
SCFA在维持肠上皮屏障功能中发挥作用。它们可以减少炎症反应,直接影响免疫细胞,减少交感神经活动,从而改善高血压。 此外,一项研究还报道了肠道菌群可以影响血管活性激素(如5-羟色胺,多巴胺和去甲肾上腺素)的形成,从而在调节血压中发挥作用。
最近的一项临床研究对高血压患者的粪便菌群进行了分析,并发现了类似的结果。普雷沃氏菌和克雷伯氏菌的比例显著增加。将健康对照组和高血压组的肠道菌群移植到GF小鼠体内。用高血压患者粪便细菌移植治疗的小鼠血压显著升高。这表明肠道微生物群与宿主的血压有关,并进一步证实不平衡的肠道微生物群是高血压的重要致病因素。
肠道微生物群参与调节基本代谢过程,如胆固醇代谢、尿酸代谢、氧化应激和炎症反应,通过其代谢物,可导致动脉粥样硬化和冠心病的发展。
冠心病患者肠道菌群的变化
在2012年,Karlssion等人使用全基因组测序来确定肠道菌群变化与动脉粥样硬化性心脏病之间的可能联系。与健康人群相比,Collinsella菌的数量增加,而 Rothia 和 Eubacterium 菌数量减少。 使用宏基因组技术进行的进一步功能分析表明,冠心病患者肠道菌群中编码肽聚糖合成的基因增加,而编码八氢番茄红素去饱和酶的基因(与血清中β-胡萝卜素减少相关)减少。
2016年,Emoto等人使用末端限制性片段长度多态性(T-RFLP)和16S rRNA来研究冠心病患者和健康志愿者之间肠道菌群的差异。结果表明,在冠心病患者中,成熟的乳杆菌数量显着增加,而拟杆菌(双歧杆菌和普氏杆菌)显着下降。此外,厚壁菌/拟杆菌的比例明显增加。 该研究还发现,不使用抗生素的冠心病患者肠道菌群中乳酸菌的比例显着增加,而拟杆菌的比例显着下降。
2017年,这些作者在两项临床试验中再次验证了这些结果。首次将肠道菌群结构的变化直接鉴定为冠心病的诊断标记。
TMAO在冠心病中的作用
肠道菌群产生的代谢性TMAO是心血管疾病的关键机制(图4)。 食物中的胆碱(例如,磷脂酰胆碱,胆碱,L-肉碱和其他三甲胺[TMA])通过肠道微生物酶复合物来产生TMA。 然后TMA进入门静脉循环,并被宿主的肝酶进一步代谢,从而产生TMAO。
图4 TMAO对冠心病的影响
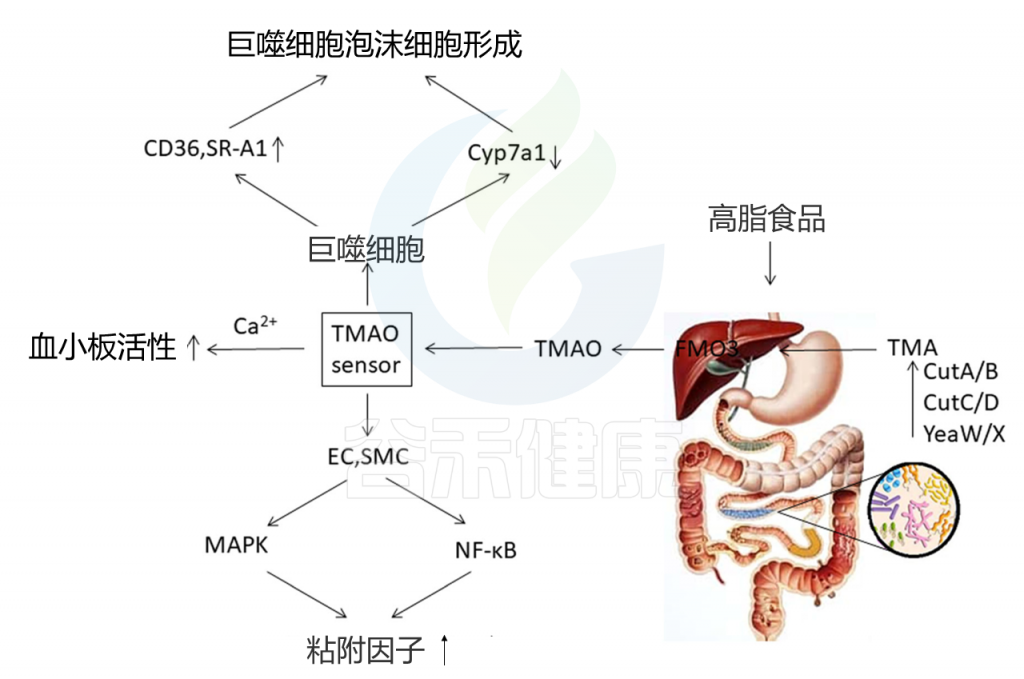

当前的研究表明,血浆TMAO水平与冠心病风险高度相关。临床研究还表明,TMAO增加了患心血管疾病的风险,并增加了急性心肌梗塞,心源性休克和死亡的发生率。
一项为期3年的研究(涉及4007名参与者)进行了选择性冠状动脉造影术。 结果表明,空腹血浆TMAO水平在独立于传统心血管危险因素的心脏事件预测中发挥作用。 这项研究表明,最高四分位数患者中,TMAO水平较高的患者恶性心脏事件的发生率比最低四分位数患者高2.5倍。 而且,TMAO的风险比显着高于低密度脂蛋白的风险比。校正传统的危险因素和肾功能后,TMAO水平仍是恶性心血管事件的独立预测因子。
Cyp7al是胆汁酸合成中的主要酶。Cyp7al的表达上调可以帮助扩大胆汁酸库,增加胆固醇的运输,并最终减少动脉粥样斑块的形成。TMAO可以降低Cyp7al的表达,抑制胆固醇的运输,引起胆固醇在细胞中的积累,并导致形成泡沫细胞。
TMAO还可以诱导血小板反应过度,因此成为动脉粥样硬化的危险因素。 TMAO与血小板之间的相互作用可能通过改变血小板依赖性钙信号传导而促进血小板高反应性并增强体内血栓形成。据报道血小板高反应性是心血管事件的危险因素。
最近的证据表明,TMAO可以在数分钟内迅速向细胞发送信号。 在内皮或平滑肌细胞中,TMAO可以迅速诱导丝裂原活化的蛋白激酶和NF-κB活化,并引起下游粘附分子的上调。 TMAO水平升高还与SMAD 3 蛋白的磷酸化增加有关。 SMAD 3是转化生长因子β(TGF-beta)途径中的关键信号。 在动物模型中,TMAO促进血管炎症并诱导主动脉内皮细胞活化和粘附蛋白上调。这些作用都是急性冠状动脉综合征的关键机制。
肠道菌群通过尿酸对冠心病的作用
血清尿酸水平可能是冠心病的独立危险因素。 尿酸在体内具有氧化特性。 血尿酸水平升高会导致血尿酸增加氧自由基,氧化应激,血管内皮功能障碍,炎症反应以及动脉粥样硬化的发展。
肠道菌群通过调节尿酸代谢来影响氧化应激过程。 大肠杆菌含量越高,尿酸分解越多。 冠心病患者血清尿酸水平升高与肠道菌群功能障碍有关。高尿酸血症也是动脉粥样硬化的危险因素。血清尿酸水平升高会增加氧自由基的产生,引起氧化应激,并引起内皮功能障碍。UA水平与循环类胡萝卜素成负相关。
与年龄,性别,总能量,蛋白质和维生素摄入量无关,循环尿酸水平与总类胡萝卜素(尤其是α-胡萝卜素,番茄红素,叶黄素,玉米黄质和硒)呈负相关。 类胡萝卜素作为抗氧化剂,具有抗心绞痛的作用。一项研究分析了动脉粥样硬化患者和正常对照组的肠道菌群结构,发现动脉粥样硬化患者的肠道菌群富含编码肽聚糖生物合成的基因,而正常对照组的肠道菌群富含类胡萝卜素编码基因。肠道微生物疾病会导致含有合成类胡萝卜素基因的细菌减少,从而降低血液中的类胡萝卜素水平并削弱抗氧化作用,从而促进动脉粥样硬化的发展。
肠道菌群失衡与冠心病的发病机制有关。 这是一种有效的靶向疗法,但缺乏与冠心病和心肌梗塞患者干预相关的数据。 Lam等人使用抗生素抑制肠道菌群,并观察这些变化对急性心肌梗死(AMI)小鼠预后的影响。 研究结果表明肠道菌群变化与心肌梗死之间存在联系,并证明益生菌补充剂可以减少心肌梗死率。 Gan等研究了给予益生菌以减轻心肌梗塞后心肌肥大的小鼠。作者确定,干扰肠道菌群结构并改善急性心肌梗死的预后可能成为AMI的新疗法。
在当前的临床实践中,益生元和益生菌是调节肠道菌群失衡的主要治疗工具。 为了确定益生菌是否可以改变心肌梗塞后患者的预后,研究人员建立了大鼠心肌梗死模型,并在大鼠饮用水中随机给予GR-1或安慰剂和益生菌。 16S rRNA用于对大鼠盲肠微生物组成进行测序,两组之间无明显差异。 但是,心钠素的基因表达有所不同。接受GR-1的动物的左心室肥厚较轻,血液动力学参数更好。 停止使用益生菌后的四个星期,两组仍然存在差异,这表明在治疗结束后GR-1的作用仍然存在。
益生菌可以用作预防冠心病和改善心肌梗死患者预后的潜在疗法。 益生元作为发酵底物,可以增强有益肠道菌群的活性,并有效改善血糖控制和血浆脂质分布。此外,益生元还可以改善肠道通透性,减少代谢性内毒素血症,减轻炎症,缓解糖尿病患者对葡萄糖不耐的症状。
研究人员认为,粪便捐赠是一种治疗由于微生物引起的肠外疾病的新疗法。研究表明,健康人向代谢综合征男性患者捐赠粪便样本后,在6周后就会增加胰岛素敏感性和丁酸水平。 但是,该研究并未证实改善肠道菌群结构是否可以预防冠状动脉粥样硬化或降低AMI发生率。 需要大样本的前瞻性队列研究来进一步探讨肠道菌群与冠心病之间是否存在因果关系。
最近,研究人员发现DMB可以抑制TMA的产生。 抑制TMA的产生可降低小鼠的TMAO水平和动脉粥样硬化斑块形成,且无不良反应。 此外,在一些天然安全食品中也富含DMB,例如醋,红酒,初榨橄榄油和葡萄籽。因此,可以通过食用DMB胆碱来调节潜在的动脉粥样硬化来防止TMA产生。
本文介绍了肠道菌群与冠心病之间的关系,以及目前对这种关系的研究。 已经达成共识,冠心病患者的肠道菌群存在差异。 无菌小鼠模型和菌群基因组学技术的出现可以帮助确定肠道菌群与冠心病之间的关系,并将肠道菌群研究的准确性提高到菌株水平。
展望未来,早期发现和抑制冠心病发展,并进行干预调节是预防冠心病发展的关键目标。
【参考文献】
Liu Huagang,Zhuang Junli,Tang Peng et al. The Role of the Gut Microbiota in Coronary Heart Disease.[J] .Curr Atheroscler Rep, 2020, 22: 77.
Belkaid Y, Hand TW. Role of the microbiota in immunity and inflammation. Cell. 2014;157(1):121-41.
CM O, K R. Heartbeat: the gut microbiota and heart failure. Heart. 2016;102(11):811 TMAO increases the risk of cardiovascular disease
Richards EM, et al. The gut, its microbiome, and hypertension. Curr Hypertens Rep. 2017;19(4):36
Pedersen HK, Gudmundsdottir V, Nielsen HB, Hyotylainen T, Nielsen T, Jensen BAH, et al. Human gut microbes impact host serum metabolome and insulin sensitivity. Nature. 2016;535(7612):376–81

谷禾健康
辅助化疗可导致约三分之一的女性体重增加,葡萄糖耐量下降和高血压。这些事件的潜在机制尚未定义。这项研究评估了乳腺癌和妇科癌症辅助化疗患者的微生物组与体重增加之间的关联。近日发表在《BMC Medicine》上题为“The intestinal microbiome, weight, and metabolic changes in women treated by adjuvant chemotherapy for breast and gynecological malignancies”的一项小样本研究评估了乳腺癌和妇科癌症辅助化疗患者的微生物组与体重增加之间的关联。
方法:在开始辅助治疗之前招募患者。前瞻性收集有关肿瘤治疗,更年期状态和抗生素使用的数据。如果在研究期间接受抗生素治疗,则将患者排除在外。在治疗前和治疗结束后4-6周测量体重和身高。体重增加定义为体重增加3%或更多。治疗前收集粪便样本。并进行16S rRNA基因可变V4区扩增测序。数据使用QIIME 2进行处理和分析,并使用DADA2通过q2-dada2对读取进行了去噪和聚类。每个样品的读数均> 9300。使用Swiss Webster无菌小鼠进行了患者的粪便移植实验。
结果:招募了33名患者;其中9人增加了基线体重的3.5–10.6%。在治疗后体重增加的妇女的治疗前微生物组的多样性和分类学与对照妇女明显不同。与使用对照妇女的粪便样本进行移植的小鼠相比,从体重增加的患者的样本中进行粪便微生物菌群的移植诱导了无菌小鼠的代谢变化。
结论:肠道化学组的组成及其多样性与乳腺癌和妇科恶性肿瘤辅助化疗后体重增加有关。小鼠FMT实验表明,微生物组介导了化学疗法的不良代谢作用。值得进一步研究微生物组的预测价值,以及其对化疗后体重和代谢变化的作用机理。

图一:化疗后体重增重的妇女的肠道微生物组与对照组妇女的肠道微生物组成不同

图二:对GF小鼠使用化疗后体重会增加的妇女的预处理样本进行FMT,与不会增加体重的妇女的FMT相比,FMT会引起显著体重等指标的变化。

图三 对GF小鼠使用化疗后体重会增加的女性预处理样本的FMT,与不会增加体重的女性(对照)相比,会引起显著的微生物变化。
参考文献:Uzan-Yulzari, A., Morr, M., Tareef-Nabwani, H. et al. The intestinal microbiome, weight, and metabolic changes in women treated by adjuvant chemotherapy for breast and gynecological malignancies. BMC Med 18, 281 (2020). https://doi.org/10.1186/s12916-020-01751-2
谷禾健康
越来越多的证据表明,肠道微生物组会影响大脑的发育和功能。肠脑连接可能是由胃肠道中产生的各种微生物分子介导的,这些微生物分子随后会渗透到许多器官,包括大脑。
动物模型研究确定了从肠道细菌传播到大脑的分子线索,这些线索可能影响神经功能和/或神经发育和神经退行性疾病。
本文描述了已知或疑似神经调节活性的细菌代谢产物,定义了从肠道菌群到大脑的信号传导机制,并讨论了肠道细菌分子可能对特定脑细胞发挥的直接作用。 许多发现是最近才发现的,本“观点”中描述的发现在很大程度上是新颖的,尚待广泛验证。
肠道微生物群(肠道菌群)包含细菌或其他微生物,包括病毒,真菌,原生生物和古细菌,它们永久或短暂地栖息在下胃肠道,特别是小肠和结肠。尤其是结肠,数量最多并且拥有高度动态的代谢活动,微生物与宿主之间的分子不断双向流动,其范围从肠道延伸到整个体内。
这好比一个化学“工厂”,它会影响孕产妇的环境,并在产前使胎儿受到微生物信号的影响。
出生后,肠道菌群迅速建立并在在生命的头两年趋于稳定,从而使宿主与共生微生物之间形成终生且非常密切的关系。个体之间的多样性水平和微生物群的特定成员之间可能存在很大差异,并且可以根据年龄,遗传,健康状况,饮食和生活方式在个体内发生变化。
胃肠道包含许多不同类型的细胞紧密相邻,并且在管腔侧暴露于包含饮食成分和肠道微生物群的外部环境中。肠道组织内含有约70%的人体免疫细胞,不断地采集微生物成分保持体内平衡。
此外还有完全位于肠道组织内的丰富的神经元(108个内在神经元)以及连接肠道与脊髓和大脑的神经元沿着肠道进行密集的神经支配。
迷走神经是肠道与大脑之间的主要神经元连接,包括一束神经元,它们直接在肠道组织(和其他器官)与脑干之间发送和接收信号。这些信息进一步传递到整个大脑。
通过研究比较了传统定植小鼠(也称为特定的无病原体小鼠)与完全没有微生物接触(无菌小鼠)的小鼠,肠道微生物群影响大脑发育和功能的证据开始出现。
未经抗生素治疗的动物表现出神经营养因子水平的改变,例如脑源性神经营养因子(BDNF)以及异常的神经肽和神经递质水平,所有这些反过来可以影响关键的神经发育过程,如神经发生,突触发生,突触成熟和修剪,以及神经活动。
在特定的无病原体和无菌小鼠之间,大脑的总体形态和体积也有所不同,尤其是在杏仁核,海马和丘脑区域,在各种细胞类型的细胞水平上都观察到了形态变化,包括神经元,少突胶质细胞和在无菌和抗生素条件下的小胶质细胞。
微生物暴露还会改变宿主的神经系统状况,并导致信号传导途径发生变化。例如,在无菌和经抗生素处理的小鼠中,下丘脑-垂体-肾上腺轴失调,这会导致糖皮质激素反应过度。
这些下丘脑-垂体-肾上腺轴的变化与一些测试模式中的行为模式有关,这些测试模式对社交活动,焦虑,认知功能和抑郁行为进行了建模。具有某些健康问题和健康对照的个体之间的肠道微生物群不同。肠道微生物群落的失衡与各种神经系统疾病和心理疾病有关,尽管还需要确定其中哪些因果关系是相关的。
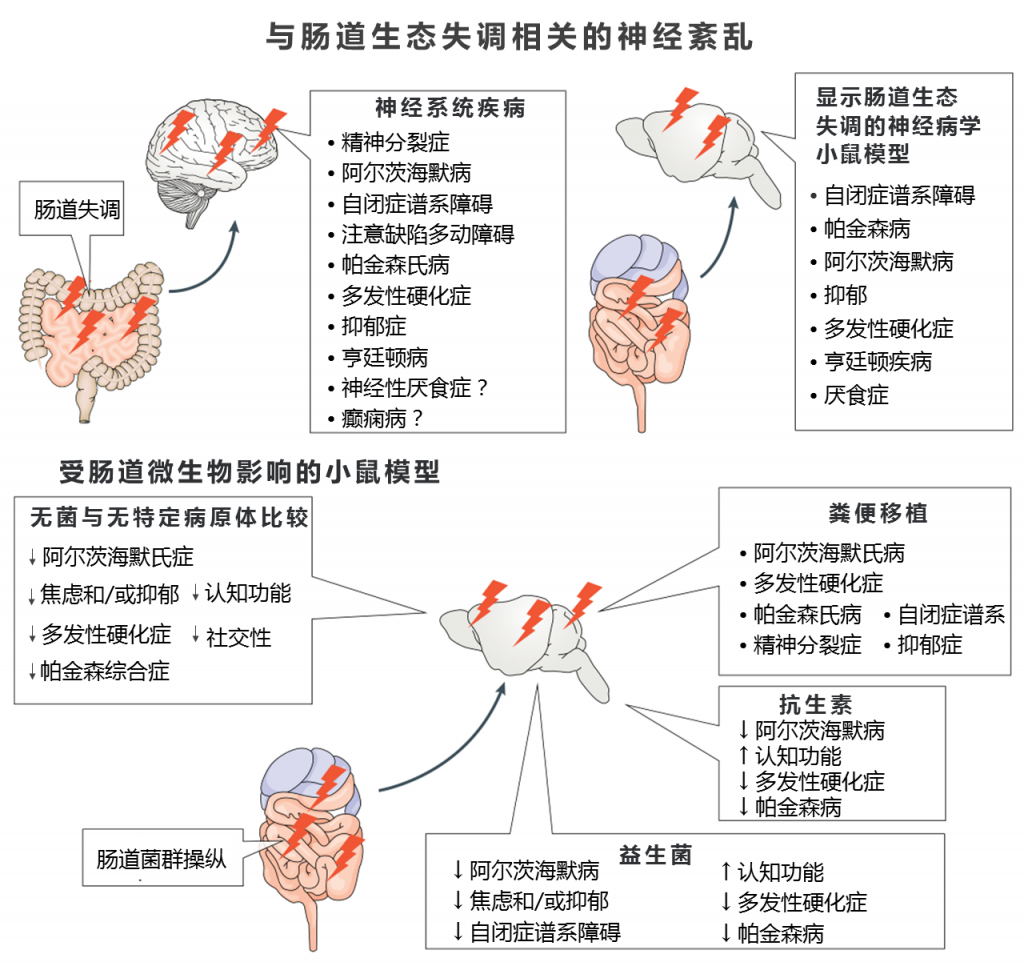

在自闭症,多发性硬化症,焦虑和抑郁症,认知缺陷的小鼠模型中,更成熟的细菌操作(例如用特定细菌治疗或用抗生素消灭细菌)已显示出改善疾病症状的作用。 同样,在帕金森病,自闭症,多发性硬化,焦虑和抑郁的人类模型中,细菌治疗对人脑活动的某些影响已可以通过在功能磁共振成像中观察到变化。 因此,越来越多的证据表明神经系统状态可能会受到肠道微生物及其副产物的影响。
已经描述了改变的微生物组谱与大脑疾病之间的各种关联,并且微生物群或特定细菌物种对行为,认知和神经变性的贡献不断建立。
此外,肠道微生物组具有惊人的遗传多样性,从人类肠道微生物种群中测序出超过2200万个基因,并且拥有庞大的独特酶库,能够产生和修饰多种化学结构基团。 我们基于这些基础发现来描述和概念化化学信息的解码,这些化学信息如何介导肠道-脑轴的观察效应,从而为理解和治疗多种神经系统疾病提供希望。
以下各节将按肠道细菌和微生物代谢产生的生物活性分子(下图)转化的前体来源(从新细菌,宿主或饮食中获取的来源)来描述类别。 还提供了对特定分子作用的简要描述。
肠道菌群代谢物
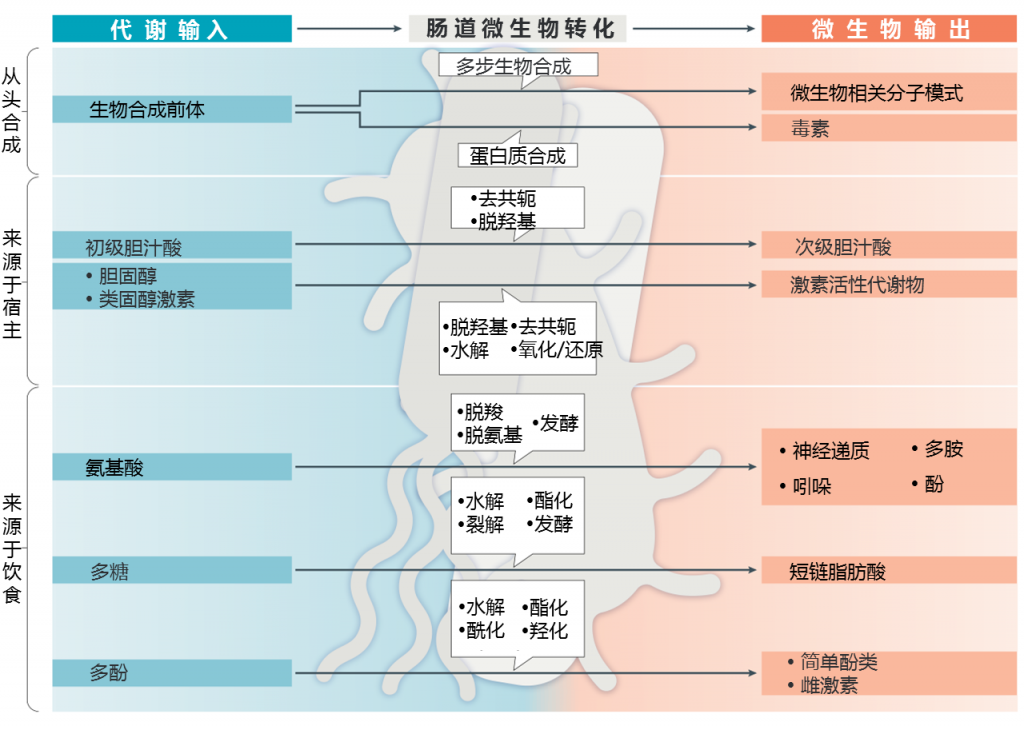

微生物会产生许多蛋白质,维生素和结构成分,这些物质或有益于宿主或对宿主产生负面影响。其中许多是通过多步生物合成途径产生的,而哺乳动物则没有这种途径。这些分子维持细菌功能,例如信号传导,结构成分和能源,尽管有些分子,如蛋白质毒素,主要以其影响宿主系统的作用而为人所知。
微生物相关分子模式(MAMP)
微生物相关的分子模式(MAMP)是微生物细胞保存完好的成分,它们在整个身体中会被宿主(包括脑部)敏锐地发现。MAMPs对所有种类的微生物的结构完整性和基本功能都起着至关重要的作用,是由核苷酸、脂类、碳水化合物和肽等不同化学基团组成的复杂分子。
无菌小鼠中缺乏MAMPs会导致免疫和神经发育不完全,但是如果宿主对MAMPs的反应仍然升高或不受控制,它们的存在会诱发与各种神经系统疾病有关的急性或慢性炎症。
两个主要的细胞表面成分MAMP似乎足以改变大脑发育和功能的是肽聚糖和脂多糖(LPS)。
肽聚糖是几乎所有细菌细胞壁的结构成分,最近被证明可转移到发育中的大脑中,影响基因表达和社会行为。
LPS是革兰氏阴性细菌的另一种普遍存在的表面分子,已在大鼠大脑中与其受体共定位。LPS注射会诱发小鼠疾病行为,认知障碍和急性抑郁样行为,并影响胎儿大脑发育。
此外,在自闭症,抑郁症,帕金森氏病和突触核病模型中,慢性或急性暴露于MAMPs可促进疾病相关症状的发生。
这些保守的微生物分子可能通过免疫介导的途径来调节哺乳动物的行为,它们通过大脑中表达的受体直接感知,或者激活全身炎症和细胞因子的产生,从而导致神经功能的改变、神经元应激或细胞死亡。
MAMPs的存在,结构和免疫调节活性随细菌种类的不同而变化,因此肠道菌群的变化可能会影响宿主对特定MAMPs的暴露水平和反应水平,进而影响后续的健康状况和行为。
毒 素
一些细菌产生的蛋白质毒素会对宿主神经系统产生负面影响。这些毒素在一般结构上通常是相似的,有多个亚基可以激活细胞表面或细胞内受体,并且可以由条件致病菌产生,它们可能在共生菌群中存在很长一段时间而不会在肠道或大脑中引起明显的疾病。
已知几种梭状芽胞杆菌会产生多种毒素,例如致命毒素,毒素B,ε毒素和肠毒素,它们可以通过全身循环到达大脑,破坏并穿过血脑屏障(BBB),抑制神经递质的释放和 /或降低从肠道到海马的目标神经元活力。
Staphylococcus spp.和 Bacillus spp.产生毒素,葡萄球菌肠毒素和蜡样芽孢杆菌毒素Cereulide,刺激迷走神经,向大脑发送信号并诱发呕吐和疾病行为。
其他种类,如沙门氏菌和大肠杆菌产生一类称为淀粉样蛋白的蛋白质,这些蛋白质在肠内聚集,并可能以朊病毒样疾病模式扩散到大脑,并可能导致神经退行性变,例如帕金森氏病和阿尔茨海默氏病。
随着营养物质的吸收和废物的分泌,持续的代谢流量通过肠上皮屏障得以维持。微生物群暴露于许多宿主分子并与其发生化学相互作用。肠道-大脑相互作用证据最多的两类宿主衍生代谢物是胆汁酸和类固醇激素。
胆汁酸
初级胆汁酸是宿主胆固醇代谢的产物,在脂肪代谢和能量代谢中(甚至在大脑中)也起着主要作用。
循环中的胆汁酸可以穿过血脑屏障,并可能直接作用于大脑中的受体,或者通过激活肠受体而具有更间接的作用,导致成纤维细胞生长因子和胰高血糖素样肽1等信号的释放,从而影响多个脑区或迷走神经的神经元活性。
许多肠道细菌物种通过脱水酶的脱羟基作用、氨基酸基团与胆盐水解酶的解偶联作用以及其他酶机制的进一步降解作用,将初级胆汁酸修饰成次级胆汁酸,从而帮助维持胆固醇稳态。
细菌修饰改变了胆汁酸在膜和核受体上的信号传导,并改变了它们的溶解度和循环。
胆汁酸的存在和清除的调节与大脑的正常功能有关,因为这些途径中的缺陷会导致小鼠和人类出现许多神经表型,例如脱髓鞘,运动功能障碍,神经炎症,癫痫发作和学习障碍。
细菌对胆汁酸结合和水平的影响可能正在影响这些脑表型。 例如,在帕金森病,阿尔茨海默病,多发性硬化症,酒精依赖和自闭症的人和小鼠模型研究中已观察到细菌相关胆汁酸水平的改变,已知胆汁酸会影响下丘脑—垂体—肾上腺轴。
实际上,在阿尔茨海默氏病患者的大脑中检测到了细菌产生的所有次级胆汁酸,并且次级胆汁酸比例的增加与它们的认知障碍和大脑影像学改变有关。
一些胆汁酸甚至被用作神经系统疾病的潜在药物,如肌萎缩性侧索硬化症和中风。肠道中细菌的存在会改变整个宿主的胆汁酸水平,肠道菌群中的群落变化会影响胆汁酸的水平和性质。这些变化可能是有利的,也可能是有害的。
胆汁酸的微生物代谢与潜在神经功能之间已知的最机械的联系可能是微生物群直接增加的脱氧胆酸水平足以诱导肠道肠嗜铬细胞中主要神经递质血清素的产生。
肠道5-羟色胺水平可能以未知的方式影响大脑功能,因为海马体中5-羟色胺的水平受小鼠微生物群的影响,但尚不清楚肠道与大脑5-羟色胺水平之间的任何进一步联系。 生物对胆汁酸的操作与脑功能之间的因果关系仍有待明确定义。
类固醇激素
类固醇激素信号对于正确的大脑结构发育,认知,记忆,决策和性行为至关重要,并且在防止社交孤立和抑郁样表型中起着重要作用。 每天产生的这些激素中,有多达15%在肠道中可以检测到,因为它们在体内循环,使它们与微生物群接触。
肠道菌群可以通过不同的降解和活化途径改变活性和非活性类固醇水平的比例来影响某些激素的水平。 两个研究最好的类别是雄激素和雌激素。
在许多情况下,可以结合激素排泄,细菌可以通过水解酶(例如β-葡萄糖醛酸糖苷酶(GUSs)和β-葡萄糖苷酶)去除结合基团,水解酶可重新激活该分子,从而持续循环并具有活性。
微生物群还可以将胆固醇转化为雄激素,激活前雄激素,并将睾丸激素代谢为其他有效的雄激素。人体粪便样品中的雌激素在氧化和还原反应中被分解。
实际上,“雌激素组”一词的产生是为了描述能够代谢雌激素的大量肠细菌基因。绝经后妇女肠道微生物群和类固醇激素水平的变化相互关联,但是,尽管宿主激素的微生物代谢潜力很大,但对脑功能的直接影响仍未经测试。
如果受微生物影响的雌激素确实具有直接的神经学作用,则它们可能具有神经保护作用,因为雌激素对小胶质细胞具有抗炎作用,并且由于微生物群落改变而引起的雌激素水平降低似乎会增加认知障碍和慢性炎症。
微生物可能足以满足这些表型的需要,因为某些类固醇激素水平可以通过微生物粪便移植在小鼠之间转移,但是需要进一步的工作将肠道微生物群产生的激素代谢物直接与神经系统疾病联系起来。
肠道菌群的组成在很大程度上取决于寄主的饮食投入。进餐的频率和食物的类型会影响被细菌代谢的底物的数量,这些细菌会大量吸收和减少,最终影响所产生的下游细菌代谢物的类型和数量。
此外,大量证据表明氨基酸,复杂植物多糖和多酚等微生物代谢产物对大脑产生影响。
氨基酸
微生物编码遗传机制以产生许多氨基酸,其中一些可以促进循环宿主水平。 但是,很可能微生物通过氨基酸水平对中枢神经系统的任何影响都是通过脱氨和脱羧途径对膳食氨基酸的修饰而发生的。
细菌氨基酸代谢的副产物包括氨,短链脂肪酸(SCFA),单酚,吲哚衍生物,神经递质,有机酸,气态化合物和胺。 那些最有可能影响脑功能的物质如下所述。
肠道细菌编码多种基因途径,这些途径将芳香族氨基酸酪氨酸,苯丙氨酸和色氨酸代谢成一大串下游产物,其中许多是神经递质。 酪氨酸代谢为酪胺,然后代谢为两种儿茶酚胺,多巴胺和去甲肾上腺素。 无菌小鼠肠中的酪胺也诱导5-羟色胺的产生。 去甲肾上腺素是由肠道细菌产生的,但人们对此尚不清楚。
然而,已显示多种细菌在体外合成去甲肾上腺素至毫摩尔范围。 由微生物群产生的儿茶酚胺可能足以改变行为,因为用抗生素治疗的小鼠对可卡因的多巴胺信号传导和行为影响更为敏感。 这些神经活性分子是否影响局部肠道神经系统,甚至间接影响大脑,是研究的一个活跃领域。
色氨酸被微生物群分解为吲哚衍生物以及色胺和犬尿氨酸代谢产物,所有这些都具有神经活性属性。 其中一些似乎仅是由微生物群产生的,因为直到细菌定殖之前在无菌小鼠中都无法检测到它们。其中许多可穿过血脑屏障,因此源自肠道的循环色氨酸代谢产物可有助于大脑中的水平。
吲哚衍生物(如吲哚丙酸)具有抗氧化性能,使其成为阿尔茨海默氏病的诱人靶标,而其他衍生物(如吲哚酚硫酸盐)在慢性肾脏疾病模型中诱发神经炎症。
Kynurenine代谢物作用于神经元谷氨酸受体,并影响记忆,焦虑样和压力样行为。实际上,在饮食色氨酸(以及所有色氨酸微生物代谢物)耗尽后,用于模拟抑郁样表型的行为测试中,无细菌小鼠与无特定病原体小鼠的反应不同。
除神经递质外,酪氨酸还可以被微生物群代谢为其他简单的酚类,例如4-乙基苯酚或对甲酚。 这些代谢物被宿主迅速硫酸化为4-乙基苯基硫酸盐(4EPS)或对甲酚基硫酸盐。
在患有自闭症和精神分裂症的小鼠模型以及患有自闭症的儿童样本中,4EPS升高,且注射入野生型小鼠中引起焦虑样表型。 对-甲酚硫酸盐已被确定为自闭症幼儿的潜在尿液生物标志物,并且与社交和抑郁样行为小鼠模型中的少突胶质细胞标志物相关,尽管这些发现目前仍具有相关性。
受肠道微生物影响的另一种氨基酸是主要的兴奋性神经递质谷氨酸,它被细菌的谷氨酸脱羧酶系统代谢,成为主要的抑制性神经递质GABA。
GABA可以被细菌进一步代谢,通过GABA氨基转移酶和琥珀酸半醛脱氢酶进行琥珀酸化。此外,还已经确定了影响宿主GABA系统的微生物群产生或受其影响的代谢产物,例如γ-谷氨酰胺基氨基酸,其降低的水平是饮食诱发的癫痫发作模型改善的介质。
已证明,产生GABA的细菌可减轻小鼠模型中的抑郁样和焦虑样行为,工程产生GABA的菌株足以降低对大鼠内脏痛的敏感性。产生GABA的微生物群与患者的抑郁呈负相关,并且据推测大脑中谷氨酸/ GABA回路的异常是焦虑症,重度抑郁症,双相情感障碍,精神分裂症和自闭症的关键。
精氨酸可被微生物群代谢为四种多胺,它们存在于所有哺乳动物细胞中,并在细胞生长和分化的许多一般过程中发挥作用,并通过谷氨酸受体调节突触可塑性和记忆形成。 这些多胺从精氨酸到胍丁胺依次产生,然后是腐胺,然后是亚精胺,然后是精胺。胍丁胺是大脑中α2-肾上腺素能和咪唑啉受体的配体。
多胺系统的失调与情绪障碍,抑郁症和阿尔茨海默氏病有关,并且多胺已被研究作为抑郁症和焦虑症行为,认知能力下降和药物依赖性的临床前治疗药物。 由于大多数哺乳动物神经递质是从氨基酸前体衍生的,因此我们推测,细菌将氨基酸转化为影响行为的分子可能代表了神经科学中新的微生物内分泌学重点,值得进一步研究。
复杂的植物多糖
由复杂碳水化合物多糖制成的膳食纤维不会被宿主消化并到达结肠,在结肠中,肠微生物会通过肠道微生物将其与各种糖苷水解酶和多糖裂解酶一起发酵,形成毫摩尔水平的SCFAs。
SCFA主要是丁酸,丙酸和乙酸,是结肠上皮细胞的丰富能量来源,剩余的钙进入体循环,可能随后影响神经系统的功能和发育,视情况而定会变好或变坏。
例如,SCFA足以加重无菌帕金森病小鼠模型中的运动症状,但它们改善了实验性中风小鼠模型的恢复能力。 醋酸盐已被证明可穿越小鼠的血脑屏障,并减少进食行为。
由复杂碳水化合物多糖制成的膳食纤维不会被宿主消化并到达结肠,在结肠中,肠微生物会通过肠道微生物将其与各种糖苷水解酶和多糖裂解酶一起发酵,形成毫摩尔水平的SCFAs。SCFA主要是丁酸,丙酸和乙酸盐,是结肠上皮细胞的丰富能量来源,剩余的钙进入体循环,可能随后影响神经系统的功能和发育,视情况而定会变好或变坏。
例如,SCFA足以加重无菌帕金森病小鼠模型中的运动症状,但它们改善了实验性中风小鼠模型的恢复能力。 醋酸盐已被证明可穿越小鼠的血脑屏障,并减少进食行为。
多 酚
多酚包含数千种至少包含一个酚基团的植物衍生分子,目前正在广泛研究作为神经疾病的治疗剂。
大多数多酚通常很难被吸收,直到被肠道菌群转化为可利用的生物活性代谢产物。 细菌水解,酰化和/或酯化后,在这些代谢物重新进入胃肠道或到达其他周围组织之前,通过甲基化,硫酸化,羟基化或葡糖醛酸化来修饰宿主。
口服母体多酚后,大脑中酚类代谢物的水平会发生变化。在大脑中检测到的口服多酚治疗的特定细菌代谢物,例如3-羟基苯甲酸和3-(3′-羟基苯基)丙酸,能够抑制标志性淀粉样蛋白聚集并减缓阿尔茨海默氏病的病理生理学进展。
多酚还通过减少炎症并通过代谢产物(例如槲皮素-3-O-葡萄糖醛酸和麦维京-3-O-葡萄糖苷)调节突触可塑性,来预防应激诱导的抑郁样行为。
带有阿魏酸酯酶基因的肠道微生物将一种多酚阿魏酸释放到循环中。 阿魏酸的施用刺激了皮质酮治疗的抑郁症小鼠模型的神经发生,并且在阿尔茨海默氏病和脑缺血的小鼠模型中具有保护作用。
葡萄籽提取物和白藜芦醇等治疗中的多酚显示出有望治疗阿尔茨海默病,帕金森病和tauophathies小鼠模型的神经病理学和认知缺陷,但还需要进一步用纯多酚进行测试。
最近,在帕金森病模型中,表明植物来源的表没食子儿茶素没食子酸酯可以预防由特定肠道细菌引起的运动症状。 一些多酚是植物雌激素,被肠道细菌代谢成雌马酚和肠内酯衍生物。植物雌激素代谢物可以是雌激素受体的激动剂或拮抗物,并且可能对经典雌激素受体配体激活的神经保护途径有影响,尽管该结构类别很大且是异质的,对大脑的直接影响仍有待确定。
其他代谢物
肠道中的微生物GUS酶可去除标记代谢物以被宿主排泄的葡糖醛酸基团。结果,微生物群恢复了原始分子并促进了该分子重新摄取回到血液。已证明该过程直接调节本文所述的许多外源和内源化合物的水平。
肠道菌群还产生维生素B和K,以及独特的脂质代谢物,例如共轭亚油酸,羟基脂肪酸和鞘脂,其中一些在宿主健康和疾病中显示出生物学活性,并且已知由 特定细菌。 由于大脑发育过程中需要维生素B和K,大脑中的高脂质含量以及脂质在信号传导途径中的重要性,未来的工作可能会阐明微生物脂质和维生素代谢产物与脑功能的联系。
对细菌代谢产物的产生和功能的研究已经确定,从肠道到大脑都会发生活跃的化学信息传递。 其他细菌分子可能具有尚未定义的神经活性特性,包括来自肠道微生物群的数千种最近鉴定(但仍未表征)的短肽中的任何一种。 鉴于鉴定和表征微生物群产生的小分子和肽谱是一项相对较新的尝试,可能会继续发现更多的神经活性微生物代谢产物。确定作用机制可能导致各种健康应用。
肠道菌群与大脑之间的通讯管道包括迷走神经的激活,内分泌细胞(包括肠嗜铬细胞)的刺激,免疫介导的信号传导以及肠道衍生代谢产物从循环系统向大脑的运输。 认为所有由肠-脑轴组成的路径都被微生物群所影响,以影响大脑的活动和行为,并且通过它们中的任何一条发出的信号都可能与其他路径交织在一起。
迷走神经激活
迷走神经直接沿着胃肠道将肌肉和粘膜层连接到脑干,并且是建立良好的信号通路,影响进食,焦虑样,抑郁样和社交行为。
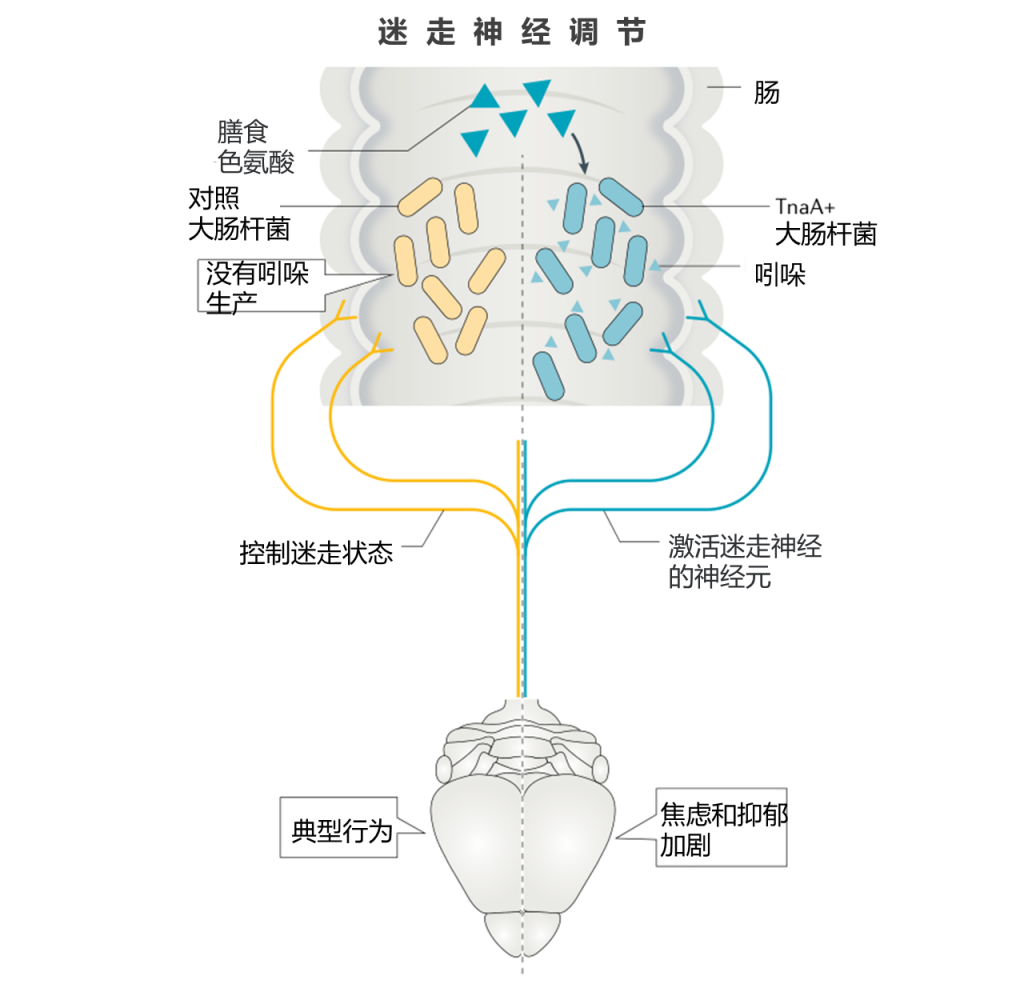

肠道病原体和益生菌通过迷走神经元的激活影响这些行为,然后改变下游的神经活动,包括脑中BDNF,GABA和催产素信号的改变。 这些反应在迷走神经切断迷走神经后被消融,但是介导这些作用的特定细菌代谢物仍不清楚。
最近的一项研究确实通过迷走神经信号传导来测量特定代谢物的作用,尽管也可能涉及其他信号传导途径。在这项工作中,将大鼠转化为能转化的大肠埃希氏菌菌株饮食中将色氨酸与TnaA色氨酸酶或吲哚生产缺陷的突变大肠杆菌转化为吲哚。 暴露于肠道吲哚的大鼠表现出增加的焦虑样和抑郁样行为并激活迷走神经元。
肠嗜铬细胞刺激
肠嗜铬细胞是肠壁中的内分泌细胞,可响应持续的肠道信号而产生并分泌人体90%的血清素。血清色素的肠嗜铬细胞产生会影响其循环水平,并具有直接或间接影响大脑活动的潜力。
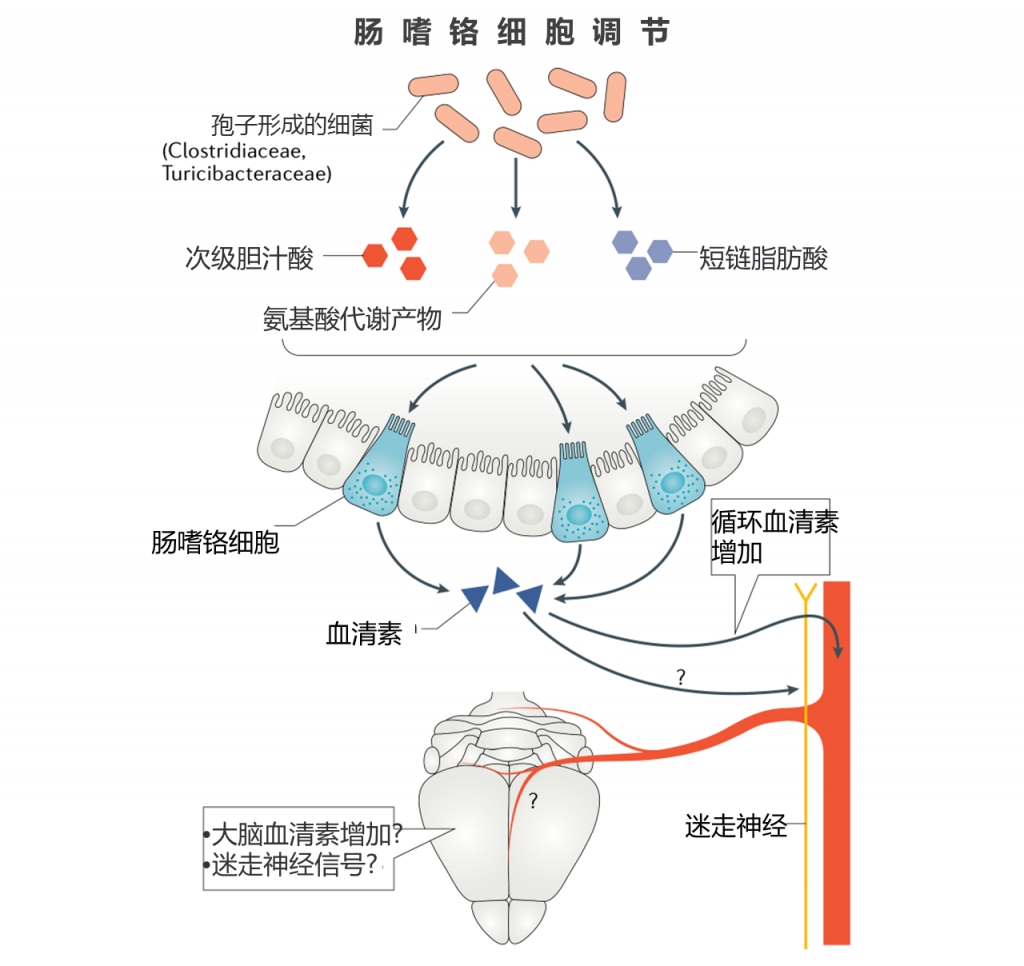

通过双歧杆菌属菌的益生菌治疗,已显示出在抑郁症小鼠模型中性能的提高。在一项研究中,该研究同时观察到大脑中5-羟色胺水平的增加以及体外肠嗜铬细胞中5-羟色胺前体的分泌增加。 然而,细菌处理,潜在的5-羟色胺调节与抑郁样表型之间没有机械联系。结肠肠嗜铬细胞确实表达各种微生物代谢物的受体并对其作出反应,包括MAMP,SCFA,芳香族氨基酸代谢物和次级胆汁酸。
最近鉴定出的一种细菌亚群可以极大地促进肠嗜铬细胞合成5-羟色胺生物合成的细菌,是孢子形成细菌,如梭状芽胞杆菌。
已证明这些细菌在体内产生的代谢产物足以在体外产生5-羟色胺诱导活性,包括α-生育酚,丁酸酯,胆酸盐,脱氧胆酸盐,对氨基苯甲酸酯,丙酸酯和酪胺。 还通过暂时的肠内给药单独测试了一个子集,并且脱氧胆酸盐,α-生育酚,对氨基苯甲酸酯和酪胺都足以诱导肠嗜铬细胞分泌5-羟色胺。
有趣的是,最近的研究表明,口服选择性5-羟色胺再摄取抑制剂可提高肠道5-羟色胺的生物利用度并用于治疗抑郁症,可能依赖迷走神经的激活来改善小鼠的抑郁样行为。 这支持了5-羟色胺的肠嗜铬细胞产生的潜力,可能通过在发育和急性环境中与其他已知的肠脑信号传导途径相交,将信号传递到肠外并到达大脑。
免疫介导的信号传导
肠道菌群为神经免疫系统的成熟提供了线索,而在发育过程中这些线索的丢失导致该系统终身功能失调。但是,由于肠道菌群变化和肠道通透性增加而导致的慢性暴露于炎症也可能会导致各种神经系统疾病。
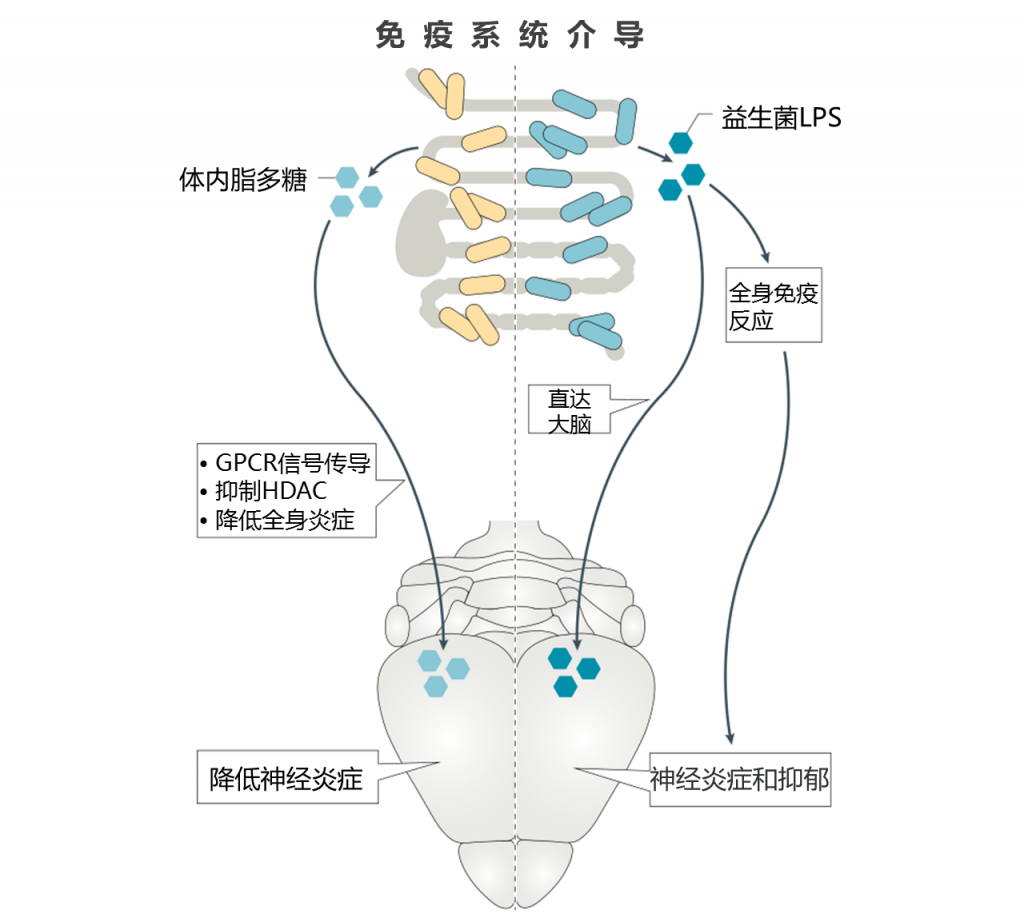

用作MAMP的细菌代谢物(例如LPS)已被用于在ASD和精神分裂症模型中激活免疫系统,并在小鼠中诱发抑郁样症状。
其他肠道代谢物可能会减轻慢性炎症。 例如,SCFA通过激活GPCR和抑制HDAC活性而与免疫系统密切相互作用。 高纤维饮食会导致较高水平的SCFA,从而导致较低水平的循环促炎细胞因子。
SCFA激活GPCR(FFA2和GPR109a)可以抑制炎症信号通路,SCFA(尤其是丁酸盐)对HDAC的抑制作用可以降低体内炎症。
这些例子可能代表了微生物分子对神经免疫信号的潜在影响的初步发现。
代谢物直接转移到大脑
肠道中产生的许多微生物代谢产物可以不同水平和速率进入全身循环。 一个例子是多酚代谢物组,最近的研究表明,在血液或尿液中几乎检测不到母体多酚,但由多酚前体产生的细菌代谢物进入循环的水平足以发挥生物学作用。
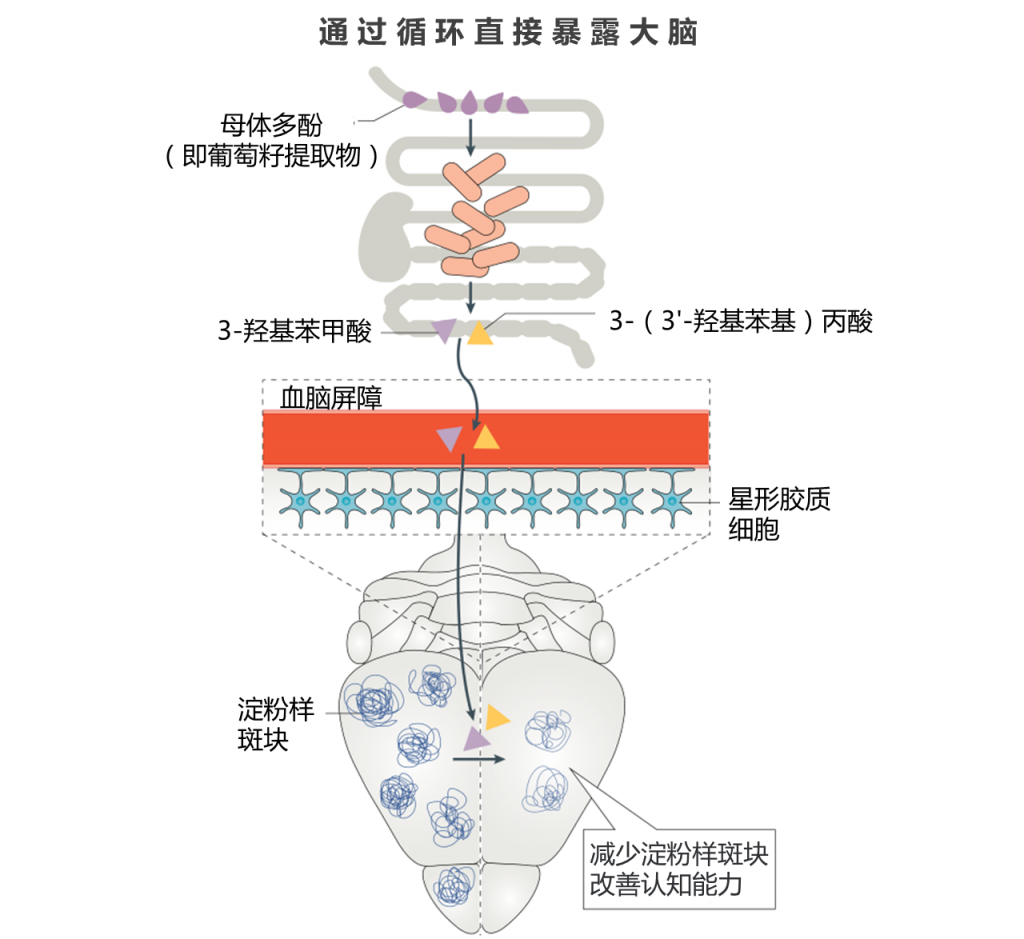
实际上,大脑似乎是某些多酚类微生物代谢产物的主要目标。尽管仍然缺乏体内证据,但体外培养物显示多酚代谢物能够穿越BBB模型系统并对神经元培养物发挥保护作用,主要是通过减少炎症反应。
此外,在大鼠的血液和脑中测定了口服多酚治疗的衍生物,发现它们可减少神经毒性聚集物的聚集并促进神经可塑性。
尽管建立了良好的肠道与大脑的联系,但通过每个导管工作的细菌分子的清晰机械细节仍然有限。 了解从肠道到大脑的微生物组信号的方式可能会提供对针对胃肠道靶标的合理药物发现平台的见解,这可能会克服当前将药物输送到大脑靶标的挑战。
研究继续建立在对肠脑轴的基础上,以探索大脑中哪些细胞受到特定细菌代谢产物的直接或间接影响。 需要大量工作来系统地证明源自肠道细菌的这些化学信使会影响特定脑细胞的发育或功能。 在这里,我们总结了肠道微生物代谢产物可能影响大脑细胞的现有证据。
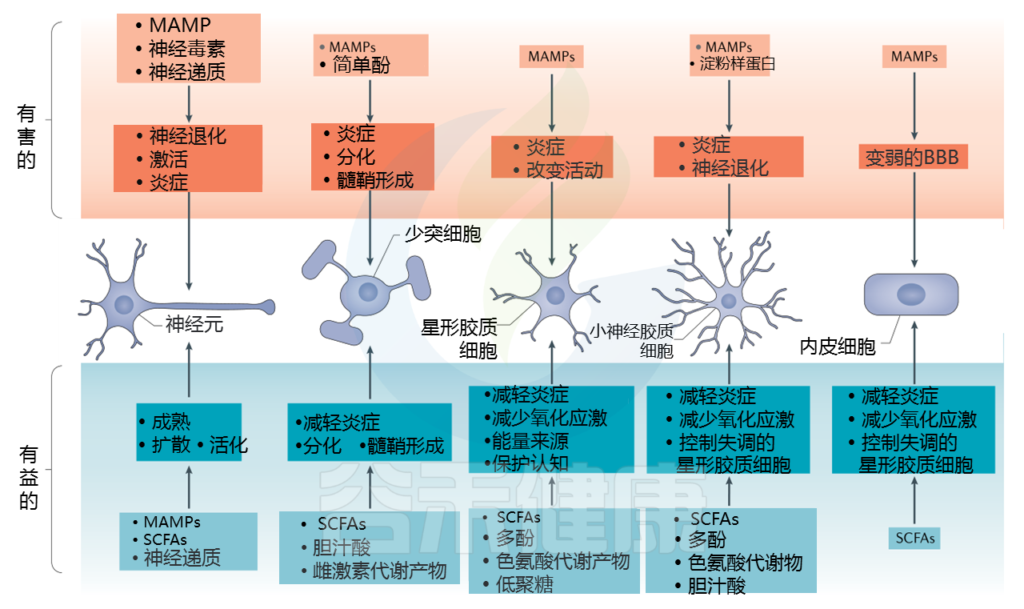
神经元
作为大脑控制行为的主要信号传导细胞,神经元从本质上讲可能是受此观点中描述的每种代谢物影响的最终靶标。 发挥影响迷走神经的细菌群落作用的所有未知代谢物都可能激活神经元。
更具体地说,神经毒素是细菌分子影响神经元的一个明显例子。 一些神经毒素由微生物群落的共生成员产生,并发挥局部或中枢神经系统的作用,从而使神经元失调或杀死神经元。
微生物群还产生或诱导神经递质及其前体的产生,包括5-羟色胺,肾上腺素,GABA,组胺,乙酰胆碱,谷氨酸和多巴胺,它们可显着影响肠,迷走神经,周围神经和中枢神经元中兴奋性和抑制性神经传递的平衡。
神经元还表达模式识别受体,并且这些受体的激活已显示出可以调节神经元分化,增殖和轴突生成以及神经炎症。 其中一些可能是由于宿主配体引起的,但是在大脑中也检测到MAMPs,例如肽聚糖,并且可能是激活受体,例如TLR2,PGLYRP2或NOD1,它们通过类似的机制在神经元中表达。
神经元也受SCFA的影响,因为乙酸进入大脑并激活下丘脑中的神经元。 最后,体外筛选鉴定了肠道微生物产生的神经活性分子,例如群体感应分子,这些分子会影响神经元的活力,形态,分化和炎症反应。
尽管后者需要在体内验证,它们说明了神经元与微生物代谢产物之间存在大量界面的可能性。
星形胶质细胞
星形胶质细胞为其他细胞提供支持并修复大脑中的损伤。 代谢物,包括特定的寡糖和多酚,SCFA和色氨酸代谢物,可能会影响星形胶质细胞的功能。
色氨酸代谢物调节星形胶质细胞中的芳烃受体,并通过降低其炎症状态和改变它们与小胶质细胞的相互作用来影响其活性。
多酚代谢产物和纯短链脂肪酸(例如丁酸)对星形胶质细胞具有体外影响,并已显示出可减少神经炎症和氧化作用。
大脑中的这些细胞将SCFA乙酸盐用作能源。 寡糖和多酚(例如来自植物巴戟天的多酚和多酚)已被细菌代谢成SCFA和其他脂质衍生物,已显示通过星形胶质细胞功能对阿尔茨海默氏病具有保护作用。星形胶质细胞还表达G蛋白偶联的胆汁酸受体1(TGR5),其可以被胆汁酸激活,从而导致神经炎症的减少,并且可能与肝性脑病有关。
少突细胞
少突胶质细胞产生隔离神经元轴突的髓鞘,,即使在整个成年期,两种细胞类型之间也会发生动态串扰。
代谢产物对少突胶质细胞增殖,分化和功能的影响可能对神经系统健康产生广泛影响。 在脱髓鞘疾病多发性硬化症的小鼠模型中,治疗性肠道菌群的操作已经成功,并伴随着与减轻的疾病症状相关的代谢组学谱的改变。
有一些证据表明,这种改善可能是由于炎症性LPS水平降低,SCFA升高以及胆汁酸改变所致,尽管尚不清楚是否存在对少突胶质细胞的直接活性或它们是否间接受益于炎症减轻。在体外,细菌性酚类代谢物对甲酚可能直接损害少突胶质细胞的成熟和髓磷脂的产生。
已知影响少突胶质细胞分化和髓鞘形成的另一类分子是雌激素分子。 微生物确实修饰了许多雌激素代谢物,但尚未证明这些代谢物的体内微生物产生与少突胶质细胞之间的结论性联系。
内皮细胞
血管内衬有内皮细胞,内皮细胞是负责维持血脑屏障BBB的主要细胞类型,BBB在很大程度上决定了分子进入大脑的速度。 微生物代谢产物对血脑屏障通透性的调节可极大地改变药物,宿主分子和其他肠道代谢产物的吸收,但是这种机制的具体例子仍然难以捉摸。
例如,细菌代谢物(例如来自某些细菌物种的LPS)以剂量依赖性和细菌应变依赖性的方式增加体内渗透性,并且无菌小鼠的BBB似乎比常规小鼠泄漏。 LPS刺激内皮细胞也会导致脑海绵状畸形,进而导致癫痫发作和中风。 已经显示SCFA通过激活内皮细胞中表达的SCFA受体来降低BBB的通透性,并同时增加紧密连接蛋白的表达,紧密连接蛋白将这些细胞密封成成功的屏障。
小胶质细胞
大脑中的主要免疫细胞称为小胶质细胞,因此,它是许多与神经炎症相关的损伤的罪魁祸首,如帕金森病,阿尔茨海默病。
因此,来自MAMP的促炎信号会诱导成熟并产生细胞因子的小胶质细胞,而通常来自多酚,SCFA和胆汁酸代谢产物的抗炎信号会通过小胶质细胞来降低大脑的氧化应激。 但是,这些信号中的某些信号对小胶质细胞的影响是复杂的,因为SCFA和其他微生物信号可能会加剧帕金森氏病无菌小鼠模型中的症状。
另一项最新研究发现,微生物色氨酸代谢物(如硫酸吲哚-3-)可控制小胶质细胞的活化,进而改变星形胶质细胞的行为。
尽管迄今为止,微生物组对细胞的特定作用的例子都很少,而且还进行了表面描述,但这些基础研究仍是揭示肠道微生物组-脑轴的潜在神经元回路,大脑区域和系统级连接的关键步骤。
对肠道微生物群研究的日益重视可能会导致生物医学的变革性进步。 识别和表征特定微生物和微生物群落的原因或贡献,应该是肠道微生物组-脑研究的主要重点。直接和间接化学信号传递的各种途径并不互相排斥,某些代谢物可能会对通向大脑的多个导管产生影响。随着微生物分子信息及其肠脑信号传导途径的特殊作用不断被发现,开发新的治疗原理和方法的潜力不断增加。
随着神经疾病中肠—脑连接的机制研究深入,微生物组和神经科学研究的合并为理解肠脑轴的基本“线路”和功能的提供了可能,并且还为人类健康可采取的行动提供了潜在的机会。
参考文献:
Needham Brittany D,Kaddurah-Daouk Rima,Mazmanian Sarkis K,Gut microbial molecules in behavioural and neurodegenerative conditions.[J] .Nat Rev Neurosci, 2020, undefined: undefined.
相关阅读:

谷禾健康
微生物需要能源和细胞构成的材料。他们还需要使用液态水来达到自然条件,并且细胞损伤率要低于修复。当缺乏资源和自然条件时,微生物通常会进入某种形式的休眠状态(例如,通过停止细胞分裂,减慢新陈代谢速度或形成内生孢子),直到它们再次生长。例如,在晚上,营养养分等待太阳回来。在冬季,土壤微生物会等待温度升高。导致结核病等疾病的微生物可以保持多年休眠状态,等待抗生素或免疫系统轰炸的停止。
但是更长的时间尺度呢?与多细胞生命不同,微生物可以在极为广泛的条件下生存,并且在没有细胞分裂的情况下可以获取各种资源来维持细胞功能。这意味着它们有可能休眠数月或数年以上。从理论上讲,没有理由说微生物无法依靠维持能量生存数百年或数千年,甚至更长的时间,而几乎没有细胞增殖。由于缺乏对微生物休眠间隔时间的理论限制,因此出现两个问题:
(i)是否有证据表明存在休眠期很长的生物?
(ii)这么长的等待时间有什么好处?
确定微生物生理学的唯一方法是将其与自然环境隔离,并在实验室中进行培养。许多处于休眠状态的种群具有充当“侦察兵”的单个细胞,它们会在随机时间退出休眠状态,以定期采样以恢复有利于生长的条件。这些侦察兵中的一些可以被赋予生长因子并进行培养。但是,依靠营养生长来研究能够长期休眠的微生物存在两个问题。
第一个问题:
首先是来自许多环境的DNA的直接测序表明大多数微生物细胞在系统发育上不同于任何人曾经培养过的细胞。这可能是“平板计数差异法(the great plate count anomaly)”背后的驱动力,它认为许多样本中不到1%的细胞可以轻松培养。重要的是要注意,并非所有环境都会受到极高的平板计数异常的影响。经历快速环境变化或具有丰富养分的环境,例如人的肠道和最近被火山灰淹没的湖泊通常以易于培养的细胞为主。
然而,对于许多条件稳定的环境,尚未培养的微生物进化支配着总细胞的丰度,并且存在巨大的平板计数异常现象。有充分的证据支持以下观点:这些群体尚未屈服于培养的原因是他们专心于慢速生长,在正常的实验室时间尺度上不容易加速生长。长期以来,人们认识到,如果将它们培养数月,可以从天然样品中获得更多的培养物。事实上,在培养耐培养演化支方面,最近最大的进展是在生长非常缓慢的生物体中。
高丰度的海水微生物(如Nitrosopumilus sp. ,Pelagibacter ubiquitans 和 Prochlorococcus sp. )一天或更长时间会翻倍,这意味着它们需要一个月或更长时间才能达到稳定阶段。
海洋沉积物微生物的培养和富集需要更长的时间,其中 Atribacteria 在5天内增加一倍,Lokiarchaeota 则在14-25天内增加一倍,而未培养的甲烷菌(ANME-2)在7个月内会增加一倍。这些培养物发展得如此缓慢,以至在人类时间尺度上几乎不可能进行详细的生理评估和基因操作,即使它们是经过技术培养的。
第二个问题:
依靠培养物来研究寿命极长的微生物的第二个问题是,营养状态下的生理状态可能与微生物以低代谢活动生存数千年时的生理状态大不相同。因此,虽然培养对于确保生物体的生理至关重要,但它不能用于研究每种情况下每种类型的超慢生长微生物。

因此,必须将培养工作与直接研究天然样品中的超慢生物结合起来。然而,在自然样本中识别等待不频繁事件的多年休眠微生物是具有挑战性的。对于人类时间尺度的观察者而言,这种超慢速生物似乎无所作为。打个比方,加州海岸线是在地质时间尺度上不断搅动的岩石,但对人类来说,它足够稳定,可以在上面建造房屋。这些房子必须坚固到足以承受偶尔的地震,但在数百万年的旋转,淹没和挖掘中,它们将无法承受土地重新定向的影响。
幸运的是,现代海洋沉积物提供了一个天然实验室,可在其中研究长期休眠的微生物,而无需加快实验室培养中微生物的生长或等待数千年才能发生变化。通过将养分浓度的变化与沉积物的沉积速率进行比较,可以在很长时间内量化细微的地球化学变化。由此产生的反应-运输模型表明,向海洋沉积物微生物群落的总能量传递速率通常比支持实验室培养所需的能量传递速率低很多数量级。这意味着这些微生物群落没有足够的能量来维持稳定的细胞分裂速度。
进一步的证据表明,在海底沉积物中埋藏在数米以内的微生物群落基本上处于非生长状态,这是因为即使种群正常生长也会发生突变或生态竞争的时间尺度之后,很少出现遗传上的新变化。这些生存的微生物群落的周转时间已被计算为几十年。这并不一定意味着细胞每30年经历一次传统的复制和细胞分裂。生物质量的改变可以通过逐渐取代所有的细胞物质来实现,脂质被脂质,核苷酸被核苷酸取代,从而在大约半个世纪的时间里,所有分子都被替换了。实际的细胞分裂事件可能需要更长的时间,或者可能永远不会发生,直到资源恢复,这可能需要数亿年。
这些微生物细胞几十年、甚至几百年、几千年或几百万年都没有复制,是因为它们在等待一个事件在这些时间尺度上发生吗?
另一种可能是,这些微生物不适应超长休眠,而只是在它们最终被俯冲到大陆之下并在俯冲带被压碎或烫伤致死之前,碰巧发现自己处于某种休眠状态数百万年。
尽管必须坚持多年静止生计的偶然选择,但有一些证据表明,在这种困境中发现自己的生物在进化上已准备就绪。随着河口沉积物深度的增加,微生物表达的酶对地下可用的底物具有更高的特异性,这表明它们具有一定的代谢活性以适应地下休眠。地下微生物还具有针对超慢代谢和细胞分裂的生理适应性。
此外,在地下发现的微生物进化枝不仅是持久存在的浮游动物群落的残余物,而且在被掩埋时不会消失。相反,它们不同于海水中发现的那些。
因此,在海洋沉积物中发现的生物虽然不能在那里真正生长,但很可能已经适应了在海洋环境中生活。但是,即使它们在长期休眠过程中经过了充分的调整和“快乐”,它们也必须在某个地方生长——自4.5亿年前地球开始以来,这些细胞就不可能一直处于休眠状态。
然后,我们必须问第二个问题:他们还在等什么?如果冬天在土壤中遇到休眠的微生物,我们可以假定它渴望在夏天变成营养状态。对于潜伏了数千到数百万年的深埋海洋沉积物生物来说,这相当于什么?他们的夏天是什么版本?
为了确定哪些事件导致长期休眠的生物体恢复其营养状态,我们必须假设一个进化框架,其中长期休眠是一种适应性的方法,最终在进化中获得回报。回报是有一天休眠的微生物会“醒来”,并产生后代,当这些资源可用时,它们首先获得这些资源,从而获得生存收益。
该模型的证据来自已在固定阶段研究多年的实验室培养。当在饥饿条件下将静止培养数月或数年的大肠杆菌培养物与新鲜生长的大肠杆菌培养物竞争时,预先适应的培养物会胜过新鲜生长的培养物,这种特性被称为静止期的生长优势。如果生活在海洋沉积物中的微生物也是如此,那么如果它们有机会竞争贫乏的资源,它们就会比更新鲜的生物有优势,就像习惯了匮乏的瑜伽士在饥荒中与贪吃的人竞争一样。
对长期休眠的适应可能是由生长资源的变化所驱动的,这些生长资源随相当长的时间尺度的周期变化而变化。由于海洋沉积物微生物处于数百至数百万年的休眠状态,因此它们很可能“等待”在这些时间范围内发生的事件。地质过程发生在足够长的时间范围内。在较短的时间范围内,微生物可以适应多年的洪水,干旱或暴风雨周期,就像蝉经历了长达17年的滞育期一样。但是,在更长的时间尺度上发生的地质事件也可能导致休眠。
海洋沉积物中休眠的微生物回到营养新鲜的海底后,可以重新进入营养状态。由于生物扰动作用、小重力流或极端风暴事件,上层公尺以上的沉积物可以被挖出并重新沉积在海底(如果水足够浅)。埋藏得更深的沉积物可能在更长的时间尺度和更大的事件中被挖掘出来。整个海底悬崖可能会因海底滑坡,塌陷或浊流而重新分布。
在更长的时间范围内,当大洋板块撞击俯冲带中的其他大洋板块或大陆板块时,那些埋藏在数百米深的海洋沉积物中幸存下来的微生物可能会被挖出来。在这里,增生棱柱或火山泥喷发为使一些深埋的微生物脱离休眠提供了潜在的机会。
其他环境,例如古老的多年冻土也可能具有长期休眠的生物。尽管重要的是要指出,由于气候变化,现代多年冻土的融化速度快于预期,但这类生物的进化回报可能是在米兰科维奇循环之后的冰川期结束。
注:米兰科维奇循环是指一个地球气候变动的集合影响。以十万年为主要周期,伴随着四万年以及二万年左右的周期。与三种地球绕日运行轨道的变化有关。这三个影响因素也造成了地球的冰期与间冰期,大都与太阳辐射变化量有关。
正如微生物不依赖于氧气一样,它们也不依赖于达到一定的增长率。众所周知,厌氧呼吸的能力会增加微生物的环境范围,从而防止将其囚禁在有氧环境中。同样,微生物在长期,甚至是非常长时间匮乏中的生存能力使它们的栖息地在更大的时间范围内扩张。时间本身成为一种资源,微生物可以利用它进入新的栖息地。他们可以等待资源补充事件,而这超出了受限于更快生长速度的生物体的时间范围。
这种超慢的微生物可以被看作是在经典的 r vs. K 策略的生态框架中的K策略者,它们具有较慢的繁殖速度,更长的寿命并保持稳态种群,以最大程度地利用环境的承载能力。
注:物种有两种生存策略。K策略:培育一两个,每一个个体都是高质量和长寿命。R策略:培育很多很多个体,以数量来博取生存概率,每个个体都比较脆弱,死亡很多。
当然,需要注意的是,像这样的生态范式是围绕多细胞真核生物而设计的,包括对后代繁殖和体型的预测,而这并不能完全转化为在地质时间尺度上存活的微生物。因此,将时间视为微生物资源的新颖性并不意味着一种新的生态范式,而是一种新的生态位。通过积极关注微生物是如何利用大范围的时间尺度,或许比以前所认为的更长的时间尺度,我们可以为微生物和地球系统如何相互作用开辟新的认识。
参考文献:
Karen G. Lloy, Time as a microbial resource, Environmental Microbiology Reports, 04 October 2020

谷禾健康
大多数细菌可能存在或至少有一部分时间处于单细胞状态。在这种单细胞状态下,细菌将更容易受到一系列威胁,包括其周围环境的物理或化学性质的简单波动,更容易受到更直接的生物威胁,如抗生素、噬菌体、拮抗细菌,甚至是捕食性单细胞真核生物。因此,每一个细菌细胞都必须具备应对这种威胁的能力,微米尺度上单细胞生命的所受压力和威胁是形成细菌进化的主要力量。考察拮抗作用在自然群落中的研究表明,拮抗作用可以发挥多种作用,从促进原始生境的定殖到维持细菌群落的稳定性。
细菌与其环境相互作用的研究历史上一直集中在获取营养和抵抗非生物胁迫的策略上。这种关注淡化了细菌生命的第三个方面,而这是它们存在的同等重要的方面:即,拮抗细菌对生存的威胁。刚刚,发表在Current Biology上的一篇来自美国华盛顿大学医学院的一篇题为:“The Central Role of Interbacterial Antagonism in Bacterial Life”的文章对这一问题进行详细的讨论和论证,证明了细菌间拮抗作用的普遍性和重要性。细菌间拮抗途径的多样性和普遍性越来越明显,细菌间毒素解除其靶标的隐蔽方式强调了这些过程的高度进化性。拮抗途径的普遍性必然与同样广泛的防御策略相匹配。这些与特征明确的中央应激反应途径重叠,突出了细菌相互作用对塑造细胞生理的贡献。

背景:
一种细菌可能比另一种典型的细菌具有同等甚至更高的地位,并对这种典型的细菌来造成威胁。在一项综合分析中,考虑并权衡了地球上细菌的主要栖息地,得出的结论是,20-80%的细菌是表面相关的,并且证明了在细菌小尺度上的多样性,常常是细菌物种之间直接的细胞-细胞接触。这些观察结果延伸到栖息地,如土壤、深海和大陆亚结构,人类肠道和口腔。因此,存在一个合理的“物理证据”,表明细菌通常彼此紧邻生活。 现在,要了解在这些相互作用过程中发生了什么,即它们在本质上是拮抗的还是合作的,我们必须从体外实验,基因组证据和理论模型中进行推断。
拮抗途径的多样性和普遍性
自二十世纪初从链霉菌属中分离出首批抗生素以来,人们就已经意识到细菌杀死或抑制其他细菌生长的能力。
然而,随着细菌学逐渐发展成为一门专注于纯培养中有机体研究的学科,细菌间相互作用的表征不再受欢迎,细菌拮抗作用的研究也主要局限于寻找与临床相关的抑制分子。在21世纪早期,人们发现细菌也可以通过特殊分泌系统的作用,用抗菌毒素来对抗密切接触的邻居。很快就发现这种机制很普遍,这促使了细菌间拮抗作用研究的复兴。
随着研究兴趣的增加和基因组数据的大量涌入,发现细菌间拮抗机制的速度正在增加。所有主要的细菌门现在已经被证明具有拮抗途径,在许多情况下包括接触依赖和非依赖机制(表1和表2)。确定的可扩散毒素包括经典的小分子抗生素,它们是链霉菌的研究重点,也包括蛋白质毒素,其大小从肽到多亚基组合。接触依赖性拮抗作用由多种特殊分泌系统介导,包括革兰氏阴性菌的IV型、V型和VI型途径以及革兰氏阳性菌的Esx分泌系统。这些系统中的每一个都向邻近细胞传递毒性效应蛋白,并利用同源免疫蛋白来防止自身和亲属中毒。
接触依赖性的细菌间拮抗作用也可以通过其他途径发生,如外膜融合介导的粘液球菌毒素交换,茎杆菌中淀粉样细菌素的表面相关产生,以及芽孢杆菌中带有羧基末端毒素结构域的肽聚糖锚定YD重复蛋白的产生。
从整个系统发生学的角度来看,不仅细菌间的拮抗机制是多种多样的; 单个物种本身可以编码多方面的拮抗武库。
多样化发生在许多层面上,包括携带多种独特拮抗机制的物种(图1),给定机制的非冗余形式(即多种毒素输出分泌途径)以及通过单个传递系统传递的过多效应子。 在生物体中发现的拮抗途径之和可占细胞总编码能力的重要部分。例如,铜绿假单胞菌编码至少六种不同的使竞争对手中毒的方法,它们共同构成了基因组的190 kb(3%)(图1A)。其中一些包含相关系统的非冗余版本,包括三个VI型分泌系统(T6SS),每个系统与多达七个独特的分泌效应子相关。 该细菌还拥有编码两种接触依赖性抑制(CDI)和三种可扩散的蛋白质毒素(称为pyocins)的基因。 革兰氏阳性枯草芽孢杆菌编码相似而广泛但不重叠的拮抗机制(图1B)。
细菌间毒素的潜伏性
细菌间拮抗途径的有效性不仅仅是其毒素内在效力的函数。毒素必须克服由细胞防御系统产生的耐受性,这些防御系统因其造成的损害而被激活,作用于细胞质分子的毒素必须突破细胞包膜,而成功的中毒策略应该相对不受抵抗力的影响。
许多抗菌毒素作用于不易从细胞外部进入的分子。 例如,似乎大多数T6SS毒素在周质中起作用,尽管有一些争论,但证据表明至少在铜绿假单胞菌中,该分泌装置最初将其抗菌蛋白传递至该隔室。 因此,具有细胞质靶标的T6SS底物需要一种穿过细菌内膜的手段。尽管这些蛋白的胞质进入细节仍然未知,但是T6SS毒素似乎并不需要通过接触依赖性抑制(CDI)系统传递毒素的特定内膜受体。
确实,铜绿假单胞菌的一种T6SS毒素Tse6似乎通过一种相当独特的机制克服了这一障碍。 该毒素可降解基本的细胞内代谢产物烟酰胺腺嘌呤二核苷酸(NAD),与细胞中最丰富的蛋白质之一,延伸因子Tu(Ef-Tu)紧密相互作用。 这种相互作用对于生化活性和毒素分泌都是必不可少的,但是破坏Tse6-Ef-Tu相互作用会使蛋白质完全无法作用于受体细胞。缺乏详细的机理理解,但简约产生了一种模型,其中Ef-Tu相互作用可能通过在细胞质内动态捕获Ef-Tu-相互作用基序来促进内膜上的Tse6易位。
通过T6SS,T4和Esx分泌系统传递毒素需要长时间的细胞间接触,这阻止了在流体条件下使用这些拮抗机制。 相反,由T5SS介导的CDI途径可以在液体培养物中生长的细胞之间起作用。 CDI毒素共有的一系列独特特征,它们在与靶细胞发生相对短暂的接触后介导其摄取。 CDI毒素以前被描述为“棒上的毒素”,因为它们由一个延伸的氨基末端细丝组成,该细丝通过b-barrel蛋白和一个羧基末端固定在分泌部位的生产细胞上 毒素结构域传递到细胞。 该报道表明,在没有靶细胞的情况下,在挤出毒素或相邻的FHA-2结构域之前,细丝的分泌会停止。 这导致发夹形结构的表面呈现,该结构由毒素的丝状部分的前半部分组成,该部分的末端具有负责靶细胞中受体结合(RBD)的域,而其余部分则由 蛋白在分泌之前向分泌通道延伸或位于周质中。 当RBD与其靶细胞上的受体结合时,分泌停滞得以缓解,并且FHA-2结构域与靶细胞的外膜缔合并嵌入其中。这随后促进了羧基末端毒素结构域向靶细胞周质的移位。 毒素中特定的脯氨酸丰富结构域被证明与分泌停滞有关。值得注意的是,缺乏该结构域的细胞在固体培养基生长条件下仍能够使靶标中毒,但丧失了在液体培养中起作用的能力。 这项研究说明了抗菌毒素访问其靶分子的途径如何对有效递送它们的条件产生深远的影响。
毒素的独创性远远超出了它们到达目标的阴险方式;如果没有办法颠覆抵抗的出现,毒素将很快被解除武装。一种“数量上的优势”方法,即通过不同机制同时传递多种毒素,可能在一定程度上已经在接触依赖型毒素传递系统中进化出来,以解决这一问题。这种策略还有一个额外的优点,即允许毒素协同作用,并便于在一系列环境条件下中毒,否则这些环境条件可能会使单一毒素的活性失效。
个别毒素也可以拥有自己的抗性颠覆解决方案。 例如,Serratia proteamaculans的ADP-核糖基酶和T6SS底物Tre1所采用的主要中毒机制是通过修饰细胞分裂蛋白FtsZ来阻止细胞分裂。然而,Tre1的活性并不局限于这个靶点;它对核糖酯表面可接近的精氨酸残基的随意修饰能力使得Tre1能够修饰其他一些必需的蛋白质。因此,如果FtsZ获得了一个突变,使其对修饰具有抵抗力,那么Tre1原则上仍然可以通过其他方式使细胞失活。
自然环境中的细菌间拮抗作用
尽管基因组证据和实验室研究对跨域细菌拮抗机制的普遍性毫无疑问,但这些机制在自然环境中的作用才刚刚开始受到关注。生物体之间的相互作用很难在原位进行监测,特别是在高度多样性的生境中或在难以实时访问的地点,如哺乳动物的肠道中。
尽管如此,采用一系列方法和不同模型系统的研究已经开始出现,这表明拮抗作用可能是细菌栖息地的一个普遍特征。
土壤包含地球上最多样化的微生物组合之一,长期以来被认为是具有拮抗能力的有机体。最近,来自特征不明显的Acidobacteria, Verrucomicrobia, Gemmatimodetes 和 Rokubacteria的土壤细菌被证明编码多种途径,以产生可作为抗菌药物的次生代谢物。然而,在土壤细菌中也经常检测到诸如交叉取食和降解协同作用等合作特性,这导致一些人质疑这种环境中拮抗作用的作用。经典生态学理论预测,两种生物所居住的生态位越重叠,它们就越有可能参与竞争行为,这就导致了这样一种假设,即土壤细菌之间的拮抗作用在邻近的相关生物之间最为强烈。有两类细菌,链霉菌属(Streptomyces sp.)和荧光假单胞菌属(Pseudomonas
fluorescens)两类细菌,它们能产生小分子抗菌剂,并能参与由细菌素介导的拮抗作用。来自同一采样点的链霉菌对比从远端采集的成对链霉菌更可能表现出拮抗作用,如果它们表现出相似的营养需求。
与链霉菌一样,具有相似营养需求的荧光假单胞菌菌株之间的相互抑制作用比那些有不同需求的菌株更强。值得注意的是,这两项研究都发现,抵抗对抗性的能力比积极抑制另一种菌株的能力更广泛。
从相关土壤细菌之间的相互作用得出了两个进化结果:获得对竞争菌株产生的毒素的抗性和/或营养专业化以避免拮抗作用。对其他细菌种群的研究将有助于解读这些细菌是否是土壤有机体中的普遍现象。
考虑到微生物在哺乳动物肠道中的定殖密度,一系列的拮抗途径是由栖息在这个生态系统中的细菌编码的就不足为奇了。然而,在没有扰动的情况下,肠道微生物群落非常稳定,这就提出了一个问题,即在这种环境中如何以及何时使用拮抗机制。这可能是肠道内的拮抗作用对于介导婴儿最初定植过程中的细菌间竞争至关重要。对拟杆菌属中T6SS基因丰度的宏基因组数据集的分析似乎支持这一点。 脆弱的芽孢杆菌特异性T6SS在婴儿定殖菌株中比在成人中更常见。使用生生物小鼠和模型社区的实验支持了该系统在肠道定植过程中的作用。的确,脆弱芽孢杆菌的T6SS有助于对生食性小鼠中敏感菌株的定植抗性。
然而,对成年肠道群落中包括T6SS在内的拮抗途径的测量表明,它们还起着最初定殖以外的作用。事实上,脆弱的芽孢杆菌的T6SS有助于gnotobiotic小鼠对敏感菌株的定殖抗性。此外,另外两种类杆菌T6SS及其各自的效应器编码在移动元件上,证据表明,在同一宿主上定殖的菌株通过水平转移获得和保持这些元件具有很强的选择性压力,从而导致效应器和免疫基因对的相容性。
在成熟的肠道菌群中,支持拮抗作用至关重要的其他证据来自获得性细菌防御(AID)和重组相关的AID(rAID)系统的发现。 这些由孤儿免疫基因组成的拟杆菌属元素普遍存在于成年肠道元基因组中,并且能够完全中和通过拮抗拟杆菌属菌株而递送的相应毒素。有趣的是,rAI簇显示出活跃基因获取的特征,表明它们可以起到适应性免疫功能的作用-与CRISPR阵列类似,但可以防御细菌间的拮抗作用而不是噬菌体攻击。
与rAID簇中编码的许多基因最接近的同源物是与T6SS以外的毒素传递途径相关的免疫基因,这些基因在拟杆菌属的外部发现,这增加了该系统对不同拮抗剂提供保护的可能性。 这些孤儿免疫基因簇在肠道细菌中的流行表明,对局部产生的毒素的抗性的获得促进了原本不相容的菌株之间的共存,这反过来又可能有助于群落的稳定。
进一步的证据支持成熟肠道菌群中拮抗作用的关键性质来自获得性细菌间防御(AID)和重组相关的AID(rAID)系统的发现。这些由孤儿免疫基因组成的类杆菌素广泛存在于成人肠道异源基因组中,能够完全中和通过拮抗拟杆菌菌株传递的相应毒素。有趣的是,rAID簇显示了活跃基因获取的特征,这表明它们可以发挥适应性免疫功能-类似于CRISPR阵列,但用于防御细菌间的对抗而不是噬菌体攻击。与rAID簇中编码的许多基因最接近的同源基因是与毒素传递途径相关的免疫基因,而T6SS则是在类杆菌之外发现的,这增加了系统对不同拮抗剂提供保护的可能性。这些孤儿免疫基因簇在肠道类杆菌中的流行表明,获得对局部产生的毒素的抵抗力促进了其他不相容菌株之间的共存,这反过来可能有助于群落的稳定。
作为可扩散抗微生物剂在成熟肠道菌群中作用的一个例子,已经确定了一个四元细菌联合体,它对小鼠的抗万古霉素肠球菌(VRE)具有定植抵抗力。这种预防作用需要革兰氏阳性菌Blautia Producta产生一种广谱的特异性抗菌肽。强调定植抗性可以在临床中发挥重要作用,接受造血细胞移植的患者对VRE感染敏感,他们拥有生产这种抗生素的基因。
革兰氏阴性菌产生的可扩散抗菌剂同样在肠道菌群中起重要作用。拟杆菌分泌抗菌蛋白,称为类杆菌分泌的抗菌蛋白(BSAP),针对靶细胞上的特定表面分子。对BSAPs的抗性是广泛存在的,并且通过与毒素基因相邻的其他靶基因的表达来介导。
在人类肠道易位基因组中,当存在BSAP基因时,具有抗性目标等位基因的菌株会富集;因此,就像由拟杆菌的T6SS介导的拮抗作用一样,这些生物体产生的可扩散的抗菌蛋白可能会在定植于不同个体的菌株之间进行兼容性选择。
上面描述的例子强调了细菌拮抗作用在原始生境定殖和捍卫已建立种群中的潜在作用。 研究表明,这些途径的第三个作用在于介导入侵。肠霍乱弧菌,霍乱弧菌和伤寒沙门氏菌均编码T6SS,有助于肠道菌落定植或表现出针对体内的共生物种。细菌素也可以介导肠道的侵袭。产质粒编码细菌素的粪肠球菌能够特异性地侵入并取代本土的粪肠球菌,并且通过改变共生微生物群落,由单核细胞增生性李斯特菌的强毒菌株产生细菌素可促进小鼠肠道定植[93]。而单核细胞增生Listeria monocytogenes菌强毒株产生的细菌素通过改变共生微生物群落来促进小鼠肠道定殖。
拮抗机制可以与外界干扰协同作用,促进病原菌入侵。发现鼠伤寒沙门氏菌的肠杆菌科特异性细菌素colicin 1b有助于其仅在炎症期间与小鼠肠道中的共生大肠杆菌株竞争,这通常会破坏肠道群落结构并促进蛋白细菌种类的生长。有趣的是,在这种情况下,肠道共生物种可以采取反策略。大肠杆菌Nissle通过产生称为微素的抗菌肽来抑制入侵的沙门氏菌的生长,这种抗菌肽是响应低铁而引起的,这是发炎的肠道的标志。此外,微素通常与铁载体偶联,从而促进铁载体被靶细胞中的铁载体吸收,而靶细胞必须主动清除铁才能维持其活性。
由于实验研究已提供证据证明细菌间的拮抗作用是微生物群落中普遍存在的一个方面,因此关于拮抗相互作用如何影响群落动态的问题也就出现了。报告表明,许多栖息地中存在的高水平细菌多样性可以通过合作代谢交叉喂养来解释。然而,这些研究往往未能明确解释活性拮抗机制,而只关注营养素的竞争。
关于合作以及拮抗和剥削性细菌间竞争对人类肠道群落动力学影响的数学模型表明,与直觉相反,拮抗作用促进稳定性。在这项分析中,合作是不稳定的,因为它有可能在物种之间建立依赖关系,从而对群落产生整体不稳定的影响。相反,对抗促进了广泛多样性水平的稳定。这项研究还确认了空间隔离是一种通过抑制物种相互作用程度来促进群落稳定的机制。
最近对鱿鱼共生菌Vibrio fischeri 的T6SS系统在寄主定殖过程中的功能的研究提供了一个真实例子,说明空间隔离和拮抗协同作用,以构建微生物群落。在这个例子中,作者发现编码T6SS的V. fischeri菌株和那些易中毒的菌株可以在同一种动物中共同定居,但只能通过占据鱿鱼发光器内不同的、空间隔离的隐窝。
对抗性防御
如果细菌间的拮抗作用像上面描述的基因组学、机械学、原位和理论研究所表明的那样普遍存在于微生物生命中,那么细菌也会进化出许多防御这些攻击的方法。一种潜在的防御机制仅仅是为了发动更好的进攻,这可能是导致对抗机制多样化和多样化的一个因素,而这些机制是由单个菌株编码的。一个有机体可以采用的相关策略是,根据特定竞争对手存在时特定活动的选择性优势,对其产生的毒素进行编码。后一种方法的一个例子是Rhs毒素。这些大的,多态性毒素由一个与羧基末端毒素相连的重复区域组成。
然而,这些对缺乏分泌所需毒素的重复部分。在鼠伤寒沙门氏菌中,这种细菌的反复传代选择了一个带有Rhs毒素的克隆,其中祖先的CT域被下游的CT域取代。这种菌株的选择是通过破坏编码这种CT毒素及其免疫决定因子的开放阅读框来实现的。尽管重组介导的毒素结构域交换尚未在该系统中得到实验验证,但编码奈瑟菌物种多态性MafB毒素的基因簇显示出类似的结构。
第二种颠覆对抗作用的方法是获得免疫决定因子,这些决定因子能够保护机体免受特定毒素的侵害(图2)。如上所述,这似乎是肠道拟杆菌的普遍特征。虽然目前为止,这些生物是唯一一个编码免疫基因阵列的群体,这些基因似乎是主动获得的,并且已经被功能性地描述过了,其他一些被称为“孤儿”免疫基因的例子也被描述过,这些基因被预测能够保护它们免受非编码它们的生物体制造的毒素的侵害。
此外,与土壤中的生产者物种相比,土壤中具有抗小分子抗生素抗性的基因更为丰富,这表明它们在保护目标细胞方面发挥着更广泛的作用。
众所周知,在临床环境中,细菌应激反应会导致抗生素耐药性。然而,这在很大程度上被认为是其提供非生物应激源保护作用的真正功能的不幸副作用。
在广泛抗菌拮抗证据的背景下重新审视这些途径,我们认为提供保护免受生物攻击实际上可能是它们在自然界的主要功能。压力反应途径的例子支持了这一点,这些途径提供了复杂的方法来对抗其他细菌产生的特定毒素的作用。例如,土壤细菌枯草芽孢杆菌(Bacillus subtilis)利用一系列互补机制来抵抗镧系抗生素(由许多革兰氏阳性细菌产生的多环肽抗菌剂)的中毒Bacillus subtilis对镧系抗生素的防御措施包括合成带负电荷的脂肪酸,它能减缓阳离子肽穿过细胞壁的速度,产生膜信号肽酶SppA,被认为有助于肽抗生素在细胞膜中降解,诱导噬菌体休克蛋白同源物,保护膜不受造孔镧系物的影响。
另一条将应激反应途径与细菌间拮抗联系起来的证据是来自另外一篇研究中,他们称之为竞争感应。这些作者提出了这样一个假设:细胞损伤表明存在拮抗竞争对手,诱导拮抗机制与修复系统协同提供了一种同时抵抗和反击攻击的手段。在铜绿假单胞菌中,应激反应机制和拮抗途径也受到协同调节,但由一种被称为副(绿脓杆菌对拮抗作用的反应)的不同机制。由溶解性抗菌毒素活性释放的细胞内自源性内容物作为旁分泌信号,刺激附近细胞中Gac/Rsm全球转录后调节通路的激活(图2)。随之而来的是T6SS的引入,以及共同提高对抗敌手竞争能力的其他因素。Gac / Rsm调节子中的许多基因没有已知的功能,这表明在这种生物体中尚需表征提供对抗拮抗作用的其他机制。
结论
细菌间拮抗途径的多样性和广泛分布,这些机制有助于细菌适应环境和在无数环境中竞争生存。这一点很重要,因为任何试图改造细菌群落(包括肠道微生物群落)以改变其特性的尝试,都必须包括一种方法,使引进的生物体能够与它们总是会遇到的其他菌相互作用进行抗衡。拮抗途径多样化的一个更微妙的潜在结果是,它们有可能成为毒素的进化库,包括细菌病原体用来对抗哺乳动物宿主的毒素,以及真核生物水平获得的抵御细菌的毒素。
表1 细菌拮抗作用的非接触依赖性机制。
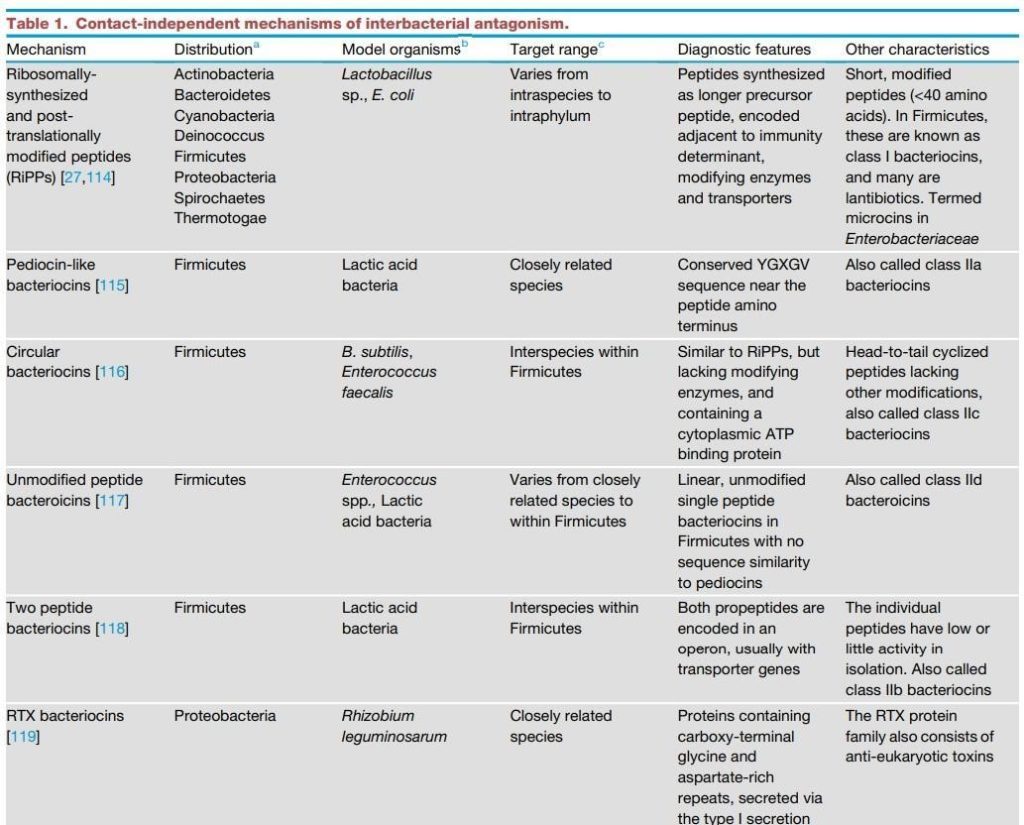
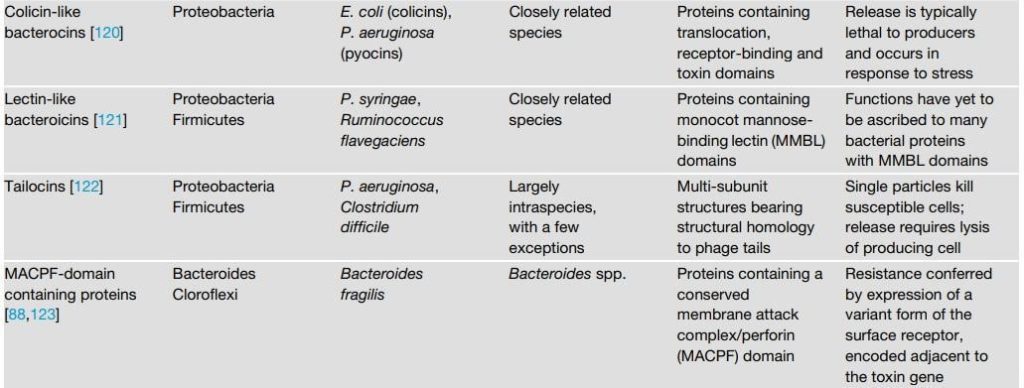

表2 接触依赖性细菌拮抗途径
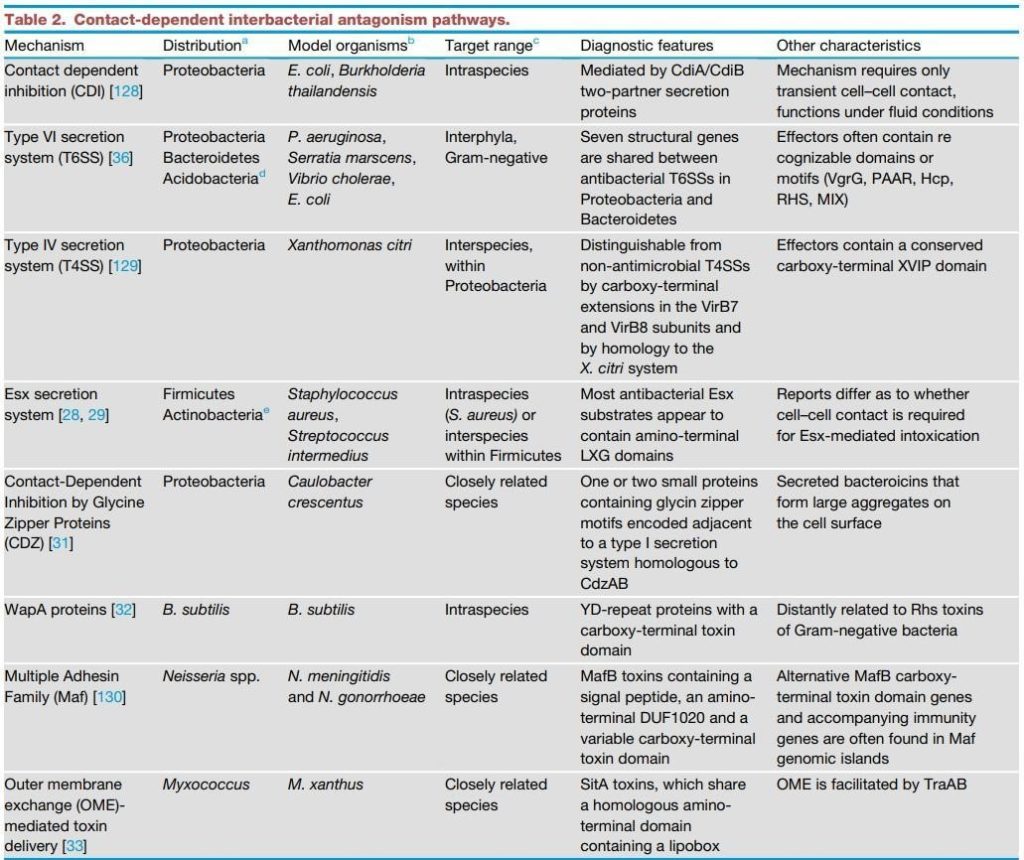
图1 细菌基因组中充满了编码各种细菌间拮抗途径的基因座。
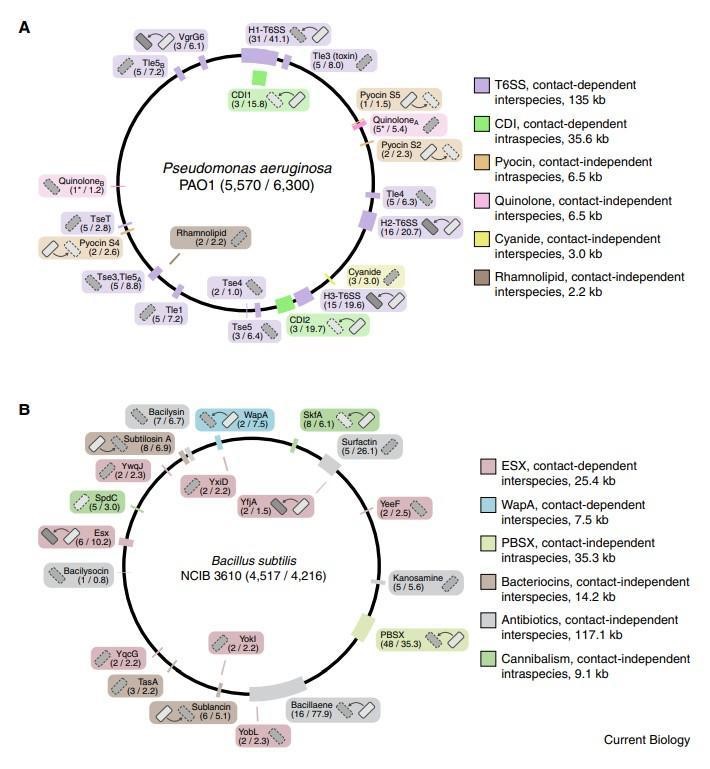
图2 革兰氏阴性细菌对T6SS的多种防御途径。
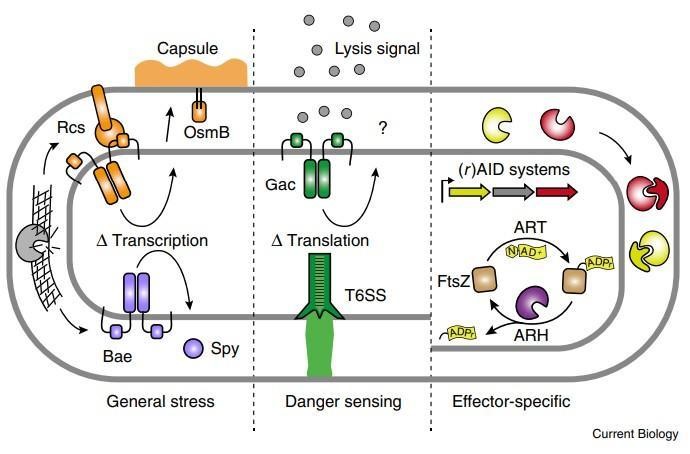

谷禾健康 原创
近年来,随着测序技术的发展,对微生物群(微生物组)的研究逐渐加深,研究热点越来越多集中于环境和生物体相互作用的微生物群。加之测序成本降低,分析技术不断提升,都使得宏基因组测序技术得到广泛应用。
宏基因组相对16S来说其物种分辨率会更高,随着物种测序完成越来越多,数据库更加完善,在肠道菌群方面基本能实现97%以上的菌都能鉴定到种,90%以上到菌株层面。
而且可以同时获得除RNA病毒外的所有物种的分布。此外包括菌基因组CNV等方法的出现,可以直接通过大规模宏基因组测序不仅找到可能的菌,进一步还能鉴定出特定候选基因区段。
对16s而言,宏基因组可挖掘的空间更大,如果想提高文章深度,发更高分的文章,宏基因组是个不错的选择。
有人说,宏基因组虽然有深度,但相应也更加复杂化。比如同样是做某类疾病,别人通过实验测序分析可以得出结论写出文章,到自己去研究怎么就遇到各种困难?完全没差异?出不了结果?
……
而等到所有分析完重新回头去找问题,也很难发现问题所在,一遍遍重新做耗时耗力…
其实这类文章并不只是测序而已,重点在于理解这个过程,研究方向的思考,分析策略的选择,包括其中要注意的因素等。
本文将从一个例子开始,为你打开研究思路,绕过某些易踩的坑,让你的数据更有利用价值,处理具体的问题也更加得心应手。
下面是利用已发表的宏基因组文章中的数据,用我们自己的流程进行一次全面的分析。在这个过程中,我们发现很多有意思的点,分享给大家。


这是一篇做精神分裂症患者粪便菌群宏基因组的文章。文中分析了90名未经药物治疗的精神分裂症患者和81名健康对照者的粪便菌群,确定了一种能够区分患者和对照者的微生物物种分类器。
研究发现与精神分裂症相关的功能代谢方面的差异主要体现在短链脂肪酸合成、色氨酸代谢以及神经递质的合成/降解。还发现了一种在精神分裂症中比较富集的物种 Streptococcus vestibularis,在小鼠的粪移植实验中,它引起了小鼠的社交行为缺陷,并改变了小鼠外周组织中神经递质的水平。
我们对这篇文章中的肠-脑模块(GBM)部分的分析比较感兴趣。为此,下载了文中使用的宏基因组原始数据,原计171个样本,但有一个无法下载成功(所以结果方面可能会与原作有细微的差异)。
在宏基因组分析之前通常要先收集元数据,那么什么是元数据?
元 数 据
元数据主要是对数据的属性进行描述的数据,也是实验数据的重要组成部分。
人体样本:主要包括个人基本生理信息(例如身高、体重、年龄、性别等)、生活行为方式、地理位置、膳食结构、营养状况、既往病史、抗生素使用情况等信息。
环境样本:指样本获取过程中的信息,例如采集地点、大气、水文、温度、pH值、压力、季节、运输方法、存储媒介等。
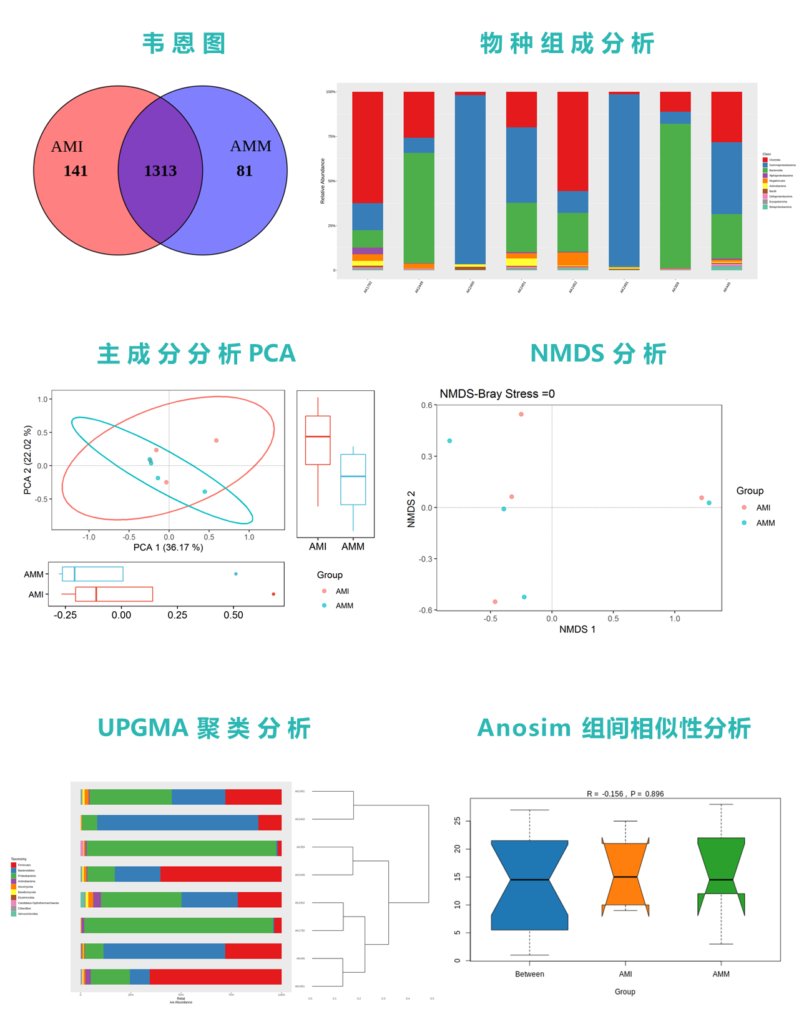
在数据分析之前我们首先对这批样本的群体构成和一些已有的元数据进行统计和特征分析:
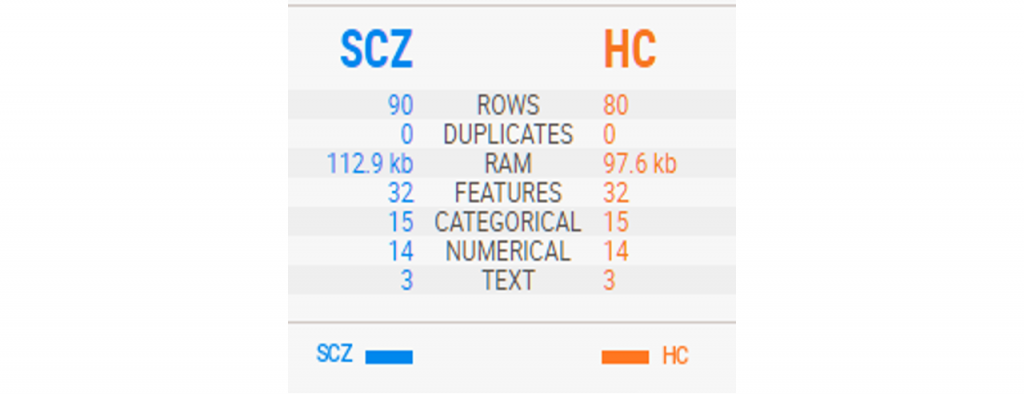

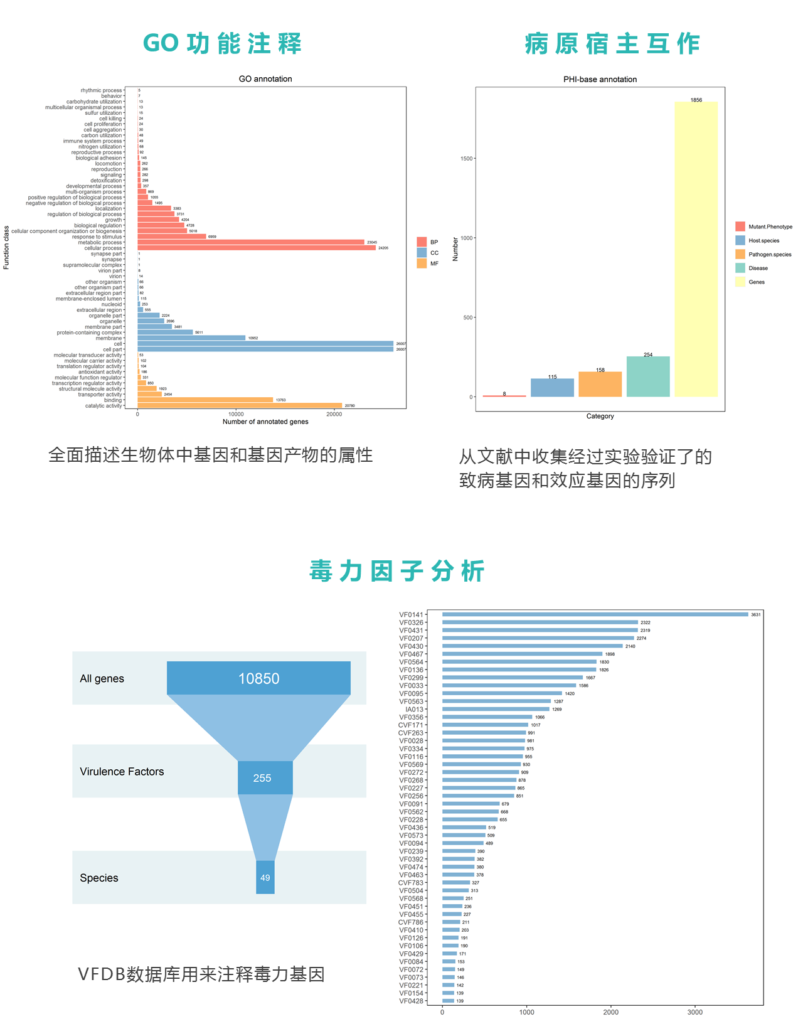
其中,SCZ是精神分裂症患者,HC是健康对照。
一共170例样本,其中精神病患者90例。
年龄、性别以及BMI还有食物构成的分布情况如下:
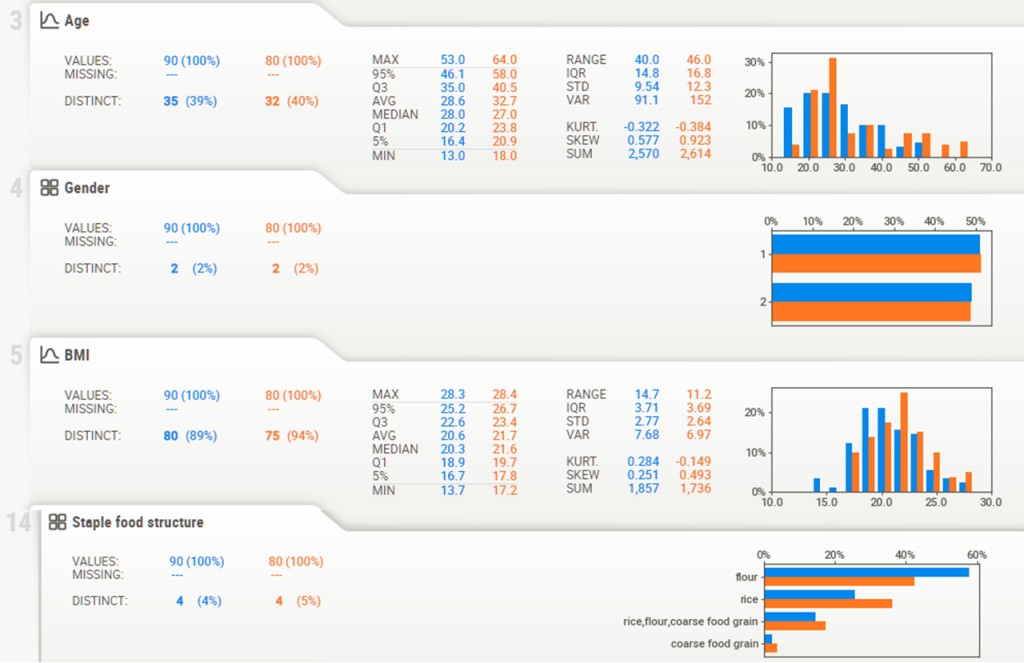

从上图中可以看出有些元信息在分组间就存在明显差异,如年龄,血清素指标,而有些元信息如性别没有明显差异。
进一步对这些元信息做统计分析,发现健康组(HC)和精神病患者(SCZ)存在显著差异(如下图的年龄信息,P值为0.117)。在我们的宏基因组分析流程中,分析前会将客户提供的所有样本元信息做统计分析,作为进一步分析的基础。

其中除了性别数据,其他几个主要因素还是存在差异的,这就要求后续分析的时候需要考虑这些因素的影响,这个在后面会提到。
研究中同时检测了血清中主要神经递质的水平,可以从中看出精神病患者的神经递质差异特征,其中多项神经递质存在极其明显的差异:
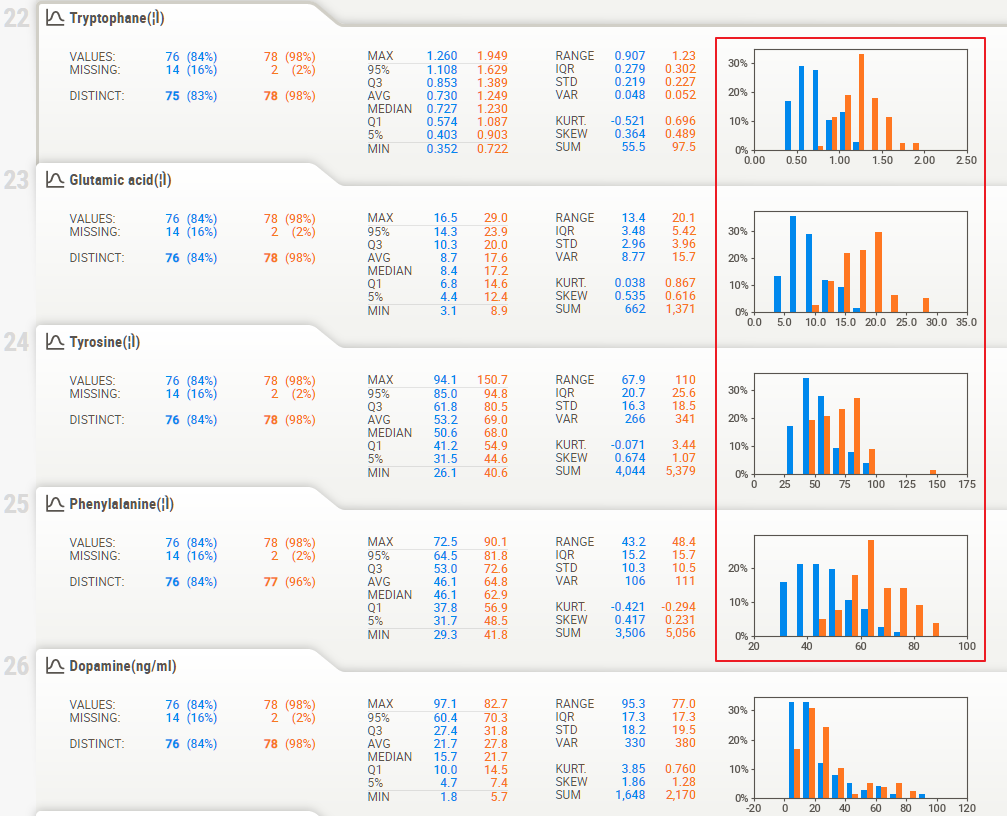
上图中框出的色氨酸、谷氨酸、酪氨酸、苯丙氨酸都存在显著差异。
我们使用的是kraken2以及谷禾自建的基于Reseq 99版本的微生物基因组数据库。需要注意的是Kraken2自带的物种数据库,其中肠道菌群中非常重要的Prevotella copri由于不在Refseq的完整测序基因组中,数据库没有包括,直接使用这个自带数据库会导致肠道菌群分析存在严重偏差,个别样本甚至95%以上都是该菌,如下面的这个样本:

可以看到红色箭头指向的Prevotella copri菌占比很高;假如数据库没有包含该菌注释,那么在后续分析的时候会错过一些重要信息。
谷禾数据分析使用了包括RefSeq 最近的99版本基因组数据,涵盖细菌、病毒、古菌、原生动物,不仅是完成的基因组还涵盖了基因组框架的物种。另外加入了IMG的真菌和细菌的基因组数据,以及真核寄生生物的数据库。
数据比对和统计分析结果如下,报告使用Pavian展示:
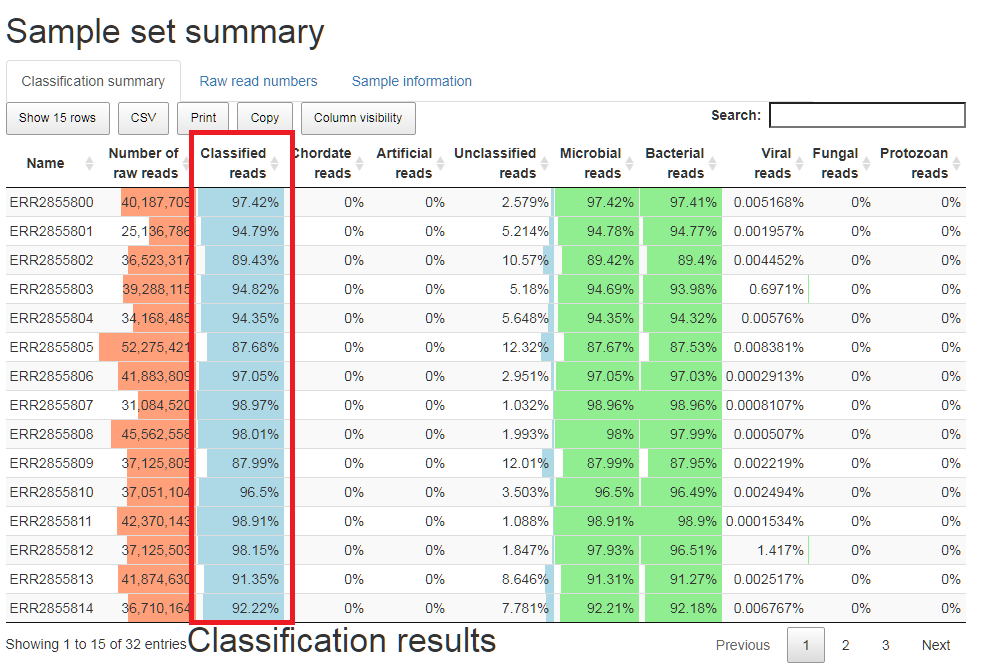
可以看到图中的红色框内,结果中能比对上数据库的比例大部分在90%以上,不能比上的只有不到10%的比例。
对应的物种构成表:
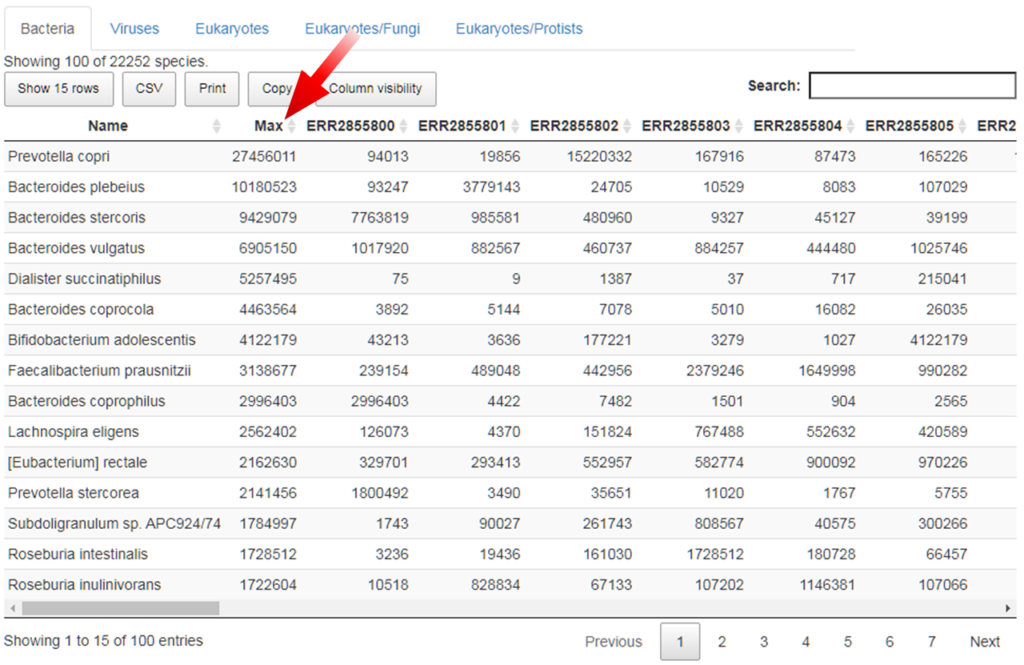
红色箭头指向的Max列,是后面列出样本reads数的总和。点击可以排序,简单方便。这个在线软件在谷禾报告中会给出相应的使用说明。
对应的每一个样的物种构成丰度:
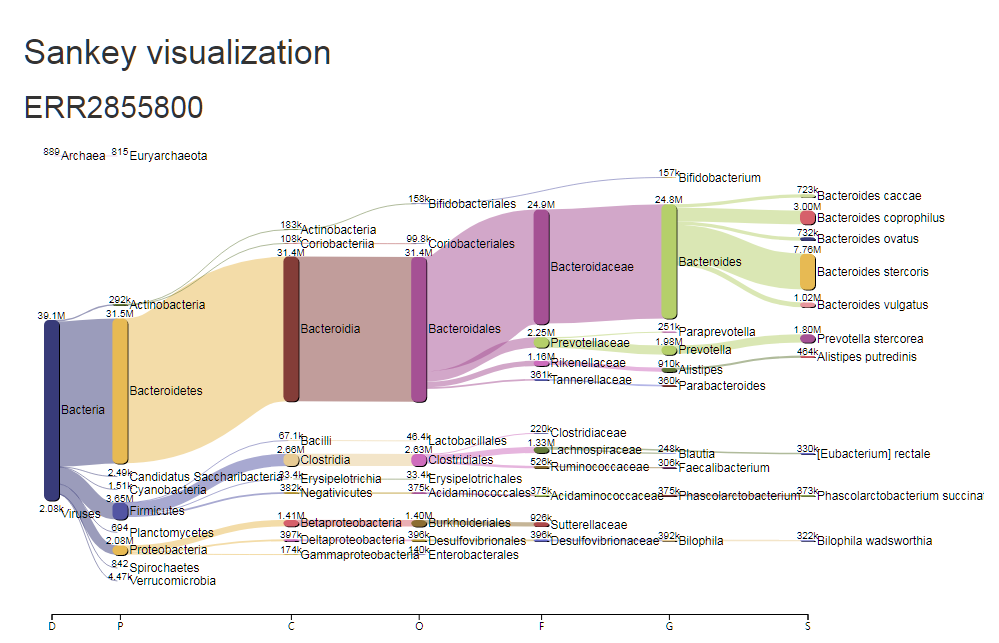
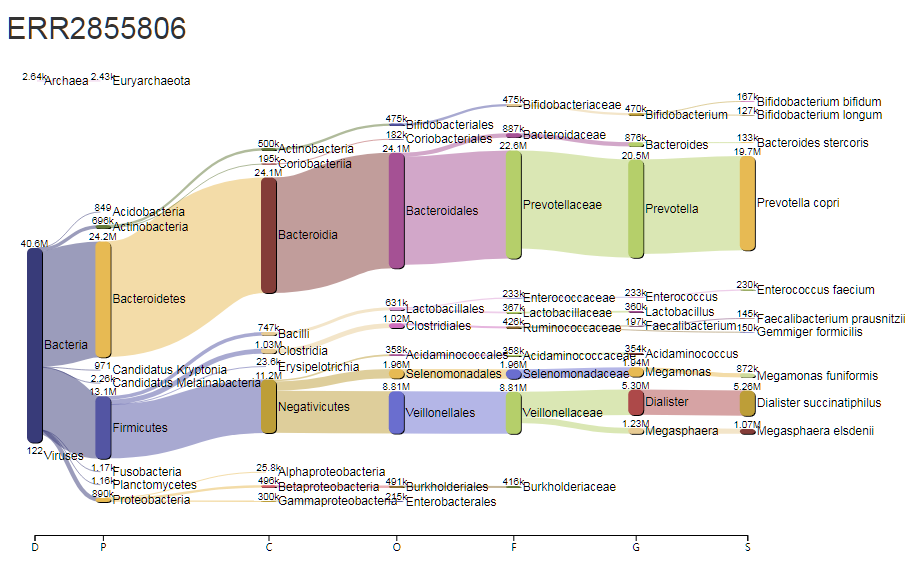
以上的两张桑基图能将菌属构成,层级关系展示出来,更加直观。
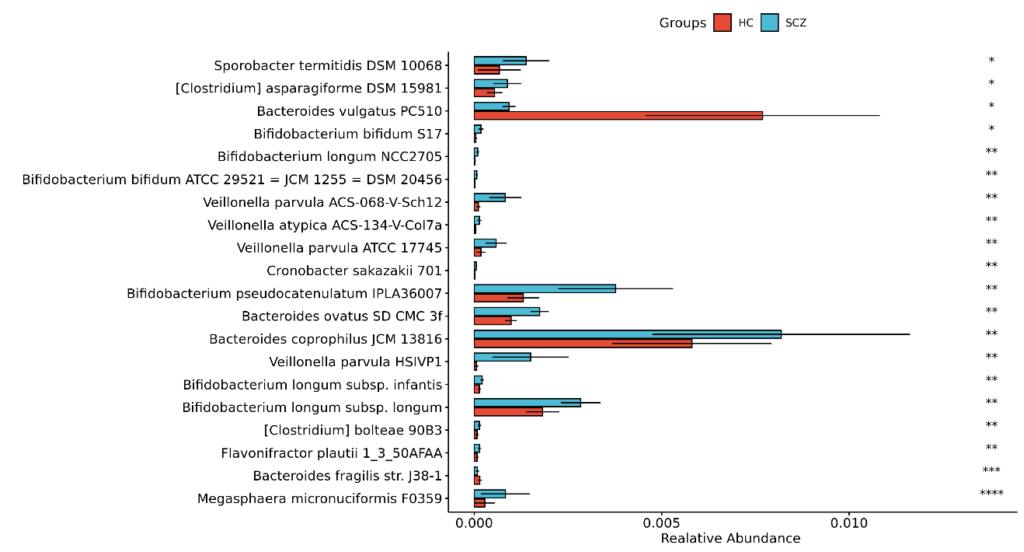
接着看分析,下图是统计检验结果,共找到85个显著差异的菌,结果如下:
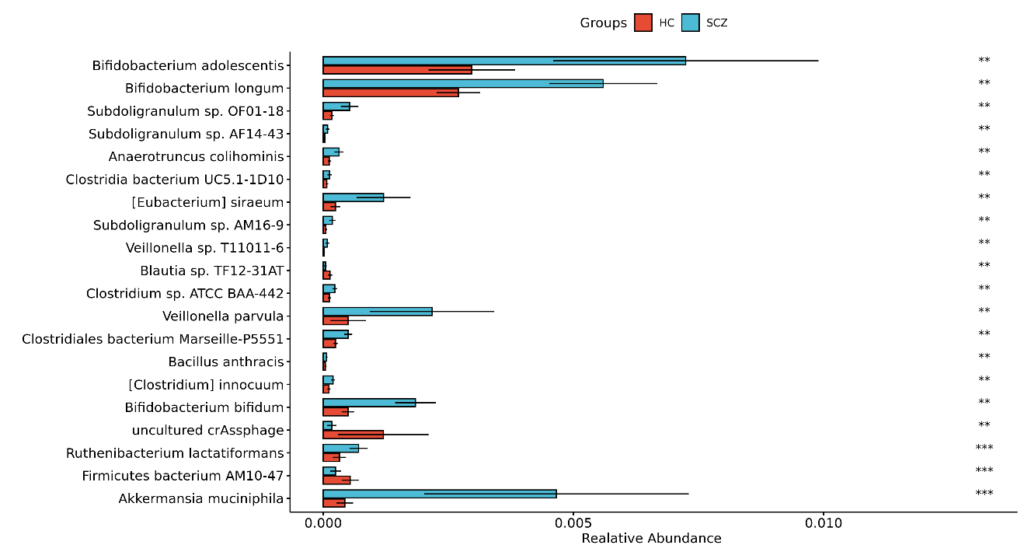
菌株部分发现42个差异菌株:
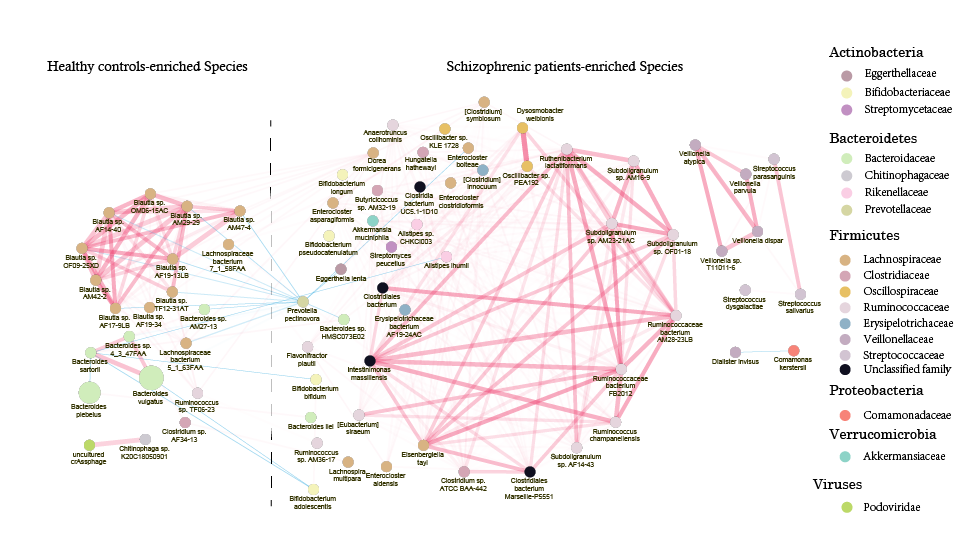
基于差异物种,使用spearmanCC,我们同样构建了精神病患者与健康对照两组差异菌的网络构成。
接着进一步分析了功能代谢,重点关注肠道菌群产生的神经递质和脑肠轴相关的代谢途径,也就是GBM模块与疾病分组和血清神经递质的关联关系。
前面已经提到,肠道菌群受年龄、饮食方式以及身体状况等影响,这些因素本身会导致肠道菌群状况产生偏差,如果不对这些因素进行统计控制,会对统计结果尤其是统计效力产生很大影响。
一般在统计上可以通过控制样本分组这些因素的分布,使其分组之间的因素基本一致或增加样本群体数量来增加统计效力。也可以通过统计方法如偏相关或加入协变量控制的GLM模型等方式来控制这些环境因素的影响。
这里的例子很好的显示了对这些因素控制和不做控制带来的统计分析结果的差异。
不 做 控 制
下图为不做控制的菌群总体GBM代谢模块与血清神经递质以及样本元数据的相关情况:
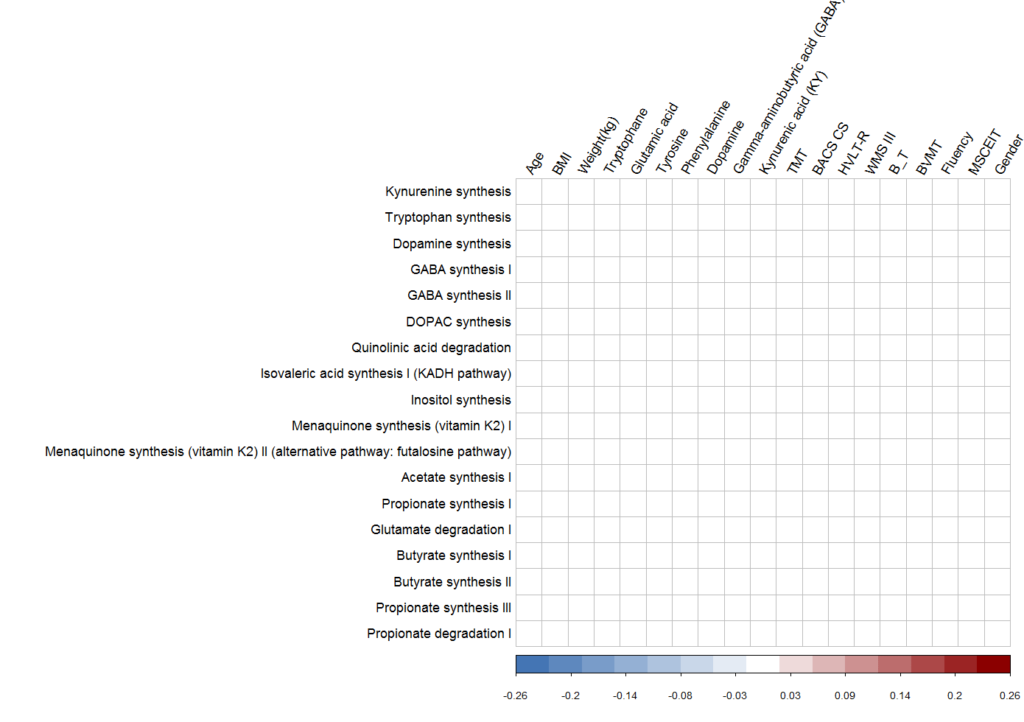
上图可以看到完全没有显著相关。
控 制 协 变 量
对性别、年龄以及食物摄入特点进行协变量控制之后的偏相关分析结果:
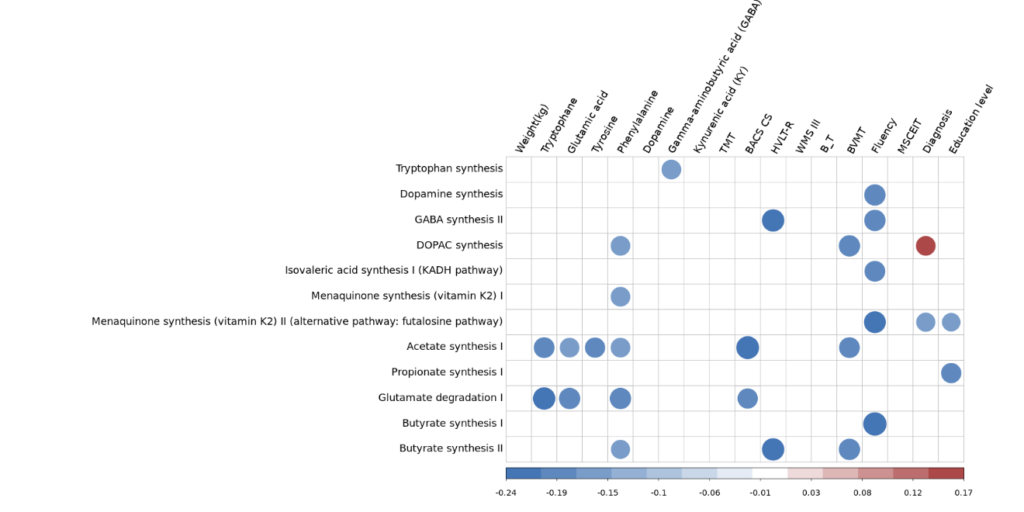
在这张图,可以找到显著的相关了。
可以看到有没有控制协变量对结果会造成影响,因此这里强调下协变量控制的重要性。
那么这里就意味着很多关联性被性别、年龄和饮食特点干扰了。
可以看到其中与是否患病的诊断(Diagnosis)相关的仅有DOPAC synthesis这一项,其他的大部分都不相关,该代谢通路同样在抑郁症人群中被发现存在显著相关,且与抑郁程度直接相关。
进一步的问题来了。
是否是菌群产生的神经递质直接影响了血清神经递质的量,并引发精神病呢?
我们发现整体菌群的主要神经递质代谢虽然部分与精神病患者异常的血清神经递质存在相关,但是关联性较弱,且差异并不明显。这就带来了一个思考:差异菌是否参与了这些神经递质的代谢异常。
我们仅分析了85个差异菌对应的GBM模块的代谢通路水平与血清神经递质的关联性(同样使用了偏相关):
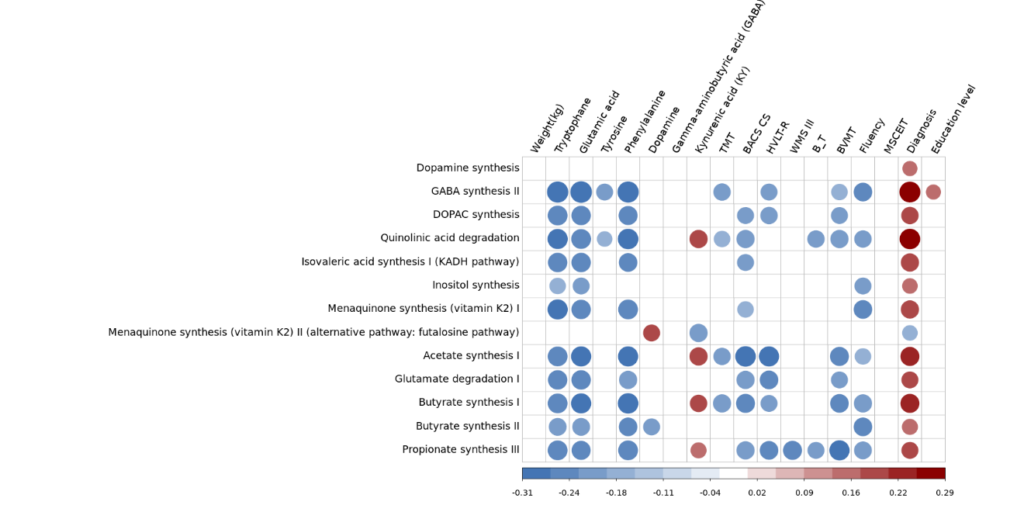
除了与诊断分组全部强相关之外,与神经递质也有大量相关。但是当我们直接比对GBM模块代谢与相应神经递质的关系时发现,并不直接对应,也不存在单纯的菌群的合成途径升高对应血清神经递质的升高,甚至出现相反的情况。
差异菌可能是对神经递质敏感的菌
基于上面的结果,我们推测,这些差异菌实际上并不是直接导致神经递质异常的原因,很可能是对神经递质异常敏感的菌,当精神病患者出现特定神经递质水平异常时,会通过代谢或底物变化诱导这些菌的生长或抑制这些菌生长。
另一个证据是论文中提及这些患者中的一部分经过治疗或用药后3个月又进行了一次检测,其中一半以上的差异菌和健康对照相比都不再显著。

虽然没有直接找到菌群作为精神病发病因素的证据,但精神病患者确实存在特征菌群的变化。
那么这些特征变化的菌群是否能帮助我们对精神病进行诊断或区分呢?
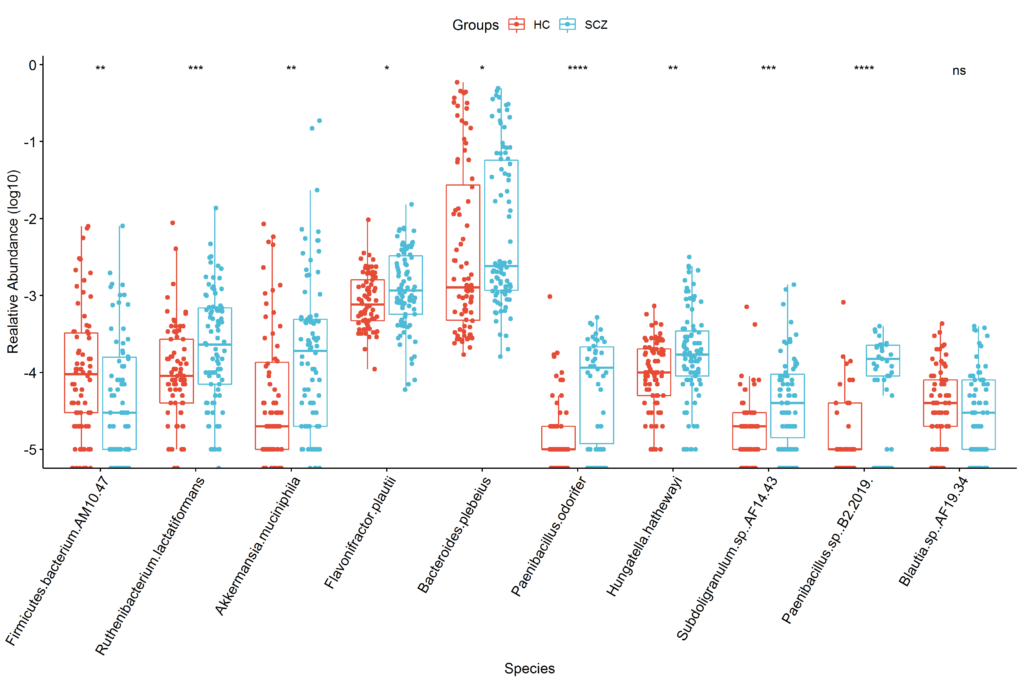
使用随机森林,我们提取了最重要的10个菌作为区分特征,其分布如下:
ROC的结果如下:
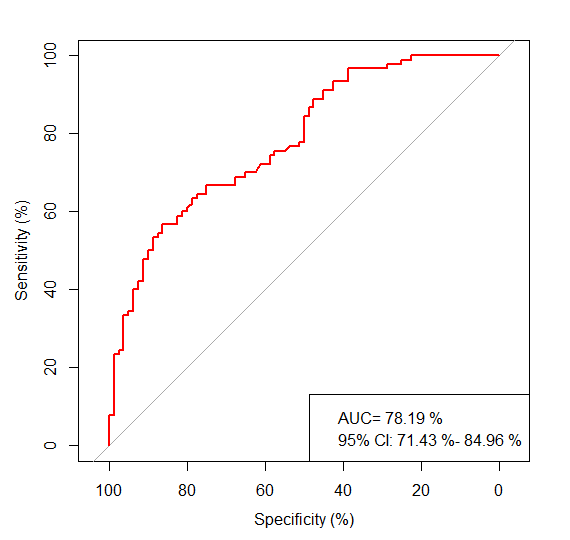
没有达到论文中提及的89.56%的水平,但显示确实可以一定程度上区分。
需要注意的是,该研究中仅招募急性复发精神分裂症(ARSCZ)和首发精神分裂症(FESCZ)患者。该文中分析内容都是基于这个前提。因此我们认为对于部分用药后的精神分裂症患者菌群还有待研究。
另外使用热图决策树对所有元数据和菌群特征对精神病进行区分分析,发现仅使用血清色氨酸和MSCEIT量表两个指标就可以较好的区分精神病患者。
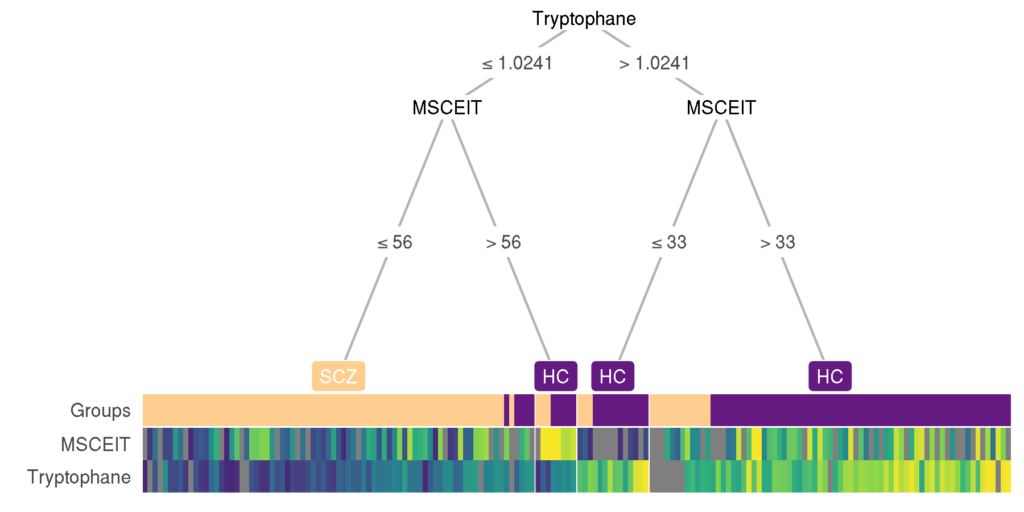
以上是我们结合自己构建的数据库,综合考虑多种因素,加入协变量控制分析得出的结果。
以上内容是对于该文章数据进行的分析。当然不同的文章,对应的分析可能会有些不同。
以下图表为谷禾宏基因组分析网页报告的部分截取。谷禾宏基因组报告的形式在原先的基础上有所优化,采用网页报告的形式便于大家浏览,方便快捷。
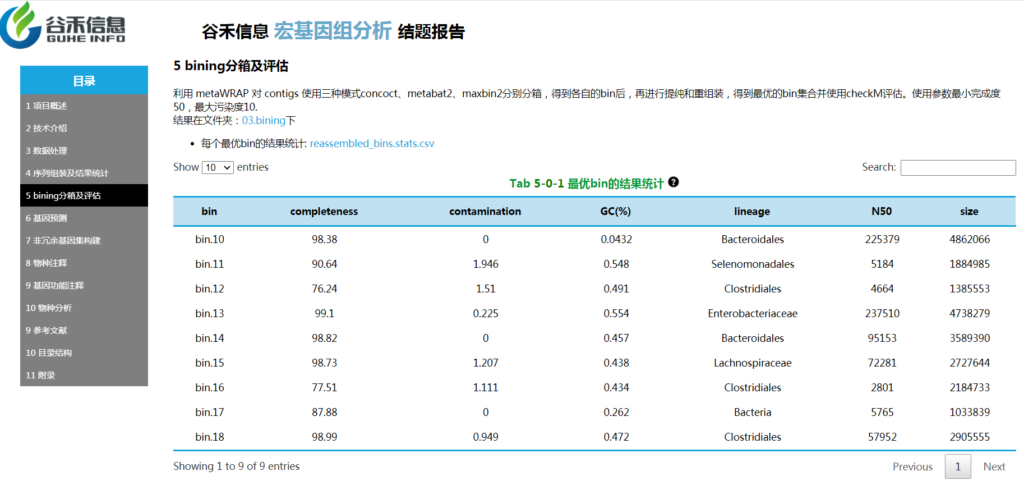
bining分箱及评估
比如说想要拼出未知菌的基因组就要用到 bining分箱及评估:
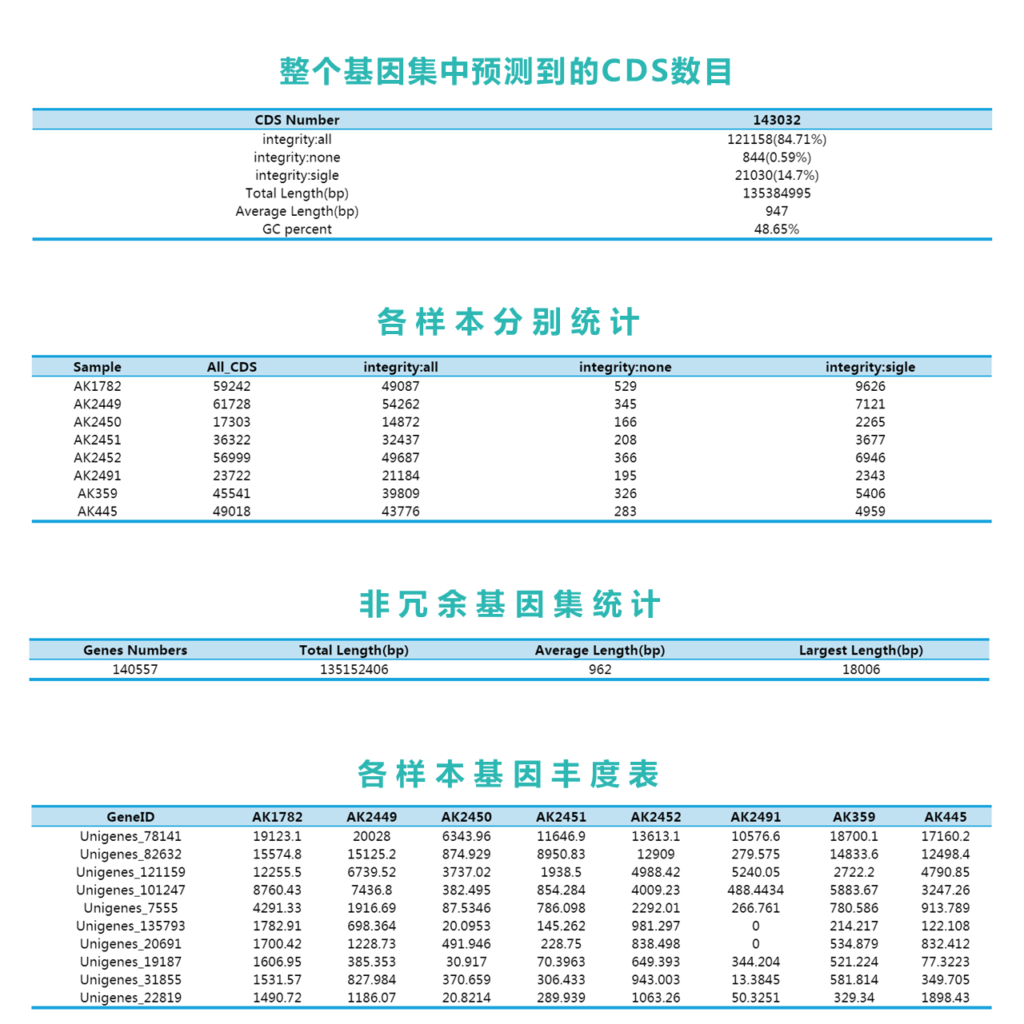
基 因 预 测
物 种 分 析
功 能 分 析
目前宏基因组相较于16s,样本测序费用还是较高,除了建库费用主要原因来自于宏基因组样本测序量大,测序成本高相应分析成本也高(前面案例提到的文章测序数据量达到3000万reads,成本可想而知)。

除一些样本来源构成复杂的样本或者后续需要做分箱分析(主要获得样本里一些菌的基因组草图)的样本还有以基因序列和变异为目标的需要比较高的测序深度以外,大部分研究微生物群落以及其与环境互作等,其实不需要那么高的测序数据量。
下面我们从该案例文章170个样本中随机抽取100万reads做beta多样性PCA图。
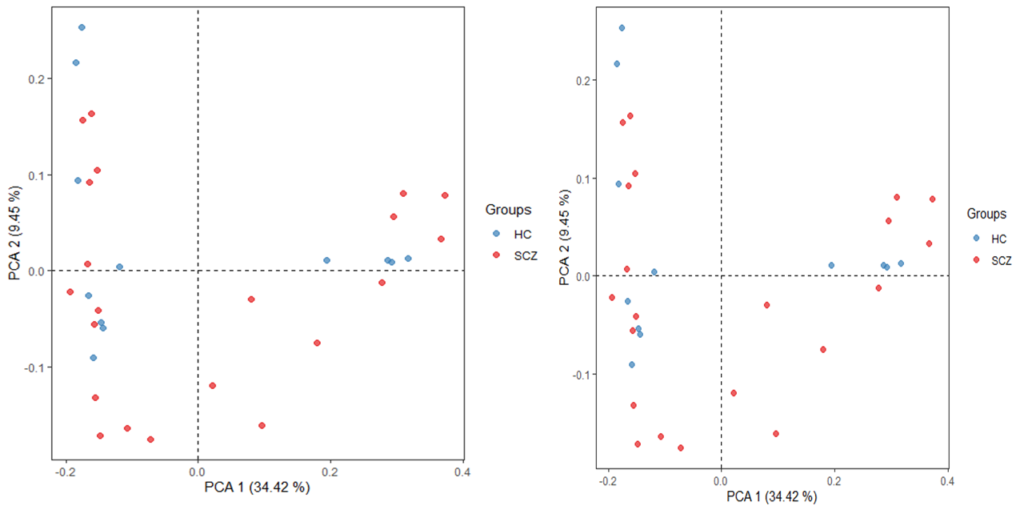
左侧是使用了完整所有序列的PCA图,右侧是每个样本随机抽取100万reads的PCA图。
可以看到随机抽样100万reads之后的菌群分布情况和完整序列的完全相同。
既然100万reads数的菌群分布情况和完整序列没什么差异,我们也可以直接拿100万reads数进行后续分析。
而其他分析各个结果均显示在100万reads的基础上进行后续分析并没有影响最后的结论。
可能有人还没听过浅宏基因组,这里稍微介绍下。其实浅宏基因组跟宏基因组类似,最大的差别在于数据量。浅宏基因组测序深度相对较低(100万reads),但是物种的分辨率并没有低于一般宏基因组(5-6G)。
谷禾经过几个月的研发的测试,推出浅宏基因组测序分析服务,每个样本数据量不低于100万reads,不通过拼接组装,直接基于kraken2等kmer,或MetaPhlAn2等标记基因的参考基因组方法进行种属丰度分类。
结合其到菌株的物种分类和丰度数据可较16s方案下的PICRUST更加准确的预测基因构成。周期在:2-3周左右,尤其适合粪便样本,价格比16s测序价格稍高一点。
更高性价比,最大程度满足大家不同的需求。
有些同学可能还有疑惑,做这个真的可以发文章吗? 在你犹豫的时候,已经有浅宏基因组的文章发表了。
近日,美国梅奥诊所消化内科和肝病科 Purna C. Kashyap研究团队和明尼苏达大学生物科学学院 Dan Knights团队合作在 Cell 上发表了题为 Longitudinal Multi-omics Reveals Subset-Specific Mechanisms Underlying Irritable Bowel Syndrome 的文章。
该文章在菌群方面研究采用了宏基因组和16S,对粪便样本采用宏基因组,对黏膜样本采用16S,因为黏膜样本含有较高的人体DNA,16S更为合适。
粪便样本的宏基因组直接采用和RefSeq89版本进行比对注释,基因部分同时结合了序列比对和利用基因组数据直接提取注释相结合。
宏基因组测序能够提供菌株层面的分辨率,同时也是后续结构变异关联分析的必要条件,随着参考基因集的完善,中等测序深度的浅宏基因组将可以大量应用于这类研究中。
此外,对于这类文章的把握,实验方案的设计也很重要。
这里我们提供一个谷禾参与设计的利用宏基因组技术,研究帕金森疾病与肠道菌群的研究方案示例。
帕金森与肠道菌群研究方案
帕金森氏病(PD)可能始于肠道中α-突触核蛋白原纤维的积聚,这可能与肠道营养不良有因果关系。
在帕金森氏病(PD)中,胃肠道功能很常见,通常先于运动征兆出现。PD可能是由病原体触发的肠道中起始,然后扩散到大脑。
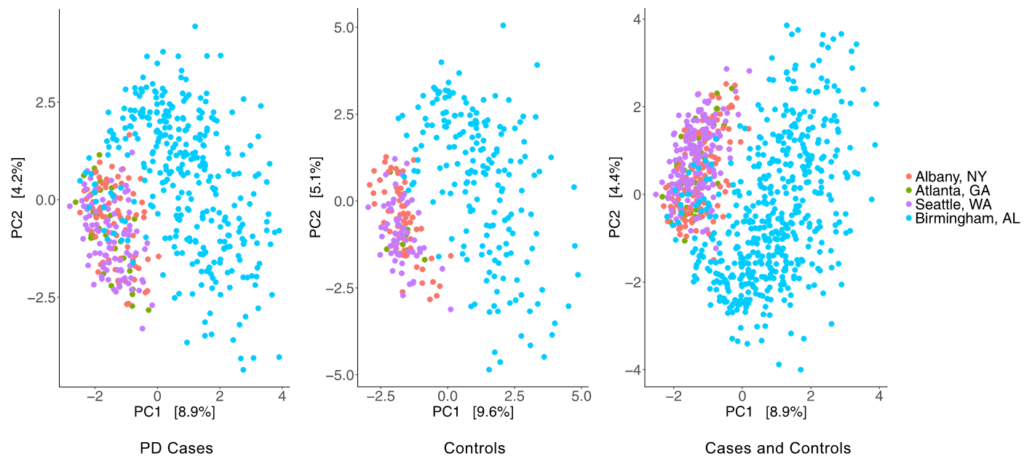
已有多个人群队列研究显示PD患者人群和健康对照人群的肠道菌群Beta多样性存在显著差异。在Wallen等2020年的研究中发现有三个聚类的菌。
簇1由机会性病原体组成,所有PD均升高。
簇2是产生短链脂肪酸(SCFA)的细菌,PD均降低。
簇3是碳水化合物代谢的益生菌,并且PD升高。消炎产生SCFA的细菌的消耗和益生菌水平的升高是确定的。
目前在开展的帕金森队列研究中以荷兰DUPARC前瞻性队列研究为代表,临床试验注册于2019.11.28日。
研 究 方 案
招募150名从头开始研究PD的受试者。参加者将在1年和3年后接受随访评估,以期每3年进行一次扩展随访。
受试者具有广泛的特征,可以主要评估PD的三个主要领域内的目标:认知,胃肠功能和视觉。
这包括
脑磁共振成像(MRI);
脑胆碱能PET显像与氟乙氧基苯甲酸(FEOBV-PET);
具有氟多巴的脑多巴胺能PET成像(FDOPA-PET);
详细的神经心理学评估,涵盖所有认知领域;肠道微生物组组成;
肠壁通透性光学相干断层扫描(OCT);
基因分型运动和非运动症状;
总体临床状况和生活方式因素,包括饮食评估;
血液和粪便的储存,用于进一步分析炎症和代谢参数。
DUPARC是第一个在一段时间内将数据合并但不限于PD受试者认知,胃肠功能和视力的非运动领域数据的研究。作为一个从头开始的PD队列研究,以未接受过治疗的受试者作为基础,DUPARC为生物标志物的发现和验证提供了独特的机会,而不会造成多巴胺能药物的混杂影响。
现有的研究已经明确发现,多巴胺能药物会对菌群和代谢造成干扰,此外如儿茶酚-O-甲基转移酶抑制剂会显著增加乳杆菌科的含量。
另一项关联研究显示儿茶酚-O-甲基转移酶抑制剂(P = 4E-4),抗胆碱能药(P = 5E-3)和可能的卡比多巴-左旋多巴(P = 0.05)均对肠道菌群产生独立显著影响。
因此在构建研究队列时需要区分接受过治疗和未接受过治疗患者,对于接受治疗患者需要采集完整的用药记录信息。
研 究 方 向
目前帕金森与肠道菌群的研究有两种研究方向:
01
向菌群代谢产物,免疫信号,神经递质等方向探索
进一步深入解析肠道菌群在帕金森疾病进展和形成过程中扮演的角色,从已有的菌群构成向菌群代谢产物,免疫信号以及神经递质等方向探索。
单纯的纳入100例左右患者与相应对照人群检测菌群构成已有较多研究,只能从中国人群方面提供人群特异性变化,预期应该会有显著差异,但高水平研究论文较为困难。
研究方法上的改进可以纳入更加完善的临床和生理指标,如药物、认知,胃肠功能和视觉,以及更细化的脑磁共振成像(MRI)和代谢组特征进行组合统计分析。
另外可以从16S改为使用宏基因组测序,从更深和菌株层面发现关键群体以及基因关联。样本人群可以在100例左右,如果有可能尽量选择多中心或多个时间点,作为独立验证队列,以提高研究可信度。
02
解决现有治疗和疾病进展的个体化差异与菌群之间的关联和机制
另一个方向是从药物和疾病进展评估角度,这个方向需要从持续的样本收集和追踪,并纳入更多的临床和治疗信息,从而解决现有治疗和疾病进展的个体化差异与菌群之间的关联和机制。
这类研究纳入患者数量可以在50~100例之间,以病人为主,但需要持续跟踪,研究方案可以选择16S或宏基因组。
上述两个方向可根据临床患者招募和临床条件自行选择或组合。如果对照人群较难招募,建议以第二方向为主。
以上信息与大家分享交流,希望可以对即将或正在开展宏基因组研究的同仁们有所帮助。技术在不断进步,有价值的东西变得更好的方法就是不断更新迭代它,欢迎大家留言和交流。
谷禾健康 原创
肠道是一个复杂的微生态系统,微生物组和宿主之间的相互作用决定了人类代谢的关键生理过程,包括炎症反应,代谢功能以及疾病易感性和发病机制。
在过去的十年中,大量的临床研究表明炎症会改变肠道微生物及其代谢产物,而受影响的肠道以及肠道微生物又会激发免疫响应和代谢活动,从而导致慢性炎症,最终形成慢性疾病。
因此,微生物组稳态的相互作用对于人体健康至关重要,而营养是塑造微生物组的主要驱动力。
生活中大多数人可能都知道过度和长期炎症对身体有害,但许多人对炎症是什么或炎症的如何发生并没有深刻的了解。
炎症,就是人们所说的“发炎”,是免疫系统的一种天然的,保护性的生物反应,可以抵抗有害的外来病原体(细菌,病毒,毒素),并帮助身体恢复健康。
当身体受到某种物质破坏细胞时,身体会释放化学物质,从而触发免疫系统的反应,这种反应包括抗体和蛋白质的释放,以及流向受损部位的血流量增加。例如,在感染的伤口周围出现的红色酸痛是一种炎症反应。身体对炎症的反应是对多种威胁的反应,不仅包括感染,还包括刺激物,压力和身体创伤。
急性炎症
在急性发炎的情况下,整个过程通常持续数小时或数天。急性炎症的症状包括肿胀和发红,发烧,发冷,疼痛和僵硬以及疲劳,这些迹象表明人体的免疫系统处于“战斗模式”,努力消除威胁。
慢性炎症
当身体的免疫反应或者应激反应持续存在时,身体会会长期处于持续的警觉状态,进而会对组织和器官造成负面影响,就会发生慢性炎症。此外,当这种自然的保护性反应过于频繁或在错误的时间发生时,也会会出现炎症问题。
此外,有时候即使外来威胁时,机体也会触发炎症反应,免疫系统会攻击人体自身健康的细胞和组织,从而导致自身免疫性疾病,如多发性硬化症,类风湿性关节炎和红斑狼疮等,这些部分是由于过度的,误导的炎症反应而导致的。
慢性炎症与疾病
发生慢性炎症,人体的免疫系统处于永无休止的战斗模式,激活了没有外部威胁即可抵御的抗病细胞。随着时间的流逝,这些战斗细胞会攻击,磨损并损害全身健康的细胞,组织,器官和系统,从而导致慢性疾病,如肥胖、心脏病,中风,糖尿病和癌症等当今主要慢性病和威胁生命的疾病。
此外,越来越多新的证据表明炎症还会影响我们的心里精神健康。这种影响是通过许多系统施加的,包括免疫系统、肠道微生物、新陈代谢、睡眠、压力反应、认知思维、记忆力、表达、冲动控制和情绪等。
症状
急性炎症通常会引起明显的症状:例如疼痛,发红或肿胀。
但是,慢性炎症症状通常较轻微,这也使它们容易被忽略。
慢性炎症的常见症状包括:
疲劳;发热;口疮;皮疹;腹痛;胸痛;睡眠障碍;焦虑等。
这些症状可能从轻度到严重不等,持续数月或数年。
原因
许多因素可以触发炎症并引发精神和身体症状:
• 短期和长期承受压力。
• 高糖,高加工淀粉/碳水化合物饮食。
• 加工脂肪(加工油,油炸食品)。
• 不良生活习惯
• 食物敏感性/过敏
• 病毒/细菌感染,病原体等
• 自身免疫性疾病
• 药物治疗/手术
• 环境毒素
• 营养不良(饮食中微量和宏观营养成分偏低)。
• 睡眠不良
• 肠道失衡
……
以上这些因素都会诱发炎症,诱发免疫反应,其中肠道是人体最大的免疫器官,肠道物理,化学屏障和肠道菌群构成生物屏障,对于维持宿主免疫的稳态以及耐受和预防病理性免疫反应来影响和改变炎症。肠道微生物通过构建肠道特异性免疫系统和排除感染性病原体参与炎症调节。
肠道是人体最大的免疫器官之一。
肠屏障
肠屏障是一个多层结构,包含微生物,化学,机械和免疫屏障,可以保护宿主免受病原体的侵害。
共生微生物还通过分泌各种物质(例如细菌素)来抑制病原体的定殖,从而参与化学屏障的构建。机械屏障包括粘液,物理吸收,流体动力学系统,上皮细胞和紧密连接。
跨膜蛋白(例如claudins)和胞质蛋白(例如小带闭合蛋白1(ZO-1),ZO-2和ZO-3)参与了紧密连接的构建。肠道相关淋巴样组织(GALT)和弥漫性免疫细胞是形成免疫屏障的重要组成部分。肠道相关淋巴组织通过感知和清除致病细菌的能力维持宿主免疫的稳态,从而通过耐受和预防病理性免疫反应影响炎症。
肠道免疫细胞和因子
炎症反应可导致由多种因素触发的组织损伤。IL-6,TNF和IL-1β属于促炎细胞因子,而细胞通透性蛋白IL-4,IL-10,IL-13和TGF属于抗炎细胞因子,它们在调节炎症反应中起重要作用。
在正常情况下,促炎因子和抗炎细胞因子水平相互平衡,在不引起过多组织损伤性炎症的情况下,维持一定程度的对病原体的保护。这些细胞及细胞因子在肠道感染中起关键作用。例如,脆弱的芽孢杆菌可将荚膜多糖A通过外膜囊泡转移至树突细胞,并且该树突细胞能够诱导Treg分泌IL-10以预防或限制IBD。荚膜多糖A还可以直接激活TLR2信号通路以抑制Th17细胞诱导的免疫反应。Th17细胞会引发炎症来抑制感染,而Treg细胞则在威胁消退后抑制炎症。如果不加抑制,Th17的活性也会导致异常炎症,从而促进自身免疫性疾病,损害肠道。
IL-6可以增加肠上皮的通透性并导致T细胞蓄积,从而维持炎症反应。同时,IL-6可以激活经典补体途径。它增加了补体5a的数量和血管的渗透性,然后导致组织损伤。
TNF分为TNF-α,TNF-β和TNF-γ。尤其是TNF-α可以诱导炎症反应。它是由单核巨噬细胞,淋巴细胞和成肌细胞分泌的。它可以破坏完整性并增加肠屏障的通透性,并促进促炎细胞因子的分泌,从而放大炎症反应。TNF-α与作为膜受体的TNF受体1结合,并通过激活TNF受体2相关的死亡域蛋白,Fas相关死亡域蛋白(FADD),FADD(如IL-1β转换酶,caspase-3,和caspase-9)。
肠道失衡会导致肠壁(称为“漏肠”)损坏。结果,毒素和细菌通过肠道“泄漏”并进入血液,从而引发免疫系统的反应:炎症。
肠道菌群构成了微生物屏障。它通过与病原菌竞争宿主上的营养和粘附位点来抑制病原菌的生长和繁殖。
微生物与免疫炎症信号
先天性免疫识别通过一系列复杂的跨膜或胞浆内模式识别受体阵列,通过对微生物相关分子模式的特异性检测和结合,直接影响宿主防御,从而激活信号通路。B. thetaiotaomicron 和柔嫩梭菌分泌的MAM多肽能够通过抑制实验性结肠炎小鼠的促炎相关NF-kB通路从而改善炎症指标。
适应性免疫反应依赖于从CD4+T细胞分化而来的效应T细胞亚群。研究发现丁酸梭菌能在C57BL/6小鼠体内产生足够数量的转化生长因子-β(TGF-β),从而产生依赖于TLR 2依赖的ERK-AP-1激酶途径和Smad 3的iTreg细胞,并相应减轻炎症。脆弱类杆菌产生共生因子,如多糖A,可通过促进产生IL-10的CD4+T细胞参与炎症调节,从而下调IL-17。
肠道微生物组可以通过抑制NF-κB抑制剂的泛素化来建立肠道免疫耐受,从而抑制NF-κB信号通路。同时,肠道微生物组是刺激免疫系统成熟的重要因素。
上皮细胞和抗原呈递细胞表面上的Toll样受体可以识别上述细菌,激活NF-κB,导致炎症基因转录,并引起肠道炎症。但是,丁酸会限制NF-κB的活化和IL-12的分泌和TNF-α的证据,某些产生丁酸的细菌可能会限制肠道的炎症。
Th2细胞的细胞因子分泌来减轻小鼠皮炎。短链脂肪酸与G蛋白偶联受体43结合以减轻中性粒细胞的炎症并通过抑制NF-κB的活化以及IL-12和TNF-α的分泌来调节炎症反应。从患有IBD的小鼠向正常小鼠移植粪便菌群可以诱导肠道粘膜分泌IL-33并激活Th2细胞以介导导致回肠炎的免疫反应。
微生物与免疫发育成熟
B. subtilis 和 B. fragilis细菌被证明促进免疫组织的发育。嗜酸杆菌、嗜酸双歧杆菌和普氏菌是调节非特异性免疫的重要细菌,它们通过维持和强化组织屏障,增加固有免疫细胞数量,促进天然免疫分子的分泌来调节非特异性免疫。双歧杆菌、干酪乳杆菌、梭状芽孢杆菌、枯草杆菌以及脆弱芽孢杆菌通过MyD88、转化生长因子-β、IL-1、IL-6、IL-17、IL-22、γ-PgA和PSA与特异性免疫密切相关。 脆性芽孢杆菌、植物双歧杆菌、双歧杆菌可通过TLR、NF-κB和MyD88调节炎症反应。

H Tan, S Nie.Trends in Food Science & Technology, 2020
乳酸杆菌和双歧杆菌可以通过限制T细胞和先天免疫细胞的活性来增加Treg的数量来控制肠道炎症。共生细菌可以降低无菌小鼠中高浓度的IgE,这限制了Th2细胞诱导的炎症反应。
用鼠李糖乳杆菌预处理牛乳腺上皮细胞(BMEC)可以减少大肠杆菌的定殖,并通过抑制含有3(NLRP3)的NLR家族吡啶结构域的激活来减弱炎症反应和细胞损伤。
肠道菌群构成丰度与炎症
炎症性肠病(IBD)是肠道的非特异性炎症。肠道菌群失衡被确定为IBD的主要原因。Roseburia的较低丰度与IBD的发生率较高相关。
在IBD患者的肠道中,Ruminococcaceae和Rikenellaceae菌含量较低,菌群α多样性的减少,放线菌和变形菌门的丰度增加。而且在物种水平上,潜在病原体(如大肠杆菌)的增加,而有益细菌(如生产丁酸的费氏杆状杆菌)减少。
自身免疫性胰腺炎患者肠道中的拟杆菌,链球菌和梭状芽胞杆菌数量增加。类风湿关节炎患者肠道中的拟杆菌,轻梭状芽胞杆菌和嗜血杆菌数量减少,而唾液乳杆菌的数量增加。
炎症扩散到包括肠道以及神经系统在内的其他器官,并加剧了人们对各种症状的出现的脆弱性,这些症状被我们称为感觉加工障碍,自闭症(ASD),多动症(ADHD),对立反抗性障碍(ODD),边缘人格障碍(BPD),抑郁症,焦虑症等。
一项研究中发现,与未确诊PTSD,OCD或焦虑症的人相比,其炎症标志物的水平明显更高。罹患PTSD的创伤幸存者的肠道微生物组和未罹患PTSD的微生物组。罹患PTSD的参与者的三种细菌-放线菌,扁豆菌和Verrucomicrobia的水平明显较低。
经历过童年创伤的参与者的这三种细菌的含量也明显较低。这三种细菌的含量低可能导致患有PTSD的创伤幸存者的免疫系统失调和炎症的高标志物。
肠道菌群与免疫炎症指标(案例数据)
在很多人体内存在免疫失衡,如过度炎症,在没有严重病原物感染的情况下产生了大量的炎症信号,从而对肠道和其他器官产生损害,持续的慢性炎症更会导致许多慢性疾病,如代谢类的疾病等,更加严重的炎症问题会导致自身免疫性疾病。
已有研究显示不同的肠道菌群可以通过免疫反应、影响肠道屏障以及通过胆汁酸转化等代谢途径影响免疫细胞相互作用,从而影响免疫调节。
借助这些方面的研究和临床数据,我们可以通过肠道菌群从几个方面来反映和了解免疫系统及自身的炎症状态。
病原菌的存在很大程度上会激发免疫系统的炎症,因此首先评估肠道菌群中是否存在异常的病原菌超标情况。
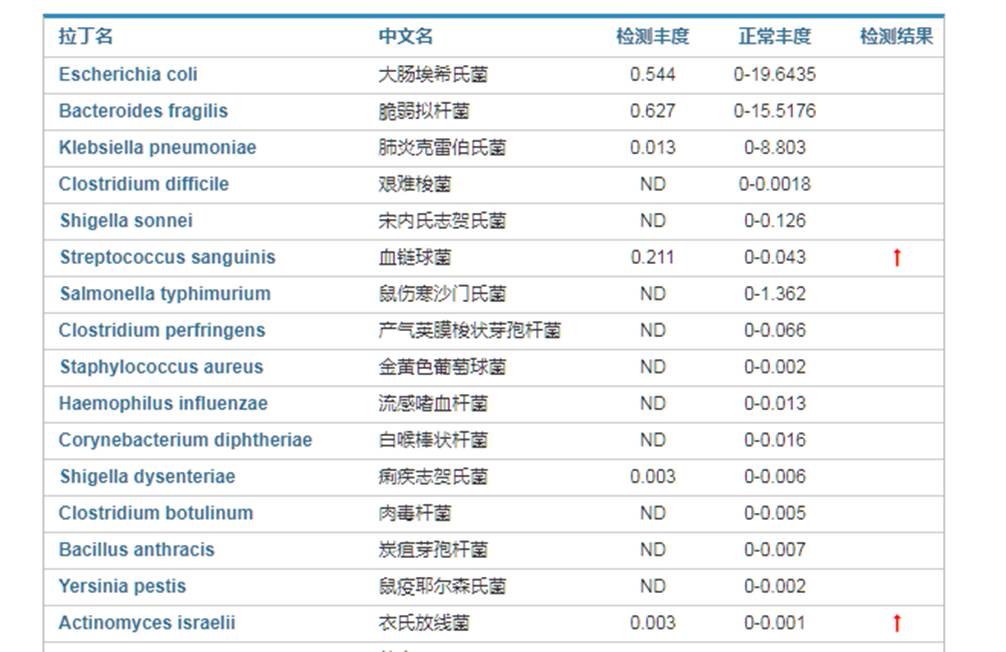
来自谷禾健康肠炎临床患者肠道菌群检测报告,结果显示血液链球菌及衣氏放线菌超标,如下:
类似的病原菌超标在没有严重导致感染症状的情况下也会诱发或刺激免疫系统炎症,如果免疫力低下就可能导致病原菌感染,如果持续存在超标也可能导致慢性炎症。
除了病原菌超标,很多其他类型的菌也会诱发肠道炎症,尤其非肠道“常见菌”占据主要比例的时候:如该案例样本肠道菌群构成,如下:
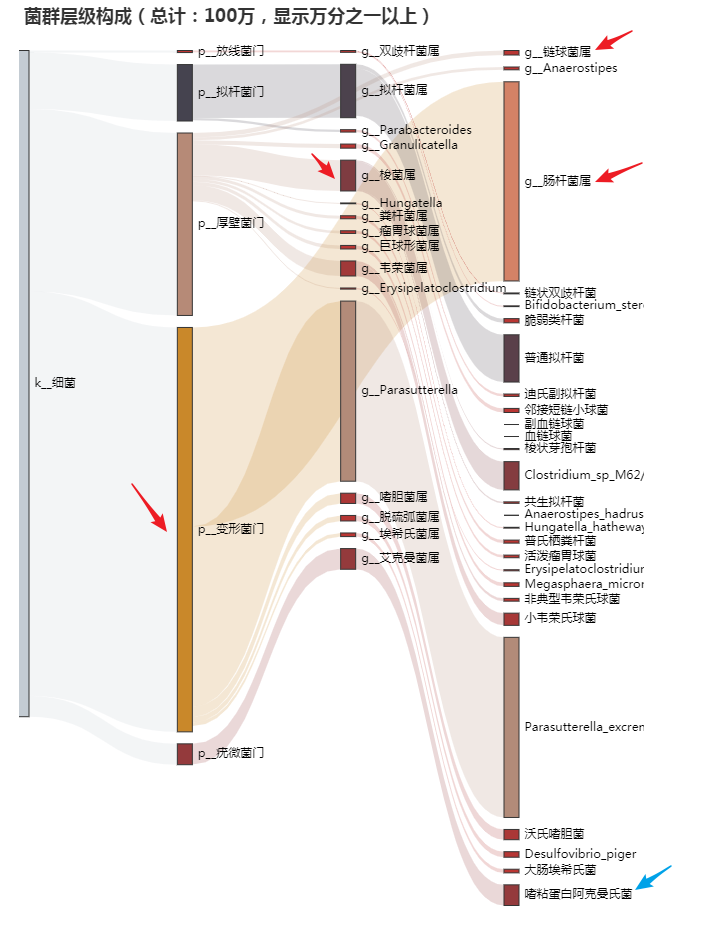
如上面红色箭头标示出的多种菌:其中变形菌门占据了一半以上的比例,该菌门下多数菌会对肠道菌群环境产生不利影响。链球菌属以及梭菌属都有很多成员也会导致炎症。
此外,蓝色箭头标示的阿克曼菌即Akk菌一般认为是益生菌,但该菌可以降解肠粘膜的黏蛋白,丰度过高可能导致肠道屏障破坏。
基于研究结果以及大样本临床数据和免疫组学检测相结合,我们发现肠道菌群可以对一些免疫炎症相关指标进行评估和预测,下面的例子就显示了存在炎症状况的指标异常:
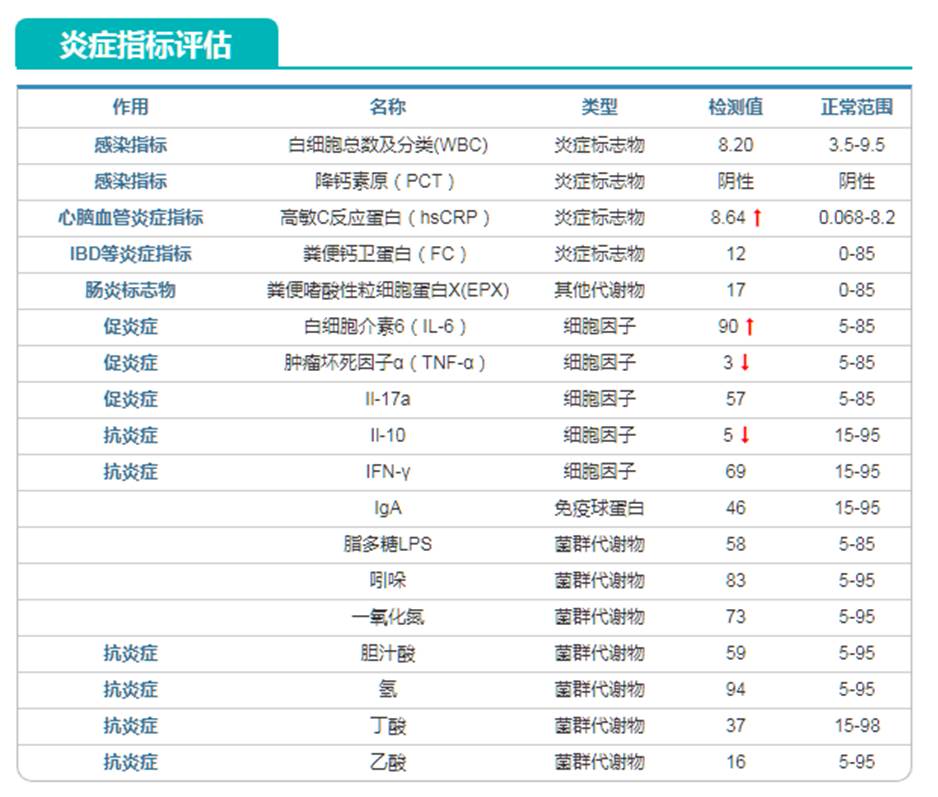
可以看到包括高敏C反应蛋白和IL-6这两个炎症指标都超标,而IL-10这个抗炎症指标过低。
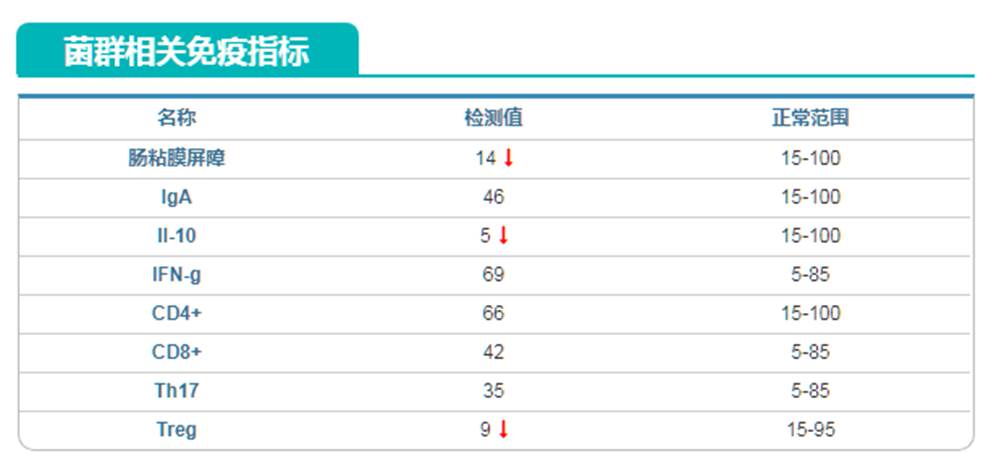
同样基于菌群的免疫指标也提示Treg抗炎细胞过低,另外由于之前Akk菌丰度过高,导致肠粘膜屏障指标提示异常。

肠道微生物代谢与炎症
免疫细胞代谢过程的调节对于维持体内平衡和免疫发病机制至关重要。新的数据表明,肠道微生物群在免疫代谢中起作用,尤其是通过代谢产物,如短链脂肪酸、胆汁酸和色氨酸代谢物的作用。
炎症黏膜的代谢分析表明,宿主和微生物组的中心代谢产物和代谢途径均受炎症环境的影响。例如,在IBD患者发炎的粘膜中,有益细菌数量的减少转化为SCFA水平降低,尤其是丁酸水平降低。
此外,最近的研究表明,由微生物生产丁酸还确定在IBD患者响应于生物疗法。用可发酵纤维(益生元)补充饮食是一种吸引人的方法,可促进有益细菌的生长并恢复缺失的代谢功能,即SCFA的产生。这可以解决炎症或至少减轻由炎症环境引起的代谢应激。最初的人类研究确实支持了此概念的可行性。
对宿主的免疫反应至关重要的另一类代谢物是色氨酸代谢物。至于SCFA,IBD患者血清中的色氨酸代谢物水平降低了。
使用小鼠进行的营养研究表明,饮食中缺乏色氨酸会导致结肠炎,并补充色氨酸以防止发炎。将失调的微生物组从喂食色氨酸缺乏饮食的小鼠转移到喂食正常饮食的无菌受体,足以引起结肠炎。在小鼠中,色氨酸代谢菌株罗氏乳杆菌可预防结肠炎。当它将色氨酸代谢成吲哚丙烯酸时,它是通过增强上皮屏障功能和减少炎症反应而起作用的芳烃受体的配体。
膳食色氨酸还可以通过增加调节微生物组组成并防止机会病原体感染的抗菌肽的产生来影响上皮免疫性。与IBD相反,在多发性硬化的鼠模型中,缺乏饮食色氨酸可防止中枢神经系统自身免疫,这是由于致脑病的T细胞反应受损和微生物组发生了深远的变化。
值得注意的是,饮食中色氨酸限制的保护作用在无菌小鼠中被取消,并且与色氨酸代谢物的原型传感器无关,这表明这些保护作用可以通过微生物组的代谢功能来介导。
肥胖被认为是一种轻度炎症,与正常人相比,肥胖个体的肠道微生物组多样性更低,而拟杆菌属的减少和放线菌的增加。
在肥胖症中,内毒素介导的轻度炎症的概念是营养,微生物组和炎症的桥梁。根据这一理论,西方饮食引起的营养不良会增加内毒素的水平,内毒素是革兰氏阴性细菌外膜的一个组成部分,然后以较高的浓度通过血液循环到达肝脏和脂肪组织等其他器官,足以满足刺激组织驻留的免疫细胞,从而导致免疫反应和器官功能受损。
微生物组与动物一起进化了数千年,并且已经建立了共生关系以确保微生物和宿主的生存。影响肠道微生物的因素很多,其中膳食营养是主要的驱动和塑造因素,具体可以参见:
肠道微生物参与营养的消化和吸收。例如,肠道微生物通过分泌消化酶和增强酶活性来增加宿主营养物质的消化率,从而在营养物质的收获中发挥重要作用。
与人类的新陈代谢潜力相反,微生物组对环境因素(即饮食和营养)具有很大的可塑性。有害的微生物组改变,例如有益细菌的丧失(例如,Akkermansia muciniphila,Paecalibacterium prausnitzii,Roseburia产生和供应短链脂肪酸(SCFA)和维生素,或者病原体的扩张(例如变形杆菌),这可能会导致易感宿主感染,也可能加剧疾病的发病机理或对治疗方法产生抵抗力。
此外,微生物代谢物(例如SCFA丁酸酯或色氨酸代谢物)控制宿主中的各种生理功能,范围从炎症反应到上皮细胞的能量代谢。因此,针对微生物组的个性化治疗方法有望改善营养不良和慢性炎症(例如炎症性肠病(IBD))的治疗功效。具体可以参见:
肠道菌群与宿主免疫力和炎症的调节密切相关。例如,饮食中的益生菌可增强宿主动物的免疫力并减少其炎症反应。大量的流行病学研究表明,食用富含不饱和脂肪的地中海饮食与寿命延长和慢性亚临床炎症疾病(如冠心病或糖尿病)的患病率较低相关。
在与肥胖个体随机对照试验,地中海饮食增加了产生短链脂肪酸的Roseburia 和 Oscillospira菌的丰度,而富含复合碳水化合物饮食增加Prevotella 和F. prausnitzii.菌的丰度。两种饮食都增加了胰岛素敏感性。
类似地,SCFA产生缺乏与糖尿病相关。在一项针对糖尿病患者的最新临床试验中,补充等能量的高纤维饮食可在个体之间不同程度调节几种产生SCFA的细菌的丰度。在纤维诱导的高水平Bifidobacterium pseudocatenulatum C95 和 F. prausnitzii CAG0106的受试者中,血红蛋白A1c水平降低,总体临床结果得到改善。
最近的一项先导研究测试了对肥胖,胰岛素抵抗患者的A. muciniphila的管理。的确,在饮食中补充A. muciniphila3个月可以减轻体重,减轻肝功能不全或炎症的血液指标,并改善一些代谢参数,例如胰岛素敏感性。
对于IBD,也已报道了减少A. muciniphila的丰富度,这使阿克曼囊虫病成为针对这些炎性疾病的微生物组治疗的诱人靶标。
迄今为止,只有极少数益生菌产品在随机临床研究中显示出有益的作用。在IBD中,涉及完全液态配方饮食的独家肠内营养(EEN)已被证明是一种有效的治疗选择,可以诱导活动性克罗恩病缓解,并且与类固醇相比,在诱导粘膜愈合方面具有更高的功效。值得注意的是,EEN增加细菌多样性和产生SCFA菌如Clostridium symbiosum, C. ruminantium, C. hathewayi, Ruminococcus torques 和R. gnavus的丰度。
图. 微生物组指导的营养干预措施,用于治疗营养不良和慢性炎症。
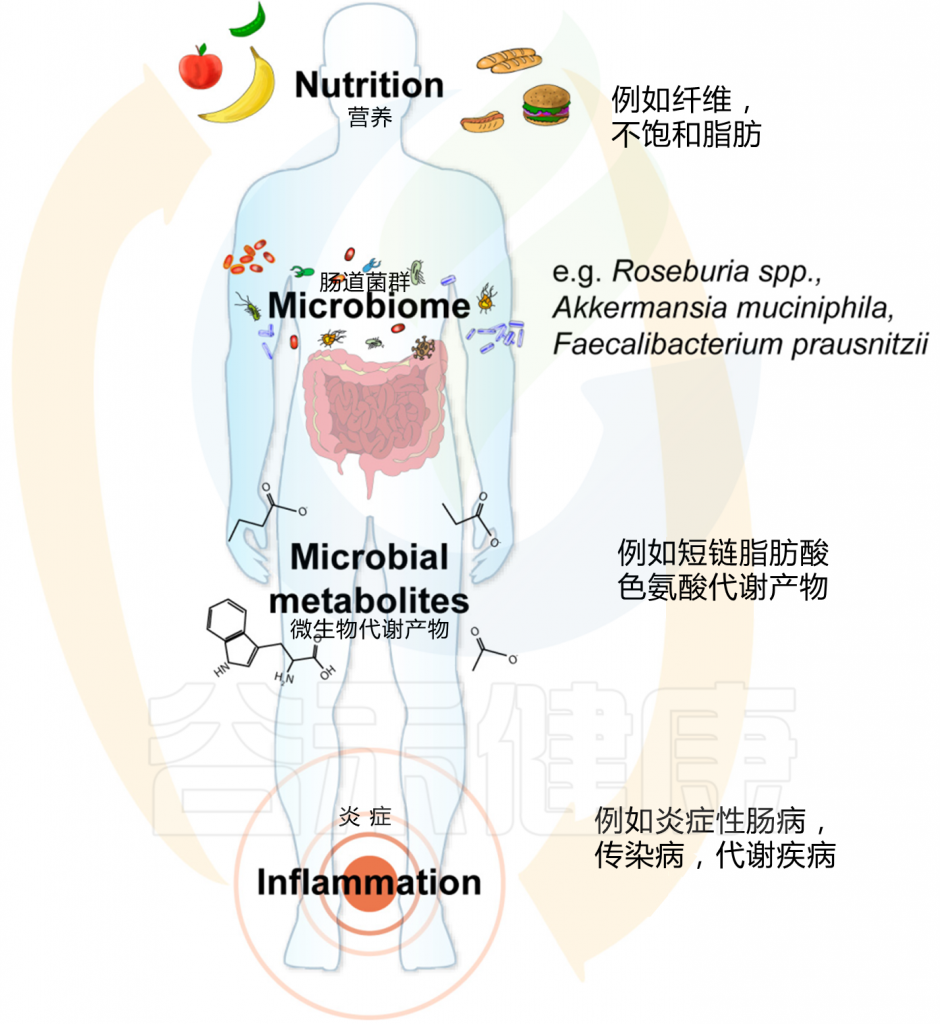

Schröder L et al., 2020. Nutrients
营养物质直接影响营养不良和炎症的发病机制,例如通过促进宿主的新陈代谢。然而,营养也是影响微生物组组成和功能的主要环境因素
正确、科学、合理地评价居民膳食质量可为居民营养健康状况的改善提供必要、可靠的参考依据。在膳食评价方法中,最为常用的方法是指数法。
膳食炎症指数
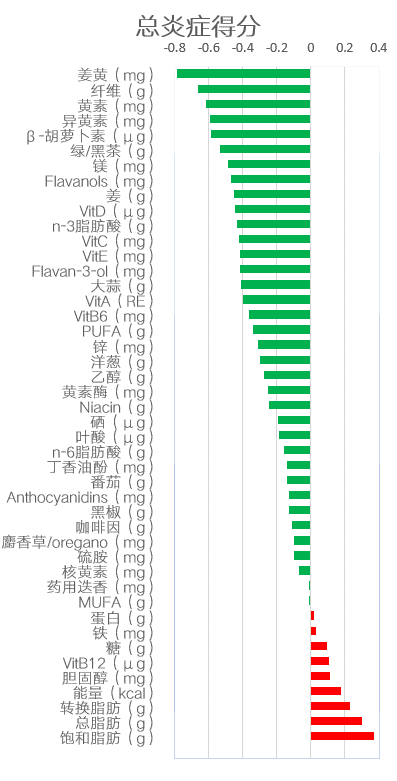
膳食炎症指数(dietary inflammatory index,DII)是由南卡罗来纳州大学研究人员在癌症预防和控制项目中开发得来, 它是文献衍生的膳食工具,用来评估个人饮食的总体炎症潜能。
DII 共由45 种膳食成分组成,每一种成分都会增加或减少个人的总体炎症评分, 最初用来评价DII 的各项炎症指标是从1950 年—2010 年的1943 篇文献研究中得来的,炎症因子的选择基于它们在炎症机制中的重要性和文献回顾性研究;用来评价炎症指数的标志物共分6 种, 即IL-1β、IL-4、IL-6、IL-10、TNF-α 和CRP,若一种食物能显著提高IL-1β、IL-6、TNF-α和CRP 水平或降低IL-4 和IL-10 水平, 则赋予“+1”评分,相反则赋予“-1”评分。
最初的研究发现血液中的C 反应蛋白(CRP)随着季节性的改变而发生变化,膳食炎症指数的高低能够显著预测出CRP 水平呈现区间性变化;且有大量的研究数据表明,饮食因素在慢性炎症的调节中起重要作用。
鉴于此,最初建立原始膳食炎症指数可用来量化个人饮食中的炎症因素,并对饮食中炎性因素的作用从抗炎至促炎进行连续性分类,见下图。
(图数据源自文献黄利等,2019,实用医药杂志)
你吃的食物在控制慢性炎症方面可以起到积极和消极的作用。
如果你希望长寿健康,那么你可能需要接受抗炎饮食。
一项来自波兰的研究对年龄在45至83岁之间的68,273名瑞典男女,进行了16年的追踪研究,那些坚持使用抗炎饮食的人的全因死亡率降低了18%,癌症死亡的风险降低了13%,心脏病死亡的风险降低了20%。饮食中含有能减少体内炎症指标的食物,可以降低我们早逝的风险。
什么是抗炎饮食?
国际食品信息理事会基金会(International Food Information Council Foundation)营养传播副主任RD将其描述为一种饮食,重点关注高营养的食物,任何“营养密集”,“天然来源的维生素,矿物质和色素很多”的食物都是这种饮食的理想成分。
尤其是抗氧化剂, “它的主要参与者是水果,蔬菜,豆类,健康脂肪等食物,例如橄榄油和鳄梨中的食物,包括鱼类,坚果和浆果等。
但是,抗炎饮食不仅是您的饮食,而且与食物的烹饪方式有关。应限制或避免高盐,饱和脂肪,糖和精制碳水化合物的食物。
美国麻省理工大学医学院开发的肠道抗炎饮食(IBD-AID)。这种饮食最初被用于炎症性肠病患者的治疗。
2011-2014年期间,麻省医学院的研究人员先后对51位患有炎症性肠病的患者进行IBD-AID饮食干预治疗,患者的年龄从19-70岁不等,最出的11位患有炎症性肠病的患者在经过6-10个月的IBD-AID饮食后,所有患者的症状都得到了明显的好转。
另外的40名患者其中,13名患者选择了不去尝试。而在尝试进行这种饮食的27位患者中, 24位患者(89%)得到了明显的好转。
在进行了IBD-AID的患者中,有11位接受了进一步的医学评估(8位克罗恩患者,3位溃疡性结肠炎患者,年龄在19-70之间)。在进行IBD-AID饮食后,这11位患者都停掉了一种以上的药物治疗。
因此,这种饮食的作用并不局限于此。它提供了一个非常好的肠道疗愈的饮食框架范例——用于减轻炎症、重建菌群,并与此同时保证营养摄入的充足。
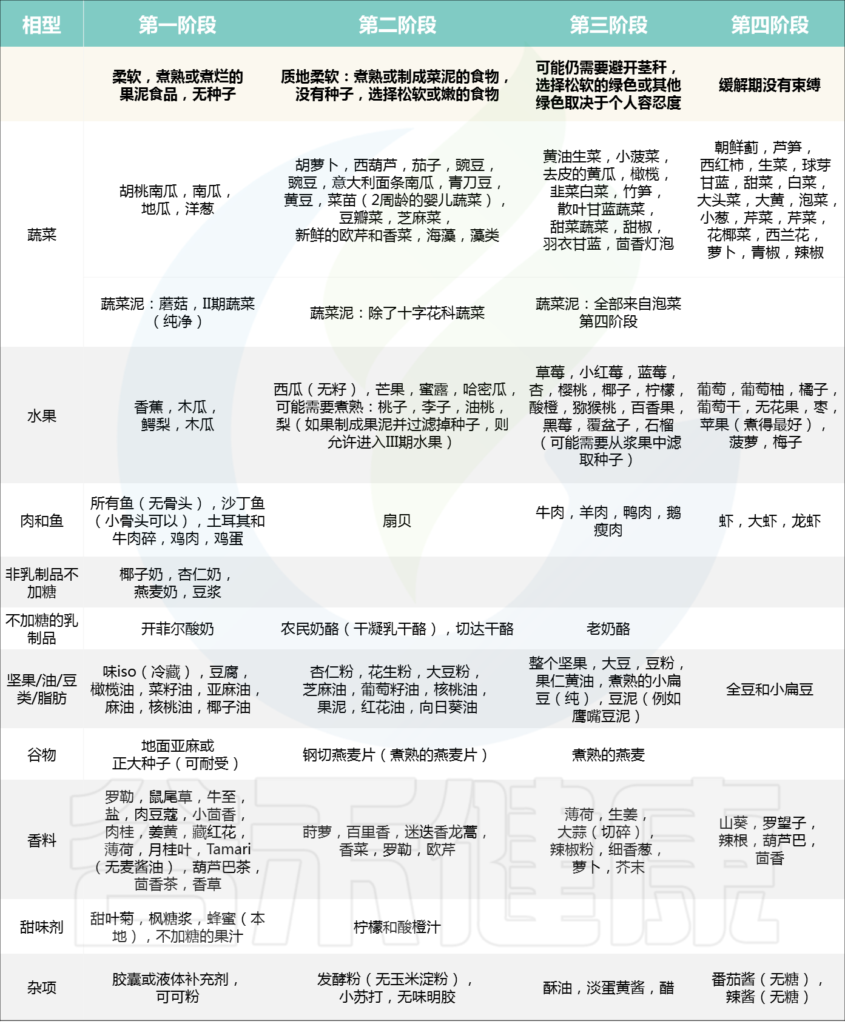
不同炎症期不同饮食
在炎症发作期、症状改善期、症状缓解期和维护期,患者对食物的耐受程度是不同的。如果你在当前处于炎症状态,可能需要从第一阶段开始。
//第一阶段
在这一阶段,食物的质地是非常重要的。你可能需要一个好的料理机,来对一些蔬菜和水果打泥。
//第二阶段
症状改善了许多,但可能仍旧存在一些症状。在这一时期,应该慢慢地增加一些纤维更高的食物,包括煮软的蔬菜和捣烂的豆类。与此同时,可能需要增加更多的含益生菌的食物,比如酸奶和奶酪。
//第三阶段
感觉消化变得好多了,排便状况也基本正常了。这个时候,你就可以加入更多的食物了。但也不要掉以轻心,症状的改善不意味着黏膜的完全修复。
//第四阶段
可能还是需要注意避免那些不允许的食物,从而为你的身体争取更长的修复时间。
基于上面,IBD-AID有五个基本组成部分:
第一,是对某些碳水化合物(包括乳糖、精制或加工的复合碳水化合物)的改性;
第二,非常强调摄取前体和益生菌(如可溶性纤维、韭菜、洋葱以及发酵食品),以帮助恢复肠道菌群的平衡;
第三,区分饱和脂肪、反式脂肪、单不饱和脂肪和多不饱和脂肪;
第四,鼓励对整体饮食模式进行回顾,检测肠道菌群和缺乏的营养素,并确定不耐症;
第五,根据需要修改食物的质地(例如,混合、研磨或烹调),以提高营养物质的吸收,并尽量减少完整的纤维。
下表中所示的阶段是修改结构复杂度的例子,营养师和患者可以随着患者耐受性和吸收能力的提高而扩大饮食。
Olendzki BC, et al. Nutr J.2014
IBD-AID方案它不仅制定了“能吃什么和不能吃什么”的标准,还回答了“什么东西应该吃多少”的问题。
前者能帮助你避免那些可能诱发肠道炎症的食物,并专注于那些营养密度高的食物。而后者,则让你在避免问题食物的同时,依然能摄入足够的营养。
肠道抗炎饮食能与不能
肠道抗炎饮食避免了那些容易造成问题的碳水化合物,包括谷物(除无麸质的燕麦)、乳糖和添加糖。
与此同时,肠道抗炎饮食强调“低饱和脂肪”——也就意味着需要限制动物油脂的摄入。如果不是处于低碳水或生酮饮食,饱和脂肪是可能造成问题的——引起血液中脂多糖的上升,从而增加人体的炎症反应。
肠道抗炎饮食不是“低碳”,就限制了饱和脂肪的摄入。
肠道抗炎饮食的选择要更为宽泛,比如,它允许燕麦、紫菜、豆腐以及许多豆类。为什么会允许这些食物?因为新的研究,也因为新的反馈。
就燕麦来说,研究发现,其中的β葡聚糖可能可以起到缓解肠道炎症的作用。而麻省医学院招募的受试患者,大多都能较好地耐受无麸质的燕麦。因此,他们将燕麦重新加入到了允许食物的列表中。
不同烹饪方式的豆类具有不同功效
而另一些食物,比如豆类,其中的问题物质是可以通过烹饪来解决的。生的豆类中含有较高的凝集素,可能会对肠道造成损伤。
但如果用高压锅烹饪,烹饪15分钟,超过98%的凝集素都会被去除。经过足够的浸泡时间再进行烹饪,效果还会更好。研究也发现,一些豆类的摄入,可能对修复肠漏是有帮助的。
很多种食物均具有抗炎特性,其中包括抗氧化剂和多酚含量高的食物。
肠道抗炎饮食推荐的食物包括:
抗炎食物
1 浆果
浆果是小果实,富含纤维,维生素和矿物质。
尽管存在几十个品种,但最常见的品种包括:
草莓、蓝莓、山莓、黑莓等。
浆果含有花青素的抗氧化剂。这些化合物具有抗炎作用,可降低患病的风险。身体会产生自然杀伤细胞(NK细胞),有助于保持免疫系统正常运转,并降低患心脏病的风险。
在一项针对男性的研究中,每天食用蓝莓的人比不食用蓝莓的人产生的NK细胞要多得多。
在另一项研究中,吃草莓的体重超重的成年人与心脏病相关的某些炎症标记物含量较低。

2 肥 鱼
肥鱼是蛋白质和长链omega-3脂肪酸EPA和DHA的重要来源。
尽管所有类型的鱼都包含一些omega-3脂肪酸,但这些脂肪鱼是最好的来源之一:
三文鱼、沙丁鱼、鲱鱼、鲭鱼、鳀鱼等。
身体将这些脂肪酸代谢为可分解的物质,称为Resolvins和protectin,具有抗炎作用。
研究发现,食用鲑鱼或EPA和DHA补充剂的人的炎症标志物C反应蛋白(CRP)减少了。但是,在另一项研究中,与服用安慰剂的人相比,每天服用EPA和DHA的心律不规则的人在炎症指标上没有差异。
3 西兰花
西兰花,一种十字花科蔬菜,还有花椰菜,抱子甘蓝和羽衣甘蓝。
研究表明,多吃十字花科蔬菜与降低患心脏病和癌症的风险有关。
这可能与其所含抗氧化剂的抗炎作用有关。
西兰花是萝卜硫烷的最佳来源之一,萝卜硫烷是一种具有强大抗炎作用的抗氧化剂,可通过减少引起炎症的细胞因子和NF-kB的水平来对抗炎症。
4 鳄梨
鳄梨可能是少数值得冠以的超级食品之一,提供各种有益的化合物,可防止发炎并降低癌症风险。
它们富含钾,镁,纤维和有益于心脏健康的单不饱和脂肪。
它们还含有类胡萝卜素和生育酚,与降低癌症风险相关。此外,鳄梨中的一种化合物可以减轻年轻皮肤细胞的炎症。
在一项研究中,当人们食用一片鳄梨和汉堡包时,与单独吃汉堡包的参与者相比,他们的炎症标志物NF-kB和IL-6含量较低。

5 绿茶
你可能听说过绿茶是您可以饮用的最健康的饮料之一。它可以降低患心脏病,癌症,阿尔茨海默氏病,肥胖和其他疾病的风险。
它的许多优点归因于其抗氧化剂和抗炎特性,尤其是一种叫做表没食子儿茶素-3-没食子酸酯(EGCG)的物质。
EGCG通过减少促炎性细胞因子的产生以及对细胞中脂肪酸的破坏来抑制炎症。
6 辣椒
甜椒和辣椒中富含维生素C和抗氧化剂,具有强大的消炎作用。
甜椒提供抗氧化槲皮素,可以减少结节病,炎性疾病;辣椒中含有芥子酸和阿魏酸,可减少炎症并导致更健康的衰老。

7 蘑菇
尽管全世界有成千上万的蘑菇品种,但只有极少数是可食用的并且可以商业种植。这些包括松露,波多贝罗蘑菇和香菇。
蘑菇的热量非常低,并且富含硒,铜和所有B族维生素。它们还包含提供抗炎保护的酚和其他抗氧化剂。
特殊蘑菇可能会减轻与肥胖有关的低度炎症。
8 葡萄
葡萄含有花青素,可减少炎症。
此外,它们还可以降低多种疾病的风险,包括心脏病,糖尿病,肥胖症,阿尔茨海默氏病和眼疾。
葡萄还是白藜芦醇的最佳来源之一,白藜芦醇是另一种具有许多健康益处的化合物。
在一项研究中,每天食用葡萄提取物的心脏病患者的炎症基因标志物(包括NF-kB)。
更重要的是,他们的脂联素水平增加了。低水平的这种激素与体重增加和罹患癌症的风险增加有关。

9 姜黄
姜黄是一种具有浓郁土味的香料,通常用于咖喱和其他印度菜肴。
姜黄素是一种强大的抗炎营养素,因此受到了广泛的关注。姜黄可减轻与关节炎,糖尿病和其他疾病相关的炎症。
实际上,每天摄入1克姜黄素与黑胡椒中的胡椒碱合用会导致代谢综合征患者的炎症标志物CRP显着降低。
但是,可能很难获得足够的姜黄素来单独从姜黄中获得明显的效果。在一项研究中,体重超标的妇女每天服用2.8克姜黄,其炎症指标没有改善。
服用含有孤立姜黄素的补品更有效。姜黄素补充剂通常与胡椒碱结合使用,可将姜黄素吸收率提高2,000%。

10 特级初榨橄榄油
特级初榨橄榄油是可以吃的最健康的脂肪之一。
它富含单不饱和脂肪,是地中海饮食中的主要食物,具有许多健康益处。
研究将特级初榨橄榄油与降低患心脏病,脑癌和其他严重健康状况的风险联系起来。在一项关于地中海饮食的研究中,每天摄入1.7盎司(50毫升)橄榄油的人们的CRP和其他一些炎症标记显着降低。
油橄榄中的一种抗氧化剂油橄榄素的作用已与布洛芬(ibuprofen)等抗炎药进行了比较。
特级初榨橄榄油比更精制的橄榄油具有更强的抗炎作用。

11 黑巧克力和可可
黑巧克力既美味又丰富,令人满足。
它还富含抗氧化剂,可减轻炎症。这些可能会降低患病的风险并导致更健康的衰老。
黄烷醇负责巧克力的抗炎作用,并保持动脉内的内皮细胞健康。在一项研究中,吸烟者在食用高黄酮醇巧克力后2小时内,内皮功能显着改善。
但是,请确保选择可可含量至少为70%的黑巧克力-更大的百分比甚至更好-以获得这些抗炎功效。

12 西红柿
西红柿是番茄红素的极好来源,它可以减少炎症并预防癌症。
西红柿富含维生素C,钾和番茄红素,这是一种抗氧化剂,具有令人印象深刻的抗炎特性。
番茄红素对于减少与几种癌症有关的促炎化合物可能特别有益。一项研究确定,喝番茄汁可以显着减轻体重过重的女性的炎症指标,但对于肥胖的女性却没有。
注意用橄榄油烹饪西红柿可以最大程度地吸收的番茄红素。这是因为番茄红素是一种类胡萝卜素,一种营养物质,可以更好地被脂肪吸收。

13 樱桃
樱桃美味可口,富含抗氧化剂,例如花青素和儿茶素,它们可以抵抗炎症。
尽管对酸樱桃的促进健康特性的研究超过了其他品种,但甜樱桃也提供了好处。
在一项研究中,当人们每天食用280克樱桃,持续1个月时,其炎症标志物CRP的水平下降,并在他们停止食用樱桃后28天内保持较低水平。

14 豆类
豆类富含纤维和植物营养素,有助于减少炎症。
它们甚至含有叶酸和重要的矿物质,包括:
镁、铁、锌、钾盐等。
15 洋葱
洋葱富含营养抗氧化剂,并且实际上可能会减少患心脏病和高胆固醇的风险。
16 高纤维食品
已知纤维会降低C反应蛋白(CRP),CRP是血液中发现的一种物质,提示存在炎症。
高纤维食物包括:如燕麦片,碾碎的干小麦,糙米,藜,和全麦面粉确保营养纤维的更高的水平。但是,如果你患有麸质过敏症,那么由小麦制成的全谷物会对你的炎症产生反作用。
在受伤或感染期间,身体会释放化学物质以帮助保护它并抵抗任何有害生物。但是,食用过多的促炎食物可能会导致慢性低度发炎。这可能会导致严重的健康问题和肠道紊乱,例如心脏病,糖尿病,癌症和过敏症。
促炎食物
1 糖和精制碳水化合物
其中尤其要注意糖的摄入: 国家卫生和健康委员会发布调查显示,我国居民的盐油糖摄入量超标,存在不合理膳食现象。
由科信食品与营养信息交流中心发布的《中国十大城市食品健康发展调研报告2020》,该报告中对这些城市推行“减油、减糖和减盐”原则的现状也进行了统计和分析,得出减糖最有成效。
摄入过多的糖和精制的碳水化合物与体内炎症增加以及胰岛素抵抗和体重增加有关。
糖过多与炎症有关
有大量证据表明,标准的西方饮食(加工糖和脂肪含量高)会导致肠道微生物群的组成以及包含这种微生物集合的肠壁强度发生 不健康的变化,并使它们远离进入血液,会引起炎症和其他损害健康功能的行为。
多项动物研究表明,高糖饮食会导致肥胖,胰岛素抵抗,肠道通透性增加和低度炎症。
人体研究证实了添加的糖和较高的炎症标记之间的联系。一项针对29位健康人的研究发现,每天仅从一罐375毫升苏打水中仅摄入40克添加糖,会导致炎症标记,胰岛素抵抗和LDL胆固醇增加。这些人也倾向于增加体重。
另一项针对超重和肥胖人群的研究发现,每天食用一罐普通苏打水六个月会导致尿酸水平升高,这是引发炎症和胰岛素抵抗的诱因。饮用无糖汽水,牛奶或水的受试者尿酸水平没有增加。
一项2018年的研究发现, 饮食中的果糖是一种天然水果和果汁中天然存在的单糖,也存在于加工甜味剂中,包括食糖和高果糖玉米糖浆,这会 改变肠道的微生物组成。
喝含糖饮料会加剧炎症。而且,这种效果可以持续相当长的时间。
摄入50克果糖的剂量仅在30分钟后会引起诸如C反应蛋白(CRP)等炎症标记物的激增。此外,CRP持续高出两个多小时。
除了添加糖以外,食用过多的精制碳水化合物还与人类炎症增加有关。在一项研究中,仅吃50克白面包形式的精制碳水化合物会导致较高的血糖水平并增加炎症标记物Nf-kB。
注意:是天然糖与炎症无关,添加的糖和天然糖之间存在差异。
添加的糖从其原始来源中去除,并添加到食品和饮料中,以用作甜味剂或延长保质期。
补充糖主要存在于加工食品和饮料中,尽管食用糖也被认为是补充糖。其他常见形式包括高果糖玉米糖浆(HFCS),蔗糖,果糖,葡萄糖和玉米糖。
食用糖(蔗糖)和高果糖玉米糖浆(HFCS)是西方饮食中添加糖的两种主要类型。
过量的糖和精制碳水化合物与炎症有关
然而,天然糖还没有被链接到炎症。实际上,许多含有天然糖的食物(例如水果和蔬菜)可能具有抗炎作用。
天然糖包括食物中天然存在的糖。实例包括水果中的果糖和乳制品中的乳糖。食用天然糖在体内被消耗和消化后的行为与添加的糖完全不同。
天然糖通常在整个食物中食用。因此,它伴随着其他营养物质,例如蛋白质和纤维,导致天然糖被缓慢吸收。天然糖的稳定吸收可防止血糖升高。
富含水果,蔬菜和全谷物等全食的饮食也可以带来其他健康益处。无需限制或避免食用完整食物。
2 人造反式脂肪
人造反式脂肪可能是您可以食用的最不健康的脂肪。
它们是通过将氢添加到液态不饱和脂肪中而产生的,以使其具有更固态的脂肪的稳定性。
在成分标签上,反式脂肪通常被列为部分氢化油。
大多数人造黄油含有反式脂肪,通常将它们添加到加工食品中以延长保质期。
与乳制品和肉类中发现的天然反式脂肪不同,人造反式脂肪已被证明会引起炎症并增加疾病风险。除降低HDL(良好)胆固醇外,反式脂肪还可能损害动脉内壁的内皮细胞功能,这是患心脏病的危险因素。
食用人造反式脂肪与高水平的炎症标记物(例如CRP)相关。事实上,在一项研究中,报告最高反式脂肪摄入量的女性中CRP水平高78%。
在一项包括体重超标的老年妇女的随机对照试验中,氢化大豆油比棕榈油和葵花籽油显着增加了炎症反应。
对健康男性和胆固醇水平升高的男性进行的研究表明,对反式脂肪的反应,炎症标志物的含量也有类似的增加。
反式脂肪含量高的食物包括炸薯条和其他油炸快餐,某些种类的微波爆米花,某些人造黄油和蔬菜起酥油,包装的蛋糕和饼干,一些糕点以及所有加工食品,标签上均标有部分氢化植物油。
3 植物油和种子油
概要一些研究表明,大量食用植物油中的omega-6脂肪酸含量可能会促进炎症。但是,证据不一致,需要更多的研究。
在20世纪,美国的植物油消费量增长了130%。
一些科学家认为,某些植物油(例如大豆油)因其很高的omega-6脂肪酸含量而促进炎症。
尽管某些膳食中的omega-6脂肪是必需的,但典型的西方饮食所提供的营养远远超出了人们的需求。实际上,健康专业人员建议多吃富含omega-3的食物,例如肥鱼,以提高omega-6与omega-3的比例并获得omega-3s的抗炎作用。
在一项研究中,与以1:1或5:1的饮食喂养的大鼠相比,以omega-6与omega-3的饮食喂养20:1的大鼠具有更高的炎症标志物水平。但是,目前尚无证据表明大量摄入omega-6脂肪酸会增加人类的炎症。
对照研究表明,最常见的饮食中omega-6酸亚油酸不会影响炎症标记。
在得出任何结论之前,需要进行更多的研究。植物油和种子油被用作食用油,并且是许多加工食品中的主要成分。

4 精制碳水化合物
高纤维,未经加工的碳水化合物是健康的,但精制碳水化合物会提高血糖水平并促进可能导致疾病的炎症。
几千年来,古代人类以草,根和水果的形式消耗了高纤维,未经加工的碳水化合物。
但是,食用精制碳水化合物可能会导致炎症。精制碳水化合物已去除了大部分纤维。纤维促进饱腹感,改善血糖控制,并喂养肠道内的有益细菌。
研究人员建议,现代饮食中的精制碳水化合物可能会促进炎症性肠细菌的生长,从而增加您患肥胖症和炎症性肠病的风险。
精制碳水化合物比未加工碳水化合物具有更高的血糖指数(GI)。高GI食品比低GI食品更快地提高血糖。
在一项研究中,报告高摄入量胃肠道食物最多的老年人死于诸如慢性阻塞性肺疾病(COPD)之类的炎性疾病的可能性是普通人的2.9倍。
在一项对照研究中,年轻健康的男人吃了50克白面包形式的精制碳水化合物,血糖水平较高,并且特定炎症标记物的水平有所增加。
糖果,面包,面食,糕点,一些谷物,饼干,蛋糕,含糖软饮料以及所有含糖或面粉的加工食品中都含有精制碳水化合物。
5 过量饮酒
虽然适度饮酒可带来一些健康益处。但是,较高的用量会导致严重的问题。大量饮酒可能会加剧炎症并导致“漏泄的肠道”,从而在整个身体内引发炎症。
在一项研究中,饮酒的人中炎症标志物CRP的水平升高。他们喝的酒越多,其CRP含量就越高。
大量饮酒的人可能会遇到细菌毒素从结肠移出进入人体的问题。这种情况-通常称为“漏泄性肠” -可以引发广泛的炎症,导致器官损伤。
为避免与酒精有关的健康问题,男性的摄入量应限制为每天两种标准饮料,女性每天只能摄入一种。
6 加工肉
加工肉富含AGEs等炎性化合物,其与结肠癌的强烈关联可能部分归因于炎症反应。食用加工肉会增加患心脏病,糖尿病,胃癌和结肠癌的风险。
加工肉的常见类型包括香肠,培根,火腿,烟熏肉和牛肉干。
与大多数其他肉类相比,加工肉类包含更高级的糖化终产物(AGEs)。AGEs是在高温下烹饪肉类和其他食物而形成的。已知会引起炎症。
在与食用肉类食用有关的所有疾病中,其与结肠癌的关联最强。尽管许多因素都会导致结肠癌,但据信其中一种机制是结肠细胞对加工肉的炎症反应。
响应多种诱因可能会发生炎症,其中一些诱因难以预防,包括污染,伤害或疾病。
为了尽可能保持健康,请尽量减少食用引发炎症的食物并食用抗炎食物,以减少炎症。

微生物组的作用主要在疾病中进行了研究,最近的评论呼吁关注个性化营养和微生物组定向疗法的潜力,例如,麻省理工开发的IBD患者中肠道抗炎饮食(IBD-AID),提供了一个非常好的肠道疗愈的饮食框架——用于减轻炎症、重建菌群,并与此同时保证营养摄入的充足和减轻患者的身体负担。
营养干预可能是挽救生命和降低医疗费用的可持续且具有成本效益的方式。但是,这些营养干预措施的长期成功因人而异。成功与否取决于每个人的饮食建议是否可行,以及这些措施是否确实产生了预期的生理变化。
图. 结合营养,微生物组和传统药物的个性化治疗路线图。
Schröder L et al., 2020. Nutrients
使用饮食干预的临床前模型进行的探索性分析和初步概念验证研究的结果已开始转移到临床。鉴于微生物组对宿主生理的核心作用及其对饮食投入的可塑性,这些对营养干预措施的个体化反应似乎至少部分取决于受试者的微生物组。通过高度特异性和个性化的营养补充来靶向微生物组的组成和功能。
因此建议在设计未来的营养干预措施时分析并纳入每个人的微生物组。虽然营养饮食干预还有很长的临床路径要走,但是发展营养干预措施,作为常规治疗的补充或替代疗法应该是未来的趋势。
参考资料:
Seunggu Han, M.D. Understanding and Managing Chronic Inflammation. 2018, 6, 27,
Schultz A, Barbosa-da-Silva S, Aguila MB, Mandarim-de-Lacerda CA. Differences and similarities in hepatic lipogenesis, gluconeogenesis and oxidative imbalance in mice fed diets rich in fructose or sucrose. Food Funct. 2015 May;6(5):1684-91. doi: 10.1039/c5fo00251f. PMID: 25905791.
Hu Y, Costenbader KH, Gao X, Al-Daabil M, Sparks JA, Solomon DH, Hu FB, Karlson EW, Lu B. Sugar-sweetened soda consumption and risk of developing rheumatoid arthritis in women. Am J Clin Nutr. 2014 Sep;100(3):959-67. doi: 10.3945/ajcn.114.086918. Epub 2014 Jul 16. PMID: 25030783; PMCID: PMC4135503.
Hu Y, Costenbader KH, Gao X, Al-Daabil M, Sparks JA, Solomon DH, Hu FB, Karlson EW, Lu B. Sugar-sweetened soda consumption and risk of developing rheumatoid arthritis in women. Am J Clin Nutr. 2014 Sep;100(3):959-67. doi: 10.3945/ajcn.114.086918. Epub 2014 Jul 16. PMID: 25030783; PMCID: PMC4135503.
Ma T, Liaset B, Hao Q, Petersen RK, Fjære E, Ngo HT, Lillefosse HH, Ringholm S, Sonne SB, Treebak JT, Pilegaard H, Frøyland L, Kristiansen K, Madsen L. Sucrose counteracts the anti-inflammatory effect of fish oil in adipose tissue and increases obesity development in mice. PLoS One. 2011;6(6):e21647. doi: 10.1371/journal.pone.0021647. Epub 2011 Jun 28. PMID: 21738749; PMCID: PMC3125273.
Frazier TH, DiBaise JK, McClain CJ. Gut microbiota, intestinal permeability, obesity-induced inflammation, and liver injury. JPEN J Parenter Enteral Nutr. 2011 Sep;35(5 Suppl):14S-20S. doi: 10.1177/0148607111413772. Epub 2011 Aug 1. PMID: 21807932.
Aeberli I, Gerber PA, Hochuli M, Kohler S, Haile SR, Gouni-Berthold I, Berthold HK, Spinas GA, Berneis K. Low to moderate sugar-sweetened beverage consumption impairs glucose and lipid metabolism and promotes inflammation in healthy young men: a randomized controlled trial. Am J Clin Nutr. 2011 Aug;94(2):479-85. doi: 10.3945/ajcn.111.013540. Epub 2011 Jun 15. PMID: 21677052.
Bruun JM, Maersk M, Belza A, Astrup A, Richelsen B. Consumption of sucrose-sweetened soft drinks increases plasma levels of uric acid in overweight and obese subjects: a 6-month randomised controlled trial. Eur J Clin Nutr. 2015 Aug;69(8):949-53. doi: 10.1038/ejcn.2015.95. Epub 2015 Jun 17. PMID: 26081486.
Jameel F, Phang M, Wood LG, Garg ML. Acute effects of feeding fructose, glucose and sucrose on blood lipid levels and systemic inflammation. Lipids Health Dis. 2014;13:195. Published 2014 Dec 16. doi:10.1186/1476-511X-13-195
Spreadbury I. Comparison with ancestral diets suggests dense acellular carbohydrates promote an inflammatory microbiota, and may be the primary dietary cause of leptin resistance and obesity. Diabetes Metab Syndr Obes. 2012;5:175-89. doi: 10.2147/DMSO.S33473. Epub 2012 Jul 6. PMID: 22826636; PMCID: PMC3402009.
Buyken AE, Flood V, Empson M, Rochtchina E, Barclay AW, Brand-Miller J, Mitchell P. Carbohydrate nutrition and inflammatory disease mortality in older adults. Am J Clin Nutr. 2010 Sep;92(3):634-43. doi: 10.3945/ajcn.2010.29390. Epub 2010 Jun 23. PMID: 20573797.
Dickinson S, Hancock DP, Petocz P, Ceriello A, Brand-Miller J. High-glycemic index carbohydrate increases nuclear factor-kappaB activation in mononuclear cells of young, lean healthy subjects. Am J Clin Nutr. 2008 May;87(5):1188-93. doi: 10.1093/ajcn/87.5.1188. PMID: 18469238.
Schmidt AM, Hori O, Brett J, Yan SD, Wautier JL, Stern D. Cellular receptors for advanced glycation end products. Implications for induction of oxidant stress and cellular dysfunction in the pathogenesis of vascular lesions. Arterioscler Thromb. 1994 Oct;14(10):1521-8. doi: 10.1161/01.atv.14.10.1521. PMID: 7918300.
Scheithauer TP, Dallinga-Thie GM, de Vos WM, Nieuwdorp M, van Raalte DH. Causality of small and large intestinal microbiota in weight regulation and insulin resistance. Mol Metab. 2016 Jun 10;5(9):759-70. doi: 10.1016/j.molmet.2016.06.002. PMID: 27617199; PMCID: PMC5004227.
Yang Q, Zhang Z, Gregg EW, Flanders WD, Merritt R, Hu FB. Added sugar intake and cardiovascular diseases mortality among US adults. JAMA Intern Med. 2014 Apr;174(4):516-24. doi: 10.1001/jamainternmed.2013.13563. PMID: 24493081.
Bosma-den Boer MM, van Wetten ML, Pruimboom L. Chronic inflammatory diseases are stimulated by current lifestyle: how diet, stress levels and medication prevent our body from recovering. Nutr Metab (Lond). 2012 Apr 17;9(1):32. doi: 10.1186/1743-7075-9-32. PMID: 22510431; PMCID: PMC3372428.
Malik VS. Sugar sweetened beverages and cardiometabolic health. Curr Opin Cardiol. 2017 Sep;32(5):572-579. doi: 10.1097/HCO.0000000000000439. PMID: 28639973.
Liu S, Willett WC, Stampfer MJ, Hu FB, Franz M, Sampson L, Hennekens CH, Manson JE. A prospective study of dietary glycemic load, carbohydrate intake, and risk of coronary heart disease in US women. Am J Clin Nutr. 2000 Jun;71(6):1455-61. doi: 10.1093/ajcn/71.6.1455. PMID: 10837285.
Malik AH, Akram Y, Shetty S, Malik SS, Yanchou Njike V. Impact of sugar-sweetened beverages on blood pressure. Am J Cardiol. 2014 May 1;113(9):1574-80. doi: 10.1016/j.amjcard.2014.01.437. Epub 2014 Feb 12. PMID: 24630785.
Seely S, Horrobin DF. Diet and breast cancer: the possible connection with sugar consumption. Med Hypotheses. 1983 Jul;11(3):319-27. doi: 10.1016/0306-9877(83)90095-6. PMID: 6645999.
Bostick RM, Potter JD, Kushi LH, Sellers TA, Steinmetz KA, McKenzie DR, Gapstur SM, Folsom AR. Sugar, meat, and fat intake, and non-dietary risk factors for colon cancer incidence in Iowa women (United States). Cancer Causes Control. 1994 Jan;5(1):38-52. doi: 10.1007/BF01830725. PMID: 8123778.
Michaud DS, Liu S, Giovannucci E, Willett WC, Colditz GA, Fuchs CS. Dietary sugar, glycemic load, and pancreatic cancer risk in a prospective study. J Natl Cancer Inst. 2002 Sep 4;94(17):1293-300. doi: 10.1093/jnci/94.17.1293. PMID: 12208894.
Genkinger JM, Li R, Spiegelman D, Anderson KE, Albanes D, Bergkvist L, Bernstein L, Black A, van den Brandt PA, English DR, Freudenheim JL, Fuchs CS, Giles GG, Giovannucci E, Goldbohm RA, Horn-Ross PL, Jacobs EJ, Koushik A, Männistö S, Marshall JR, Miller AB, Patel AV, Robien K, Rohan TE, Schairer C, Stolzenberg-Solomon R, Wolk A, Ziegler RG, Smith-Warner SA. Coffee, tea, and sugar-sweetened carbonated soft drink intake and pancreatic cancer risk: a pooled analysis of 14 cohort studies. Cancer Epidemiol Biomarkers Prev. 2012 Feb;21(2):305-18. doi: 10.1158/1055-9965.EPI-11-0945-T. Epub 2011 Dec 22. PMID: 22194529; PMCID: PMC3275675.
Arcidiacono B, Iiritano S, Nocera A, Possidente K, Nevolo MT, Ventura V, Foti D, Chiefari E, Brunetti A. Insulin resistance and cancer risk: an overview of the pathogenetic mechanisms. Exp Diabetes Res. 2012;2012:789174. doi: 10.1155/2012/789174. Epub 2012 Jun 4. PMID: 22701472; PMCID: PMC3372318.
Boyd DB. Insulin and cancer. Integr Cancer Ther. 2003 Dec;2(4):315-29. doi: 10.1177/1534735403259152. PMID: 14713323.
Malik VS, Popkin BM, Bray GA, Després JP, Willett WC, Hu FB. Sugar-sweetened beverages and risk of metabolic syndrome and type 2 diabetes: a meta-analysis. Diabetes Care. 2010 Nov;33(11):2477-83. doi: 10.2337/dc10-1079. Epub 2010 Aug 6. PMID: 20693348; PMCID: PMC2963518.
Imamura F, O’Connor L, Ye Z, Mursu J, Hayashino Y, Bhupathiraju SN, Forouhi NG. Consumption of sugar sweetened beverages, artificially sweetened beverages, and fruit juice and incidence of type 2 diabetes: systematic review, meta-analysis, and estimation of population attributable fraction. BMJ. 2015 Jul 21;351:h3576. doi: 10.1136/bmj.h3576. PMID: 26199070; PMCID: PMC4510779.
Gross LS, Li L, Ford ES, Liu S. Increased consumption of refined carbohydrates and the epidemic of type 2 diabetes in the United States: an ecologic assessment. Am J Clin Nutr. 2004 May;79(5):774-9. doi: 10.1093/ajcn/79.5.774. PMID: 15113714.
Schulze MB, Liu S, Rimm EB, Manson JE, Willett WC, Hu FB. Glycemic index, glycemic load, and dietary fiber intake and incidence of type 2 diabetes in younger and middle-aged women. Am J Clin Nutr. 2004 Aug;80(2):348-56. doi: 10.1093/ajcn/80.2.348. PMID: 15277155.
Te Morenga L, Mallard S, Mann J. Dietary sugars and body weight: systematic review and meta-analyses of randomised controlled trials and cohort studies. BMJ. 2012 Jan 15;346:e7492. doi: 10.1136/bmj.e7492. PMID: 23321486.
Das UN. Is obesity an inflammatory condition? Nutrition. 2001 Nov-Dec;17(11-12):953-66. doi: 10.1016/s0899-9007(01)00672-4. PMID: 11744348.
Vartanian LR, Schwartz MB, Brownell KD. Effects of soft drink consumption on nutrition and health: a systematic review and meta-analysis. Am J Public Health. 2007;97(4):667-675. doi:10.2105/AJPH.2005.083782
Ouyang X, Cirillo P, Sautin Y, McCall S, Bruchette JL, Diehl AM, Johnson RJ, Abdelmalek MF. Fructose consumption as a risk factor for non-alcoholic fatty liver disease. J Hepatol. 2008 Jun;48(6):993-9. doi: 10.1016/j.jhep.2008.02.011. Epub 2008 Mar 10. PMID: 18395287; PMCID: PMC2423467.
Dixon LJ, Kabi A, Nickerson KP, McDonald C. Combinatorial effects of diet and genetics on inflammatory bowel disease pathogenesis. Inflamm Bowel Dis. 2015 Apr;21(4):912-22. doi: 10.1097/MIB.0000000000000289. PMID: 25581832; PMCID: PMC4366276.
Rippe JM, Angelopoulos TJ. Relationship between Added Sugars Consumption and Chronic Disease Risk Factors: Current Understanding. Nutrients. 2016;8(11):697. Published 2016 Nov 4. doi:10.3390/nu8110697
Jegatheesan P, De Bandt JP. Fructose and NAFLD: The Multifaceted Aspects of Fructose Metabolism. Nutrients. 2017;9(3):230. Published 2017 Mar 3. doi:10.3390/nu9030230
Ervin RB, Ogden CL. Consumption of added sugars among U.S. adults, 2005-2010. NCHS Data Brief. 2013 May;(122):1-8. PMID: 23742909.
Joseph SV, Edirisinghe I, Burton-Freeman BM. Fruit Polyphenols: A Review of Anti-inflammatory Effects in Humans. Crit Rev Food Sci Nutr. 2016;56(3):419-44. doi: 10.1080/10408398.2013.767221. PMID: 25616409.
Brown L, Rosner B, Willett WW, Sacks FM. Cholesterol-lowering effects of dietary fiber: a meta-analysis. Am J Clin Nutr. 1999 Jan;69(1):30-42. doi: 10.1093/ajcn/69.1.30. PMID: 9925120.
Salas-Salvadó J, Farrés X, Luque X, Narejos S, Borrell M, Basora J, Anguera A, Torres F, Bulló M, Balanza R; Fiber in Obesity-Study Group. Effect of two doses of a mixture of soluble fibres on body weight and metabolic variables in overweight or obese patients: a randomised trial. Br J Nutr. 2008 Jun;99(6):1380-7. doi: 10.1017/S0007114507868528. Epub 2007 Nov 22. PMID: 18031592.
Dauchet L, Amouyel P, Hercberg S, Dallongeville J. Fruit and vegetable consumption and risk of coronary heart disease: a meta-analysis of cohort studies. J Nutr. 2006 Oct;136(10):2588-93. doi: 10.1093/jn/136.10.2588. PMID: 16988131.
Brymora A, Flisiński M, Johnson RJ, Goszka G, Stefańska A, Manitius J. Low-fructose diet lowers blood pressure and inflammation in patients with chronic kidney disease. Nephrol Dial Transplant. 2012 Feb;27(2):608-12. doi: 10.1093/ndt/gfr223. Epub 2011 May 25. PMID: 21613382; PMCID: PMC3350341.
Glushakova O, Kosugi T, Roncal C, et al. Fructose induces the inflammatory molecule ICAM-1 in endothelial cells. J Am Soc Nephrol. 2008;19(9):1712-1720. doi:10.1681/ASN.2007121304
Bosma-den Boer MM, van Wetten ML, Pruimboom L. Chronic inflammatory diseases are stimulated by current lifestyle: how diet, stress levels and medication prevent our body from recovering. Nutr Metab (Lond). 2012 Apr 17;9(1):32. doi: 10.1186/1743-7075-9-32. PMID: 22510431; PMCID: PMC3372428.
Lira FS, Rosa JC, Pimentel GD, Souza HA, Caperuto EC, Carnevali LC Jr, Seelaender M, Damaso AR, Oyama LM, de Mello MT, Santos RV. Endotoxin levels correlate positively with a sedentary lifestyle and negatively with highly trained subjects. Lipids Health Dis. 2010 Aug 4;9:82. doi: 10.1186/1476-511X-9-82. PMID: 20684772; PMCID: PMC2922209.
45 Pruimboom L, Raison CL, Muskiet FA. Physical Activity Protects the Human Brain against Metabolic Stress Induced by a Postprandial and Chronic Inflammation. Behav Neurol. 2015;2015:569869. doi: 10.1155/2015/569869. Epub 2015 May 5. PMID: 26074674; PMCID: PMC4436444.
Ihalainen JK, Schumann M, Eklund D, Hämäläinen M, Moilanen E, Paulsen G, Häkkinen K, Mero AA. Combined aerobic and resistance training decreases inflammation markers in healthy men. Scand J Med Sci Sports. 2018 Jan;28(1):40-47. doi: 10.1111/sms.12906. Epub 2017 Jun 13. PMID: 28453868.
Frassetto LA, Schloetter M, Mietus-Synder M, Morris RC Jr, Sebastian A. Metabolic and physiologic improvements from consuming a paleolithic, hunter-gatherer type diet. Eur J Clin Nutr. 2009 Aug;63(8):947-55. doi: 10.1038/ejcn.2009.4. Epub 2009 Feb 11. Erratum in: Eur J Clin Nutr. 2015 Dec;69(12):1376. PMID: 19209185.
Berk, M., Kapczinski, F., Andreazza, A. C., Dean, O. M., Giorlando, F., Maes, M., … & Magalhães, P. V. S. (2011). Pathways underlying neuroprogression in bipolar disorder: focus on inflammation, oxidative stress and neurotrophic factors. Neuroscience & biobehavioral reviews, 35(3), 804-817.
Callaghan, B. L., Fields, A., Gee, D. G., Gabard-Durnam, L., Caldera, C., Humphreys, K. L., … & Tottenham, N. (2019). Mind and gut: Associations between mood and gastrointestinal distress in children exposed to adversity. Development and psychopathology, 1-20.
Chang, T. T., Yen, Y-C., (2010). Cytokines and Major Psychiatric Disorders. Taiwanese Journal of Psychiatry (Taipei) Vol. 24 No. 4, 257-268.
Dobbin, J. P., Harth, M., McCain, G. A., Martin, R. A., & Cousin, K. (1991). Cytokine production and lymphocyte transformation during stress. Brain, behavior, and immunity, 5(4), 339-348.
Gershon, M. D. (1999). The enteric nervous system: a second brain. Hospital Practice, 34(7), 31-52
Haroon, E., Raison, C. L., & Miller, A. H. (2012). Psychoneuroimmunology meets neuropsychopharmacology: translational implications of the impact of inflammation on behavior. Neuropsychopharmacology, 37(1), 137.
Hemmings, S. M., Malan-Muller, S., van den Heuvel, L. L., Demmitt, B. A., Stanislawski, M. A., Smith, D. G., … & Marotz, C. A. (2017). The microbiome in posttraumatic stress disorder and trauma-exposed controls: an exploratory study. Psychosomatic medicine, 79(8), 936.
Foster, J. A., Rinaman, L., & Cryan, J. F. (2017). Stress & the gut-brain axis: regulation by the microbiome. Neurobiology of stress, 7, 124-136.
Martin, C. R., Osadchiy, V., Kalani, A., & Mayer, E. A. (2018). The Brain-Gut-Microbiome Axis. Cellular and Molecular Gastroenterology and Hepatology, 6(2), 133-148.
Michopoulos, V., Powers, A., Gillespie, C. F., Ressler, K. J., & Jovanovic, T. (2017). Inflammation in fear-and anxiety-based disorders: PTSD, GAD, and beyond. Neuropsychopharmacology, 42(1), 254.
Milaniak, I., & Jaffee, S. R. (2019). Childhood socioeconomic status and inflammation: A systematic review and meta-analysis. Brain, behavior, and immunity.
Renna, M. E., O’toole, M. S., Spaeth, P. E., Lekander, M., & Mennin, D. S. (2018). The association between anxiety, traumatic stress, and obsessive–compulsive disorders and chronic inflammation: A systematic review and meta‐analysis. Depression and anxiety, 35(11), 1081-1094.
Smith S. R. (1997). Immunological Evidence Supporting The Immune-Cytokine Model of Depression. Cytokines and Depression.
Sylvia, K. E., & Demas, G. E. (2018). A gut feeling: microbiome-brain-immune interactions modulate social and affective behaviors. Hormones and behavior, 99, 41-49.
Toft, H., Bramness, J. G., Lien, L., Abebe, D. S., Wampold, B. E., Tilden, T., … & Neupane, S. P. (2018). PTsD patients show increasing cytokine levels during treatment despite reduced psychological distress. Neuropsychiatric disease and treatment, 14, 2367.
Werbner, M., Barsheshet, Y., Werbner, N., Zigdon, M., Averbuch, I., Ziv, O., … & Koren, O. (2019). Social-Stress-Responsive Microbiota Induces Stimulation of Self-Reactive Effector T Helper Cells. mSystems, 4(4), e00292-18.
Calder PC, Ahluwalia N, Brouns F, Buetler T, Clement K, Cunningham K, Esposito K, Jönsson LS, Kolb H, Lansink M, Marcos A, Margioris A, Matusheski N, Nordmann H, O’Brien J, Pugliese G, Rizkalla S, Schalkwijk C, Tuomilehto J, Wärnberg J, Watzl B, Winklhofer-Roob BM. Dietary factors and low-grade inflammation in relation to overweight and obesity. Br J Nutr. 2011 Dec;106 Suppl 3:S5-78. doi: 10.1017/S0007114511005460. PMID: 22133051.
Joseph SV, Edirisinghe I, Burton-Freeman BM. Berries: anti-inflammatory effects in humans. J Agric Food Chem. 2014 May 7;62(18):3886-903. doi: 10.1021/jf4044056. Epub 2014 Mar 17. PMID: 24512603.
Burton-Freeman BM, Sandhu AK, Edirisinghe I. Red Raspberries and Their Bioactive Polyphenols: Cardiometabolic and Neuronal Health Links. Adv Nutr. 2016 Jan 15;7(1):44-65. doi: 10.3945/an.115.009639. PMID: 26773014; PMCID: PMC4717884.
Skrovankova S, Sumczynski D, Mlcek J, Jurikova T, Sochor J. Bioactive Compounds and Antioxidant Activity in Different Types of Berries. Int J Mol Sci. 2015 Oct 16;16(10):24673-706. doi: 10.3390/ijms161024673. PMID: 26501271; PMCID: PMC4632771.
McAnulty LS, Nieman DC, Dumke CL, Shooter LA, Henson DA, Utter AC, Milne G, McAnulty SR. Effect of blueberry ingestion on natural killer cell counts, oxidative stress, and inflammation prior to and after 2.5 h of running. Appl Physiol Nutr Metab. 2011 Dec;36(6):976-84. doi: 10.1139/h11-120. Epub 2011 Nov 23. PMID: 22111516.
Ellis CL, Edirisinghe I, Kappagoda T, Burton-Freeman B. Attenuation of meal-induced inflammatory and thrombotic responses in overweight men and women after 6-week daily strawberry (Fragaria) intake. A randomized placebo-controlled trial. J Atheroscler Thromb. 2011;18(4):318-27. doi: 10.5551/jat.6114. Epub 2011 Jan 13. PMID: 21242652.
Jung UJ, Torrejon C, Tighe AP, Deckelbaum RJ. n-3 Fatty acids and cardiovascular disease: mechanisms underlying beneficial effects. Am J Clin Nutr. 2008 Jun;87(6):2003S-9S. doi: 10.1093/ajcn/87.6.2003S. PMID: 18541602.
Tabbaa M, Golubic M, Roizen MF, Bernstein AM. Docosahexaenoic acid, inflammation, and bacterial dysbiosis in relation to periodontal disease, inflammatory bowel disease, and the metabolic syndrome. Nutrients. 2013;5(8):3299-3310. Published 2013 Aug 19. doi:10.3390/nu5083299
Zivkovic AM, Telis N, German JB, Hammock BD. Dietary omega-3 fatty acids aid in the modulation of inflammation and metabolic health. Calif Agric (Berkeley). 2011 Jul;65(3):106-111. doi: 10.3733/ca.v065n03p106. PMID: 24860193; PMCID: PMC4030645.
Weylandt KH, Chiu CY, Gomolka B, Waechter SF, Wiedenmann B. Omega-3 fatty acids and their lipid mediators: towards an understanding of resolvin and protectin formation. Prostaglandins Other Lipid Mediat. 2012 Mar;97(3-4):73-82. doi: 10.1016/j.prostaglandins.2012.01.005. Epub 2012 Feb 3. PMID: 22326554.
Grimstad T, Berge RK, Bohov P, Skorve J, Gøransson L, Omdal R, Aasprong OG, Haugen M, Meltzer HM, Hausken T. Salmon diet in patients with active ulcerative colitis reduced the simple clinical colitis activity index and increased the anti-inflammatory fatty acid index–a pilot study. Scand J Clin Lab Invest. 2011 Feb;71(1):68-73. doi: 10.3109/00365513.2010.542484. Epub 2010 Dec 8. PMID: 21142420.
Ellulu MS, Khaza’ai H, Patimah I, Rahmat A, Abed Y. Effect of long chain omega-3 polyunsaturated fatty acids on inflammation and metabolic markers in hypertensive and/or diabetic obese adults: a randomized controlled trial. Food Nutr Res. 2016 Jan 29;60:29268. doi: 10.3402/fnr.v60.29268. PMID: 26829184; PMCID: PMC4734034.
Darghosian L, Free M, Li J, Gebretsadik T, Bian A, Shintani A, McBride BF, Solus J, Milne G, Crossley GH, Thompson D, Vidaillet H, Okafor H, Darbar D, Murray KT, Stein CM. Effect of omega-three polyunsaturated fatty acids on inflammation, oxidative stress, and recurrence of atrial fibrillation. Am J Cardiol. 2015 Jan 15;115(2):196-201. doi: 10.1016/j.amjcard.2014.10.022. Epub 2014 Oct 29. PMID: 25465932; PMCID: PMC4276435.
Zhang X, Shu XO, Xiang YB, Yang G, Li H, Gao J, Cai H, Gao YT, Zheng W. Cruciferous vegetable consumption is associated with a reduced risk of total and cardiovascular disease mortality. Am J Clin Nutr. 2011 Jul;94(1):240-6. doi: 10.3945/ajcn.110.009340. Epub 2011 May 18. PMID: 21593509; PMCID: PMC3127519.
Murillo G, Mehta RG. Cruciferous vegetables and cancer prevention. Nutr Cancer. 2001;41(1-2):17-28. doi: 10.1080/01635581.2001.9680607. PMID: 12094621.
Guerrero-Beltrán CE, Calderón-Oliver M, Pedraza-Chaverri J, Chirino YI. Protective effect of sulforaphane against oxidative stress: recent advances. Exp Toxicol Pathol. 2012 Jul;64(5):503-8. doi: 10.1016/j.etp.2010.11.005. Epub 2010 Dec 3. PMID: 21129940.
Folkard DL, Marlow G, Mithen RF, Ferguson LR. Effect of Sulforaphane on NOD2 via NF-κB: implications for Crohn’s disease. J Inflamm (Lond). 2015 Jan 20;12:6. doi: 10.1186/s12950-015-0051-x. PMID: 25705128; PMCID: PMC4335778.
Hwang JH, Lim SB. Antioxidant and Anti-inflammatory Activities of Broccoli Florets in LPS-stimulated RAW 264.7 Cells. Prev Nutr Food Sci. 2014 Jun;19(2):89-97. doi: 10.3746/pnf.2014.19.2.089. PMID: 25054107; PMCID: PMC4103733.
Lu QY, Zhang Y, Wang Y, Wang D, Lee RP, Gao K, Byrns R, Heber D. California Hass avocado: profiling of carotenoids, tocopherol, fatty acid, and fat content during maturation and from different growing areas. J Agric Food Chem. 2009 Nov 11;57(21):10408-13. doi: 10.1021/jf901839h. PMID: 19813713; PMCID: PMC2796540.
Key TJ, Appleby PN, Travis RC, Albanes D, Alberg AJ, Barricarte A, Black A, Boeing H, Bueno-de-Mesquita HB, Chan JM, Chen C, Cook MB, Donovan JL, Galan P, Gilbert R, Giles GG, Giovannucci E, Goodman GE, Goodman PJ, Gunter MJ, Hamdy FC, Heliövaara M, Helzlsouer KJ, Henderson BE, Hercberg S, Hoffman-Bolton J, Hoover RN, Johansson M, Khaw KT, King IB, Knekt P, Kolonel LN, Le Marchand L, Männistö S, Martin RM, Meyer HE, Mondul AM, Moy KA, Neal DE, Neuhouser ML, Palli D, Platz EA, Pouchieu C, Rissanen H, Schenk JM, Severi G, Stampfer MJ, Tjønneland A, Touvier M, Trichopoulou A, Weinstein SJ, Ziegler RG, Zhou CK, Allen NE; Endogenous Hormones Nutritional Biomarkers Prostate Cancer Collaborative Group. Carotenoids, retinol, tocopherols, and prostate cancer risk: pooled analysis of 15 studies. Am J Clin Nutr. 2015 Nov;102(5):1142-57. doi: 10.3945/ajcn.115.114306. Epub 2015 Oct 7. PMID: 26447150; PMCID: PMC4625592.
amimi RM, Hankinson SE, Campos H, Spiegelman D, Zhang S, Colditz GA, Willett WC, Hunter DJ. Plasma carotenoids, retinol, and tocopherols and risk of breast cancer. Am J Epidemiol. 2005 Jan 15;161(2):153-60. doi: 10.1093/aje/kwi030. PMID: 15632265.
Donnarumma G, Paoletti I, Buommino E, Fusco A, Baudouin C, Msika P, Tufano MA, Baroni A. AV119, a natural sugar from avocado gratissima, modulates the LPS-induced proinflammatory response in human keratinocytes. Inflammation. 2011 Dec;34(6):568-75. doi: 10.1007/s10753-010-9264-6. PMID: 20936426.
Li Z, Wong A, Henning SM, Zhang Y, Jones A, Zerlin A, Thames G, Bowerman S, Tseng CH, Heber D. Hass avocado modulates postprandial vascular reactivity and postprandial inflammatory responses to a hamburger meal in healthy volunteers. Food Funct. 2013 Feb 26;4(3):384-91. doi: 10.1039/c2fo30226h. PMID: 23196671.
Zimmer AR, Leonardi B, Miron D, Schapoval E, Oliveira JR, Gosmann G. Antioxidant and anti-inflammatory properties of Capsicum baccatum: from traditional use to scientific approach. J Ethnopharmacol. 2012 Jan 6;139(1):228-33. doi: 10.1016/j.jep.2011.11.005. Epub 2011 Nov 9. PMID: 22100562.
Kang JH, Kim CS, Han IS, Kawada T, Yu R. Capsaicin, a spicy component of hot peppers, modulates adipokine gene expression and protein release from obese-mouse adipose tissues and isolated adipocytes, and suppresses the inflammatory responses of adipose tissue macrophages. FEBS Lett. 2007 Sep 18;581(23):4389-96. doi: 10.1016/j.febslet.2007.07.082. Epub 2007 Aug 14. PMID: 17719033.
Sancho R, Lucena C, Macho A, Calzado MA, Blanco-Molina M, Minassi A, Appendino G, Muñoz E. Immunosuppressive activity of capsaicinoids: capsiate derived from sweet peppers inhibits NF-kappaB activation and is a potent antiinflammatory compound in vivo. Eur J Immunol. 2002 Jun;32(6):1753-63. doi: 10.1002/1521-4141(200206)32:6<1753::AID-IMMU1753>3.0.CO;2-2. PMID: 12115659.
Boots AW, Drent M, de Boer VC, Bast A, Haenen GR. Quercetin reduces markers of oxidative stress and inflammation in sarcoidosis. Clin Nutr. 2011 Aug;30(4):506-12. doi: 10.1016/j.clnu.2011.01.010. Epub 2011 Feb 15. PMID: 21324570.
Srinivasan M, Sudheer AR, Menon VP. Ferulic Acid: therapeutic potential through its antioxidant property. J Clin Biochem Nutr. 2007 Mar;40(2):92-100. doi: 10.3164/jcbn.40.92. PMID: 18188410; PMCID: PMC2127228.
Elsayed EA, El Enshasy H, Wadaan MA, Aziz R. Mushrooms: a potential natural source of anti-inflammatory compounds for medical applications. Mediators Inflamm. 2014;2014:805841. doi: 10.1155/2014/805841. Epub 2014 Nov 23. PMID: 25505823; PMCID: PMC4258329.
Ganeshpurkar A, Rai G. Experimental evaluation of analgesic and anti-inflammatory potential of Oyster mushroom Pleurotus florida. Indian J Pharmacol. 2013 Jan-Feb;45(1):66-70. doi: 10.4103/0253-7613.106438. PMID: 23543896; PMCID: PMC3608298.
Mori K, Ouchi K, Hirasawa N. The Anti-Inflammatory Effects of Lion’s Mane Culinary-Medicinal Mushroom, Hericium erinaceus (Higher Basidiomycetes) in a Coculture System of 3T3-L1 Adipocytes and RAW264 Macrophages. Int J Med Mushrooms. 2015;17(7):609-18. doi: 10.1615/intjmedmushrooms.v17.i7.10. PMID: 26559695.
Gunawardena D, Bennett L, Shanmugam K, King K, Williams R, Zabaras D, Head R, Ooi L, Gyengesi E, Münch G. Anti-inflammatory effects of five commercially available mushroom species determined in lipopolysaccharide and interferon-γ activated murine macrophages. Food Chem. 2014 Apr 1;148:92-6. doi: 10.1016/j.foodchem.2013.10.015. Epub 2013 Oct 14. PMID: 24262531.
Schwartz B, Hadar Y. Possible mechanisms of action of mushroom-derived glucans on inflammatory bowel disease and associated cancer. Ann Transl Med. 2014 Feb;2(2):19. doi: 10.3978/j.issn.2305-5839.2014.01.03. PMID: 25332995; PMCID: PMC4202469.
Seymour EM, Bennink MR, Watts SW, Bolling SF. Whole grape intake impacts cardiac peroxisome proliferator-activated receptor and nuclear factor kappaB activity and cytokine expression in rats with diastolic dysfunction. Hypertension. 2010 May;55(5):1179-85. doi: 10.1161/HYPERTENSIONAHA.109.149393. Epub 2010 Mar 15. PMID: 20231522; PMCID: PMC2929369.
Reinisalo M, Kårlund A, Koskela A, Kaarniranta K, Karjalainen RO. Polyphenol Stilbenes: Molecular Mechanisms of Defence against Oxidative Stress and Aging-Related Diseases. Oxid Med Cell Longev. 2015;2015:340520. doi: 10.1155/2015/340520. Epub 2015 Jun 9. PMID: 26180583; PMCID: PMC4477219.
Ha JH, Shil PK, Zhu P, Gu L, Li Q, Chung S. Ocular inflammation and endoplasmic reticulum stress are attenuated by supplementation with grape polyphenols in human retinal pigmented epithelium cells and in C57BL/6 mice. J Nutr. 2014 Jun;144(6):799-806. doi: 10.3945/jn.113.186957. Epub 2014 Apr 3. PMID: 24699803; PMCID: PMC6611528.
Mossalayi MD, Rambert J, Renouf E, Micouleau M, Mérillon JM. Grape polyphenols and propolis mixture inhibits inflammatory mediator release from human leukocytes and reduces clinical scores in experimental arthritis. Phytomedicine. 2014 Feb 15;21(3):290-7. doi: 10.1016/j.phymed.2013.08.015. Epub 2013 Sep 20. PMID: 24055518.
omé-Carneiro J, Gonzálvez M, Larrosa M, Yáñez-Gascón MJ, García-Almagro FJ, Ruiz-Ros JA, Tomás-Barberán FA, García-Conesa MT, Espín JC. Grape resveratrol increases serum adiponectin and downregulates inflammatory genes in peripheral blood mononuclear cells: a triple-blind, placebo-controlled, one-year clinical trial in patients with stable coronary artery disease. Cardiovasc Drugs Ther. 2013 Feb;27(1):37-48. doi: 10.1007/s10557-012-6427-8. PMID: 23224687; PMCID: PMC3555235.
Barb D, Williams CJ, Neuwirth AK, Mantzoros CS. Adiponectin in relation to malignancies: a review of existing basic research and clinical evidence. Am J Clin Nutr. 2007 Sep;86(3):s858-66. doi: 10.1093/ajcn/86.3.858S. PMID: 18265479.
木森,肠道抗炎饮食,2019.10. 08. 知乎
Olendzki, B., Silverstein, T., Persuitte, G., Baldwin, K., Ma, Y., & Cave, D. (2011). An anti‐inflammatory diet for Inflammatory Bowel Disease; the IBD‐AID: P‐133. Inflammatory Bowel Diseases, 17, S53-S54.
Olendzki BC, Silverstein TD, Persuitte GM, Ma Y, Baldwin KR, Cave D. “An anti-inflammatory diet as treatment for inflammatory bowel disease: a case series report.” Nutrition journal 13 (2014): 5.
黄利, 杨国超, 王敏娟, et al. 膳食炎症指数的研究进展及应用[J]. 实用医药杂志, 2019(6).
SHIVAPPA N,STECK SE,HURLEY TG,et al. Designing and developing a literature-derived,population-based dietary inflammatory index[J]. Public Health Nutr,2014,17(8):1689-1696
CAVICCHIA PP,STECK SE,HURLEY TG,et al. A new dietary inflammatory index predicts interval changes in serum highsensitivity C-reactive protein[J]. J Nutr,2009,139(12):2365-2372.
Palozza P, Parrone N, Catalano A, Simone R. Tomato Lycopene and Inflammatory Cascade: Basic Interactions and Clinical Implications. Curr Med Chem. 2010;17(23):2547-63. doi: 10.2174/092986710791556041. PMID: 20491642.
Ip BC, Wang XD. Non-alcoholic steatohepatitis and hepatocellular carcinoma: implications for lycopene intervention. Nutrients. 2013 Dec 27;6(1):124-62. doi: 10.3390/nu6010124. PMID: 24379011; PMCID: PMC3916853.
Trejo-Solís C, Pedraza-Chaverrí J, Torres-Ramos M, Jiménez-Farfán D, Cruz Salgado A, Serrano-García N, Osorio-Rico L, Sotelo J. Multiple molecular and cellular mechanisms of action of lycopene in cancer inhibition. Evid Based Complement Alternat Med. 2013;2013:705121. doi: 10.1155/2013/705121. Epub 2013 Jul 21. PMID: 23970935; PMCID: PMC3736525.
Burton-Freeman B, Sesso HD. Whole food versus supplement: comparing the clinical evidence of tomato intake and lycopene supplementation on cardiovascular risk factors. Adv Nutr. 2014 Sep;5(5):457-85. doi: 10.3945/an.114.005231. PMID: 25469376; PMCID: PMC4188219.
Fielding JM, Rowley KG, Cooper P, O’ Dea K. Increases in plasma lycopene concentration after consumption of tomatoes cooked with olive oil. Asia Pac J Clin Nutr. 2005;14(2):131-6. PMID: 15927929.
Ferretti G, Bacchetti T, Belleggia A, Neri D. Cherry antioxidants: from farm to table. Molecules. 2010 Oct 12;15(10):6993-7005. doi: 10.3390/molecules15106993. PMID: 20944519; PMCID: PMC6259571.
Coelho Rabello Lima L, Oliveira Assumpção C, Prestes J, Sérgio Denadai B. CONSUMPTION OF CHERRIES AS A STRATEGY TO ATTENUATE EXERCISE-INDUCED MUSCLE DAMAGE AND INFLAMMATION IN HUMANS. Nutr Hosp. 2015 Nov 1;32(5):1885-93. doi: 10.3305/nh.2015.32.5.9709. PMID: 26545642.
Seymour EM, Lewis SK, Urcuyo-Llanes DE, Tanone II, Kirakosyan A, Kaufman PB, Bolling SF. Regular tart cherry intake alters abdominal adiposity, adipose gene transcription, and inflammation in obesity-prone rats fed a high fat diet. J Med Food. 2009 Oct;12(5):935-42. doi: 10.1089/jmf.2008.0270. PMID: 19857054.
Kelley DS, Adkins Y, Reddy A, Woodhouse LR, Mackey BE, Erickson KL. Sweet bing cherries lower circulating concentrations of markers for chronic inflammatory diseases in healthy humans. J Nutr. 2013 Mar;143(3):340-4. doi: 10.3945/jn.112.171371. Epub 2013 Jan 23. PMID: 23343675.
Kelley DS, Rasooly R, Jacob RA, Kader AA, Mackey BE. Consumption of Bing sweet cherries lowers circulating concentrations of inflammation markers in healthy men and women. J Nutr. 2006 Apr;136(4):981-6. doi: 10.1093/jn/136.4.981. PMID: 16549461.
Lopes AEDSC, Araújo LF, Levy RB, Barreto SM, Giatti L. Association between consumption of ultra-processed foods and serum C-reactive protein levels: cross-sectional results from the ELSA-Brasil study. Sao Paulo Med J. 2019 Jul 15;137(2):169-176. doi: 10.1590/1516-3180.2018.0363070219. PMID: 31314878.
Mozaffarian D, Pischon T, Hankinson SE, Rifai N, Joshipura K, Willett WC, Rimm EB. Dietary intake of trans fatty acids and systemic inflammation in women. Am J Clin Nutr. 2004 Apr;79(4):606-12. doi: 10.1093/ajcn/79.4.606. PMID: 15051604; PMCID: PMC1282449.
Buyken AE, Goletzke J, Joslowski G, Felbick A, Cheng G, Herder C, Brand-Miller JC. Association between carbohydrate quality and inflammatory markers: systematic review of observational and interventional studies. Am J Clin Nutr. 2014 Apr;99(4):813-33. doi: 10.3945/ajcn.113.074252. Epub 2014 Feb 19. PMID: 24552752.
Moura FA, de Andrade KQ, dos Santos JC, Goulart MO. Lipoic Acid: its antioxidant and anti-inflammatory role and clinical applications. Curr Top Med Chem. 2015;15(5):458-83. doi: 10.2174/1568026615666150114161358. PMID: 25620240.
Castro MC, Massa ML, Arbeláez LG, Schinella G, Gagliardino JJ, Francini F. Fructose-induced inflammation, insulin resistance and oxidative stress: A liver pathological triad effectively disrupted by lipoic acid. Life Sci. 2015 Sep 15;137:1-6. doi: 10.1016/j.lfs.2015.07.010. Epub 2015 Jul 17. PMID: 26188590.
Moon HS. Chemopreventive Effects of Alpha Lipoic Acid on Obesity-Related Cancers. Ann Nutr Metab. 2016;68(2):137-44. doi: 10.1159/000443994. Epub 2016 Feb 2. PMID: 26829711.
Liu Z, Guo J, Sun H, Huang Y, Zhao R, Yang X. α-Lipoic acid attenuates LPS-induced liver injury by improving mitochondrial function in association with GR mitochondrial DNA occupancy. Biochimie. 2015 Sep;116:52-60. doi: 10.1016/j.biochi.2015.06.023. Epub 2015 Jun 29. PMID: 26133658.
Sola S, Mir MQ, Cheema FA, Khan-Merchant N, Menon RG, Parthasarathy S, Khan BV. Irbesartan and lipoic acid improve endothelial function and reduce markers of inflammation in the metabolic syndrome: results of the Irbesartan and Lipoic Acid in Endothelial Dysfunction (ISLAND) study. Circulation. 2005 Jan 25;111(3):343-8. doi: 10.1161/01.CIR.0000153272.48711.B9. Epub 2005 Jan 17. PMID: 15655130.
Khalili M, Azimi A, Izadi V, Eghtesadi S, Mirshafiey A, Sahraian MA, Motevalian A, Norouzi A, Sanoobar M, Eskandari G, Farhoudi M, Amani F. Does lipoic acid consumption affect the cytokine profile in multiple sclerosis patients: a double-blind, placebo-controlled, randomized clinical trial. Neuroimmunomodulation. 2014;21(6):291-6. doi: 10.1159/000356145. Epub 2014 May 6. PMID: 24821457.
Han T, Bai J, Liu W, Hu Y. A systematic review and meta-analysis of α-lipoic acid in the treatment of diabetic peripheral neuropathy. Eur J Endocrinol. 2012 Oct;167(4):465-71. doi: 10.1530/EJE-12-0555. Epub 2012 Jul 25. PMID: 22837391.
Hwang S, Byun JW, Yoon JS, Lee EJ. Inhibitory Effects of α-Lipoic Acid on Oxidative Stress-Induced Adipogenesis in Orbital Fibroblasts From Patients With Graves Ophthalmopathy. Medicine (Baltimore). 2016 Jan;95(2):e2497. doi: 10.1097/MD.0000000000002497. PMID: 26765462; PMCID: PMC4718288.
Mirtaheri E, Gargari BP, Kolahi S, Dehghan P, Asghari-Jafarabadi M, Hajalilou M, Shakiba Novin Z, Mesgari Abbasi M. Effects of Alpha-Lipoic Acid Supplementation on Inflammatory Biomarkers and Matrix Metalloproteinase-3 in Rheumatoid Arthritis Patients. J Am Coll Nutr. 2015;34(4):310-7. doi: 10.1080/07315724.2014.910740. Epub 2015 Mar 9. PMID: 25751300.
Ziegler D, Hanefeld M, Ruhnau KJ, Hasche H, Lobisch M, Schütte K, Kerum G, Malessa R. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a 7-month multicenter randomized controlled trial (ALADIN III Study). ALADIN III Study Group. Alpha-Lipoic Acid in Diabetic Neuropathy. Diabetes Care. 1999 Aug;22(8):1296-301. doi: 10.2337/diacare.22.8.1296. PMID: 10480774.
Vidović B, Milovanović S, Dorđević B, Kotur-Stevuljević J, Stefanović A, Ivanišević J, Miljković M, Spasić S, Stojanović D, Pantović M. Effect of alpha-lipoic acid supplementation on oxidative stress markers and antioxidative defense in patients with schizophrenia. Psychiatr Danub. 2014 Sep;26(3):205-13. PMID: 25191766.
Nabavi SF, Thiagarajan R, Rastrelli L, Daglia M, Sobarzo-Sánchez E, Alinezhad H, Nabavi SM. Curcumin: a natural product for diabetes and its complications. Curr Top Med Chem. 2015;15(23):2445-55. doi: 10.2174/1568026615666150619142519. PMID: 26088351.
He Y, Yue Y, Zheng X, Zhang K, Chen S, Du Z. Curcumin, inflammation, and chronic diseases: how are they linked? Molecules. 2015 May 20;20(5):9183-213. doi: 10.3390/molecules20059183. PMID: 26007179; PMCID: PMC6272784.
Hanai H, Iida T, Takeuchi K, Watanabe F, Maruyama Y, Andoh A, Tsujikawa T, Fujiyama Y, Mitsuyama K, Sata M, Yamada M, Iwaoka Y, Kanke K, Hiraishi H, Hirayama K, Arai H, Yoshii S, Uchijima M, Nagata T, Koide Y. Curcumin maintenance therapy for ulcerative colitis: randomized, multicenter, double-blind, placebo-controlled trial. Clin Gastroenterol Hepatol. 2006 Dec;4(12):1502-6. doi: 10.1016/j.cgh.2006.08.008. Epub 2006 Nov 13. PMID: 17101300.
Panahi Y, Darvishi B, Ghanei M, Jowzi N, Beiraghdar F, Varnamkhasti BS. Molecular mechanisms of curcumins suppressing effects on tumorigenesis, angiogenesis and metastasis, focusing on NF-κB pathway. Cytokine Growth Factor Rev. 2016 Apr;28:21-9. doi: 10.1016/j.cytogfr.2015.12.004. Epub 2016 Jan 2. PMID: 26774676.
Panahi Y, Alishiri GH, Parvin S, Sahebkar A. Mitigation of Systemic Oxidative Stress by Curcuminoids in Osteoarthritis: Results of a Randomized Controlled Trial. J Diet Suppl. 2016;13(2):209-20. doi: 10.3109/19390211.2015.1008611. Epub 2015 Feb 17. PMID: 25688638.
Chandran B, Goel A. A randomized, pilot study to assess the efficacy and safety of curcumin in patients with active rheumatoid arthritis. Phytother Res. 2012 Nov;26(11):1719-25. doi: 10.1002/ptr.4639. Epub 2012 Mar 9. PMID: 22407780.
Panahi Y, Hosseini MS, Khalili N, Naimi E, Majeed M, Sahebkar A. Antioxidant and anti-inflammatory effects of curcuminoid-piperine combination in subjects with metabolic syndrome: A randomized controlled trial and an updated meta-analysis. Clin Nutr. 2015 Dec;34(6):1101-8. doi: 10.1016/j.clnu.2014.12.019. Epub 2015 Jan 7. PMID: 25618800.
Panahi Y, Saadat A, Beiraghdar F, Sahebkar A. Adjuvant therapy with bioavailability-boosted curcuminoids suppresses systemic inflammation and improves quality of life in patients with solid tumors: a randomized double-blind placebo-controlled trial. Phytother Res. 2014 Oct;28(10):1461-7. doi: 10.1002/ptr.5149. Epub 2014 Mar 19. PMID: 24648302.
Shoba G, Joy D, Joseph T, Majeed M, Rajendran R, Srinivas PS. Influence of piperine on the pharmacokinetics of curcumin in animals and human volunteers. Planta Med. 1998 May;64(4):353-6. doi: 10.1055/s-2006-957450. PMID: 9619120.
Zivkovic AM, Telis N, German JB, Hammock BD. Dietary omega-3 fatty acids aid in the modulation of inflammation and metabolic health. Calif Agric (Berkeley). 2011 Jul;65(3):106-111. doi: 10.3733/ca.v065n03p106. PMID: 24860193; PMCID: PMC4030645.
Ellulu MS, Khaza’ai H, Patimah I, Rahmat A, Abed Y. Effect of long chain omega-3 polyunsaturated fatty acids on inflammation and metabolic markers in hypertensive and/or diabetic obese adults: a randomized controlled trial. Food Nutr Res. 2016 Jan 29;60:29268. doi: 10.3402/fnr.v60.29268. PMID: 26829184; PMCID: PMC4734034.
Itariu BK, Zeyda M, Hochbrugger EE, Neuhofer A, Prager G, Schindler K, Bohdjalian A, Mascher D, Vangala S, Schranz M, Krebs M, Bischof MG, Stulnig TM. Long-chain n-3 PUFAs reduce adipose tissue and systemic inflammation in severely obese nondiabetic patients: a randomized controlled trial. Am J Clin Nutr. 2012 Nov;96(5):1137-49. doi: 10.3945/ajcn.112.037432. Epub 2012 Oct 3. PMID: 23034965.
Ciubotaru I, Lee YS, Wander RC. Dietary fish oil decreases C-reactive protein, interleukin-6, and triacylglycerol to HDL-cholesterol ratio in postmenopausal women on HRT. J Nutr Biochem. 2003 Sep;14(9):513-21. doi: 10.1016/s0955-2863(03)00101-3. PMID: 14505813.
Dangardt F, Osika W, Chen Y, Nilsson U, Gan LM, Gronowitz E, Strandvik B, Friberg P. Omega-3 fatty acid supplementation improves vascular function and reduces inflammation in obese adolescents. Atherosclerosis. 2010 Oct;212(2):580-5. doi: 10.1016/j.atherosclerosis.2010.06.046. Epub 2010 Jul 21. PMID: 20727522.
Finocchiaro C, Segre O, Fadda M, Monge T, Scigliano M, Schena M, Tinivella M, Tiozzo E, Catalano MG, Pugliese M, Fortunati N, Aragno M, Muzio G, Maggiora M, Oraldi M, Canuto RA. Effect of n-3 fatty acids on patients with advanced lung cancer: a double-blind, placebo-controlled study. Br J Nutr. 2012 Jul;108(2):327-33. doi: 10.1017/S0007114511005551. Epub 2011 Nov 25. PMID: 22114792.
Tabbaa M, Golubic M, Roizen MF, Bernstein AM. Docosahexaenoic acid, inflammation, and bacterial dysbiosis in relation to periodontal disease, inflammatory bowel disease, and the metabolic syndrome. Nutrients. 2013;5(8):3299-3310. Published 2013 Aug 19. doi:10.3390/nu5083299
Martorell M, Capó X, Sureda A, Batle JM, Llompart I, Argelich E, Tur JA, Pons A. Effect of DHA on plasma fatty acid availability and oxidative stress during training season and football exercise. Food Funct. 2014 Aug;5(8):1920-31. doi: 10.1039/c4fo00229f. PMID: 24955731.
DiLorenzo FM, Drager CJ, Rankin JW. Docosahexaenoic acid affects markers of inflammation and muscle damage after eccentric exercise. J Strength Cond Res. 2014 Oct;28(10):2768-74. doi: 10.1519/JSC.0000000000000617. PMID: 25029008.
Capó X, Martorell M, Llompart I, Sureda A, Tur JA, Pons A. Docosahexanoic acid diet supplementation attenuates the peripheral mononuclear cell inflammatory response to exercise following LPS activation. Cytokine. 2014 Oct;69(2):155-64. doi: 10.1016/j.cyto.2014.05.026. Epub 2014 Jun 19. PMID: 24954162.
Flock MR, Skulas-Ray AC, Harris WS, Gaugler TL, Fleming JA, Kris-Etherton PM. Effects of supplemental long-chain omega-3 fatty acids and erythrocyte membrane fatty acid content on circulating inflammatory markers in a randomized controlled trial of healthy adults. Prostaglandins Leukot Essent Fatty Acids. 2014 Oct;91(4):161-8. doi: 10.1016/j.plefa.2014.07.006. Epub 2014 Jul 17. PMID: 25091379; PMCID: PMC4156902.
Pot GK, Brouwer IA, Enneman A, Rijkers GT, Kampman E, Geelen A. No effect of fish oil supplementation on serum inflammatory markers and their interrelationships: a randomized controlled trial in healthy, middle-aged individuals. Eur J Clin Nutr. 2009 Nov;63(11):1353-9. doi: 10.1038/ejcn.2009.63. Epub 2009 Jul 22. PMID: 19623203.
Darghosian L, Free M, Li J, Gebretsadik T, Bian A, Shintani A, McBride BF, Solus J, Milne G, Crossley GH, Thompson D, Vidaillet H, Okafor H, Darbar D, Murray KT, Stein CM. Effect of omega-three polyunsaturated fatty acids on inflammation, oxidative stress, and recurrence of atrial fibrillation. Am J Cardiol. 2015 Jan 15;115(2):196-201. doi: 10.1016/j.amjcard.2014.10.022. Epub 2014 Oct 29. PMID: 25465932; PMCID: PMC4276435.
Rashidian A, Mehrzadi S, Ghannadi AR, Mahzooni P, Sadr S, Minaiyan M. Protective effect of ginger volatile oil against acetic acid-induced colitis in rats: a light microscopic evaluation. J Integr Med. 2014 Mar;12(2):115-20. doi: 10.1016/S2095-4964(14)60011-X. PMID: 24666677.
Yang M, Liu C, Jiang J, Zuo G, Lin X, Yamahara J, Wang J, Li Y. Ginger extract diminishes chronic fructose consumption-induced kidney injury through suppression of renal overexpression of proinflammatory cytokines in rats. BMC Complement Altern Med. 2014 May 27;14:174. doi: 10.1186/1472-6882-14-174. PMID: 24885946; PMCID: PMC4047007.
Mahluji S, Ostadrahimi A, Mobasseri M, Ebrahimzade Attari V, Payahoo L. Anti-inflammatory effects of zingiber officinale in type 2 diabetic patients. Adv Pharm Bull. 2013;3(2):273-6. doi: 10.5681/apb.2013.044. Epub 2013 Aug 20. PMID: 24312847; PMCID: PMC3848205.
Arablou T, Aryaeian N, Valizadeh M, Sharifi F, Hosseini A, Djalali M. The effect of ginger consumption on glycemic status, lipid profile and some inflammatory markers in patients with type 2 diabetes mellitus. Int J Food Sci Nutr. 2014 Jun;65(4):515-20. doi: 10.3109/09637486.2014.880671. Epub 2014 Feb 4. PMID: 24490949.
Karimi N, Dabidi Roshan V, Fathi Bayatiyani Z. Individually and Combined Water-Based Exercise With Ginger Supplement, on Systemic Inflammation and Metabolic Syndrome Indices, Among the Obese Women With Breast Neoplasms. Iran J Cancer Prev. 2015 Dec;8(6):e3856. doi: 10.17795/ijcp-3856. Epub 2015 Dec 23. PMID: 26855719; PMCID: PMC4736069.
Hoseinzadeh K, Daryanoosh F, Baghdasar PJ, Alizadeh H. Acute effects of ginger extract on biochemical and functional symptoms of delayed onset muscle soreness. Med J Islam Repub Iran. 2015 Sep 12;29:261. PMID: 26793652; PMCID: PMC4715415.
Black CD, Herring MP, Hurley DJ, O’Connor PJ. Ginger (Zingiber officinale) reduces muscle pain caused by eccentric exercise. J Pain. 2010 Sep;11(9):894-903. doi: 10.1016/j.jpain.2009.12.013. Epub 2010 Apr 24. PMID: 20418184.
Chaiyakunapruk N, Kitikannakorn N, Nathisuwan S, Leeprakobboon K, Leelasettagool C. The efficacy of ginger for the prevention of postoperative nausea and vomiting: a meta-analysis. Am J Obstet Gynecol. 2006 Jan;194(1):95-9. doi: 10.1016/j.ajog.2005.06.046. PMID: 16389016.
Riccioni G, Gammone MA, Tettamanti G, Bergante S, Pluchinotta FR, D’Orazio N. Resveratrol and anti-atherogenic effects. Int J Food Sci Nutr. 2015;66(6):603-10. doi: 10.3109/09637486.2015.1077796. Epub 2015 Aug 26. PMID: 26306466.
Pan W, Yu H, Huang S, Zhu P. Resveratrol Protects against TNF-α-Induced Injury in Human Umbilical Endothelial Cells through Promoting Sirtuin-1-Induced Repression of NF-KB and p38 MAPK. PLoS One. 2016 Jan 22;11(1):e0147034. doi: 10.1371/journal.pone.0147034. PMID: 26799794; PMCID: PMC4723256.
Nøhr MK, Dudele A, Poulsen MM, Ebbesen LH, Radko Y, Christensen LP, Jessen N, Richelsen B, Lund S, Pedersen SB. LPS-Enhanced Glucose-Stimulated Insulin Secretion Is Normalized by Resveratrol. PLoS One. 2016 Jan 11;11(1):e0146840. doi: 10.1371/journal.pone.0146840. PMID: 26751381; PMCID: PMC4709071.
Zhang X, Jiang A, Qi B, Ma Z, Xiong Y, Dou J, Wang J. Resveratrol Protects against Helicobacter pylori-Associated Gastritis by Combating Oxidative Stress. Int J Mol Sci. 2015 Nov 20;16(11):27757-69. doi: 10.3390/ijms161126061. PMID: 26610474; PMCID: PMC4661919.
Macedo RC, Vieira A, Marin DP, Otton R. Effects of chronic resveratrol supplementation in military firefighters undergo a physical fitness test–a placebo-controlled, double blind study. Chem Biol Interact. 2015 Feb 5;227:89-95. doi: 10.1016/j.cbi.2014.12.033. Epub 2015 Jan 5. PMID: 25572586.
Faghihzadeh F, Adibi P, Rafiei R, Hekmatdoost A. Resveratrol supplementation improves inflammatory biomarkers in patients with nonalcoholic fatty liver disease. Nutr Res. 2014 Oct;34(10):837-43. doi: 10.1016/j.nutres.2014.09.005. Epub 2014 Sep 23. PMID: 25311610.
Tomé-Carneiro J, Gonzálvez M, Larrosa M, Yáñez-Gascón MJ, García-Almagro FJ, Ruiz-Ros JA, Tomás-Barberán FA, García-Conesa MT, Espín JC. Grape resveratrol increases serum adiponectin and downregulates inflammatory genes in peripheral blood mononuclear cells: a triple-blind, placebo-controlled, one-year clinical trial in patients with stable coronary artery disease. Cardiovasc Drugs Ther. 2013 Feb;27(1):37-48. doi: 10.1007/s10557-012-6427-8. PMID: 23224687; PMCID: PMC3555235.
Culpitt SV, Rogers DF, Fenwick PS, Shah P, De Matos C, Russell RE, Barnes PJ, Donnelly LE. Inhibition by red wine extract, resveratrol, of cytokine release by alveolar macrophages in COPD. Thorax. 2003 Nov;58(11):942-6. doi: 10.1136/thorax.58.11.942. PMID: 14586044; PMCID: PMC1746526.
Samsami-Kor M, Daryani NE, Asl PR, Hekmatdoost A. Anti-Inflammatory Effects of Resveratrol in Patients with Ulcerative Colitis: A Randomized, Double-Blind, Placebo-controlled Pilot Study. Arch Med Res. 2015 May;46(4):280-5. doi: 10.1016/j.arcmed.2015.05.005. Epub 2015 May 20. PMID: 26002728.
Timmers S, Konings E, Bilet L, Houtkooper RH, van de Weijer T, Goossens GH, Hoeks J, van der Krieken S, Ryu D, Kersten S, Moonen-Kornips E, Hesselink MKC, Kunz I, Schrauwen-Hinderling VB, Blaak E, Auwerx J, Schrauwen P. Calorie restriction-like effects of 30 days of resveratrol supplementation on energy metabolism and metabolic profile in obese humans. Cell Metab. 2011 Nov 2;14(5):612-22. doi: 10.1016/j.cmet.2011.10.002. PMID: 22055504; PMCID: PMC3880862.
van der Made SM, Plat J, Mensink RP. Resveratrol does not influence metabolic risk markers related to cardiovascular health in overweight and slightly obese subjects: a randomized, placebo-controlled crossover trial. PLoS One. 2015 Mar 19;10(3):e0118393. doi: 10.1371/journal.pone.0118393. PMID: 25790328; PMCID: PMC4366169.
Catalgol B, Batirel S, Taga Y, Ozer NK. Resveratrol: French paradox revisited. Front Pharmacol. 2012 Jul 17;3:141. doi: 10.3389/fphar.2012.00141. PMID: 22822401; PMCID: PMC3398412.
Patel KR, Scott E, Brown VA, Gescher AJ, Steward WP, Brown K. Clinical trials of resveratrol. Ann N Y Acad Sci. 2011 Jan;1215:161-9. doi: 10.1111/j.1749-6632.2010.05853.x. PMID: 21261655.
Shih CM, Cheng SN, Wong CS, Kuo YL, Chou TC. Antiinflammatory and antihyperalgesic activity of C-phycocyanin. Anesth Analg. 2009 Apr;108(4):1303-10. doi: 10.1213/ane.0b013e318193e919. PMID: 19299804.
Reddy MC, Subhashini J, Mahipal SV, Bhat VB, Srinivas Reddy P, Kiranmai G, Madyastha KM, Reddanna P. C-Phycocyanin, a selective cyclooxygenase-2 inhibitor, induces apoptosis in lipopolysaccharide-stimulated RAW 264.7 macrophages. Biochem Biophys Res Commun. 2003 May 2;304(2):385-92. doi: 10.1016/s0006-291x(03)00586-2. PMID: 12711327.
Gutiérrez-Rebolledo GA, Galar-Martínez M, García-Rodríguez RV, Chamorro-Cevallos GA, Hernández-Reyes AG, Martínez-Galero E. Antioxidant Effect of Spirulina (Arthrospira) maxima on Chronic Inflammation Induced by Freund’s Complete Adjuvant in Rats. J Med Food. 2015 Aug;18(8):865-71. doi: 10.1089/jmf.2014.0117. Epub 2015 Jan 19. PMID: 25599112; PMCID: PMC4523079.
Gemma C, Mesches MH, Sepesi B, Choo K, Holmes DB, Bickford PC. Diets enriched in foods with high antioxidant activity reverse age-induced decreases in cerebellar beta-adrenergic function and increases in proinflammatory cytokines. J Neurosci. 2002 Jul 15;22(14):6114-20. doi: 10.1523/JNEUROSCI.22-14-06114.2002. PMID: 12122072; PMCID: PMC6757915.
Ku CS, Pham TX, Park Y, Kim B, Shin MS, Kang I, Lee J. Edible blue-green algae reduce the production of pro-inflammatory cytokines by inhibiting NF-κB pathway in macrophages and splenocytes. Biochim Biophys Acta. 2013 Apr;1830(4):2981-8. doi: 10.1016/j.bbagen.2013.01.018. Epub 2013 Jan 26. PMID: 23357040; PMCID: PMC3594481.
Pabon MM, Jernberg JN, Morganti J, Contreras J, Hudson CE, Klein RL, Bickford PC. A spirulina-enhanced diet provides neuroprotection in an α-synuclein model of Parkinson’s disease. PLoS One. 2012;7(9):e45256. doi: 10.1371/journal.pone.0045256. Epub 2012 Sep 18. PMID: 23028885; PMCID: PMC3445455.
Nielsen CH, Balachandran P, Christensen O, Pugh ND, Tamta H, Sufka KJ, Wu X, Walsted A, Schjørring-Thyssen M, Enevold C, Pasco DS. Enhancement of natural killer cell activity in healthy subjects by Immulina®, a Spirulina extract enriched for Braun-type lipoproteins. Planta Med. 2010 Nov;76(16):1802-8. doi: 10.1055/s-0030-1250043. Epub 2010 Jun 17. PMID: 20560112.
Selmi C, Leung PS, Fischer L, German B, Yang CY, Kenny TP, Cysewski GR, Gershwin ME. The effects of Spirulina on anemia and immune function in senior citizens. Cell Mol Immunol. 2011 May;8(3):248-54. doi: 10.1038/cmi.2010.76. Epub 2011 Jan 31. PMID: 21278762; PMCID: PMC4012879.
Park HJ, Lee YJ, Ryu HK, Kim MH, Chung HW, Kim WY. A randomized double-blind, placebo-controlled study to establish the effects of spirulina in elderly Koreans. Ann Nutr Metab. 2008;52(4):322-8. doi: 10.1159/000151486. Epub 2008 Aug 19. PMID: 18714150.
Lee EH, Park JE, Choi YJ, Huh KB, Kim WY. A randomized study to establish the effects of spirulina in type 2 diabetes mellitus patients. Nutr Res Pract. 2008 Winter;2(4):295-300. doi: 10.4162/nrp.2008.2.4.295. Epub 2008 Dec 31. PMID: 20016733; PMCID: PMC2788188.
Schröder L, Kaiser S, Flemer B, Hamm J, Hinrichsen F, Bordoni D, Rosenstiel P, Sommer F. Nutritional Targeting of the Microbiome as Potential Therapy for Malnutrition and Chronic Inflammation. Nutrients. 2020 Oct 3;12(10):E3032. doi: 10.3390/nu12103032. PMID: 33022941.
Xue J, Ajuwon KM, Fang R, Mechanistic insight into the gut microbiome and its interaction with host immunity and inflammation. Animal Nutrition. 2020
免责声明: 本账号发表的内容仅是用于信息的分享,仅供学习参考使用。 在采取任何预防、治疗或治愈的措施之前,请先咨询临床医生。

谷禾健康
背景
目前,全球一半以上的人口居住在城市,到2050年,这一比例预计将增加到70%。 城市为人类带来了各种好处(例如,更大的就业,教育机会以及接触多种文化和食物的机会),但会影响我们与自然的互动。 重要的是,空气质量,建筑物密度,植被和运输路线等城市特征可能会影响健康,部分原因是改变了环境微生物群落(微生物群落)的组成以及我们对它们的暴露程度。
空气微生物组与人类健康特别相关,因为我们接触的持久性和普遍性。空气生物组中主要是细菌和真菌,它们共同构成了很大比例的空气传播颗粒。每天,我们的皮肤,口腔,鼻腔和呼吸道表面都暴露于这些社区。 实际上,生活在城市环境中的人们每天可以吸入大约一亿细菌。
空气生物组最著名的健康影响是过敏反应的潜在诱因,以及引起呼吸道和传染性疾病的原因:例如,引起感染的细菌以及触发哮喘和过敏性鼻炎的花粉和真菌孢子。但是,越来越多的证据表明,某些类型的需氧菌素暴露可能具有重要的保护作用:特别是生命早期暴露于生物气溶胶可以引起免疫功能的系统性变化,从而抑制过敏,哮喘和炎症。在此基础上,早期接触丰富的气生真菌与降低过敏和/或哮喘发展的风险有关。
在这种情况下,城市化对空气微生物群落的任何影响都可能对人类健康产生重要影响。 一个人生活的环境决定了他们所接触的微生物,城市似乎减少了空气传播的微生物的多样性和丰富度。众所周知,过敏和哮喘在城市中比农村地区更为普遍; 如果城市确实减少了空气微生物群落的多样性,那么减少对微生物生物多样性的暴露可能是解释过敏,哮喘和其他城市相关疾病的机制。
然而,关于空气生物组的哪些特征引起功能性全身免疫变化尚存争议。 “卫生假说”声称,大量的微生物暴露至关重要。 相反,“生物多样性假说”假设我们所接触的微生物群落的多样性是免疫系统发育的关键。 对于卫生和生物多样性都有经验支持 ; 目前尚不清楚什么构成“更健康的”空气生物组。
如果我们要创建更健康的城市和人口,我们迫切需要更好地了解城市如何影响空气生物群系以及这对人类健康的意义。
近日,澳大利亚塔斯马尼亚大学自然科学学院和医学院的研究团队发表在环境生态学领域高水平期刊《Science of the Total Environment》上的一篇题为:“Urbanisation reduces the abundance and diversity of airborne microbes – but what does that mean for our health?”的研究通过系统地研究比较城市和农村地区空气传播的真菌和细菌群落(以下简称“空气微生物组(aerobiome)”,主要指低层大气中的细菌和真菌)的特征和/或健康影响的研究来填补这一知识空白。主要回答了以下问题:
(1)城乡空气生物组群之间在多样性和/或丰度上是否存在系统性差异?
(2)暴露于城市和农村的空气生物组会导致健康结果的系统性差异吗?

研究方法
搜索策略和纳入标准
使用Web of Science和ProQuest对经过同行评审的文章进行了系统搜索。以下搜索算法用于识别将城市和农村的空气生物组群进行比较并将研究结果与人类健康相关的研究。纳入了对沉降或吸尘的室内灰尘(例如,吸尘的床垫样品)进行采样的研究,因为这被认为是室外环境暴露的代表。如果研究仅在城市或农村类别中有一个抽样地点,则将其排除在外(即,必须包含多个城市和农村样本重复样本才能纳入研究)。没有明确地寻找检查花粉的研究,但是如果将这些群落的数据并入了研究通过空气传播的真菌或细菌群落的研究中,则将其包括在内。对于所有纳入的论文,符合纳入标准的。
数据析取
LC和EJF使用预先设计的数据收集表从每项研究中提取了以下信息:检查的空气生物组组分(即真菌,细菌,内毒素);城乡空气生物群系在多样性和/或丰度方面的差异,是否存在对健康影响的直接检验,以及认为什么机制是差异健康结果的基础(如果有)。
2.3。 数据分析我们评估了所有研究,这些研究比较了至少一个空气生物组的组成部分的多样性和/或丰度,并且统计了发现(a)城市,(b)农村或(c)空气生物组的指标均不高的论文数量。对每个分析都进行了单独的计数,也就是说,如果出版物比较了真菌和细菌的多样性,会将其视为单独的分析。 同样,如果一项研究的指标中发现有矛盾的发现,则将这些发现分开计数。使用Pearson卡方检验确定在城市和农村地区发现多样性和丰度更高的研究数量之间是否存在显着差异(α= 0.05) 量化该类别差异的研究。

结果:
城乡空气生物群系的比较特征
在通过搜索词识别的377篇论文中,我们的筛选揭示了19篇论文,这些论文明确比较了复制的城市和农村地区的空气生物群系,旨在了解人类健康的影响。 只有少数研究比较了城市和农村地区之间的空气生物组多样性(30次分析中n = 12,占40%)。在12个多样性比较中,绝大多数(n = 8; 67%; p≤0.01)发现农村地区的多样性更高,有四个发现两个地区的多样性相似(33%)。没有研究发现城市地区更加多样化。

空气生物组差异对健康的影响
只有四项研究同时测试了空气生物组学和人类健康的影响。 其中两项研究仅是观察性研究,两项是通过实验测试了城市和乡村空气生物群系对免疫功能的不同影响。所有四项研究都确定,农村空气生物组可以促进更好的健康结果。
两项通过实验测试城市和农村空气生物组暴露对免疫功能影响的研究均得出结论,早期暴露于农村空气生物群系有助于T调节和修饰的Th1型免疫反应,从而预防Th2介导的过敏和哮喘。
农舍,农村家庭和农舍都比城市家庭具有更多的细菌,农舍但不是城市家庭的灰尘诱导人体血液中抗炎细胞因子(IL-10和IL-2)的释放。
发现城市尘埃对人树突状细胞的刺激使免疫反应趋向于更高的过敏性(Th2型反应),而谷仓尘土的刺激则引起了较低的过敏性(Th1型)免疫反应。 但是研究指出归因于城市尘埃的免疫学影响是:1)与乡村农场的尘埃相比,尘埃较少,2)人类共生生物的比例更高,3)“微生物碎片”(破碎而不是完整的细胞)更多。
还有两项研究将空气生物组差异与人类健康结果相关联。研究发现农村地区的儿童哮喘,鼻炎和临床医生测试的过敏性致敏症的患病率较低,并且比城市地区的儿童患细菌的丰富性和多样性更高。 另一项研究表明,农村环境微生物群和婴儿肠道微生物群比城市人群更为多样化; 可能与免疫功能有联系的结果,尽管在研究中未测试此类联系。
讨论:
影响城乡空气生物组的因素
鉴于空气微生物的两个主要来源是叶片表面和土壤, 在空间上,空气生物群系可以在相对较小的尺度上变化,这在很大程度上受土地利用,土地覆盖以及距特定生物气溶胶生产活动的距离的影响。土地绿化覆盖尤为重要; 与城市非植被相比,即使在50 m附近,植被带也可能具有明显的空中细菌和真菌空中群落。
从时间上讲,天气和季节对空气生物群系有重要影响; 在夏季或秋季以及雨后,温带环境中的真菌和细菌总数通常较高。尽管这些模式取决于当地的气候和土地覆盖特征。如果要更好地理解城乡之间的空气生物组差异,就需要在研究设计中控制这些因素。
在“城市”和“农村”区域内的不同采样位置可能掩盖了空气生物组的差异,尤其是在空间重复次数有限或在不同时间采样位置的情况下。
这就提出了规模问题,因为它涉及到城乡分类;这些术语的定义方式多种多样,强调了需要在土地利用类别中进行抽样复制,以详细说明生态驱动因素对区域格局的影响。 在本研究分析中,研究者排除了仅对城市或农村类别中的单个位置进行采样的13项研究,认为该领域的主要问题是采样重复性不足。 当将这些研究包括在内时,农村空气生物组学丰度和多样性的增加趋势是一致的,这表明这种趋势对于研究设计和严谨性的变化是有力的。
空气生物群落与人类健康之间的联系
尽管所有这些研究都是通过健康的角度对空气生物群系进行检查的,但我们发现很少直接测试对人类健康的影响,因此很难确定农村和城市空气生物群系的影响或确定其对健康有影响的特征(即丰度与多样性)。微生物群落。 尽管如此,四项测试了空气生物组对人类健康的影响的研究都发现农村环境有益于健康 。 两项检查因果关系的研究得出的结论是,农村农场的尘土引发了从更过敏的(Th2型)免疫应答的转变。 然而,他们将这种转变归因于空气生物组的不同特征:在农村环境中细菌多样性增加或人类适应性降低的微生物和空气传播的微生物碎片减少。微生物群落的丰度,多样性和组成如何影响健康,以及人类为了获得最佳健康结果而暴露于空中微生物组的年龄和频率是应用这些概念之前必须回答的关键问题。
局限性,挑战和机遇
我们首先要承认在“城市”和“农村”的粗略分类中极端的生态变异性。 鉴于土地利用和土地覆盖甚至可以在很小的尺度上影响空气生物群落(例如50m),这些景观类别似乎不够粗略,无法进行比较。
但是,这些景观之间存在重要的生态差异,包括不透水表面,植被和裸露土壤的数量以及人口密度等,这些差异支持将这些分类用于初步研究。我们发现农村景观的丰富度和多样性不断提高,反映了这些景观水平的差异。 但是,此处确定的趋势将隐藏这些类别中的重要差异。 例如,城市范围内的生物多样性绿色空间可能创造出更多的生物多样性空气生物群落,并具有潜在的健康益处。鼓励进一步探索这些更细微的差异,并进行足够的空间复制和对人类健康影响的实验测试,以促进对空气生物组学的进一步了解和应用。
比较空气生物研究的另一个挑战是收集,分析和报告结果的方法的多样性。根据微生物和感兴趣的问题,研究使用了多种采样方法。 这些方法学决策可能会显著影响所得微生物群落的推断丰度和多样性。 传统上,通过培养和/或显微镜鉴定进行空气生物组学研究,而现代遗传技术(例如高通量DNA测序)则可以更好地量化微生物群落的多样性。
因此,除非对于培养活细菌/真菌特别感兴趣,我们建议使用高通量测序方法。 通过将高通量方法与qPCR结合使用,研究人员可以有效,更客观地评估不同空气生物组成分(细菌,真菌和花粉)的多样性和丰度。 通过在给定研究中仅比较城市与农村的结果,分析避免了这些方法上的混淆,但是,为了获得最大的比较潜力,需要统一方法。地球微生物组项目在线提供了详细的方案,用于环境微生物组采样和高通量DNA测序方法,建议以后的研究使用这些指南。
除抽样方法外,另一个影响可比性的问题是对丰度和多样性指标的使用和报告不一致。计算多样性的方式(例如物种丰富度,香农多样性,UniFrac距离等)会影响生物多样性与健康之间的关系。 例如,我们的一项研究表明,不同地点之间细菌和真菌的物种丰富度(α多样性)没有差异,但农村地区之间的地点间差异(β多样性)更大。 要准确比较研究或地区之间的社区,就需要访问用于计算社区指标的原始数据。
这些类型的大数据比较有助于获取知识,但是只有在所有DNA序列数据都可以公开访问时才有可能,例如Earth Microbiome Project。因此鼓励其他研究人员提供其数据,以促进跨研究的比较。
结论
该统计结果表明,严格比较农村和城市空气生物群系的研究仍然很少,尚需了解农村和城市空气生物群系如何以及为何不同以及如何影响人类健康。但是,他们发现,与城市地区相比,农村地区空气传播的真菌和细菌的丰度和多样性呈现出明显的趋势。 同样,所有四项研究同时比较了城市和农村的空气微生物组和人类健康,得出的结论是,农村的空气微生物组对人有保护性免疫系统的作用。包括两项直接测试不同空气生物组对人类免疫功能的影响的研究。 但是,值得注意的是,有几篇论文发现站点之间的丰度或多样性没有差异,这表明需要进行研究以探究造成空气生物群系城乡差异的驱动因素。
由于城市增长引起的环境变化,包括土地利用变化,人口和住房密度,农业集约化以及野生和家养动植物种群的变化,都可能影响空中微生物群落。除了进一步的研究比较各种土地利用和地理区域的空气生物群落,同时控制关键的混杂因素(如天气)外,至关重要的是,研究必须公开其方法和数据,以使用相同的分析和生物信息管道促进交叉研究的比较。还需要进行更多研究以实验性地测试这些变化如何影响人类健康。
主要参考文献
Flies EJ, Clarke LJ, Brook BW, Jones P. Urbanisation reduces the abundance and diversity of airborne microbes – but what does that mean for our health? A systematic review. Sci Total Environ. 2020 Oct 10;738:140337. doi: 10.1016/j.scitotenv.2020.140337. Epub 2020 Jun 22. PMID: 32806360.
Barberán, A., Ladau, J., Leff, J.W., Pollard, K.S., Menninger, H.L., Dunn, R.R., Fierer, N., 2015. Continental-scale distributions of dust-associated bacteria and fungi. PNAS 112, 5756–5761. https://doi.org/10.1073/pnas.1420815112.
Bertolini, V., Gandolfi, I., Ambrosini, R., Bestetti, G., Innocente, E., Rampazzo, G., Franzetti, A., 2013. Temporal variability and effect of environmental variables on airborne bacterial communities in an urban area of Northern Italy. Appl.Microbiol. Biotechnol. 97, 6561–6570. https://doi.org/10.1007/s00253-012-4450-0.
Mbareche, H., Brisebois, E., Veillette, M., Duchaine, C., 2017. Bioaerosol sampling and detection methods based on molecular approaches: no pain no gain. Sci. Total Environ. 599–600, 2095–2104. https://doi.org/10.1016/j.scitotenv.2017.05.076.
Mhuireach, G., Johnson, B.R., Altrichter, A.E., Ladau, J.,Meadow, J.F., Pollard, K.S., Green, J.L., 2016. Urban greenness influences airborne bacterial community composition. Sci.Total Environ. 571, 680–687. https://doi.org/10.1016/j.scitotenv.2016.07.037.

谷禾健康

在前一篇文章 生命早期微生物接触和过敏风险:如何预防,我们已经了解了微生物与过敏之间千丝万缕的联系。从构建微生物开始,到影响微生物的因素,过敏机制的阐述以及预防过敏的措施等都有了基本的认识。
本文将对微生物在过敏性疾病(食物过敏、特异性皮炎、哮喘)中的作用进行逐一介绍,尤其是微生物在儿童食物过敏这种常见的疾病中的发病机制进行详细阐述。
我们知道微生物组的组成在生命的最初几年是动态变化的,并且可以受到一些产前和产后环境和宿主相关因素的影响(下图)
影响人体微生物群发育的因素


Diego G. Peroniet al, Front.Immunol. 2020
新生儿微生物群是一个脆弱的、高度动态的生态系统,在生命的最初几年里,由于一些产前和围产期因素的影响,其组成发生了迅速的变化。肠道微生物群的成熟主要发生在2-3岁时。因此,婴儿早期可能是调节微生物群落以促进健康生长发育的关键时期。
生命的前1000天(即从受孕到2岁)似乎代表了微生物组调节的关键机会窗口。在这一时期之后,肠道微生物群趋向于获得具有不同微生物群落组成和功能的类似成人的结构。
在过去的二十年中,食物过敏(FA)的患病率,持续性和严重性一直在增加。来自人类和动物研究的越来越多的证据支持肠道微生态失调在FA发展中的关键作用。
基于16S rRNA测序的研究发现,与没有FA的儿童相比,患有FA的儿童具有独特的肠道微生物组结构。
表. 在有和没有FA的小儿患者之间主要的肠道微生物组差异(基于16S-rRNA测序的研究)

M.D.Costanzo et al, Int.J.Mol.Sci.2020
FA:食物过敏; FS: 食物过敏; OTUs:操作分类单元; N.R.: 未报道过的; ↑ : 增加;↓: 减少; =: 不变.
表1中所有研究均调查了IgE介导的食物过敏。有趣的是,关于46例受非IgE介导的牛乳过敏(CMA)影响的患者的数据显示,与健康对照组相比,失调的菌群中拟杆菌Bacteroides (Bac 12) 和Alistipes丰富,IgE介导的CMA儿童的特征重叠,是从健康到IgE介导的CMA患者的拟杆菌逐渐增加。
在同一项研究中,患有非IgE介导的CMA的儿童的粪便中丁酸浓度明显低于健康人。
菌群失调先于FA发作
来自人体研究的可用数据表明,菌群失调先于FA发作。Nakayama等人对过敏性和非过敏性婴儿的粪便细菌组成进行了分析,并将肠道微生物组组成的某些变化与以后几年的过敏发展相关联。
Azad 等人研究发现,在婴儿早期肠道微生物组含量较低的情况下,肠杆菌科Enterobacteriaceae / 拟杆菌科Bacteroidaceae的比率增加和Ruminococcaceae的丰度较低与随后的食物敏感性相关,这表明早期肠道菌群失调对FA的后续发展有促进作用。
此外,人类研究的可用数据表明:
– 没有特定的菌群可以始终与FA相关联,其广泛的微生物可能对耐受性机制产生积极或消极的影响;
– 生命早期,尤其是生命的头6个月,微生物组构成与FA的发展更为相关;
– 菌群失调不仅可以影响FA的发生,而且可以影响FA的病程,这是由比较长大后不再患FA的儿童与FA持续存在的患者不同的肠道微生物组特征所表明的。
肠道微生物组通过促进针对FA的几种免疫和非免疫作用机制,在介导免疫耐受中起重要作用。
目前的证据表明,肠道微生物组可以预防FA,从而诱导T调节(Treg)细胞的活化,而在无菌小鼠中发现Treg细胞被耗尽,从而导致FA的形成。
微生物群诱导的Treg细胞表达核激素受体RORγt,并沿着一条通向Th17细胞的途径分化。相反,在Treg细胞中不存在RORγt的情况下,表达GATA-3的Treg细胞和常规Th2细胞会扩增,并且与Th2相关的病理会加剧。
通过共生微生物,包括梭菌Clostridiales和拟杆菌Bacteroidales,在保护性RORγt+ Treg细胞的产生中起作用机制的特征是涉及髓系分化原发反应(MyD88)的途径。
这反过来又是几种先天性免疫细胞因子(IL-1,IL-18,IL-33)和Toll样受体信号通路的重要信号转导子。
Treg细胞中MyD88的缺失消除了保护作用,从而建立了MyD88–RORγt信号轴,可在肠道的新生Treg细胞中起作用,介导FA中共生菌对耐受的诱导。
此前已证实,Treg细胞中的MyD88调节IgA对肠道菌群和饮食抗原的反应,而这反过来在促进宿主-微生物组共生中起着至关重要的作用。
菌群失调导致FA中共生菌群-Treg细胞MyD88–RORγt +轴破坏。FA婴儿和小鼠的分泌型IgA与肠道菌群的结合减少,并且IgE结合明显增加。
除了对Treg细胞有直接作用外,健康的肠道微生物组还可以通过影响肠上皮细胞的功能并调节其屏障保护特性来保护FA。
固有的淋巴样细胞(ILCs)在粘膜和屏障位点丰富,参与了这些防御机制。
在其他因素中,ILC3产生IL-22,这是一种细胞因子,通过其多效性作用来促进组织抗微生物肽的产生,增强上皮的再生,增加粘液的产生以及调节肠道对食物过敏原的渗透性,从而对维持组织的免疫力和生理至关重要。
此外,Feehley等人的结果表明,健康婴儿粪便微生物群定殖的小鼠在回肠上皮细胞中显示一组独特的基因上调,例如Fbp2,其编码糖原异生酶果糖-双磷酸酶1,在维持肠道生态平衡中起重要作用。
相比之下,被CMA婴儿粪便微生物菌群定植的小鼠表现出Tgfbr3和Ror2的下调,这对上皮修复很重要。
菌落定植后,微生物组还促进固有层内的B细胞受体编辑。调节性B细胞具有免疫抑制能力,通常由IL-10分泌介导,但也有IL-35和TGF-β的产生。另一个免疫调节作用是在分化为浆细胞的过程中IgG4抗体的上调。
肠道微生物组在肠道中发挥促耐受作用的其他潜在机制与免疫调节代谢产物的产生有关,该代谢产物与宿主免疫细胞相互作用,促进无害的管腔抗原无反应性。
短链脂肪酸(SCFA)资料的初步数据为干预开辟了新的前景。SCFA,包括乙酸,丙酸,戊酸和丁酸,均来自结肠中膳食纤维的微生物发酵。SCFA是结肠细胞的主要能源。
SCFA直接与肠上皮细胞(例如GPR41,GPR43,GPR109A和Olfr78)上的G蛋白偶联受体(GPCR)结合,或者可以被动扩散通过细胞膜以抑制上皮和肠免疫细胞中的组蛋白脱乙酰基酶(HDAC)。
对肠上皮细胞的下游影响是调节参与能量代谢,细胞增殖和分化以及上皮屏障(紧密连接和粘液产生)的强化的基因表达。SCFA还通过改变NLRP3炎性体和自噬活性来影响肠道炎症和组织修复过程。
丁酸对食物过敏发挥免疫和非免疫作用
在SCFA中,丁酸在免疫耐受中起关键作用。已经发现SCFA能够增加结肠Treg细胞的频率,并且对来自无菌小鼠的结肠Treg细胞进行体外丙酸处理可显着增加FoxP3和IL-10表达,这是调节Treg细胞功能的关键细胞因子。
同样,已证明丁酸可在小鼠模型中促进活化FoxP3 + Treg细胞的生成。丁酸能够增强维生素A的代谢,进而诱导肠道CD103 +树突状细胞(DC)中的醛脱氢酶(ALDH)活性,并增加Treg细胞和IgA产生的百分比。
此外,丁酸促进B细胞分化,增加IgA和IgG的产生。其机制是多方面的,包括通过抑制HDAC对基因表达进行强烈的表观遗传调控(下图)
图. 丁酸对食物过敏发挥免疫和非免疫作用(FA)
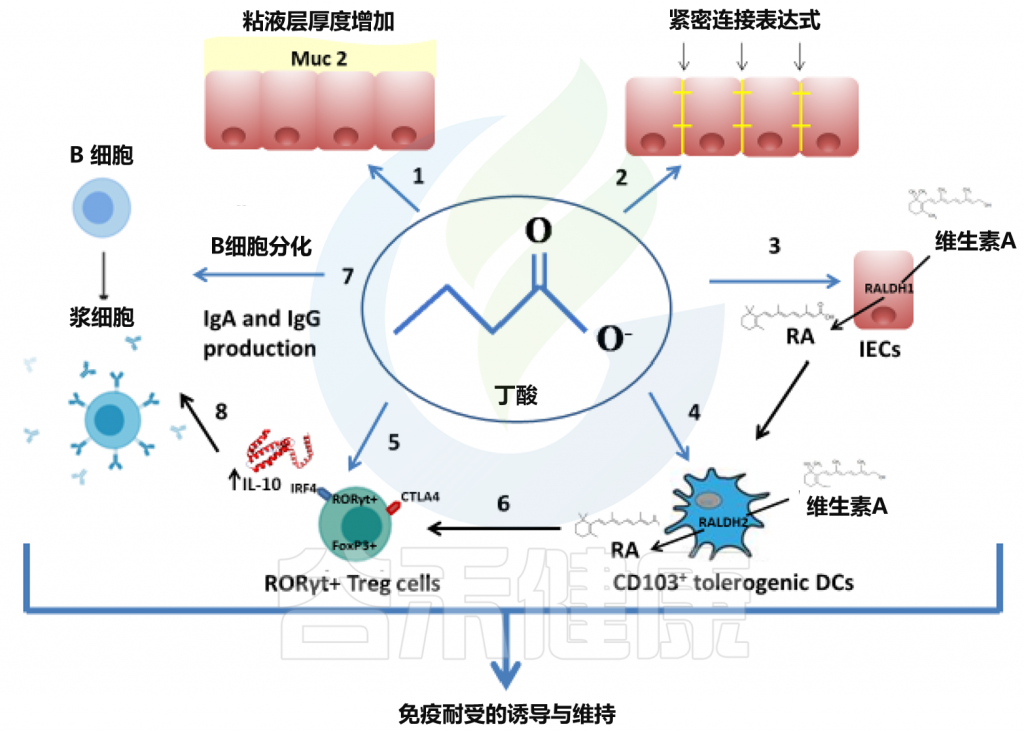

M.D.Costanzo et al, Int.J.Mol.Sci.2020
产丁酸菌代表一个功能基团,而不是一个连贯的系统发育基团。菌群失调会抑制高丁酸盐生产者种类,从而导致丁酸总产量减少。因此,不同类型的菌群失调可能具有相同的代谢特征,导致丁酸或其他代谢物水平产生相似的影响,从而促进FA的发生。
从这些数据开始,研究者在CMA小鼠模型中测试了丁酸口服液,并观察到它抑制了急性过敏性皮肤反应和过敏性症状评分,体温降低,肠通透性增加以及β-乳球蛋白(BLG)特异性IgE,IL- 4,和白细胞介素10的生产,表明丁酸对FA的保护作用。
此外,丁酸补充剂增强了口服免疫疗法在CMA小鼠模型中诱导的效应细胞的脱敏,有效减少了抗原攻击后肥大细胞和嗜碱性粒细胞的活化,并增强了Treg细胞的功能。
除了这些源自CMA小鼠模型的初步数据外,人体研究的结果还证实了SCFA在FA中的重要作用。
FA与特定疾病的代谢组学特征相关,特别是在鞘脂和磷脂代谢中,FA与哮喘区别开来。FA患者和哮喘患者的特定比较显示,微生物群敏感的芳香族氨基酸和继发性胆汁酸代谢存在差异。
在患有FA的儿童中,严重的全身反应史和多个FA的存在与色氨酸代谢产物,类花生酸,缩醛磷脂和脂肪酸水平的变化有关。在患有FA的儿童中观察到的鞘脂和神经酰胺水平降低以及其他代谢组学改变可能反映了微生物组改变与肠道免疫细胞亚群之间的相互作用。
鉴定对免疫耐受网络有积极影响的细菌代谢物可能是一种利用后生物方法对抗FA的有趣策略。
影响FA的发生的干预手段包括环境,益生菌/益生元/合生元等制剂的使用,粪菌移植等。
环境因素
有几种可更改的环境因素可以影响FA的发生,并且有可能成为预防FA的目标。机会之窗被称为“头1000天”,在该机会之窗中,环境因素决定了个人对成年后发展为传染性和非传染性慢性疾病(包括过敏)的敏感性。这个时期从子宫内发育到生命的最初2年,在此期间,肠道菌群和免疫系统的发育受到环境因素的强烈影响。
图. 婴儿肠道菌群组成和功能与多种环境因素有关

M.D.Costanzo et al, Int.J.Mol.Sci.2020
孕期和哺乳期的产妇饮食对产妇肠道和哺乳动物腺微生物群(肠胃通路)具有直接和间接的影响,并且在早期影响婴儿肠道微生物组的组成和功能中起着关键作用。
其他因素,例如农村环境,阴道分娩,家庭人数增加,宠物接触,母乳喂养,高纤维饮食和/或发酵食品,都与抵抗FA的发展有关。
相反,剖宫产,产前和生命早期接触抗生素,胃酸抑制剂,防腐剂以及垃圾食品和/或低纤维/高脂饮食可能会增加FA发生的风险。这些环境因素主要与肠道微生物组的结构和功能有关。
益 生 菌
益生菌被定义为“活微生物,当以适量的量作为食物的一部分进行施用时,可以给宿主带来健康益处”。
益生菌可以在免疫耐受网络中发挥不同的作用:调节肠道微生物组的结构和功能(例如,增加丁酸盐的产生);与肠细胞相互作用,随后调节非免疫性(肠通透性和粘液厚度)和免疫耐受机制(刺激分泌型IgA和β-防御素的产生);免疫细胞对细胞因子反应的调节。
补充益生菌是预防和治疗FA的有效选择。最常见的益生菌分为两种,即乳酸杆菌和双歧杆菌。
鸡蛋过敏
最近在鸡蛋过敏的小鼠模型中进行了益生菌抗FA活性的临床前研究。罗伊氏乳杆菌AB425917恢复了肠道菌群的恶化和Th1 / Th2的失衡,从而诱导了肠道对卵清蛋白诱导的过敏反应的免疫耐受。
宋等人分离并鉴定的鼠李糖乳杆菌2016SWU.05.0601,能够通过调节肠道菌群恢复卵白蛋白致敏小鼠的Th1 / Th2和Treg / Th17免疫失衡,这有助于降低血清IgE和卵白蛋白-IgE水平。
贝类过敏
在小鼠贝类过敏模型中,口服益生菌株婴儿双歧杆菌14.518在预防和治疗策略中有效地抑制了原肌球蛋白引起的过敏反应。
进一步的研究结果表明,婴儿双歧杆菌14.518刺激了肠道相关淋巴组织中DC的成熟和CD103+耐受性DC的积累,从而诱导了旨在抑制Th2偏向性反应的Treg细胞分化。
作者发现婴儿双歧杆菌14.518调节肠道菌群组成的变化。具体而言,Dorea的增加和Ralstonia的减少与Th2/Treg比值高度相关,可能有助于减轻原肌球蛋白引起的过敏反应。
牛奶过敏
在CMA的鼠模型中也进行了临床前研究。干酪乳杆菌BL2对无菌小鼠的新生婴儿进行单菌落化,可调节对牛奶蛋白的过敏性致敏作用。
酪乳杆菌定殖的小鼠发展出更高的酪蛋白特异性IgG反应,因为酪蛋白被酪乳杆菌水解成免疫原性肽。其他作者报道了相似的结果,他们观察到在BLG致敏的小鼠中施用婴儿双歧杆菌CGMCC313-2后IgE,IL-4和IL-13的浓度降低。
临床研究已经调查了选定的益生菌菌株对FA的功效。该作用似乎是菌株特异性的。在各种益生菌中,鼠李糖乳杆菌GG(LGG)已作为一种细菌菌株出现,能够在人类尤其是CMA中发挥抗过敏作用。
在CMA儿童中,与单独的EHCF和其他配方相比,补充LGG的广泛水解酪蛋白配方(EHCF)在6和12个月后诱导更高的耐受率。在对220名CMA患儿的小儿队列进行的3年随访中,与单独使用EHCF相比,用EHCF + LGG治疗后,进一步证实了口服耐受性获得率更高,其他过敏性表现的发生率也更低。
此外,用EHCF + LGG治疗CMA婴儿导致特定细菌菌株的富集,这些细菌与较高的粪便丁酸水平相关。世界过敏组织准则认为,使用功能性食物调节免疫系统是一种有前途的研究假设,是在CMA背景下诱导耐受性免疫环境的努力的一部分。
然而,作者得出结论,需要更多来自随机对照试验的证据。他们确定了在CMA治疗中补充益生菌的进一步研究是开发CMA有力证据基础的重要领域。
花生过敏
还对患有花生过敏的患者进行了LGG的研究。在一项临床试验中,接受了花生口服LGG免疫治疗18个月。与安慰剂相比,接受联合治疗的受试者对花生的脱敏率更高(分别为82.1%和3.6%)。
对参与该益生菌和口服免疫疗法联合试验的56名儿童中的48名儿童的随访研究表明,与接受安慰剂的受试者相比,在停止治疗后的四年中,接受治疗的个体更有可能继续吃花生(67%vs 。4%,p = 0.001);此外,与安慰剂治疗的对照组相比,治疗组的更多参与者的花生皮刺试验量较小,花生sIgG4:sIgE比例更高。


益 生 元
益生元现在被定义为“被赋予健康益处的宿主微生物选择性利用的底物”,包括不可消化的化合物,例如寡糖或可溶性发酵纤维,它们被选择性利用并促进有益微生物的生长并改善健康。
尤其对半乳糖-低聚糖(GOS)/果糖-低聚糖(FOS)的组合研究最多。益生元的作用机理有直接和间接作用。间接影响包括选择性发酵,增加肠道内有益菌数量。
SCFA在肠道和肠外水平介导益生元的直接有益作用。有人建议补充益生元是预防过敏性疾病的一种可能的干预方法。然而,在该领域进行的绝大多数系统评价和荟萃分析得出的结论是,尽管几项研究显示了益生元对过敏表现的积极作用,但现有证据不足以推荐将益生元作为预防过敏的常规方法。配方奶喂养的婴儿。因此,在该领域需要进一步严格的研究。
后 生 元
“后生元”是指使用无活力的细胞或细胞级分,当以足够的量给药时,它们会给宿主带来健康益处。另外,“后生元”还与可溶性成分有关,例如SCFA,维生素,细菌素,有机酸,酶,过氧化氢,乙醇,二乙酰基,肽,细胞表面蛋白,海胆酸,肽聚糖衍生的多肽,内多糖和外多糖活益生菌细胞在发酵过程中产生或在实验室中合成产生的,乳球蛋白,缩醛磷脂,多磷酸盐和群体感应分子。
SCFA引发的免疫调节机制代表是饮食、肠道微生物组和过敏性疾病之间最紧密的联系之一。
在一个301名1岁儿童的人类队列中,据报道饮食摄入的成分与粪便中SCFA含量之间存在显着相关性,表明饮食可用于调节SCFA的微生物产生。作者还研究了SCFA在预防过敏中的作用,发现丁酸水平最高的儿童对食物过敏原过敏的风险降低了。
如前所述,临床前研究表明,在SCFA中,丁酸酯通过多种致耐受机制有助于预防FA的发展。在人类观察性研究中,在过敏性儿童中观察到丁酸缺乏症,而在CMA治愈速度较快的儿童中观察到了富含丁酸产生菌(梭菌类和厚壁菌门)的富集。
这些数据表明,基于SCFA对抗FA的后生方法的潜力。但是,尚未进行基于SCFA补充剂进行FA预防和治疗的临床试验。因此,目前尚无任何科学学会推荐用于预防和治疗FA的最佳生物后给药频率。
合 生 元
益生元是益生元和益生菌的混合物,它们通过改善存活的微生物饮食补充剂在胃肠道中的存活和植入,改善宿主的健康来影响宿主。
Candy等人设计了一项研究,以研究合生元成分是否可以改善非IgE介导的CMA婴儿的肠道菌群,以达到与健康,母乳喂养婴儿相似的微生物组成。
给疑患有非IgE介导的CMA的婴儿服用含有合生素的测试配方,或不含合生素的对照配方。测试配方为低变应原,基于营养完整的氨基酸的配方,包括低聚果糖和益生菌短双歧杆菌M-16V的益生元混合物。对照配方是不含合生元的氨基酸配方。
作者得出的结论是,基于含有特定的合生元的氨基酸配方,改善了疑似非IgE介导的CMA婴儿的粪便微生物群,接近了健康,母乳喂养婴儿的肠道菌群组成。
有趣的是,双歧杆菌-16V可能通过IL-33/ST2信号改变肠道微生物群,以减轻过敏症状。这些结果表明肠道微生物群对FA对膳食抗原的调节是必不可少的,并证明菌群调节的干预可能与FA有关。
但是,尽管这些初步数据很有希望,但仍需要进一步研究以评估这种方法对临床症状的疗效。
粪便菌群移植
粪便菌群移植代表了另一种在FA患者中塑造肠道菌群的方法。该策略背后的思想是,从健康的供体向疾病的受者进行粪便微生物菌群的移植可以通过促进口服耐受性来恢复肠道的普遍性。
最近,一项人体研究表明,粪便菌群移植能够通过恢复肠道菌群多样性来诱导婴儿过敏性结肠炎的缓解。但是,该领域的可用数据仍然有限,相关的科学工作才刚刚开始。
在世界范围内,最常见的炎症性皮肤病是特应性皮炎(AD),儿童患病率为10–20%。在这些儿童中,有60%的人AD发病发生在生命的早期,即1岁之前。84%患有特应性皮炎的儿童有入睡困难。
特应性皮炎是一种复杂的皮肤病,其特征是表皮屏障功能障碍、先天/适应性免疫反应改变和皮肤微生物多样性受损。
一些因素,如年龄、性别、种族、气候、紫外线照射和生活方式驱动因素,都会影响皮肤微生物组的组成。
健康的皮肤微生物组
健康的皮肤微生物群以丙酸菌属Propionibacterium species为代表,主要分布于皮脂腺部位,棒状杆菌Corynebacterium和葡萄球菌 Staphylococcus在潮湿的微环境中更为丰富。马拉色菌Malassezia是人类皮肤上主要的真菌菌群。
特异性皮炎微生物组
微生物多样性的丧失,金黄色葡萄球菌Staphylococcus aureus 多于表皮葡萄球菌Staphylococcus epidermidis,是急性和慢性AD皮肤部位的一个特征性特征,与AD的严重程度和对常见过敏原过敏的风险相关。

C.E. Powerset al.Journal of Dermatology,2015
AD,特应性皮炎;AMP,腺苷一磷酸;
PS,心理应激;RH,相对湿度
金黄色葡萄球菌通过不同途径参与表皮屏障的破坏,包括下调表皮蛋白的终末分化,如丝状蛋白和洛瑞林,以及促进皮肤蛋白酶活性,从而直接破坏皮肤屏障。
凝固酶阴性葡萄球菌,包括表皮葡萄球菌 S. epidermidis、S. hominis和S. lugdunensis,可以分泌抗菌代谢物,限制金黄色葡萄球菌的过度生长和生物膜的形成。
表皮葡萄球菌
此外,表皮葡萄球菌还可以激活TLR2信号,诱导角质形成细胞衍生抗菌肽的产生,增加表皮紧密连接蛋白的表达。表皮葡萄球菌在新生儿皮肤上的定植与诱导特异性树突状细胞(Tregs)有关,这些树状突细胞调节宿主免疫反应的局部激活。
最近有研究表明,婴儿在2个月时皮肤共生葡萄球菌的种类显著减少,这些婴儿后来在1岁时发展为AD,这表明有针对性的局部调节有利于早期定植该属,可能会降低以后发生AD的风险。
这些发现,再加上定期使用保湿霜修复皮肤屏障和恢复共生细菌多样性的证据,构成了正在进行的局部益生菌应用研究的基本原理,例如Vitreoscilla filiformis裂解物和Roseomonas mucosa,作为调节皮肤微生物群与治疗AD的潜在策略。
初步资料还显示,将抗微生物凝固酶阴性葡萄球菌自体皮肤移植到AD患者身上,可以减少金黄色葡萄球菌的过度生长和定植。
AD患者肠道菌群的变化
AD患者肠道微生物组中双歧杆菌的浓度低于健康对照组,并且这些数量与疾病的严重程度成反比。艰难梭菌早期肠道定植与AD的发生有关,1个月时拟杆菌多样性较低与2岁时的AD相关。
有证据表明,由于T细胞介导的反应发生变化,产前和产后补充乳酸杆菌和双歧杆菌可以降低婴儿患AD的风险。
最后,最近一项关于肠道微生物群的大型前瞻性研究表明,与健康对照组相比,学龄前患上AD的儿童的Lachnobacterium和Faecalibacterium的数量明显减少。值得注意的是,这些菌群的差异丰度在整个婴儿期被记录下来,这支持了它们在AD发展中的发挥保护作用的可能性。
越来越多的证据表明,生命早期肺部微生物组的组成可以影响呼吸系统健康或疾病的发展。临床前模型支持细菌对过敏性气道炎症的保护作用。
拟杆菌门,尤其是普雷沃特菌属Prevotella,在健康受试者的肺部微生物群中占优势。
在生命的前2周,肺微生物组促进树突状细胞中程序性死亡配体1(PDL1)的瞬时表达,这是Treg介导的减轻过敏性气道反应所必需的。
流行病学证据表明,在农业环境中长大的儿童,从小就接触各种微生物群,过敏发生率较低。
生命早期链球菌气道定植是哮喘的强预测因子
值得注意的是,在生命的头2个月内,由链球菌Streptococcus 、莫拉克西拉菌Moraxella或嗜血杆菌Haemophilus引起的气道定植与生命第一年的下呼吸道病毒感染的严重程度和以后哮喘发展的风险有关。
变形菌门也与哮喘和中性粒细胞性加重有关,而拟杆菌与嗜酸性粒细胞性加重有关,因此认为不同的介质和微生物组可能代表不同的生物恶化簇。
新的证据表明,早期肠道微生物的紊乱也会影响过敏性气道炎症的发展。在新生小鼠中使用抗生素有利于微生物组分的变化,这与肠道阻力的改变和气道高反应性的增加有关。同样,人在出生前后接触抗生素会增加患哮喘的风险。
哮喘婴儿肠道微生物组
在最近的一项纵向研究中,Galazzo等人表明,与健康对照组相比,学龄期哮喘婴儿肠道微生物组中的细菌属Lachnobacterium、Lachnospira和Dialister显著减少。
加拿大健康婴儿纵向发育研究(CHILD)对3个月大时肠道微生物组的分析表明,在有儿童哮喘风险的婴儿中,毛螺菌属Lachnospira, 韦荣球菌属Veillonella, 粪杆菌属Faecalibacterium和罗氏菌属Rothia 减少。
在另一项最近的观察性队列研究中,1岁时毛螺菌科Lachnospiraceae, 粪杆菌属Faecalibacterium和Dialister减少与5岁时哮喘风险增加相关。
菌群对哮喘发生的保护作用可以通过其发酵产物介导
Faecalibacterium prausnitzii 发酵膳食纤维产生短链脂肪酸,尤其是丁酸。丁酸是结肠细胞的首选能源,通过诱导Tregs和促进上皮屏障通透性具有抗炎作用。
SCFAs可促进骨髓树突状细胞的成熟过程,导致成熟细胞在肺部激发Th2反应和诱导黏膜B细胞产生IgA的能力降低。在实验和人体研究中,早期高水平的肠道微生物衍生丁酸可降低过敏原致敏和哮喘发生的风险。
最后,最近对口服益生菌对哮喘相关结果影响的研究进行了系统综述,结果表明,在哮喘控制和肺功能方面,接受益生菌补充的儿童与对照组相比没有显著差异。
综上,生命早期是微生物和免疫系统发育的关键时期。目前已知的婴儿期与过敏性疾病相关的微生物群改变(下图)。

Diego G. Peroniet al, Front.Immunol. 2020
在生命的最初几年中,微生物群的发育和成熟受到干扰,可能对免疫健康产生各种有害影响,有助于确定过敏疾病的发展。
尽管近年来对早期生命营养、微生物组和免疫系统发育之间关系的理解已经显著增加,但在涉及的分子机制方面仍然存在着大量的知识空白,需要探索。
当然,通过干预以可改变的环境因素的形式,或者用益生菌、益生元、合生元来塑造肠道微生物组都是有效策略。肠道微生物组正在成为预防和治疗儿童过敏性疾病的创新目标。
相关阅读:
参考文献:
Di Costanzo Margherita,Carucci Laura,Berni Canani Roberto et al. Gut Microbiome Modulation for Preventing and Treating Pediatric Food Allergies.[J] .Int J Mol Sci, 2020, 21.
Diego G. Peroni,et al,Microbiome Composition and Its Impact on the Development of Allergic Diseases,Front. Immunol., 23 April 2020.
Powers C E, McShane D B, Gilligan P H, et al. Microbiome and pediatric atopic dermatitis[J]. The Journal of dermatology, 2015, 42(12): 1137-1142.
Hulshof Lies,Van’t Land Belinda,Sprikkelman Aline B et al. Role of Microbial Modulation in Management of Atopic Dermatitis in Children.[J] .Nutrients, 2017, 9: undefined.
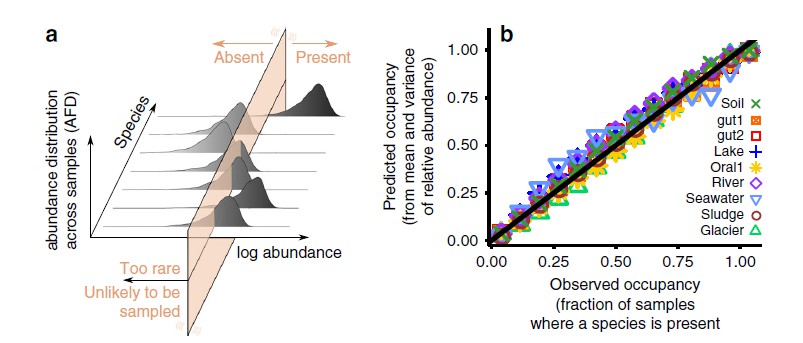
谷禾健康
肠道菌群是健康和疾病的新领域。不仅许多疾病都与微生物群落紊乱有关,而且越来越多的研究指出了其因果关系。在目前我们所知的情况下,很难定义什么是健康的微生物群,这主要是由于个体间的高度可变性。那么,“弹性菌群”可用作健康菌群的替代物。此外,肠道菌群是最容易受到环境变化和损害的“器官”。
在个人的一生中,面临着不健康饮食,药物和感染等状况。恢复到出状况之前基线的能力受损可能导致菌群失调。因此,有理由假设,维持有弹性力的微生物群对健康很重要。本文综述了复原力的概念,有关弹性菌群特征的已知知识,以及如何使用高脂饮食干预的人类模型,通过实验评估微生物菌群的复原力。


可以通过维持微生物群恢复力的干预措施来了解哪些微生物群或功能会受到干预的干扰,并可以使用益生菌(如果有)替代减少的物种,或使用益生元进行强化。具有多种结构和组成的纤维也可以用于增加微生物群的多样性,微生物群的特征可能与弹性有关。最后,讨论一些未解决的问题和知识缺口。
人类肠道内有数万亿种微生物,大多数是细菌。这种微生物生态系统,即微生物群落,在人类生理和健康中起着至关重要的作用。肠道微生物群的研究历来集中在与肠易激综合征、炎症性肠病、过敏、糖尿病、癌症、哮喘和肥胖的关联。
一些研究已经超出了相关性,并基于人类粪便移植或人类微生物群转移至无菌小鼠的研究表明微生物群对某些疾病的致病作用。成人肠道微生物群是相当稳定的,同时不断受到宿主和多种外部因素的影响。在特别强烈的应激反应下,肠道微生物群可能会发生严重改变,这可能会影响个人的健康。
定义一个健康的微生物群对于预防或纠正失调,并将其对健康的影响降到最低非常重要。然而,微生物群的组成非常多样,变化很大,这取决于饮食、地理位置、种族、运动水平、药物使用(包括但不限于抗生素)和遗传学等。除了这些内在和外在因素,很大一部分个体之间的微生物群变化不能用任何特定的因素来解释。
高度的变异性使得很难定义正常或健康的微生物群。然而,微生物多样性的某些特征,如微生物多样性的增加,通常被认为是肠道微生物多样性的增加。在确定肠道微生物群是否健康或有益生元时,也可以考虑对宿主(如肠道屏障功能和免疫功能)的影响。或者,在肠道微生物生态系统中,恢复力可以作为健康生态系统的替代标志。恢复力是其在压力下抵抗变化或从扰动中迅速完全恢复的特性。
与功能和生命维持相互依赖联系在一起,人类肠道内的细菌被构造成一个复杂的生态系统,具有多重交互作用。这种肠道微生物生态系统在从新生儿到婴儿到幼儿的早期生命中演化和建立,在成人生活中基本保持稳定。外部压力因素,如极端饮食变化、感染、抗生素使用或其他药物,包括所有治疗类的成员都会扰乱这个生态系统。随后,这种肠道微生物生态系统可能恢复或恢复不到其原始状态(下图)。一个有弹性的微生物群在受到扰动后将恢复到原来的平衡状态,而非弹性微生物群将转向一个改变后的新状态。

描述生态系统的原生状态、扰动、回到原始状态或过渡到新状态可能性的概念图解
基线是发生扰动前生态系统的状态。
影响是由于压力源而引起的生态系统的变化。
恢复力是生态系统保持其状态并从扰动中恢复的特性。系统在冲击(阻力)期间持续存在的能力以及在干扰影响(恢复)后恢复到基线的能力决定了整体的弹性。从概念上讲,下面的图对此进行了说明。

描述在压力下肠道微生物群的扰动的概念图解。弹性描述了生态系统维持其状态或从干扰中恢复的能力。弹性取决于减少冲击(抵抗)和从干扰影响中恢复(恢复)的能力
可以说,一个健康个体在受到刺激后能够迅速、完全恢复到基线水平的微生物群是一个健康的微生物群,因为这种恢复力可能会阻止新平衡偏向失调方向,从而阻止对个人的健康产生负面影响。
肠道弹性的概念已经在一些文章中进行了讨论。正如最近提出的,一种结合挑战性测试和生物标志物的模型,可以告知微生物群恢复的动态,从而记录恢复力作为健康的指标。然而,这些建议仍然是理论上的,据我们所知,关于弹性量化模型的实验验证还没有报道。
微生物多样性可能对恢复力起到积极作用。Tap等人发现,当膳食纤维摄入量增加时,人体肠道微生物群的丰富性提高了其稳定性。另一项人类研究表明,抗生素引起的微生物群扰动较弱,与刺激前微生物群多样性较高有关。
宿主免疫状态也可能影响微生物群的恢复力。两项研究表明,基因消融小鼠体内的细菌传感器nod2会导致微生物群从抗生素干扰中恢复受损。然而,第三项以aroA缺陷沙门氏菌为干预的研究并没有发现nod蛋白对微生物群恢复力有任何影响。Nod是一种免疫信号的细胞内传感器,对特定的肽聚糖结构特别敏感,因此反应性可能取决于干预中使用的病原体。这些基础研究表明,宿主微生物群共生的稳定性可能是评估恢复力的另一个重要指标。
一些作者试图模拟肠道微生物生态系统的稳定性和恢复力。Shaw等人使用稳定性景观框架模拟抗生素治疗后肠道微生物群的恢复力。某些其他方法,如增加的自相关和“主导”群体中变量的方差,可以作为关键过渡到替代稳定状态的早期指标。
一项研究集中于通过研究特定微生物群落物种的分布来定义微生物群落中的“危机元素”,并发现与宿主参数相关的双峰分布。有些细菌要么几乎不存在,要么相当丰富,这取决于某些宿主因素,而且可能是那些与改变状态有关的细菌。
文献中描述了一些恢复力公式。最近对其中的大部分进行了审查,并将其归类为一个概念框架。简言之,这些公式可分为三类指标:一类指标描述了相对于干扰前状态基线的变化,从而评估系统受到干扰的程度;另两类指标考察干扰后的恢复情况。这种恢复既可以表示为相对于基线,也可以表示为相对于扰动的大小。前者强调系统恢复到扰动前状态的程度。后者强调它从扰动的影响中恢复了多少。
为了实验性地评估微生物群的弹性,必须对微生物群提出挑战,并测量一些或所有上述参数。一些研究使用抗生素或饮食干预来扰乱微生物群,并评估各种干预措施对这种干扰的影响。
大卫等人的一项研究为在人体试验中研究微生物群的恢复力提供了一个很好的模型。它所面临的干预是动物性饮食(如肉、奶酪),由70%的脂肪、0%的碳水化合物和30%的蛋白质组成。在饮食干预2天后,微生物群组成就发生了显著变化,并在饮食干预结束后6天恢复到基线水平。使用饮食干预的好处是它可以标准化,并且不会像在健康受试者中使用抗生素那样引发伦理问题。

弹性指数可以通过使用已知受压力影响的参数(如微生物群组成、功能和/或代谢物)来计算。弹性指数可用于定量衡量微生物群偏离的程度以及恢复的速度和充分程度,从而量化弹性。这种弹性指数提供了一种测量方法,可以用来比较不同的压力源。
理想情况下,一个人应该能够在不施加压力的情况下评估个人的微生物群弹性。综合大数据的机器学习可以帮助设计基于微生物群和宿主参数的算法,用于预测微生物群的弹性。其中一个参数是α-多样性。这一点得到了一项人类研究的支持,该研究表明,抗生素引起的微生物群扰动较弱,与干预前较高的微生物群α-多样性有关。
一项将微生物群转移到无菌小鼠中的研究表明,抗生素引起的扰动程度取决于供体,这为在没有干预的情况下通过分析基线微生物群来预测恢复力的假设提供了依据。
如上所述,在整个生命周期中,肠道微生物群都会受到反复而多样的干预,包括不健康的饮食、药物、酒精、剧烈运动和病原体等。抵抗这些干预的能力下降或迅速完全恢复到干预前状态的能力可能导致新的平衡和失调,这可能有助于慢性非传染性疾病(CNCDs)的发展。在接受抗生素治疗的人类受试者中,观察到微生物群恢复基线和建立新平衡的能力减弱。因此,干预以维持微生物群处于弹性状态可能是一种措施,以延迟或阻止微生物群相关的CNCDs的发展。值得注意的是,微生物群构成了一个易于接近的干预“器官”,尽管如何稳定地调节微生物群可能不那么明显。
这种微生物群恢复力与健康之间的联系的理论很有吸引力,但支持它的数据却很少。在人类研究中,Mondot等人将微生物群落稳健性定义为物种丰富度高和OTU(操作分类学单位)之间的高度相关性。他们发现微生物群落的稳定性与回肠结肠切除术后克罗恩病的缓解呈正相关。
了解弹性微生物群的特征将有助于设计旨在提高弹性的干预措施。虽然这方面的知识目前还不完全,但已经知道微生物多样性可能是一个影响因素,膳食纤维可能是增加微生物多样性的一种方式。膳食纤维是碳水化合物聚合物,在上消化道中不被消化吸收,到达结肠,在那里受到细菌发酵。许多研究表明,纤维会影响微生物群的组成和功能,尤其是短链脂肪酸的产生。对不同地理位置的人类的研究表明,摄入更多的膳食纤维与肠道微生物群多样性增加有关,人类干预研究表明,膳食纤维和全谷类食物的摄入增加了肠道微生物群的多样性。


微生物群落多样性原则上也可以通过膳食纤维的复杂混合来增加,如至少一项小鼠研究所示,它提供了广泛的结构和单糖单元。在小鼠身上的一项研究表明,纤维对改善微生物群的恢复力有直接作用。在这项研究中,喂食富含纤维的饮食并用抗生素和艰难梭菌(原为梭状芽孢杆菌)激发的小鼠的微生物群恢复到激发前的组成,而喂食低纤维饮食并以同样方式激发的小鼠的微生物群则没有恢复。
已发表的关于人类微生物群的数据显示,许多物种通常受到干扰。这些可能是脆弱的物种,可以通过营养干预来促进或补充。例如,B. adolescentis是高脂肪饮食中减少最多的菌群。此外,在抗生素的作用下,该菌数量急剧减少,恢复缓慢。因此,有理由提出并(i)检验假设,将B. adolescentis作为益生菌混合物的组成部分可以提高微生物群的弹性,(ii)排除Bifidobacterium adolescentis只是一种生物指示剂的可能性。其他作为益生菌存在的双歧杆菌和乳杆菌物种,如长双歧杆菌、双歧杆菌、B. angulatum 和 L. casei,也会因对微生物群的干预而发生变化,尽管不像B. adolescentis那样剧烈,因此,可以成为弹性混合营养液的一部分。
并非所有干预中减少的菌都以益生菌的形式存在,但已知能够促进这些物种生长的成分也可以用来防止它们在干预期间和之后的下降。例如,菊粉有利于 B. adolescentis 和 Faecalibacterium prausnitzii 的生长。F. prausnitzii 是一种有益菌,当微生物群受到抗生素或高脂肪饮食的干预时,它就会减少,并且与腹泻的恢复有关。
以促进某些菌为目的的饮食干预必须谨慎地进行,以避免目标物种变得过于突出,从而对物种多样性产生负面影响,这将与预期的效果相违背。
两项研究调查了益生菌对抗生素干扰微生物群的影响,以确定它们是否能提高恢复力。一项研究表明,补充鼠李糖乳杆菌和瑞士乳杆菌对抗生素阿莫西林+克拉维酸引起的微生物群扰动没有影响,而另一项较早的研究表明,混合益生菌(B.lactis Bl-04, B. lactis Bi-07, Lactobacillus acidophilus NCFM, Lactobacillus paracasei Lpc-37, 和 Bifidobacterium bifidum Bb-02),将阿莫西林+克拉维酸引起的粪便微生物群破坏降至最低。本研究中的益生菌组,通过随机片段长度多态性(RFLP)分析显示出明显的恢复趋势,此外,通过细菌培养可显著提高耐药性。
除了修复微生物群的组成外,还需要考虑如何将受到干扰的微生物群对宿主的影响降至最低。菌群失调通常会导致炎症和肠道通透性增加,进而对微生物群产生负面影响。
为了打破这一恶性循环,混合益生菌(如鼠李糖乳杆菌GG)或显示可增强肠道屏障(如植物乳杆菌)的益生菌混合物,可能是通过作用于宿主生理学来改善微生物群的一个很好的补充方法。
还有许多问题有待回答,即还有哪些参数能使微生物群具有弹性。关键物种的作用必须确定,而且可能很重要。这些分类群被认为与大量其他分类群相互作用,可能有助于维持微生物群落的状态。目前,关键物种在微生物群恢复力中所起的作用尚未阐明,仅提出了一些候选关键物种(例如,瘤胃球菌)。
稀有物种呢?通常,丰度低于某一阈值的分类群被合理地排除在分析之外,因为极低的数字和零之间的差异可能是由于方法敏感性而不是生理差异。这一方法可用于与恢复力相关的研究,因为低丰度类群的消失可能比丰度类群的大量减少更为相关。如果提供重要功能的低丰度物种灭绝,这种不可逆的事件可能会将微生物群转移到另一种稳定状态,这可能是迈向菌群失调的一步。
关于物种层面的知识是否足够可靠以进行干预,这个问题仍然悬而未决。益生菌的好处是已知的菌株依赖性。因此,提供一个特定的菌株来取代一个减少的物种可能行不通,如果它是另一个具有不同功能的受干扰菌株。分析技术还需要进一步改进,因为目前的鸟枪式宏基因组微生物群分析技术允许在物种级别进行区分,但很少在菌株级别进行区分。
其他领域的肠道微生物在微生物群落弹性中的作用仍有待阐明。大多数微生物群的研究都集中在细菌上,但古细菌、真核生物和病毒也存在于肠道中。一些研究发现病毒组、真菌或古细菌的组成与人类疾病(包括2型糖尿病、炎症性肠病和肥胖)之间存在关联。有趣的是,一项研究显示,在易患1型糖尿病的儿童中,病毒组多样性在自身免疫发生之前减少。
关于共生肠道微生物之间的相互作用知之甚少。据我们所知,没有研究表明病毒、古生菌和真菌在哺乳动物肠道微生物群恢复力中的作用。然而,细菌以外的其他微生物也有可能在恢复力方面发挥作用,尤其是噬菌体,因为它们有能力感染和溶解特定的细菌,从而可能控制它们的数量。
另一个重要的问题是,肠道微生物群的弹性是特定于压力的,还是与压力性质无关的弹性程度相似?目前这个问题还没有实验性地解决。
本文总结了造就有弹性的微生物群的因素,以及如何设计一种有效的营养干预策略来提高恢复力。提高微生物群的恢复力可能对健康产生重要的有益影响。目前的知识虽然不完整,但包含了足够的信息来证明和指导第一代解决方案的人体试验的设计。随着我们对微生物群恢复力机制的进一步了解,未来的新发现将用于设计下一代干预措施的组成。
参考文献:
Shaillay Kumar Dogra, Joel Doré, Sami Damak, Gut Microbiota Resilience: Definition, Link to Health and Strategies for Intervention,Front. Microbiol., 15 September 2020