 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


原创:谷禾健康
你可能听说过
肠道微生物群会影响大脑的生理和行为
但你是否清楚
肠道微生物群究竟是如何调节社会行为?
研究微生物群和社会行为之间的关系可以为我们带来什么?
近日发表在Science期刊上的一篇最新综述或许可以帮助你进一步了解微生物群和社会行为之间的关系。


肠道微生物群与中枢神经系统之间的双向通路,即微生物-肠-脑轴,影响动物王国中各种复杂的社会行为。一些动物已经进化出了它们自己与肠道微生物群的独特关系,这可能有助于它们与同种动物间的互动。肠道微生物群与社会行为之间的关系可能有助于解释在自闭症谱系障碍(ASDS)等情况下观察到的社会缺陷,并可能引领开发新的治疗方法。
微生物-肠-脑轴与社会行为的关系
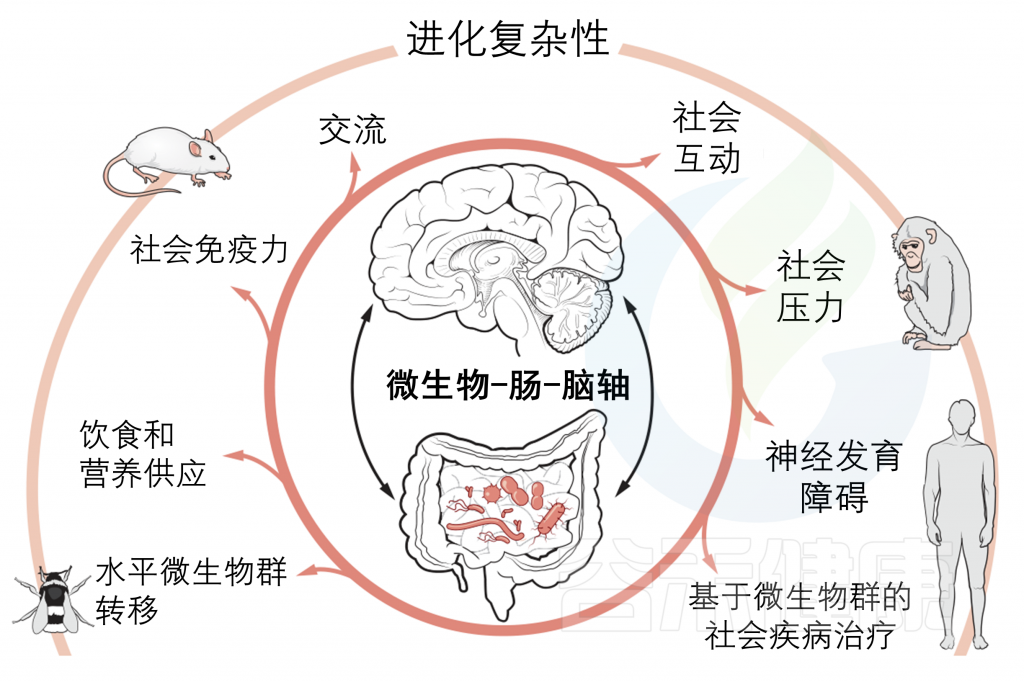

背景
微生物群-肠-脑轴
研究表明,胃肠道微生物可以通过多种途径向大脑发出信号,包括免疫激活、微生物代谢产物和肽的产生、迷走神经的激活以及肠道内各种神经递质和神经调节剂的产生。这种双向途径被称为微生物群-肠-脑轴。


虽然对肠道微生物在自然种群中的功能和生态影响的研究正在增加,但从进化的角度来看,目前尚不清楚微生物与社会大脑之间的关系是为什么和何时出现的。跨物种分析可以帮助我们理解人类的社交能力。
进展
社会行为
社会行为可以定义为只有当动物出现在一个群体中时才能观察到的行为。
社交性包括一系列复杂的互动行为,这些行为可以是合作的、中立的,也可以是敌对的。
社交能力可以促进互利的结果,如分工、合作照顾和增强免疫力,但社交能力也能促进消极结果,包括冲突、侵略和胁迫。
了解调节社会行为的内在和外在因素,对于揭示个体和种群如何繁衍生息,对于确定某些动物物种为什么进化成比其他物种更善于交际,对于阐明社会行为障碍的潜在病因,都是很重要的。
1973年,Konrad Lorenz等人在哺乳动物的遗传起源、发展和社会行为模式的启发方面的突破性研究获得了诺贝尔奖,为评估影响社会行为的各种内在因素和外在因素提供了基础。
从那时起,人们在理解行为方面取得了巨大的进步,尤其是社会行为,已经成为生物学研究中最有趣、最复杂的领域之一。
社会行为由多个相互连接的大脑边缘区域控制
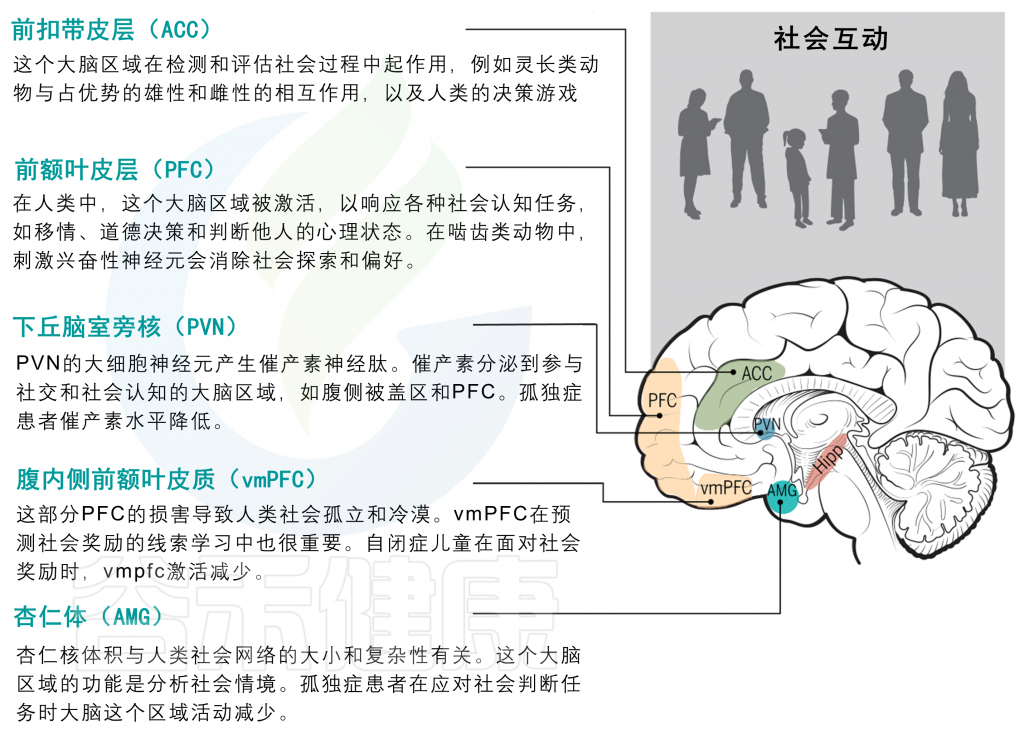

临床前和临床影像学研究有助于描绘人类和其他哺乳动物社会行为的神经回路。社会行为受几个皮质下前脑结构控制,如前额叶皮质(PFC)、前扣带皮质(ACC)、杏仁核(AMG)、海马体(HIPP)和下丘脑室旁核(PVN)构成一个完整网络的一部分,以促进这种复杂的行为。
对这些大脑区域中任何一个的损伤或功能障碍都会引起社会行为的不安。事实上,AMG和PFC等区域的神经生物学已经被证明在自闭症谱系障碍(ASDs)等社会大脑疾病中发生了改变。
动物界的研究
对宿主微生物相互作用的新认识导致人们前所未有地关注动物体内的微生物世界,包括无脊椎动物(如白蚁、蜜蜂、黄蜂)和脊椎动物(鸟类、鬣狗、人类)。
开创性的研究已经确定了胃肠道微生物群对健康的影响,微生物群在从早期到成年的神经发育过程中发挥作用,并影响神经传递、神经炎症和动物行为等神经过程。微生物产生的信号可能直接或间接地改变大脑功能,并且由于动物是在微生物世界中进化的,这些信号可能在整个进化过程中影响了动物的大脑。
动物界微生物群与社会行为的关系


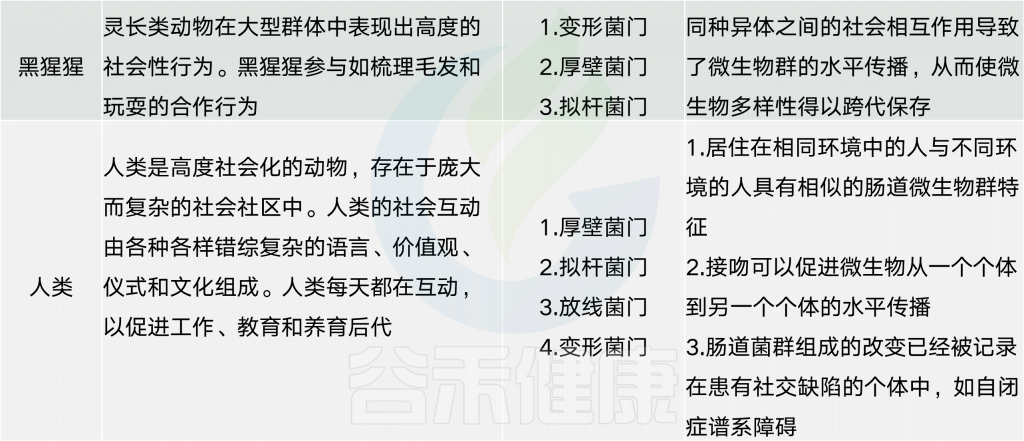



对社会物种和非社会物种的微生物群组成的研究表明,在许多动物物种中都存在相同的细菌门。然而,不同的物种以不同的方式利用它们的相关微生物群,以促进各种形式的社会互动。
对无脊椎动物和脊椎动物物种的观察表明,饮食和免疫等因素会产生选择压力,从而推动微生物群与社会行为之间的关系。
虽然微生物群可能通过调节肠脑轴而影响内源性行为,但一些动物物种可能已经进化成利用共生细菌来介导相同物种的成员之间的通信。例如,鬣狗从它们的气味腺体中产生一种有气味的糊状物,其中含有发酵细菌,这被认为是为了促进同种动物之间的社会凝聚力。动物和微生物群之间的这种复杂的关系提出了这样的假设:微生物可能影响着社会大脑和行为的进化,以此作为传播它们自己的遗传物质的手段。
肠道微生物群调控社会行为机制
越来越多的证据表明,在动物界观察到的许多行为反应可能在动物生命的不同阶段受到肠道微生物群的调节,在这个范式中,越来越强调阐明肠道微生物群与大脑交流的机制。
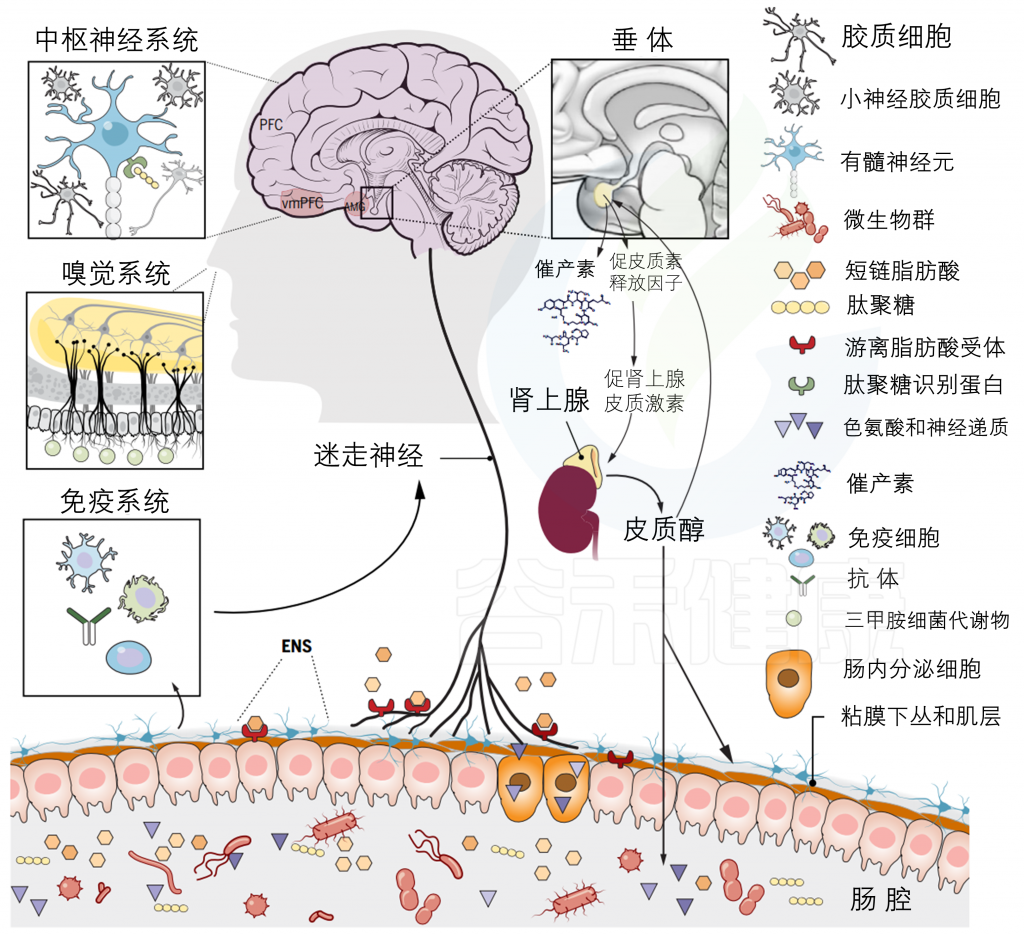

代谢产物
胃肠道中的细菌发酵和代谢导致神经递质和短链脂肪酸(SCFAs)等代谢产物的产生。SCFAs可能通过与迷走神经上表达的游离脂肪酸受体(FFAR)结合和激活,间接影响脑的生理和行为。
此外,它们在胃肠系统局部抑制组蛋白脱乙酰酶的能力可能间接影响各种介质对大脑的信号传导。
迷走神经
迷走神经最近被证明与肠内分泌细胞形成突触联系,这有助于通过谷氨酸能神经传递将营养信号传递给大脑。
迷走神经纤维富含5-HT3、Toll样受体4(TLR4)、游离脂肪酸受体(FFARs)和肠肽受体等受体;因此,它们是从肠腔向大脑传输信号的理想场所。
迷走神经切断术研究提供了经验证据,证明迷走神经是微生物群与大脑沟通的另一条途径。
免疫机制
肠道微生物群与免疫系统之间的联系是另一个被高度探索的途径,共生细菌可以通过这种联系对大脑生理和行为施加影响,在革兰氏阴性菌和革兰氏阳性菌细胞壁上表达的细菌肽聚糖能够通过激活在大脑(中枢神经系统插件)中表达的特定病原体识别受体,如PGLYRP2,影响社会行为的发展。
嗅觉机制
微生物群还可以通过排泄代谢物影响社会行为,代谢物充当嗅觉信息素。小鼠尿液中分泌的三甲胺可通过激活嗅觉受体(嗅觉系统插件)促进小鼠的社会凝聚力通过这些不同的途径,肠道微生物群已经被证明可以调节多种中枢生理过程,如神经炎症、5-羟色胺转换、髓鞘形成和亲社会激素催产素的分泌,从而提供了肠道菌群如何影响社会行为的机制性见解。
暴露于应激源后,促肾上腺皮质激素(ACTH)从垂体前叶(垂体内叶)释放,并刺激应激激素糖皮质激素的释放。
糖皮质激素影响新陈代谢和介导免疫激活等全系统效应。共生细菌暴露于糖皮质激素会降低它们的相对丰度。此外,在慢性应激条件下,糖皮质激素释放增加与肠道微生物多样性和丰富性降低有关。
社会大脑受到多种生物和环境因素的影响
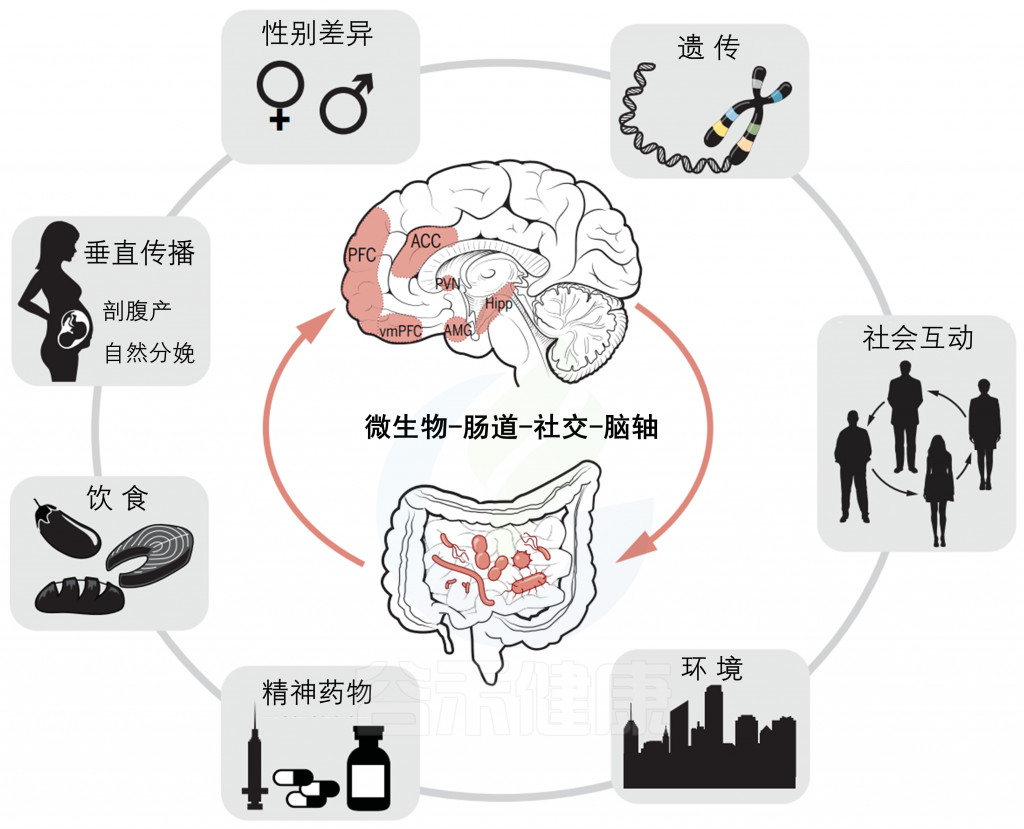

社会行为受多个相互关联的大脑区域(如下丘脑、杏仁核、前扣带皮质和前额叶皮质)支配,这些区域受多种外在和内在因素(如性别、遗传和表观遗传机制以及环境)的影响,这些因素都可能直接影响社会行为,也可以相互结合来塑造这种行为。例如,宿主遗传可以影响宿主胃肠道微生物群的组成,从而影响肠道菌群对社会行为的相对贡献。此外,饮食、精神药物和环境等外在因素也会影响微生物群的组成,从而间接地改变行为。
以微生物群为基础的干预治疗社会行为缺陷的临床和临床前研究自闭症谱系障碍
微生物群与社会失调之间的联系表明,瞄准微生物群可以改善社会行为缺陷。基于微生物群的策略已经证明了在各种临床前模型中改变社会行为的潜力,一些初步证据表明对人类的影响。






ASD,自闭症谱系障碍;ATEC,自闭症治疗评估清单;CFU,菌落形成单位;PBS,磷酸盐缓冲生理盐水;FOS,低聚果糖;GABA,g-氨基丁酸;GOS,低聚半乳糖;poly(I:C),聚肌苷:多胞苷酸;Shank3,SH3和多个ankyrin重复结构域3
展望
了解影响整个动物王国社会行为的发展和规划的因素不仅对重新思考大脑生理和行为的演变很重要,而且还有助于更深入地了解人类社会大脑的紊乱[包括自闭症谱系障碍(ASD)、社会恐惧症和精神分裂症]。
微生物群与这些疾病之间联系的证据正在增加,临床前和新出现的临床数据提出了这样的假设,即通过饮食或活的生物治疗干预以微生物为目标可以改善这类神经发育障碍的相关行为症状。需要进行更大规模的临床试验,以确认这种干预措施的有效性,然后才能被认为是神经发育障碍的一线治疗方法。
虽然目前肠道菌群和神经发育障碍之间的联系是一个有趣的研究领域,但微生物群在动物社会行为进化中的任何作用都不会取代其他因素。相反,它为这些复杂行为的产生增加了一个额外的视角。
参考文献
Sherwin E, Bordenstein S R, Quinn J L, et al. Microbiota and the social brain[J]. Science, 2019, 366(6465).

谷禾健康
菌株的定植一直是一个重要问题,无论是婴幼儿的早期定植还是希望通过菌群干预改变菌群构成或益生菌补充的方式实现益生菌的定植。但是受原有菌群互作和环境影响,如何提高菌株定殖效率和改善定向增殖效果存在很大困难。通过独特的营养代谢特征使用稀有营养系统可实现控制菌种移植,并且不受原菌群结构影响。通过改造菌株,可以精准的通过营养系统来实现有效可控的定制对基于菌群的生物疗法具有重要意义。
来自斯坦福大学医学院微生物学与免疫学系和 Novome Biotechnologies 公司的研究人员在 一项研究中指出,独特的代谢生态位能使菌株植入肠道菌群,相关研究成果发表在Nature期刊。
通过控制海洋多糖、卟啉和一种含有用于卟啉利用的罕见基因簇的外源性拟杆菌菌株来产生独有的代谢生态位。对外源性菌株给予专有的营养,使得外源性菌株在具有不同肠道微生物群落的小鼠中以可预测的丰度有效的植入,这种针对性的饮食支持足以克服同基因菌株的优先排斥,并使菌株替换成为可能。
他们演示了将 60 kb 的卟啉利用位点转移到幼稚的类杆菌菌株中,并通过改变卟啉的剂量,对肠道内的应变丰度进行多个数量级的精细调控。最后证明了这个系统能够将一个新的菌株引入结肠隐窝生态系统。这些数据强调了营养有效性对形成微生物区群成员的影响,扩大了在复杂微生物群背景下进行广泛研究的能力,并对肠道中基于细胞的治疗策略有意义。
Niche ( 生态位 ):是指一个种群在生态系统中,在时间空间上所占据的位置及其与相关种群之间的功能关系与作用。生态位又称生态龛。表示生态系统中每种生物生存所必需的生境最小阈值。
Bacteroides ovatus(卵拟杆菌):能够利用膳食果聚糖和海洋多糖(marine polysaccharide)
GFP ( 绿色萤光蛋白 ):在细胞生物学与分子生物学中,绿色萤光蛋白(GFP)基因常用做报告基因 (reporter gene)。绿色萤光蛋白基因也可以克隆到脊椎动物(例如:兔子)上进行表现,并拿来映证某种假设的实验方法。通过基因工程技术,绿色萤光蛋白 (GFP) 基因能转进不同物种的基因组,在后代中持续表达。现在,绿色萤光蛋白 (GFP) 基因已被导入并表达在许多物种,包括细菌,酵母和其他真菌,鱼(例如斑马鱼),植物,苍蝇,甚至人等哺乳动物的细胞。
Priority Effects ( 优先效应 ):在信息呈现顺序中,首先呈现的信息比后来呈现的信息在印象形成中有更大的权重
高度竞争和动态的肠道微生物群的微生物组成的变化可以影响宿主生物学的许多方面。尽管肠道微生物组成对人类健康很重要,但控制共生菌株入侵现有复杂群落的规则还没有得到很好的解释。常驻菌株往往排除了与其类似的入侵菌株,在某些情况下,被现有菌株占据的生态位可以被类似的入侵菌株利用。无法预测或控制粪便微生物移植的结果表明,需要对影响新菌株是否能够整合到预先存在的复杂微生物群的因素进行基本了解。
饮食是形成社区成员和功能的主要力量。拟杆菌属的成员通过其多糖利用位点 (PULs) 编码的机制,大量利用饮食来源的微生物可获得的碳水化合物 (MACs)。假设特定的 MACs 可以作为一种杠杆,通过它可以调节不同的社区中定植菌株密度。
拟杆菌种具有有趣的定殖行为,其中早期定殖者将排除具有挑战性的同源菌株,这种现象被称为优先效应。假设这种行为可以通过向具有挑战性的菌株提供特殊营养来克服,从而创造一个独一无二的代谢生态位。
罕见拟杆菌属菌株对卟啉的消耗是通过水平转移的 PUL 实现的,PUL 来源于海洋细菌。
废水处理设施的主要废水中分离出来的 NB001(利用卟啉的B.ovatus)和 NB004 (原始的B.stercoris)
所有细菌的生长都是在37°C的厌氧条件下进行的,在富培养基(胰蛋白胨-酵母-葡萄糖12)中进行生长,不添加抗生素。
所有细菌的生长都是在 37°C的厌氧条件下进行的,在富培养基(胰蛋白胨-酵母-葡萄糖12)中进行生长,不添加抗生素。使用过滤器消毒)中生长 24 小时,在1:200的新鲜培养基中继代培养并生长 24 小时,并在 BHI-BA 上连续稀释。将单个菌落挑选到 SMM 中进行生长确认、低温储存和下游分析。
使用 PureLink 基因组 DNA 迷你试剂盒 (Invitgen) 从 NB001 和 NB004 中提取基因组 DNA。基于 Geneious 进行基因注释和比对,NB001 的全基因组测序显示了一个与先前描述的卟啉 PUL 高度同源的基因簇。
使用质粒 pWD034 敲除了预测对海藻 MACs 生长至关重要的8个基因。
基于基因注释和赋予 PUL 能力的移动元件的序列比对,设计了三个不同大小的最小PULs(20kb,40kb和60kb)。获得具有短长度和中等长度 PUL 的 B.thetaiotaomicron
通过敲除卟啉利用基因,验证了完整的 PUL 对卟啉体外特异性生长的要求
无菌小鼠 (Germ-free) 或限制性植物 (RF) 8-16 周的常规雄性或雌性小鼠被安置在隔离器中。选择大小足以产生统计显著性的样本,在断奶时将动物分组。通过口服 108 c.f.u将所有拟杆菌属菌株接种到无菌或RF小鼠中,用健康人类供体的粪便样本将小鼠人性化 (Hum-1、Hum-2)。在 NB001 导入前一周,小鼠被喂养缺乏 MAC 的食物。NB001 导入7天后,小鼠切换到定制饮食,菊粉或海藻作为唯一可用的 MAC。RF小鼠在水中以指定的百分比给予卟啉。
从粪便样品中提取 16S rRNA 分析 DNA,并在 16S v4 区域( 515F,806R )进行扩增。使用Qiime1.9 来分析所得到的 Illumina 产生的测序读数。数据被分类到具有最低读数 ( 16384 )的样品,并且通过 UCLUST 和通过 Greengenes13.8 数据库的分类分配执行OTU注释。
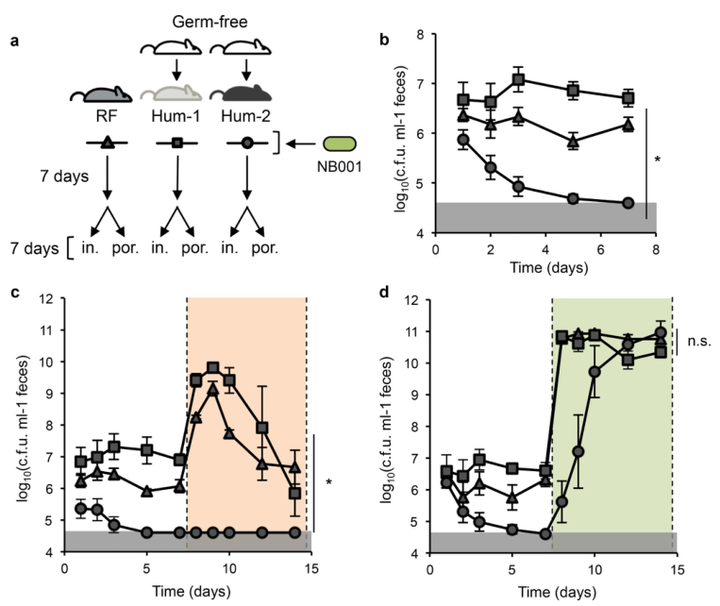
a图实验设计方案将具有三种不同肠道菌群的小鼠(rf)或人类(hum-1,hum-2)定植NB001。NB001在粪便中被追踪7天,小鼠被切换到含有菊粉(in.)或富含卟啉海藻的特殊多糖周。
b图为未添加特殊营养物质时定植菌株(NB001)在粪便中的密度。
c图为添加富含菊粉(in.)营养物质时定植菌株(NB001)在粪便中的密度。
d图为添加富含卟啉(por.)营养物质时定植菌株(NB001)在粪便中的密度。
cd图中通过颜色阴影区分在饮食中添加特殊营养物质之前和之后粪便中NB001的密度。
通过KruskalWallis检验查看组间差异显著结果,“*”表示有显著差异,“n.s.”表示无显著差异。灰色阴影框表示检测的限度。
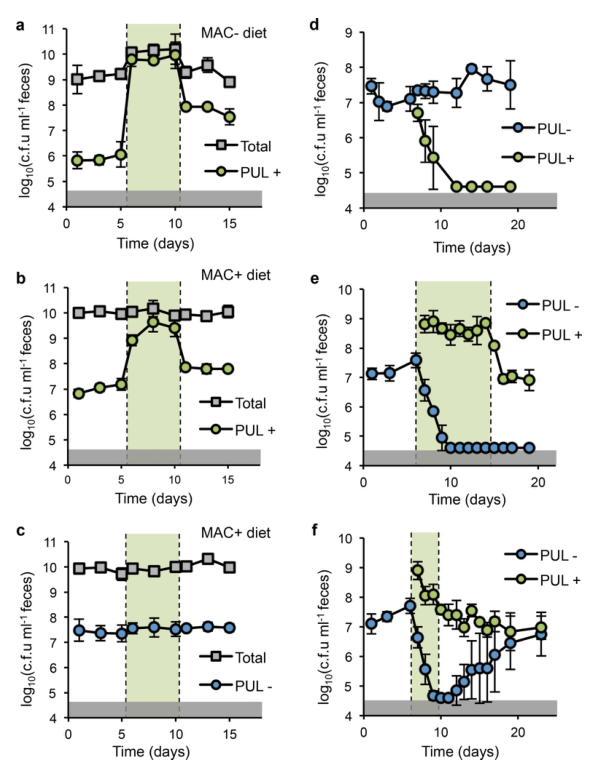
Total(可培养厌氧菌总数)
ab 图,被NB001(PUL+)菌株定植的常规小鼠与缺乏MAC食物喂养或富含MAC食物喂养的常规小鼠,在同样给予卟啉后,菌株丰度发生了变化。绿色阴影为给予卟啉的时间周期。
c 图,被NB001(PUL-)菌株定植的常规小鼠与富含MAC食物喂养的常规小鼠在给予卟啉后,菌株丰度没有变化。
d-f 图,常规小鼠进食富含MAC的饮食后,用PUL定植6天,第6天用PUL+进行挑战。
d 图,在没有给予卟啉的情况下,挑战菌株(PUL+)被现有菌株(PUL-)排除了。
e 图,在给予卟啉的第8天,挑战菌株(PUL+)取代了现有菌株(PUL-)。
f 图,挑战菌株(PUL+)与现有菌株(PUL-)在连续3天的卟啉脉冲后稳定共存。
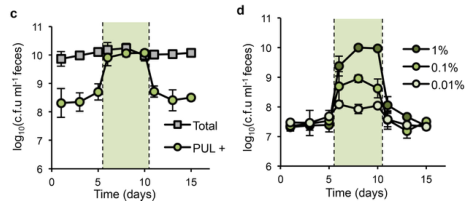
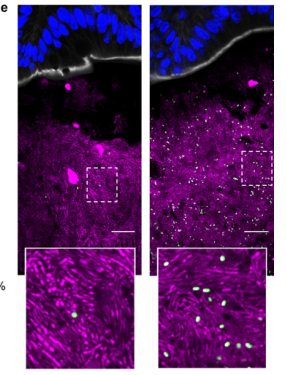
c 图,将含有中等长度 PUL 的 B.thetaiotaomicron 菌株在常规小鼠中定植,喂养富含 MAC的食物和添加了1%卟啉的饮用水,展示了添加卟啉前后的菌株丰度变化
d 图,将含有中等长度 PUL 的 B.thetaiotaomicron 菌株在常规小鼠中定植,喂养富含MAC的食物和添加了1%卟啉、0.1%卟啉或0.01%卟啉的饮用水,表现出对卟啉的精细调节(绿色阴影部分)可以影响菌株的丰度。
e 图,图像为宿主的近端结肠,表达GFP标记的NB001菌株在常规小鼠中定植,给予0.01%的卟啉(左)或1%的卟啉(右)
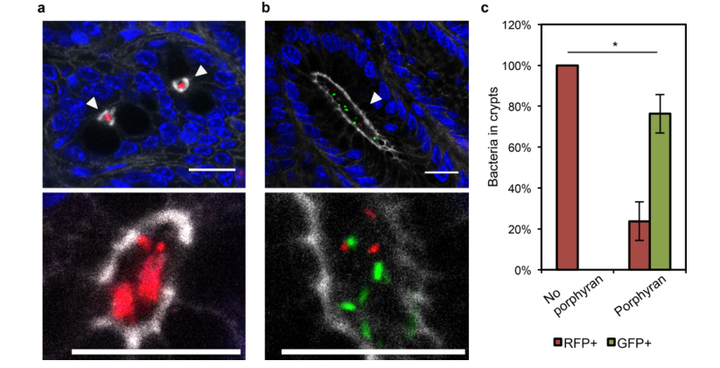
将表达 RFP 标记(红色)的野生型 B.thetotaomicron 引入无菌小鼠体内,7天后再引入表达GFP 标记(绿色)的含有中等长度 PUL 的工程化 B.thetotaomicron 挑战菌株。
a 图 表示在没有给予卟啉的情况下,挑战菌株被从结肠隐窝群体中剔除了。
b 图 表示,当重新给予卟啉时,可以重塑结肠隐窝群体。
c 图 表示在有或没有卟啉的饮食中结肠隐窝中细菌的定量(每组3只小鼠,每只小鼠统计100个隐窝细菌)。双侧t检验,p=0.0395(*)。误差条表示标准差。
利用全基因组测序注释结果改造菌株中的基因,使用小鼠进行动物实验,结合16S rRNA测序监测不同专有营养的给予对定植菌株丰度的影响。对数据使用 KruskalWallis 进行差异检验。研究了一种使用稀有营养系统对控制菌种移植的有效途径,不依赖于背景菌群,并将给予专有营养作为菌种融入肠道群落的关键调控因子。

谷禾健康
随着现代社会飞速发展,尤其是在医药、食品和卫生等方面都在飞跃,那么在这样条件下微生物群落的变化对人类健康带来哪些影响?
近日,来自美国斯坦福大学微生物学与免疫学系及人类微生物研究中心的 Justin L. Sonnenburg 和 Erica D. Sonnenburg 在 science 上面发表文章,就工业化对人体肠道微生物群的影响展开讨论,向我们展示了工业化时代新的生活方式驱动的微生物群变化对人健康的有利影响,同时也指出了某些可能被忽略的影响以及应采取的措施。

首先,我们知道每个人都是一个生态系统,由数以千计的物种和数万亿的成员组成,而这些成员大多数是肠道中的微生物群。微生物群与免疫系统、中枢神经系统和新陈代谢之间存在着密切的联系。
肠道微生物群已经与人类共食了数百万年,经历了数十万代。从非工业化环境迁移到工业化环境,人们的微生物群组成的变化与生活方式改变的时间和严重程度相对应。
我们现在处于工业化世界,人们的微生物群是人类从未经历过的结构。这里我们根据时期划分两种类型:“传统”微生物群,“工业”微生物群。相对于“传统”微生物群,“工业”微生物群似乎具有较低的微生物多样性,种类和功能发生重大变化。
处于工业化时代的人们,从刚出生的时候,微生物群定殖的过程就开始受到许多因素的影响,包括出生方式(自然分娩或剖腹产)、营养(母乳或配方奶粉)、饮食(工业生产食品)、环境(卫生习惯)、感染和抗生素使用等。
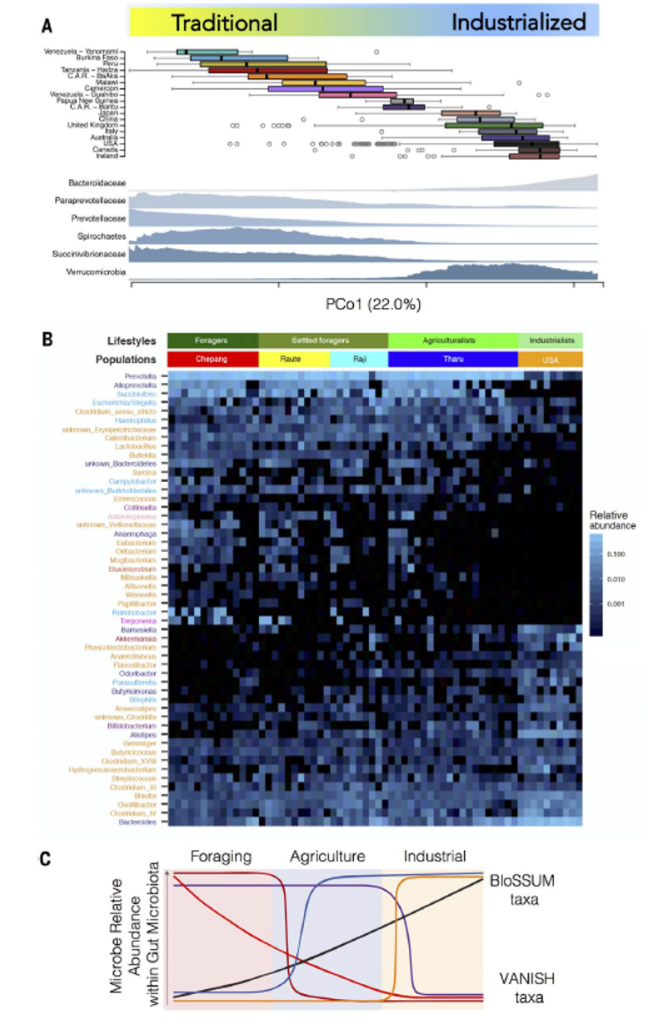

肠道微生物群反映了传统和工业人群的生活方式
图注:(A)通过Bray-Curtis主成分分析分离的多个研究中肠道微生物群的聚集性16S rRNA计数的差异性。A上图:第一个主成分解释了18个人生活方式的22%的变化,从委内瑞拉的未接触美洲印第安人(上)到完全工业化的澳大利亚、美国、加拿大和爱尔兰人(下)。 A下图:菌在科水平的相对丰度揭示了消失类群的整体模式,这与工业化社会是负相关的,比如拟杆菌科和韦荣菌科。
(B)热力图修改自 Jha等,显示种属随着生活方式的变化而变化,包括同一个地址位置(尼泊尔)作为觅食者、定居觅食者或农业学家的个体与美国的工业化个体的比较。
(C)模型修改自Jha等,随着生活方式迁移,菌群损失和/或减少与增益和/或增加的关系。不同的菌群丰度变化模式对应着随着人口从觅食向城市化转移而转变生活方式的特定方面。该模型还可以反映工业化人类从觅食(智人大约20万至30万年前出现)到农业(1万至2万年前开始)再到工业化(100至200年前开始)的历史进程。
我们不能忘记使用抗生素、增加卫生设施和医疗生产来根除病原微生物的企图是如何挽救了无数人的生命的(特别是在紧急医疗保健方面)。技术和医学的进步具有不可否认的好处,如西方饮食和婴儿配方奶粉,增加了便利性,提高了人类的生产力,满足了日益增长的人口的食品需求。但需要注意的是,在我们并未了解微生物群之前,这些技术已经开始广泛运用。
随着工业生活方式在全球的普及,人类微生物群的变化可能是非传染性慢性疾病同时传播的核心,而且很难逆转。在工业化人群中微生物群的变化可能对健康没有影响,也有可能是导致人类免疫系统失调的主要原因,从而导致慢性炎症。非传染性疾病,如中风、心脏病、一些癌症、慢性肾病、糖尿病和痴呆,所有这些都是由慢性炎症引起的,这些疾病可能与世界范围内的工业化生活方式的扩大有关。
一个关键的障碍是确定工业化引起的微生物群变化对人类健康的影响。这种影响的严重程度可能取决于许多因素的具体情况,包括健康状况、饮食、人类基因型和生活方式。可能需要分离和归档对工业化敏感的菌株,以便能够对这些微生物进行更详细的研究。
建议以可持续性和保护为重点来看待微生物生物多样性可能是保障人类健康的一种重要方法。如果我们要与我们的内部微生物世界保持一种可持续的关系,就必须确定一条可持续的医疗实践、饮食和卫生的前进道路,同时铭记微生物群的重要性和脆弱性。

谷禾健康 原创
导语:You are what you eat.
——饮食、肠道菌群与健康
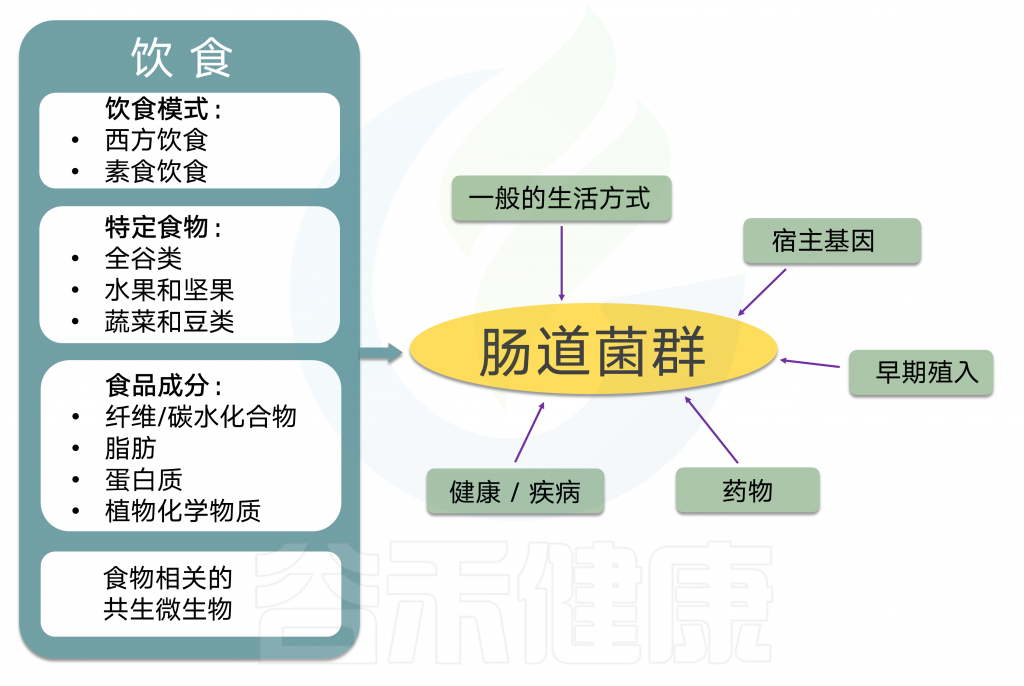
肠道菌群对人体健康的影响和关联性已被广泛研究和认可,肠道菌群作为人体最重要的共生伙伴与我们的健康密切相关。影响肠道菌群的因素众多,饮食、年龄、发育、遗传、疾病、抗生素、用药、甚至激素水平和情绪压力都影响并塑造着每个人独特的肠道菌群,但是短期内,饮食内容以及饮食模式被认为是塑造肠道菌群最重要的驱动因素,长期来看,饮食也是调整和干预肠道菌群调整最有效和健康的选择方式。
肠道菌群是消化的关键组成部分,分解复杂的碳水化合物,蛋白质,并且在较小程度上分解到达下胃肠道的脂肪。该过程产生大量微生物代谢物,其可以局部和全身起作用(在被吸收到血流中之后)。这些途径都可以产生潜在有益和潜在毒性的代谢物。
接下来,我们逐一解析各大营养物质和肠道菌群之间的关系,对人体健康会带来什么样的影响。
小贴士【全文导航】
各类营养成分
饮食模式—菌群
饮食量作为微生物调节剂
进食频率对菌群的影响
时间-饮食-菌群
饮食-菌群-健康互动的复杂性
普通膳食建议
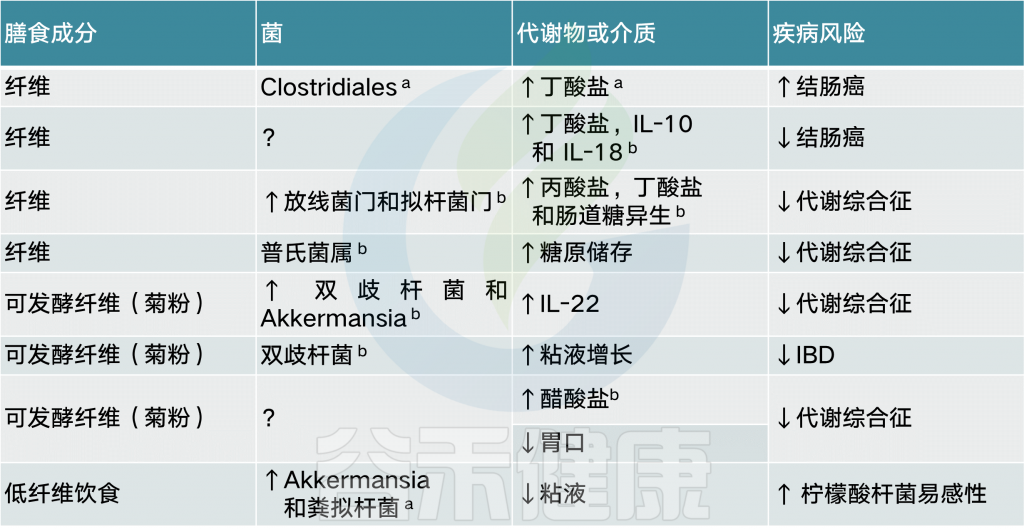
膳食纤维
大部分食物经过小肠时吸收,但仍有一部分不能被消化吸收,主要是植物细胞壁多糖(包括纤维素,木聚糖,果胶)以及一些特定对体内水解酶无反应的多糖成分(如菊粉和寡糖),通常称为膳食纤维。膳食纤维在这里被定义为具有三个或更多个单体单元的碳水化合物聚合物。

膳食纤维对结肠屏障有重要作用,是结肠微生物的主要营养来源,经细菌酵解可以形成短链脂肪酸,对维持结肠系细胞的营养和功能完整时必需的,而且还具有排气,解毒,抗氧化,抗癌作用。
膳食纤维的发酵是盲肠和结肠微生物群的主要功能之一,也是短链脂肪酸的主要来源,短链脂肪酸是发酵的最终产物。
膳食纤维摄入增加时,胃肠运输速度增快,肠腔内细菌数量因营养物质增加而增多,从而使短链脂肪酸的含量明显增加,肠腔内PH值下降,影响肠腔内特定菌群的定植和生长。
膳食纤维主要有以下几类:
菊粉
一些研究表明菊粉通常与其他纤维结合从而对人体肠道微生物群组成产生影响。
菊粉或与减轻腹泻有关
一项研究调查了菊粉和部分水解瓜尔胶(i-phgg)或麦芽糊精混合物对60名便秘妇女肠道微生物群的影响。其中纤维组梭状芽孢杆菌(某些种类与腹泻有关)总数减少。
食用菊粉后双歧杆菌增加
在另一项研究中,从全球洋蓟(cynara scolymus)中提取的长链菊粉被给予健康志愿者。这项研究持续了3周,经过3周的缓冲期后,受试者又服用了3周的麦芽糊精(安慰剂)。总细菌水平不受干预影响。然而,与基线水平和麦芽糖糊精摄入后相比,食用菊粉后双歧杆菌数量显著增加。而且,食用菊粉后乳酸杆菌/肠球菌的数量更高,而食用麦芽糖糊精后则有所下降。另外,阿托波氏菌属的丰度增加,拟杆菌/普氏杆菌组的数量减少。SCFA浓度无差异。
此外,Lecerf等人还研究了菊粉和低聚木糖的影响。.在一项随机交叉研究中,60名健康受试者被给予木糖低聚糖、菊粉和木糖低聚糖以及小麦麦芽糖糊精的混合物4周。与麦芽糖糊精相比,仅木糖低聚糖就能提高双歧杆菌和丁酸盐的粪便浓度。此外,A-葡萄糖苷酶和B-葡萄糖醛酸酶活性较高,而乙酸和R-甲酚的粪便浓度较低。菊粉和低聚木糖的组合增加了粪便中的短链脂肪酸和丙酸盐,同时降低了血液中的脂多糖浓度。
抗性淀粉
淀粉可能逃过小肠的消化,到达结肠发酵。这种抗性淀粉通常被称为物理不可接近淀粉(RS1)、天然颗粒淀粉(RS2)、逆反应淀粉(RS3)或化学改性淀粉(RS4)

抗性淀粉促进布氏瘤胃球菌生长
一项随机交叉研究,包括14名超重男性,研究了在10周内服用RS3的效果。在特定饮食中,个体的细菌分布随时间的推移是恒定的。大多数研究对象在RS饮食中,布氏瘤胃球菌Ruminococcus bromii的丰度增加,该菌比例高达17%,而在含有麦麸的非淀粉多糖(NSP)饮食中为3.8%。未培养的颤杆菌克Oscillibacter和直肠真杆菌的水平也随着含有RS的饮食而增加。
在另一项关于RS的研究中,10名受试者被给予RS2、RS4或天然淀粉作为饼干,持续3周。RS4导致放线菌和类杆菌数量增加,而厚壁菌门数量降低。在种水平上,青春双歧杆菌Bifidobacterium adolescentis和迪氏副拟杆菌Parabacteroides distasonis的比例随RS4的增加而增加,而RS2则较RS4提高了布氏瘤胃球菌Ruminococcus bromii和直肠真杆菌的比例。个体差异较大,变化是可逆的,且与消耗的RS相关。
综上这两项研究的结果表明,食物中RS可能对布氏瘤胃球菌Ruminococcus bromii和直肠真杆菌有促进生长的作用,但这种作用可能取决于所使用的RS的类型。
低聚果糖和低聚半乳糖
无法在小肠中被酶解吸收,到达结肠后可产生SCFA,降低肠道pH值,具有促进双歧杆菌、乳杆菌等有益菌增殖,抑制肠杆菌、沙门菌等有害菌肠道内定植和繁殖的生理功能。
在一项前瞻性、双盲、随机、交叉试验中,健康志愿者每2周食用液体配方食品。一种配方食品含有由低聚果糖和豌豆纤维组成的膳食纤维,而另一种配方食品不含添加纤维。
在研究开始和两个干预期(6周)之间,志愿者们消耗他们的习惯性饮食。除双歧杆菌比例随纤维补充饮食增加而增加外,两个饮食期后所有靶向细菌种类均减少。
无论饮食的纤维含量如何,普氏栖粪杆菌Faecalibacterium prausnitzii和Roseburia intestinalis水平均降低,而拟杆菌的减少只发生在无纤维饮食。
无纤维饮食后,粪便短链脂肪酸(乙酸、丙酸和丁酸)浓度降低,而补充纤维饮食后,丁酸盐浓度也降低。
在一项双盲安慰剂对照交叉研究中,超重的成年人被喂食半乳糖(GOS)或麦芽糊精(安慰剂)混合物12周。在6周和12周后,含GOS的饮食增加了粪便中双歧杆菌的数量,而与安慰剂组相比,拟杆菌属(Bacteroides sp .)和梭菌(Clostridium histolitycum group)的数量同时减少。
聚葡萄糖
在持续21天的对照研究中,检测了聚葡萄糖(PDX)摄入对肠道微生物群的影响。每天志愿者食用三个小吃棒,提供PDX,可溶性玉米纤维或无纤维(对照)。与对照条相比,摄入PDX和可溶性玉米纤维导致梭菌科增多,优杆菌科减少。粪杆菌属Faecalibacterium,考拉杆菌属Phascolarctobacterium和戴阿利斯特杆菌属Dialister的水平较高,而对于乳杆菌,仅在可溶性玉米纤维消耗后才观察到这种效应。
普氏栖粪杆菌Faecalibacterium prausnitzii的数量也增多了。这种菌是丁酸盐生产者,以其抗炎特性而闻名。
处理前后,厚壁菌是最丰富的细菌群(93%),而纤维素消耗后,放线菌的丰度减少。
另一项对照研究,包括接受PDX治疗3周的健康人类受试者,结果显示,已知生产丁酸盐的菌Ruminococcus intestinalis的数量和Clostridium I,II和IV菌数量增加,而与接受麦芽糖糊精的安慰剂组相比,乳杆菌/肠球菌比例降低。肠道菌群变化持续了10周。
阿拉伯木聚糖

在一项前瞻性、双盲、随机、交叉试验中,健康志愿者每2周食用液体配方食品。一种配方食品含有由低聚果糖和豌豆纤维组成的膳食纤维,而另一种配方食品不含添加纤维。
在研究开始和两个干预期(6周)之间,志愿者们消耗他们的习惯性饮食。除双歧杆菌比例随纤维补充饮食增加而增加外,两个饮食期后所有靶向细菌种类均减少。
无论饮食的纤维含量如何,普氏栖粪杆菌Faecalibacterium prausnitzii和Roseburia intestinalis水平均降低,而拟杆菌的减少只发生在无纤维饮食。
无纤维饮食后,粪便短链脂肪酸(乙酸、丙酸和丁酸)浓度降低,而补充纤维饮食后,丁酸盐浓度也降低。
在一项双盲安慰剂对照交叉研究中,超重的成年人被喂食半乳糖(GOS)或麦芽糊精(安慰剂)混合物12周。在6周和12周后,含GOS的饮食增加了粪便中双歧杆菌的数量,而与安慰剂组相比,拟杆菌属(Bacteroides sp .)和梭菌(Clostridium histolitycum group)的数量同时减少。
聚葡萄糖
在持续21天的对照研究中,检测了聚葡萄糖(PDX)摄入对肠道微生物群的影响。每天志愿者食用三个小吃棒,提供PDX,可溶性玉米纤维或无纤维(对照)。与对照条相比,摄入PDX和可溶性玉米纤维导致梭菌科增多,优杆菌科减少。粪杆菌属Faecalibacterium,考拉杆菌属Phascolarctobacterium和戴阿利斯特杆菌属Dialister的水平较高,而对于乳杆菌,仅在可溶性玉米纤维消耗后才观察到这种效应。
普氏栖粪杆菌Faecalibacterium prausnitzii的数量也增多了。这种菌是丁酸盐生产者,以其抗炎特性而闻名。
处理前后,厚壁菌是最丰富的细菌群(93%),而纤维素消耗后,放线菌的丰度减少。
另一项对照研究,包括接受PDX治疗3周的健康人类受试者,结果显示,已知生产丁酸盐的菌Ruminococcus intestinalis的数量和Clostridium I,II和IV菌数量增加,而与接受麦芽糖糊精的安慰剂组相比,乳杆菌/肠球菌比例降低。肠道菌群变化持续了10周。
阿拉伯木聚糖
对健康成年人食用含有阿拉伯低聚糖(AXOS)的面包进行了对照研究。为了干预,将木聚糖内酯酶制剂加入到小麦/黑麦面包的面团中,得到平均聚合度为18。安慰剂面包含有阿拉伯木聚糖,平均聚合度为174。
安慰剂治疗后,拟杆菌/直肠真杆菌和 罗氏-真杆菌(Roseburia – Eubacterium) /普氏栖粪杆菌 比例更高。
食用添加AXOS的面包后,细菌总数和粪便丁酸盐含量增加,而分支链短链脂肪酸的浓度降低,同时,蛋白质发酵减少。
此外,一项随机的安慰剂对照的交叉研究检查了服用AXOS或麦芽糖糊精(安慰剂)的效果。与基线水平相比,摄入AXOS后(但3周后食用安慰剂后)双歧杆菌水平增加。细菌总数,乳酸杆菌,罗氏-直肠真杆菌或肠杆菌没有变化。在AXOS饮食后,尿液中的甲酚(一种细菌代谢物)含量较高。

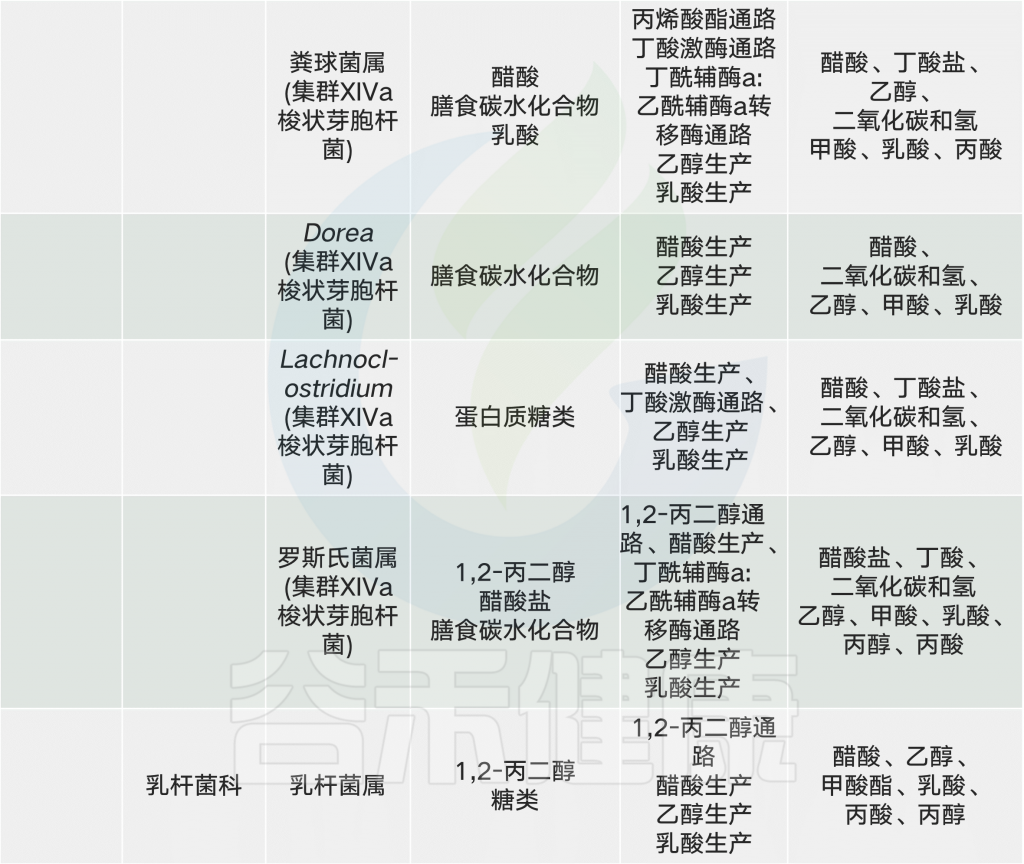
总的来说,具有不同化学成分的膳食纤维似乎能够刺激产丁酸盐菌的生长和活性,例如Roseburia、直肠真杆菌和普氏栖粪杆菌。此外,摄入纤维后,双歧杆菌和乳酸杆菌的数量增加,并经常出现拟杆菌向副拟杆菌的转变。肠道中较高浓度的丁酸盐可能有益于局部和全身健康。
综上,我们已经了解到膳食纤维对身体健康的益处,那么假设不吃膳食纤维,会发生什么后果呢?
一项研究构建了无菌小鼠,研究人员定制了3种食物:含有15%纤维的食物;富含可溶性纤维的食物(类似于膳食补充剂);不含有纤维的食物。他们以不同的食物喂养试验小鼠,并用大肠杆菌感染它们。
不吃膳食纤维,肠道菌群会吃你
结果发现:富含15%纤维的食物喂养的小鼠,它们肠道被感染的程度最轻。因为它们肠道黏液层较厚,可以防御细菌入侵。但是,如果小鼠摄取的是不含有纤维的食物,它们体内的肠道菌群会因为饥饿而“吃”黏液。一旦长期缺乏纤维,肠道菌群甚至于会“吃”肠壁。而且,使用富含可溶性纤维食物(类似膳食补充剂)的小鼠,它们体内的肠道菌群依然会呈现出“饥饿”状态。

碳水化合物
那些富含淀粉的食物,是我们平时摄入碳水化合物的主要来源,比如大米、小麦、玉米等谷物、土豆等薯类。

大肠中的细菌主要依赖于在上消化道中未消化的膳食底物以存活。糖分解细菌发酵通常产生有益的代谢产物,而如果碳水化合物含量有限,细菌转向替代能源,导致其他代谢产物的产生,这可能对人类健康更有害。膳食碳水化合物发酵后的关键细菌发酵产物是短链脂肪酸和气体。
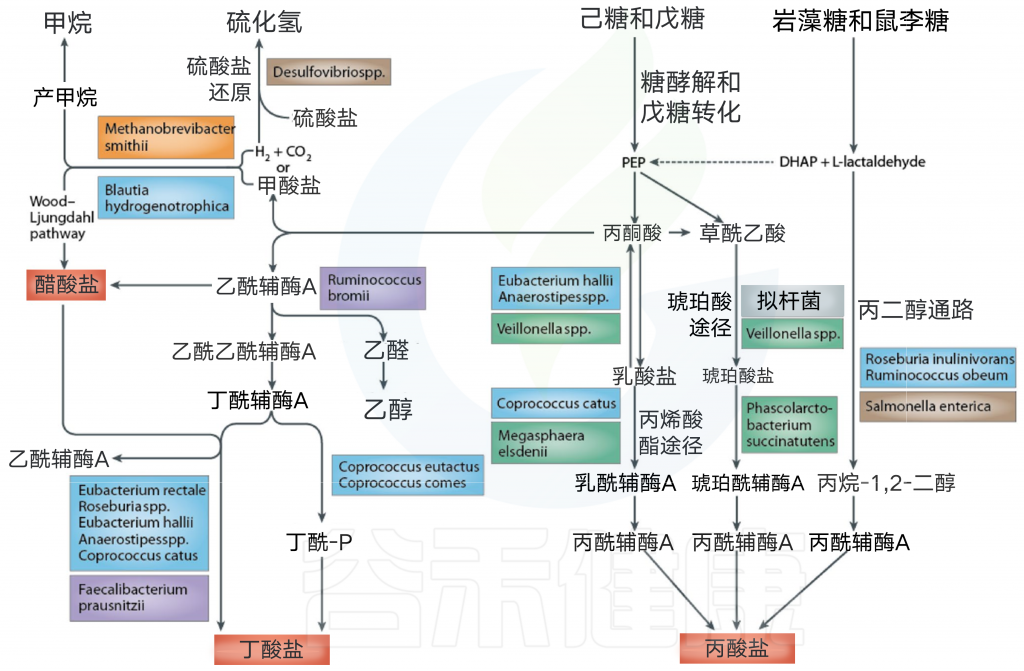
细菌发酵产物之一 短链脂肪酸
粪便中检测到的三种最丰富的SCFA是乙酸盐,丙酸盐和丁酸盐。
丁酸盐潜在的抗癌活性
丁酸盐可以说是最重要的。它能通过抑制组蛋白去乙酰化酶诱导结肠癌细胞凋亡及其调节基因表达的能力,形成人类结肠细胞的关键能量来源,并具有潜在的抗癌活性。还有证据表明丁酸盐可通过cAMP依赖性机制激活肠道糖异生(IGN),对葡萄糖和能量稳态有益。
丙酸盐与减肥有关
丙酸盐也是上皮细胞的能量来源,但也转移到肝脏,在肝脏中它也在糖原异生中起作用。由于与肠道受体(G蛋白偶联受体,GPR)GPR 41和GPR 43(也称为脂肪酸受体FFAR2和FFAR3)相互作用,它也越来越被认为是饱腹感信号中的重要分子。在肠道糖异生中丙酸转化为葡萄糖通过减少肝葡萄糖的产生直接促进能量稳态,从而减少肥胖。
细菌成长离不开乙酸盐
乙酸盐是最丰富的SCFA,是其他细菌生长的必需辅因子/代谢物。例如,在没有乙酸盐的情况下,普氏栖粪杆菌Faecalibacterium prausnitzii不会在纯培养物中生长。
细菌交叉喂养
细菌产生中间发酵产物,包括富马酸盐,琥珀酸盐和乳酸盐,但由于其它细菌广泛利用它们,这些产物通常在健康个体的粪便中被检测到低水平。例如,乳酸通常被其他细菌转化为丙酸盐或丁酸盐,因此在成年粪便中以可忽略的水平存在。
然而,在患有溃疡性结肠炎的患者中,乳酸可以被检测到显着更高的量,并且可能是疾病的指标。共培养交叉饲喂研究说明了细菌相互作用对最终短链脂肪酸检测的影响。由长双歧杆菌在纯培养物中生长的果寡糖(FOS)产生的乳酸盐在与Eubacterium hallii的共培养中完全消失,且单独的E. hallii不能在碳水化合物底物上生长,被显著的丁酸盐水平所取代。
乙酸盐刺激了Roseburia intestinalis的生长,并且与不同的长双歧杆菌菌株共培养,果寡糖上的Roseburia intestinalis生长推迟,直到由长双歧杆菌产生的足够的乙酸盐积累在生长培养基中。
脂肪
脂类在小肠消化吸收的比例较大,粪便中测得的脂肪酸只有7%左右。但有关高脂饮食-肠道菌群相关研究越来越引人注目。

高脂肪含量的食物富含磷脂酰胆碱和胆碱,肠道细菌能将其转化成三甲胺,氧化的三甲胺进入血液可导致动脉粥样硬化,从而引发心血管疾病。
高脂饮食引起的菌群失调可能与其促胆汁酸分泌有关
脂肪量和质量可能影响肠道微生物群组成。胆汁酸是膳食影响菌群构成的重要因素之一,在消化、吸收脂类,以及清除、排泄机体产生的诸多废物等发面发挥重要作用。
来自人类干预研究的初步数据表明,膳食脂肪通过其对胆汁酸分泌以及胆汁酸组成的影响间接调节肠道菌群的组成。
高脂肪摄入会刺激胆汁酸的分泌并增加粪便中二级胆汁酸的浓度,如脱氧胆酸(DCA)。由于它们具有选择性的抗菌活性,胆汁酸如DCA可以介导脂肪诱导的肠道菌群改变。
在最近的一项短期干预研究中,高脂肪,以动物为基础的饮食显着增加粪便DCA浓度并改变微生物群组成,导致耐胆汁酸细菌增加。
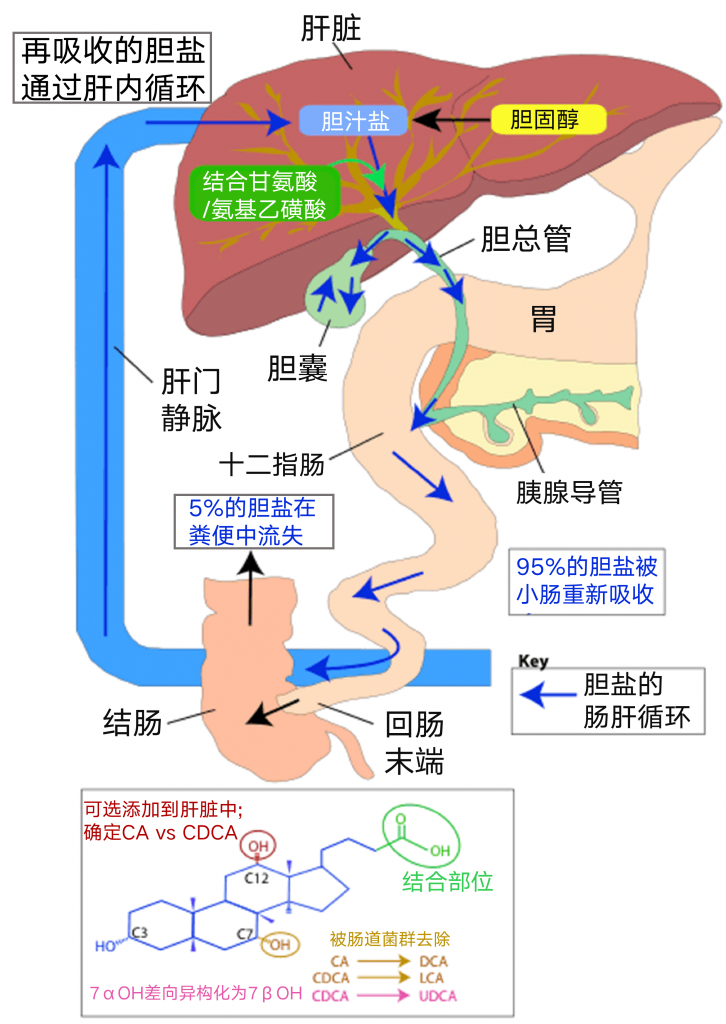
脂肪也有好坏之分
高饱和和反式脂肪饮食被认为会通过提高血液总胆固醇和低密度脂蛋白胆固醇来增加心血管疾病的风险。另一方面,促进健康的脂肪,如单不饱和脂肪和多不饱和脂肪,对减轻慢性疾病的风险至关重要。
为了你的身体正常运转,你需要在饱和和不饱和脂肪之间保持稳定和平衡的供应。
几项人体研究表明,高脂肪饮食会增加厌氧菌总数和拟杆菌计数。让受试者食用不同脂肪含量的饮食。研究者指出,与基线水平相比,低脂肪饮食的摄入导致拟杆菌丰度增加,同时空腹血糖和总胆固醇降低。另一方面,高饱和脂肪饮食增加了普氏栖粪杆菌Faecalibacterium prausnitzii的相对比例。
最后,摄入高单不饱和脂肪的受试者并没有经历任何细菌属相对丰度的变化,但总体上确实降低了总细菌负荷、血浆总胆固醇和低密度脂蛋白胆固醇。
对大鼠的研究表明,摄入高脂肪食物会导致肠道乳酸菌数量显著减少,而产丙酸盐和乙酸盐的菌(包括梭状芽孢杆菌、拟杆菌和肠杆菌)则不成比例地增多。此外,肠道乳酸杆菌的丰度与大鼠脂肪量和体重呈负相关。
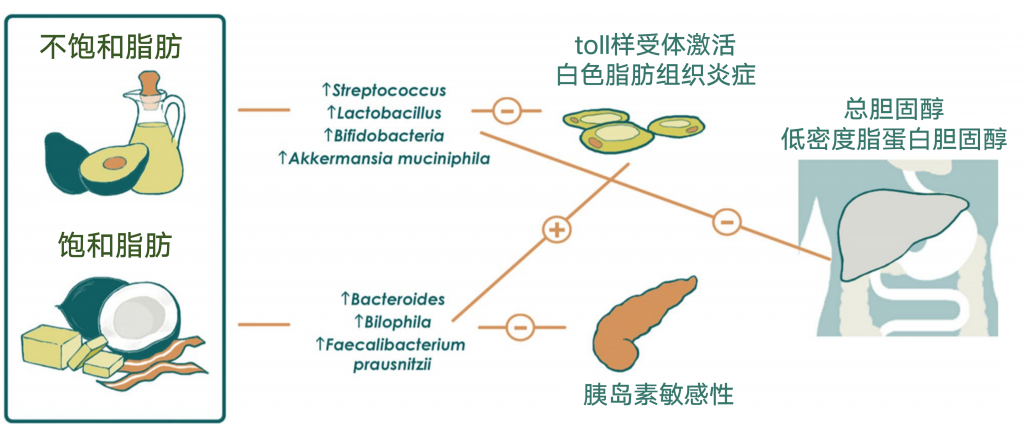
饱和脂肪促进代谢紊乱
猪油源性和鱼油源性脂质的比较显示,猪油喂养小鼠的拟杆菌和嗜胆菌属增多,用鱼油来源喂养的小鼠放线菌(双歧杆菌和Adlercreutzia)、乳酸菌(乳酸杆菌和链球菌)和Akkermansia muciniphila增加。
此外,与食用鱼油的小鼠相比,食用猪油的小鼠的全身TLR活化、白色脂肪组织炎症和胰岛素敏感性受损。作者证明,至少部分原因是由于两组间肠道菌群不同。结果表明,饮食中富含饱和脂肪的小鼠肠道菌群可能通过TLR信号在挑战时促进代谢紊乱。
另外还有第三类脂肪包括氢化脂肪,这是一种人工处理后的脂肪,天然食物中并不存在,比如油炸的快餐食品和人造黄油等,通常是不健康的应该避免食用。
蛋白质
食物中的蛋白质的消化产物主要是氨基酸以及一些小肽,约有95%经过胃和小肠被消化吸收,未吸收的氨基酸以及未消化的蛋白质在大肠下部,经大肠杆菌的作用,即腐败作用,产生一系列产物。

大多数的研究指出,蛋白质消耗与总微生物多样性相关。例如,关于乳清和豌豆蛋白提取物,已报道可提高肠共生双歧杆菌和乳酸杆菌,而乳清另外降低了致病脆弱拟杆菌和产气荚膜梭菌 。豌豆蛋白也被观察到增加肠道短链脂肪酸(SCFA)水平,这被认为是抗炎的并且对维持粘膜屏障很重要。
一项研究给无菌小鼠肠道接种10种细菌,并给予不同组合的单糖(蔗糖)、多糖(玉米淀粉)、脂肪(玉米油)和蛋白质(酪蛋白),结果发现随着酪蛋白浓度增加,细菌总数增加,有7种细菌数量与酪蛋白呈正相关,3种细菌呈负相关。数量与酪蛋白浓度呈正相关的细菌多形拟杆菌、卵形拟杆菌、粪拟杆菌均属于拟杆菌属,占细菌总数绝大部分。
此外,摄入红肉促进的几种微生物也与三甲胺-N-氧化物(TMAO)水平升高有关,三甲胺-N-氧化物是一种致动脉粥样化合物,可增加心血管疾病的风险。
【 注:红肉是营养学上的概念,指的是在烹饪前呈现岀红色的肉,含有很高的饱和脂肪。如猪肉、牛肉、羊肉、鹿肉、兔肉等所有哺乳动物的的肌肉、内脏及其制品都是红肉。
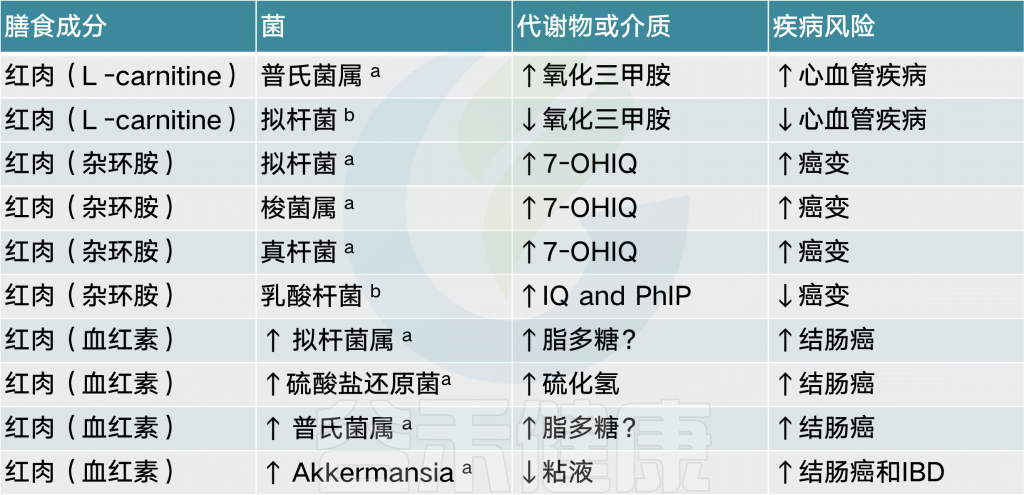
有证据表明,芳香族氨基酸(苯丙氨酸,酪氨酸和色氨酸)可以发酵成苯基丙醇代谢物,苯乙酸和4-羟基苯乙酸,它们在粪便中含量很高。所涉及的包括几种拟杆菌,Eubacterium hallii和Clostridium barlettii.
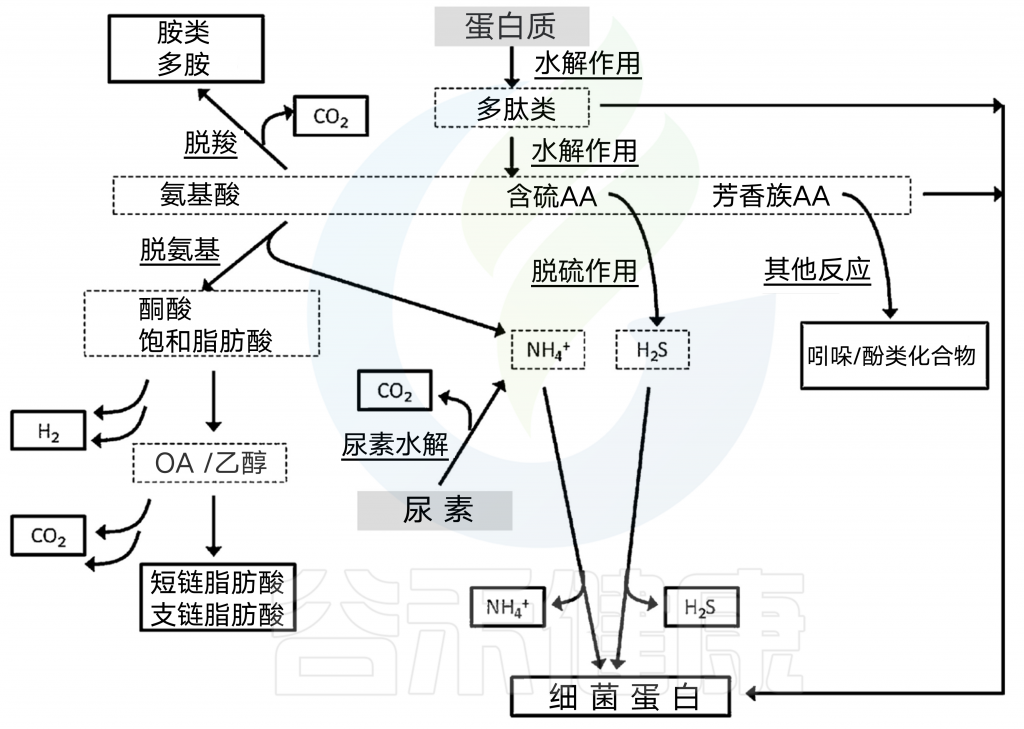
宿主对蛋白质的消化率比碳水化合物和脂肪的消化率变数更大,受先前提到的食品加工因素、大量营养素比率和转运时间的影响,这也导致不同氨基酸组成可以供肠道微生物群利用。
氨基酸发酵所需的额外的相互转化步骤产生了大量的代谢产物。对宿主有毒的化合物可由此过程产生,包括胺、酚/吲哚和含硫化合物。当然并非所有的氨基酸都会发酵成有毒的产品;事实上,最丰富的终产物是SCFAs.
氨基酸分解代谢两个步骤:要么脱氨生成羧酸加氨,要么脱羧生成胺加二氧化碳。脱氨基会产生高浓度的SCFAs.
接下来的步骤取决于氨基酸起始底物的种类,大多数最终会产生三羧酸循环中间体、丙酮酸盐或辅酶A-连接的SCFA前体。
人体肠道微生物群发酵氨基酸的主要产物

植物源生物活性营养素
植物,除了纤维,还为人类饮食提供了许多生物活性化合物。多酚是一大类不同的化合物,多存在于一些常见的植物性食物,如红酒、大豆、番茄、葡萄、绿茶等,其中一些有益于健康。
例如,给高脂饮食喂养的小鼠补充来自葡萄或蔓越莓的多酚,减少了炎症和饮食带来的致肥效果。这与
Akkermansia muciniphila菌的大量增加有关。

但由于对化合物的反应具有相当大的个体间差异,因此很难分析多酚对人类,特别是黄酮类化合物的健康影响,这可能源于肠道菌群的差异。
研究用高脂饮食喂养的小鼠,由于低膳食可用性和类黄酮降解共生物的增加,肠道中的黄酮类芹菜素和柚皮素水平显著减少。将高脂饮食喂养的小鼠转换为正常的多糖饮食使其代谢参数正常化,但不是它们的肠道菌群组成,其持续降解这些类黄酮,导致类黄酮水平低。由于成功节食的小鼠被重新喂养高脂饮食,低黄酮类水平充当“微生物群记忆”,通过影响棕色脂肪组织的热量产生进一步加剧高脂饮食喂养小鼠的代谢作用。用膳食芹菜素和柚皮素补充节食小鼠,可以通过补充其调节能量消耗的能力来防止加剧的体重恢复。

植物来源化合物如何与尿路结石风险增加有关?
通过肠道菌群改变为与健康有益的形式的其他植物化合物的实例包括羟基肉桂酸咖啡酸,香豆酸和阿魏酸,它们作为植物中的酯共轭物存在,并以其自由化学形式被认为是抗炎和抗氧化的。双歧杆菌,乳酸杆菌和埃希氏菌属的成员能够从共轭植物形态中释放出来,从而影响这些生物活性化合物的个体化水平。
与此同时,肠道菌群会降解其他有毒植物来源的化合物,如草酸盐,其中富含几种绿色,坚果,浆果和茶,并形成可能导致肾结石形成的草酸钙晶体。 在分解代谢草酸盐的细菌中,产甲酸草酸杆菌Oxalobacter formigenes是一个关键的参与者,该分类群的低丰度与尿草酸盐浓度升高和人类尿路结石风险增加有关。
各种食物中存在的膳食多酚类型
以及导致降解的微生物的类型

膳食多酚除了具有全身抗菌和代谢功能外,还具有抑制肠道细菌的作用。
维生素
维生素是人体健康必需的小分子物质,近年的研究发现这些小分子物质对肠道菌群的组成有一定的影响。

通过肠道菌群产生甲基萘醌,叶酸,钴胺素和核黄素,以满足其自身的能量和代谢需求。
维生素K在血液凝固,骨代谢以及可能的胰岛素敏感性中起关键作用。广泛的抗生素治疗降低肝脏维生素K2浓度,肠道菌群是维生素K的重要来源。
维生素B9是参与细胞分裂的必需维生素,这种维生素缺乏与癌症,贫血症的高风险相关和胚胎发育过程中的神经管缺陷。
维生素B12是一种代谢辅助因子,其缺陷导致老年人痴呆症和心血管疾病的风险增加。
维生素B2是辅因子黄素腺嘌呤二核苷酸(FAD)和黄素单核苷酸(FMN)的前体。其缺乏与神经肌肉和神经系统疾病,癌症和李斯特菌感染的易感性有关。
一项研究通过问卷形式计算非洲裔美国人和美国白人的饮食组成,结果显示非洲裔美国人杂环胺的摄入较高,维生素的摄入较少,并且与两个种族粪便微生物组成差异相关。维生素D摄入不足或缺乏可引起肠道菌群组成的改变。
另有研究表明,补充维生素D3可改变上消化道(胃体、胃窦和十二指肠)的肠道微生物群。γ-变形杆菌相对丰度降低,包括假单胞菌属和大肠杆菌/志贺氏杆菌属,细菌丰度增加。
食品添加剂
在过去的几十年里,人类饮食的主要变化之一是加工食品的增加,这些食品通常含有合成的或天然的添加剂,如防腐剂、甜味剂、乳化剂和强化剂。这些添加剂通常被食品监管机构认为是安全的,依据是批准时公布的科学证据。
膳食乳化剂导致菌群失调引起炎症

许多食品(如工业生产的番茄酱)中都添加了膳食乳化剂,以保持油和水的乳剂。一项研究表明,低剂量的两种常见乳化剂,羧甲基纤维素和聚山梨酯-80,会使小鼠菌群失调,从而诱发低度炎症、代谢综合征和结肠炎。当对这些化合物的反应在人类肠道菌群培养中进行分析时,检测到了生物活性鞭毛蛋白水平的升高,其原因可能是菌群失调,也可能是细菌基因表达发生了改变。
另一种乳化剂是磷脂酰胆碱(一种卵磷脂)。与l-肉碱和其他胆碱分子一样,卵磷脂被肠道微生物群转化为TMA,从而增加TMAO水平和CVD1的风险
菌群决定无热量的人造甜味剂对人有益or有害

另一种常用的食品添加剂是无热量的人造甜味剂,它被推广为一种常见的减肥策略,通过将含有高热量糖的食物和饮料换成无热量的甜味替代品,来限制饮食中摄入的热量。
在人类的观察研究和啮齿类动物的干预中,对这种方法的疗效的研究显示出混合的和相互矛盾的结果:一些研究显示了无热量的人造甜味剂对减肥有益,而另一些研究报告了无热量的人造甜味剂促进增重和其他相关的代谢紊乱。

无热量的人造甜味剂与葡萄糖不耐受有关
有几项研究报告了啮齿动物在食用糖精、三氯蔗糖阿斯巴甜、甜蜜素、新甜和阿昔单胺钾等无热量的人造甜味剂时,其代谢平衡失调和菌群破坏。对改变的微生物组或其分泌的代谢物的基因含量进行的功能分析表明,人造甜味剂诱导的生态失调通向代谢表型,对于糖精,通过将引用糖精的小鼠菌群移植到GF幼鼠中,表现出同样葡萄糖不耐受。从而将无热量的人造甜味剂和葡萄糖不耐受建立直接联系。
无热量的人造甜味剂与提高能源收获能力有关
有趣的是,在两项针对不同无热量的人造甜味剂(糖精和阿斯巴甜)的啮齿类动物研究中,消耗量与醋酸和丙酸盐水平的增加有关,这表明无热量的人造甜味剂改变的肠道微生物群的能量收获能力增加。
在一项小规模的人体干预试验中,糖精摄入后葡萄糖稳态的破坏在一些参与者中很明显,但不是所有的参与者中都存在,这与他们接触糖精前和糖精诱导的菌群组成的改变有关(每天补充120mg糖精,6天,7人)
以上结果表明,无热量的人造甜味剂摄入对健康影响的相反结果源于参与者自身菌群的差异(通过鉴定菌群的敏感性特征)。由此,对于用无热量的人造甜味剂替代高热量甜味剂,我们可以区分哪些人可以从中获益,哪些人应该避免。
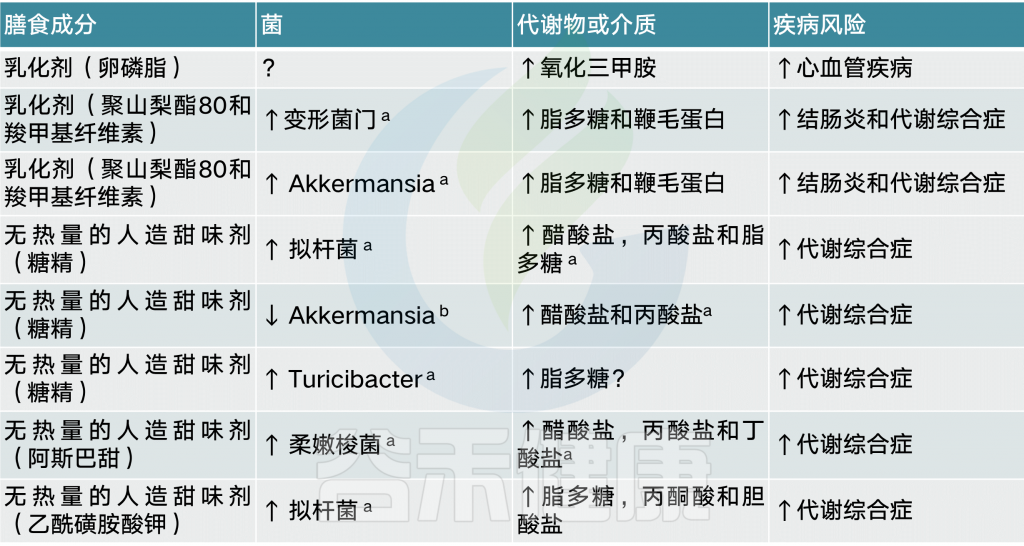
矿物质
大量补铁或有菌群失调风险
众所周知,补充铁是预防和治疗贫血的常用方法,尤其是婴儿。然而,细菌尤其是一些病原体是高效的铁清除剂。因此,补充铁可能导致菌群失调和病原体大量繁殖
类似的,在饮食中补充锰会增加心脏的细菌定植,增加小鼠金黄色葡萄球菌感染的致死率,这可能是由于细菌利用锰来保护机体免受活性氧和中性粒细胞的杀灭。
以上所有都是讨论食物中的某种营养成分,但我们日常生活中,每天吃很多种类的食物,多种食物的组合互相协同,我们可以探讨下不同的饮食模式和肠道菌群之间的关系,以及对健康的影响。
饮食模式-菌群
地中海饮食法
地中海饮食主要是植物性饮食。地中海饮食强调食用蔬菜、水果、蔬菜、坚果和橄榄油等“健康”脂肪。还有一个重点是利用香料和其他调味品来代替盐的使用。饮食的另一个重要组成部分是限制加工食品中的碳水化合物。
在一项小型研究中,与同样饮食的男性相比,女性在地中海饮食后的食欲和饥饿感下降幅度更大,这可能是由于该饮食中纤维含量增加所致。如果遵循正确的饮食习惯,这种饮食中的纤维含量高,动物源的脂肪含量低,加工食品中的碳水化合物含量低,盐含量低。
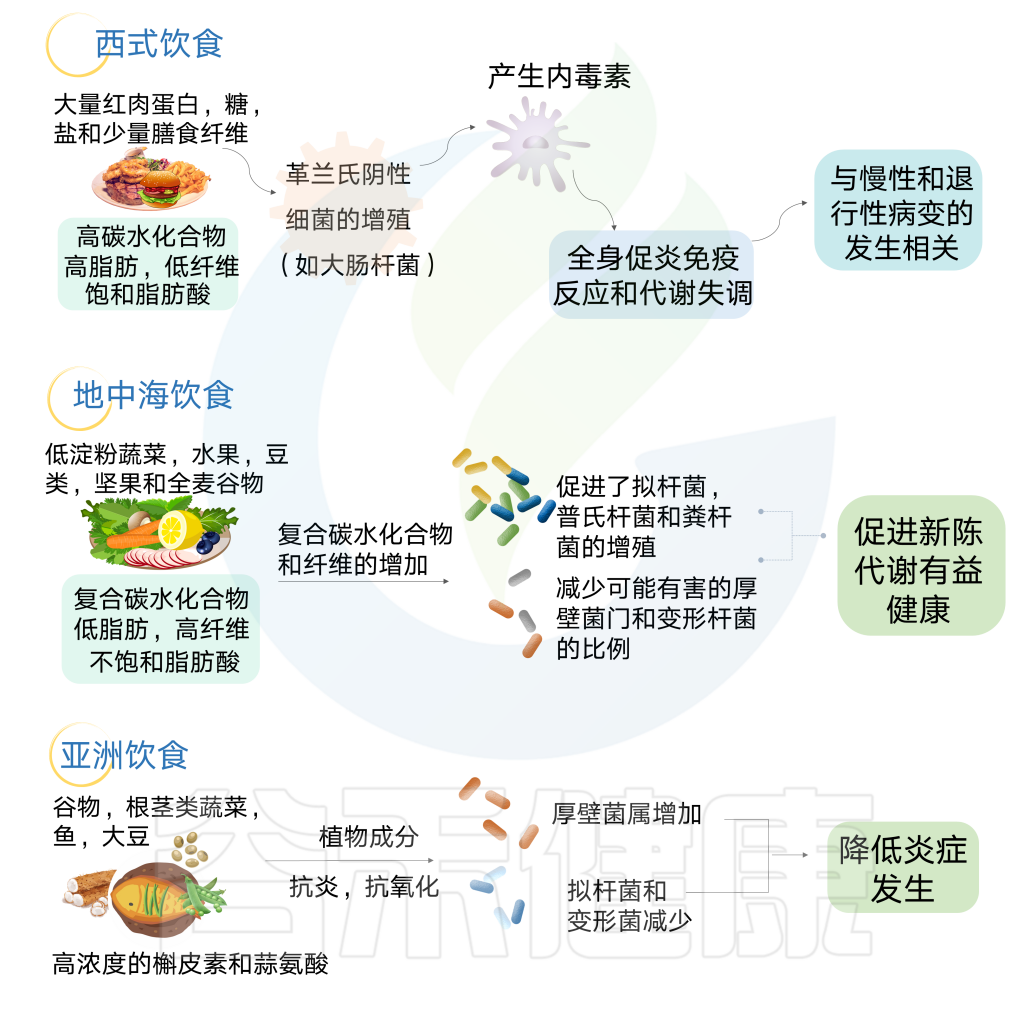
不同饮食特点的肠道菌群特征
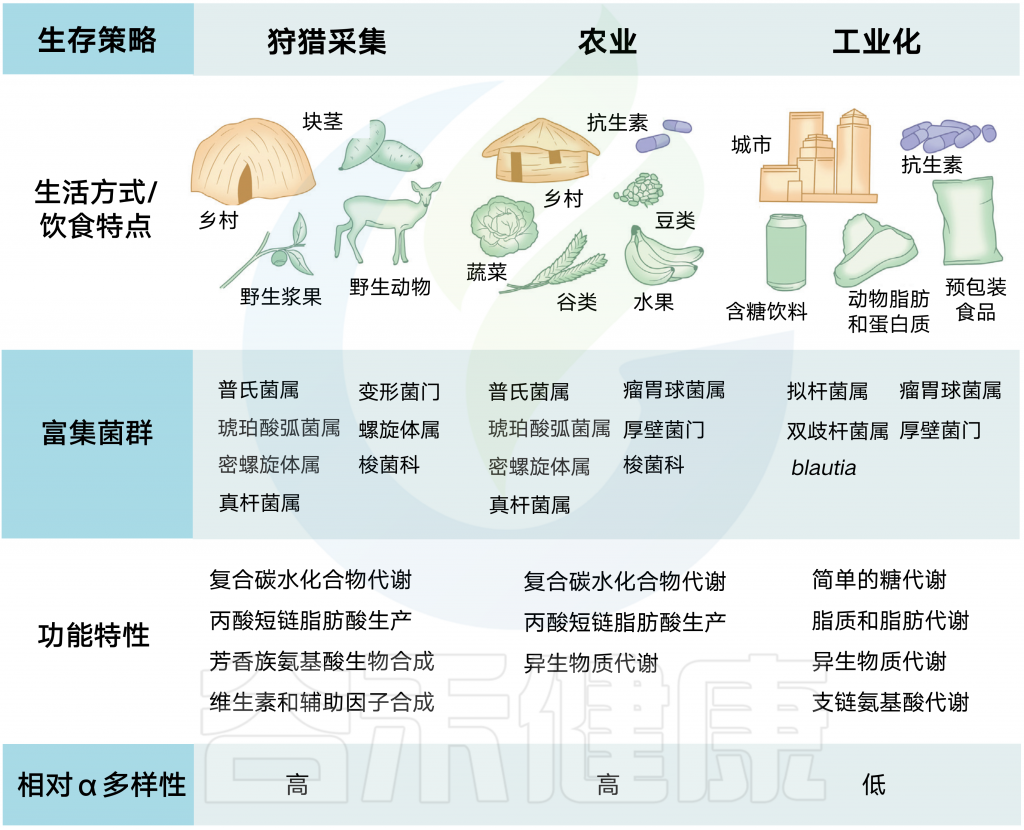
狩猎-采集人群依赖于觅食,很少接触治疗剂,在普氏菌和其他纤维降解菌群中高度富集。相反,西方化社会中发现的饮食特征和卫生基础设施与拟杆菌的优势相关,同时伴随着微生物多样性的减少。
动物饮食 vs 植物饮食
基于动物的饮食对肠道微生物群的影响比基于植物的饮食更大。
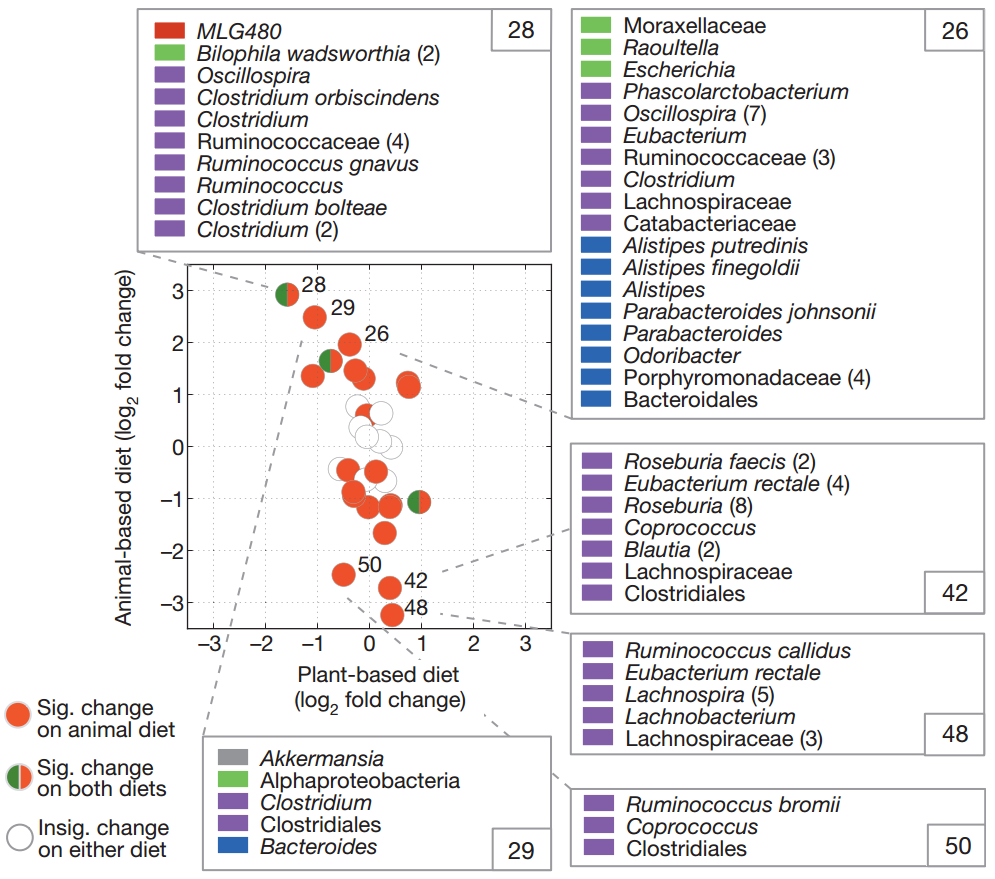
菌群对饮食的反应相对于所有受试者的基线样品计算每个饮食组上的簇log2倍数变化,并绘制为圆圈。
基于动物的饮食中具有显着倍数变化的群集以红色着色,并且基于植物和动物的饮食具有显着倍数变化的群集以红色和绿色着色。
未着色的簇在基于动物或植物的饮食中没有表现出显着的倍数变化(q <0.05,双侧Wilcoxon符号秩检验)。
在动物饮食中具有三个最大的正和负折叠变化的群集中的菌群成员也被显示并通过门着色:厚壁菌门(紫色),拟杆菌(蓝色),变形菌门(绿色),Tenericutes(红色)和Verrucomicrobia(灰色)。括号中会计入多个具有相同名称的OTU。
动物饮食增加了耐胆汁微生物(腐烂别样杆菌、嗜胆菌属和拟杆菌)的数量,并降低代谢膳食植物多糖的厚壁菌门的水平(罗氏菌属Roseburia、直肠真杆菌和布氏瘤胃球菌)。
该研究还显示:相对于植物性饮食和基线样本,动物性饮食显著降低了碳水化合物发酵产物的水平,提高了氨基酸发酵产物的浓度。
饮食量作为微生物调节剂
摄取的食物量会影响肠道微生物群。
在人类中,短期碳水化合物限制(每天24-164克,持续4周)导致产生丁酸盐的细菌减少,因此产生丁酸盐70,以及限制卡路里的方案(10%的能量摄入减少10%周)导致微生物组组成的改变,包括Blautia coccoides的减少和拟杆菌属的增加。
进食频率对菌群的影响
尽管对进食频率和健康状况进行了大量研究,但最近才开始研究进食频率对胃肠道微生物组的影响。
马的盲肠微生物群受饲养频率的影响,饲养频率越高,YRC22属相对丰度越高,普氏菌属、乳酸杆菌属、链球菌属、粪球菌属、和考拉杆菌属(Phascolarctobacterium)相对丰度越低。
为了确定饮食模式的改变是否影响与人类葡萄糖反应、脂质代谢和肥胖相关的类群,还需要进行更多的研究。
与进食频率无关,某些菌群与改善的葡萄糖稳态,脂质和肥胖有关。例如,粘蛋白降解肠细菌A. muciniphila与改善的葡萄糖稳态有关,与动物模型中的炎症反向相关。
在人类中,Akkermansia的增加与空腹血糖、腰臀比和皮下脂肪细胞直径呈负相关。
除以上膳食成分、饮食模式、饮食量、进食频率等对菌群产生影响外,还有昼夜节律变化也会影响菌群波动。
时间-饮食-菌群
饮食对微生物组分和功能的时间效应可以在多个时间尺度上发生,范围从饮食诱导每日微生物组波动到注意到长期变化后数天内观察到的营养相关效应。
在最高分辨率下,宿主每天昼夜节律的睡眠-清醒和进食-禁食周期伴随着显著的组成和功能性肠道微生物群变化,在三个主要门,拟杆菌门,厚壁菌门和变形杆菌门的成员中,以及粪便和循环中的细菌代谢产物的水平上,都能观察到绝对丰度振荡。
一生中饮食都会影响肠道细菌的结构和功能
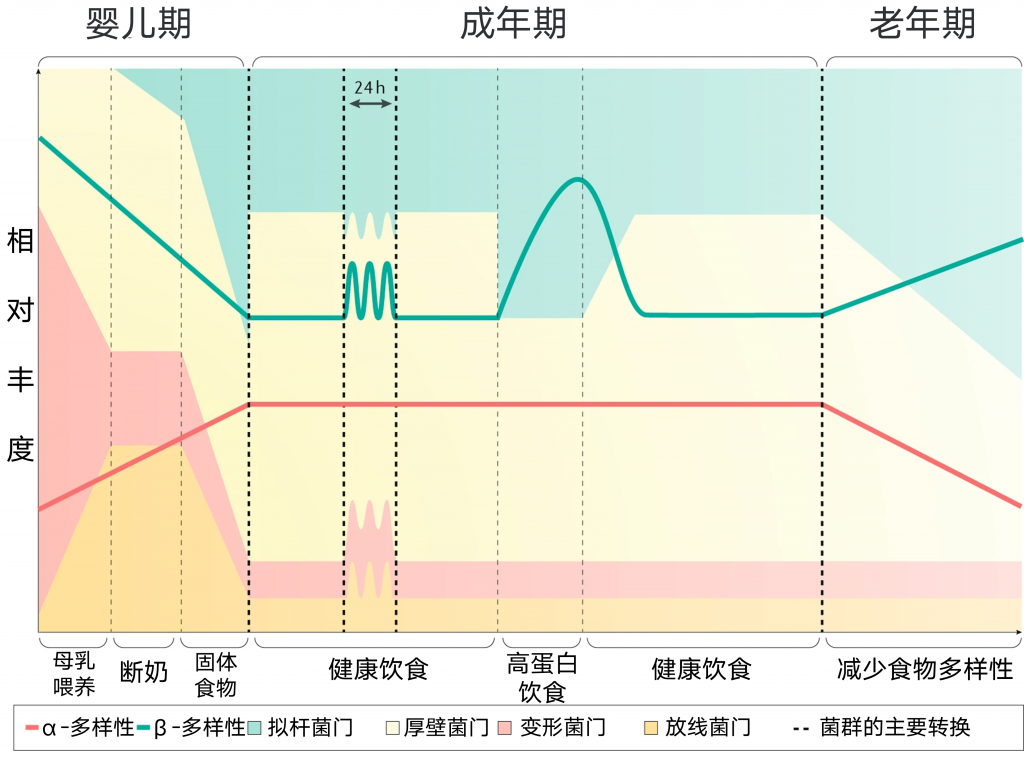
失调的昼夜节律和饮食对微生物群的影响
连续肠外营养的小鼠已被证明微生物群落结构发生了实质性变化,但微生物群并未完全丧失昼夜变化。但高脂肪饮食和昼夜节律紊乱的结合可能是导致小鼠微生物失调的原因。
有证据表明细菌含有时钟基因,并以昼夜节律的方式调节宿主的行为。例如,产气肠杆菌据称含有内源性生物钟基因,其通过分泌到胃肠道中的褪黑激素与人宿主同步。
在小鼠中,高脂肪饮食干预后出现的肝昼夜节律钟的重新编程被归因于微生物驱动的感应和转录因子PPARC的激活。
肝脏和肠道昼夜节律基因都受到未结合的胆汁酸(已知的微生物代谢产物)的影响。在无菌和抗生素诱导的小鼠模型中,微生物群的缺失已被证明会改变肠上皮细胞核受体的转录以及诸如Rev-erba、RORa、Bmal1、Cry1、Per1和Per2等时钟元件。
已发现在没有微生物的动物中,回肠和结肠上皮细胞内昼夜节律性被完全打乱了。研究人员推测,微生物相关的分子模式是以连续的方式从微生物群中释放出来的,相反,也有研究表明细菌组成的昼夜变化导致细菌代谢物浓度的相应变化,例如在禁食期间达到峰值的丁酸盐,以及在摄食期间达到峰值的硫化氢。已显示粪便丁酸盐在标准但不是高脂肪饮食的小鼠中循环,而硫化氢在高脂肪但非正常饮食的小鼠的盲肠中表现出周期性行为。先前已经在体外证明这些代谢物可以直接影响肝脏时钟基因Per2和Bmal1的循环。
总之,在昼夜节律破坏后观察到的负面后果可能与由肠屏障功能的改变,促炎细菌的丰度增加和昼夜节律紊乱相关疾病的病因引起的炎症过程有关。
饮食-菌群-健康互动的复杂性
大量营养素、微量营养素和食品添加剂与微生物群相互作用,改变特定属的丰度或微生物代谢产物环境,从而对宿主健康产生相当大的影响。在这个复杂的网络中,大多数食物成分和微生物是多面的,对宿主既有利又有害。
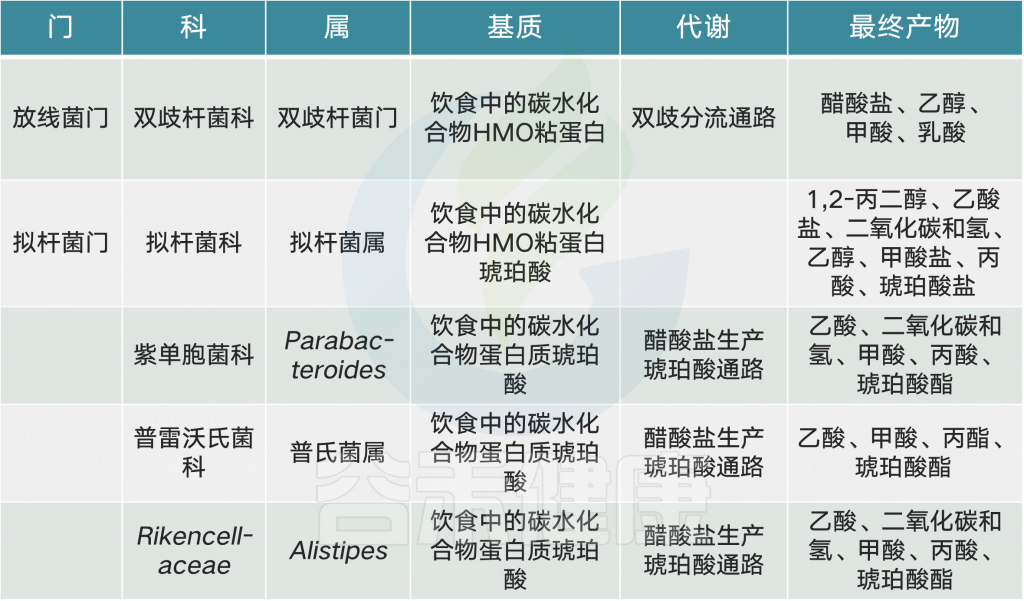
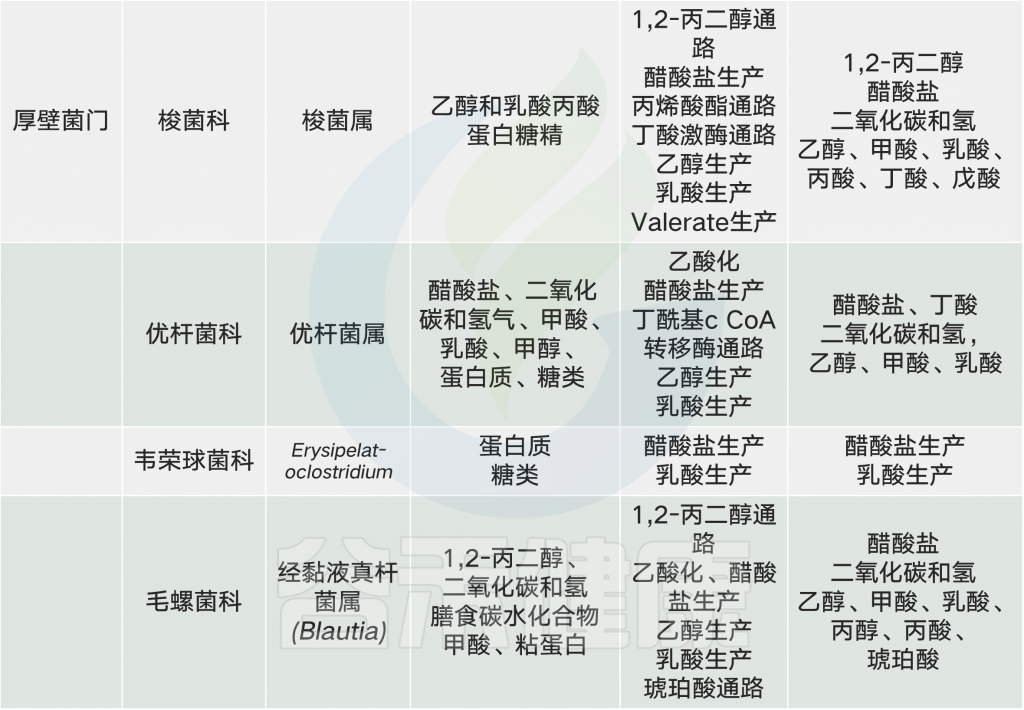

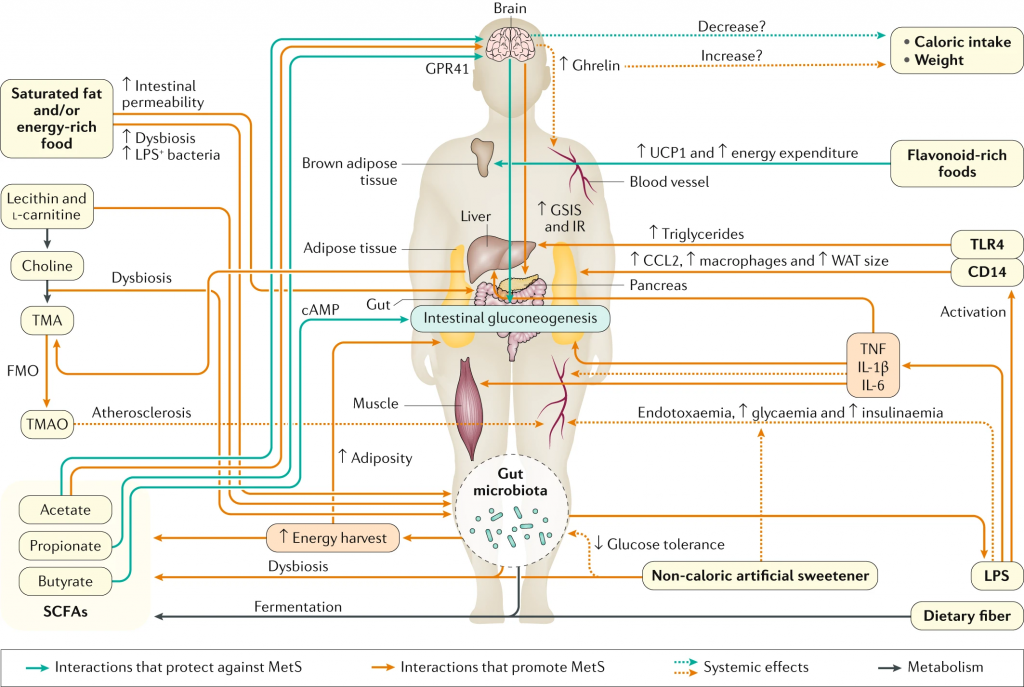
常见的膳食成分通过肠道微生物群代谢并产生调节宿主代谢(例如在动脉粥样硬化中)的代谢物【例如,膳食胆碱和三甲胺(TMA)】。同时,饮食改变了菌群组成并因此改变了微生物代谢产物,其中一些对宿主会产生有益或有害的影响【例如,脂肪,脂多糖(脂多糖)和内毒素血症)】。一些相互作用局限于肠道【例如,纤维,短链脂肪酸(SCFAs)和肠道糖异生】,而其他作用则有系统性效果【例如,脂肪,乙酸盐和抗胰岛素性(IR)】。
饮食模式可以通过营养物质对多种变量的影响影响影响代谢变化和炎症的发展,包括微生物组分、微生物产物的释放、胃肠道信号分子、以及神经递质。
由于细菌专门用于不同底物的发酵,复合饮食可以为特定的种系提供一系列促生长和生长抑制因子。
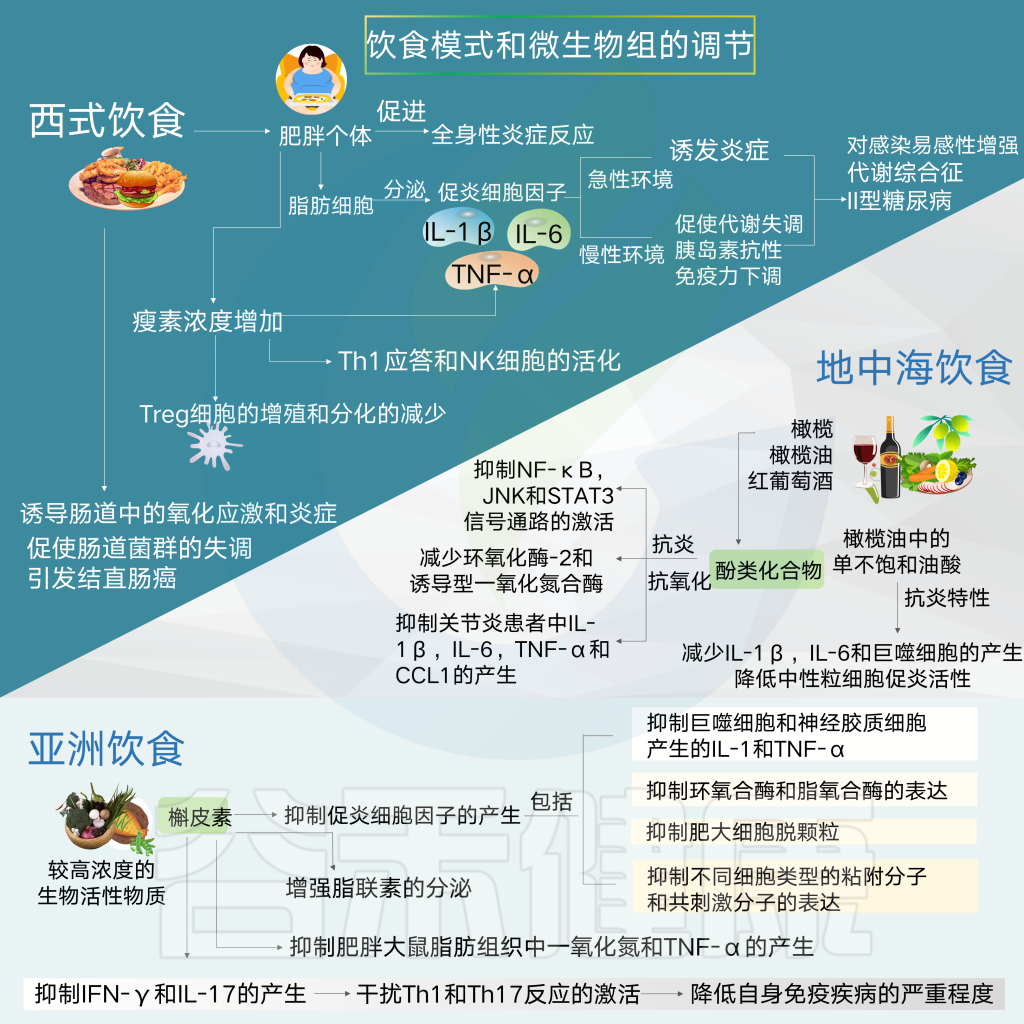
这些信号分子依次与免疫系统的调节有关,促进或抑制促炎细胞因子的产生和特异性白细胞亚群的扩大,如Th17和Treg细胞,它们与神经系统发育有关。
膳食代谢产物可通过不同的信号通路引起免疫应答
膳食代谢物来源于各种食物的消化
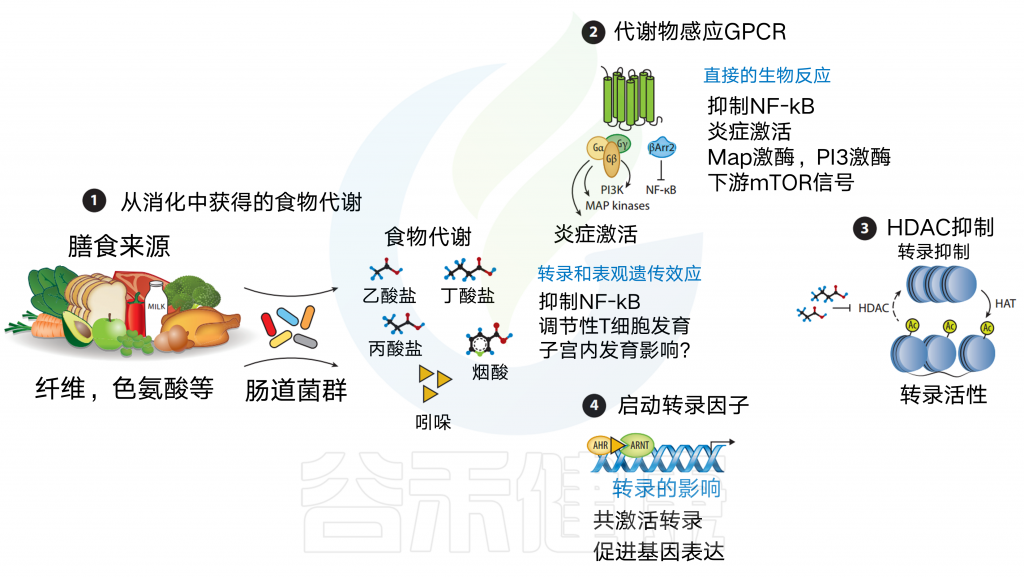
食物,如纤维、鱼和肉被消化,直接(例如,ω-3脂肪酸、烟酸)或间接产生代谢物【例如,短链脂肪酸(scfas)或吲哚-3-醛,分别通过细菌消化膳食纤维或色氨酸获得】
膳食代谢产物可以通过代谢传感GPCRs发出信号
这可以通过激活MAP激酶等途径的传统G蛋白信号传导,或通过β-抑制蛋白2来实现,一种与抗炎作用更密切相关的替代途径,包括抑制NF-κB功能或抑制炎症细胞因子的产生。
此外,在GPCR激活后,NLRP3炎症体激活响应Ca2+通量或K+射流。
某些代谢物作为组蛋白脱乙酰酶(HDAC)抑制剂
例如短链脂肪酸,尤其是丁酸盐和丙酸盐。
SCFAs抑制HDAC可使组蛋白内赖氨酸残基乙酰化,从而通过染色质松弛促进基因转录。
最后,膳食代谢物可以作为转录共激活因子
例如,吲哚-3-醛与芳烃受体(AHR)结合,允许其与AHR核转位蛋白(ARNT)相互作用以促进基因转录,包括肠内稳态细胞因子IL-22.
膳食代谢物信号的作用以及对免疫、代谢和神经系统的影响
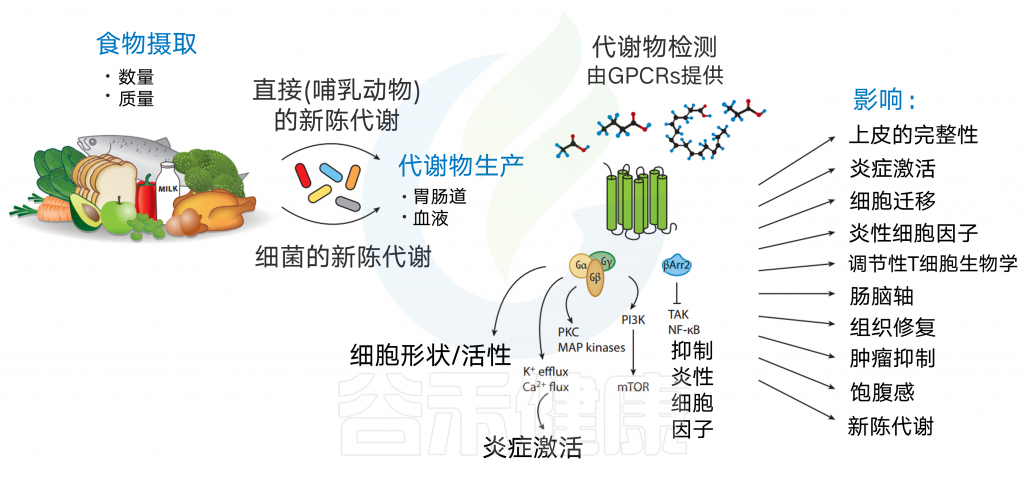
各种膳食代谢物的可用性取决于食物摄入量(数量和质量)以及宿主或肠道微生物群的新陈代谢。代谢产物分布到胃肠道,并以高浓度输送到门静脉。
这些代谢物可以引发广泛的生物学功能,主要是通过结合到它们的同源GPCRs。GPCR激活可诱导细胞形态和运动的改变,诱导Ca2+或K+流出,或诱导下游pi3k/map激酶途径。GPCRs也可以通过β-抑制蛋白来传递信号,β-抑制蛋白可以抑制NF-κB的激活和促炎细胞因子的产生。
随后,其同源GPCRs的饮食代谢物激活可影响细胞迁移、炎症体激活、上皮完整性、炎性细胞因子产生、Treg细胞生物学、肠-脑轴、组织修复、肿瘤抑制、饱腹感和代谢。
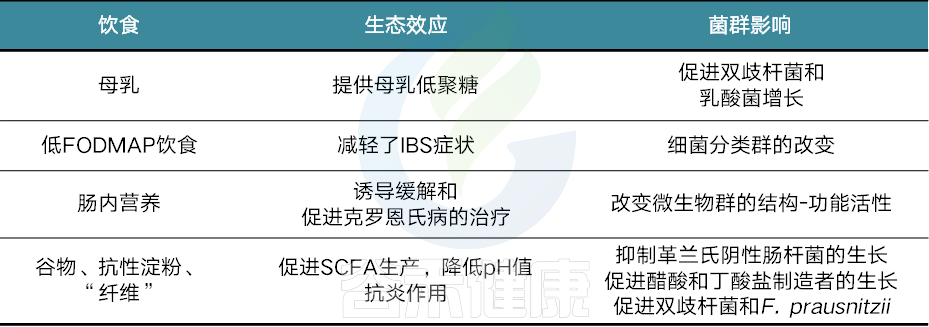
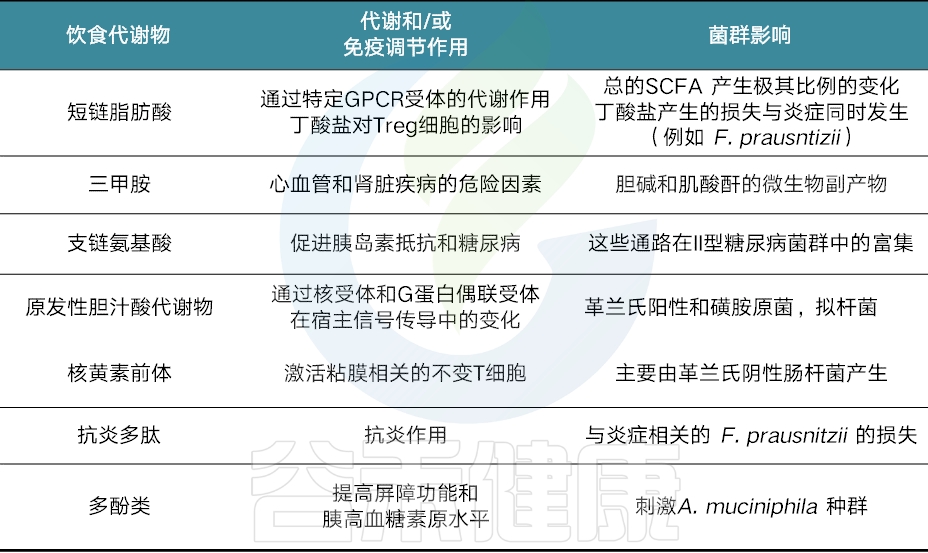
饮食和菌群相互作用影响胃肠功能和健康(从生态学、代谢学和免疫调节的角度)
以上我们知道了饮食对塑造肠道菌群及健康的重要性
然而或许我们还有疑问:
肠道菌群对摄取食物的响应周期是多长时间?
肠道菌群的动态波动和稳定主要受什么因素影响?
下面看一篇权威的论文
该文章将每日宏基因组数据与日常饮食相结合,构建了响应饮食的肠道菌群变化模型来进行研究。
实验设计
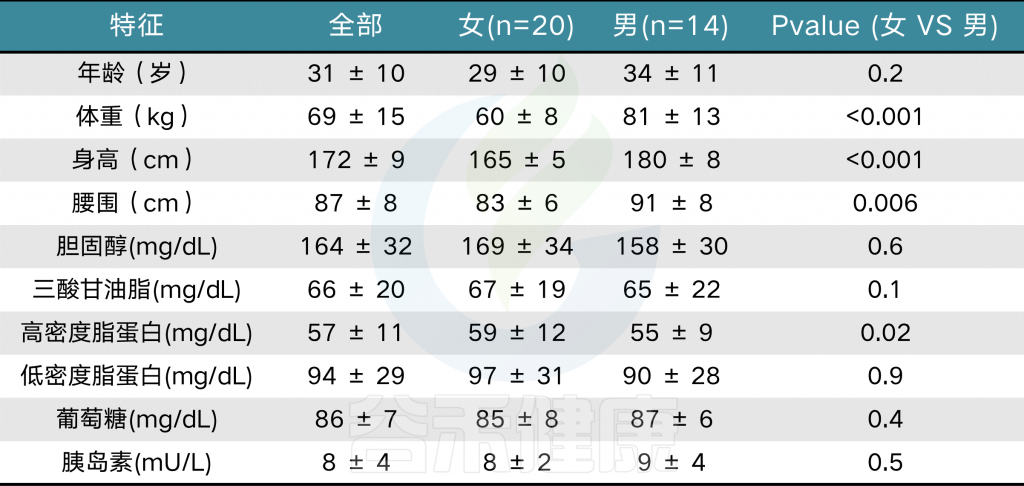
某研究连续17天收集来自34名受试者的膳食摄入数据和粪便样本。使用自动化自我管理的24小时(ASA24)饮食评估工具收集每日食物记录
表1 按性别分类的主体特征
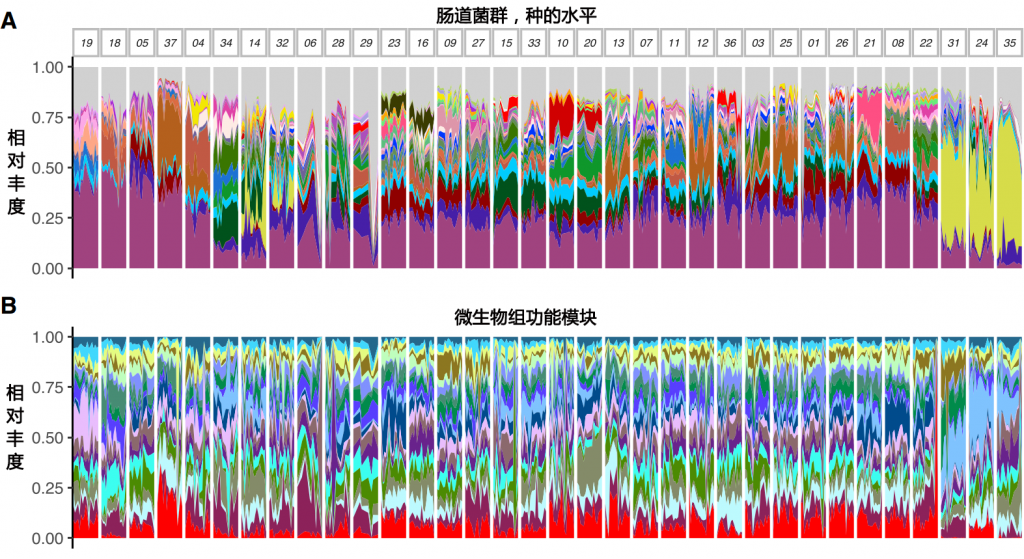

结果发现
同时我们也可以看出,以调节肠道菌群为目的的干预方案需要针对个体进行定制。
对上述所有饮食的比较揭示了一个中心主题:蔬菜、水果、瘦肉的消费量增加,加工食品的消费量减少,可带来积极的健康效益。大多数人选择食物的因素往往集中在食物的数量和容易获得和准备,而不是食物的内容和质量。由于优先考虑这些因素,食物首要为我们身体提供能源和保障健康越来越被我们忽视,取而代之的是快餐,高热量、低营养质量食品的大量进入我们生活,这直接导致了当下的许多慢病包括肥胖的流行。
普遍饮食建议
主要参考文献
Kaczmarek J L, Thompson S V, Holscher H D. Complex interactions of circadian rhythms, eating behaviors, and the gastrointestinal microbiota and their potential impact on health[J]. Nutrition reviews, 2017, 75(9): 673-682.
Johnson A J, Vangay P, Al-Ghalith G A, et al. Daily Sampling Reveals Personalized Diet-Microbiome Associations in Humans[J]. Cell host & microbe, 2019, 25(6): 789-802. e5.
Oliphant K, Allen-Vercoe E. Macronutrient metabolism by the human gut microbiome: major fermentation by-products and their impact on host health[J]. Microbiome, 2019, 7(1): 91.
Zmora N, Suez J, Elinav E. You are what you eat: diet, health and the gut microbiota[J]. Nature Reviews Gastroenterology & Hepatology, 2018: 1.
Jandhyala S M, Talukdar R, Subramanyam C, et al. Role of the normal gut microbiota[J]. World journal of gastroenterology: WJG, 2015, 21(29): 8787.
David L A, Maurice C F, Carmody R N, et al. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature, 2014, 505(7484): 559.
Rowland I, Gibson G, Heinken A, et al. Gut microbiota functions: metabolism of nutrients and other food components[J]. European journal of nutrition, 2018, 57(1): 1-24.
Murtaza N, Cuív P Ó, Morrison M. Diet and the microbiome[J]. Gastroenterology Clinics, 2017, 46(1): 49-60.
Brewster R, Tamburini F B, Asiimwe E, et al. Surveying Gut Microbiome Research in Africans: Toward Improved Diversity and Representation[J]. Trends in microbiology, 2019.
Trepel F. Dietary fibre: more than a matter of dietetics. I. Compounds, properties, physiological effects[J]. Wiener klinische Wochenschrift, 2004, 116(14): 465-476.
Faith J J, McNulty N P, Rey F E, et al. Predicting a human gut microbiota’s response to diet in gnotobiotic mice[J]. Science, 2011, 333(6038): 101-104.
Mai V, McCrary Q M, Sinha R, et al. Associations between dietary habits and body mass index with gut microbiota composition and fecal water genotoxicity: an observational study in African American and Caucasian American volunteers[J]. Nutrition journal, 2009, 8(1): 49.
Pace L A, Crowe S E. Complex relationships between food, diet, and the microbiome[J]. Gastroenterology Clinics, 2016, 45(2): 253-265.
Dietary reference intakes: the essential guide to nutrient requirements[M]. National Academies Press, 2006.
Hellwig JP, Otten JJ, Meyers LD. Dietary Reference Intakes∷ the Essential Guide to Nutrient Requirements. 2006
Katz DL, Meller S. Can we say what diet is best for health? Annu Rev Public Health. 2014;35:83–103. doi: 10.1146/annurev-publhealth-032013-182351.
原创: 谷禾健康
说话晚、读书读不进、每天不开心不全是我们的错,还可能是肠道菌群有问题。肠道菌群不仅影响消化吸收,还影响神经系统。近年来,科学家们研究发现,肠道细菌可能在神经发育,焦虑和抑郁症的诱发过程中,甚至很多中枢神经系统疾病中,都起着重要的作用。
肠道菌群究竟是什么
首先,我们了解下肠道菌群。
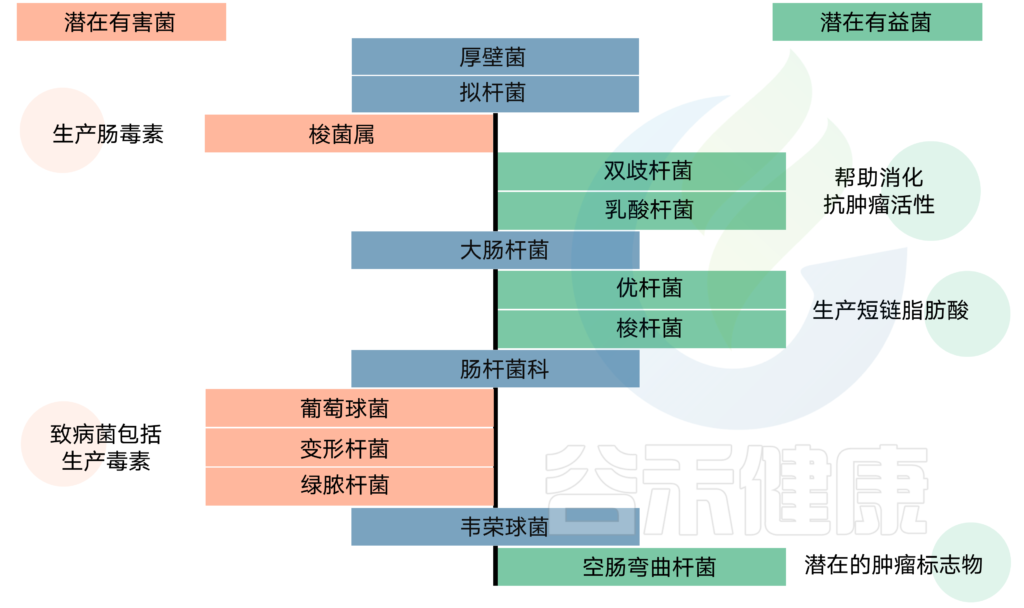
肠道菌群包含居住在胃肠道中的大约100万亿微生物的集体基因组,我们肠道细菌的基因库包含比人类基因组多150倍的独特基因。
在人体定植的许多微生物群落中,肠道菌群正在成为影响宿主健康状况的主要参与者。肠道菌群的组成是在宿主发育早期建立的,并且可以在一生中经历无数的变化。越来越多的证据表明,肠道微生物组与中枢神经系统(CNS)相通 。
肠道菌群和我们的发育同步
是伴随和影响我们一生的伙伴
从怀孕时期就影响我们的神经发育
神经发育过程
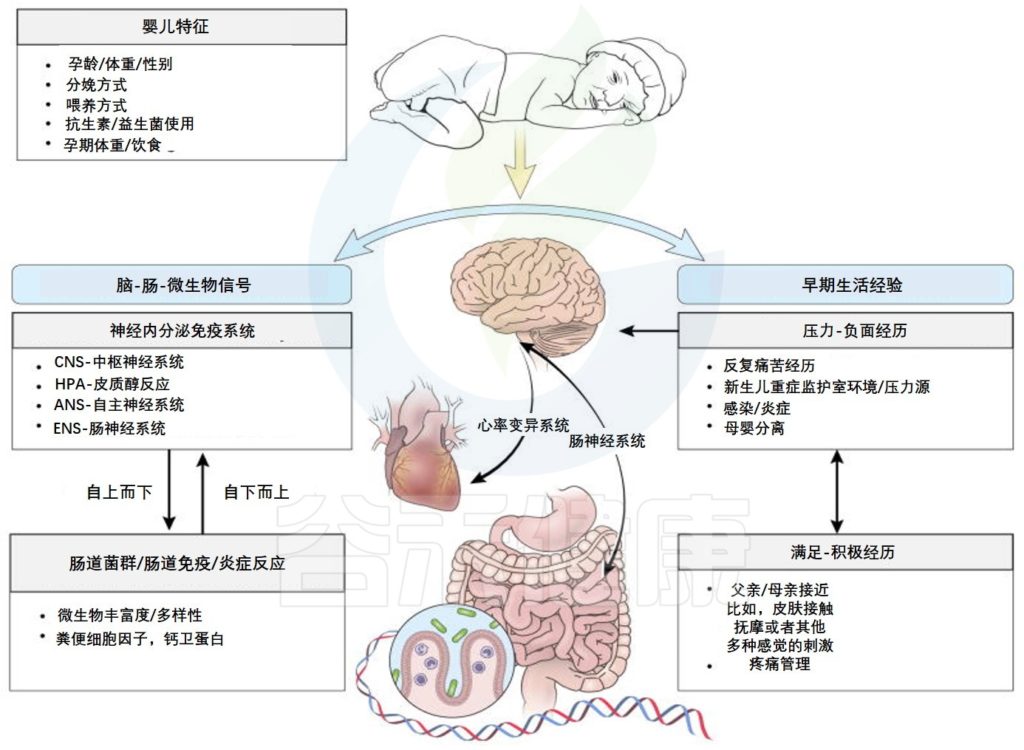
经研究发现,神经发育的主要过程与母体和新生儿肠道微生物的变化一致

肠-脑轴参与婴儿早期神经发育与感受
接下来我们看看胃肠道是怎么构成的
胃肠道的构成
胃肠道(GI)长5米,上皮表面积约32平方米。它是身体70-80%免疫细胞的家园,超过1亿个神经元,以及多达100,000个外在神经末梢。
微生物组包含多达40万亿个细胞和至少数百种不同的物种。胃肠道的一个重要功能是感知和响应外部线索。
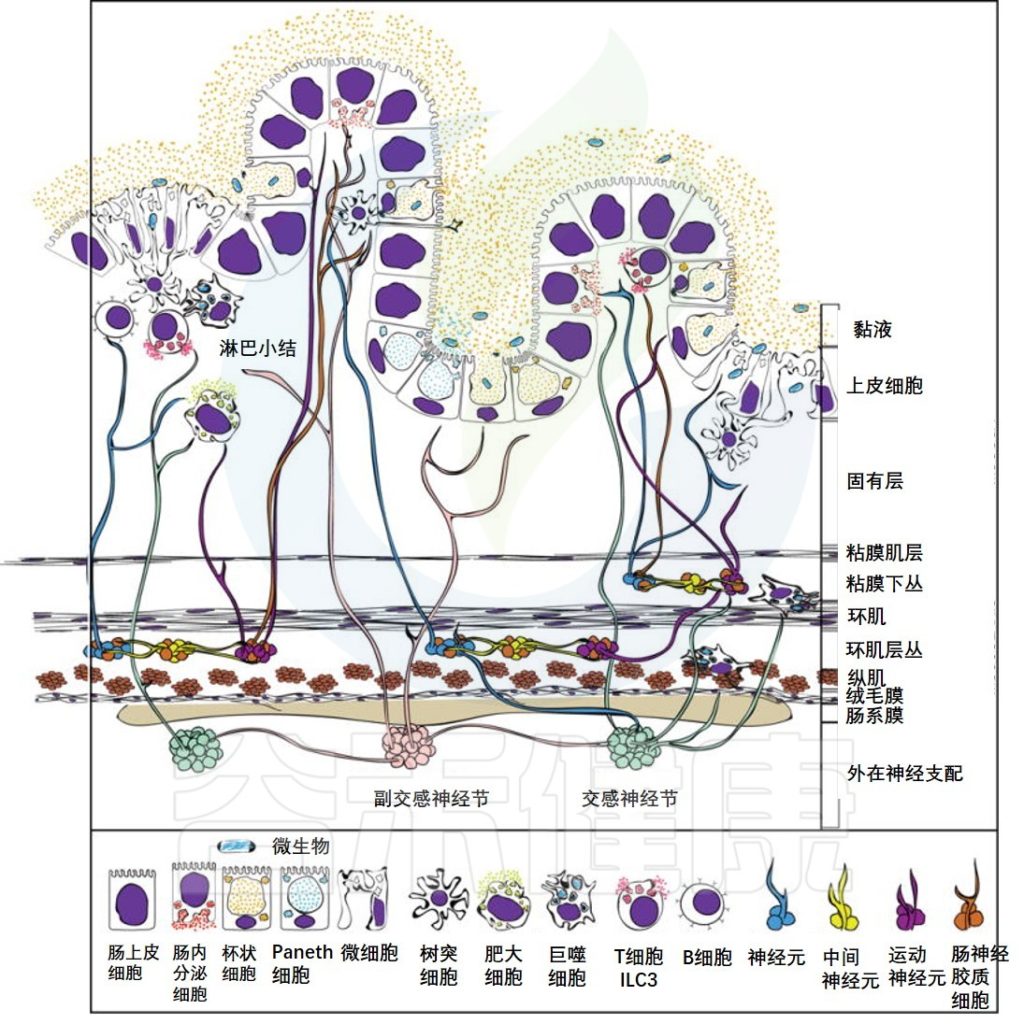
胃肠道由不同的横截面隔室组成。外在的,交感神经和副交感神经纤维通过肠系膜进入胃肠道并且可以延伸遍及肠组织的所有层。各种免疫细胞驻留在肌层,但在固有层中也非常丰富,特别是在Peyer氏斑块和淋巴滤泡中。
这些免疫细胞也与神经元和神经胶质细胞紧密相连。这里显示的上皮由5种不同的细胞类型组成,包括吸收肠上皮细胞,肠内分泌细胞,杯状细胞,潘氏细胞,微细胞。
胃肠道(GI)对于营养物质的吸收,粘膜和全身免疫反应的诱导以及健康的肠道微生物群的维持是必不可少的。
你会发现不只是消化的细胞
还有大量的神经元和免疫细胞
以及海量的肠道菌群
为什么有句话说
“肠胃不好顺带着心情和脑子也不好了”?
肠道又是如何联系到大脑
从而影响神经系统的呢?
经过大量的研究,我们逐步揭开了肠道菌群与大脑之间的联系。
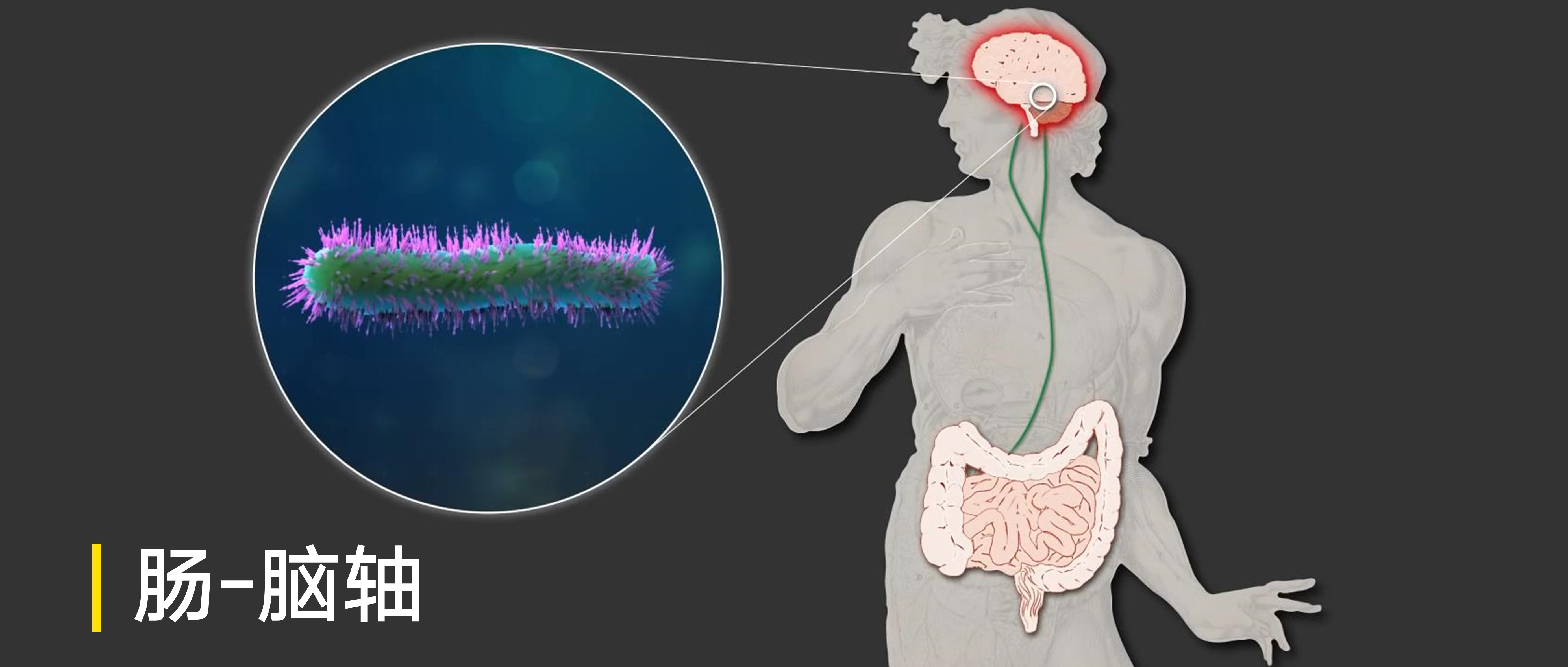
肠-脑轴
人体肠道微生物组以多种方式影响人类大脑健康:
(1)结构性细菌成分如脂多糖为先天免疫系统提供低级强直性刺激。由细菌生态失调,小肠细菌过度生长或肠渗透性增加引起的过度刺激可能产生全身和/或中枢神经系统炎症。
(2)细菌蛋白质可能与人类抗原交叉反应,刺激适应性免疫系统的功能失调反应。
(3)细菌酶可产生神经毒性代谢物,如D-乳酸和氨,甚至有益的代谢物如短链脂肪酸也可能发挥神经毒性。
(4)肠道微生物可以与人类产生相同的激素和神经递质。这些激素的细菌受体影响微生物的生长和毒力。
(5)肠道细菌直接刺激肠神经系统的传入神经元,通过迷走神经向大脑发送信号。通过这些不同的机制,肠道微生物塑造了睡眠和下丘脑 – 垂体 – 肾上腺轴的应激反应的结构。它们影响记忆,情绪和认知,并且在临床和治疗上与一系列疾病相关,包括酗酒,慢性疲劳综合症,纤维肌痛和不安腿综合征。
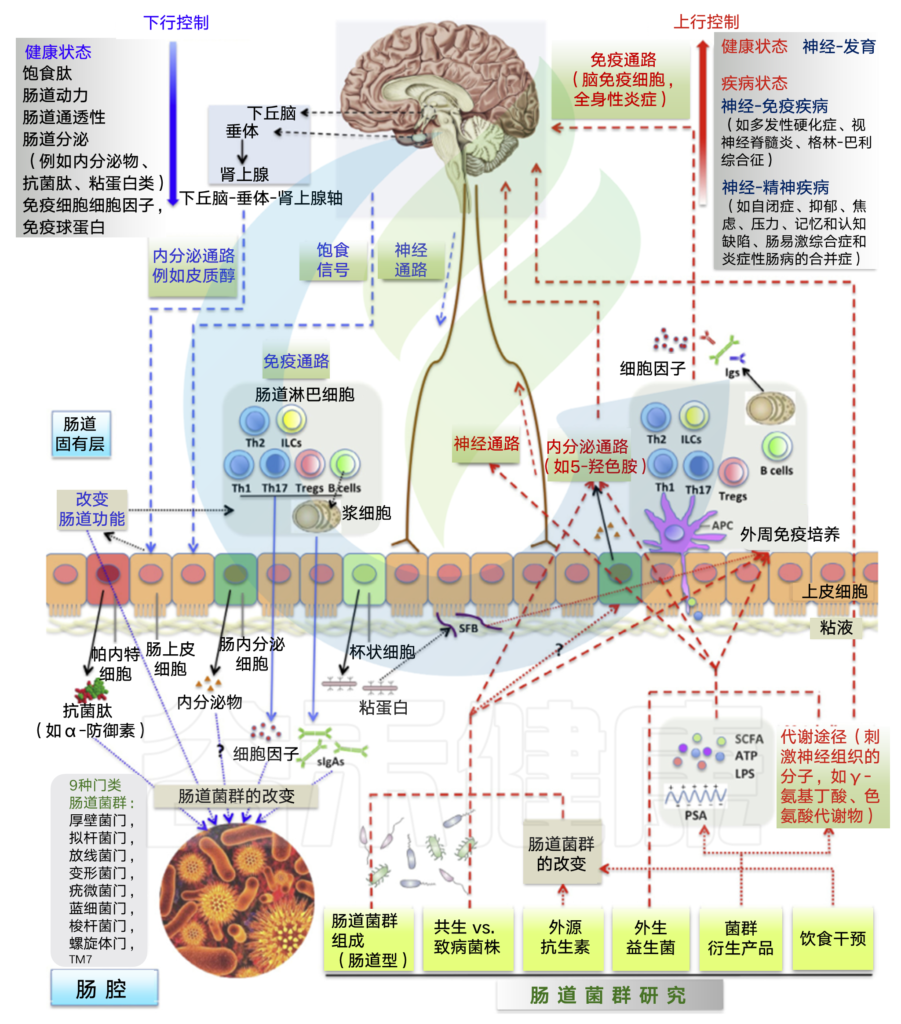
在健康和疾病的背景下,多个途径引导微生物组 – 肠 – 脑轴的向下和向上方向。
(A)向下,CNS通过影响营养的可用性饱食信号肽,影响肠功能和神经通路的内分泌物来控制肠道微生物组成。
皮质醇的HPA轴释放调节肠道运动和完整性。
免疫途径(细胞,细胞因子和sIgAs)可以开启,用以响应肠道功能的改变。内分泌和神经通路还可以调节来自特化肠上皮细胞的分泌,包括潘氏细胞,肠内分泌细胞和杯状细胞。它们的分泌产物影响菌群的存活和居住环境。
(B)向上,肠道微生物组通过神经(通过微生物组直接激活神经元),内分泌(例如5-羟色胺的肠内分泌细胞释放),代谢(神经活性分子的菌群合成)和免疫(CNS浸润免疫细胞和全身炎症)途径来控制CNS活动。
菌群在健康状态(神经发育)和疾病(一系列神经免疫和神经精神疾病)状态影响CNS。肠腔菌群,其产物由APC取样,附着上皮的SFB(肠内节丝状菌)介导外周免疫培养。
肠道微生物组成,菌群内的特定菌株,益生菌处理,菌群衍生产物和其他因素构成微生物组研究的范围。
由肠道微生物及其产物
直接或间接驱动的基本发育过程
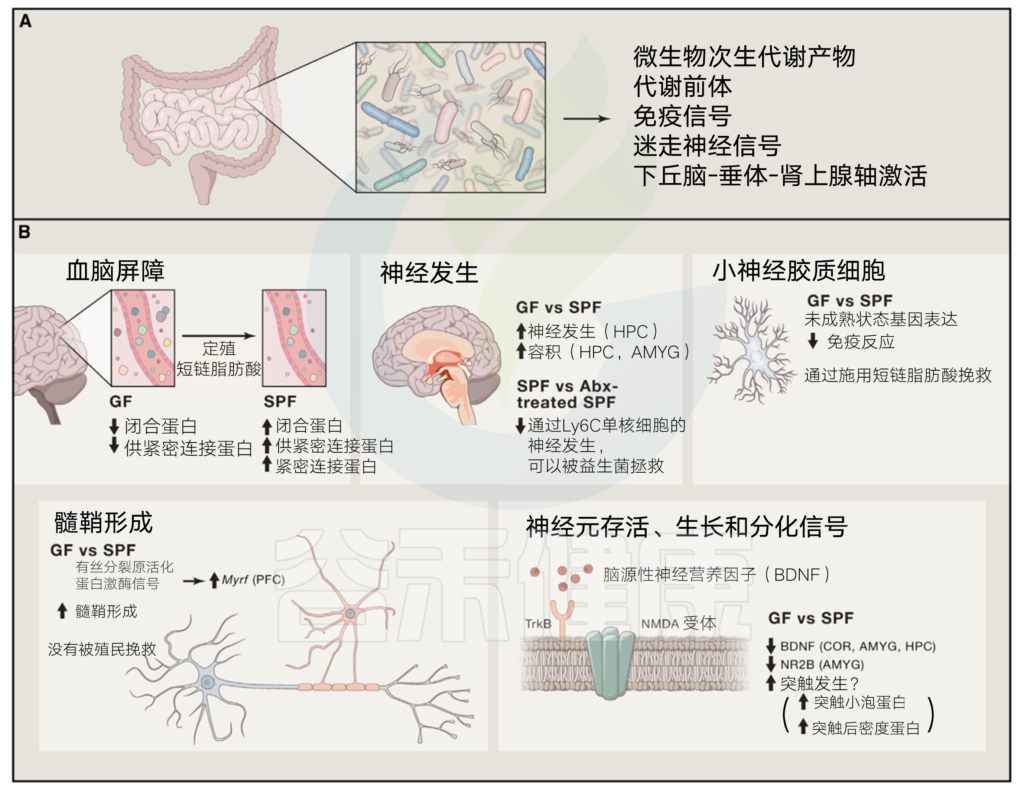
细分来看,肠神经系统(ENS)就是肠道的大脑,同时还是联系着肠道外部(微生物群,代谢物和营养物)和内部(免疫细胞和基质细胞)微环境。
肠神经系统
胃肠生理学的关键方面由肠神经系统(ENS)控制。ENS由神经元和神经胶质细胞组成。
肠神经元位于粘膜下或肌间神经丛中。两个丛都位于两个肌肉层之间。副交感神经纤维释放乙酰胆碱,交感神经释放去甲肾上腺素。这些外在神经纤维可以支配肠神经元,但也与平滑肌,固有层和上皮细胞相关。肠神经元可以相互支配或延伸到固有层,特定的肠道真菌(IFAN)可以突触到交感神经节。
肠神经胶质细胞产生和释放神经营养因子,与肠神经元结合,并延伸到整个粘膜。左列和中间列用颜色编码,分别代表产生特定条件的细胞和分子以及从这些特定条件产生的结果。
肠神经元与胶质细胞的连接
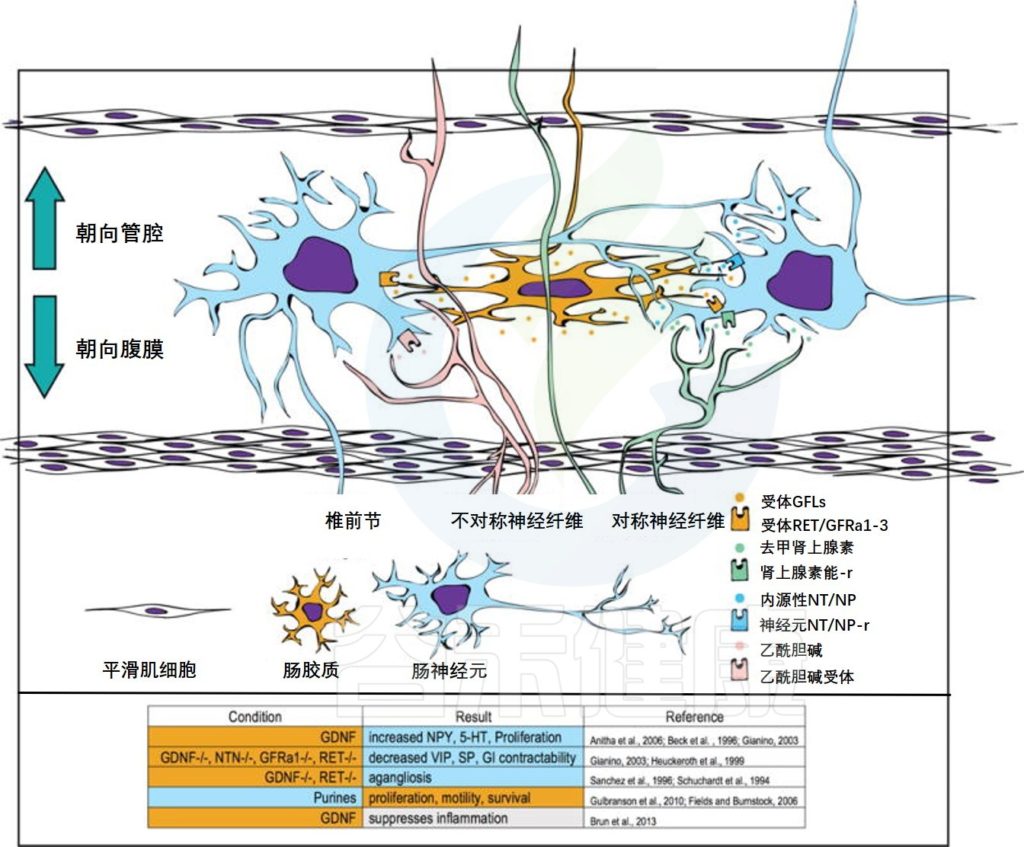
此外肠道菌群还通过释放不同物质和干预免疫系统最终影响血脑屏障和中枢神经系统(CNS)产生联系。
肠道用于收集营养和能量,防止有害的毒素和病原体,并清除废物,它是一个高度动态的环境,受到蠕动活动的周期性波动的影响。这些功能主要受两个肠神经系统(ENS)和驻留在肠道内的亿万共生细菌调节和控制。斑马鱼研究实验表明ENS调节肠道微生物群落成员身份以维持肠道健康。通过施用代表性抗炎细菌菌株或恢复ENS功能来预防ENS突变体中的炎症。
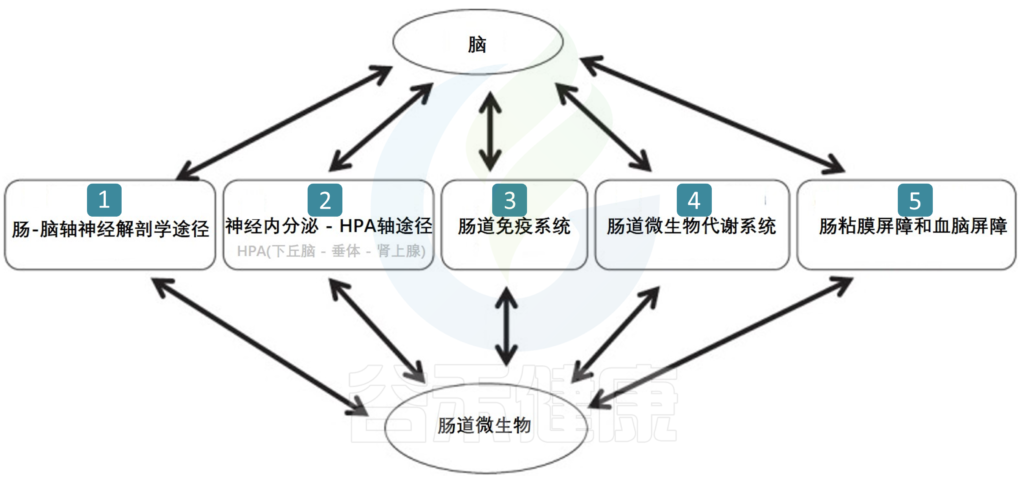
肠-脑之间通讯途径
肠道微生物群与大脑之间可能存在五种通信途径,包括肠道神经网络,神经内分泌 – HPA轴,肠道免疫系统,肠道菌群合成的一些神经递质和神经调节因子,以及包括肠粘膜屏障和血脑屏障在内的屏障。在这个通信网络中,大脑影响肠道运动,感知和分泌功能,来自肠道的内脏信号也影响大脑功能。
肠道微生物群与脑之间可能存在的五种通讯途径
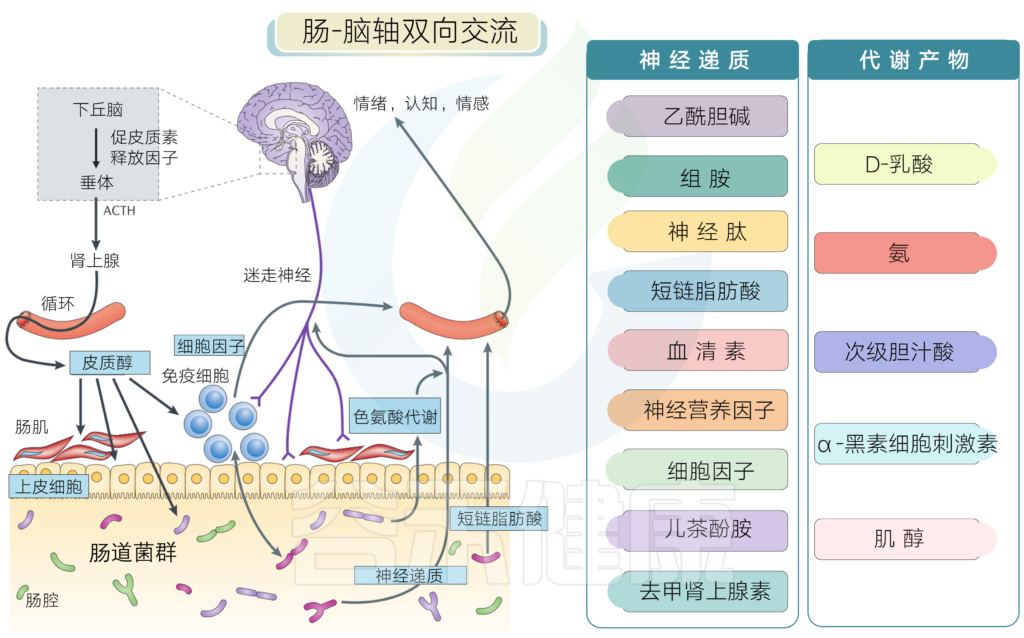
神经递质和代谢产物
很多肠道菌群能代谢产生大量神经递质及其类似物,此外肠道菌群的部分代谢物质也会通过免疫系统影响神经系统。
连接菌群和大脑的
还离不开一个重要通道
——血脑屏障
血脑屏障越来越多的证据表明,菌群与中枢神经系统(CNS)相互作用,并可以调节其许多功能。这种相互作用的一种机制是在血脑屏障(BBB)的水平上。
细菌可以直接将因子释放到体循环中或可以转移到血液中。一旦进入血液,微生物组及其因子可以改变外周免疫细胞,促进与BBB的相互作用,并最终与神经血管单元的其他元素相互作用。
在菌群影响下从外围部位释放的细菌及其因子或细胞因子和其他免疫活性物质可穿过BBB,改变BBB完整性,改变BBB转运率,或诱导屏障细胞释放神经免疫物质。
由菌群代谢产物,例如短链脂肪酸,可穿过BBB以影响脑功能。通过这些和其他机制,微生物组-BBB相互作用可以影响疾病的进程。

Logsdon et al, Experimental Biology and Medicine, 2018
图中1层
菌群与全身免疫细胞相通,可影响血脑屏障(BBB)和CNS功能。肠腔不断暴露于来自外部环境的细菌。肠上皮屏障的破坏可允许肠道菌群不受调节的移动进入固有层。
图中2层
细菌可以渗透GALT(肠道相关的淋巴组织)和血腔,它们与各种免疫细胞相互作用,包括T细胞。
图中3层
某些细菌可以刺激效应型T细胞分化。调节性T细胞测量在GALT,血液和脑脊液中局部菌群的变化可促进T细胞脑浸润。
图中4层
循环细菌可以上调炎性细胞因子水平,影响BBB完整性并促进神经炎症。LPS(脂多糖)由细菌因子产生,并且可以作用于内皮TLR(Toll样受体)以促进神经炎症和CNS疾病。
图中5层
细菌代谢物可以上调紧密连接蛋白并改善BBB完整性。
图中6层
代谢物也可穿过BBB以影响神经胶质细胞和神经炎症。微生物组对周细胞的作用仍不清楚。
那么肠道菌群如果发生变化,
会带来哪些神经系统疾病和问题呢?
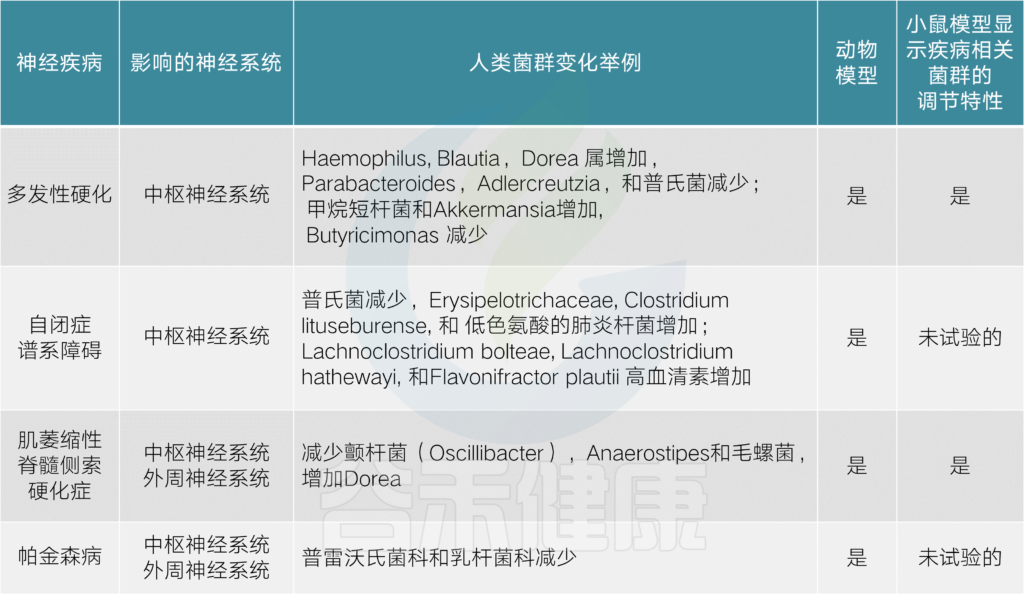
神经系统疾病的相关菌
目前已经发现一些与神经系统疾病(包括多发性硬化症,自闭症,帕金森病等)研究相关的菌。研究发现,这些疾病患者的某些菌群的数量明显发生变化,具体如下表:
菌群干预或异常会导致的问题
目前有越来越多的证据表明,肠道微生物群在指导和促进大脑发育过程中发挥着重要作用,对健康具有长期的影响。
菌群和菌群产物的扰动
会影响小鼠模型和人类的行为结果
产前效果
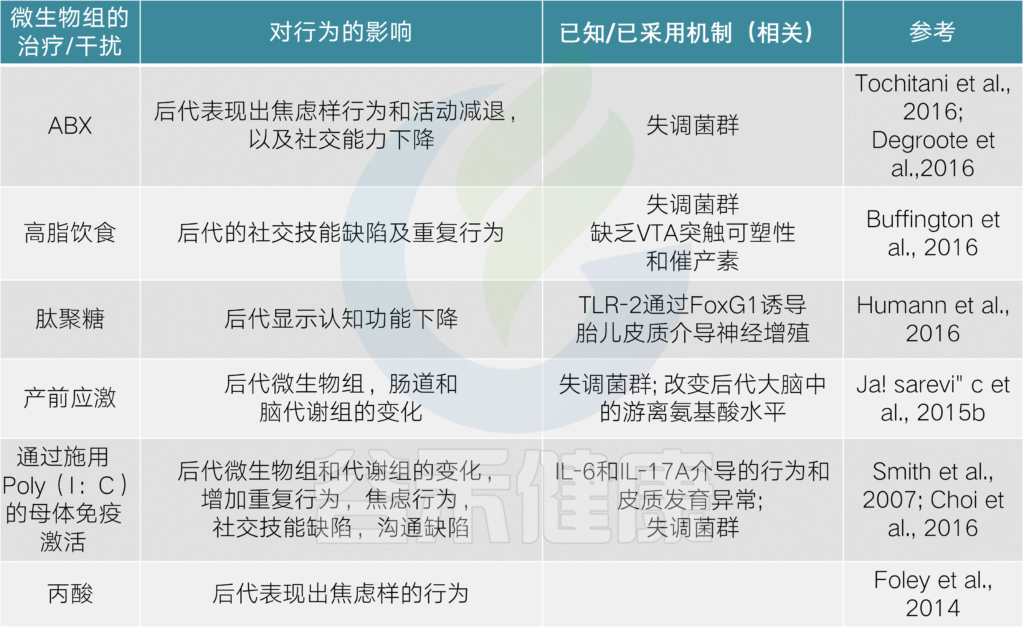
产后效果




菌群如何影响中枢神经系统疾病

免疫介导的CNS疾病
多发性硬化症
多发性硬化症(MS)是由针对中枢神经组织的自身反应性免疫攻击介导的慢性CNS脱髓鞘疾病。这是通过研究患者和使用称为实验性自身免疫性脑脊髓炎(EAE)的MS动物模型来实现的。
如在一系列研究中观察到的,用单一细菌或细菌混合物口服治疗可调节EAE。益生菌动物双歧杆菌减少了大鼠EAE模型中症状的持续时间。
乳酸杆菌(包括LcS),单独施用或与其他双歧杆菌属菌株组合施用,倾向于通过相互调节促炎细胞因子和抗炎细胞因子反应来缓解小鼠EAE症状。
脆弱拟杆菌和乳酸片球菌(菌株R037)的益生菌治疗也显着降低了小鼠对EAE的易感性。
视神经脊髓炎
视神经脊髓炎(NMO),是一种CNS自身免疫疾病,其特征在于视神经和脊髓的免疫介导的脱髓鞘。
研究发现水通道蛋白血清阳性的NMO和NMO谱系疾病患者血清对胃肠道的抗原(最常见的饮食蛋白)抗体水平高于健康对照组,暗示NMO患者微生物群组成和免疫状态的改变。
格林 – 巴利综合征
格林 – 巴利综合征(GBS)是一种周围神经系统的自身免疫性疾病。
空肠弯曲杆菌在家禽中发现的肠道共生物种是由食物污染引起的人类肠炎的主要原因。研究表明弯曲杆菌肠炎患者的GBS风险高。
此外,弯曲杆菌与几种GBS的病理形式有关。不同的弯曲杆菌菌株以及宿主因子在GBS发育过程中形成自身反应性免疫反应中起重要作用。
因此,空肠弯曲杆菌代表了一种介导神经自身免疫的肠道相关病原体。
其他免疫介导的疾病
脑膜炎是CNS保护膜的炎症。病毒或细菌感染可能导致脑膜炎。据报道,成年肠道共生大肠杆菌 K1能够通过母体转移给新生儿引起脑膜炎。
慢性疲劳综合征(CFS),也称为肌痛性脑脊髓炎(ME),目前尚不清楚病因。据推测,共生细菌的转运升高可能是某些CFS患者疾病活动的原因。
非免疫介导的CNS疾病
自闭症
自闭症谱系障碍(ASD)是一系列发育性神经行为障碍,其特征是社交互动和沟通受损。新出现的数据表明肠道微生物组与ASD之间存在联系,可能是直接因果关系,也可能是间接的非典型摄食和营养模式的结果。
肠道微生物群的破坏可能促进产生神经毒素的细菌的过度定殖,从而导致自闭症症状。据报道,在自闭症儿童的粪便样本中存在的梭菌属下的物种数量更多,Bacteroidetes和Firmicutes门的不平衡也表现在自闭症儿童身上。
此外,其他肠道共生物的水平改变,包括双歧杆菌,乳酸杆菌,Sutterella,普氏菌和Ruminococcus属以及Alcaligenaceae家族,与自闭症相关。
肠道微生物组介导的新陈代谢也会影响自闭症。
抑郁症
抑郁症是由神经精神障碍或免疫失调导致的情绪障碍的主要形式。益生菌治疗已经显示出抑制动物抑郁症模型的功效。乳杆菌属下的物种特别表征为抗抑郁剂,包含鼠李糖乳杆菌和瑞士乳杆菌菌株的益生菌混合物通过使皮质酮水平正常化来改善母体分离诱导的抑郁。
类似地,鼠李糖乳杆菌菌株JB-1通过以迷走神经依赖性方式调节皮质酮和GABA受体来减少抑郁相关行为。
双歧杆菌的种类也是有效的抗抑郁药。
如大鼠强迫游泳试验(FST)和母体分离模型所示,Bifidobacterium infantis减轻了抑郁症。涉及的机制包括促炎细胞因子的减弱,色氨酸代谢的调节和CNS神经递质。
此外,含有高水平多不饱和脂肪酸(PUFA)n-3的饮食配方通过与瑞士乳杆菌和长双歧杆菌相似的机制减弱大鼠MI后抑郁症。
焦虑和压力
焦虑和压力是具有神经,内分泌和免疫学基础的情绪障碍的常见形式。暴露于诸如化学,生物或环境刺激的压力因素可引发压力和焦虑反应,其涉及激活HPA轴(下丘脑-垂体-肾上腺轴)。如前所述,焦虑和压力的共病已经在剧烈和轻微的肠功能障碍类型中被感知,强调了肠 – 脑信号如神经递质和免疫因子的作用。
与具有正常肠道微生物群的SPF小鼠相比,GF小鼠显示出增加的运动活性和减少的焦虑。这种行为表型与GF小鼠的CNS中更高水平的神经递质和降低的突触长期增强相关。
后来的研究证实了GF条件下焦虑样行为的减少,这可以通过其他神经化学变化来解释,例如神经递质受体减少和色氨酸代谢增加。因此推测肠道微生物组调节HPA轴的设定点。
有益的益生菌可以改善焦虑。乳杆菌属和双歧杆菌属的特定种类具有抗焦虑作用。用长双歧杆菌,婴儿双歧杆菌,瑞氏乳杆菌或鼠李糖乳杆菌的某些菌株进行益生菌处理单独或联合使用,在动物焦虑模型中归一化行为表型。
Lactobacillus farciminis还抑制了应激诱导的肠道泄漏并减弱了HPA轴应激反应。
由瑞士乳杆菌和长双歧杆菌组成的益生菌制剂显示出在大鼠中的抗焦虑样活性和对健康人受试者的有益心理作用。
痛
通过益生菌调节微生物组可以减轻由对刺激的外周神经反应和对CNS的信号转导引起的伤害性疼痛。在乳杆菌属的种中可见抗伤害感受作用。
罗伊氏乳杆菌还减轻正常大鼠CRD诱导的内脏疼痛。
L. paracasei使抗生素扰动小鼠的CRD内脏超敏反应正常化。
嗜酸乳杆菌通过诱导阿片样物质和大麻素受体在肠道疼痛中产生镇痛作用。
此外,两项研究支持IBS背景下特定婴儿双歧杆菌菌株的抗伤害感受作用。
其他神经精神症状
微生物组与其他神经精神疾病有关,其中经常发生基于免疫和非免疫的病因的混合物。GF动物表现出缺陷的记忆和认知能力。用小鼠菌群重新定殖GF小鼠可以增强或减少探索行为。海马脑源性神经营养因子水平与探索行为正相关。
益生菌能够改善感染引起的记忆功能障碍和糖尿病引起的认知缺陷。肠道微生物组的膳食改变也调节了小鼠的认知和学习行为。
总而言之,肠道菌群的研究对于CNS疾病相关的诊断,预后和治疗都有很大的意义。
主要参考文献
Sharon G et al. (2017) The Central NervousSystem and the Gut Microbiome. Cell. 167: 915–932.
Cong et al. (2016) Early life experience and gut microbiome: the Brain-Gut-Microbiota signaling system. Adv Neonatal Care. 15(5): 314–323.
Rolig et al. (2017). The enteric nervous system promotes intestinal health by constraining microbiota composition. PLoS Biol. 15(2): e2000689.
Logsdon AF et al. (2018) Gut reactions: How the blood–brain barrier connects the microbiome and the brain. Exp Biol Med. 243(2): 159–165.
Wang HX and Wang YP (2016). Gut Microbiota-brain Axis Chin Med J (Engl). 129(19): 2373–2380.
Vighi G et al. (2008) Allergy and the gastrointestinal system. Clin Exp Immunol.153:3–6
Hooper LV et al. (2012) Interactions between the microbiota and the immune system. Science. 336:1268–1273
Mowat AM. (2003) Anatomical basis of tolerance and immunity to intestinal antigens. Nat Rev Immunol. 3:331–341.
Bryan B. Yoo et al. (2018) The Enteric Network: Interactions between the Immune and Nervous Systems of the Gut. Immunity. 46(6): 910–926.
Johansson MEV et al. (2016) Immunological aspects of intestinal mucus and mucins. Nat Rev Immunol. 16:639–649.
Gerbe F et al. (2016) Intestinal epithelial tuft cells initiate type 2 mucosal immunity to helminth parasites. Nature. 529:226–230.
Howitt MR et al. (2016)Tuft cells, taste-chemosensory cells, orchestrate parasite type 2 immunity in the gut. Science. 351:1329–1333.
Shivani Ghaisas et al. (2016) Gut microbiome in health and disease: linking the microbiome-gut-brain axis and environmental factors in the pathogenesis of systemic and neurodegenerative diseases. Pharmacol Ther. 158: 52–62.
Yatsunenko T et al. (2012) Human gut microbiome viewed across age and geography. Nature. 486:222–227.
Dogra S et al. (2015) Dynamics of infant gut microbiota are influenced by delivery mode and gestational duration and are associated with subsequent adiposity. MBio. 6
Villaran RF et al. (2010) Ulcerative colitis exacerbates lipopolysaccharide-induced damage to the nigral dopaminergic system: potential risk factor in Parkinson’s disease. J Neurochem. 114:1687–1700.
Wang Y, Kasper LH. (2014) The role of microbiome in central nervous system disorders. Brain Behav Immun. 38: 1–12.
Mayer EA et al. (2017) The gut and its microbiome as related to central nervous system functioning and psychological wellbeing: Introduction to the Special Issue of Psychosomatic Medicine. Psychosom Med. 79(8): 844–846.
Cryan JF et al (2012). Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nature reviews. Neuroscience. 13:701–712.
Belkaid Y, Naik S. (2013) Compartmentalized and systemic control of tissue immunity by commensals. Nature immunology. 14:646–653.
Knuesel I et al. (2014) Maternal immune activation and abnormalbrain development across CNS disorders. Nat Rev Neurol. 10:643–660.
Möhle L et al. (2016) Ly6Chi Monocytes Provide a Link betweenAntibiotic-Induced Changes in Gut Microbiota and Adult HippocampalNeurogenesis. Cell Rep. 15:1945–1956.
Matcovitch-Natan et al. (2016) Microglia development follows astepwise program to regulate brain homeostasis. Science
Desbonnet L. et al. (2015) Gut microbiota depletion from earlyadolescence in mice: Implications for brain and behaviour. Brain Behav Immun. 48:165–173.

人体内有大量的细菌和其他微生物,它们统称为微生物群或微生物群,它们对我们的健康有重要的功能,包括我们的消化系统和免疫系统。最近的创新带来了更好的测序技术和生物信息学,导致人类微生物组研究尤其是肠道研究的显着增加。本文简要介绍了微生物组研究中使用的技术,并为此提供了新的见解 – 直到最近,这个看不见的世界。另外,将讨论潜在的诊断和治疗应用。
微生物群,微生物群,肠道细菌,食物
安东尼范列文虎克(1632-1723)也许是第一个看到细菌的人。他用自己制造的简单但非常有效的显微镜研究了皮屑,头发,昆虫,血液和沼泽水等各种物体。在致伦敦皇家学会的信中,他将他的观察结果描述为井和运河水中的微小“微生物”[1]。1683年,范列文虎克给皇家学会再写了一封信。虽然他总是用盐和一块布清洁他的嘴,但他已经看到他的自制平视
显微镜下他的牙齿和材料之间有什么斑块。在那里,他也看到了数以百计的“小动物”。他的这些口腔细菌的图画和描述可能是与我们身体相关的微生物的发现[1]。
在随后的三个世纪中,微生物学蓬勃发展 – 主要在病原体领域。大多数细菌和病毒被认为是病原体,鉴于霍乱,结核病,天花和百日咳等疾病的高发病率,这是一种合乎逻辑的假设。随着疫苗和抗生素的出现,这些传染性疾病在二十世纪的墨水中减少了,微生物学也可以专注于研究人体内和微生物上的微生物。
我们现在知道,我们的身体适应了生活在我们皮肤上,口腔,胃和肠道中的复杂微生物群落。这些微生物聚生体由细菌,古细菌,原生动物和真菌组成,它们一起被称为人类微生物群(所有微生物)或人类微生物群(所有目前的微生物及其基因组)[2]。一个人容纳几百到几千种不同的微生物物种,主要是细菌,大多数微生物都生活在大肠里。一种广泛使用但现在已经过时的统计数据声称,我们的身体比人体细胞含有十倍多的微生物细胞。在最近的出版物中,这些计算已经重新完成,现在估计人体内和人体内的微生物数量大约等于体细胞的数量,即4×1013 [3]。
人们并不是复杂的微生物群落的唯一栖息地。微生物无处不在。几乎所有生物体 – 植物或动物的生命 – 都与微生物有关。此外,微生物群落在各种环境中都有发现,如土壤,海水,冰川和室内各种表面平原。
在过去的二十年中,DNA扩增和测序技术有了惊人的改进。这导致了大量的微生物群落研究[2]。许多这些研究利用了16S rRNA基因的独特性质,它编码的RNA是小核糖体亚基的一部分[4]。核糖体是所有活生物体的一部分,因此是每个细菌基因组中的rRNA基因。16S rRNA基因具有独特的“镶嵌结构”,具有保守区和可变区。保守结构域可用于设计几乎适用于所有细菌基因组的通用引物,而中间可变结构域(V1至V9)对每种细菌物种都是独特的,因此可用于鉴定和表征。
新的分子技术使研究各种样品类型的微生物多样性成为可能,而不必依赖于培养。这导致了许多未知细菌门的发现,现在已经有数百万个细菌和古菌序列被发表。
此外,现在可以对样本中的完整基因组DNA进行测序,以便可以研究复杂群落中的所有基因及其可能的功能(宏基因组学)。最后,科学能够在转录组学,蛋白质组学和代谢组学领域提供各种其他创新 – 在某些条件下对所有这些基因表达的新见解[6]。除DNA提取和测序领域的创新之外,生物信息学在分析这些技术产生的大量数据方面有很大进展。
新技术使分析人体中复杂的微生物群成为可能。发现人类微生物群落因解剖部位而异,但也受个体和时间的影响[7,8]。2008年开展了两项大规模微生物群研究。欧洲MetaHit-联盟关注粪便的宏基因组分析[9],而美国人类微生物组计划则检查了几个身体部位[10]。最近的两项大荷兰一比利时研究显示,食物和药物对肠道微生物组成的重要影响[11,12]。这些项目极大地扩展了我们对人体微生物居民身份和功能的认识。
我们身体的微生物定植开始于出生时,在生命的第三或第四年左右或多或少完成[13]。这个殖民化过程如何进行,部分取决于交付的类型。在自然分娩期间,婴儿首先接触母亲的阴道和直肠细菌; 而在剖腹产期间,宝宝首先会主要接触皮肤细菌。与此同时,这些新的见解启发了一些父母在母亲的阴道微生物群中涂抹新生儿[14]。此外,婴儿在头几个月的喂养方式决定了他们的肠道微生物群的发展。母乳含有细菌,人造奶不育。通过剖腹产出生的婴儿或用人造奶喂养的婴儿可能会出现一种扰乱的定植模式,哮喘的风险稍高,过敏和晚年肥胖[15]。决定儿童时期微生物群发育的其他因素是兄弟姐妹或宠物的存在以及其他家庭成员的微生物群的组成[16]。与狗或农场长大的儿童发展哮喘的机会较小[17]。这似乎证实了卫生学假说,该假说认为暴露于细菌是儿童早期对免疫系统发育和对环境抗原更高耐受性所必需的。
我们体内的微生物,特别是肠道中的微生物,对我们的健康非常重要。我们肠道细菌的共同基因是我们自己的基因组的一个很好的功能延伸。人类肠道微生物群含有比人类基因组多150倍的基因,它编码了许多我们无法自行合成的酶[9]。肠道微生物群的一个重要功能是消化我们不能自行分解的营养物质。大多数植物碳水化合物和纤维不能在小肠中消化,并在未被消化的大肠中被肠道细菌发酵。由此肠道微生物群的存在使得哺乳动物能够从食物中提取更多的能量。在无菌培养箱中出生并繁殖的无菌小鼠,
除了复杂的碳水化合物和纤维的消化和发酵之外,肠道微生物群还涉及短链脂肪酸的生产(例如
丁酸盐),脂肪代谢,大肠解剖结构的正确发展,免疫系统的控制,维生素的合成以及肠道内空洞的填充,使病原体不能定植[8-10,19]。也有越来越多的证据表明肠道菌群与中枢神经系统之间存在相互沟通的途径,称为脑 – 肠轴,甚至有迹象表明肠道细菌对其宿主的行为和情绪有影响[20]。因此,无菌小鼠比殖民小鼠承担更多的风险,但他们也有较少的记忆。目前还不清楚微生物群与大脑之间的这种联系在人类行为中是否也很重要。
因为我们的肠道细菌实际上是带有大量基因的小化工厂,它们也可以分解或修饰各种化学物质。诸如细胞抑制剂和心脏药物的药物可以被肠道微生物群激活或失活。不同的人对相同药物的反应可能不同,需要更高或更低的剂量,这取决于他们携带的肠道细菌[21]。
人类肠道微生物群通常相当稳定。在一项志愿者长时间收集粪便的研究中,除了在饮食改变,胃肠感染期间或国际旅行期间,肠道微生物群或多或少都保持不变[22,23]。最近对非洲和南美洲传统社区非西方人粪便成分的研究表明,生活方式和饮食对人类肠道微生物群的影响很大。狩猎采集者,传统农民和城市工业人群有着截然不同的微生物群[13,24-26]。狩猎采集者的肠道菌群含有这三组中最高的细菌多样性。这很可能是由这些传统生活小组消耗的大量纤维所引起的 – 比普通美国人和欧洲人多十倍。
在严重感染中,抗生素可以挽救生命,但它们也会对我们的微生物群产生意想不到的副作用。大多数抗生素是广谱的,他们不幸地不区分我们身体中的病原体和有益细菌。许多标准的抗生素治疗方案对我们肠道中细菌类型的数量有很大的影响,通常患者并没有注意到它。恢复通常是不完整的,甚至在停止治疗的几个月后[28,29]。口腔微生物群似乎比肠道微生物群对这些紊乱更不敏感[28]。
另外,从动物实验中发现,反复实际的抗生素治疗主要是在年轻动物中,结果可转移到永久性被扰乱的微生物群中[30],并通过移植人类肠道细菌在无菌小鼠中导致肥胖[31]。这导致了这样的假设:儿童时期反复的抗生素治疗可以导致肠道微生物群的细菌种类减少[32]。在生命的头三年,美国儿童平均得到三至六种抗生素,正是在他们的微生物组发育时。虽然这个数字在荷兰较低,但抗生素反复给儿童开处方,导致肠道菌群多样性减少可能与西方世界肥胖和糖尿病患病率增加有关。
微生物组研究的成功案例之一是应用粪便移植治疗艰难梭菌感染(CDI)患者。艰难梭菌是一种孢子形成和产毒素的细菌,在健康人群中约10%存在于小肠中,但在医院和养老院患者中百分比较高。抗生素治疗可导致肠道微生物群与艰难梭菌的不平衡,艰难梭菌对大多数抗生素具有相对抗性,突然导致它长到大量。可能导致腹泻,腹痛和发烧。在美国,抗生素每年导致近50万例CDI病例和30,000例死亡[33]。直到最近,有限的治疗方案还包括特定的抗生素如万古霉素,在极端情况下,切除一部分结肠。复发性感染很常见。阿姆斯特丹学术医疗中心的研究表明,粪便移植与健康供体的粪便对CDI患者非常成功。第一次移植后,治愈率超过80%,经过第二次尝试后,增加的百分比可能高达94%[34,35]。因此粪便移植已成为CDI治疗以及许多其他肠道疾病的有吸引力的替代方案。虽然粪便移植的并发症发生率很低,但存在致病性病毒或细菌传播或粪便吸入的风险[36]。阿姆斯特丹学术医疗中心的研究表明,粪便移植与健康供体的粪便对CDI患者非常成功。第一次移植后,治愈率超过80%,经过第二次尝试后,增加的百分比可能高达94%[34,35]。因此粪便移植已成为CDI治疗以及许多其他肠道疾病的有吸引力的替代方案。虽然粪便移植的并发症发生率很低,但存在传播致病病毒或细菌或吸入粪便的风险[36]。阿姆斯特丹学术医学中心的研究表明,粪便与健康供体的粪便移植对于CDI患者非常成功。第一次移植后,治愈率超过80%,经过第二次尝试后,增加的百分比可能高达94%[34,35]。因此粪便移植已成为CDI治疗以及许多其他肠道疾病的有吸引力的替代方案。虽然粪便移植的并发症发生率很低,但存在传播致病病毒或细菌或吸入粪便物质的风险[36]。经过第二次尝试后,这个百分比可能高达94%[34,35]。因此粪便移植已成为CDI治疗以及许多其他肠道疾病的有吸引力的替代方案。虽然粪便移植的并发症发生率很低,但存在传播致病病毒或细菌或吸入粪便物质的风险[36]。经过第二次尝试后,这个百分比可能高达94%[34,35]。因此粪便移植已成为CDI治疗以及许多其他肠道疾病的有吸引力的替代方案。虽然粪便移植的并发症发生率很低,但存在传播致病病毒或细菌或吸入粪便物质的风险[36]。
炎症性肠病(IBD)如克罗恩病和溃疡性结肠炎是难以治疗的肠炎性病症,其原因不明并且症状不稳定。除了遗传成分之外,还有证据表明肠道微生物群的作用。IBD的肠道微生物群与健康人有所不同,细菌多样性较低,特定细菌群比例改变[37]。然而,这种生态失调是否是临床症状的原因还是长期炎症,药物治疗或饮食改变的结果尚不清楚。尽管有许多出版物和研究,迄今为止还没有发现明显的微生物病原体。除其他外,CDI患者粪便移植的成功取决于肠道内微生物多样性的恢复。
自闭症是社会交往领域各种发展制约因素的总称,并且治疗方案很少。与健康儿童相比,自闭症儿童患有肠胃问题,如腹泻或便秘。因此,微生物对这种疾病的可能作用有很大的兴趣[20]。不幸的是,孤独症患者的肠道菌群研究似乎相互矛盾,并且尚未显示与健康人群有明显差异[38]。可能地,自闭症中的一些不同微生物群是由这些患者的某些行为引起的,通常包括强烈的厌恶蔬菜和水果以及偏爱淀粉食物。因此自闭症患者可能会拒绝某些营养素,如纤维。这可能是一些研究中发现的肠道细菌差异的原因。与IBD一样,因此很难区分因果关系。虽然自闭症和肠道细菌之间的关系仍不清楚,但尚未导致临床治疗选择。益生菌,益生菌和最近的粪便移植越来越受到自闭症患者(父母)的’自我药疗’的欢迎[38]。
除了越来越认识到肠道细菌对我们的健康有益之外,我们开始意识到我们生活得很干净。与当前传统的狩猎采集者相比,他们的生活条件可能与我们的祖先非常相似,我们的西方生活方式使我们与微生物的接触更少。婴儿通常是通过剖宫产或喂食无菌奶而出生的,孩子们的兄弟姐妹越来越少,在沙箱或街上玩的少。我们的食物和饮用水几乎是无菌的,我们几乎不接触土壤,植物或动物,我们经常接受抗生素,许多肥皂和洗发水含有三氯生,抗菌擦拭物或紫外线固定器消毒牙刷或手机正变得越来越流行。所有这些因素,加上小纤维的食物,这可能有助于确保我们来自细菌物种的肠道微生物群远低于传统生物群落。由于我们的微生物组参与了我们身体中的许多过程,包括免疫系统的构建和控制,抗生素的使用增加,纤维摄入量减少,以及在年龄较小时减少接触细菌可能与增加许多代谢,过敏和慢性肠道疾病[32]。显然我们不想回到中世纪,传染病可能会杀死半个大陆的人口。接种疫苗很重要,危及生命的细菌感染应该用抗生素治疗,在我们吃东西或开始治疗病人之前洗手是一件好事。但是,也许我们应该通过食用发酵食品和益生菌让自己稍微暴露于细菌,并且在步行,园艺或玩沙盒等活动中更加活跃。我们还需要通过摄入更多膳食纤维和复合碳水化合物以及更少的单糖来照顾我们的内部微生物。
来自微生物组研究的新见解也与’个性化医疗’的发展非常吻合,患者可根据其基因组的个体布局以及他们的微生物进行量身定制的治疗。确定微生物组概况可能很快成为标准治疗的一部分,某些细菌群的缺失或存在可用于诊断或作为起始点,作为目前难以治疗的疾病的治疗计划。与此相关的令人担忧的发展,商业公司的崛起提供了特殊的益生菌和粪便移植药丸。许多这些补品销售没有科学基础或质量。虽然某些特定情况下的益生菌菌株已被证实有积极影响,这些类型的产品的扩散使得难以将小麦从谷壳中分离出来。然而,微生物组研究领域是非常感激和令人兴奋的职业,我期望我们将发现我们的小朋友对我们未来健康的许多意想不到的特征和影响。
除了越来越认识到肠道细菌对我们的健康有益,我们开始意识到我们生活得太干净。与当前传统的狩猎采集者相比,他们的生活条件可能与我们的祖先非常相似,我们的西方生活方式使我们与微生物的接触少得多。婴儿通常是通过剖宫产或者喂食无菌奶来产生的,孩子们在兄弟姐妹少的情况下长大,在沙箱或者街上玩的少。我们的食物和饮用水几乎无菌; 我们几乎不接触土壤,植物或动物; 我们经常接受抗生素; 许多肥皂和洗发水含有三氯生; 并且抗菌擦拭物或紫外线固定器消毒牙刷或电话正变得越来越流行。所有这些因素,加上我们食物中的纤维太少,可能有助于确保我们的细菌物种的肠道微生物群体比传统生物群落的多样性要少得多。由于我们的微生物组参与了我们身体的许多过程,包括免疫系统的构建和控制,抗生素的使用增加,纤维摄入量减少,以及在早期接触细菌减少可能与增加许多代谢,过敏和慢性肠道疾病[32]。显然,我们不想回到中世纪,因为传染病可能会杀死半个大陆的人口。接种疫苗很重要,危及生命的细菌感染应该用抗生素治疗,在我们吃东西或开始治疗病人之前洗手是一件好事。但是,也许我们应该通过食用发酵食物和益生菌让自己稍微暴露于细菌,并且在步行,园艺或玩沙盒等活动中更加活跃。我们还需要通过摄入更多膳食纤维和复合碳水化合物以及更少的单糖来照顾我们的内部微生物。
来自微生物组调查的新见解也与’个性化医疗’的发展相契合,在这种情况下,患者可以根据其基因组的个体布局以及他们的微生物进行量身定制的治疗。确定微生物组概况可能很快成为标准治疗的一部分,某些细菌群的缺失或存在可用于诊断,或作为可用作目前难以治疗的疾病的治疗计划的起点。与此相关的一个令人担忧的发展是商业公司提供特殊的益生菌和粪便移植药丸的混合物的兴起。许多这些补充剂在没有科学基础或质量控制的情况下销售。虽然某些特定情况下的益生菌菌株已被证实有积极影响,这些类型的产品的扩散使得难以将小麦从谷壳中分离出来。然而,微生物组研究领域是一个非常令人兴奋和令人兴奋的专业,我希望我们将来会发现我们的小朋友对我们健康的许多意想不到的特征和影响。
1. Gest H. The discovery of microorganisms by Robert Hooke and Antoni van Leeuwenhoek, Fellows of The Royal Society. Notes Rec R Soc Lond 2004;58:187-201.
2. Grice EA, Segre JA. The human microbiome: our second genome. Annu Rev Genomics Hum Genet 2012;13:151-70.
3. Sender R, Fuchs S, Milo R. Are We Really Vastly Outnumbered? Revisiting the Ratio of Bacterial to Host Cells in Humans. Cell 2016;164:337-40.
4. Woese CR, Fox GE. Phylogenetic structure of the prokaryotic domain: the primary kingdoms. Proc Natl Acad Sci U S A 1977;74:5088-90.
5. Schloss PD, Handelsman J. Status of the microbial census. Microbiol Mol Biol Rev 2004;68:686-91.
6. Franzosa EA, Hsu T, Sirota-Madi A, Shafquat A, Abu-Ali G, Morgan XC, et al. Sequencing and beyond: integrating molecular “omics” for microbial community profiling. Nat Rev Microbiol 2015;13:360-72.
7. Costello EK, Lauber CL, Hamady M, Fierer N, Gordon JI, Knight R. Bacterial community variation in human body habitats across space and time. Science 2009;326:1694-7.
8. Bik EM. Composition and function of the human-associated microbiota. Nutr Rev 2009;67:S164-S71.
9. Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, et al. A human gut microbial gene catalogue established by metagenomic sequencing. Nature 2010;464:59-65.
10. Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome. Nature 2012;486:207-14.
11. Falony G, Joossens M, Vieira-Silva S, Wang J, Darzi Y, Faust K, et al. Population-level analysis of gut microbiome variation. Science 2016;352:560-4.
12. Zhernakova A, Kurilshikov A, Bonder MJ, Tigchelaar EF, Schirmer M, Vatanen T, et al. Population-based metagenomics analysis reveals markers for gut microbiome composition and diversity. Science 2016;352:565-9.
13. Yatsunenko T, Rey FE, Manary MJ, Trehan I, Dominguez-Bello MG, Contreras M, et al. Human gut microbiome viewed across age and geography. Nature 2012;486:222-7.
14. Dominguez-Bello MG, De Jesus-Laboy KM, Shen N, Cox LM, Amir A, Gonzalez A, et al. Partial restoration of the microbiota of cesarean-born infants via vaginal microbial transfer. Nat Med 2016;22:250-3.
15. Mueller NT, Bakacs E, Combellick J, Grigoryan Z, Dominguez-Bello MG. The infant microbiome development: mom matters. Trends Mol Med 2015;21:109-17.
16. Song SJ, Lauber C, Costello EK, Lozupone CA, Humphrey G, Berg-Lyons D, et al. Cohabiting family members share microbiota with one another and with their dogs. Elife 2013;2:e00458.
17. Fall T, Lundholm C, Örtqvist AK, Fall K, Fang F, Hedhammar Å, et al. Early Exposure to Dogs and Farm Animals and the Risk of Childhood Asthma. JAMA Pediatr 2015;169:e153219.
18. Bäckhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, et al. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci U S A 2004;101:15718-23.
19. Kau AL, Ahern PP, Griffin NW, Goodman AL, Gordon JI. Human nutrition, the gut microbiome and the immune system. Nature 2011;474:327-36.
20. O’ Mahony SM, Stilling RM, Dinan TG, Cryan JF. The microbiome and childhood diseases: Focus on brain-gut axis. Birth Defects Res C Embryo Today 2015;105:296-313.
21. Spanogiannopoulos P, Bess EN, Carmody RN, Turnbaugh PJ. The microbial pharmacists within us: a metagenomic view of xenobiotic metabolism. Nat Rev Microbiol 2016;14:273-87.
22. David LA, Materna AC, Friedman J, Campos-Baptista MI, Blackburn MC, Perrotta A, et al. Host lifestyle affects human microbiota on daily timescales. Genome Biol 2014;15:R89.
23. David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature 2014;505:559-63.
24. Gomez A, Petrzelkova KJ, Burns MB, Yeoman CJ, Amato KR, Vlckova K, et al. Gut Microbiome of Coexisting BaAka Pygmies and Bantu Reflects Gradients of Traditional Subsistence Patterns. Cell Rep 2016;14:2142-53.
25. Schnorr SL, Candela M, Rampelli S, Centanni M, Consolandi C, Basaglia G, et al. Gut microbiome of the Hadza hunter-gatherers. Nat Commun 2014;5:3654.
26. Obregon-Tito AJ, Tito RY, Metcalf J, Sankaranarayanan K, Clemente JC, Ursell LK, et al. Subsistence strategies in traditional societies distinguish gut microbiomes. Nat Commun 2015;6:6505.
27. Sonnenburg ED, Smits SA, Tikhonov M, Higginbottom SK, Wingreen NS, Sonnenburg JL. Diet-induced extinctions in the gut microbiota compound over generations. Nature 2016;529:212-5.
28. Zaura E, Brandt BW, Teixeira de Mattos MJ, Buijs MJ, Caspers MPM, Rashid M-U, et al. Same Exposure but Two Radically Different Responses to Antibiotics: Resilience of the Salivary Microbiome versus Long-Term Microbial Shifts in Feces. MBio 2015;6:e01693-e01615.
29. Dethlefsen L, Relman DA. Incomplete recovery and individualized responses of the human distal gut microbiota to repeated antibiotic perturbation. Proc Natl Acad Sci U S A 2011;108:4554-61.
30. Nobel YR, Cox LM, Kirigin FF, Bokulich NA, Yamanishi S, Teitler I, et al. Metabolic and metagenomic outcomes from early-life pulsed antibiotic treatment. Nat Commun 2015;6:7486.
31. Ridaura VK, Faith JJ, Rey FE, Cheng J, Duncan AE, Kau AL, et al. Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science 2013;341:1241214.
32. Cox LM, Blaser MJ. Antibiotics in early life and obesity. Nat Rev Endocrinol 2015;11:182-90.
33. Leffler DA, Lamont JT. Clostridium difficile infection. N Engl J Med 2015;372:1539-48.
34. Drekonja D, Reich J, Gezahegn S, Greer N, Shaukat A, MacDonald R, et al. Fecal Microbiota Transplantation for Clostridium difficile Infection: A Systematic Review. Ann Intern Med 2015;162:630-8.
35. Van Nood E, Vrieze A, Nieuwdorp M, Fuentes S, Zoetendal EG, de Vos WM, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med 2013;368:407-15.
36. Baxter M, Colville A. Adverse events in faecal microbiota transplant: a review of the literature. J Hosp Infect 2016;92:117-27.
37. Kostic AD, Xavier RJ, Gevers D. The microbiome in inflammatory bowel disease: current status and the future ahead. Gastroenterology 2014;146:1489-99.
38. Rosenfeld CS. Microbiome Disturbances and Autism Spectrum Disorders. Drug Metab Dispos 2015;43:1557-71.