 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

食物让我们填饱肚子,补充养分,且感受到快乐与满足,然而,对有些人来说,部分食物却成为了难以预料的健康障碍。
“当时坐在一家优雅的西餐厅,四周萦绕着新鲜烘焙面包的诱人香气,我感受到一场味蕾的盛宴”,刚毕业的小楠回忆着,“然而,就在我大口享受那细腻丝滑的奶油酱和意面时,肠胃却在暗暗策划一场叛变”… “随之而来的腹胀、腹痛,彻底破坏了圣诞节的氛围”…
小楠也是“食物不耐受”的群体之一。“当时出去吃饭常有状况发生,但并不知道是和食物不耐受有关,还是一起吃饭的同学提醒了我”。
对于食物不耐受的人来说,由于其症状形式多样,较迟缓发烧,且不那么严重,许多人甚至根本没有意识到自己患有食物不耐受。有时候,人会感到疲倦,但并没有把疲倦,或情绪低落,或头痛这些与食物不耐受关联起来。
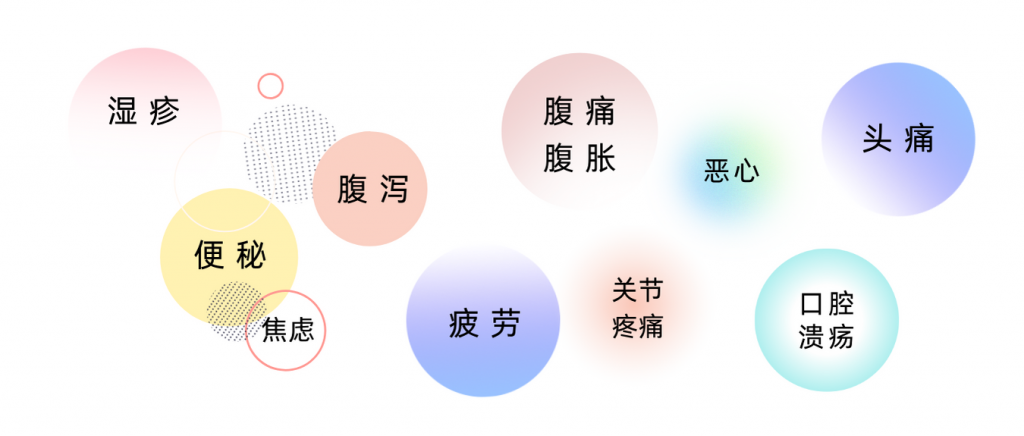
以上一系列症状都有可能与食物不耐受相关。其实,像小楠这样食物不耐受的人其实比较常见,据估计,全世界约有 20% 的人有食物不耐受。
很多人小时候并没有食物不耐受,等成年后的某一天突然发现出现食物不耐受,这说明遗传因素并不一定主导,有其他潜在的因素在起作用。环境因素、生活方式和饮食习惯的改变等都可能会导致食物不耐受的出现。
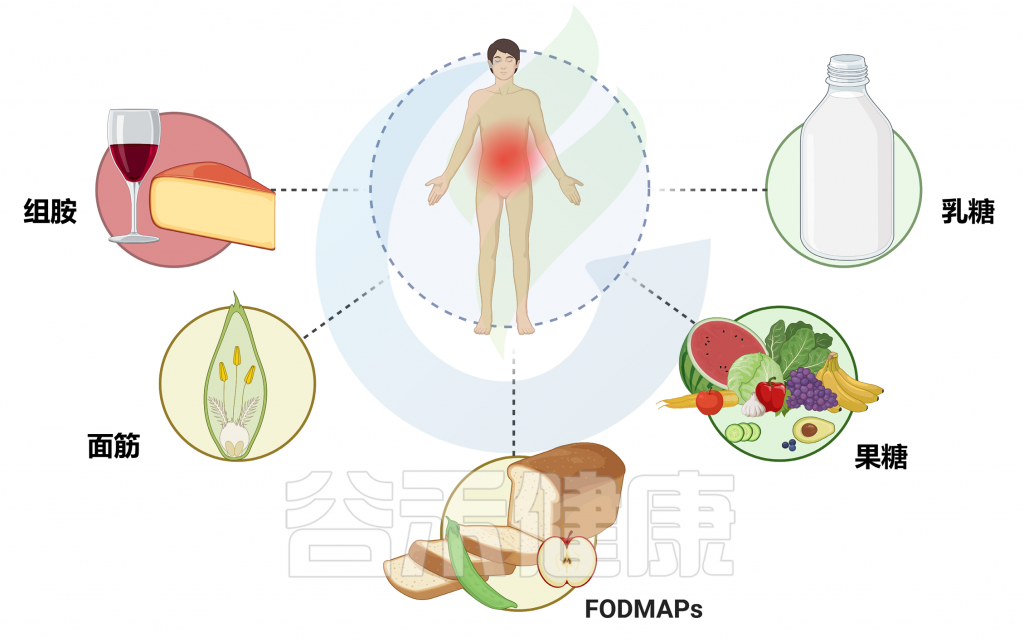
以下是一些常见的原因:酶缺乏(乳糖不耐受中的乳糖酶缺乏),化学物质敏感(如咖啡因、防腐剂、色素、味精等),药物反应,消化系统疾病,饮食习惯(高FODMAP食物),遗传,心理(压力和焦虑)等。
食物不耐受和食物过敏又不一样,食物过敏涉及免疫系统,如IgE介导的反应,这可能会迅速导致严重甚至危及生命的反应。而食物不耐受主要涉及消化系统。
食物不耐受可能在进食后30分钟左右开始,但也可能要在一两天后才发生。症状的延迟发作特点意味着食物不耐受的诊断可能更为复杂。症状包括腹泻、腹胀、胃痛、疲劳、头痛等,可能与消化系统的功能紊乱有关,而肠道菌群在这里扮演了重要的角色。
比如部分健康人群的肠道微生物组蛋白水解能力较低,可能与喝牛奶后肠道不适相关。有研究发现,在乳糖不耐受患者中,乳制品摄入量与胃肠道不适之间的关联部分是由双歧杆菌丰度介导的。
此外,由于感染,炎症等因素带来的肠道菌群失调,有害菌过度增长,产生毒素和其他代谢产物,损害肠道细胞,肠道功能紊乱,肠道屏障破坏增加肠道通透性,可能导致食物成分不能在正确的位置也不能恰当处理,从而发生食物不耐受。
虽然说食物不耐受很常见,但诊断起来却很困难,通常需要时间、耐心和仔细观察,也需要专业人士帮助识别触发食物或成分。症状及其严重程度取决于所吃食物的类型和数量。
许多食物都有可能触发一系列症状,比如牛奶、小麦、贝类、坚果、西红柿、花生、鱼、茄子等,但有时候我们并不知道是哪种食物,又是如何引发这些症状,因此常常踩雷而不自知。
当有一天食物成了罪魁祸首时,会面临一系列挑战,比如缺乏基础知识,对其诊断的延迟、不适当,而不正确的饮食管理更会放大该问题的影响,甚至带来营养缺乏,这对同时患有其他疾病的人群更是雪上加霜,这种情况下,了解食物不耐受就非常重要。
本文我们就来了解一下常见的食物不耐受的关键证据和科学理解,食物如何诱发其反应的机制及相关诊断,食物不耐受与肠道微生物群之间的复杂关系,这有助于我们更好地理解食物不耐受与身体症状的关联,从而采取措施来减轻其带来的不适。
“食物不耐受”(Food Intolerance)并不是一个最近出现的词,事实上,这个概念最早可以追溯到20世纪初。食物不耐受是指人体在消化某些食物时出现困难,这通常是由于缺乏特定的消化酶或者对食物中的某些成分有不良反应,但并不涉及免疫系统的反应。
在20世纪,随着医学和营养科学的发展,人们逐渐开始了解到并非所有的消化不良都是由传统意义上的疾病引起的,而有可能是由于身体对某些食物成分的不耐受。例如,乳糖不耐受是一种大家都知道的食物不耐受,它是由于身体内乳糖酶的缺乏或不足导致的,使消化乳糖变得困难。
在过去的二十年中,食物不良反应的病例显着增加,人们对食物不耐受的认识也不断深化,相关的研究不断增多。现如今,食物不耐受已经成为营养学和临床医学中的一个重要话题。
一般来说,食物不耐受的临床表现涉及多个器官或系统,常见症状包括:
但还有许多其他可能的症状,包括:
症状可能持续几个小时或几天。
不是。食物不耐受常常与食物过敏混淆。它们之间的区别在于其免疫基础。
食物不耐受主要是由于人体消化系统的问题导致对某些食物产生反应,但不涉及免疫系统。可由任何(非蛋白质)食物成分引起,比食物过敏更为常见。症状通常与食用量成正比,每次摄入都会有类似症状。有些人对乳糖不耐受,乳糖酶水平可能降低或缺乏。
而食物过敏涉及到免疫系统,对过敏食物的反应不仅与摄入量有关,即使很少量也可能引起严重反应。食物过敏的影响可能更严重,甚至可能涉及生命安全。
食物过敏的特征是摄入特定食物后,IgE介导的针对食物蛋白的抗体被激活。例如,对花生过敏的人可能会产生影响组织中肥大细胞和血液中嗜碱性粒细胞的反应。乳糜泻是一种 T 细胞介导的免疫反应,无 IgE 介导的反应。T 细胞免疫反应与更延迟的反应相关,这意味着症状在摄入后数小时或数天内出现,而不是在食用后立即出现。
总的来说,食物不耐受主要由消化问题引起,食物过敏则是由免疫系统的异常反应引起,两者机理上有区别。

有可能的。
虽然食物不耐受和食物过敏是由不同机制引起的,但一个人可能同时经历这两种情况。食物不耐受可能会加剧食物过敏的症状,反之亦然。此外,食物不耐受可能会导致肠道刺激和炎症,这可能会影响肠道菌群的平衡,进而影响免疫系统的反应。
据估计,食物不耐受影响多达 20% 的人口,但鉴于临床表现和非免疫机制差异很大,对诊断和管理的完全理解很复杂。
一项在瑞士儿童医院以及 4 家儿科私人诊所进行的横断面研究。共纳入2036名54个月至46岁(平均年龄:1.18岁)的儿童和青少年(7%为男性,4%为女性),其中316名(16%)参与者报告因不耐受而避免食物。乳糖不耐症是最常见的一种。在所有病例中,有55%没有进行任何医学检查来证实这种不耐受。251名(12%)参与者表示,出于假定的健康原因避免耐受的食物。
食物不耐受是由于身体无法消化某种食物或食物中的成分而引起的。
最常见的食物不耐受是乳糖不耐受。
当然,其他任何食物都可能与食物不耐受相关,例如:
◗ 麸质(小麦、黑麦和大麦)——存在于面包和面食等食物中
◗ 组胺——存在于葡萄酒和奶酪等食物和饮料中
◗ 咖啡因——存在于咖啡、茶和一些碳酸饮料中
◗ 亚硫酸盐——存在于苹果酒、啤酒和葡萄酒中
◗ 水杨酸盐——存在于一些水果、蔬菜、香草和香料中
◗ 谷氨酸钠 (MSG) – 存在于成熟的水果、腌肉和咸味食品中
doi.org/10.3390/nu15234969
遗传、消化系统疾病(IBS、IBD等)、消化酶缺乏、对食品添加剂的敏感性、肠道菌群失调、药物食物相互作用、食物中的自然毒素、压力和情绪等因素都可能与食物不耐受有关。具体原因取决于食物不耐受的类型。
接下来我们逐一了解常见的食物不耐受、原因、诊断、治疗/改善措施等。
小时候,大家喝牛奶基本没啥问题,但现在越来越多人开始出现乳糖不耐受。
这其中有些人是随着年龄的增长慢慢地出现乳糖不耐受,也有人是生病或者服用一些药物之后突然开始了乳糖不耐受…
●
当未消化的乳糖通过肠道而不被吸收时,就会发生乳糖吸收不良。管腔中未消化的乳糖会受到细菌发酵,增加渗透压,导致摄入乳糖后出现不耐受症状。当乳糖吸收不良伴有上述症状时,通常称为乳糖不耐受。
简单来说:
乳糖不能直接在肠道中吸收,而是必须被乳糖酶分解成两种较小的糖成分。
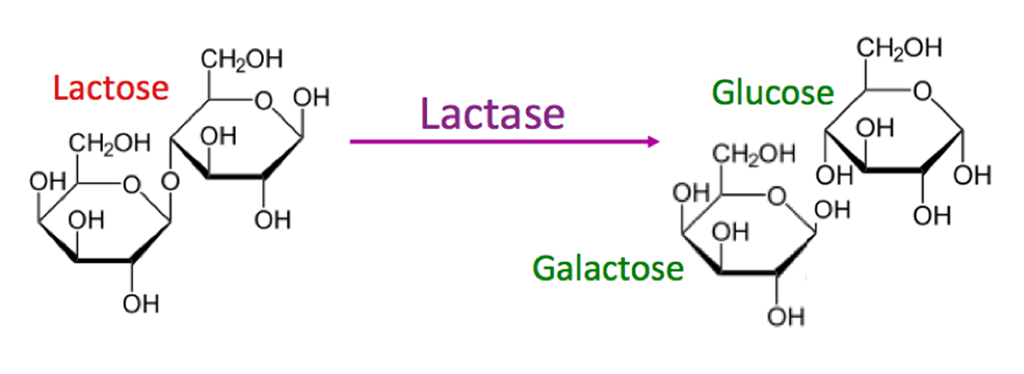
图源:evo-ed
乳糖酶缺乏可能导致乳糖不耐受。
主要原因有四个:
原发性乳糖酶缺乏或乳糖酶不持续
乳糖酶活性随着个体年龄的增长而逐渐下降。这种衰退从婴儿期开始,症状通常出现在青春期或成年早期。
乳糖酶持久性是由 2 号染色体上的显性基因突变引起的。乳糖酶不持久不是疾病而是遗传表型。
大约 70%–100% 的亚洲成年人口是乳糖酶非持久性 (LNP)基因型。
继发性乳糖酶缺乏症
继发性乳糖酶缺乏症是由肠上皮损伤引起的,可能发生在多种情况下,如胃肠炎、化疗、抗生素使用、乳糜泻、炎症性肠病、艾滋病、营养不良或吸收表面减少的情况,如短肠综合症。
乳糖酶活性的降低是暂时的、可逆的,一旦潜在的肠道损伤得到治疗或解决,乳糖酶活性的降低通常会得到改善。
先天性乳糖酶缺乏症
先天性乳糖酶缺乏症是一种极其罕见的儿科疾病,会导致婴儿出现严重症状和发育不良。这种情况源于常染色体隐性遗传模式,导致出生时乳糖酶活性降低或缺失。
发育性乳糖酶缺乏
在妊娠28-37周之间出生的早产儿中观察到发育性乳糖酶缺乏症。在这些情况下,婴儿的肠道发育不全导致无法分解乳糖。然而,随着年龄的增长,随着肠道的成熟和喂养,特别是母乳喂养,这种情况通常会改善。
乳糖吸收不良,无论是由于原发性还是继发性乳糖酶缺乏,都会导致未消化的乳糖与肠道微生物群相互作用。
乳糖的细菌发酵会产生短链脂肪酸(乙酸盐、丙酸盐和丁酸盐)和气体(氢气、二氧化碳,有时还有甲烷)。当乳糖的量超过结肠微生物群的发酵能力,或者短链脂肪酸的负荷超过结肠的吸收能力时,就会发生腹泻。水的渗透滞留进一步增加了结肠中的渗透负荷,从而放大了效果。
个体可能患有乳糖酶缺乏症但没有症状。
在出现临床表现的情况下,症状包括腹胀、腹痛、胀气、腹泻,有时还包括恶心。
症状的严重程度可能有所不同,大多数人可以耐受相对少量的乳糖而不会感到不适。
一些方法可以检查一个人是否有乳糖不耐症,如基因检测、酶活性测试、呼气测试等。在这些检测中,小肠活检测量乳糖酶的活性是最精确的方法,但是需要通过内窥镜检查直接从小肠壁取样,这种侵入性的方法通常不作为首选诊断手段。
乳糖呼气测试是一个更简单、不伤身体的方法,用来看一个人消化乳糖的能力,以及是否因为吃了乳糖而有不适的症状。
但是,这些测试有一个问题:有的人虽然测试显示他们有乳糖不耐症,但是他们吃乳糖后并没有不舒服,所以测试结果并不能完全确定不舒服是不是因为乳糖不耐症造成的。
为了解决这个问题,有些时候在做呼气测试的时候会用一些标准化的问卷,或者用盲测(测试者不知道他们吃的是不是含乳糖的东西)。盲测特别有用,因为很多时候人们自己说的乳糖不耐症的症状和客观结果之间的相关性较低,特别是在有肠易激综合征(IBS)的人群中。
总的来说,乳糖不耐症的诊断可以通过准确的病史和临床评估,并在避免含乳糖的食物 5-7 天后通过症状消退来确诊。
可以和其他食物一起吃
如果乳糖与其他营养素一起食用,耐受阈值就会升高。
因此,一种解决方案可能是将乳糖与其他食物一起食用,以减缓胃排空和小肠运输,从而使乳糖有更多时间分解和吸收,从而减少出现症状的可能性。
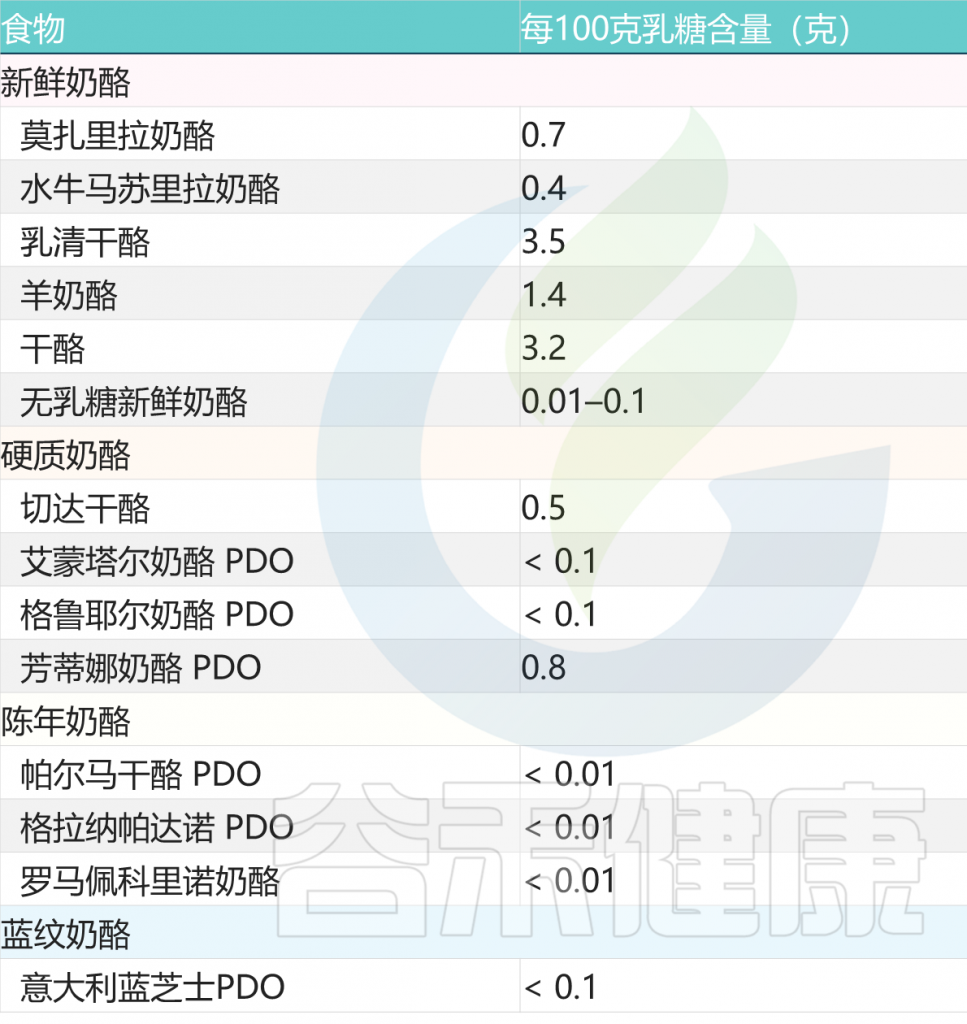
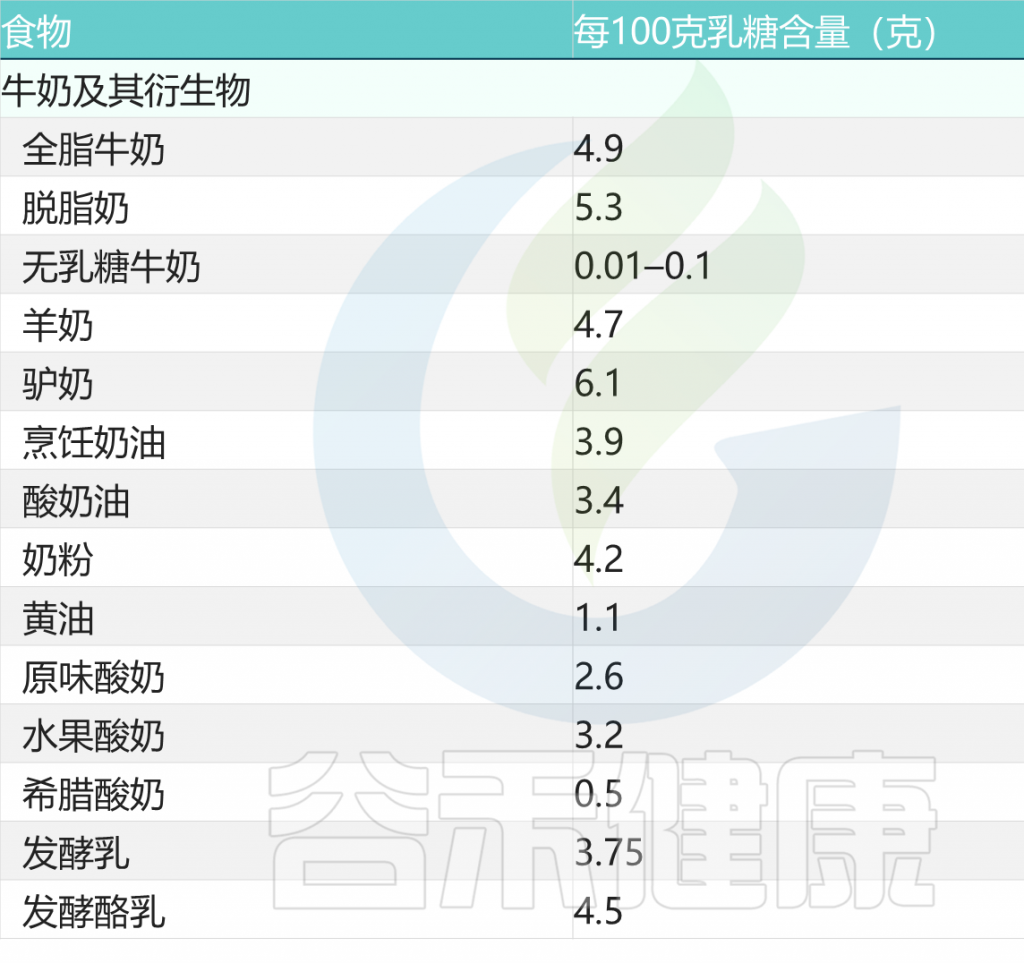
陈年奶酪也是比较好的选择
与新鲜奶酪不同,陈年奶酪几乎不含或不含乳糖。事实上,在成熟过程中,细菌消耗了所有存在的乳糖。
常见奶酪类乳制品的乳糖含量
doi: 10.1186/s12967-020-02429-2
无乳糖食品
为了确保乳制品中所含物质的摄入不会因乳糖而引起腹部不适,现在有一些无乳糖食品。从营养的角度来看,它们与经典乳制品相当,不同之处在于它们不含乳糖。不含乳糖、添加乳糖酶的乳制品通常被认为是安全的。
技术的不断进步正在不断提高无乳糖乳制品的营养价值、功能、感官吸引力和质量。这些发展旨在为乳糖不耐症患者提供更多样、更可口的选择,同时确保最佳营养摄入和整体健康。
也可以喝牛奶,但一开始量不建议太多
对于乳糖不耐受患者,如今不再建议避免食用所有乳制品,因为大多数乳糖不耐受患者可以耐受每单剂量最多 5 克乳糖,大约相当于 100 毫升牛奶,并且可能比严格的无乳糖饮食有好处。
常见牛奶类乳制品的乳糖含量
doi: 10.1186/s12967-020-02429-2
摄入乳糖后出现症状的可能性受到多种因素的影响。
外在因素包括:
内在因素包括:
我们详细看一下,肠道微生物组成这个内在因素发挥的作用。
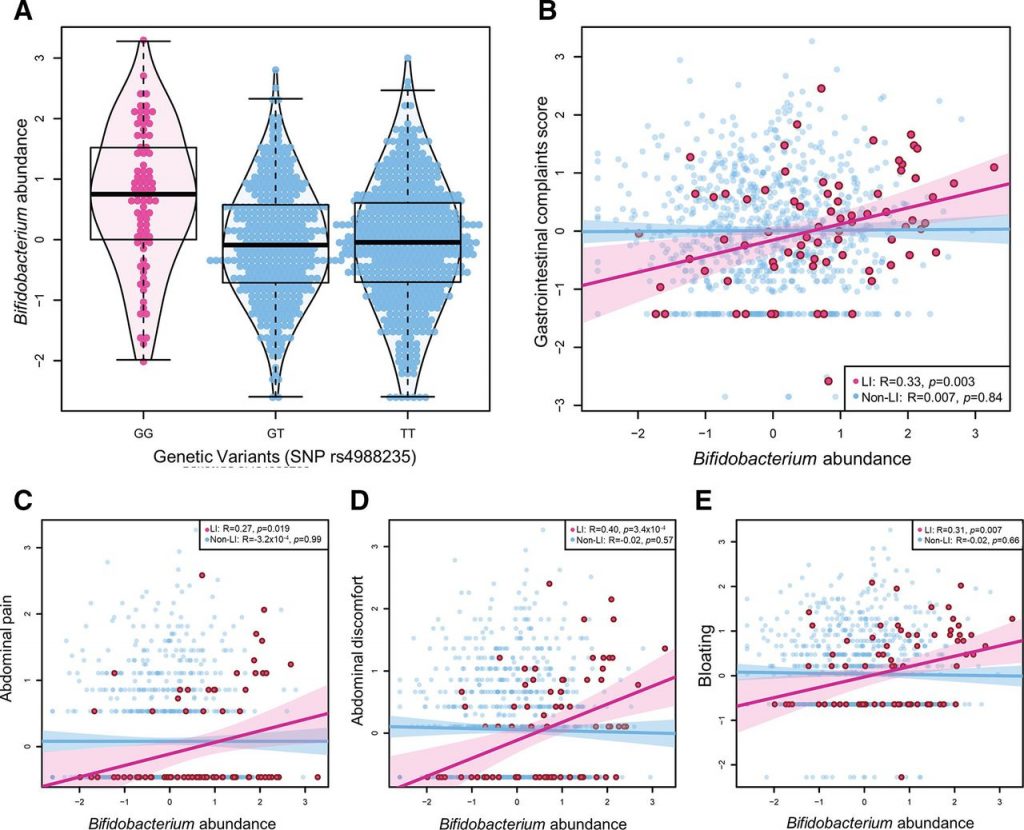
有研究发现,与非乳糖不耐受个体相比,在乳糖不耐受个体中双歧杆菌丰度增加( P Wilcox =4.56×10 -9 ),并且与乳糖不耐受组的乳制品摄入量呈正相关 (R=0.22,p =0.05)。乳糖不耐受组和非乳糖不耐受组之间的乳制品摄入量没有显著差异。在乳糖不耐受个体中,双歧杆菌丰度与总肠道不适评分之间呈正相关(R=0.33,p=0.003)。
在六种特定的肠道疾病中,双歧杆菌丰度与腹痛、不适和腹胀呈正相关,但与任何其他疾病无关。研究人员发现乳制品摄入量与胃肠道不适之间的关联部分是由双歧杆菌丰度介导的(Prop介导=43%,p=0.054)
乳糖不耐症个体的双歧杆菌丰度和肠道不适
doi.org/10.1136/gutjnl-2020-323911
A)与 SNP rs4988235 的乳糖耐受基因型(G/T 和 T/T)相比,乳糖不耐受基因型(纯合 G/G)个体的双歧杆菌丰度更高。
B) 在乳糖不耐受个体中,双歧杆菌丰度与胃肠道症状总评分显著相关 (p=0.003)。
更具体地说,双歧杆菌丰度与 (C) 腹痛、(D) 胃肠道不适和 (E) 腹胀呈正相关。
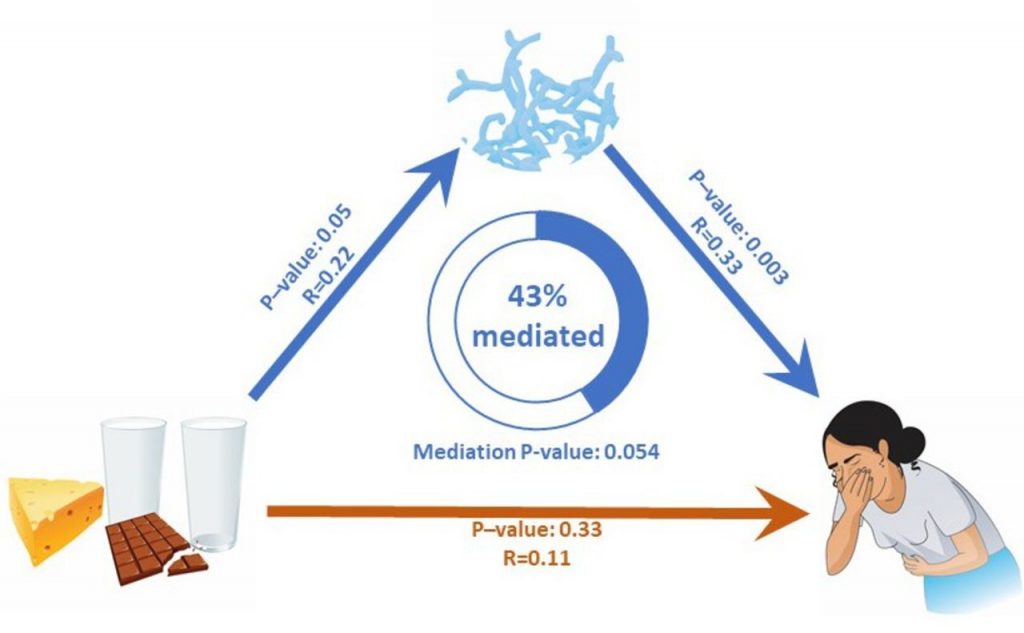
分析牛奶摄入量、双歧杆菌丰度和肠道不适之间的直接和间接关系
doi.org/10.1136/gutjnl-2020-323911
具有统计学意义的关联用蓝色箭头显示。
红色箭头表示不显著的相关性。
乳糖不耐受个体中与乳制品消费相关的肠道不适很大程度上是由双歧杆菌丰度介导的。
该研究结果证明,乳糖不耐受患者所经历的特定肠道症状可能是肠道中双歧杆菌丰度的结果,而不是乳糖摄入的直接影响。这项工作支持了初步报告,乳糖发酵细菌的代谢产物可能与乳糖不耐受症状的发生有关。
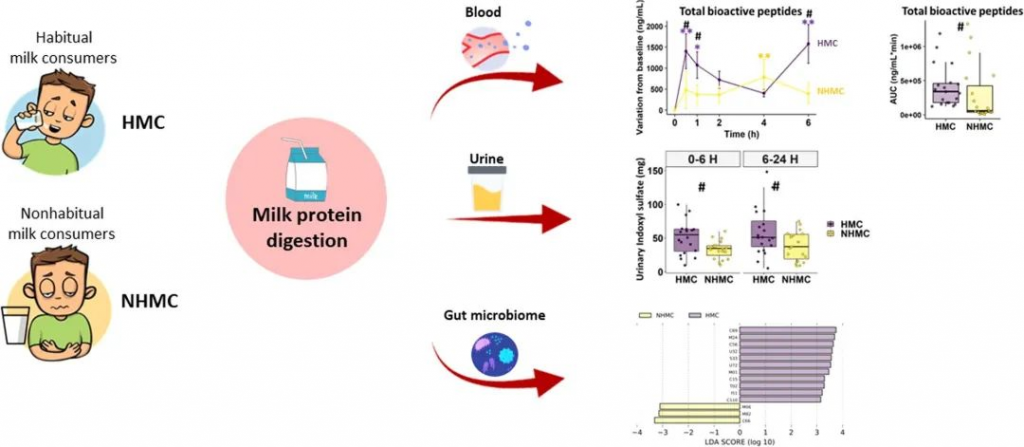
许多健康人尽管没有乳糖不耐症,但患有与牛奶相关的胃肠道不适;造成这种情况的机制尚不清楚,这可能与他们体内牛奶蛋白消化相关的生理反应有关。这种差异可能源于他们肠道微生物组的特定构成,这反过来又受到他们的饮食习惯影响。我们来看一项研究 ↓↓
该研究旨在探讨19名耐乳糖健康非习惯性牛奶消费者[NHMCs]在食用牛奶后报告胃肠不适的牛奶蛋白消化和相关生理反应(主要结果)、肠道微生物组和肠道通透性,并与20名没有胃肠不适的习惯性牛奶消费者[HMCs]进行比较。
doi.org/10.1016/j.foodres.2023.112953
结果表明,与习惯性牛奶消费者相比,非习惯性牛奶消费者中的牛奶消耗量以及胃肠不适导致循环BAP缓慢而较低的增加,胃饥饿素(ghrelin)、胰岛素和内源性大麻素的反应较低,葡萄糖反应和血清DPPIV活性较高。
两组的肠道通透性相似,而习惯饮食(非习惯性牛奶消费者中乳制品含量较低,膳食纤维与蛋白质比例较高)可能形成了肠道微生物组;非习惯性牛奶消费者表现出双歧杆菌丰度较低、普氏菌丰度较高和蛋白酶编码基因丰度较低等特点,这可能会降低蛋白质消化,如硫酸吲哚的尿排泄量较低所示。
总之,研究结果表明,由于肠道微生物组较低的蛋白水解能力,牛奶蛋白质的消化效率较低,这可能解释健康人食用牛奶后的胃肠不适。
在精准医疗和个性化营养时代,该研究的结果有利于个性化饮食疗法。也就是是,患有牛奶相关胃肠道不适的健康人可能会受益于基于蛋白水解酶的疗法或针对微生物组的临时干预。此外,在个性化饮食方法中,牛奶相关的胃肠道不适可以通过食用含有预消化牛奶蛋白的牛奶食品来管理。食用在肠道中发挥蛋白水解活性的益生菌可能会进一步减轻敏感个体的胃肠道疾病和焦虑。
以前可能会建议乳糖不耐受患者尽量避免乳制品。但实际上,牛奶和乳制品是钙、磷、胆碱、核黄素、维生素 B12 和维生素 A 的主要来源,排除所有乳制品有可能会导致微量营养素缺乏。
从饮食中完全消除乳制品相关的主要风险是缺钙和损害骨骼健康。
* 膳食钙的最佳来源包括牛奶、奶酪、乳制品,西兰花、羽衣甘蓝、羽衣甘蓝、萝卜叶菜等。
大多数分析研究得出的结论是,乳制品是适当骨骼状态所需营养的极好来源,且在不食用乳制品的情况下达到建议的钙摄入量是具有挑战性的。
然而,对于乳糖不耐受的个体来说,摄入乳制品可能导致消化不适和其他相关症状。这就引出了一个重要的问题:如何在不引发消化不适的情况下为这些个体提供必要的营养素?
还是可以从肠道菌群的角度去考虑,因为肠道菌群的稳态,可能会帮助本来乳糖不耐受的人群慢慢适应乳糖。
我们来看最新的一项研究,该研究展示了乳糖酶非持久性基因型(LNP)个体每天补充乳糖前后肠道微生物群和乳糖不耐受症状的变化。
该研究前后为期 12 周,纳入了 25 名携带 LNP 基因型的亚洲裔健康成年人。参与者逐渐增加乳糖剂量,从每天两次 3 克到 6 克到 12 克,连续 4 周每天提供 6 克、12 克或 24 克的剂量。参与者在 12 周干预前后提交了重复的粪便样本,并接受了 25 克乳糖挑战氢呼吸测试 (HBT)。记录乳糖挑战期间的每日胃肠道症状和总症状评分(TSS)。
结果发现,干预后双歧杆菌相对丰度从 5.5% ± 7.6% 显著增加至 10.4% ± 9.6% (P =0.009),粪便 β-半乳糖苷酶活性增加2倍(570±269U/g;P <0.001),与基线 (272 ± 158 U/g) 相比。
双歧杆菌的β-半乳糖苷酶活性使这些个体能够更有效地消化乳糖。
双歧杆菌通过双歧分流发酵糖,比通过糖酵解发酵产生更多的 ATP,从而产生竞争优势。乳酸和乙酸盐是双歧杆菌乳糖发酵的主要代谢产物,不会产生氢气、二氧化碳或甲烷等气体。
乳酸和乙酸盐是肠道中其他细菌的底物,如产丁酸的Anaerostipes。Anaerostipes的相对丰度也因乳糖干预而增加。
双歧杆菌和Anaerostipes之间的交叉喂养可能发挥作用。这种交叉喂养产生的丁酸盐是肠细胞的重要能量来源,在改善肠道屏障功能方面发挥作用,并发挥抗炎活性。
乳糖干预前后优势属和双歧杆菌属的平均相对丰度
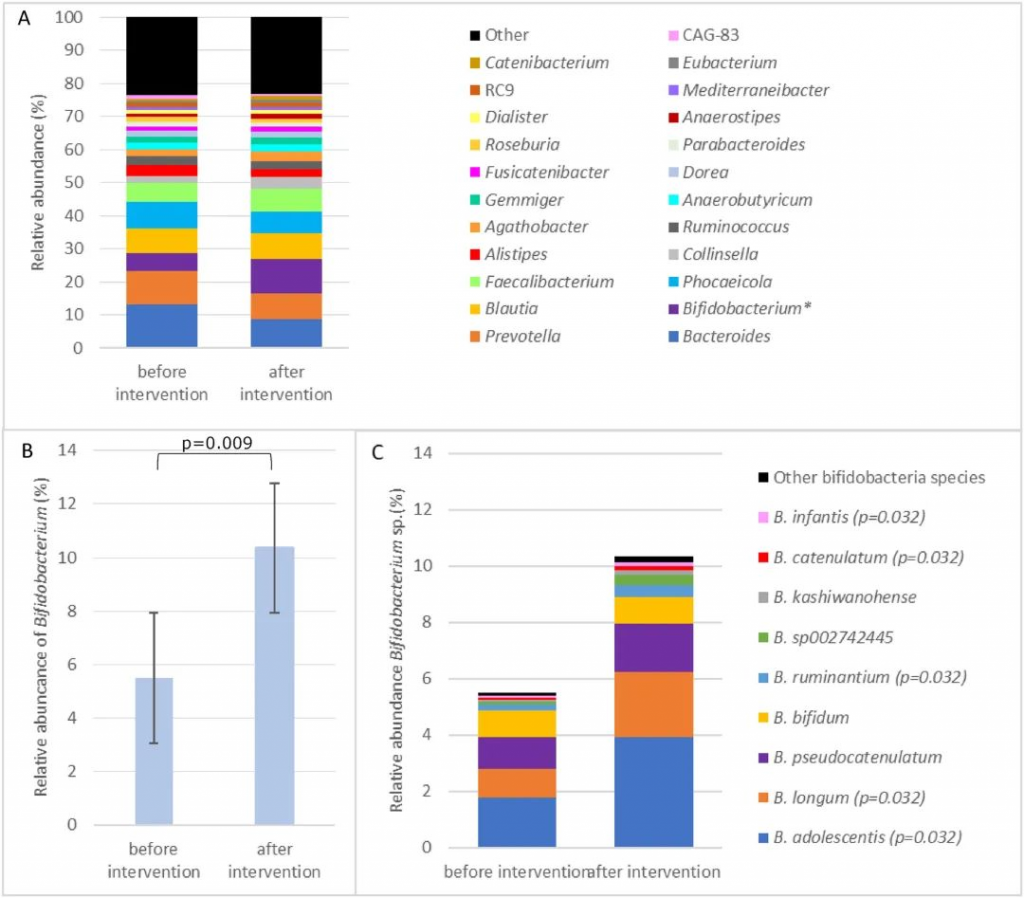
doi.org/10.1016/j.ajcnut.2023.12.016
与基线 HBT (57 ± 38 ppm·min) 相比,第二次 HBT (38 ± 35 ppm·min) 期间观察到呼出氢气减少 1.5 倍(曲线下增量面积;P = 0.01)。这也证实了双歧杆菌发酵不产生氢气,双歧杆菌多了,氢气就少了。
TSS 无显著下降(干预前为 10.6 ± 8.3,干预后为 8.1 ± 7.2;P =0.09)。
12 周乳糖干预前后的乳糖氢气呼气测试
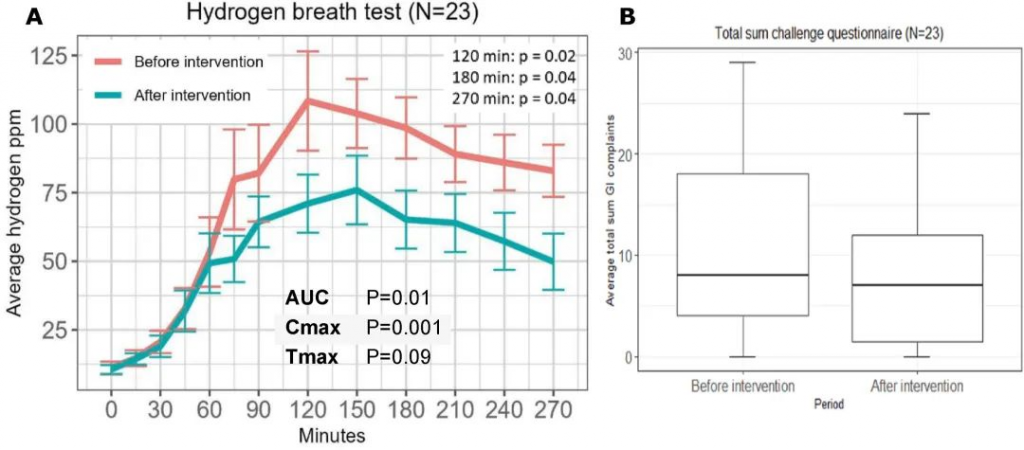
doi.org/10.1016/j.ajcnut.2023.12.016
每日摄入乳糖的耐受性良好,在干预期间报告有轻微甚至没有胃肠道不适。
双歧杆菌水平的增加表明肠道微生物群在重复消耗增量剂量的乳糖后发生了适应,第二次 25 g 乳糖 HBT 期间呼出的氢气浓度降低证明了肠道菌群的耐受性良好。双歧杆菌代谢乳糖而不产生气体,从而可能减少具有 LNP 基因型的个体肠道内气体的形成。
一些古代游牧民族可能就是通过这种肠道微生物组的改变适应了乳制品饮食,他们没有乳糖酶持续活性的遗传证据。
这表明,即使在遗传上缺乏分解乳糖的能力,人们也可能通过其他生物学机制,比如肠道菌群的改变来适应乳制品。
这种增加的乳糖耐受性可能消除了完全从饮食中去除乳制品的必要性。
上述研究我们了解到,既然肠道菌群的调整可以帮助逐渐适应乳糖,那么这可能会为乳糖不耐受者提供新的策略,通过益生菌、益生元等方式可以调节肠道菌群。
益生菌
益生菌经常被添加到乳制品中,既作为发酵剂又作为食品添加剂。例如乳杆菌、长双歧杆菌或动物双歧杆菌,它们在肠道中产生乳糖酶。
2022 年发表的文献包括使用益生菌双歧杆菌900791、罗伊氏乳杆菌DSM 17938和嗜酸乳杆菌DDS-1 的三项研究,共 117 名受试者。结果显示,只有罗伊氏乳杆菌DSM 17938 表现出症状显著改善和呼出氢气减少,而嗜酸乳杆菌DDS-1 表现出乳糖不耐受症状显著改善。
最近的一项荟萃分析包括 12 项研究,总样本量为 263 名患者,结果发现服用益生菌可以缓解乳糖不耐受症状。
摄入乳酸菌可以缓解乳糖不耐受的症状,但这些细菌可能不会在结肠中持久存在。一个新策略是“喂养”乳酸菌,益生元人类无法消化,但乳酸菌可以吃。在初步的临床试验中,使用这种“益生元”的受试者报告说乳糖耐受性有所改善,并且他们的肠道微生物组也相应发生了变化。
益生元
最近的一项系统回顾包括两项研究,其中在总共 462 名受试者中研究了短链低聚半乳糖 GOS (RP-G28) 的功效。作者发现,GOS (RP-G28) 在治疗阶段以及停止后 30 天内显示出乳糖不耐受症状的改善。
一项针对 377 名乳糖不耐受患者的随机安慰剂对照研究报告称,定期摄入短链 GOS (RP-G28) 发现,与安慰剂相比,总体评估结果显著改善,并且五种双歧杆菌分类群显著增加。
以上是研究中发现的部分有效果的益生菌和益生元,但对于每一位乳糖不耐受个体是否有效,效果是否持久,还需要结合肠道菌群检测报告辅助评估。比如某患者的有益菌并不是显著缺乏,但是其肠道菌群中某些条件致病菌超标,可能会加重乳糖不耐受的症状,这就需要医生或专业人士综合评估给出个性化干预建议。
此外,了解停止补充后某些症状恶化可能与哪些菌群及其相关代谢有关,也能帮助医生和患者更有针对性地进行干预,以达到更好的健康效果。
一类特定的食物不耐受与麸质摄入有关。
乳糜泻和小麦过敏是众所周知的病理状况,会引发独特的免疫反应。乳糜泻涉及主要针对胃肠道的自身抗体的产生,而小麦过敏会引发 IgE 介导的反应,过敏可能会导致瘙痒、呕吐或呼吸急促。
然而,有一部分人在食用麸质后会出现肠道和肠外症状,但没有表现出乳糜泻特异性抗体或过敏生物标志物。这些人被归类为患有非乳糜泻麸质敏感性 (NCGS),与乳糜泻不同,麸质敏感性不会损害小肠,麸质不耐受症状也往往比乳糜泻症状出现得更快,一般在食用麸质后几分钟到几小时内就出现了。
这种病症首次在 20 世纪 80 年代被描述,当时一名 43 岁的患者出现腹泻,但缺乏乳糜泻的生物标志物。该患者在采用无麸质饮食(GFD)后表现出显著改善。
典型的肠道症状包括:
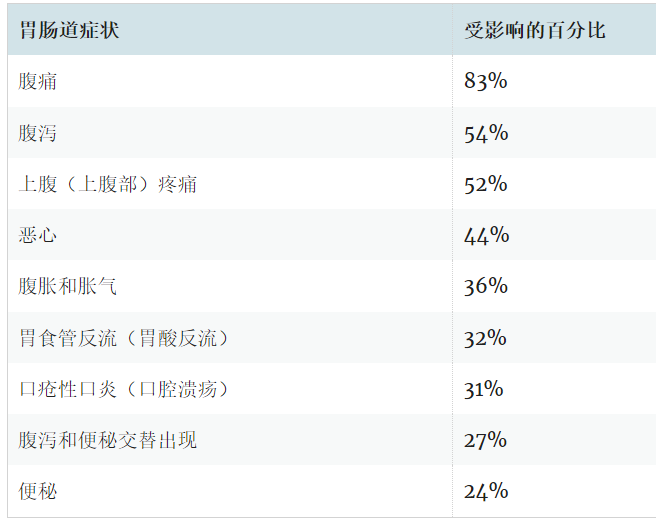
肠外表现可能包括:
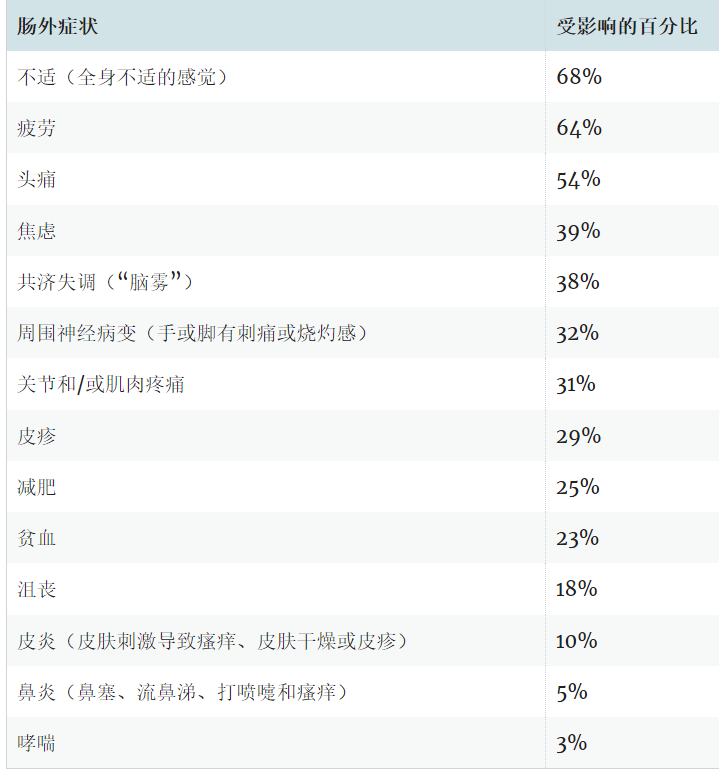
症状通常在摄入麸质后数小时至数天内出现,并在从饮食中去除麸质后消失。
通常,许多非乳糜泻麸质敏感性患者有乳糜泻或食物过敏家族史,并且还与桥本甲状腺炎和糖尿病等其他自身免疫性疾病相关。
麸质不耐受和乳糜泻虽然都是与麸质有关,都会引起胃肠道症状,如胃痛、腹胀、恶心和腹泻,但具有不同的生理机制和临床表现。

哪些食物中含有麸质?
小麦、大麦和黑麦都是含麸质的谷物。麸质也会出现在许多加工食品中,尤其是那些以这些谷物为基础或含有这些谷物成分的食品,例如:
小麦中的其他成分也可能引发不耐受
无麸质饮食在大多数情况下可以有效减轻症状,但一些 NCGS 患者尽管在诊断后多年遵循严格的无麸质饮食,但仍然报告症状。这表明除麸质外,小麦的其他成分可能是造成这些 NCGS 患者症状的原因。
小麦含有多种蛋白质,根据其功能可分为结构蛋白、功能蛋白或储存蛋白。其中,80%是储存蛋白,包括麦醇溶蛋白和麦谷蛋白,它们有助于麸质的形成。
注:这是一种蛋白质网络,赋予面包和硬质小麦面团独特的粘弹性。
这些储存蛋白富含脯氨酸,这使得它们能够抵抗肠道蛋白水解酶。高脯氨酸含量会导致免疫原性肽的产生,从而引发炎症和氧化应激反应。
麸质作为不耐受罪魁祸首的确切作用尚不完全清楚。小麦含有 2-4% 的淀粉酶胰蛋白酶抑制剂 (ATI),这也会加剧肠道免疫反应并增加炎症。
注:ATI是植物来源的蛋白质,可以使小麦具有抗虫性(能够抵抗黄粉虫和臭虫的损害)。
小麦中还包含一些果聚糖,这些也会在小肠中缓慢吸收,并被肠道细菌快速发酵,导致气体产生和腹胀。一项双盲交叉挑战,以检查麸质和果聚糖对自我报告的NCGS患者的影响。结果显示,在这一组中,似乎是果聚糖而不是麸质引发了更显著的胃肠道症状。
麸质不耐受其实比乳糜泻更常见。任何人都可能患有麸质不耐受,但在 30 岁- 40 岁之间人群发病率较高,在女性中更为常见。
也有研究认为,在儿童中,男性 NCGS 的患病率高于女性。
由于缺乏对该疾病及其致病原因的了解,因此没有可以诊断NCGS的实验室测试或影像学研究。诊断主要基于测试和排除所有其他可能的原因。
乳糜泻:通过可检测乳糜泻自身抗体的血液检查和小肠活检以检查绒毛萎缩来诊断。
小麦过敏:通过过敏血液测试、皮肤点刺测试或斑贴测试来诊断。
可能会进行其他测试以排除其他可疑原因。
如果排除乳糜泻和小麦过敏,可能会建议吃无麸质饮食六周,然后重新摄入麸质一周。一些人认为,饮食能使症状改善30%,重新引入麸质能使症状增加30%,即可诊断为非乳糜泻麸质敏感性。
IBS和NCGS的症状相似可能导致错误的诊断和无效的治疗。一例临床病例描述一名 49 岁女性,曾被诊断患有 IBS。患者主诉腹痛、便秘、胃酸反流和头痛。
考虑并最终排除以下情况:自身免疫性疾病、甲状腺激素水平异常、幽门螺杆菌感染。在不适当的治疗过程中,患者出现了类似系统性红斑狼疮的症状。此外,患者在服用皮质类固醇后表现出一些改善,这也很难做出正确的诊断。最终,经过多年的不当治疗,才发现是NCGS。
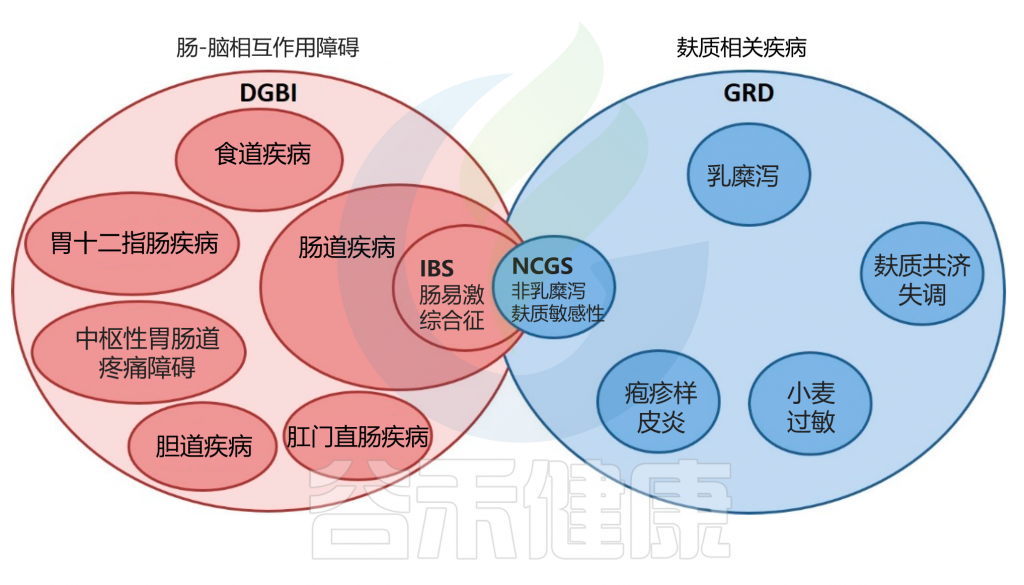
当然一些研究表明 NCGS 可能是发生 IBS 的主要触发因素。事实上,由于NCGS 和类似 IBS的症状往往重叠,因此诊断过程特别具有挑战性。
IBS 和 NCGS 之间的重叠
doi.org/10.3390/nu12123735
通常需要通过详细的病史收集、排除其他医学原因、饮食日记记录以及可能的饮食干预来辅助诊断。同时,也可以结合肠道菌群健康检测辅助判别,如果检测到肠道中某些细菌的增多,这些菌参与的代谢途径可能与小麦或麸质摄入有关,这可能支持NCGS的诊断。如果在饮食中去除小麦或麸质后肠道菌群发生了积极的变化,并且症状得到缓解,这也有助于NCGS诊断。
在进行诊断时,需要综合考虑多种因素,肠道菌群检测的结果与临床症状、病史、其他实验室测试和可能的饮食干预结果一起考虑,可以更加全面地加以评估。
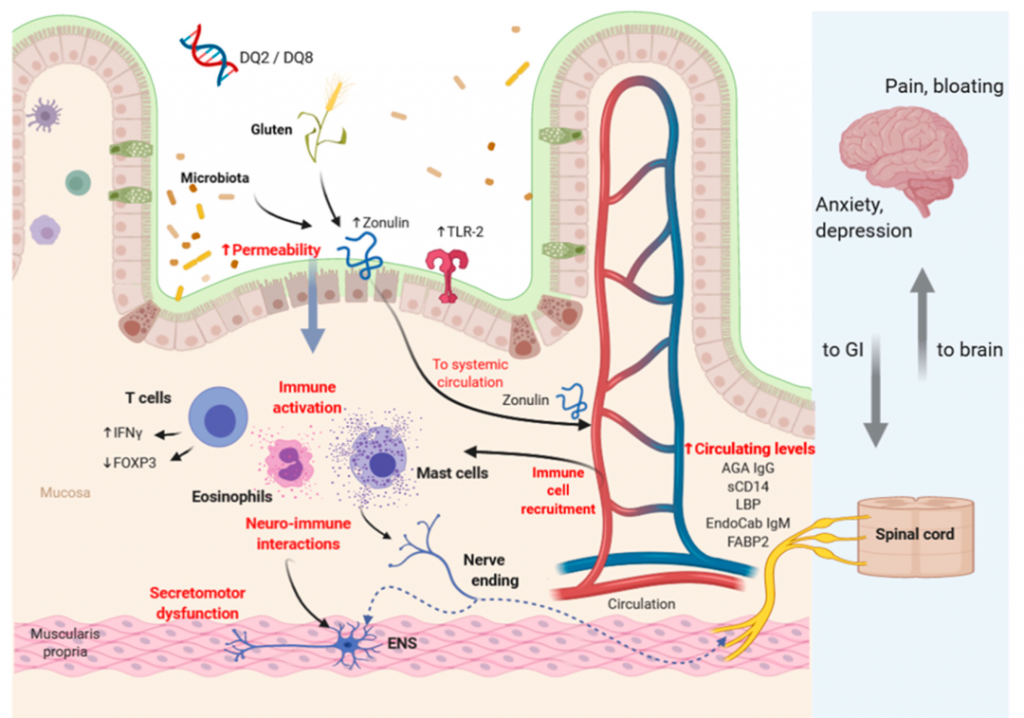
NCGS 的病理生理学涉及免疫激活、通透性改变、神经免疫相互作用和遗传因素。麸质和微生物群可以增加上皮通透性,有利于不同抗原进入粘膜并随后激活免疫系统。神经免疫激活和分泌运动功能障碍可能影响大脑活动。
非乳糜泻麸质敏感性病理生理学中涉及的潜在机制
doi.org/10.3390/nu12123735
从组织学角度来看,与健康个体相比没有太多差异,因为正常的绒毛结构维持在十二指肠水平。上皮内淋巴细胞(IEL≤25/100肠细胞)的截止值用于定义正常十二指肠组织学,对应于Marsh 0。然而,归类为非乳糜泻麸质敏感患者显示十二指肠上皮内淋巴细胞计数增加(>25/100肠细胞),对应于Marsh I 病变。
绒毛上皮中 IEL 的不规则分布和簇状分布作为支持 NCGS 诊断的组织学发现,但需要更大规模的研究来证实。
最近一项多中心研究发现,即使在绒毛结构的Marsh 0期,非乳糜泻麸质敏感患者十二指肠粘膜也表现出与肠腔抗原反应一致的独特变化。非乳糜泻麸质敏感患者固有层水平存在嗜酸性粒细胞,这表明这种情况可能更接近于食物过敏。
Zonulin是一种在调节肠屏障通透性方面发挥作用的蛋白质。有人认为,在HLA-DQ2/8阳性个体中,非乳糜泻麸质敏感患者中zonulin增加,而在采用无麸质饮食后降低,因此可以用于与腹泻型肠易激综合征(IBS-D)进行鉴别诊断。
肠道微生物群与麸质相关疾病之间的关系很复杂。人类肠道中存在大量能够水解麸质蛋白和肽的细菌。
NCGS 患者表现出有益菌种(双歧杆菌)的减少和促炎细菌(肠杆菌科和大肠杆菌)的增加。
上皮水平上的 Toll 样受体 (TLR 2-4) 会因病原微生物而被激活。肠道微生物群的参与,非乳糜泻麸质敏感性患者中致病性拟杆菌门增加,腐生菌(厚壁菌门)减少。这种失调可能会导致患者出现腹胀,这可能是由于发酵增加所致。
在分子水平上,观察到Claudin-4的增加,这是负责细胞旁通透性的紧密连接的组成部分。因此,对非乳糜泻麸质敏感性提出了“漏肠”假设,表明肠屏障受损。这可以导致食物成分(如麸质)和其他外来物质更容易穿越肠道壁,这可能触发免疫反应和炎症,增加对麸质的敏感性。
★ 无麸质饮食
大多数麸质不耐受患者通过遵循无麸质饮食可以缓解症状。
无麸质饮食中可以吃的谷物有:
藜麦、糙米、野米、高粱、木薯、小米、燕麦等
麸质存在于无数食品、饮料和其他产品中,仔细阅读食品和饮料标签,了解哪些食物、饮料和成分含有麸质。
低麸质饮食通过调节肠道菌群改善不耐受
一项研究比较了60名丹麦成年人,他们分别接受了8周的低麸质饮食和8周的高麸质饮食。低麸质饮食改变了粪便微生物组,降低了双歧杆菌、Dorea、Blautia、Lachnospiraceae的相对丰度,以及两种产丁酸的细菌Anerostipes hadrus和Eubacterium hallii。然而,低麸质饮食也增加了梭状芽孢杆菌目和毛螺菌科一个未分类物种的相对丰度,这两个类群产丁酸。
总能量、纤维和FODMAP的摄入量在两种不同的饮食条件下没有变化。低麸质饮食减少了餐后的呼吸氢,减轻了自我报告的腹胀。它还显著增加了饱腹激素PYY的产生,并导致体重减轻。低麸质饮食可以降低血清IL-1β,这是参与炎症反应的分子。
需要更多的研究来了解不同的无麸质饮食如何影响粪便微生物组和免疫系统。
其他饮食方式也包括:
★ 低ATI饮食
我们前面讲到,小麦中的除了麸质之外的其他成分也可能引发消化道症状,其中也会ATI 可能会促进 NCGS 中出现的肠道炎症症状,这与乳糜泻不同。
应避免的 ATI 含量高的食物包括黑麦、大麦、小麦(以及所有小麦产品变体)以及含麸质的食物。
★ 益生菌
益生菌可能减轻麸质敏感个体的影响。在细胞培养和动物研究中,已发现某些长双歧杆菌(NCC2705 和 CECT 7347)、动物双歧杆菌(乳酸亚种)和鼠李糖乳杆菌 (GG) 菌株可减弱醇溶蛋白对肠粘膜的破坏作用。
在一项针对新诊断克罗恩病儿童的随机安慰剂对照试验中,长双歧杆菌 CECT 7347 补充剂三个月可改善生长参数,降低潜在促炎菌属脆弱拟杆菌的丰度,并减少粪便分泌 IgA,表明肠道免疫系统不再处于“高度警戒”状态。
另一项针对无麸质饮食的克罗恩病患儿的研究发现,补充短双歧杆菌(BR03 和 B632)三个月可显著降低循环 TNFα,这是全身炎症的标志物。停止补充益生菌三个月后,TNFα水平再次升高。
总的来说,补充益生菌在减轻麸质造成的损害和改善麸质敏感个体的整体健康方面潜力很大。
不过,在补充益生菌之前,最好进行肠道菌群健康检测,因为益生菌的效果因人而异,可能受到个体肠道菌群的影响。假如某位麸质不耐受患者本身长双歧杆菌较多,补充长双歧杆菌不一定有用,那么可能需要结合该患者的总体肠道菌群检测报告来看,哪些菌群不平衡,过多或多少带来怎样的健康风险,对麸质不耐受可能产生什么样的影响,综合评估是否需要补充以及什么方案更适合总体健康。
★ 益生元
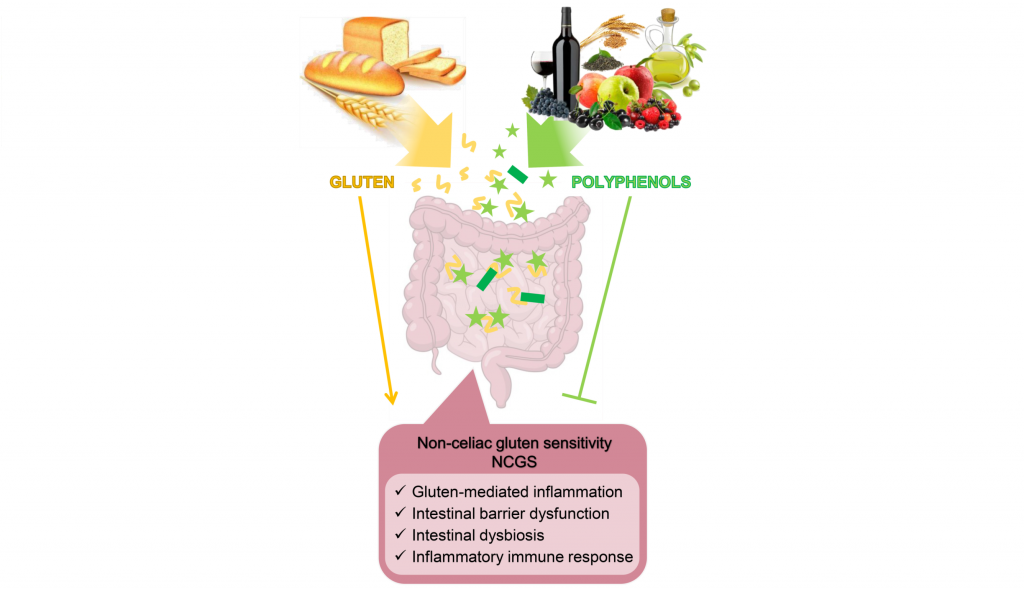
多酚是我们饮食中常见的植物化学生物活性成分。多项研究表明,多酚可以通过与蛋白质等其他大分子相互作用来发挥促进健康的特性,优先与富含脯氨酸的蛋白质结合,例如麸质蛋白。
doi.org/10.3390/nu14132679
多酚通过改善肠道菌群缓解 NCGS 症状
作为益生元底物,多酚刺激有益细菌种类的生长和活性,例如Akkermansia muciniphila、多形拟杆菌(Bacteroides thetaiotaomicron)、Faecalibacter prausnitzii 、双歧杆菌、乳杆菌,促进微生态转变,发挥其抗炎、抗氧化、免疫和屏障完整性保护作用,从而在肠道和全身水平上抑制麸质的毒性作用。
NCGS 中多酚及其代谢物的潜在目标
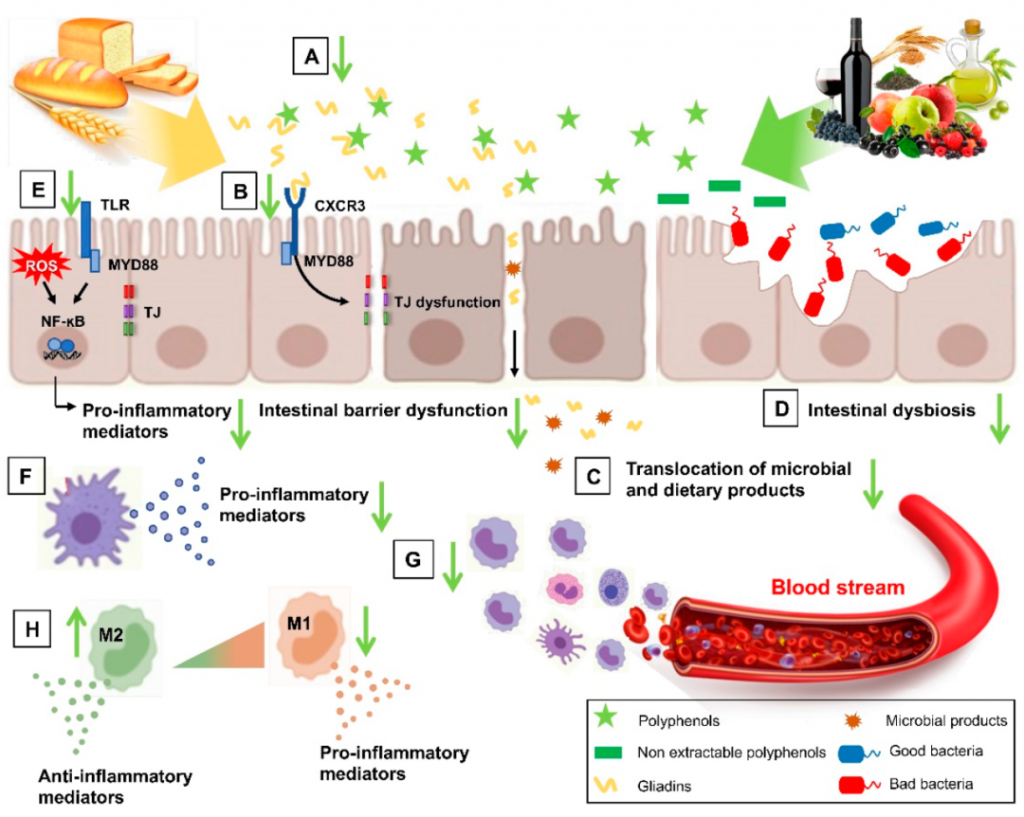
doi.org/10.3390/nu14132679
多酚可以结合并隔离麸质,降低麸质的生物利用度(A);它们可以抑制麦醇溶蛋白肽和 CXCR3 受体之间的相互作用,恢复改变的肠道通透性(B),然后减少微生物和膳食产品的易位(C);它们还可以改善肠道菌群失调,肠道屏障功能障碍(D)。多酚可以削弱肠道水平的氧化应激和炎症诱导途径 (E),并抑制压倒性的炎症免疫反应(F),减少固有层 (G) 中骨髓细胞的募集,并增加 M2 极化抗炎巨噬细胞 (H)。
富含多酚的食物包括:
橄榄油、红葡萄/葡萄酒、水果(浆果类如蓝莓、草莓、黑莓和覆盆子等)、蔬菜(如洋葱、茄子、菠菜等)、谷物(豆类如黑豆和红豆等)、坚果(如核桃、杏仁)、可可、咖啡、茶等。
现在“无麸质饮食”的概念越来越流行,无麸质饮食可以说是欧美健康饮食界近几年的流行饮食方式,甚至很多健康人包括各类博主也开始遵循无麸质饮食,然而这也可能会伴随一些健康风险。
与遵循常规饮食的受试者相比,无麸质饮食与常量营养素(例如饱和脂肪和糖)的消耗增加以及微量营养素(例如铁、叶酸和锌)的摄入量较低有关。
也有研究表明,健康成人持续无麸质饮食后,双歧杆菌、乳酸杆菌和长双歧杆菌减少,而肠杆菌科和大肠杆菌增加。
无麸质饮食饮食明显影响多种菌群的丰度,特别是那些专门参与碳水化合物和淀粉代谢的物种,如韦荣氏球菌科。
无麸质饮食也可能会导致下列风险增高:
无麸质饮食人群最好定期进行检查下列指标:
因此,对于健康人来说,在决定是否采用无麸质饮食之前,应该充分了解其可能的健康风险,每个人应该根据自身身体状况和需求来决定。
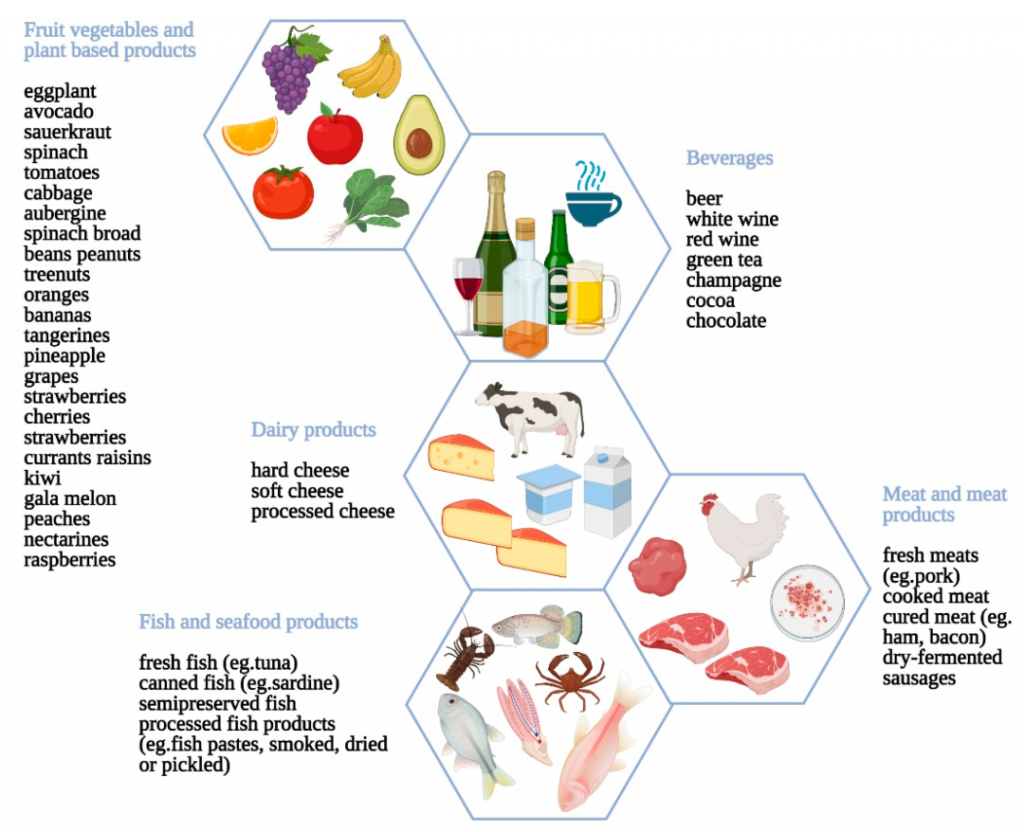
FODMAP 是短链碳水化合物,包括乳糖、超过葡萄糖的果糖、糖醇(山梨醇和甘露醇)、果聚糖和 GOS(水苏糖和棉子糖),天然存在于水果、蔬菜、谷物、乳制品等大量食品和甜味剂中。
这组碳水化合物已被确定为触发功能性胃肠道症状患者的症状,如肠易激综合征(IBS)。
高FODMAP食品是指含有超过 4 克乳糖、超过 0.3 克甘露醇、山梨醇、低聚半乳糖或果聚糖的食品。因此,可以通过考虑食物的 FODMAP 含量来对食物进行分类。
敏感个体食用高FODMAP饮食与腹痛、腹胀、肠胃胀气和肠道习惯改变等低胃肠道症状相关。
在IBS患者队列中,使用低FODMAP饮食对症状的改善已被证明在50-80%之间变化。该范围可能受到几个因素的影响,包括研究设计、患者选择和习惯饮食中的FODMAP摄入量。
FODMAPs难以被肠道细菌吸收和发酵。
因此,摄入大量FODMAPs会导致大量短链脂肪酸(SCFAs)和大量气体(包括二氧化碳、氢气和甲烷)的过度产生,这些物质会导致肠腔膨胀和肠腔内水潴留。
在内脏超敏反应患者中,增加内腔水分输送和气体的联合作用导致膨胀,导致疼痛和不适。
关于内脏超敏详见我们之间的文章:
腹胀、腹痛、肠胃不明原因疼痛?–可能是内脏高敏感,详细了解内脏高敏的原因后果
最近,还提出了其他作用机制,如由于低FODMAP饮食后尿组胺和促炎细胞因子的显著减少,高FODMAP食物的免疫激活潜力。
然而,需要进一步的数据来证实这些发现,并确认它们对症状反应的影响。
那些对特定高FODMAP食物反应明显的人,可能需要减少这些食物的摄入。
其他人群还包括:
肠易激综合征(IBS)患者
IBS是一种常见的消化系统疾病,其症状包括腹痛、腹胀、腹泻和便秘。低FODMAP饮食已被证明可以有效减轻这些症状。
小肠细菌过度生长(SIBO)患者
SIBO是一种病状,其中小肠中的细菌数量异常增多,可能导致类似IBS的症状。限制FODMAPs可以帮助减少细菌的食物来源,从而减轻症状。
功能性腹胀患者
这是一种以腹部不适和腹胀为主要症状的状况,而低FODMAP饮食可以帮助减少腹胀和其他相关症状。
炎症性肠病患者
如克罗恩病和溃疡性结肠炎,虽然低FODMAP饮食并非治疗这些疾病的主要方法,但它有时可以帮助控制某些症状,尤其是在病情活动期间。
其他消化不良的人
有些人可能没有特定诊断,但发现减少高FODMAP食物的摄入能够减轻他们的消化不良。
IBS 是一种功能性胃肠道疾病,影响全世界多达 20% 的人。胃肠道症状受到不同因素的影响,例如心理社会领域、生理功能及其相互作用(肠-脑轴)。IBS的特点是内脏运动和敏感性异常,以及免疫功能和微生物群组成异常;因此,它与各种胃肠道症状和生活质量受损有关。罗马 IV 诊断标准允许根据症状将 IBS 患者分为三类:伴有腹泻的 IBS(IBS-D)、伴有便秘的 IBS(IBS-C)和具有混合排便习惯的 IBS(IBS-M)。
IBS的发病机制仍不完全清楚,但不同的研究表明饮食在症状管理中发挥着重要作用。最有证据支持的饮食是低 FODMAP 饮食 (LFD),它对 IBS 治疗有效。
七项研究证实了低 FODMAP 饮食的积极作用,表明低 FODMAP 饮食后 IBS 严重程度评分系统(IBS-SSS)显著下降。同样,与遵循标准饮食的患者相比,生活质量有所改善。
最后,与 IBS-C 患者相比,低 FODMAP 饮食在 IBS-D 和 IBS-M 患者中的疗效似乎更高。
低FODMAP饮食在世界范围内广泛研究,并显示出良好的疗效证据,得到荟萃分析的支持,并已纳入临床指南。
低FODMAP饮食减少碳水化合物亚类的摄入,包括:
针对低 FODMAP 饮食的特点,可以采用“自上而下”的方法,分为限制、重新引入和个性化长期维护三个步骤。
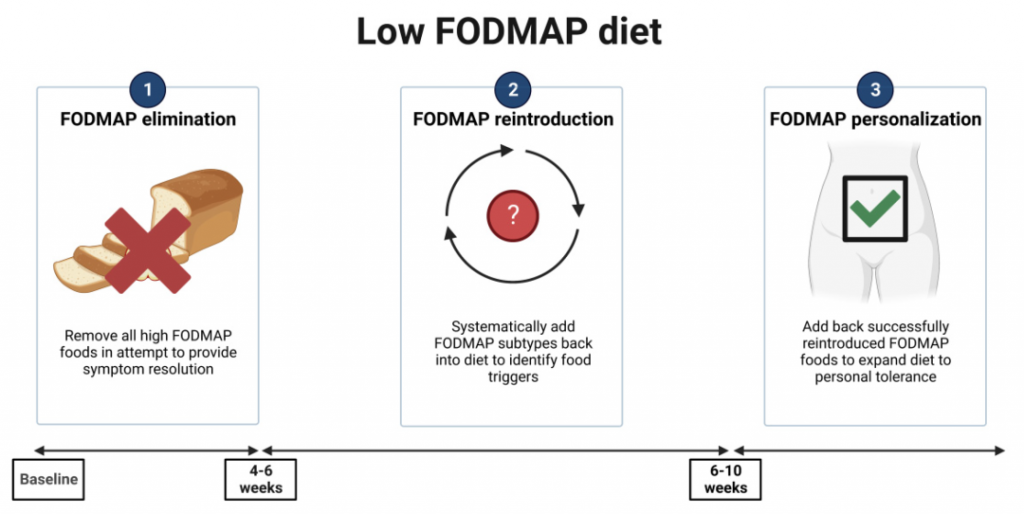
第一阶段要求从饮食中排除所有高 FODMAP 食物,通常持续 4-6 周。这是最关键的阶段,重要的是向患者解释 FODMAP 在胃肠道症状发生中的作用。
第二阶段的目的是重新引入 FODMAP 并评估每位患者的耐受性,调整饮食以进行长期维持。在此阶段,评估饮食依从性和临床反应也很重要;个性化重新引入食物,考虑每种食物 3 天,可以识别患者症状的特定触发因素。
第三阶段涉及制定长期饮食,根据患者的 FODMAP 耐受性进行定制。关键是要制定灵活的饮食结构,以保持多样化和营养充足,并控制肠易激综合征症状。
低 FODMAP 饮食并不是所有受胃肠道紊乱影响的患者的灵丹妙药。
营养缺乏风险
主要原因是缺乏适当的饮食咨询和自我限制饮食。关于膳食摄入量的研究并不一致。由于碳水化合物摄入量的减少,纤维缺乏症是最常见的;此外,当过量摄入乳制品时,钙摄入量也会降低。
考虑到维生素的消耗,维生素缺乏的风险与严格减少饮食中的蔬菜和水果有关。排除几种蔬菜可能会导致天然抗氧化剂的减少,例如类黄酮、类胡萝卜素和维生素C,酚酸和花青素等。
不过总的来说,缺乏有关低 FODMAP 饮食长期影响的数据,但如果患者在饮食过程中得到专业人员的适当监测,营养缺乏的风险非常低。
便秘风险
低 FODMAP 饮食的另一个潜在限制是纤维消耗量低,这可能会加重便秘,尤其是 IBS-C 患者。
适当的营养随访和知识科普可以改善饮食管理和纤维摄入量。
饮食失调风险
低 FODMAP 饮食第一步中施加的限制可能会对患者的情绪状态产生负面影响。有研究表明,低 FODMAP 饮食后的 IBS 患者与食物相关的生活质量较低。
此外,低 FODMAP 饮食对IBS症状恶化的焦虑以及随之而来的饮食限制似乎与饮食失调的发生相关。特别是,回避性限制性食物摄入障碍和神经性厌食症是与低 FODMAP 饮食相关的最常见的饮食失调。
微生物群变化的风险
高 FODMAP 食物通常是益生元的良好来源,尤其是那些含有低聚果糖、低聚半乳糖和纤维的食物,因此减少摄入量可能会改变微生物群结构。这会减少短链脂肪酸的产生及其对结肠细胞的重要保护和营养活性。
短期研究表明,低 FODMAP 饮食可能会导致总体细菌丰度、双歧杆菌和普拉梭菌减少。普拉梭菌的减少可能对肠粘膜屏障的完整性有害。
总之,这不是一种“简单”的饮食,当患者在没有任何专业建议的情况下遵循该饮食时,问题就会增加。同时,有必要在这一新领域进一步研究,以确定哪些患者可以从低FODMAP饮食中受益,并改善管理。
果糖不耐受分为遗传性果糖不耐受和非遗传性果糖不耐受。
遗传性果糖不耐受 (HFI) 是一种罕见的常染色体隐性遗传疾病,无法正常代谢果糖,导致各种代谢紊乱和临床症状。
这是由位于染色体 9q22.3 上的醛缩酶 B 酶突变引起,摄入果糖后可导致明显的胃肠道症状,并可能导致长期器官损伤,特别是肾和肝脏损伤。
临床特征
当患有这种疾病的个体直接或通过蔗糖或山梨醇间接接触膳食果糖时,遗传性果糖不耐受症状就会出现。
果糖不耐受的人在食用高果糖食物或饮料后经常会出现胃肠道症状,如腹痛、腹胀、腹泻和恶心。这些症状可以是轻微到严重的不适,并且可以显着影响个人的生活质量。
症状及其严重程度取决于果糖剂量、患者年龄、伴随疾病和醛缩酶 B 的残留酶活性,并且是非特异性的,因此很难仅根据症状来怀疑遗传性果糖不耐受。常见的临床表现是恶心、呕吐、腹部不适和生长受限/生长迟缓。
治疗
遗传性果糖不耐受的管理包括严格避免含有果糖、蔗糖和山梨醇的食物。通过正确的诊断和坚持果糖限制饮食,果糖不耐受的个体可以有效地控制他们的病情并改善他们的整体健康。
遵循严格的不含有果糖、蔗糖和山梨糖醇的饮食,并补充葡萄糖和玉米淀粉等碳水化合物,可以使症状迅速逆转。患者应避免使用含有蔗糖的药物和疫苗,例如两种口服轮状病毒活疫苗 Rotarix ® 和 RotaTeq ®。鉴于减少水果和蔬菜摄入量是饮食要求,建议每天补充“无糖”多种维生素,以防止微量营养素缺乏,特别是水溶性维生素缺乏。
非遗传性果糖不耐受是怎么回事?
相对于管腔果糖的量而言,肠上皮细胞摄取果糖不足。
小肠中果糖的吸收能力远低于葡萄糖的吸收能力;葡萄糖以剂量依赖性方式刺激果糖吸收,当果糖含量多于葡萄糖时,就会发生吸收不良。然后,未吸收的果糖进入结肠,并以与 LNP 患者的乳糖相同的方式发酵。
如何诊断?
果糖吸收不良 (FM) 的诊断通常需要结合病史评估、症状评估和特定测试。多年来,一直使用特定的氢气呼气测试来评估果糖吸收不良。关于氢气和甲烷呼气试验的适应症、性能和临床影响的欧洲指南建议,成人诊断果糖吸收不良和不耐受时的果糖剂量应为 20-25 克。
关于“胃肠道疾病中 H2 呼吸测试的方法和适应症”的罗马共识会议和 ESPGHAN 关于呼气测试使用的文件均表示,在临床实践中不建议进行果糖呼气测试。
鉴于这种诊断的不确定性,可能会建议消除饮食,即在特定时期内从饮食中去除高果糖食物。如果症状在此期间有所改善,然后在重新摄入含果糖食物时又出现,则可能表明果糖吸收不良。
如何改善?
由于果糖是一种 FODMAP,因此通常建议采用低 FODMAP 饮食来代替低果糖饮食,特别是对于怀疑患有伴随功能障碍的患者。先前的调查表明,诊断为 IBS 或 FGID 的个体中,很大一部分(35%~73%)表现出与果糖吸收不良一致的特征。
木糖异构酶已被提议作为果糖不耐受的潜在治疗方法,因为它能够将果糖转化为葡萄糖。一项双盲、安慰剂对照研究表明,口服木糖异构酶与摄入果糖后呼吸氢显著减少有关,并且恶心和腹痛显著改善。目前,经验疗法包括采取限制饮食和评估症状。
蔗糖由一种葡萄糖和一种果糖分子组成。这两个分子之间的结合被膜结合酶蔗糖酶-异麦芽糖酶破坏。先天性蔗糖酶-异麦芽糖酶缺乏症(CSID)是一种罕见的常染色体隐性遗传疾病,染色体 3q25-26 上的蔗糖酶-异麦芽糖酶基因发生突变。
获得性形式的蔗糖酶-异麦芽糖酶缺乏症可能继发于与肠绒毛萎缩相关的其他慢性胃肠道疾病,例如肠道感染、乳糜泻、克罗恩病和影响小肠的其他肠病。
功能性蔗糖酶-异麦芽糖基因变异似乎在具有提示 IBS 症状的患者中更为常见。然而,如上所述,最近的指南不建议对这些患者进行碳水化合物测试。
使用来自酿酒酵母产生的酶糖化酶来水解蔗糖,作为这种不耐受的可能治疗方法。因为一项古老的双盲研究显示,与安慰剂相比,这种酶与食物一起服用可以显著预防在含蔗糖饮食中的患者的不耐受症状。
组胺一般在哪些食物中出现?
发酵食品、酒精、贝类、熏肉、豆类、巧克力、某些水果和蔬菜等。
doi.org/10.3390/nu13051638
组胺不耐受是如何发生的?
由于二胺氧化酶(DAO)活性低,肠道中组胺降解途径受损或减慢,导致组胺在血浆中积聚并出现不良反应,特别是在高饮食摄入的情况下。然而,这种因果关系尚未得到证实。
组胺不耐受有哪些表现?
由于组胺受体普遍分布在身体的不同器官和组织中,组胺不耐受的临床表现包括多种非特异性胃肠道和肠外症状。
这种多形性的表现导致难以就组胺不耐受的诊断标准达成共识。
组胺不耐受的发病率
缺乏可靠的诊断系统对目前报告的组胺不耐受发生率产生了影响,估计约占人口的 1-3%。随着更多关于组胺不耐受的知识和诊断工具的出现,这种情况可能会增加。
肠道微生物会影响组胺不耐受的发生
肠道微生物群也会影响组胺不耐受的发生。最近的研究表明,组胺不耐受可能是由肠道微生物群的改变引起的。肠道中大量的组胺分泌细菌可能会导致组胺不耐受。健康人体内双歧杆菌的数量较多。而在血清二胺氧化酶活性降低的人群中观察到变形菌属数量较多。
在组胺不耐受人群中观察到肠道菌群失调,与健康个体相比,与肠道健康相关的普氏菌科(Prevotellaceae)、瘤胃球菌(Ruminococcus)、粪杆菌(Faecalibacterium)和普拉梭菌(Faecablibacterium prausnitzii)的比例明显较低。组胺不耐受人群还具有显著更高丰度的组胺分泌细菌,包括葡萄球菌属和变形杆菌属、属于肠杆菌科的几个未识别属,以及产气荚膜梭菌和粪肠球菌。
组胺不耐受的治疗建议
组胺不耐受疗法的基础是基于低组胺含量食物的消除饮食。一般来说,公认的饮食指南尚未制定;但是,建议避免食用富含组胺的食物如奶酪、油性鱼类和贝类,以及生发酵肉制品、腌菜、发酵豆制品、葡萄酒和啤酒、鸡蛋、巧克力和蘑菇。
此外,应避免食用会刺激内源性组胺释放的蔬菜和水果(如菠菜、西红柿、柑橘类水果、草莓、茄子、鳄梨、木瓜、香蕉、猕猴桃、菠萝和李子)。
关于组胺不耐受,详见之前的文章:
茄属植物是属于茄科的一组蔬菜。超过 3,000 种植物属于这一类。常见的品种有茄子、西红柿、土豆、青椒等。有些人对茄属蔬菜不耐受。
那些对茄属植物敏感或过敏的人可尝试一些替代品。其中包括:
亚硫酸盐
白葡萄酒和干果中含有大量的亚硫酸盐等,亚硫酸盐也会添加到其他食品中,增强脆度或防止霉菌生长,而 FDA 禁止亚硫酸盐作为新鲜水果和蔬菜的喷雾防腐剂。
摄入后,不良反应最常见于易感人群,例如哮喘患者。所提出的机制包括吸入摄入的亚硫酸盐产生的二氧化硫、亚硫酸盐氧化酶缺乏以及 IgE 介导的反应。
此外,有人提出可能涉及副交感神经系统,亚硫酸氧化酶不足会导致亚硫酸盐积累,引起胆碱能介导的支气管收缩。
谷氨酸钠
另一种被认为是不良非免疫反应罪魁祸首的食品添加剂是谷氨酸钠 (MSG-E621),它通常作为咸味增强剂添加。然而,富含天然结合或游离形式谷氨酸的食物以与味精相同的方式代谢,并且没有证明它会引起与添加味精的食物相同的症状。
食物不耐受的存在会影响患者的心理健康。与对照组相比,食物不耐受患者的焦虑、抑郁和躯体症状更常见。
一些关注心理社会相关性的研究表明,食物不耐受与年龄较小、女性、高等教育和肠易激综合症之间可能存在关联。
此外,研究表明,食物不耐受也可能与IBS中的食物厌恶重叠,并且这可能在食物不耐受中也很重要。事实上,如果摄入某种特定食物同时伴随着心理障碍,那么胃肠道症状就会在摄入某种食物后出现,并且可以习得对该食物的厌恶。
针对 IBS 人群的研究表明需要更好的沟通,积极的医患关系可以改善症状管理。因此,可以假设这对于食物不耐受的患者来说会是成功的。
此外,与胃肠道症状相关的食物不耐受的存在也可能成为饮食失调患者拒绝食物的理由。考虑到饮食失调患者中膳食相关症状的发生率很高,临床医生调查饮食行为障碍的存在至关重要。
饮食日记可以帮助你了解自己的饮食习惯和模式,帮助你识别对某些食物或成分的反应。

每天列出你吃的食物和出现的症状。一旦你确定了一种似乎会引发你症状的食物,就几个星期不吃它,看看会发生什么。过了几个星期后重新再吃它。如果症状随着它的减去而消失,但随着重新开始吃又复发,这样你就逐渐找到罪魁祸首。

编辑
每餐后填写相关栏目。列出症状时,按1-10 的等级对其严重程度进行评分。“其他因素”列用于记录压力或情绪不安等因素。
在每周结束时,寻找任何可能的模式或潜在的食物触发因素。一旦确定了可能存在问题的食物,请遵循消除饮食至少两周,有些认为4-8周,具体取决于严重程度。
每次最好只排除一种食物,以免其他因素干扰。
关于写饮食日记的小技巧:
饮食日记是一场马拉松,所以要对自己宽容一点,一开始不必面面俱到把所有的都记下来,那样只会变成日常生活的负担,轻松一点有利于坚持。
如果要记录的话,尽量在吃完几个小时内就写,不要拖太久,不然等过两天回忆再写会很麻烦。可以随身带个小本子或者记在手机等电子设备中。
如果在外面吃饭来不及记录,可以迅速把吃的东西拍个照,回去再写。
注:这里列的饮食日记的样式仅供参考,也可以用自己习惯的样式来进行。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Tuck CJ, Biesiekierski JR, Schmid-Grendelmeier P, Pohl D. Food Intolerances. Nutrients. 2019 Jul 22;11(7):1684.
Facioni MS, Raspini B, Pivari F, Dogliotti E, Cena H. Nutritional management of lactose intolerance: the importance of diet and food labelling. J Transl Med. 2020 Jun 26;18(1):260.
JanssenDuijghuijsen L, Looijesteijn E, van den Belt M, Gerhard B, Ziegler M, Ariens R, Tjoelker R, Geurts J. Changes in gut microbiota and lactose intolerance symptoms before and after daily lactose supplementation in individuals with the lactase nonpersistent genotype. Am J Clin Nutr. 2023 Dec 28:S0002-9165(23)66349-X.
Brandao Gois MF, Sinha T, Spreckels JE, Vich Vila A, Bolte LA, Weersma RK, Wijmenga C, Fu J, Zhernakova A, Kurilshikov A. Role of the gut microbiome in mediating lactose intolerance symptoms. Gut. 2022 Jan;71(1):215-217.
Tagliamonte S, Barone Lumaga R, De Filippis F, Valentino V, Ferracane R, Guerville M, Gandolfi I, Barbara G, Ercolini D, Vitaglione P. Milk protein digestion and the gut microbiome influence gastrointestinal discomfort after cow milk consumption in healthy subjects. Food Res Int. 2023 Aug;170:112953.
Sánchez-Pérez S, Comas-Basté O, Duelo A, Veciana-Nogués MT, Berlanga M, Latorre-Moratalla ML, Vidal-Carou MC. Intestinal Dysbiosis in Patients with Histamine Intolerance. Nutrients. 2022 Apr 23;14(9):1774.
Gargano D, Appanna R, Santonicola A, De Bartolomeis F, Stellato C, Cianferoni A, Casolaro V, Iovino P. Food Allergy and Intolerance: A Narrative Review on Nutritional Concerns. Nutrients. 2021 May 13;13(5):1638.
Hon E, Gupta SK. Gastrointestinal Food Allergies and Intolerances. Gastroenterol Clin North Am. 2021 Mar;50(1):41-57.
Légeret C, Lohmann C, Furlano RI, Köhler H. Food intolerances in children and adolescents in Switzerland. Eur J Pediatr. 2023 Feb;182(2):867-875.
Onyimba F, Crowe SE, Johnson S, Leung J. Food Allergies and Intolerances: A Clinical Approach to the Diagnosis and Management of Adverse Reactions to Food. Clin Gastroenterol Hepatol. 2021 Nov;19(11):2230-2240.e1.
Caio G, Lungaro L, Segata N, Guarino M, Zoli G, Volta U, De Giorgio R. Effect of Gluten-Free Diet on Gut Microbiota Composition in Patients with Celiac Disease and Non-Celiac Gluten/Wheat Sensitivity. Nutrients. 2020 Jun 19;12(6):1832.
Bascuñán KA, Araya M, Roncoroni L, Doneda L, Elli L. Dietary Gluten as a Conditioning Factor of the Gut Microbiota in Celiac Disease. Adv Nutr. 2020 Jan 1;11(1):160-174.
Calabriso N, Scoditti E, Massaro M, Maffia M, Chieppa M, Laddomada B, Carluccio MA. Non-Celiac Gluten Sensitivity and Protective Role of Dietary Polyphenols. Nutrients. 2022 Jun 28;14(13):2679.
Alkalay MJ. Nutrition in Patients with Lactose Malabsorption, Celiac Disease, and Related Disorders. Nutrients. 2021 Dec 21;14(1):2.
Leis R, de Castro MJ, de Lamas C, Picáns R, Couce ML. Effects of Prebiotic and Probiotic Supplementation on Lactase Deficiency and Lactose Intolerance: A Systematic Review of Controlled Trials. Nutrients. 2020 May 20;12(5):1487.
Roszkowska, A.; Pawlicka, M.; Mroczek, A.; Bałabuszek, K.; Nieradko-Iwanicka, B. Non-Celiac Gluten Sensitivity: A Review. Medicina 2019, 55, 222
Cenni S, Sesenna V, Boiardi G, Casertano M, Russo G, Reginelli A, Esposito S, Strisciuglio C. The Role of Gluten in Gastrointestinal Disorders: A Review. Nutrients. 2023 Mar 27;15(7):1615.
Losurdo G, Principi M, Iannone A, Amoruso A, Ierardi E, Di Leo A, Barone M. Extra-intestinal manifestations of non-celiac gluten sensitivity: An expanding paradigm. World J Gastroenterol. 2018 Apr 14;24(14):1521-1530.
Barbaro, M.R.; Cremon, C.; Wrona, D.; Fuschi, D.; Marasco, G.; Stanghellini, V.; Barbara, G. Non-Celiac Gluten Sensitivity in the Context of Functional Gastrointestinal Disorders. Nutrients 2020, 12, 3735.
Tagliamonte S, Barone Lumaga R, De Filippis F, Valentino V, Ferracane R, Guerville M, Gandolfi I, Barbara G, Ercolini D, Vitaglione P. Milk protein digestion and the gut microbiome influence gastrointestinal discomfort after cow milk consumption in healthy subjects. Food Res Int. 2023 Aug;170:112953.
Bellini M, Tonarelli S, Nagy AG, Pancetti A, Costa F, Ricchiuti A, de Bortoli N, Mosca M, Marchi S, Rossi A. Low FODMAP Diet: Evidence, Doubts, and Hopes. Nutrients. 2020 Jan 4;12(1):148.
Hrubisko, M.; Danis, R.; Huorka, M.; Wawruch, M. Histamine Intolerance—The More We Know the Less We Know. A Review. Nutrients 2021, 13, 2228.
Cotton, C.; Raju, S.A.; Ahmed, H.; Webster, G.; Hallam, R.; Croall, I.; Coleman, S.; Trott, N.; Rej, A.; Shiha, M.G.; et al. Does a Gluten-Free Diet Improve Quality of Life and Sleep in Patients with Non-Coeliac Gluten/Wheat Sensitivity? Nutrients 2023, 15, 3461.
谷禾健康
双歧杆菌
双歧杆菌属(Bifidobacterium)是放线菌门严格厌氧的革兰氏阳性多形性杆状细菌。末端常常分叉,故名双歧杆菌。是人和动物肠道的重要核心菌群和有益生理菌群,也是母乳喂养婴儿中发现的第二大菌。
肥胖、糖尿病和过敏等各种疾病都与生命各个阶段的双歧杆菌数量减少有关。双歧杆菌有助于改善消化问题,抗菌和病毒、抗炎、改善血糖控制,降低血脂水平,提高免疫力,表现出抗氧化活性,有助于预防湿疹,缓解压力和过敏。
从代谢的角度来看,该属比较典型的特征是单糖的分解代谢(即所谓的果糖 6-磷酸途径),主要发酵葡萄糖产生乳酸和乙酸和少量乙醇。
重要的是,双歧杆菌产生硫胺素(维生素B1)、核黄素(维生素B2)、维生素 B6和维生素 K。可能还具有合成叶酸、烟酸(维生素B3)和吡哆醇(维生素B6)的能力。双歧杆菌代谢产物还包括γ-氨基丁酸 (GABA)和生物素。比如青春双歧杆菌是人体肠道微生物群中 GABA生产的关键成员。
by Kateryna Kon
食用双歧杆菌食品可以通过降低胃 pH 值(促进矿物质的电离,这是矿物质的吸收所必需的)来提高某些矿物质的生物利用度,包括钙、锌和铁。
多种因素会导致人体肠道内双歧杆菌变化
导致减少的因素包括:
增加双歧杆菌的因素包括:
补充益生菌:可以通过食物或药物的方式补充益生菌,可以增加肠道内双歧杆菌。
吃发酵食品:多吃发酵食品,如酸奶、奶酪、泡菜,适量葡萄酒等,可以增加肠道内双歧杆菌。
增加特定膳食补充剂,比如低聚果糖,抗性淀粉,白藜芦醇、镁、绿茶、水苏糖,杏仁/杏仁皮、岩藻多糖、大麦、菊芋、阿拉伯木聚糖、菊粉等
多样性饮食,摄入足够的蔬菜、水果、豆类和全谷物,定期摄入奶制品。
合理运动和良好睡眠,清洁的水源等。
存在于不同生态位的双歧杆菌物种与其宿主之间有不同的生态关系
抗生素敏感性
药敏实验显示双歧杆菌对多种抗生素敏感,如氯霉素、四环素、红霉素等,但对氨苄青霉素、庆大霉素、痢特灵、丁胺卡那霉素、新霉素、环丙沙星等抗生素耐受。
应用
目前双歧杆菌制剂已经广泛应用于保健食品、医药等领域。比如双歧杆菌药品、双歧杆菌与药成分搭配的保健药品、双歧杆菌与双歧因子搭配的保健食品以及双歧杆菌与寡糖、葡萄糖酸、精氨酸配合,对青春双歧杆菌有选择的增殖作用,发挥特有的免疫赋活功能等。
开发价值
未来还可能扩大双歧杆菌利用面,促进双歧杆菌向多元化方向发展。比如双歧杆菌富含B族维生素,该菌的代谢产物富含(L+)乳酸和一些酶类,可用来生产微生态护肤品或其他化妆品。除用于特定保健食品和医药外,在畜业、水产业和肉制品加工中也广泛应用,也大有开发价值。
通过补充益生菌或益生元调节双歧杆菌水平可以改变肠道微生物群的整体组成和代谢。但是双歧杆菌介导的健康益处是双歧杆菌、肠道微生物群的其他成员和人类宿主之间建立的复杂动态相互作用的结果。值得强调的是,某些双歧杆菌定植特征受肠道因素调节,包括其他微生物的存在。
这体现在具有不同肠道微生物群组成的个体似乎对双歧杆菌补充剂的反应不同,这一事实提供了双歧杆菌-肠道微生物群串扰存在的进一步证据。
本文主要讨论和介绍双歧杆菌的菌属特性,生态代谢特征,对人体的健康特性以及影响双歧杆菌在体内定植的主要因素。
—正文—
★
▼
双歧杆菌属于放线菌目,双歧杆菌在细胞壁类型上与其他放线菌(如链霉菌和诺卡氏菌)是分开的;双歧杆菌被指定为具有 VIII 型细胞壁(鸟氨酸浓度相对较高)。
属水平
双歧杆菌属(Bifidobacterium)于 1899 年首先由 Tissier 从母乳喂养婴儿的粪便中分离出来,并命名为Bacillus bifidus。
然而,由于它们与乳杆菌相似的形态和生理特征,在 20 世纪的大部分时间里它们被归类为乳杆菌属的成员,直到最近才被认为是和乳杆菌不同的属。
种水平
随着鉴定方案的技术改进和微生物系统学信息的扩展,该属中已定义物种的数量已经稳步增加。
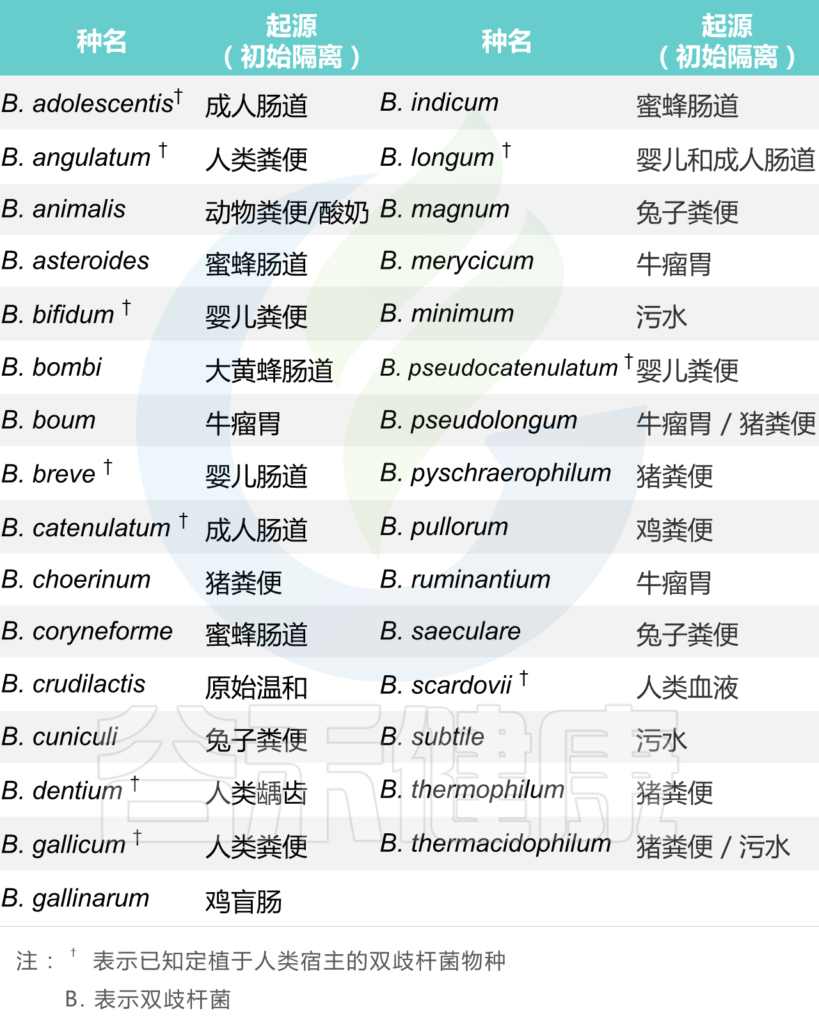
Bergey 的系统细菌学手册(1986) 鉴定了 24 种不同的双歧杆菌。在这些物种中,被认为主要起源于人类的类型有以下种:
B.bifidum、B.longum、B.infantis、
B.breve、B.adolescentis、B.angulatum、B.catenulatum、B.pseudocatenulatum 、B.dentium 。
大多数这些物种在人类结肠中占主导地位,随后可以在粪便和污水中找到。
在2004共列出了 33 种双歧杆菌;大多数新添加的物种都是从动物来源中分离出来的。
截止2020年已在该菌属在分类学上已鉴定出 78 个种和 10 个亚种,而且这个数字每年都在上升。
▼
双歧杆菌是革兰氏阳性、不运动、过氧化氢酶阴性、不形成孢子和非还原细菌的多样化菌属。是厌氧菌和多形性细菌,具有单细胞、链、聚合物形、V 形或 Y 形或栅栏形等多种排列方式。
适宜生长条件
人源双歧杆菌的最适生长温度为 36 至 38 °C,而动物源双歧杆菌的最适生长温度为 41 至 43 °C。但蒙古双歧杆菌和嗜冷双歧杆菌除外,它们分别可以在 15°C 和 8°C 下生长;最高生长温度为 43–45°C,但嗜热双歧杆菌除外,其最高生长温度为 49.5°C。
双歧杆菌的最适生长 pH为 6.5–7.0。pH 值低于 4.5–5.0 或高于 8.0–8.5 时不会一般发生生长。嗜热双歧杆菌除外,它可以在 pH 4.5 下生长或 pH 8.0–8.5 下不生长。
双歧杆菌菌落与乳酸菌易混淆
在琼脂平板上,双歧杆菌的菌落与乳酸菌(尤其是乳酸杆菌)的菌落非常相似,容易混淆,经常被错误地称为乳酸菌的一员;然而,双歧杆菌与发酵食品生产中使用的传统乳酸菌都没有密切关系。
与乳酸菌相比,双歧杆菌的耐酸性较差,它们的生长不能称为“兼性厌氧”。双歧杆菌确实会通过碳水化合物的发酵产生乳酸,但通常产生的乙酸量高于乳酸,并且所使用的分解代谢途径不同于乳酸菌所采用的同源发酵和异源发酵途径。
乳杆菌的 DNA 的平均(G+C)mol%约为 37%,双歧杆菌的平均值约为 58%。
▼
它们是正常人类和动物肠道菌群的天然居民,并且已经从六个不同的生态位中分离出来,双其中三个与人类和动物肠道环境直接相关:例如人类肠道、动物肠道(牛、兔、鼠、鸡和昆虫)和口腔,而其他(污水、血液和食物)可能是胃肠道污染的结果。
从不同生态位分离出来的双歧杆菌物种表
doi.org/10.2217/fon-2019-0374
▼
通常在我们的认知中,双歧杆菌是益生菌,但实际上,双歧杆菌与其宿主之间可以建立不同的生态关系,从机会性致病相互作用(例如齿双歧杆菌)到共生甚至促进健康的关系(例如双歧双歧杆菌和短双歧杆菌)。
在已知的促进健康的菌群中,双歧杆菌代表了最主要的群体之一,一些双歧杆菌物种通常被用作许多功能性食品中的益生菌成分。
动物双歧杆菌已被证明是在冷藏条件下保持活力的双歧杆菌物种中最顽强的物种之一,并且一些菌株已被证明可以为人类带来健康益处,但动物这个名称在暗示对人类有益方面并不易于使用,尤其是老鼠粪便作为原始来源。
在当前的文献中,人们越来越意识到双歧杆菌的潜在致病性。双歧杆菌的致病潜力尚不清楚;有报道称在免疫功能低下的宿主和肠道屏障受损的宿主中具有“败血症样图像”的侵袭性。
双歧杆菌的促炎作用

Lim HJ,et al., J Microbiol Biotechnol. 2020
先前的研究表明,最常见的引起双歧杆菌感染是长双歧杆菌和齿双歧杆菌。在儿科和成人菌血症病例中,无论是否使用过益生菌,公认的菌种是婴儿双歧杆菌、青春双歧杆菌、短双歧杆菌、长双歧杆菌和齿双歧杆菌(在较早的文献中称为埃里克森双歧杆菌)。
已经报道了由双歧杆菌引起的几种类型的感染。偶尔的感染发现还包括B. scardovii。
在一项研究中,从无菌场所分离出的 15 种推定的双歧杆菌分离株或大量存在的双歧杆菌被鉴定到物种水平,鉴定出四种:A. omnicolens、B. breve、B. longum、B. scardovii ,来自胃肠道或泌尿生殖道,B. breve来自血液。Scardovia wiggsiae 是一种新物种,与严重的幼儿龋齿有关。
在血培养分析中,双歧杆菌约占厌氧血培养分离株的 0.5-3%,截至 2015 年,文献中仅报道了 15 例成人双歧杆菌菌血症,因此,双歧杆菌还是相对安全的。
▼
双歧杆菌属属于放线菌门、放线菌纲(高 G+C 革兰氏阳性菌)、双歧杆菌目和双歧杆菌科。
产生B族维生素
双歧杆菌可产生硫胺素、核黄素、维生素 B6 和维生素 K。还有报道称它们具有合成叶酸、烟酸和吡哆醇的能力。这些维生素B复合物在人体中被慢慢吸收。
产生乳酸
关于含有双歧杆菌的发酵乳的营养特性的现有信息表明,与非发酵乳相比,它们的残留乳糖含量较低,游离氨基酸和维生素含量较高。它们优先含有(+)-乳酸[双歧杆菌除乙酸外还产生(+)-乳酸,而乳酸菌产生(−)-乳酸],更容易被人体代谢。这对于 1 岁以下的婴儿尤为重要,因为在这些婴儿中代谢性酸中毒可能是一个问题。
所有与人类有关的物种都可以发酵乳糖;在考虑将双歧杆菌应用于乳制品和作为益生菌培养物以缓解乳糖吸收不良不适的预期效果时,这是一个重要特征。
主要代谢途径:果糖 6-磷酸途径
双歧杆菌使用果糖 6-磷酸途径(双歧途径)作为碳水化合物代谢的主要途径,其中Xfp是该途径的主要酶,具有双底物特异性,最终代谢产物是乙酸盐、乳酸盐和乙醇。
注:Xfp——果糖 6-磷酸磷酸酮醇酶
其他代谢途径
人们认为,双歧杆菌能够与其他胃肠道细菌竞争并在胃肠道区域的细菌菌群中占据很大比例,部分原因可能是它能够利用多种分子提供能量。双歧杆菌可能还参与的其它代谢通路如下:
2-氧代羧酸代谢
ABC转运体
丙氨酸、天冬氨酸和谷氨酸代谢
氨基糖和核苷酸糖代谢
氨酰-tRNA生物合成
精氨酸和脯氨酸代谢
精氨酸生物合成
细菌分泌系统
碱基切除修复
氨基酸的生物合成
抗生素的生物合成
次级代谢物的生物合成
不饱和脂肪酸的生物合成
生物素代谢
丁酸代谢
C5-支链二元酸代谢
碳青霉烯生物合成
碳代谢
氯代烷烃和氯代烯烃降解
柠檬酸循环(TCA循环)
氰基氨基酸代谢
半胱氨酸和甲硫氨酸代谢
D-丙氨酸代谢
D-谷氨酰胺和D-谷氨酸代谢
DNA复制
芳香族化合物的降解
脂肪酸生物合成
脂肪酸降解
脂肪酸代谢
叶酸生物合成
果糖和甘露糖代谢
半乳糖代谢
谷胱甘肽代谢
甘油脂代谢
甘油磷脂代谢
甘氨酸、丝氨酸和苏氨酸代谢
糖酵解/糖异生
乙醛酸和二羧酸代谢
组氨酸代谢
同源重组
肌醇磷酸代谢
胰岛素抵抗
赖氨酸生物合成
代谢途径
甲烷代谢
不同环境中的微生物代谢
错配修复
内酰胺生物合成
萘降解
烟酸盐和烟酰胺代谢
氮代谢
非核糖体肽结构
核苷酸切除修复
一个由叶酸组成的碳库
其他聚糖降解
氧化磷酸化
泛酸和 CoA 生物合成
戊糖和葡萄糖醛酸相互转化
戊糖磷酸途径
肽聚糖生物合成
苯丙氨酸代谢
苯丙氨酸、酪氨酸和色氨酸的生物合成
磷酸转移酶系统 (PTS)
聚酮化合物糖单元生物合成
卟啉和叶绿素代谢
丙酸代谢
蛋白质输出
嘌呤代谢
嘧啶代谢
丙酮酸代谢
RNA降解
RNA聚合酶
核黄素代谢
核糖体
次级胆汁酸生物合成
硒化合物代谢
鞘脂代谢
淀粉和蔗糖代谢
链霉素生物合成
硫代谢
牛磺酸和亚牛磺酸代谢
萜类骨架生物合成
硫胺素代谢
双组分系统
酪氨酸代谢
泛醌和其他萜类醌生物合成
缬氨酸、亮氨酸和异亮氨酸的生物合成
缬氨酸、亮氨酸和异亮氨酸降解
万古霉素耐药
维生素B6代谢
β-内酰胺抗性
▼
Bifidus在拉丁语中的意思是裂开或分开(当营养受限时,细胞的特征性分叉很明显)。
双歧杆菌属的物种具有较高的 rRNA 16S 序列相似性,构成了一个连贯的系统发育单元。
2002年,来自长双歧杆菌的第一个基因组被发表,并且此后公开可用的双歧杆菌基因组数量稳步增加。截至2016年4月,共有254个公开的双歧杆菌基因组序列,其中61个代表完整的基因组序列。通过比较不同物种的基因组,揭示了该属的系统发育和进化适应性。
双歧杆菌基因组平均长度为2.2 Mb,通常编码52-58个tRNA基因和3-5个rRNA操纵子。
▼
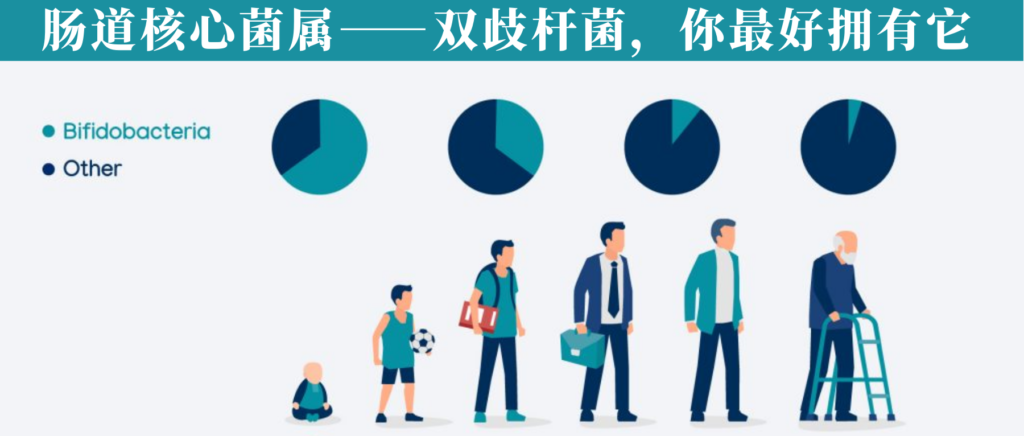
• 通常,在婴儿肠道内以婴儿双歧杆菌和短双歧杆菌为优势菌群;
• 而在成人肠道内则缺少这两种双歧杆菌,仅有少量双岐双歧杆菌、青春双歧杆菌和长双歧杆菌存在
通过使用不同的方法和技术,已经观察到双歧杆菌的数量和多样性会随着年龄的增长而减少(当然这个目前仍然不明确)。
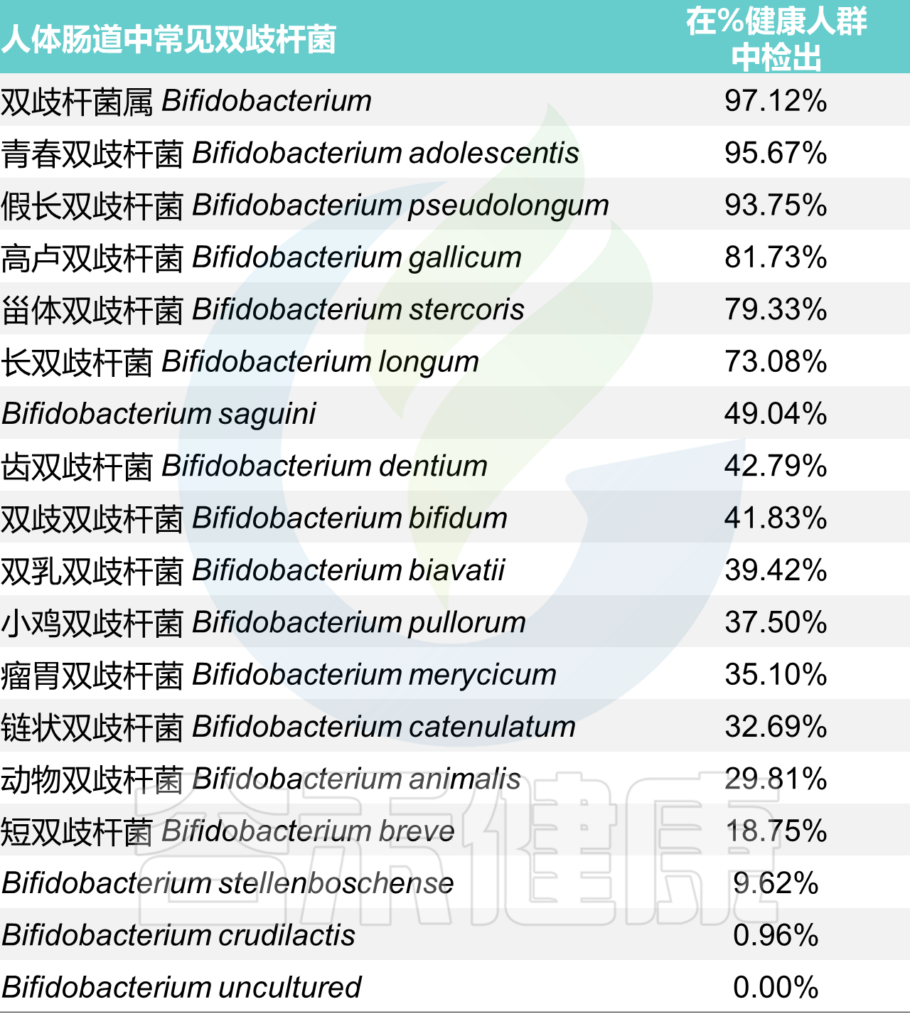
<来源:谷禾健康肠道菌群检测数据库>
其中能在人体肠道内定植并能用于制备保健食品的双歧杆菌主要有5种:
婴儿:双歧杆菌占90%,断奶后迅速下降
双歧杆菌通常是婴儿肠道微生物群中最丰富的分类群(高达 90%),其丰富性与对婴儿健康的各种有益影响有关,包括肠道中叶酸的产生、对疫苗接种的免疫反应增加和预防或减少过敏性疾病。
已知双歧杆菌产生的紧密粘附菌毛会刺激结肠上皮细胞增殖,从而可能影响新生儿肠道的成熟。富含双歧杆菌的健康肠道微生物群在母乳喂养期间继续存在,但相对丰度在断奶后迅速下降。
成人:双歧杆菌参与复杂碳水化合物的代谢
存在于成人肠道中的肠道双歧杆菌基因组,例如青春双歧杆菌,似乎并不包含与母乳成分利用相关的基因,相反,它们包含大量专门用于成人饮食中常见的复杂碳水化合物的代谢(例如,淀粉和淀粉衍生的碳水化合物)。
到目前为止,饮食类型(西方、亚洲、地中海)与特定双歧杆菌种类在肠道中的富集之间尚无明确关系,但据报道不同人群和国家之间存在差异。
老人:双歧杆菌物种水平变化
在老年人(百岁老人)中也提到了物种水平的变化。结果仍然有些争议。在某些地区,百岁老人的微生物群组成仍然与成年人相似,然而,也有些地方百岁老人的双歧杆菌比例高于年轻老人。
与衰老过程间接相关的其他外在因素也会影响双歧杆菌的组成。抗生素在老年人群中的长期使用无疑对肠道菌群组成产生巨大影响,从而减少双歧杆菌数量。
▼
双歧杆菌介导的健康益处是双歧杆菌、肠道微生物群的其他成员和人类宿主之间建立的复杂动态相互作用的结果。
这些错综复杂的相关模式尚未在分子水平上得到完全破译。因此,目前正在努力了解肠道生态系统内的代谢通量,以辨别健康和疾病中的微生物群-宿主串扰。这将为通过以微生物组为目标的方法以更精确、安全和可控的方式调节宿主健康奠定基础。
在双歧杆菌益处中,抑制肠病原体和减少轮状病毒感染是它们最确定的结果。许多体外研究表明,双歧杆菌可以通过产生有机酸、抗菌肽、群体感应抑制剂来抑制病原体, 或免疫刺激以及其他机制,为它们预防某些感染的能力提供分子线索。
双歧杆菌的抗菌作用
Lim HJ,et al., J Microbiol Biotechnol. 2020
另一个事实表明,存在一个关键的双歧杆菌-肠道微生物群-宿主串扰,即婴儿早期微生物群的建立似乎遵循一种精心策划和有组织的菌群演替模式。
与人类肠道菌群的串扰机制表现在:
第一批肠道定殖者,双歧杆菌占主导地位
有助于减少环境并产生代谢物,使其他细菌种群能够稳定地定植肠道。
和其他肠道细菌间存在显著的共生效应
多形拟杆菌能够在长双歧杆菌存在下,扩大其利用多糖的能力,这表明常驻肠道共生体能够调整其底物利用以响应对双歧杆菌。
通过补充益生菌调节双歧杆菌
通过补充益生菌调节双歧杆菌水平可以改变肠道微生物群的整体组成和代谢。
在源自人肠道的微生物群小鼠模型中补充长双歧杆菌菌株会增加丙酮酸、丁酸和生物素的产量。可能是由于长双歧杆菌和Bacteroides caccae的共存。
补充长双歧杆菌还与肠杆菌科的减少和直肠真杆菌的增加相关,支持双歧杆菌对其他肠道菌群的数量和功能的影响。
双歧杆菌分子调节肠道菌群
体外研究表明,在双歧杆菌胞外多糖存在的情况下,脆弱拟杆菌和Faecalibacterium prausnitzii(粪栖杆菌,又名普拉梭菌)会改变它们的代谢。
通过补充益生元调节双歧杆菌
通过益生元(包括菊粉、阿拉伯木聚糖、低聚半乳糖和低聚果糖)促进双歧杆菌生长,也与更高的乳杆菌-双歧杆菌与肠杆菌科比例相关,并调节短链脂肪酸,有机酸等的产生。
对益生元代谢分析,了解双歧杆菌与其他菌群的交叉喂养机制
B. longum NCC2705 和E. rectale ATCC 33656之间的交叉喂养机制,有利于双歧杆菌菌株和产丁酸菌在同一生态位中共存。为阿拉伯木聚糖寡糖的产双歧和产丁酸作用提供了新的见解。
理解双歧杆菌和拟杆菌属物种以及双歧杆菌和普拉梭菌之间的交叉喂养机制),这将有助于理解共培养发酵的产丁酸活性。这些结果也有助于阐明益生元发酵过程中肠道内的细菌相互作用。
双歧杆菌菌株间的潜在串扰
分析长双歧杆菌和短双歧杆菌菌株之间的相互作用,证明它们对碳水化合物利用酶的产生显著影响。
双歧双歧杆菌PRL2010和短双歧杆菌UCC2003之间存在交叉喂养机制:
短双歧杆菌UCC2003不能在体外利用唾液酸作为唯一的碳源,尽管它可以以消耗唾液酸的残留物为代价生长。
双歧双歧杆菌PRL2010 从粘蛋白上裂解。事实上,对双歧杆菌属糖苷利用能力的详细分析强调了特定物种专门针对特定碳水化合物的利用,因此表明双歧杆菌物种可能在肠道内合作利用碳水化合物。
也就是说益生菌菌株的混合物可能会产生协同效应,提高它们对肠道菌群以及宿主健康发挥作用的能力。
值得强调的是,某些双歧杆菌定植特征受肠道因素调节,包括其他微生物的存在。具有不同肠道微生物群组成的个体似乎对双歧杆菌补充剂的反应不同,这一事实提供了双歧杆菌-肠道微生物群串扰存在的进一步证据。
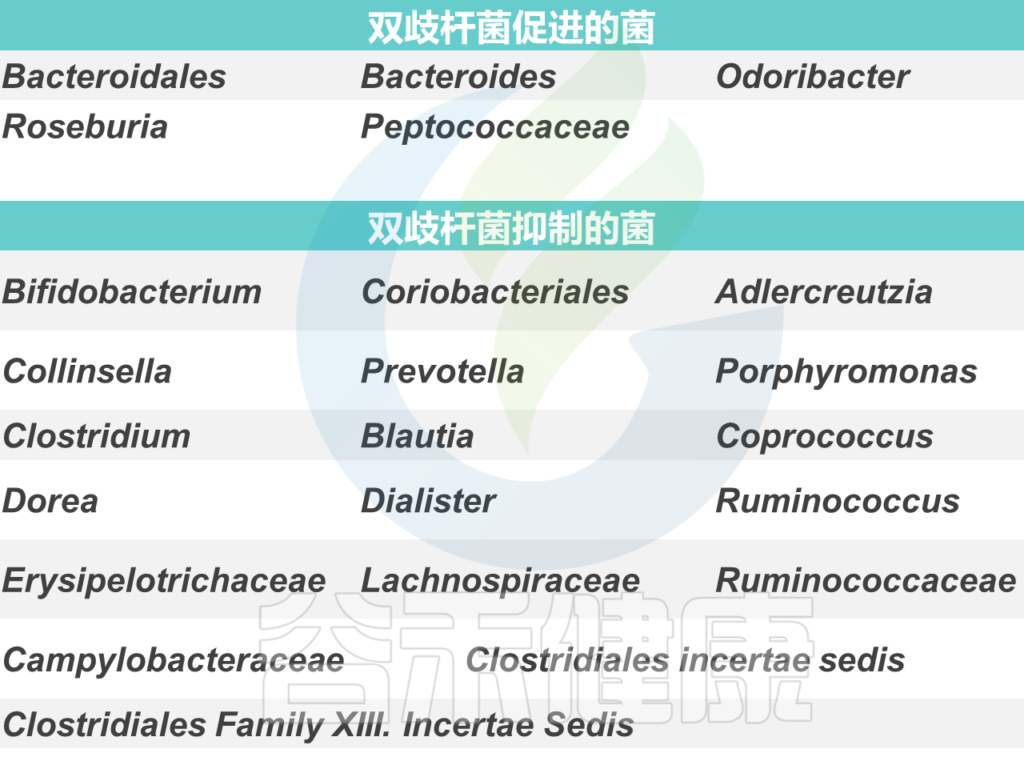
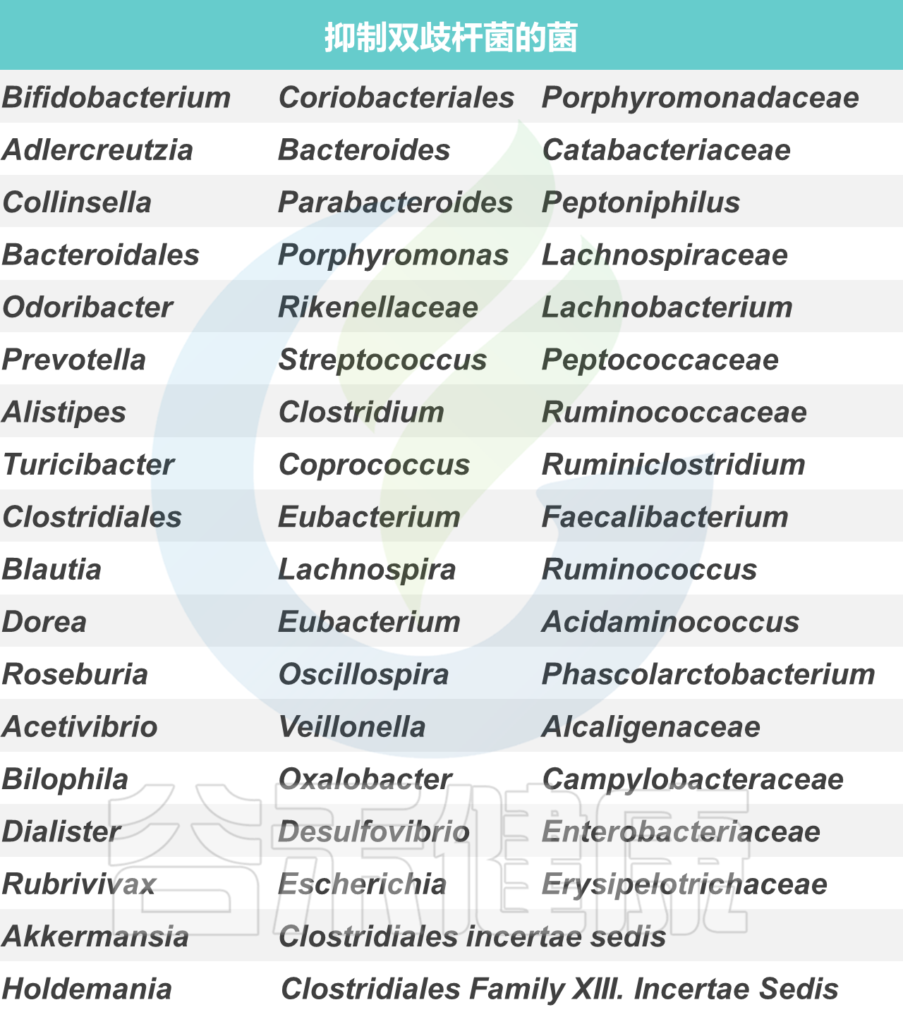
双歧杆菌与其他菌群可能的相互影响如下:
尽管这种不同行为背后的串扰的分子机制还远未被理解,但对它们的理解将极大地帮助设计基于益生菌的疗法,即使在目前在临床试验中被归类为“无反应者”的那些亚群中也能发挥作用。
★
双歧杆菌是革兰氏阳性菌,必须能够在胃肠道运输中存活下来,了解双歧杆菌对克服胃肠道应激因素的反应,对于合理选择益生菌菌株和开发分子工具箱以提高其性能至关重要。最近的发展,如表达载体和突变生成系统,以及功能基因组学和其他组学技术的巨大进步,揭示了双歧杆菌使用多种策略来适应人类肠道的特定环境条件。
▼
在通过胃肠道期间,口服益生菌会遇到各种恶劣的环境条件(下图)。这些条件危及这些有益微生物的生存,损害它们的生存能力和功能。这些包括消化酶、胃中的酸性 pH 值、防御素和肠道中高浓度的胆汁盐。
人类胃肠道的示意图和双歧杆菌对各种环境因素或生态位的反应
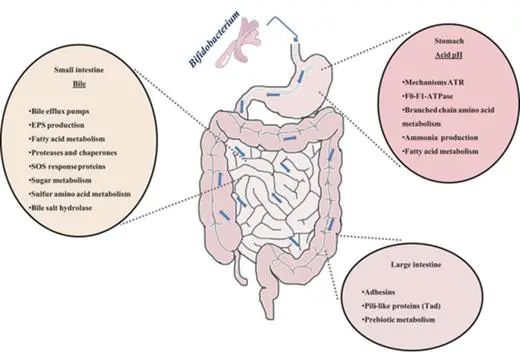
低 pH 值
胃液成分造成的强酸性条件是双歧杆菌在胃中应对的首要障碍之一。除动物双歧杆菌和嗜酸双歧杆菌外,双歧杆菌对酸的耐受性较低。因此,益生菌的使用需要分离具有良好耐酸性的菌株,这些菌株通常对其他技术和胃肠道应激因素表现出交叉抗性。
细菌可能通过一系列酸诱导机制对随后的酸胁迫产生耐受性。双歧杆菌中这种耐酸反应 (ATR) 的分子机制在部分研究中已经被报道。长双歧杆菌中的乳酸和酸适应与 F0-F1-ATP 酶亚基的过量产生有关,这通过增加的 H + 排出活性来抵消这种 H + 积累。
注:暴露于低pH值会影响质子动力,导致H+在细胞内积累。
在双歧杆菌中发现了环境条件(例如可发酵碳源的可用性或生长期)对酸耐受性的强烈影响。这突出了体外模型模拟双歧杆菌在肠道中面临的条件的局限性。
胆汁
胆汁的存在是双歧杆菌在肠道中必须面对的生理障碍之一。胆汁酸是这种生物体液的主要成分,它们具有类似洗涤剂的抗菌特性。这些酸在细胞质中的积累会影响细胞的稳态,导致离子泄漏。
双歧杆菌对这种肠道疾病的抵抗力取决于物种,尽管它们可以通过接触胆汁获得稳定的抵抗表型。这个过程经常涉及对其他压力因素的交叉抗性的出现、抗生素抗性模式的改变、碳水化合物代谢、细胞表面结构和组成,以及它们与肠道生态系统的相互作用等。
酶和抗菌肽
双歧杆菌在胃肠道中存活和功能受到多种因素的影响,其中包括消化酶(如胃蛋白酶和胰酶)、肠道抗菌肽(如防御素和导管素)以及某些益生菌的刺激。
研究表明,消化酶可能影响双歧杆菌的粘附,而肠道抗菌肽可能影响双歧杆菌的存活和功能,但其机制尚未完全了解。
某些益生菌会刺激肠道防御素的产生。B. animalis亚种lactis Bb12导致人体中 β-2-防御素的产生增加,这可能解释了双歧杆菌预防某些感染的能力。
▼
微生物对肠粘膜的粘附是定植过程中的一个重要特征,并且与菌株与宿主相互作用的能力有关。因此,对粘膜的粘附经常被用作选择益生菌菌株的标准。
菌株的粘附能力似乎对免疫调节和竞争性排斥病原体也很重要。肠粘膜的外部区域由覆盖上皮细胞的粘液层组成。这种粘液富含糖蛋白和糖脂,为细菌粘附提供了丰富的目标,包括碳水化合物部分。
竞争性排除肠道病原体
一些益生菌与肠道病原体共享碳水化合物结合特异性,这为使用益生菌对抗过度竞争的病原体以预防感染提供了明确的理由。因此,对人肠粘液和/或人肠上皮细胞系的粘附一直是评估细菌粘附的最常用模型。在这方面,某些双歧杆菌菌株具有从肠道细胞和人体肠道粘液中竞争性排除肠道病原体的能力。
细菌粘附到胃肠道粘膜的机制很复杂,涉及非特异性现象,细胞壁特性和组成以及粘附素的存在等因素,构成了菌株粘附粘膜能力的最重要决定因素。
★
双歧杆菌在预防疾病方面的作用仍在研究中,但它们的一些有益作用包括:
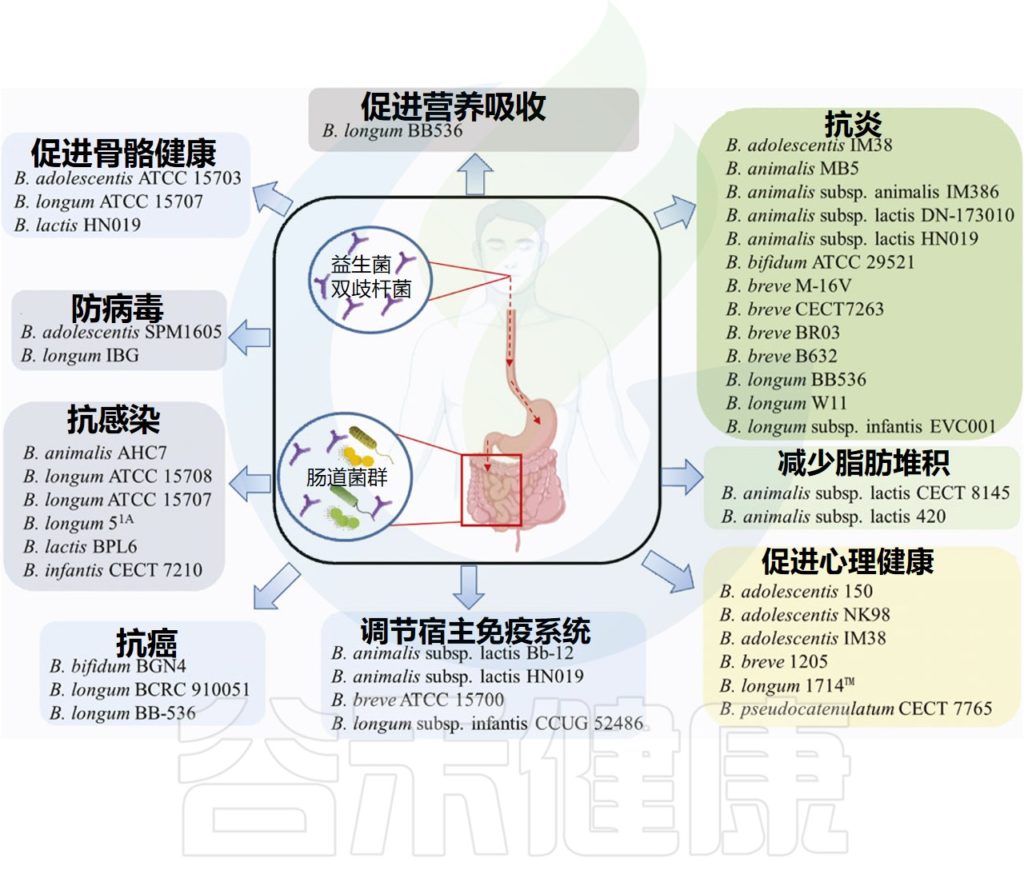
doi.org/10.3389/fbioe.2021.770248
补充双歧杆菌也被证明可以增强肠道新陈代谢,理论支持两者之间的协同相互作用双歧杆菌和其他有益的肠道菌种。
✔ 治疗消化系统疾病中发挥作用
在消化系统中可以看到双歧杆菌最流行的治疗效果之一:
在因使用抗生素而出现腹泻的婴儿中,含有双歧杆菌和嗜热链球菌的益生菌配方可显著降低腹泻的发生率。
施用婴儿双歧杆菌CECT 7210 和短双歧杆菌K-110 可成功抑制轮状病毒并治疗腹泻。
双歧杆菌的抗病毒作用

Lim HJ,et al., J Microbiol Biotechnol. 2020
动物双歧杆菌已发现发酵乳制品中的双歧杆菌可以改善结肠规律性,这引发了关于双歧杆菌是否可以帮助治疗便秘的问题。
✔ 治疗感染疾病中发挥作用
双歧杆菌已被证明对产气荚膜梭状芽孢杆菌、肠病原性大肠杆菌和轮状病毒具有作用。双歧杆菌的另一种普遍尝试的临床应用涉及粪便移植作为治疗复发性艰难梭菌结肠炎的方法。
研究进一步表明双歧杆菌在预防艰难梭菌相关性腹泻、改善幽门螺杆菌根除(与抗生素治疗相结合)以及降低结肠手术后术后感染率方面的功效。
虽然作用机制尚不清楚,但研究报告称,双歧杆菌可减轻炎症性肠病的症状,缓解溃疡性结肠炎,并降低早产儿坏死性小肠结肠炎的发生率。尽管溃疡性结肠炎症状有所改善,但益生菌在克罗恩病的治疗中没有显示出益处。
双歧杆菌属的抗炎作用

Lim HJ,et al., J Microbiol Biotechnol. 2020
✔ 治疗肝病中发挥作用
双歧双歧杆菌可能通过帮助重建肠道菌群在慢性肝病的管理中发挥作用,肠道菌群是肝硬化期间受到干扰的环境。在这些患者中,含双歧杆菌的益生菌补充剂可有效预防肝性脑病的发展,但无法确定对总体死亡率的影响。
✔ 免疫反应中发挥作用
双歧杆菌也可能在刺激宿主的免疫反应中发挥作用:给予长双歧杆菌的小鼠产生了 T 和 B 淋巴细胞的显著增加,以及巨噬细胞吞噬活性的增加。有趣的是,已发现乳糜泻患者肠道微生物组中的双歧杆菌水平较低,并且在一些研究中,益生菌给药可降低 TNF-α 水平并改善症状。
B. animalis、B. longum 和B. bifidum的某些菌株在体外和体内实验中展示的对免疫功能影响的示意图
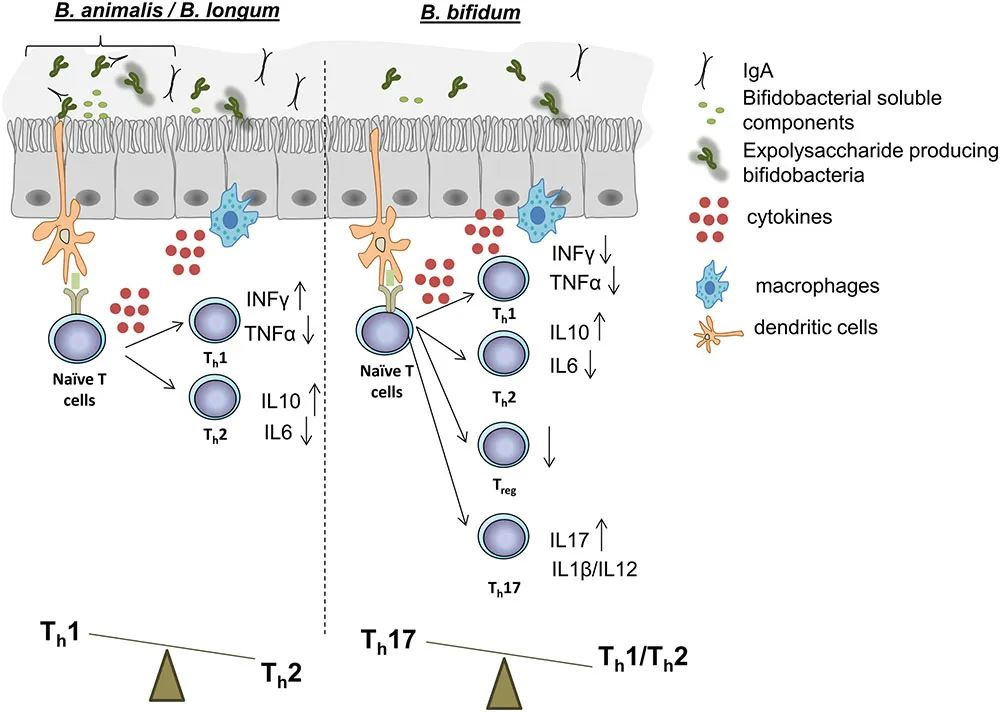
doi.org/10.3389/fmicb.2017.02345
✔ 治疗过敏性疾病中发挥作用
服用含双歧杆菌的益生菌后,患有特应性皮炎和过敏性鼻炎症状的儿童得到改善。还对高危婴儿的特应性皮炎的预防进行了研究,一些证据表明对产前或产后妇女给予益生菌有益。
✔ 治疗代谢性疾病中发挥作用
双歧杆菌对糖尿病、肥胖症和高脂血症的有益作用也得到了研究,证据显示其对普通人群的血糖水平和胰岛素抵抗具有有益作用,同时还能降低孕妇妊娠糖尿病的发病率。
一些数据也已发表,显示含有双歧杆菌的补充剂在降低胆固醇水平方面的功效,尽管更多的证据表明其他益生菌菌株的功效更大。双歧杆菌属,也显示出对减轻体重和减少体脂有益。
✔ 治疗精神类疾病中发挥作用
双歧杆菌益生菌干预在改善重度抑郁症患者的症状方面显示出显着疗效,一些数据表明,服用含双歧杆菌的益生菌补充剂的健康个体和精神分裂症患者的抑郁和焦虑水平发生率较低。
✔ 婴儿人群中发挥作用
在婴儿人群中,补充双歧杆菌可降低极低出生体重婴儿患坏死性小肠结肠炎的风险、降低全因死亡率以及迟发性败血症。
双歧杆菌菌株在人体试验中显示出有效性

编辑
doi.org/10.1128/microbiolspec.BAD-0010-2016
总之,大量证据支持双歧杆菌在治疗和预防多种人类疾病方面的安全、有益作用。
★
各种研究报道双歧杆菌通过不同的机制表现出抗肿瘤作用,包括发酵和生物转化。
不同种类的双歧杆菌通过下调和上调抗凋亡和促凋亡基因对结直肠癌细胞表现出抗癌活性。
此外,双歧杆菌可以与现有的癌症治疗手段发挥协同效应,通过调节免疫反应以帮助抗癌。越来越多的证据表明,双歧杆菌的某些物种和菌株可以改善免疫监视和抗肿瘤反应。
通过对非小细胞肺癌患者队列中癌症治疗有反应者和无反应者的肠道微生物群进行比较,作者发现,对治疗有反应的患者的粪便样本中富含双歧杆菌。
特定的双歧双歧杆菌菌株与癌症治疗协同作用
Hall, L.J, et al.,Nat Microbiol 2021
在癌症小鼠模型中测试了四种商业双歧杆菌菌株。只有那些在细胞壁中表达高水平肽聚糖的菌株在额外处理的同时,才会产生协同效应。产生协同作用的菌株诱导TLR2依赖性反应,导致IFN-γ和IL-2水平升高,并增加抗肿瘤白细胞。研究结果表明,用某些双歧杆菌菌株补充,可能会使无反应患者变得有反应。
体内和体外研究表明,长双歧杆菌和短双歧杆菌菌株能够保护 DNA 免受致癌物的侵害,并在大鼠模型中抑制两种不同致癌物的遗传毒性作用。
另一项研究表明,动物双歧杆菌对致癌物喹诺酮具有抗突变活性。在研究双歧杆菌的潜力在预防和/或治疗癌症方面,发现益生菌和细菌的组合可以减少小鼠结直肠癌模型中致癌物诱导的癌细胞。
双歧杆菌在免疫监视和刺激宿主免疫反应中的作用
一项早期研究表明,将短双歧杆菌添加到淋巴集结细胞的培养物中会导致免疫反应增强,如抗脂多糖抗体生产。
一项更近期的综合研究比较了口服或未口服双歧杆菌的小鼠黑色素瘤的生长情况。接受细菌制剂的小鼠表现出自发的抗肿瘤作用,这些作用在粪便转移后被逆转。
此外,肿瘤控制得到了与检查点封锁相同程度的改善,两者的结合几乎消除了肿瘤的生长。这些作用是通过增加树突状细胞功能、增强 CD8 + T 细胞启动和肿瘤微环境中的积累来介导的。
双歧杆菌可以作为一种运载工具,这种运载工具可以被设计用来表达感兴趣的基因/质粒。
双歧杆菌最有前途的作用,也是未来的药物输送载体。作为一种非致病性厌氧共生细菌,它成为了一种有吸引力的药物递送候选物,第一个肿瘤靶向研究表明该细菌在艾氏腹水小鼠肿瘤中高度定位。双歧杆菌对肿瘤组织的独特定位源于该细菌只能在缺氧条件下生存的厌氧特性:缺氧是恶性肿瘤的普遍现象,在肿瘤中心更为明显,从而选择性地吸引双歧杆菌生物体。
类似的后续工作证明了双歧杆菌不仅能够定位于肿瘤组织,而且能够表达lux报告基因的工程质粒。
几项研究证明了双歧杆菌作为疫苗递送载体、所需基因质粒的载体、可在无需质粒转染的情况下富集抗癌物质(如硒)的细菌的广泛用途。在不同的模式中,双歧杆菌证明有效地选择性靶向肿瘤细胞,同时表现出抗肿瘤作用。
当使用青春双歧杆菌菌株递送时,内皮抑素是一种广泛的血管生成抑制剂,可成功并选择性地抑制血管生成。
肝癌小鼠异种移植模型注射了经改造以表达内皮抑素基因的青春双歧杆菌。结果与细菌对肿瘤的选择性定位一致,因为在处死的正常组织中没有发现杆菌,并且与对照小鼠相比,血管生成受到强烈抑制,肿瘤生长减少。
考虑到双歧杆菌选择性定位于厌氧肿瘤环境的能力,及其携带转染质粒的能力,“货物”基因传递的可能性几乎是无限的。这种运载工具已被用于提供靶向分子通路调节剂。
双歧杆菌递送PTEN,抑制肿瘤生长
一个例子是使用长双歧杆菌穿梭载体递送PTEN,这是一种主要的肿瘤抑制基因,通常在癌发生的早期步骤中丢失,试图“挽救”其在小鼠实体瘤中的表达,并重建抑癌活性。 尽管结果尚未完全发表,但已描述了携带线性质粒的长双歧杆菌 L17菌株的成功改造,该质粒由pMB1和PTEN cDNA上游的HU基因启动子组成。当对小鼠实体瘤给药时,它会显着抑制肿瘤生长。
双歧杆菌递送中草药
如前所述,通过双歧杆菌载体递送药物/产品的可能性实际上是无限的,并且可能会扩展到包括递送正在临床评估的传统医学中使用的产品,比如,臭椿酮。
双歧杆菌递送生物转化剂
双歧杆菌也已被用于将生物转化剂递送至肿瘤部位。在该模型中,将无活性前药转化为其有效活性形式所需的酶通过双歧杆菌穿梭输送,确保在肿瘤内选择性地发生激活。
这种生物转化模型实现了两个目标:
此外,在有假体关节或心脏瓣膜等异物的患者中,细菌可能会脱靶到这些厌氧部位,需要高度警惕。
关于双歧杆菌属药物递送系统的可用临床前研究

doi.org/10.2217/fon-2019-0374
★
双歧杆菌是杂食“动物”,许多食物有利于促进其生长。
优质益生元:
低聚半乳糖GOS、低聚果糖FOS 和 母乳低聚糖HMO 已被用于婴儿配方奶粉,以增强婴儿肠道中的双歧杆菌。它们是经过临床验证的益生元,对促进肠道中的双歧杆菌非常有效。
含有多酚的食物:
苹果皮、红茶和绿茶、黑巧克力、咖啡、橄榄、橄榄油、姜黄和石榴、蔓越莓、蓝莓、黑莓和覆盆子等深色水果,适量葡萄酒等。
含有可溶性纤维的食物:
苹果、梨、燕麦、大麦、萝卜、西兰花、鳄梨和豆类。
含有抗性淀粉的食物:
绿色或半绿色香蕉、煮熟和冷却的土豆、煮熟和冷却的米饭、豆类和豆类。
某些发酵食品:
例如,酸奶,开菲尔,泡菜等。
其他食物:
例如:菊苣、洋葱、大蒜等。
如何知道这些吃进去的食品或补充剂对双歧杆菌产生影响?
肠道菌群检测是目前较为直观地反映补充剂和食物对肠道双歧杆菌影响的方法,使用 DNA 测序技术评估肠道中的菌群丰度。
如果通过检测发现双歧杆菌处于正常水平,则不需要额外补充,过高的双歧杆菌水平并不代表更健康;如果发现双歧杆菌缺乏,那么通过食物或益生菌补充剂等各种针对性补充方式是有利于健康的手段之一。
双歧杆菌是益生菌混合物的重要组成部分,当以适当的剂量给药时,它基本上具有各种有益健康的特性,包括抗感染、抗炎、抗癌、促进宿主心理和身体健康以及调节宿主免疫系统。
双歧杆菌通过抑制促炎细胞因子,诱导抗炎细胞因子来调节免疫系统,表明其作为感染性或炎症性疾病或癌症的潜在疗法的有效性。
当然,并非所有双歧杆菌都可以是益生菌菌株,需要正确识别益生菌干预的菌株、病理学和对应人群。深入理解双歧杆菌在宿主微生物组中的作用机制,从而了解更多未来使用这些微生物治疗疾病的影响和安全性。
此外,双歧杆菌工程可以促进增值化学品的生物产量的增加,同时消耗更少的资源。有必要进一步研究双歧杆菌作为工程宿主的可行性。
除了特定保健食品和医药行业外,双歧杆菌在微生态护肤、畜业、水产业和肉制品加工中也广泛应用,大有开发价值。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Turroni F, van Sinderen D, Ventura M. Genomics and ecological overview of the genus Bifidobacterium. Int J Food Microbiol. 2011 Sep 1;149(1):37-44. doi: 10.1016/j.ijfoodmicro.2010.12.010. Epub 2010 Dec 28. PMID: 21276626.
Lim HJ, Shin HS. Antimicrobial and Immunomodulatory Effects of Bifidobacterium Strains: A Review. J Microbiol Biotechnol. 2020 Dec 28;30(12):1793-1800. doi: 10.4014/jmb.2007.07046. PMID: 33144551; PMCID: PMC9728261.
Chen J, Chen X, Ho CL. Recent Development of Probiotic Bifidobacteria for Treating Human Diseases. Front Bioeng Biotechnol. 2021 Dec 22;9:770248. doi: 10.3389/fbioe.2021.770248. PMID: 35004640; PMCID: PMC8727868.
Sanchez B, Ruiz L, de los Reyes-Gavilan CG, Margolles A. Proteomics of stress response in Bifidobacterium. Front Biosci. 2008 May 1;13:6905-19. doi: 10.2741/3198. PMID: 18508704.
Sánchez B, Ruiz L, Gueimonde M, Ruas-Madiedo P, Margolles A. Adaptation of bifidobacteria to the gastrointestinal tract and functional consequences. Pharmacol Res. 2013 Mar;69(1):127-36. doi: 10.1016/j.phrs.2012.11.004. Epub 2012 Nov 22. PMID: 23178557.
Luo J, Li Y, Xie J, Gao L, Liu L, Ou S, Chen L, Peng X. The primary biological network of Bifidobacterium in the gut. FEMS Microbiol Lett. 2018 Apr 1;365(8). doi: 10.1093/femsle/fny057. PMID: 29546277.
González-Rodríguez I, Ruiz L, Gueimonde M, Margolles A, Sánchez B. Factors involved in the colonization and survival of bifidobacteria in the gastrointestinal tract. FEMS Microbiol Lett. 2013 Mar;340(1):1-10. doi: 10.1111/1574-6968.12056. Epub 2012 Dec 17. PMID: 23181549.
Andriantsoanirina V, Allano S, Butel MJ, Aires J. Tolerance of Bifidobacterium human isolates to bile, acid and oxygen. Anaerobe. 2013 Jun;21:39-42. doi: 10.1016/j.anaerobe.2013.04.005. Epub 2013 Apr 15. PMID: 23598280.
Gwiazdowska D, Juś K, Jasnowska-Małecka J, Kluczyńska K. The impact of polyphenols on Bifidobacterium growth. Acta Biochim Pol. 2015;62(4):895-901. doi: 10.18388/abp.2015_1154. Epub 2015 Nov 30. PMID: 26619254.
Jung DH, Seo DH, Kim YJ, Chung WH, Nam YD, Park CS. The presence of resistant starch-degrading amylases in Bifidobacterium adolescentis of the human gut. Int J Biol Macromol. 2020 Oct 15;161:389-397. doi: 10.1016/j.ijbiomac.2020.05.235. Epub 2020 May 30. PMID: 32479932.
Ferrario C, Milani C, Mancabelli L, Lugli GA, Turroni F, Duranti S, Mangifesta M, Viappiani A, Sinderen Dv, Ventura M. A genome-based identification approach for members of the genus Bifidobacterium. FEMS Microbiol Ecol. 2015 Mar;91(3):fiv009. doi: 10.1093/femsec/fiv009. Epub 2015 Jan 27. PMID: 25764568.
Lugli GA, Milani C, Turroni F, Tremblay D, Ferrario C, Mancabelli L, Duranti S, Ward DV, Ossiprandi MC, Moineau S, van Sinderen D, Ventura M. Prophages of the genus Bifidobacterium as modulating agents of the infant gut microbiota. Environ Microbiol. 2016 Jul;18(7):2196-213. doi: 10.1111/1462-2920.13154. Epub 2016 Jan 18. PMID: 26627180.
Lugli GA, Milani C, Turroni F, Duranti S, Ferrario C, Viappiani A, Mancabelli L, Mangifesta M, Taminiau B, Delcenserie V, van Sinderen D, Ventura M. Investigation of the evolutionary development of the genus Bifidobacterium by comparative genomics. Appl Environ Microbiol. 2014 Oct;80(20):6383-94. doi: 10.1128/AEM.02004-14. Epub 2014 Aug 8. PMID: 25107967; PMCID: PMC4178631.
Collado MC, Hernández M, Sanz Y. Production of bacteriocin-like inhibitory compounds by human fecal Bifidobacterium strains. J Food Prot. 2005 May;68(5):1034-40. doi: 10.4315/0362-028x-68.5.1034. PMID: 15895738.

谷禾健康


什么是天然产物?
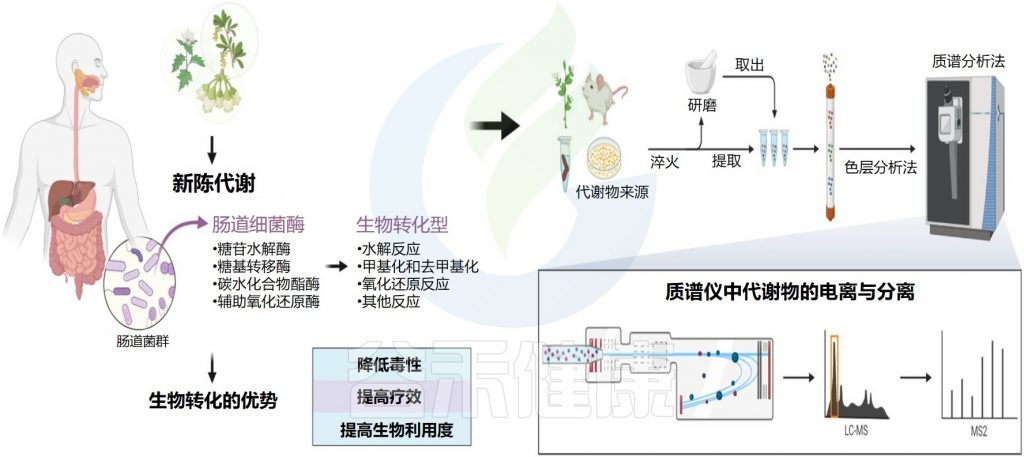
天然产物是指动物、植物、昆虫或微生物体内的组成成分或其代谢产物以及人和动物体内许多内源性的化学成分,是自然产生的小分子。值得注意的是,天然产物来源中,植物来源占85%以上。
谷禾在这里主要介绍植物来源的天然产物,包括营养素和药物。它们很容易与肠道微生物群相互作用,因为它们的成分复杂,在肠道中的停留时间长。通常,外源物质在小肠中的停留时间为1-6小时,在结肠中的停留时间为1-3天。特定的肠道微生物分解和转化天然产物,产生丰富的代谢物和功能化合物,具有宿主本身无法合成的生理活性。
天然产物在食品、药品、保健品领域均有运用。天然产物是极为重要的新药来源。近年来临床应用的药物,三分之二左右源自天然产物、天然产物衍生物以及天然的生物大分子,几乎涵盖了疾病治疗的各个方面。这在防治癌症及传染类疾病领域中的表现尤为明显。
天然产物在临床上得到了广泛的应用,其特点是多组分、多靶点、药效学物质多、作用机理复杂、生理活性多样。
对于口服天然产物,肠道菌群与临床疗效密切相关,但这种关系尚不明朗。肠道微生物在酶系统多样性引起的天然产物的转化和利用中起着重要作用。黄酮类化合物、生物碱、木酚素和酚类等有效成分不能通过人体消化酶直接代谢,但可以通过肠道微生物产生的酶转化,然后加以利用。因此,重点是通过肠道微生物群进行天然产物的代谢。
本文介绍了肠道微生物群及其对天然产物各组分生物转化的影响的研究,并强调了所涉及的常见菌群,反应类型,药理作用和研究方法。为临床疾病防治中的应用提供理论支持,以及日常的选择健康的药物提供一定的参考,并为基于肠道生物转化的天然产物研究提供新思路。
基于肠道微生物的天然产物的生物转化和代谢
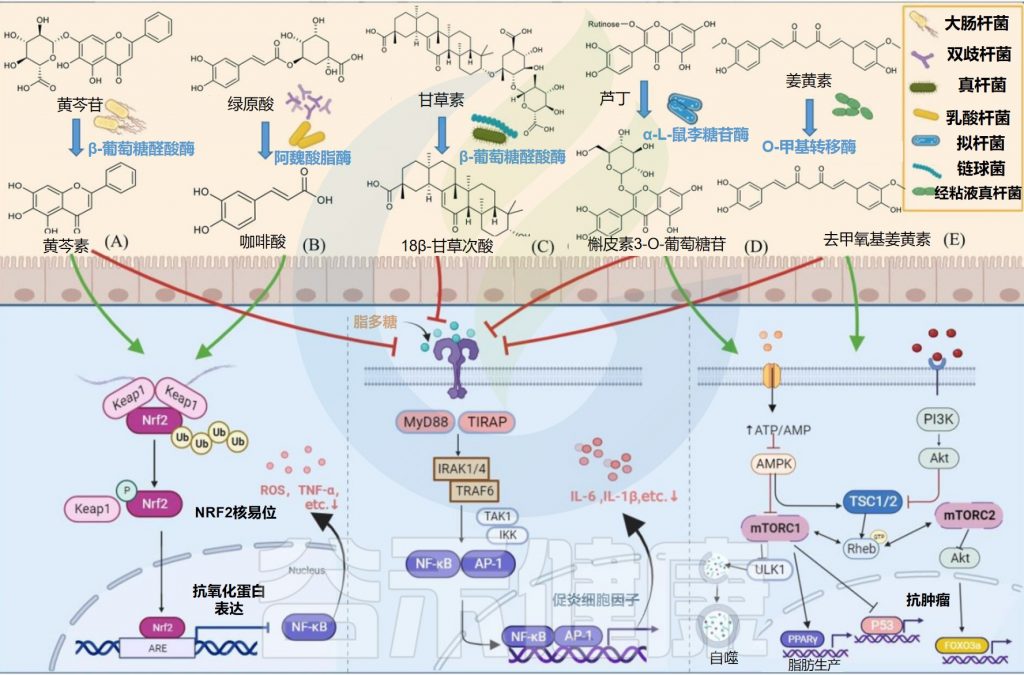

Zhao Y,et al.Front Microbiol.2022
★人体肠道中的微生物
肠道微生物群由1000-1250种细菌组成,这些细菌以各种形式与人类相互作用,例如共生和寄生,这种相互作用通过微生物代谢物作为信号分子极大地影响人类健康。
肠道微生物构成了一个动态和多样化的微生态系统,这是抵抗致病细菌的天然屏障。肠道微生物具有丰富的酶系统,包括葡萄糖苷酶,还原酶,裂解酶,转移酶等,并大大扩展了人体内的代谢反应池。
✦肠道菌群影响口服给药的效果
口服给药是药物递送的首选途径,口服药物占市场最畅销药物的大部分。近年来,肠道微生物群对天然产物口服给药稳定性的影响受到广泛关注。
肠道具有丰富的细菌,有助于正常的消化功能,其中健康受试者中约98%的肠道微生物可分为四个门,厚壁菌门(Firmicutes),拟杆菌门(Bacteroidetes),变形菌门(Proteobacteria)和放线菌门(Actinobacteria)。
一些肠道微生物如大肠杆菌,双歧杆菌,真杆菌,乳酸杆菌,拟杆菌和链球菌参与天然产物的生物转化,其部分代谢物有利于肠道吸收并发挥显著的药理作用。
关键肠道微生物对天然产物的生物转化

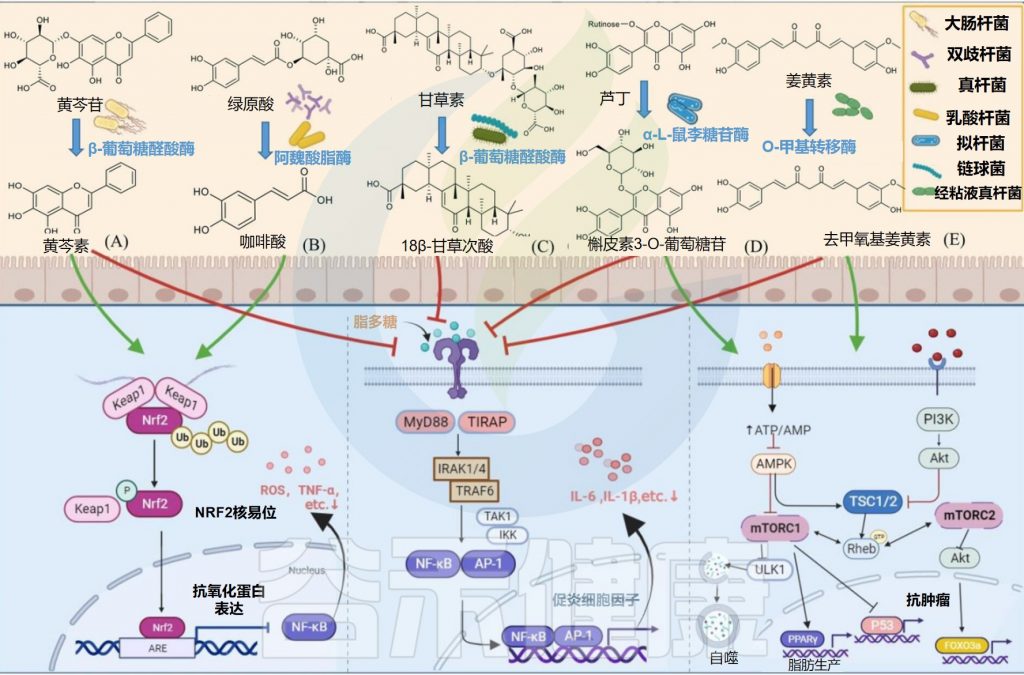
Zhao Y,et al.Front Microbiol.2022
▸
大肠杆菌(Escherichia coli),又叫大肠埃希氏菌,是一种革兰氏阴性,无孢子,兼性厌氧细菌,主要栖息在脊椎动物的肠道中。
✦水解黄芩苷而具有抗炎抗氧化作用
部分大肠杆菌可以产生糖苷酶参与外源物质的转化,从而产生其有益作用。例如,E.coli HGU-3产生β-葡萄糖醛酸酶,水解黄芩苷中的糖苷键以产生黄芩素。
在相同剂量下,黄芩素比黄芩蒿素更有效地抑制组胺诱导的抓挠行为,并通过抑制Nrf2-ARE和NF-κB信号通路而具有抗炎和抗氧化作用。
✦在脂肪肝变性中有治疗益处
一些大肠杆菌菌株具有较高的姜黄素转化活性。E.coli DH10B的高表达NADPH依赖性姜黄素/二氢姜黄素还原酶(CurA)将姜黄素还原为二氢姜黄素(DHC)和四氢姜黄素(THC),其全基因组序列已经确定。
NADPH是一种辅酶,叫还原型辅酶Ⅱ,学名烟酰胺腺嘌呤二核苷酸,在很多生物体内的化学反应中起递氢体的作用,具有重要的意义。
二氢姜黄素和四氢姜黄素通过调节SREBP-1C和PPARα的mRNA和蛋白质表达水平来降低细胞中的甘油三酯水平,并以依赖性方式衰减肝脏脂肪生成;二氢姜黄素和四氢姜黄素在肝脂肪变性中比姜黄素具有新的治疗益处。
✦水解肉桂酸后有抗氧化和抗癌特性
E.coli Nu, E.coli MC和E.coli WC-1具有肉桂酰酯酶活性,可通过水解共轭羟基肉桂酸和游离羟基肉桂酸酯释放羟肉桂酸,在体外和体内均显示出抗氧化和抗癌特性。
目前,对大肠杆菌的遗传和生化特征的良好理解可能有助于在体外合成具有各种健康活性的天然产物衍生物。
▸
双歧杆菌(Bifidobacterium)是属于放线菌门的广泛而丰富的属,是人类肠道微生物群的首批定植者之一。人类肠道中最常见的双歧杆菌包括青春期双歧杆菌,B.angulatum, B.bifidum, B. breve, B.catenulatum, B.dentium, B.longum, B.pseudocatenulatum和B.pseudolongum,占成人微生物组的10%,它们与宿主健康有关。
✦预防急性肝损伤
某些种类的双歧杆菌可以通过表达阿魏酰酯酶产生酚酸。例如,动物双歧杆菌的阿魏酰酯酶可以将绿原酸(CHA)水解成咖啡酸(CAA)。咖啡酸可以通过增加Nrf2转录来预防对乙酰氨基酚诱导的小鼠急性肝损伤。
✦调节胆汁酸和降低胆固醇
部分双歧杆菌的参与促进了黄烷酮,糖苷和皂苷在肠道中的代谢。B.longum R0175中的β-葡萄糖苷酶和去甲基化酶通过环裂解和脱甲基作用促进3-(3′-羟基苯基)丙酸和3-苯丙酸的产生。
B.longum SBT2928水解六种主要的人类和两种动物胆汁盐。因此,双歧杆菌可以调节胆汁酸代谢并降低体内胆固醇水平。
✦抗肿瘤和提高免疫
此外,B.breve ATCC 15700产生β-葡萄糖苷酶,在人参皂苷Rd的C-3和C-20位置裂解糖苷,生成脱糖基化的人参皂苷。
人参皂苷主要存在于人参和马铃薯药材中
人参皂甙的作用和功能是抑制肿瘤细胞的生长,诱导肿瘤细胞死亡,研究肿瘤的活性功能,肿瘤的异常逆行分化,提高人体免疫功能。
这些天然产物具有潜在的益处,代谢特征使双歧杆菌成为共生发展的主要候选者。
▸
真杆菌(Eubacterium)菌株的属是革兰氏阳性菌,它是人类肠道微生物群的核心属之一,并显示出在人类肠道的广泛定植。
一些真杆菌产生糖苷酶,还原酶等,并参与外源性物质的代谢。
✦抗炎抗氧化
E. ramulus是研究最广泛的类黄酮降解肠道细菌之一,它在人体肠道中很普遍。广泛存在于人体肠道中。来自E. ramulus的查尔酮异构酶和黄烷酮/黄烷醇裂解还原酶降解某些类黄酮产生查尔酮和二氢查尔酮。
二氢查尔酮及其代谢物具有抗炎和抗氧化作用,可以下调促炎细胞因子的分泌,并挽救脂多糖诱导的氧化磷酸化。
✦降解黄酮类化合物
研究了E.ramulus strain wK1对槲皮素和木犀草素的降解,发现静止细胞和酶制剂通过2,3位双键的还原和随后的环分裂将这些黄酮转化为3,4-二羟基苯基乙酸和3-(3,4-二羟基苯基)丙酸。
来自E.ramulus strain wK1的根皮素水解酶将邻近根皮素芳香A环的C-C键水解为3-(4-羟基苯基)丙酸和间苯三酚。
E.cellulosolvens ATCC 43171T可通过释放的葡萄糖部分的发酵促进类黄酮和葡萄糖苷的去糖基化。
注意:葡萄糖苷的去糖化仅由细菌酶催化。
✦预防气道过敏性炎症
Eubacterium L-8将甘草酸(GL)水解为18β-甘草次酸(18β-GA)。18β-甘草次酸通过抑制NF-κB磷酸化和增强Nrf2/HO-1通路来预防气道过敏性炎症。
NF-kB——核因子κB,参与细胞对外界刺激的响应,在细胞的炎症反应、免疫应答等过程中起到关键性作用
Nrf2/HO-1信号通路已成为细胞抗氧化应激的主要防御机制之一
这些代谢转化体现从真杆菌中获得的各种益处。然而,还需要进一步的体内研究,以最大限度地发挥真杆菌属的潜在益处。
▸
乳酸菌属(Lactobacillus)属于厚壁菌门,可以平衡微生物群落并保护胃肠粘膜。一些乳杆菌属富含代谢酶,如α-鼠李糖酶,单宁酶,没食子酸酯脱羧酶等,它们转化外源性物质。
✦抗炎、抗氧化作用
L. rhamnosus NCTC 10302具有β-葡糖苷酶和α-鼠李糖苷酶活性,通过水解,环裂变和脱氢将橙皮素7-O-葡萄糖苷和柚皮素-7-O-芸香糖苷转化为各自的糖苷元和3-(苯基)丙酸。
L. plantarum表达单宁酶水解没食子酸酯,具有短脂肪醇取代基的原儿茶酸酯和复杂的没食子单宁以产生没食子酸。没食子酸通过抑制MAPK/NF-κB途径并激活Akt/AMPK/ Nrf2途径,在脂多糖诱导的炎症和氧化应激中起保护作用。
MAPK是信号从细胞表面传导到细胞核内部的重要传递者。
Akt,蛋白激酶B,又称PKB或Rac,在细胞存活和凋亡中起重要作用。
✦预防代谢紊乱
观察到,没食子酸和邻苯三酚是由L.plantarum WCFS1中没食子甘氨酸代谢酶降解没食子甘肽而产生的。这项研究意味着益生元-益生菌相互作用在预防饮食诱导的代谢紊乱方面的潜在作用。
✦改善骨质疏松
具有大豆苷元还原酶活性的Lactobacillus sp. Niu-O16。二氢大豆苷元抑制NF-κB活化和MAPK磷酸化,从而改善骨质疏松症。
L.casei, L.plantarum和L.acidophilus影响白藜芦醇苷到白藜芦醇的去糖基化。这种转化对于提高白藜芦醇苷的生物利用度和生物活性非常重要。来自L.reuteri, L.helveticus和L.fermentum的阿魏酰酯酶水解绿原酸以释放咖啡酸。
这些发现为乳杆菌在促进健康的制药和食品应用中的作用开辟了新的视角。然而,潜在的转化机制值得进一步研究。
▸
拟杆菌属(Bacteroides)的成员是革兰氏阴性专性厌氧菌,占结肠中细菌总数的25%,在人类肠道细菌组中起着多种作用。在临床中经常检测到拟杆菌物种,例如脆弱拟杆菌,B.distasonis, B.ovatus和B.thetaiotaomicron。
✦抑制炎症反应
拟杆菌属拥有一系列水解酶,并通过转化外来物质参与与其微生物邻居的物种间关联。体外共孵育实验表明,某些拟杆菌物种参与类黄酮的生物转化。
Bacteroides sp. 45表达α-L-鼠李糖苷酶和β-芦丁糖苷酶,用于将芦丁水解成槲皮素3-O-葡萄糖苷,槲皮素和白花青素。
槲皮素3-O-葡萄糖苷比其他形式的槲皮素吸收得更好,并且可以通过抑制NF-κB和MAPK信号通路来抑制结肠炎小鼠的炎症反应。
Bacteroides sp. 54将槲皮苷代谢为羟基槲皮素和去甲基槲皮素。槲皮苷也被α-L-鼠李糖苷酶降解为槲皮素,并通过Bacteroides sp.45进行进一步的环裂解以产生3,4-二羟基苯甲酸。
β-葡萄糖醛酸酶由拟杆菌J-37表达,将甘草酸代谢为18β-甘草次酸。
天然产物在拟杆菌作用下进行生物转化,产生具有不同功能活性的代谢物。了解人体内天然产物的整个过程以评估其对人体健康的影响是很重要的。
▸
链球菌属(Streptococcus)是革兰氏阳性菌,呈球形或卵形,通常成链排列或成对排列,广泛存在于人类粪便和鼻咽中。
宏转录组学分析表明,磷酸转移酶系统主要由链球菌表达,这表明这些细菌是小肠中可用碳水化合物的主要利用者。
✦抗癌、抗过敏作用
Streptococcus LJ-22表达β-葡萄糖醛酸酶将甘草酸代谢为18β-甘草次酸-3-O-β-D-葡萄糖醛酸(GAMG)。GAMG对脂多糖诱导的RAW264.7细胞具有抗过敏活性。
甘草酸和甘草次酸均有一定的防癌和抗癌作用。甘草次酸可抑制原癌细胞的信息传递和基因表达.甘草酸对多种恶性肿瘤均有抑制作用。甘草次酸还具有抗病毒感染的作用,对致癌性的病毒如肝炎病毒,EB病毒及艾滋病毒的感染均有抑制作用。
此外,单宁酸被Streptococcus gallolyticus subsp.Gallolyticus(SGG)的单宁酶降解以产生邻苯三酚。SGG可能通过消除单宁酸对肿瘤细胞的毒性来促进结直肠癌的发展。因此,有必要进行进一步的体内研究,以确定消除这些单宁酸降解微生物是否可以支持结直肠癌的有效治疗。
✦降低血压,抗氧化
S.thermophilus GIM 1.321很高的β-葡萄糖苷酶生产能力,用于将果实花青素降解为绿原酸,咖啡酸和阿魏酸。
CAA和CHA(10/15毫克/千克/天)的施用可以降低血压并发挥抗氧化作用。
链球菌菌株可能是肠道中的共生、致病和机会性病原体,需要更多关于其对人类健康影响的信息。更好地了解链球菌如何代谢天然产物,可以调节肠道微生物组以提高治疗效果。
▸
经黏液真杆菌(Blautia)属物种严格无氧,不可移动,通常为球形或椭圆形,广泛存在于哺乳动物的肠道和粪便中。越来越多的证据表明,经黏液真杆菌的益生菌特性对天然产物的生物转化有影响。
✦影响生物转化
在类黄酮生物转化过程中,Blautia催化的反应包括去甲基化,去糖基化以及环裂解,其可能被相应的酶催化,例如O-糖苷酶和β-葡萄糖苷酶。
研究表明,Blautia sp. MRG-PMF1菌株分别将5,7-二甲氧基黄酮和5,7,4-三甲氧基黄酮转化为生物活性白杨素和芹菜素,对芳基甲基醚官能团具有水解能力。Blautia sp. MRG-PMF1还具有去糖基化活性,并且发现各种异黄酮,黄酮和黄酮被代谢成相应的糖苷元。
✦去甲基产物具有抗炎、抗癌、抗氧化能力
Blautia sp. MRG-PMF1在菌株进一步代谢具有雌激素作用的去甲基香菜素。该菌株还可以催化姜黄素以产生具有抗炎和抗癌特性的去甲氧基姜黄素。
此外,Blautia sp. AUH-JLD56能够单独生物转化牛蒡子苷或牛蒡子苷元,制成具有更好抗氧化能力的去甲基化产物。
最近,关于Blautia对草本植物和功能性食品的生物转化和代谢研究越来越多。探索Blautia的生物转化对于开发新的酶和生物活性代谢物具有重要意义。
复杂的微生物酶催化肠道中天然产物的代谢,产生有利于宿主利用/排泄的亲脂性和低分子量代谢物。与人类遗传学不同,肠道微生物组的特征是可改变的,使其成为优化治疗的潜在治疗靶点。
口服天然产品进入消化道后,首先会接触大量肠道微生物及其产生的活性酶。因此,天然产物的肠道生物转化可能发生在通过肝脏的第一次传递效应之前,也可以被运输到肝脏进行修饰/结合,然后排泄到肠道,与肠道微生物反应形成一系列代谢产物。
因此,与健康或疾病相关的特定菌株、特定代谢途径和特定酶的组合对于确定肠道微生物对宿主的影响非常重要。
✦水解提高生物活性和生物利用度
某些天然产物具有高分子量和低脂溶性,并且它们难以在肠道中被人体吸收并且具有低生物利用度。通过肠道微生物介导的水解,它们的物理性质发生了变化,它们的生物活性和生物利用度大大提高。
大多数糖苷具有低活性,被认为是“天然前体药物”。在与肠道微生物相互作用后,糖苷的糖基被去除,然后,糖苷部分被肠细胞吸收以发挥生理作用。水解反应是进一步转化所必需的,产物(例如糖)参与促进肠道微生物的生长和存活。
肠道微生物对天然产物的水解反应



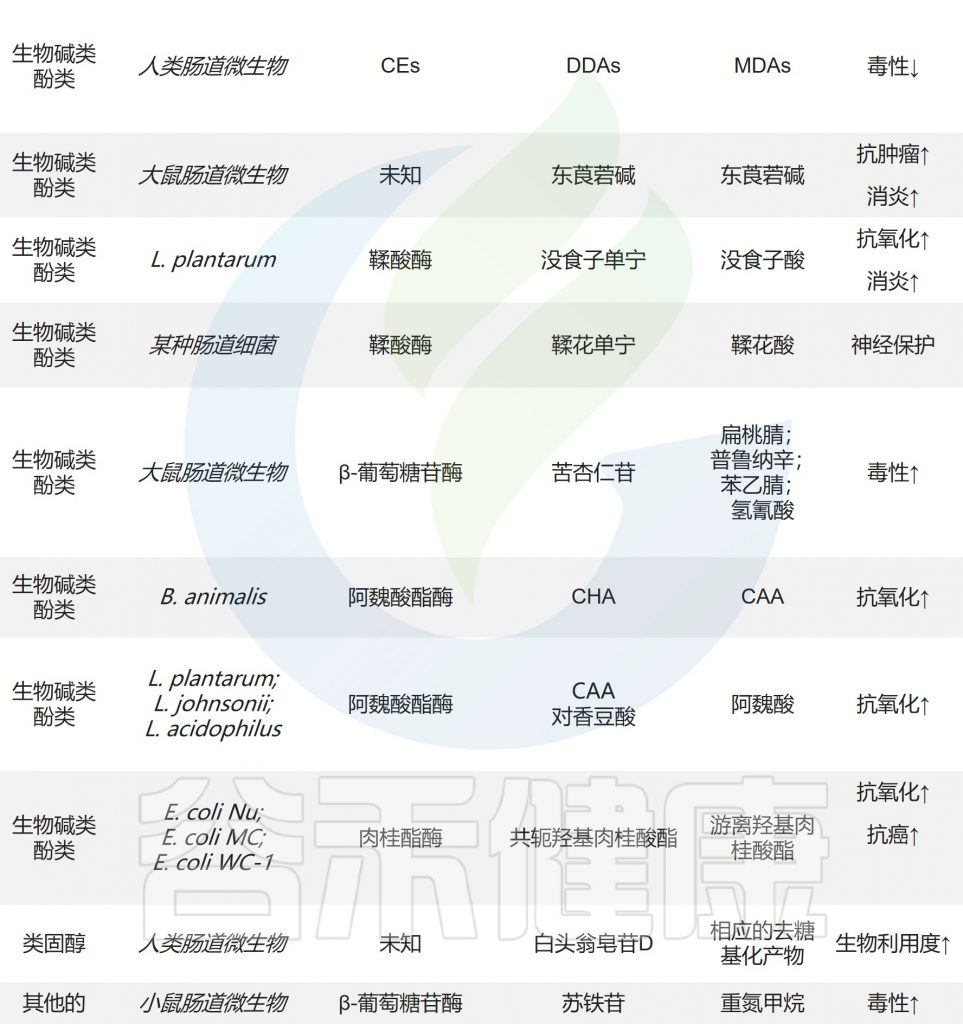




Zhao Y,et al.Front Microbiol.2022
✦类黄酮
类黄酮是天然酚类化合物,大量存在于水果和蔬菜中。肠道微生物可能是黄酮类化合物(糖苷形式)功效的部分原因,由于存在水溶性糖成分,其生物利用度较低。
具有3羟基黄酮碱和平面环体系的黄烷醇构成了一类重要的黄酮类化合物。异鼠李素-3-O-新橙皮苷首先被Escherichia sp.23脱糖基化为异鼠李苷-3-O–葡糖苷,去糖基化成苷元异鼠李甙。
•肠道酶代谢比肠道微生物更快
肠道微生物和衍生酶共同控制通过体外测定确定的淫羊藿类黄酮的代谢。在目前的研究中,肠道酶代谢类黄酮的速度比肠道微生物更快。
来自Bacteroides thetaiotaomicron VPI-5482的α-L-鼠李糖苷酶可以水解淫羊藿定C的α-1,2糖苷键以产生芸香苷。
芸香苷,又叫芦丁。具有抗炎、抗氧化、抗过敏、抗病毒等功效。
•肠道酶在水解中起着重要作用
E. ramulus和Clostridium saccharogumia将花青素-氰苷3-葡萄糖苷转化为氰苷。人类肠道酶如β-葡糖苷酶在汉黄芩苷水解成汉黄苷素中起着关键作用。
茶氨酸菌素A是红茶中发现的一种生物活性儿茶素二聚体,通过人类粪便微生物群脱乙酰产生茶氨酸霉素C。
•空间位阻会限制酶降解
观察了黄烷醇的代谢差异,结果表明,在肠道微生物发酵过程中,空间位阻可能限制细菌酶降解部分黄烷醇环。
在肠道微生物的作用下,许多其他类黄酮也会发生水解反应。值得注意的是,考虑到类黄酮的结构差异,肠道微生物对类黄酮的降解程度差异很大,从而影响其生物可利用性。需要进一步研究肠道代谢在类黄酮生物利用度和吸收中的作用,以及可能的细菌类黄酮相互作用活性。
✦萜类化合物
萜类化合物是具有抗癌,抗炎和神经保护作用的最大一类天然产物。部分萜类化合物也可被肠道微生物水解。
萜类化合物广泛存在于自然界,是构成某些植物的香精、树脂、色素等的主要成分。如玫瑰油、桉叶油、松脂等都含有多种萜类化合物。另外,某些动物的激素、维生素等也属于萜类化合物。
肠道微生物也可以水解部分萜类化合物。京尼平苷在Eubacterium sp. A-44表达的β-葡萄糖苷酶的作用下产生京尼平。芍药苷在β-葡萄糖苷酶的作用下转化为PM-I,该酶由L. brevis和脆弱拟杆菌(B. fragilis)表达。通过与大鼠厌氧肠道微生物群孵育,芍药苷也被脱糖并脱苯基为小分子量的白花苷和酰基白花苷。
•肠道微生物中的酶促进水解作用
研究证明,几种具有酯酶的双歧杆菌物种可以在体外将白芍苷水解为苯甲酸。体外研究表明积雪草苷被糖苷键水解酶逐渐去糖基化,并产生相应的苷元。柴胡皂苷B1在β-葡萄糖苷酶和β-D-聚焦酶的作用下逐渐水解为原柴胡皂素和柴胡皂甙A,由Eubacterium sp. A-44表达。
除上述化合物外,萜类人参皂苷Rh2、阿迪普西洛苷I、罗汉果苷III和具栖冬青苷也可在肠道微生物的作用下发生水解反应。
肠道微生物在萜类化合物代谢中起着重要作用,其代谢产物对肠道微生物组和人体健康的影响有待进一步研究。
✦其他化合物
具有极低生物利用度的尿石素只有在来自Gordonibacter urolithinfaciens, Gordonibacter pamelaeae和Ellagibacter isourolithinifaciens的鞣酸酶作用下水解成鞣花酸和尿石等衍生物时才能发挥药理作用。
尿石素——存在于水果和坚果中的一类化合物鞣花单宁的天然代谢产物
从大黄中提取的蒽醌糖苷被肠道微生物水解为蒽醌苷元。Sennoside A是大黄提取物的主要成分,通过Bifidobacterium sp. strain SEN的β-葡萄糖苷酶代谢为大黄蒽酮。
大黄蒽酮具有泻下攻积、清热泻火、解毒、活血祛瘀、利胆退黄等功效。
在肠道微生物表达的羧酸酯酶(CE)的作用下,二酯二萜生物碱(DDAs,如乌头碱)水解C-8和C-14的酯键,产生毒性较小的单酯二萜生物碱。生物碱东莨菪碱、类固醇化合物白头翁皂苷D和半胱氨酸在肠道微生物的作用下也会发生水解反应。
小结
水解反应是肠道微生物代谢天然产物的重要步骤,是生物活性表达和进一步生物转化所必需的。
应重点关注参与该反应的特定微生物和酶,以充分了解天然产物的最终命运及其对人体健康的影响,并为个性化治疗提供依据。
肠道微生物可以通过亲核取代反应表达转移酶并在两种底物之间移动官能团。
肠道微生物将甲基添加到外源物质中需要化学活化的辅底物,如乙酰辅酶A、三磷酸腺苷或腺苷甲硫氨酸,而去甲基化需要可以进行亲核催化的辅因子。
甲基化修饰可以优化天然产物的生理活性,去甲基化可以释放极性基团以进一步结合和排出体外,并为肠道微生物的生长提供碳源。
下图显示了肠道微生物作用下天然产物的甲基化和去甲基化以及带来的影响。
肠道微生物对天然产物的甲基化和去甲基化

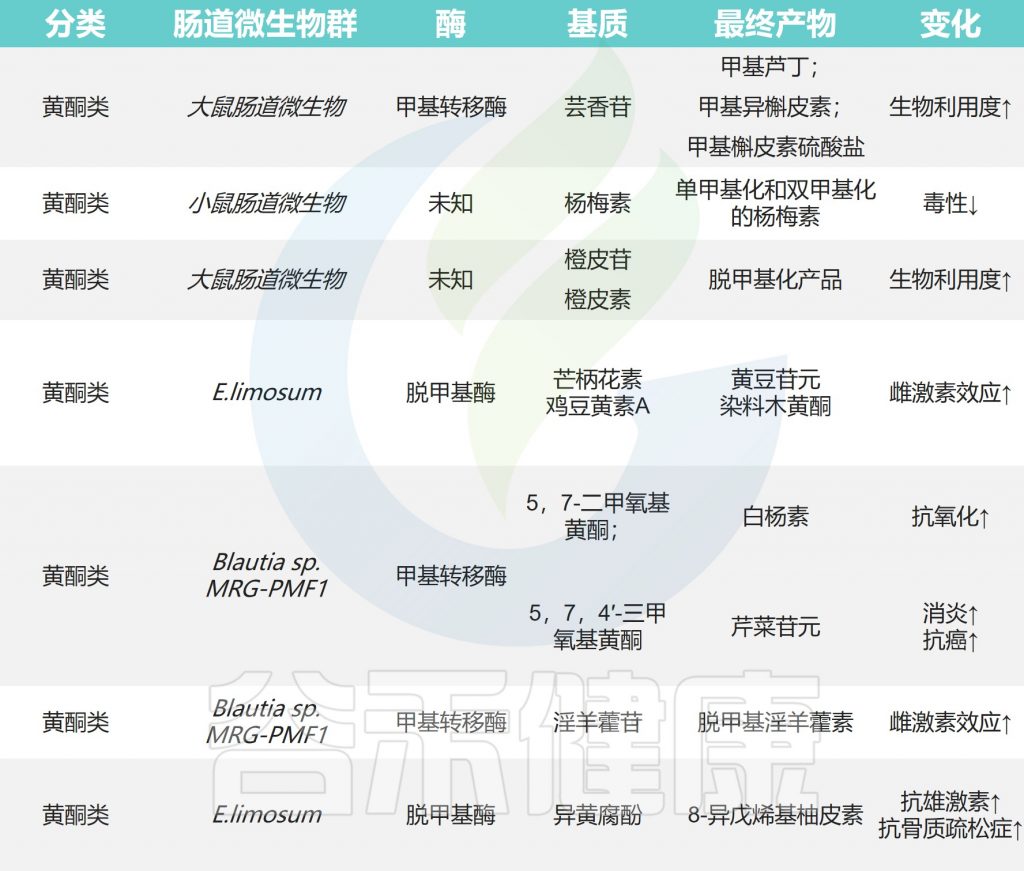


Zhao Y,et al.Front Microbiol.2022
✦类黄酮甲基化后具有抗癌活性
类黄酮甲基化修饰可以在类黄酮结构中的C-2,C-3,C-4,C-5,C-6,C-7和C-8位置进行,甲基化类黄酮的生物利用度大大提高。
甲基化类黄酮具有显著的抗癌活性和对肝脏代谢的抵抗力。在大鼠口服芦丁后,在粪便样品中检测到许多甲基化代谢物,如甲基芦丁,甲基异槲皮素和甲基槲皮素硫酸盐。
作用过程
甲基化的异黄酮类化合物在E.limosum ATCC 8486的作用下进行去甲基化以产生大豆苷元和染料木黄酮。异氧杂环丁酚通过苌香产生去甲基化产物8-异辛基柚皮素。橙皮苷,5,7-二甲氧基黄酮,黄腐酚和5,7,4′-三甲氧基黄酮也可以在肠道微生物的作用下进行去甲基化反应。
✦生物碱具有抗癌性和抗病毒活性
生物碱是含氮化合物,由海洋和陆地生物生物合成,它们具有抗癌性和抗病毒活性。
绝大多数生物碱分布在高等植物,尤其是双子叶植物中,如毛茛科、罂粟科、防己科、茄科、夹竹桃科、芸香科、豆科、小檗科等。
在肠道微生物表达的酶的作用下,苦木中的主要生物碱成分准碳质酮被甲基化为准碳质碱丁基。异喹啉生物碱巴马汀通过体外厌氧培养产生去甲基产物,如哥伦比亚胺、药根碱、去甲基小檗碱和去甲基小蘖碱。通过离子阱电喷雾电离串联质谱法证明了肠道微生物对乌头碱的去甲基作用,并产生了去甲基乌头碱。
✦木酚素可以抗炎防心血管疾病
膳食木酚素是植物雌激素,主要存在于种子,坚果,豆类和蔬菜中。
木酚素在微生物作用下的一些转化
牛蒡苷可由Eubacterium sp. ARC-2菌株去甲基化为二羟基内酯和其他产物。从人类粪便细菌中分离出一种名为Lautia sp. AUH-JLD56的细菌,该物种可以有效地将牛蒡苷或牛蒡苷元转化为去甲基化代谢物3′-去甲基牛蒡苷(3′-DMAG)。
Secoisoolaricinol是亚麻籽中最常见的木脂素之一,可在Blautia producta、Gordonibacter和Lactonifactor longoviformis的存在下去甲基,形成肠内酯和肠二醇。
芝麻素通过甲基化、去甲基化和肠道微生物的其他反应代谢为哺乳动物木脂素内酯和肠二醇。罗汉松树脂酚和连翘脂素也可以去甲基化以产生内酯。水飞蓟宾A和B被人类粪便微生物群去甲基为去甲基水飞蓟宾A和脱甲基水飞蓟宾B。
✦其他化合物
多酚化合物姜黄素被Lautia sp. MRG-PMF1去甲基化,以产生代谢物去甲基姜黄素(DMC)和双去甲基姜黄素(bDMC)。二氢异铁酸的去甲基化产物,如二氢咖啡酸,也在粪便代谢物中获得。
研究发现,甲基化反应发生在甘草皂苷22β-乙酰氧基甘草酸糖链的内部和外部葡萄糖醛酸残基处,产生22β-乙氧基甘草酸甲酯。
丹参素,萜类化合物,二苯乙烯类化合物和类固醇化合物在肠道微生物的作用下经历甲基化和去甲基化。
小结
甲基化和去甲基化反应是肠道微生物代谢的重要途径。甲基化能引起染色质结构、稳定性及蛋白质相互作用方式的改变,从而控制基因表达。去甲基化则诱导了基因的重新活化和表达。
然而,介导这种反应的基因/酶尚未完全确定,还需要进一步的实验研究。
肠道微生物可以表达许多氧化还原酶并通过调节各种官能团转化天然化合物,如烯烃、羧酸衍生物、硝基、氧化物和a,b不饱和羧酸衍生物,这些官能团影响体内天然产物的活性。
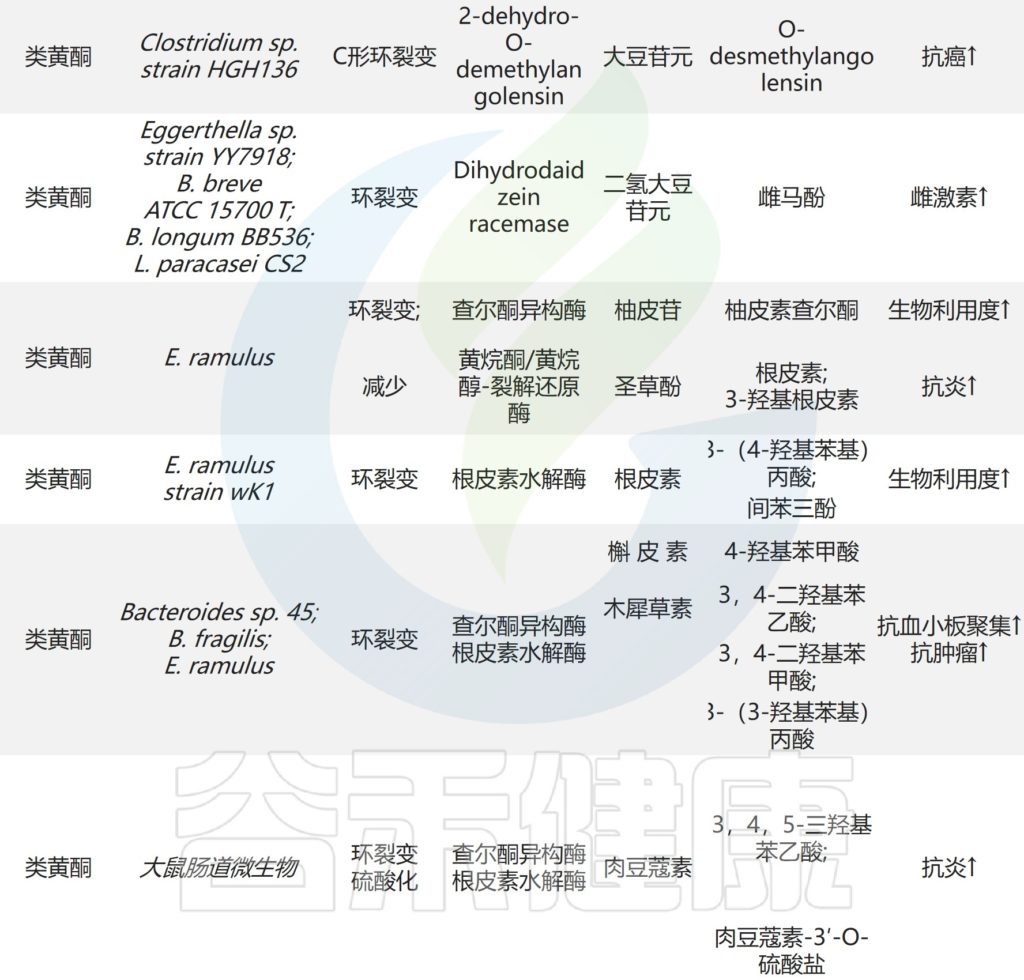
下图显示了肠道微生物作用下天然产物的氧化和还原反应。
肠道微生物对天然产物的还原和氧化反应






Zhao Y,et al.Front Microbiol.2022
✦类黄酮
黄酮类化合物大豆苷元在Clostridium sp. strain HGH6和Lactobacillus. sp. Niu-O16的作用下还原为二氢大豆苷元和进一步的四氢大豆苷元。还原产物二氢染料木黄酮是由染料木黄酮在人类粪便细菌的作用下产生的。
通过分析,在厌氧条件下与槲皮素一起孵育,在大鼠肠液培养液中鉴定出脱氧代谢物山奈酚和双键氢化还原产物西叶素等化合物。
从Flavonifractor plautii ATCC 49531中发现了黄酮还原酶,该酶特异性催化黄酮/黄烷醇C环的C2-C3双结合的氢化作用,并在黄酮类化合物整个生物降解途径的初始步骤中起作用。
去甲黄腐酚,一种查尔酮化合物,被分枝杆菌还原为去甲-α,β-二氢黄腐酚
•药理作用
黄酮类化合物分布广泛,具有多种生物活性。
1.黄酮类化合物具有抗自由基和抗氧化作用;2.防治心血管疾病方面均具有良好的效果;3.抑菌抗免疫作用;4.对动物激素的调节作用。
✦生物碱
•小檗碱具有杀菌消炎的功效
由肠道微生物产生的硝酸还原酶催化生物碱中的醚和配位键反应。小檗碱(BBR)作为黄连的主要成分,可以通过肠道微生物表达的硝基还原酶还原为二氢小檗碱,这种还原产物具有很高的极性。
二氢小檗碱可以在肠道中被吸收,然后被氧化成原型小檗碱进入血液。二氢小檗碱在肠道中的吸收率是小檗碱的五倍。同时还发现,肠道微生物可以通过氧化将小檗碱转化为氧小檗碱。
小檗碱的功效和作用主要就是起到杀菌消炎的作用,抗菌谱比较广,主要用于治疗各种肠道感染和菌痢等。
•其他生物碱产物
血红素是小檗碱的一种新代谢产物,可能是一种值得探索的生物活性剂。黄连碱是一种天然的原小檗碱生物碱,具有与小檗碱相同的母体结构。口服黄连后,C-O键打开并断裂,随后发生还原反应,生成氢化小檗碱。阿南酰胺被小鼠和人类肠道微生物群还原为二氢阿南酰胺,生物利用度更高。
✦苯丙酸
•咖啡酸具有抑菌、抗病毒作用
咖啡酸(CAA)作为食品和饮料中的主要膳食多酚,在酯化后很容易进入结肠并与肠道微生物群发生反应。
苯丙酸通过C4双键还原和脱氢作用转化为3-羟基苯基丙酸,然后通过体外肠道微生物的β氧化迅速转化为3-苯基丙酸。苯丙酸也可以脱羟基化为间香豆酸或氢化为二氢咖啡酸。
咖啡酸片具有较普遍的抑菌效果,可用于抑菌、抗病毒。除此之外,还具有中枢兴奋、解毒凝血等作用。
丹参素是丹参的主要单体酚酸,通过肠道微生物群进行脱氢和脱氧,生成3-苯基-2-羟基丙酸、3-(3,4-二羟基苯基)-2-丙烯酸(咖啡酸)和3-(3,4-二羟基苯)丙酸。
✦其他化合物
甘草次酸通过盲肠中的Ruminococcus sp. po1-3的3β-羟基类固醇脱氢酶生成3-氧代甘草次甲酸。
•通便作用
番泻甙是一类天然蒽醌衍生物和二聚糖苷,首先被β-葡萄糖苷酶水解生成番泻甙-8-O-单糖苷,然后在体内被链球菌还原为具有通便作用的大黄蒽醌。
二萜类白藜芦醇被Slackia equolifaciens和Eggerthella lentaATCC 4305还原为二氢白藜芦醇。
此外,二酮姜黄,类固醇化合物地高辛和其他化合物马兜铃酸也可以在肠道微生物的存在下减少。肠道微生物黄酮还原酶和硝基还原酶具有特殊的催化选择性,填补了肠道微生物转化途径的关键空白。
然而,介导肠道微生物减少的特定基因和酶尚未完全确定。
肠道微生物对天然产物的其他反应
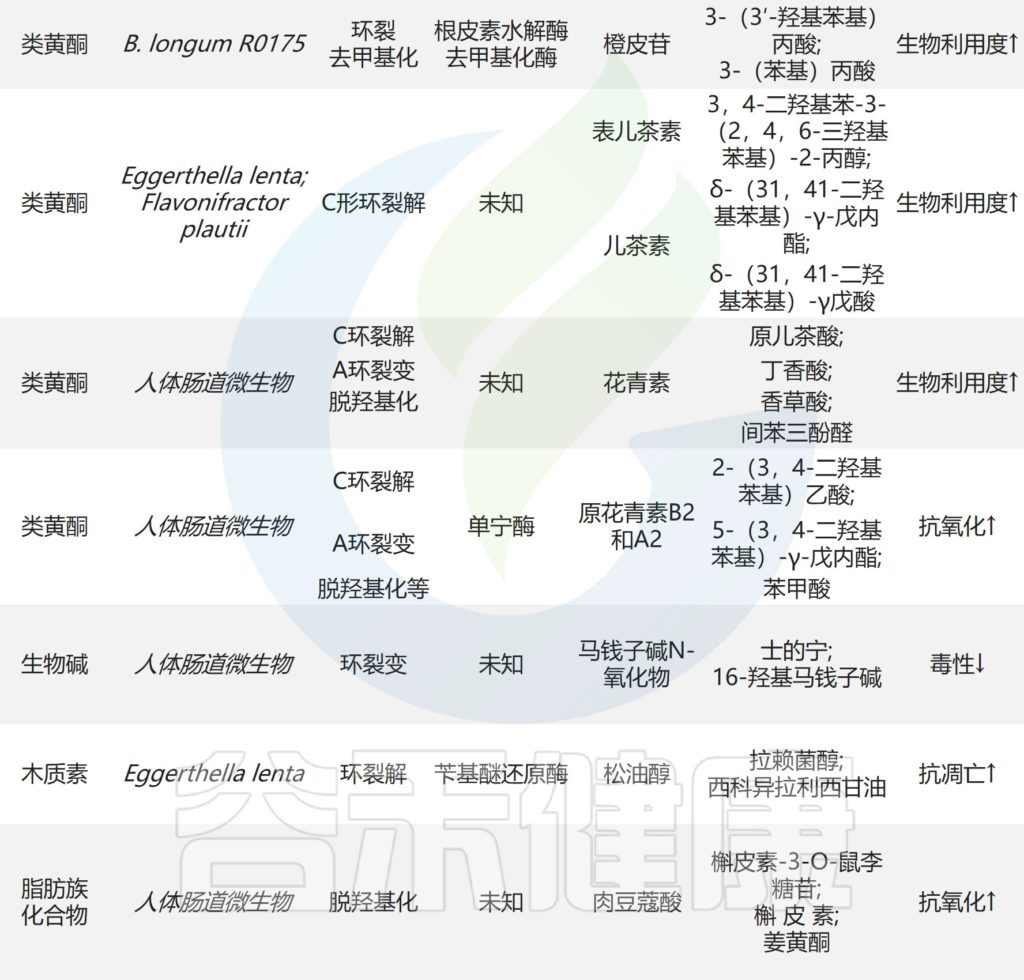
Zhao Y,et al.Front Microbiol.2022
如图中所示,肠道微生物也通过环分裂、硫化、芳构化和其他反应转化天然产物。
龙胆苦苷是一种天然的环烯醚萜苷,可通过肠道微生物β-葡萄糖苷酶水解为龙胆醛,然后通过N-杂环反应水解为含氮化合物。
京尼平丙酮醇的部分开环导致肠道微生物形成二醛。奎宁酸可以在肠道微生物存在下芳香化为马尿酸。
原花青素B2和A2与人类肠道微生物体外发酵,获得了主要的水解和环裂解代谢物,即苯甲酸、2-(3,4-二羟基苯基)乙酸和5-(3,4-二羟基苯)-γ-戊内酯。
口服木犀草素后,在大鼠粪便样品中检测到硫酸盐和氢还原代谢物。由肠道微生物促进的大豆苷元转化为雌马酚是另一个有趣的例子。
木犀草素,多以糖苷的形式存在于多种植物中,具有镇咳和祛痰作用。
雌马酚的作用:1.抗氧化,雌马酚属于多酚类物质,可作为氢/电子受体,清除自由基;2. 免疫调控,雌马酚的免疫保护作用可能是有其抗氧化作用所介导的,涂抹雌马酚对皮肤有免疫保护作用。
SesA是一种来自Sinomonas sp.no.22的芝麻素代谢酶,通过环裂解催化亚甲基从芝麻素或芝麻素单儿茶酚转移到四氢叶酸,产生芝麻素一儿茶酚或二儿茶酚和5,10-亚甲基四氢叶酸酯。
萜类化合物,类黄酮,苯酚,生物碱和脂肪酸都可以在肠道微生物的作用下进行生物转化反应,产生活性代谢物。
这些研究证明了各种肠道微生物组的巨大代谢潜力。天然产物的肠道微生物代谢及其在宿主健康中的作用应该是未来研究的重点。
小结
本节总结了来自单个反应的肠道微生物群介导的天然产物的生物转化。
但是,观察到一些限制。首先,考虑到肠道微生物的复杂性和肠道微生物酶的多样性,天然产物在肠道中经历复杂的转变。单个反应只能描述一定的新陈代谢过程。可以通过激活/抑制这一过程来优化治疗。
此外,考虑到肠道微生物含有各种潜在的多功能酶,可以预期肠道微生物会有更多的生物转化反应被天然产物所低估。
为了阐明肠道微生物代谢如何影响人类健康,研究人员应该将功能与基因和酶联系起来。
除了调节肠道微生物对天然产物的处置外,天然产物对肠道微生态学的调节作为潜在的功效机制也很重要。
越来越多的肠道微生物群研究逐渐揭示了大多数天然产品的高药理作用与低口服利用率之间的关系。大多数糖苷具有复杂的母体结构,很难被肠细胞吸收,从而限制了它们的组织特异性生物可及性。
这些化合物通过依赖于微生物/肠道微生物酶的降解反应转化为小分子代谢物/独特代谢物,从而对宿主产生广泛影响。肠道微生物还作用于膳食酚类物质,产生有助于宿主健康的功能代谢物。
✦增强抗肿瘤、抗炎、降脂作用
肠道微生物的生物转化促进了天然产物的治疗效果。人参皂苷对化合物K(CK)的典型代谢模型已被广泛报道,具有增强的抗肿瘤,抗炎和降脂作用。
人参皂苷的生物转化和代谢物化合物k的功效
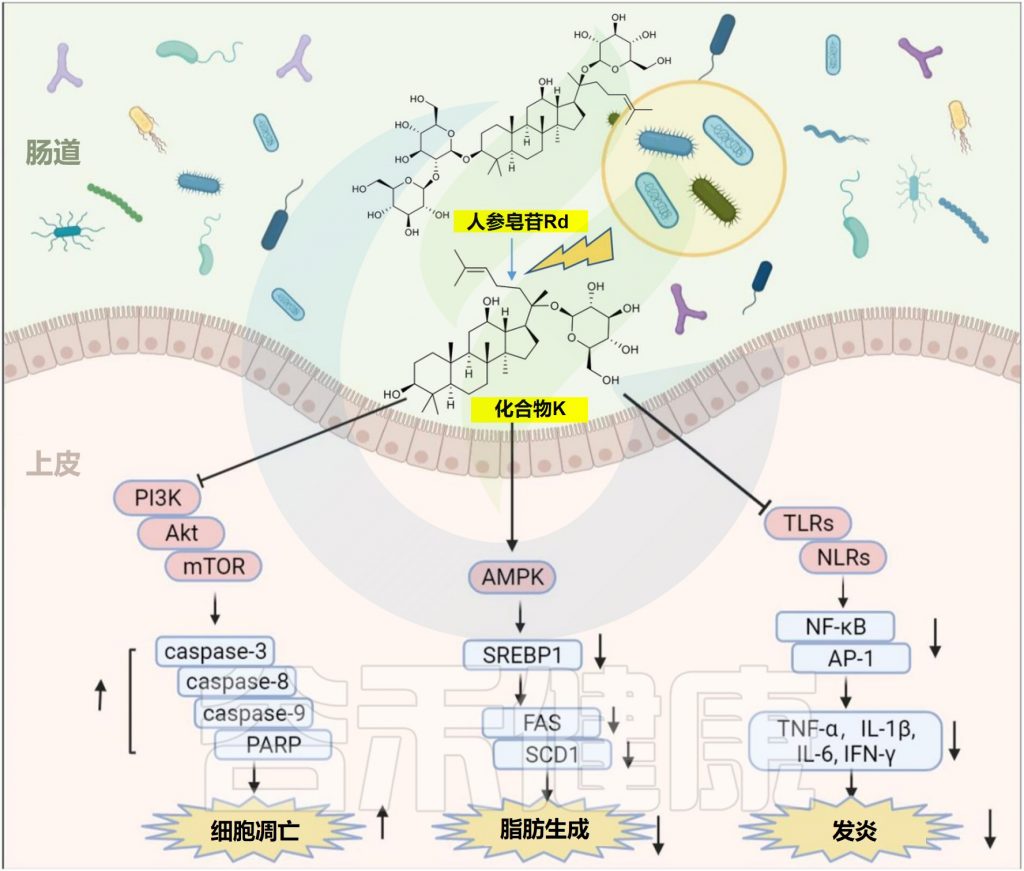

编辑
Zhao Y,et al.Front Microbiol.2022
1 —降脂
在20μM时,化合物K通过激活AMPK减少人肝细胞癌细胞中的肝脂堆积
2–抗癌
在50μM时,化合物K通过上调半胱天冬酶-3,半胱天冬酶-8,半胱天冬酶-9和环磷酸腺苷依赖性蛋白激酶来抑制胶质母细胞瘤细胞的生长。
3–减弱炎症
化合物K通过自噬诱导和调节NF-κB、p38蛋白和JNK/MAPK信号来减轻巨噬细胞炎症和泡沫细胞形成。
✦姜黄素可以抑制炎症
姜黄素代谢物的生物利用度取决于微生物群依赖性。例如,去甲基姜黄素增加PPARγ表达,导致自噬和核转录因子κB抑制,随后抑制脂多糖诱导的炎症。
PPARγ——是一种过氧化物酶体增殖物激活受体
MAPK——即AMP依赖的蛋白激酶,是生物能量代谢调节的关键分子
去甲基姜黄素通过抑制炎症因子的分泌和MAPK和NF-κB途径的激活来减轻体内和体外的炎症反应。由于在其原型苯环结构中不存在甲基,去甲基姜黄素的化学稳定性增加,从而解释了姜黄素的强大有益作用。
姜黄素来源:姜黄素是从植物根茎中提取,主要来源于生姜,然后就是那些植物中,胡萝卜、番茄以及辣椒,咖喱,芥末中也含有一些姜黄素。
✦尿石素具有抗炎和神经保护等作用
值得注意的是,尿石素A(UA)是一种天然化合物,由肠道微生物从摄入的鞣花单宁和鞣花酸中产生,具有显著的抗炎和神经保护作用。
在1μM时,尿石素A足以降低聚(I:C)诱导的RAW264.7细胞中肿瘤坏死因子和MCP-1的产生,并使TLR3/TRIF信号失活。尿石素A提高高脂饮食小鼠的全身胰岛素敏感性并降低肝脏白细胞介素1β水平。
MCP-1,是一种由星形胶质细胞分泌的促进炎症的蛋白质。
Toll样受体3(TLR3)是TLR家族的成员,介导I型干扰素、促炎细胞因子和趋化因子的转录诱导
尿石素A通过降低皮层和海马体中白细胞介素6、白细胞介素1β和肿瘤坏死因子的水平来改善小鼠的认知障碍,并抑制神经炎症。
小结
这些研究强调了鉴定天然产物微生物代谢的重要性。此外,许多体外药理活性测量应与微生物代谢产物一起进行,微生物代谢产物实际上与体内的生化受体相互作用。
肠道微生物的组成,结构,功能和代谢物已成为天然产物发挥有益作用和降低毒性的潜在目标。
例如,肠道微生物可以通过羧基酯酶催化双酯型二萜生物碱的C-8和C-14的酯键水解,或催化C-8的酯交换以产生毒性较小的单酯二萜烯生物碱。
大肠杆菌的地高辛还原型菌株含有强心苷还原酶,它可以还原地高辛环上的α和β-不饱和内酯,并将其代谢为活性较低的二氢地高辛,从而抑制其可能的心脏毒性。
地高辛,主要用于心脏类疾病的治疗,对心脏的作用表现为正性肌力作用,减慢心率,抑制心脏传导。
然而,这种能力是有限的,并且50%的地高辛可以通过肠道微生物转化而失活。强心苷还原酶可能是地高辛失活的有效生物标志物,其表达可以被精氨酸抑制。
•饮食可能调节微生物代谢活动
饮食可以解释地高辛还原的个体间差异,并可能调节体内微生物代谢活动。相比之下,有毒化合物可以由肠道微生物产生。桦木素在来自肠道微生物的β-葡萄糖苷酶的作用下水解成致癌性重氮甲烷。
建议
应开发微生物肠道酶的小分子抑制剂,以在这个复杂的栖息地的特定转化中发挥调节作用。肠道微生物群转化的代谢物与前体物质之间的毒性差异值得进一步研究。
此外,过量的药物可能导致肠道微生物失衡和不良反应,不同剂量的天然产物对肠道微生物和新陈代谢的影响也需进一步研究。
考虑到肠道微生物可以增加宿主对药物或天然产物的复杂和可变反应,这一过程值得研究。
生物转化的方法
(1)肠液转化。转化产物的大规模制备可以通过肠液生物转化来实现;
(2)与宿主微生物群的样品一起孵育。原型药物和代谢物的类型和数量可以使用该方法检测。它具有准确表示个体的整个肠道微生物组的优点;
(3)代表性菌株的孵育。该方法具有高通量潜力,这对于大规模药物研究很有价值,并有助于有益代谢物的工业生产。
✦模型分析有利于认识微生物代谢
器官微生理系统,胃肠道类器官的各种预测/计算工具可能有助于提高我们对未来微生物代谢的理解。
此外,在动物模型中已经研究了天然产物代谢与肠道微生物之间的关系,其结果可用于研究代谢物的分布和形式。无菌/抗生素处理的动物与传统动物进行了比较,以证明肠道微生物在天然产物代谢中的关键作用。
这种方法的局限性在于人类和啮齿动物之间存在固有的胃肠道和微生物差异。在临床试验中从受试者收集的粪便进行详细微生物群和代谢物分析可以全面反映天然产物在体内的代谢过程,并用于解释个体差异。
✦增加测序技术的应用
增加测序技术的应用,以研究微生物的转录活性和代谢谱。通过使用单细胞法,可以表征肠道微生物的生理结构,以确定其代谢活性。
转录组测序技术(RNA-Seq)可以直接分析人体肠道中具有强代谢活性的微生物的基因表达谱。
单细胞方法,宏转录组学和宏基因组学的组合已被用于鉴定和表征肠道微生物群的活性亚群,并确定它们对天然产物的代谢反应。
肠道微生物群是编码各种代谢酶的基因库。大多数天然产物的生物活性和潜在健康益处的激活极度依赖肠道微生物作为底物加工工厂。
了解微生物如何独特地调整天然产物以及这些代谢物对宿主健康的影响。已经得出以下结论:
(1)肠道微生物可以改变天然产物;
(2)天然产物可以调节肠道微生物的组成和丰度;
(3)肠道微生物可以介导天然产物的多组分协同作用。
此外,肠道微生物的巨大可塑性和个体间差异是值得注意的。因此,需要提高对肠道微生物对天然产物代谢的生理,化学和微生物贡献的理解,以帮助解释天然产物反应的个体差异,并为个性化治疗提供支持。
确认生物转化中极其参与的象征性功能及其物质基础将有助于探索天然产物与肠道微生物群之间相互作用的治疗模式。
主要参考文献
Zhao Y, Zhong X, Yan J, Sun C, Zhao X, Wang X. Potential roles of gut microbes in biotransformation of natural products: An overview. Front Microbiol. 2022 Sep 29;13:956378. doi: 10.3389/fmicb.2022.956378. PMID: 36246222; PMCID: PMC9560768.
Abookleesh F. L., Al-Anzi B. S., Ullah A. (2022). Potential antiviral action of alkaloids. Molecules 27:903. doi: 10.3390/molecules27030903.
Agatonovic-Kustrin S., Kustrin E., Gegechkori V., Morton D. W. (2020). Anxiolytic terpenoids and aromatherapy for anxiety and depression. Adv. Exp. Med. Biol. 1260, 283–296. doi: 10.1007/978-3-030-42667-5_11.
Al-Ishaq R. K., Liskova A., Kubatka P., Büsselberg D. (2021). Enzymatic metabolism of flavonoids by gut microbiota and its impact on gastrointestinal cancer. Cancers 13:3934. doi: 10.3390/cancers13163934.
Augusti P. R., Conterato G. M. M., Denardin C. C., Prazeres I. D., Serra A. T., Bronze M. R., et al.. (2021). Bioactivity, bioavailability, and gut microbiota transformations of dietary phenolic compounds: implications for COVID-19. J. Nutr. Biochem. 97:108787. doi: 10.1016/j.jnutbio.2021.108787.
Berlinberg A. J., Brar A., Stahly A., Gerich M. E., Fennimore B. P., Scott F. I., et al.. (2022). A novel approach toward less invasive multiomics gut analyses: a pilot study. Microbiol. Spectr. 10:e0244621. doi: 10.1128/spectrum.02446-21.
Bess E. N., Bisanz J. E., Yarza F., Bustion A., Rich B. E., Li X., et al.. (2020). Genetic basis for the cooperative bioactivation of plant lignans by Eggerthella lenta and other human gut bacteria. Nat. Microbiol. 5, 56–66. doi: 10.1038/s41564-019-0596-1.

谷禾健康

疫苗是公共卫生领域最伟大的成就之一,每年可预防数百万儿童疾病和死亡病例。然而,许多疫苗的功效在地理和社会经济不同地区的婴儿之间可能存在很大差异。
有研究发现,肠道微生物组组成的差异已成为解释免疫结果差异的主要因素之一。
在本篇文章中,谷禾总结了各位学者的研究。关于肠道微生物群对生命早期免疫的影响,重点关注微生物群中具有促进健康和免疫调节特性的两个重要成员:双歧杆菌和拟杆菌。
此外还罗列了一些具有免疫刺激特性的微生物产物、与宿主的相互作用以及它们对婴儿疫苗反应和功效的影响。
通过本文,可以让大家更好地了解肠道微生物对免疫接种的影响,让人们更有针对性地选择免疫接种,更好地保护我们的健康。
本文出现的专业名词
疫苗是指用各类病原微生物制作的用于预防接种的生物制品。其中用细菌或螺旋体制作的疫苗亦称为菌苗。疫苗分为活疫苗和死疫苗两种。
常用的疫苗:常用的活疫苗有卡介苗,脊髓灰质炎疫苗、麻疹疫苗、鼠疫菌苗等;常用的死疫苗有百日咳菌苗、伤寒菌苗、流脑菌苗、霍乱菌苗等。
免疫球蛋白(Ig)——指具有抗体活性或化学结构,与抗体分子相似的球蛋白
辅助T细胞(Th细胞)在免疫反应中扮演中间过程的角色:它可以增生扩散来激活其它类型的产生直接免疫反应的免疫细胞
调节性T细胞(Tregs)是维持机体免疫耐受的重要因素之一,通过主动调节的方式抑制存在于正常机体内潜在的自身反应性T细胞的活化与增殖,从而调节机体的免疫力
G蛋白偶联受体(GPCRs)是一大类膜蛋白受体的统称
Toll样受体(TLR)是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,表达在巨噬细胞、树突状细胞和上皮细胞表面,可识别多种类型的病原体相关分子模式或损伤相关分子模式
人类胃肠道微生物群由细菌、病毒、古生菌和真菌组成的复杂群落,其组成沿胃肠道长度变化。
微生物定植在出生时开始,并在整个生命过程中不断变化,生命的前1000天是生态系统结构最脆弱和最不稳定的时期。
✦胃肠道微生物对健康至关重要
胃肠道微生物群有助于粘膜和全身免疫系统的成熟,抵抗病原体定植,消化膳食成分,并提供微量营养素。
胃肠道微生物群的结构和功能紊乱与各种疾病有关,包括代谢紊乱、神经退行性疾病,过敏,自身免疫性疾病,和癌症。
值得注意的是,影响微生物组的因素与影响疫苗免疫反应的因素相似,强调了免疫与胃肠道微生物群之间的相互关系。
在生命早期,影响胃肠道微生物群发育的其他因素是分娩方式,早产,营养(母乳与配方奶),早期使用抗生素或益生菌和卫生等。
✦ 分娩方式对早期微生物群的影响
在出生期间和出生后,婴儿会接触到促进免疫系统成熟的环境抗原和微生物,其性质取决于分娩方式。
●阴道分娩
阴道分娩的婴儿暴露于母体阴道和粪便微生物群中,导致微生物分布以埃希氏菌、乳酸杆菌、拟杆菌和双歧杆菌为主。
●剖宫产分娩
相比之下,剖宫产分娩的新生儿与母体皮肤和医院微生物的接触更多,并且经常被链球菌、葡萄球菌和肠球菌定植。
✦早期用抗生素对免疫系统发育有负面影响
早期使用抗生素治疗会对这种最初的定植和随后的免疫系统发育产生负面影响。这些早期生活障碍会在短期内导致感染风险增加。从长远来看,与免疫和代谢相关疾病(如特应性)的风险增加有关。
因此,在正确的时间由正确的微生物定殖对于有效建立免疫防御和稳态至关重要。
✦母乳喂养对肠道微生物群有益处
母乳喂养提供了抗菌肽、母体抗体和先天免疫因子,它们促进了对新生婴儿的被动保护,并提供了塑造婴儿微生物群的关键膳食成分。
人乳寡糖可增强双歧杆菌的定殖和持久性(占总微生物群落的80%),这在以配方奶喂养的婴儿中不太明显(5-30%)。
人乳寡糖(HMOs)是人类母乳中仅次于乳糖和脂肪的第三大固体成分,有助于预防人类细胞、组织和小鼠中的链球菌感染。
人乳寡糖的微生物代谢导致短链脂肪酸的产生,短链脂肪酸被与膜结合的特定G蛋白偶联受体识别,由免疫细胞在全身和胃肠道中表达,是关键用于发展免疫耐受性。母乳还直接通过母乳微生物组引入微生物,从而进一步播种婴儿肠道。
断奶和从母乳或以配方食品为基础的营养过渡到固体食物推动了胃肠道微生物群的重大变化,双歧杆菌种类减少,并引入了瘤胃球菌、阿克曼氏菌和普雷沃氏菌。
✦疫苗效果存在差异
许多许可疫苗的功效在人群之间存在差异,在某些情况下,转化为几乎没有效果。
许多内在因素导致疫苗反应的这种变异性,包括年龄、遗传(占受者之间变异的 20-40%)、贫血和性别。
此外,广泛的外部因素会极大地影响疫苗接种结果,包括疫苗成分和免疫方案,预先接触病原体和慢性炎症,暴露于母体抗体,营养状况和地理位置等。
✦肠道微生物有助于促进免疫
人们越来越认识到婴儿胃肠道微生物群在疫苗免疫中的作用。胃肠道微生物群已被证明可通过多种机制促进对疫苗的体液和细胞免疫反应的有效刺激。
肠道微生物群的免疫调节
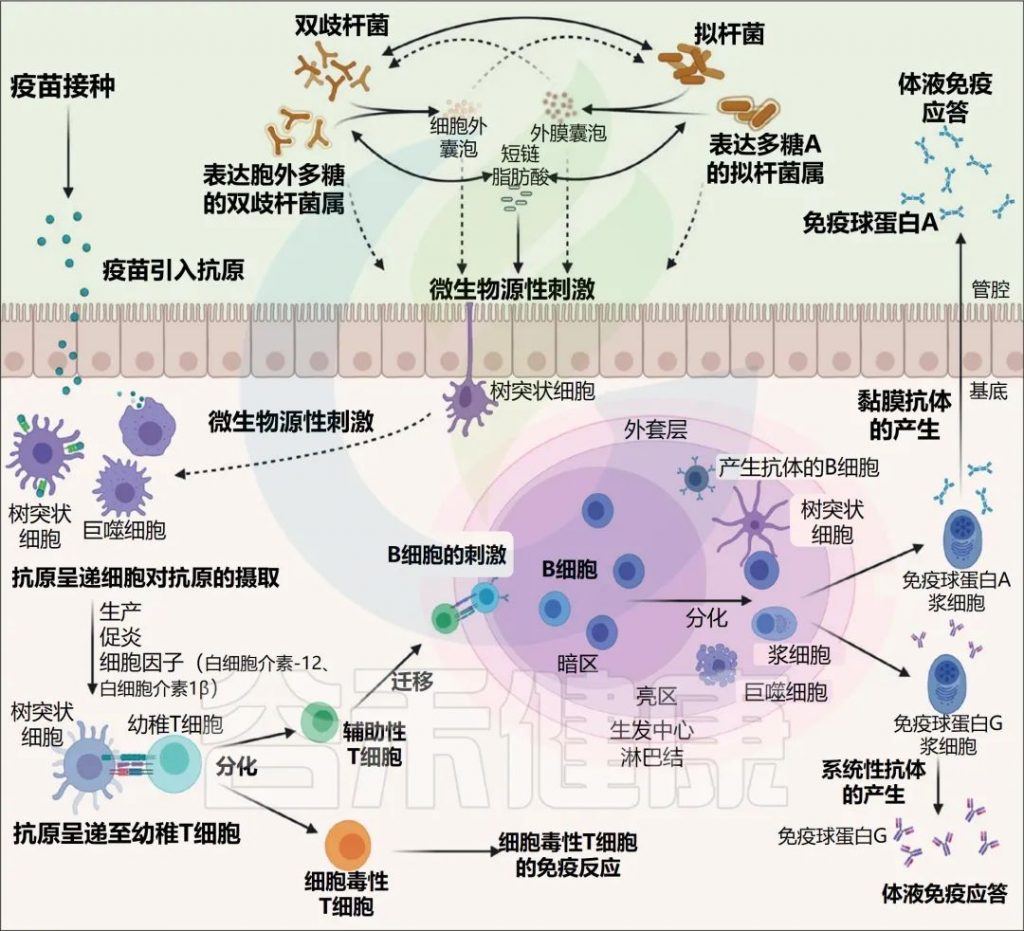

Jordan A,et al.Lancet Microbe.2022
微生物群刺激对于产生免疫球蛋白 (IgA) 的B细胞的发育和成熟、通过促进IgA类别转换的记忆浆细胞以及生发中心的发育至关重要。此外,通过介导浆细胞样树突状细胞产生I型干扰素,微生物群增强了抗原特异性T细胞反应。
肠道微生物群和免疫系统之间的共生关系,以及遗传和环境影响,可以解释个体对疫苗的免疫反应的可变性。
抗生素引起的新生小鼠微生物组紊乱,以及使用免疫缺陷的无菌幼崽,导致对不同佐剂和减毒活疫苗的体液反应受损,其特征是Th1和Th17反应降低,IgG和IgM生产。
注:辅助性T细胞1(Th1)主要为对抗细胞内细菌及原虫的免疫反应。
辅助性T细胞17(Th17)是一种新发现的能够分泌白介素17的T细胞亚群。
IgG是免疫球蛋白G,是免疫球蛋白中的一种,来源于浆细胞,具有抗病毒、抗菌和免疫调节的功能。
IgM是免疫球蛋白M,由于B淋巴细胞在抗原如病毒或细菌等病原微生物等的刺激下转化为浆细胞,产生能与相应抗原发生特异性结合的抗体,而形成免疫球蛋白。
值得注意的是,在通过施用特定的鞭毛大肠杆菌菌株或粪便微生物群转移来恢复微生物群后,这种损害是可逆的。
某些细菌科、属和物种的丰度与人类对疫苗的免疫反应差异有关,无论是正面的还是负面的。
// 不同地区间的研究
对来自加纳、巴基斯坦、孟加拉国和荷兰的接种轮状病毒疫苗的有反应和无反应儿童的微生物谱比较研究表明,与同一队列的无应答者相比,来自不同低收入和中等收入国家的应答者的微生物群组成与荷兰婴儿微生物群更为相似(即梭菌群XI和变形菌的丰度更高,拟杆菌门的数量更低)。
小结
由于胃肠道微生物组在激活和抑制免疫反应以及随后对疫苗免疫的影响方面具有多因素作用,因此研究不同的微生物群调节干预措施以最大限度地提高疫苗效力。
益生元、益生菌和抗生素
益生元——指一些不被宿主消化吸收却能够选择性地促进体内有益菌的代谢和增殖,从而改善宿主健康的有机物质。
益生菌——通过定殖在人体内,改变宿主某一部位菌群组成的一类对宿主有益的活性微生物。
✦益生元和益生菌对疫苗免疫有积极作用
对小鼠接种流感和霍乱疫苗的研究报告表明,不同的益生元与疫苗接种后的全身免疫反应之间存在正相关,与双歧杆菌和乳酸杆菌的丰度增加以及短链脂肪酸的产生有关。
已经研究了它们对疫苗接种反应的影响。系统评价总结了26项使用益生菌对人类进行干预研究的结果,以提高17种不同疫苗的功效,其中一半的研究显示出积极的结果。
婴幼儿使用益生菌效果更好
与成人相比,在新生儿和幼儿(0-16 周龄)中使用益生菌乳酸杆菌和双歧杆菌菌株的试验显示成功率更高,接种流感、白喉、轮状病毒和脊髓灰质炎疫苗后对体液免疫的影响最大。
然而,不同研究(包括使用的细菌菌株)的设计缺乏一致性,因此难以得出可靠的结论。
✦抗生素对疫苗的影响暂不明确
抗生素——指由微生物(包括细菌、真菌、放线菌属)或高等动植物在生活过程中所产生的具有抗病原体或其他活性的一类次级代谢产物,能干扰其他生活细胞发育功能的化学物质。
人体研究调查了抗生素介导的微生物耗竭对流感、脊髓灰质炎、轮状病毒、破伤风和卡介苗免疫反应的影响。没有观察到疫苗免疫原性改善或显著降低,这与抗生素使用、微生物群紊乱和免疫介导疾病的增加有关。
总之,某些细菌种类与婴儿疫苗应答者的体液或细胞免疫呈正相关或直接诱导增强。双歧杆菌是增强疫苗接种反应的良好候选者,也是健康早期肠道微生物群的关键成员。
其他可以刺激先天和适应性免疫反应的核心肠道微生物群成员,如拟杆菌属,也正在成为疫苗研究中的新型微生物群疗法。
扩展阅读:抗生素对微生物组及对人体健康的影响
双歧杆菌和拟杆菌的免疫调节
✦ 双歧杆菌减少炎症
在小鼠肥胖模型中,给予假链状双歧杆菌通过恢复调节性T细胞 (Treg) 和B淋巴细胞的平衡状态来减少全身炎症,并降低促炎细胞因子白细胞介素IL-17A和肿瘤坏死因子TNF的浓度。
白细胞介素——指在白细胞或免疫细胞间相互作用的淋巴因子,它和血细胞生长因子同属细胞因子。两者相互协调,相互作用,共同完成造血和免疫调节功能。
肿瘤坏死因子——血清中出现一种能使多种肿瘤发生出血性坏死的物质。
类似的免疫稳态特性已归因于双歧杆菌菌株,其通过体外刺激树突状细胞,诱导Th17谱并增强Treg细胞从幼稚淋巴细胞的分化。
双歧双歧杆菌DSM 20082裂解物刺激外周T细胞可增加CD8+ T细胞的细胞毒活性,而对CD4+ T细胞活性没有任何影响。
尽管支持这些免疫调节特性的机制尚不清楚,但已经提出了几个目标。
包括膳食发酵产物(例如,在人乳寡糖和其他复合碳水化合物代谢后),导致产生短链脂肪酸(即乙酸盐)和其他代谢副产物,这些副产物直接与宿主免疫细胞受体相互作用并促进其他共生体的交叉喂养细菌,如拟杆菌属和大肠杆菌。
长双歧杆菌亚种产生免疫调节化合物和蛋白质,如细胞外蛇毒蛋白,它不可逆地灭活促炎蛋白酶。
双歧杆菌MIMBb75之前已经证明其表面有肽聚糖水解酶TgaA,它通过启动白细胞介素-2生成和单核细胞衍生的树突状细胞激活,促进调节性T细胞扩增。
●双歧杆菌增强了免疫抗病毒反应
在新生仔猪中,长双歧杆菌AH1206菌株增强了肠道IL-10的产生,而动物双歧杆菌亚种乳酸Bb12、婴儿双歧杆菌MCC12和短双歧杆菌MCC1274促进了免疫成熟和免疫稳态。
更重要的是,MCC12和MCC1274 菌株在接种轮状病毒疫苗后增强了B细胞和抗病毒反应,表明双歧杆菌的免疫改变特征对某些菌株具有特异性。
●放线菌和双歧杆菌对人体免疫反应起促进作用
在人类中,几项研究强调了高丰度放线菌门和某些双歧杆菌菌株与对不同疫苗的免疫反应增加之间的正相关关系。
孟加拉婴儿胃肠道微生物组中高浓度的婴儿长双歧杆菌亚种与CD8+ T 细胞和CD4+ T 细胞反应增加以及接种卡介苗、破伤风和乙型肝炎疫苗后IgG滴度升高相关。
接种卡介苗、破伤风和乙型肝炎疫苗后,IgG滴度更高,在口服脊髓灰质炎疫苗接种后,双歧杆菌丰度高的中国婴儿表现出脊髓灰质特异性IgA应答增加。在疫苗补充研究中,B.longum BB536显示通过诱导干扰素-γ分泌来增强婴儿的Th1反应。
干扰素-γ——免疫干扰素,是由有丝分裂原刺激T淋巴细胞产生的。干扰素是一种高效的抗病毒生物活性物质,又是一种具有广泛免疫调节作用的淋巴因子。
扩展阅读:如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍
✦拟杆菌影响疫苗免疫反应
拟杆菌属是婴儿期肠道定植的主要属,并且在整个成年生活中占主导地位。某些物种和菌株具有重要的互惠作用,从产生抗菌分子到通过分解不同聚糖提供营养。
关于拟杆菌和疫苗的反应性,存在相互矛盾的结果:
在加纳进行的轮状病毒试验发现,疫苗应答与拟杆菌门丰度呈负相关,而对巴基斯坦婴儿的一项类似研究显示,疫苗应答者中拟杆菌门的浓度增加。
观察到尼加拉瓜婴儿的疫苗反应者和无反应者中不同拟杆菌菌株的丰度存在差异。
注:由于样本量小,这些发现在多次调整后没有统计学意义,强调需要进行更大规模的研究来探索这些关联。
考虑到拟杆菌在诱导稳态免疫启动中的突出作用,可以预期拟杆菌和疫苗反应之间存在联系。
Bacteroides thetaiotaomicron中独特的寡糖结构具有佐剂特性,以依赖CD4+ T 细胞的方式诱导由乙型肝炎病毒疫苗引发的乙型肝炎病毒抗原特异性抗体浓度升高,这表明这种寡糖可作为大肠杆菌中毒性更大的脂多糖的替代佐剂。
短链脂肪酸是由肠道微生物群的不同成员通过发酵膳食复合碳水化合物(包括母乳或益生元中的碳水化合物)产生的。
短链脂肪酸在其一元羧酸碳链中含有少于六个碳原子,其中醋酸盐 (C2)、丙酸盐 (C3) 和丁酸盐 (C4) 最为普遍。它们是水溶性的,可以直接被不同的细胞吸收、转运或相互作用,包括肠上皮细胞、交感神经元和免疫细胞。
✦ 短链脂肪酸的多种益处
它们提供许多有益的健康影响,包括肠细胞的能量来源、加强上皮屏障、改变代谢过程、抑制肠道病原体生长、离子吸收的介质,以及作为肠道和全身免疫调节途径中的信号分子。
双歧杆菌和拟杆菌产生的乙酸,以及拟杆菌产生的丙酸盐,将在下面更详细地讲述。
●作为主要能源
乙酸盐可以酶促转化为乙酰辅酶A,并被许多不同的微生物群成员用来生产丁酸盐,并作为三羧酸循环中的主要能源。
●激活调节免疫细胞,增强疫苗反应
T细胞中细胞内乙酰辅酶A的增加会激活mTOR,从而驱动Th1和Th17 T细胞的分化。乙酸盐还可以激活B细胞、T细胞亚群、中性粒细胞、巨噬细胞、树突细胞和肠上皮细胞上表达的G蛋白偶联受体43(GPR43),导致固有层调节性T细胞增殖,和调节自身抗体的产生和边缘区B细胞。
mTOR是一种丝氨酸/苏氨酸蛋白激酶,对激素、生长因子、营养物质,能量和压力信号做出反应,是细胞代谢,生长和存货的中心调节因子。
GPR43的激活影响中性粒细胞趋化性和脱粒,以及脂肪组织中巨噬细胞产生肿瘤坏死因子。此外,缺乏GPR43的树突细胞无法诱导B细胞的类别转换。
没有产生短链脂肪酸的胃肠道细菌的小鼠的浆细胞分化减少,并且在稳态和病原体特异性抗体反应方面存在缺陷。乙酸盐可通过在体外增强针对霍乱毒素的抗原特异性IgA和IgG的产生以及刺激浆细胞分化所必需的树突状细胞中的信号分子来增强疫苗反应。
●改变巨噬细胞浓度
丙酸盐诱导小鼠调节性T细胞的分化和增殖以及白细胞介素10的表达。丙酸盐激活GPR15和GPR43还通过降低组蛋白去乙酰化酶6和9的表达以及抑制 NF-κB信号传导来增加结肠调节性T细胞的浓度。
丙酸盐激活GPR41会改变骨髓造血功能,导致巨噬细胞和树突状细胞前体浓度升高,并扭曲Th2分化。
✦短链脂肪酸是流感疫苗的潜在佐剂
一项调查短链脂肪酸对甲型流感病毒感染影响的研究揭示了短链脂肪酸(包括丙酸盐)通过激活GPR43来限制感染严重程度和伴随的肺炎球菌二重感染的重要作用。
GPR43被认为是甲型流感病毒进入的辅助受体
这意味着短链脂肪酸与该受体的结合抑制了病毒的进入和复制,这表明流感疫苗具有潜在的佐剂特性。
扩展阅读:你吃的膳食纤维对你有帮助吗?
胞外多糖是一些特殊微生物在生长代谢过程中分泌到细胞壁外、易与菌体分离、分泌到环境中的水溶性多糖,属于微生物的次级代谢产物。
胞外多糖是单糖或寡糖簇,包括形成同多糖或杂多糖的葡萄糖、果糖、半乳糖、岩藻糖和鼠李糖。
✦改变代谢物环境浓度,提供保护
这些可以分泌到肠道环境中或与亲本细菌的细胞壁有关。胞外多糖的表达增强了对宿主细胞的粘附,提供了对消化和环境压力的保护,并促进了生物膜的形成和胃肠道中的长期定植。
来自不同双歧杆菌菌株的胞外多糖可以被其他微生物发酵,从而改变代谢物环境和短链脂肪酸浓度。胞外多糖可以通过巨噬细胞和树突状细胞表面表达的特定模式识别受体(如TLR1、TLR2或TLR6)被识别为微生物相关的分子模式。
✦促进抗炎反应
受体的激活,取决于胞外多糖的化学物理特性(例如,分子量或电荷),导致产生不同的促炎和抗炎细胞因子谱,并以菌株特异性方式分别分化幼稚T细胞。
脆弱拟杆菌的表面多糖A可激活巨噬细胞上的Toll样受体2,并诱导调节性T细胞的扩增和抗炎白细胞介素10的产生,从而在病毒感染期间促进强烈的抗炎反应。
TLRs是一种模式识别受体家族,在先天免疫反应中起着重要作用。
✦增强对病毒的抵抗力
此外,多糖A激活结肠树突状细胞的Toll样受体2和肿瘤坏死因子分泌,增强了对病毒感染的天然抵抗力。
来自长双歧杆菌BCRC14634的胞外多糖被证明可增强巨噬细胞产生白细胞介素,与同基因的胞外多糖阴性突变体相比,来自B.longum亚种longum 35624的胞外多糖显示通过抑制促炎细胞因子产生来抑制促炎性Th17细胞的扩增。
在某些情况下,胞外多糖的存在与免疫沉默效应和逃避适应性B细胞反应有关,如在短双歧杆菌UCC2003中观察到的。
此外,这种双歧杆菌菌株和胞外多糖的存在也与较低丰度的促炎IFN-γ、肿瘤坏死因子和IL-12相关。
研究表明,青春双歧杆菌IF1-03通过增加巨噬细胞分泌IL-10来增加抗炎免疫反应,增加调节性T细胞浓度,这需要通过细胞外信号调节激酶或丝裂原活化蛋白激酶和NF-κB途径激活Toll样受体2和信号转导。
值得注意的是,在青春芽孢杆菌IF1-11产生的胞外多糖的情况下观察到相反的效果,它模拟巨噬细胞分泌高浓度的促炎性白细胞介素6、白细胞介素-17A 和转化生长因子-β,以及少量的白细胞介素10,随后将T细胞偏向Th17细胞。
转化生长因子-β(TGF-β)是属于一组新近发现的调节细胞生长和分化的TGF-β超家族
小结
这些研究展现了依赖于菌株的胞外多糖的免疫调节能力。以前使用乳酸杆菌的工作衍生的胞外多糖表明它们可以作为新型疫苗佐剂。因此,在特定疫苗接种后需要进一步测试关注拟杆菌和双歧杆菌相关胞外多糖的作用。
细菌细胞外囊泡是球形的膜衍生结构,大小从10纳米到 400 纳米不等,其中包含来自母细胞膜和周质的各种成分。
✦功能和分布
根据其膜组成和结构进行区分,其含量受环境因素(如培养条件或营养胁迫)的影响。这种影响可能导致DNA、RNA、脂多糖、酶、肽聚糖、毒素、信号分子、代谢物和毒力因子的数量和质量差异。
细菌细胞外囊泡并不局限于胃肠道,并且已在血液中检测到,它们可以从那里轻松进入不同的组织,包括大脑。
一项研究详细概述了不同的细菌膜外囊泡、它们的特性、功能和潜在应用。由共生细菌产生的细菌膜外囊泡有助于复杂微生物群落成员之间的合作和共养相互作用,并作为胃肠道微生物群成员与宿主之间跨界串扰的中介。
✦促进免疫反应
细菌细胞外囊泡可以激活免疫细胞并促进针对囊泡本身和亲代细胞的免疫反应。
膜脂、蛋白质(包括与微生物相关的分子模式)、危险信号和胞外多糖可以结合并激活模式识别受体和toll样受体,触发上皮细胞以外的不同免疫反应。
来自脆弱拟杆菌的囊泡携带荚膜多糖A,它激活黏膜下树突状细胞上的Toll样受体2,细胞外囊泡随后以肌动蛋白依赖性方式内化,导致白细胞介素10浓度增加和T细胞极化偏斜向调节性T细胞分化。
发现表明源于拟杆菌的胞外囊泡以物种特异性的方式在人类粘膜和血液树突状细胞中诱导白细胞介素10依赖性免疫调节反应。
✦为疫苗提供了多种可能性
细菌细胞外囊泡的非复制性及其内在的佐剂性、热稳定性以及对低pH值和酶降解的抵抗力,为疫苗设计和交付提供了多种可能性。
它们可以在不注射的情况下直接给药至粘膜部位(例如胃肠道和呼吸道),从而降低给药成本并降低与肠外分娩相关的潜在不良反应的风险。
此外,含有免疫原性成分的细菌细胞外囊泡可以促进强烈的先天性和适应性免疫反应,并提供大量针对传染病的保护。
✦呈递抗原,降低毒性
来自病原菌的细菌细胞外囊泡已成功用于疫苗制剂,一些针对霍乱弧菌和B Neisseria meningitidis的细胞外囊泡疫苗已获得许可,其中B Neisseria meningitidis疫苗显示出针对淋球菌的潜在跨物种保护作用。
其他研究表明,由微生物群成员产生的细菌细胞外囊泡,包括生物工程细菌细胞外囊泡,已被用于传递病原体的抗原。
源于拟杆菌的、表达不同鼠疫耶尔森菌抗原的细菌细胞外囊泡在体内诱导了特异性和强免疫反应,包括血清IgG和粘膜IgA,它们能够清除鼠疫感染。
来自突变的非致病性大肠杆菌的细菌细胞外囊泡对抗原特异性T细胞反应具有佐剂特性,并降低了毒性。
人类肠道微生物群正在成为疫苗反应性的重要决定因素,其中双歧杆菌和拟杆菌能够影响免疫和个体疫苗免疫反应。
这两个属是发育中的健康婴儿肠道微生物群的重要组成部分,但极易受到早期生活干扰的影响,例如剖腹产、配方奶与母乳以及抗生素的使用。
专注于这些促进健康的菌群,并利用它们的免疫调节特性,可能会导致更安全的方法来增强婴儿免疫力和疫苗效力。使用整个细菌或其产物和代谢物来调节免疫反应的新策略是可能的,例如在癌症中观察到对免疫检查点抑制剂的反应增强。
未来展望
对来自健康婴儿微生物组的关键菌株及其副产物和代谢物有更深入的了解和表征,可以催生新一代安全、无针和经济的疫苗促进疗法。关键特征,如剂量、疫苗设计和给药时间,将是重要的考虑因素。
主要参考文献:
Jordan A, Carding SR, Hall LJ. The early-life gut microbiome and vaccine efficacy. Lancet Microbe. 2022 Sep 8:S2666-5247(22)00185-9. doi:
10.1016/S2666-5247(22)00185-9. Epub ahead of print. PMID: 36088916.
Praharaj I, John SM, Bandyopadhyay R, Kang G.
Probiotics, antibiotics and the immune responses to vaccines.Philos Trans R Soc Lond B Biol Sci. 2015; 37020140144.
Ciabattini A, Olivieri R, Lazzeri E, Medaglini D.
Role of the microbiota in the modulation of vaccine immune responses.Front Microbiol. 2019; 101305.
Hill DL, Carr EJ, Rutishauser T, et al.Immune system development varies according to age, location, and anemia in African children.Sci Transl Med. 2020; 12eaaw9522.
Parker EPK, Bronowski C, Sindhu KNC, et al.Impact of maternal antibodies and microbiota development on the immunogenicity of oral rotavirus vaccine in African, Indian, and European infants.Nat Commun. 2021; 127288.

谷禾健康
在谷禾肠道菌群健康检测中,我们会看到结果报告中关于维生素的评估如下:

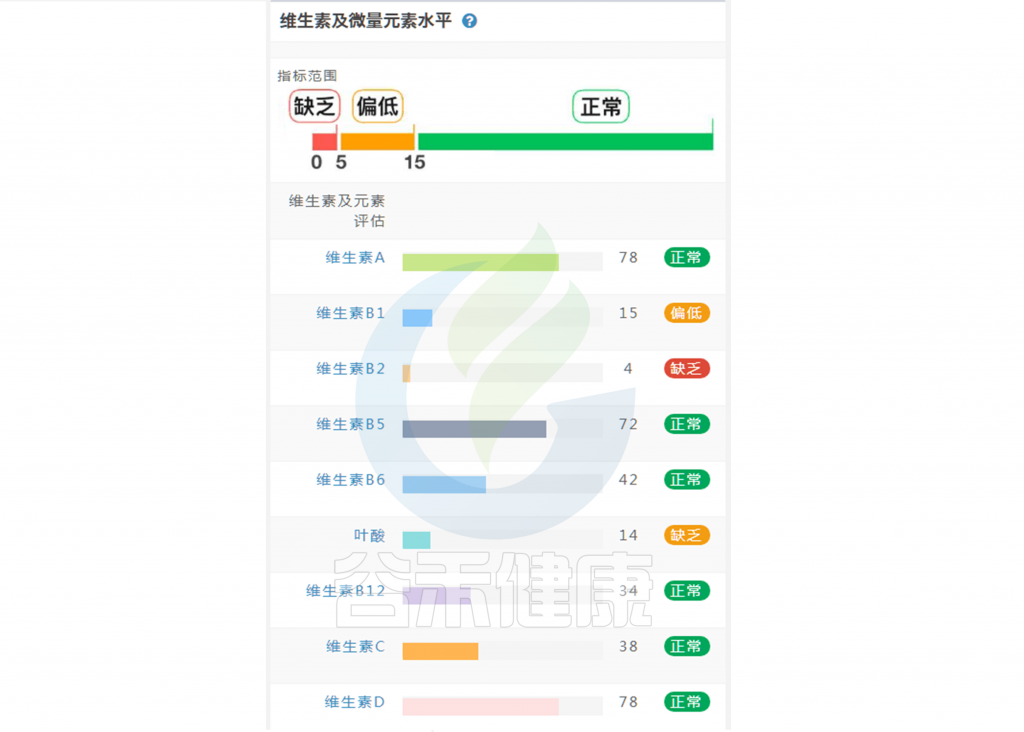
摄入水平建议保持在70-80分之间最佳,如果单项指标低于5表明摄入比例在人群中属于最低的5%,评估为缺乏,如上图中维生素B2;低于15评估为偏低,如上图中叶酸;达到或超过95则表明该项指标可能摄入比例偏高,可适当减少摄入;其余则为正常范围。
上图可以看到,像维生素C这项指标分值在38,虽然正常但相对于最佳来说是偏低的。
一些小伙伴可能会存在这样的疑惑:
为什么肠道菌群检测可以评估维生素?
这些维生素指标的分值代表着什么含义?
肠道菌群和维生素之间有什么样的关联?
它们如何影响人体健康/疾病?
如何判断维生素是否缺乏?
该如何补充?
…
本文就以上问题进行详细解答,同时也包括维生素-微生物群之间的相互作用,维生素维持肠道菌群稳态和减少肠道炎症以预防癌症的机制,产生维生素的益生菌,补充调节维生素的方式包括饮食、益生菌等。
在阅读本文之前,可以先了解一下各类常见的维生素功能,缺乏导致的症状。


每个维生素的详细介绍可以点开以下查看(请在谷禾健康微信公众号找到这篇文章查看)。
维生素B1(硫胺素)
维生素B2(核黄素)
维生素B3(烟酸)
维生素B5(泛酸)
维生素B6(吡哆醇)
维生素B7(生物素)
维生素B9(叶酸)
维生素B12(钴胺素)
以上每个都有关于该维生素的详细介绍,包括:
—正文—
维生素是一种微量营养素,在人体的生长、新陈代谢和发育中起着至关重要的作用。
在谷禾肠道菌群健康检测报告中,维生素分值即代表该维生素的膳食摄入水平和菌群代谢能力(报告中显示的分值是经过一系列计算得到的一个相对值)。
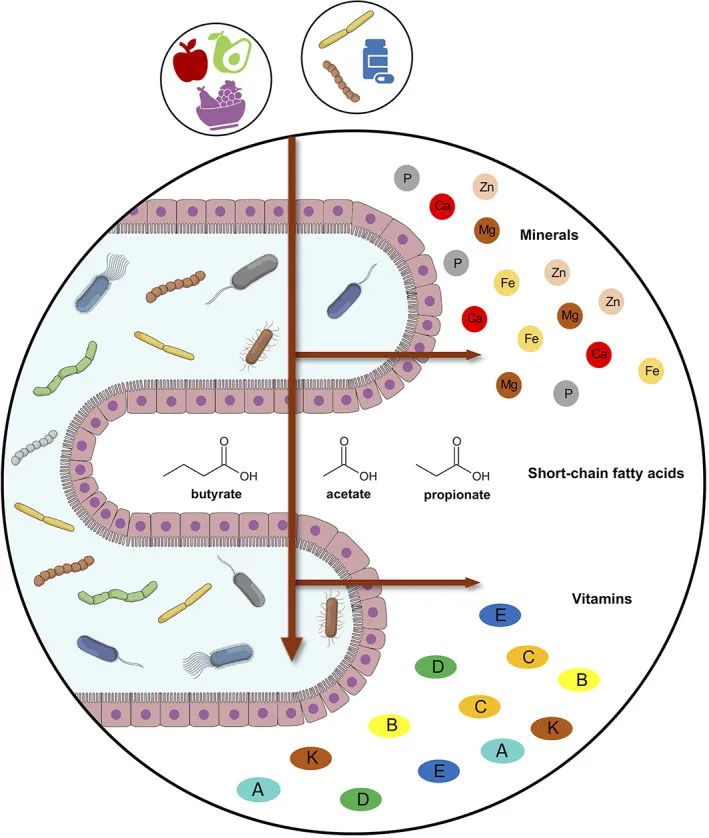
其中B族维生素很多需要通过肠道菌群对初始原料进行代谢之后才会产生,因此肠道菌群相应的基因和代谢途径的丰度水平也会直接反映这些维生素的摄入水平。
我们知道维生素的缺乏可能引起一些不良后果,导致维生素缺乏的原因有很多,摄入不足,吸收不良等都会导致维生素缺乏。
我们日常主要从饮食中获取维生素,肠道是主要吸收部位。例如,维生素 A 主要在近端空肠吸收,维生素 D 在远端空肠吸收最佳,维生素 E 和 K 主要在回肠吸收。因此,肠道功能受损可能会影响维生素的吸收。当然,影响维生素吸收的其他原因还包括年龄,某些疾病,药物等因素。
那么肠道菌群和维生素之间有什么关联?
肠道菌群是人体生理和健康的重要决定因素。肠道菌群帮助吸收营养,并参与维生素代谢。
肠道有益菌:乳酸菌和双歧杆菌,可以重新合成B族和K族维生素,为宿主提供约30%的每日摄入量。与从食物中获得的维生素不同,微生物产生的维生素主要在结肠中吸收。接下来了解一下具体哪些菌群,如何产生维生素。
前一章节我们知道,除了通过饮食提供维生素外,人体肠道中的细菌也可以产生一些维生素,如果吸收得当,可以部分满足人体的需要。
可以把这些细菌微生物想象成小小的维生素工厂。细菌确保为自己和与他们共生的微生物朋友提供维生素,同时也会为人体提供维生素。
合成的B族维生素的菌群较多
研究人员估计了人体肠道细菌可以提供维生素每日参考摄入量的百分比,得出的结论是可以提供:
40-65% 的人体肠道菌群具有合成 B 族维生素的能力。两种最常见的合成维生素是维生素B2和B3,预测分别有 166 和 162 个生产者。
可以合成 B 族维生素的细菌以及B 族维生素缺乏对肠道健康的影响
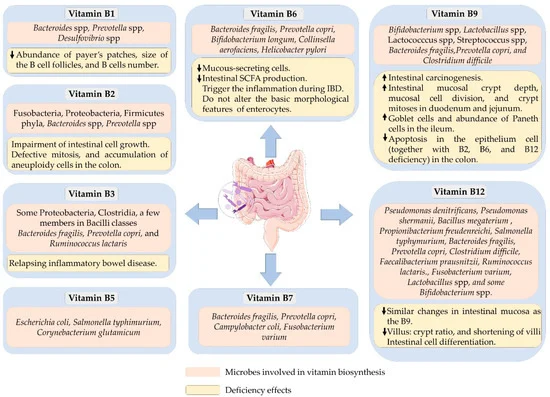
doi.org/10.3390/microorganisms10061168
大部分肠道菌群都参与维生素的合成
随着基因组注释方法的不断完善,研究人员可以预测维生素代谢途径并评估维生素生物合成潜力。通过检索 UniProt 数据库,研究人员发现:
厚壁菌门是维生素的主要代谢相关菌,其次是变形菌门,再然后是拟杆菌和放线菌。这四种菌群是人体肠道菌群的主要组成部分,占总菌群的60%-90%.
下表列出了参与合成B族维生素的肠道菌群,以及相应的代谢机制。


以上是肠道菌群对维生素产生的影响,而维生素和肠道菌群之间的作用是双向的,维生素也会影响肠道菌群,下一章节我们详细了解维生素对肠道菌群的影响。
维生素通过调节免疫力、细菌生长和新陈代谢来改变肠道微生物群的组成。
例如,膳食补充剂中的维生素 B、C、D 和 E 通过有利于双歧杆菌、乳酸杆菌和罗斯氏菌等有益菌属的肠道黏膜扩张和定植,在很大程度上有助于微生物组的组成。
肠道微生物组和宿主之间的微量营养素交换
doi: 10.1002/biof.1835
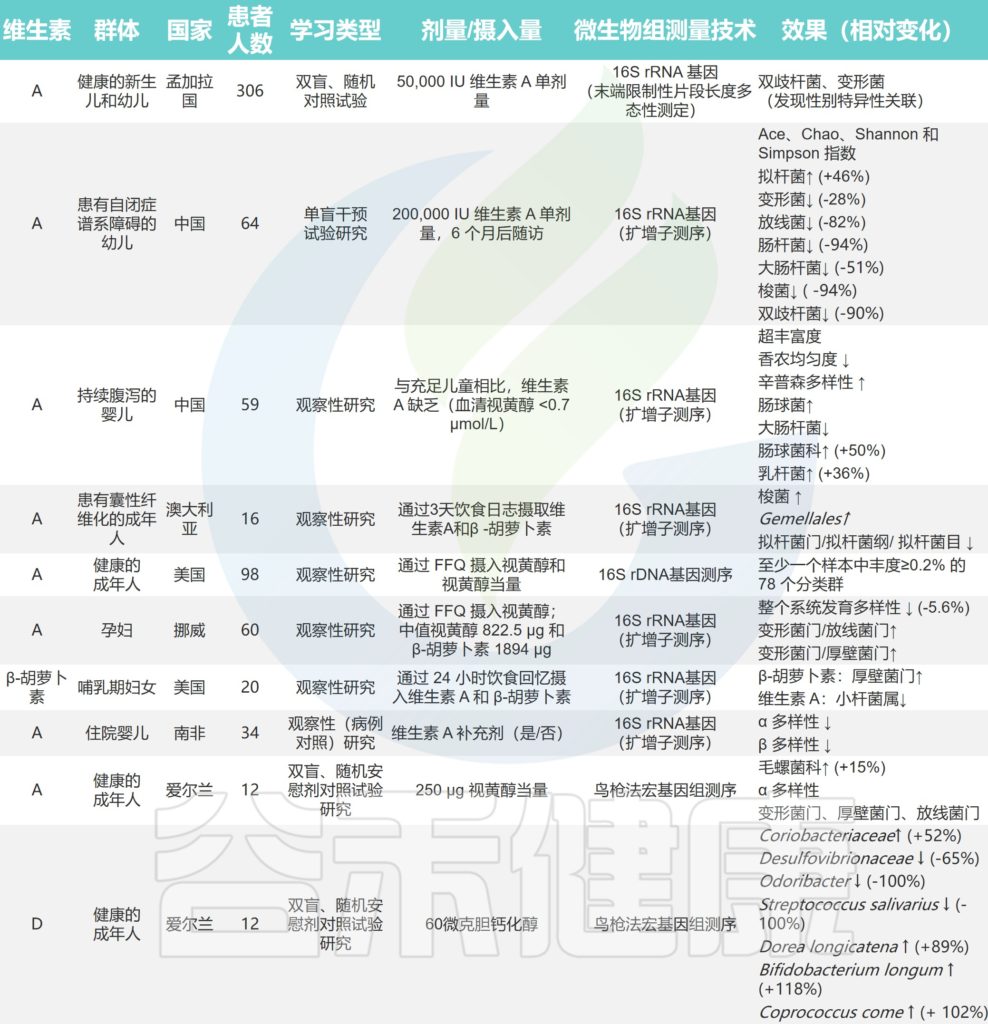
一项研究调查了 96 名健康志愿者,结果表明:
补充维生素 B2 后肠道微生物的种类数量显着增加;联合补充维生素 B2 和 C 导致Sutterella显着减少,但Coprococcus数量增加;
维生素C显着提高肠道微生物的α多样性;
服用维生素D后,促进放线菌的生长和抑制拟杆菌的生长。
补充维生素对人体肠道菌群的影响

doi.org/10.3390/nu14163383
/ 维生素A /
维生素 A 的充足状态可能与微生物多样性增加有关。在小鼠实验中,普通拟杆菌(Bacteroides vulgatus )在维生素 A 缺乏期显着增加。维生素 A 缺乏导致的粘膜反应受损,粘蛋白和防御素 6 表达减少,可能使病原菌更容易穿透肠道屏障。
维生素A缺乏使厚壁菌门中毛螺菌_NK4A136_群、厌氧菌、颤杆菌的数量减少,毛螺菌的含量也降低;然而,Parasutterella呈上升趋势。TLR4 可能参与了维生素 A 调节微生物群的过程。
/ B族维生素 /
研究人员在一个小的成年志愿者群体中进行了一项试点研究,该群体补充了过量核黄素(100mg),持续14天。他们发现,在补充期间,每克粪便中的Faecalibacterium prausnitzii数量增加。作者还注意到厌氧菌Roseburia 增加,大肠杆菌减少。
其他关于B族维生素对肠道菌群的影响详见:
/ 维生素C /
补充维生素 C 可减少肠杆菌科细菌的数量,增加乳酸杆菌的丰度,抑制有害菌的生长,促进有益菌的增加。
也有研究表明,维生素 C 服用4周导致 α 多样性增加,短链脂肪酸浓度增加。

/ 维生素D /
维生素 D 和肠道微生物群的相互作用对免疫稳态至关重要。补充高水平的维生素 D 增加了普氏菌,减少了韦荣氏菌和嗜血杆菌。
婴儿饮食中补充维生素 D 对早期微生物组成的变化有重要影响,而儿童缺乏维生素 D 会导致细菌多样性降低。
最近的一项研究表明,维生素D的活性代谢物1,25-二羟基胆钙化醇,维生素D受体的配体(VDR),影响美国不同地区老年人肠道菌群的α -和β -多样性。
研究人员报告了通过食物频率问卷评估的微量营养素摄入量与孕妇微生物群组成之间的相关性。他们观察到,高脂溶性维生素,特别是维生素D的膳食摄入量与微生物α多样性降低有关(P值<0.001),维生素D和视黄醇与变形菌相对增加有关,变形菌门是一个已知包含多种病原体并具有促炎特性的门。
/ 维生素E /
维生素E对变形菌有抑制作用,而维生素E(和纤维)的摄入量较低与Sutterella水平较高相关,据报道,自闭症和某些胃肠道疾病婴儿的Sutterella水平大量增加。
体外维生素E 可以防止几种人类病原体的生物膜形成,特别是金黄色葡萄球菌和表皮葡萄球菌。
/ 维生素K /
一项动物实验表明,缺乏维生素 K 的小鼠的肠道中,瘤胃球菌、毛螺菌科、Muribaculaceae的含量较多。
关于维生素对人体肠道微生物组直接影响的研究
doi.org/10.1016/j.nutres.2021.09.001
饮食是维生素的主要来源,通过饮食补充维生素也会影响菌群。
注:由于测试饮食干预效果所需的随机试验的样本量和持续时间,相关发病率的研究具有挑战性。此外,由于特定的营养素不是孤立地消耗的,而是作为饮食模式的一部分,并且饮食成分之间相互作用,因此饮食带来的实际影响可能只有作为一个整体考虑时才会变得明显。
因此这里我们主要考虑饮食模式,例如地中海饮食等饮食方式。
地中海饮食是营养均衡饮食的典型代表,其特点是大量且频繁地摄入重要的纤维来源(谷物、蔬菜、豆类、水果和坚果)和具有抗氧化特性的化学成分(维生素、类黄酮、植物甾醇、矿物质、萜烯和酚类)。

同时地中海饮食还富含复杂和不溶性纤维含量。我们知道,大量摄入膳食纤维可促进肠道中有益菌群的生长,例如增加拟杆菌、普雷沃氏菌属、罗斯氏菌属、瘤胃球菌属、普拉梭菌等菌属的丰度,从而在肠道中产生高水平的短链脂肪酸,包括丁酸盐。
响应地中海饮食而增殖的细菌可以充当“基石”物种,也就是说它们对于稳定的“肠道生态系统”至关重要。这些变化主要是由于膳食纤维和相关维生素和矿物质的增加,特别是维生素C、B6、B9、铜、钾、铁、锰和镁。
总之,维生素似乎是微生物-宿主间代谢相互作用的重要媒介。
越来越多证据表明,维生素缺乏会导致肠道菌群紊乱,进而引发肠道疾病,甚至促进炎症和肿瘤的发展。下一章节详细讨论,维生素-微生物群相互作用对健康/疾病的影响。
最近的几项观察表明,微生物群失调和维生素缺乏是相互关联的。
维生素对宿主健康的影响

doi.org/10.1016/j.nutres.2021.09.001
这种关系可能直接影响宿主健康:例如,克罗恩病恶化与参与抗炎介质核黄素、硫胺和叶酸生物合成的微生物基因减少有关。
此外,2型糖尿病受试者在与微生物介导的维生素代谢相关的基因丰度谱中显示出显著变化。
营养不良儿童的微生物群显示,参与B族维生素代谢的多种途径(包括烟酸/NADP生物合成)显著减少。
在经历饮食振荡以诱导急性短期维生素A缺乏的灵长类小鼠模型中,Hibberd等人观察到细菌群落结构和宏转录组的调节,其中Bacteroides vulgatus是显著的应答者,在缺乏维生素A的情况下其丰度增加。有趣的是,B.vulgatus是在人类肠道微生物群的灵长类小鼠模型中鉴定的一种生长差异物种。
所有这些观察结果表明,维生素缺乏可能会改变肠道微生物群,从而影响人体健康。
下面我们以肠道疾病和精神类疾病两大类疾病为例,来具体了解维生素-微生物相互作用及其在疾病中的影响。
维生素 A 和 D 分别在近端和远端空肠吸收。维生素E和K主要在回肠吸收;微生物产生的维生素主要在结肠中吸收。维生素缺乏会加重肠道炎症,甚至通过多种机制促进癌症。
肠道菌群->维生素->肠道疾病中的作用
慢性 IBD 发生和发病机制中的关键作用是微生物(尤其是共生菌群)对宿主黏膜免疫功能的影响。同时,肠道微生物群和慢性炎症已被证明与肿瘤发生密切相关。
维生素具有调节肠道菌群和保护肠道的功能。因此,维生素和微生物群的相互作用可能在 IBD 和结直肠癌的治疗中具有巨大的潜力。
维生素A通过促进黏膜愈合、促进产生ASCFA的相关菌增加、降低UC相关菌的水平来达到治疗UC的效果。
费氏丙酸杆菌ET-3 产生维生素 K2 的前体,即 1,4-二羟基-2-萘甲酸 (DHNA),可激活芳烃受体 (AhR) 以改善结肠炎并调节肠道微生物群。
维生素 D 的缺乏会增加拟杆菌门、变形杆菌门和螺杆菌科的丰度,降低厚壁菌门和去铁细菌的丰度门,并且还影响 E-钙粘蛋白表达并减少耐受树突状细胞的数量。
然而,在治疗 IBD 时,维生素 D 与利福昔明的共同给药会影响肠道菌群和利福昔明的疗效。维生素 D 促进A. muciniphila的生长以保护肠粘膜屏障,这些作用对于对抗结直肠癌的发展尤为重要。
研究表明,维生素 E 及其代谢物在调节肠道菌群、减少炎症和抑制癌变方面具有巨大潜力。此外,维生素 Eδ-生育三烯酚 (δTE) 及其代谢物δTE-13′-羧基色原酚 (δTE-13′) 增加了肠道中的乳球菌和拟杆菌,并抑制炎症因子的产生。
维生素->肠道菌群->肠道疾病中的作用
▸维生素在IBD和结直肠癌中的作用不容忽视
大量临床研究表明,缺乏维生素 B 和维生素 D 的人群中结直肠癌的患病率较高。同时,IBD 的长期不愈合使患者面临更高的结直肠癌风险。维生素 D 水平低的 IBD 患者疾病严重程度和预后较差。
▸为什么肠道炎症容易导致癌症高风险?
在炎症背景下,敲除 IKKbetaβ(炎症与癌症之间的联系)可减少由于上皮细胞凋亡增加而导致的癌症发生。在一项关于结肠炎相关癌前癌 (CApC) 的研究中,IL-6 反式信号转导的存在增加了炎症性致癌的风险。如果不及时治疗,由肠道菌群紊乱和维生素缺乏引起的肠道炎症最终可能发展为癌症。
维生素 A 在肠道炎症和癌症中的作用
维生素 A 及其活性代谢物视黄酸 (RA) 在人体免疫系统中发挥着关键作用,并可能对辅助 T 细胞的分化产生影响。
炎症下:视黄酸从保护转变为破坏作用
在非炎症条件下,视黄酸能够抑制 IL-6 受体的表达和 Th1/Th17 的产生。
在炎症条件下,视黄酸从对粘膜的保护作用转变为破坏作用;这反映在活动期 IBD 患者黏膜中视黄酸水平显着升高,伴随着 CD4 和 CD8 分泌的 IL-17 和 IFN-γ 的上调。
维生素A及其代谢物:发挥抗炎作用
维生素 A 及其代谢物通过阻断 Th1 和 Th17 的激活,抑制 IL-17、INF-γ 和 TNF-α 的产生而显示出抗炎作用。同时,它们可以通过与TGF-β协同作用,提高Foxp3的水平,发挥免疫功能,从而促进抗炎因子的发挥。
一项数据显示,低水平的维生素 A 会激活核 NF-kB 并促进胶原蛋白的形成,从而加剧结肠炎的炎症。补充维生素后,肠道炎症明显缓解。
全反式维甲酸 (AtRA) 可降低 UC 和结直肠癌患者结肠黏膜分泌的 TNF-α 和一氧化氮合酶 2 (NOS2) 蛋白的表达。

维生素A保护肠黏膜屏障,其潜在机制是拮抗LPS的肠道破坏作用
在一项关于维生素 A 缺乏对结肠炎和结直肠癌发展的影响的检查中,研究人员使用葡聚糖硫酸钠 (DSS) 诱导小鼠结肠炎;此外,偶氮甲烷 (AOM) 预注射和 DSS 结肠炎的组合诱导了结直肠癌。缺乏维生素的小鼠肠道炎症水平较高,黏膜愈合较慢,免疫反应增强,更容易发生结直肠癌。
AtRA具有抗癌作用,结直肠癌中AtRA 水平降低
在结直肠癌小鼠模型中,肠道细菌引起的炎症影响 AtRA 代谢;这导致其水平下降。在 UC 及其相关结直肠癌的临床样本中发现 AtRA 代谢酶活性降低和 AtRA 水平降低。同时,AtRA通过激活CD8 + T细胞发挥抗癌作用;这为 CAC 的治疗提供了新的见解。
视黄醇和视黄醇结合蛋白(RBP)的结合激活致癌基因STRA6,促进结直肠癌的发生;Holo-RBP/STRA6 通路可通过促进成纤维细胞的致癌作用进一步发挥致癌作用。
在一项关于维生素 A 缺乏对结肠炎和结直肠癌发展影响的动物实验中,当维生素 A 处于低水平时,小鼠体内的维生素 A 脂滴会被降解,免疫反应会增强,结肠炎症会加重,癌变进程将加快。
维生素 B12 和叶酸在肠道炎症和癌症中的作用
IBD 患者缺乏维生素 B12 和叶酸的原因有很多,包括回肠和空肠微生物过度生长、维生素 B12 摄入不足或身体需求增加、维生素肠道破坏增加或吸收能力降低、某些药物(如甲氨蝶呤或柳氮磺胺吡啶)的不良反应、一些病理原因例如蛋白丢失性肠病、肝功能异常、回肠相关病变或手术切除、肠瘘等。
维生素 B12 缺乏不会影响健康的肠道微生物群组成;然而,它会导致实验性结肠炎中肠道菌群失调,并促进条件致病菌的生长。出乎意料的是,维生素 B12 缺乏减少了结肠组织的损伤;这可能与抗炎细胞因子 IL-10 的增加有关。

对甲基缺乏饮食 (MDD) 的潜在作用进行了一项研究,该饮食可降低维生素 B12 和叶酸的血浆浓度,并提高同型半胱氨酸水平,对 DSS 诱导的小鼠结肠炎的影响。喂食 MDD 的 DSS 治疗小鼠比其他治疗组患有更严重的结肠炎。
尽管超氧化物歧化酶和谷胱甘肽过氧化物酶活性保持稳定,但 caspase-3 和 Bax 的水平受到影响。除Bcl-2表达增加外,炎症相关标志物如胞质磷脂酶A2和环氧合酶2的表达也有明显增加趋势;这伴随着金属蛋白酶组织抑制剂(TIMP)3蛋白的表达降低。因此,维生素 B12 缺乏可能会加重实验性 IBD 的炎症程度。
高维生素 B12 水平可通过减少 DNA 甲基化来降低结直肠癌的风险
在结直肠癌患者中,与低血清维生素 B12 组相比,高维生素 B12 组的肿瘤区域和外周血单个核细胞 (PBMC) 中长散布的核元素 1 (LINE1) 甲基化被证明是降低的;肿瘤区域的LINE1甲基化水平也低于周围的非肿瘤区域。
氧化应激是结直肠癌发病机制之一;此外,叶酸和维生素 B12 的水平与体内抗氧化剂谷胱甘肽的水平呈正相关。提高 AOM 诱导的结直肠癌中的叶酸和维生素 B12 水平显示出显着的抗凋亡、抗氧化应激和抗 AOM 细胞毒性。
在对 4517 名 IBD 患者的系统评价和荟萃分析中,补充叶酸被证明可以降低 IBD 患者的结直肠癌风险并防止结直肠癌发展。
有趣的是,有证据表明缺乏甲基供体营养素叶酸、胆碱、蛋氨酸和维生素 B12 会抑制 Apc 突变小鼠的肿瘤发展。总而言之,维生素B12和叶酸在肠道疾病中的作用需要更深入的研究。
维生素 D 在肠道炎症和癌症中的作用
流行病学和动物实验表明,维生素 D 缺乏是 IBD 和 结直肠癌的高危因素。维生素 D 补充剂有助于降低疾病严重程度,可能通过多种机制,包括调节免疫细胞运输和分化,以及抗菌肽合成。
维生素D可以维持肠黏膜屏障的正常功能,提高机体的先天性和适应性免疫
1α,25-二羟基维生素 D3(骨化三醇)是维生素 D 的活性形式,可与 TGF-β 结合,提高 IL-2 水平,调节 T 细胞抑制炎性细胞因子的产生,增强 Foxp3 + Treg 细胞的存活和功能。

维生素D受体(VDR)是维生素D调节免疫和发挥抗炎作用的重要途径
相关资料显示,VDR对肠道有保护作用;它可以通过调节 JAK/STAT 通路来维持肠道稳态并预防癌症。
在 IBD 患者 中,结肠上皮中VDR的含量明显低于正常人。在实验性结肠炎模型中,与缺乏 VDR 的小鼠相比,表达 hVDR 的转基因小鼠的结肠炎症较少。用 hVDR 转基因恢复上皮 VDR 表达可减轻严重结肠炎并降低死亡率。内在机制是 VDR 通过抑制 NF-κB 活化发挥抗凋亡作用,以保护肠道屏障缓解结肠炎。
肠道菌群通过犬尿氨酸通路(合成维生素),在精神健康方面发挥作用
关于肠道细菌在心理健康方面的作用的关键方面,是它们通过犬尿氨酸通路参与调节色氨酸代谢。微生物群能够合成犬尿氨酸途径 (KP) 的酶促辅助因子,如维生素 B2 和 B6。

犬尿氨酸是主要的色氨酸代谢途径,其中 95% 的这种氨基酸被代谢为各种免疫和神经调节犬尿氨酸/色氨酸分解代谢物 (TRYCAT),在大脑中,犬尿氨酸途径主要在神经胶质细胞中分隔。
犬尿氨酸通路在精神、神经退行性和神经系统疾病中的作用是至关重要的,包括重度抑郁症,双相情感障碍,精神分裂症,阿尔茨海默病,亨廷顿病和帕金森病,与 HIV 感染相关的痴呆,手术后认知能力下降,肌萎缩侧索硬化(ALS) 等。
精神病理学和炎症中维生素缺乏与高同型半胱氨酸血症有关
精神病理学和炎症中维生素缺乏的另一个关键机制与高同型半胱氨酸血症(hHcy)有关,这可能是由叶酸、维生素 B6 和 B12 缺乏引起的。
高同型半胱氨酸血症和维生素 B 缺乏在重度抑郁症、精神分裂症、双相情感障碍、自闭症、焦虑症和痴呆症(包括阿尔茨海默病和帕金森病)中起关键作用。
同型半胱氨酸(Hcy)是在蛋白质消化过程中获得的另一种氨基酸蛋氨酸代谢过程中形成的氨基酸和中间体。该反应需要维生素 B12 作为酶促辅因子和叶酸衍生物(5-甲基四氢叶酸)作为甲基供体。
注:Hcy-同型半胱氨酸,是人体内含硫氨基酸的一个重要的代谢中间产物,可能是动脉粥样硬化等心血管疾病发病的一个独立危险因子。
此外,Hcy 可以在需要维生素 B6 作为酶辅因子参与的途径中转化为半胱氨酸。
因此,Hcy 被认为是叶酸和维生素 B12 缺乏的敏感标志物。
高同型半胱氨酸血症导致神经和精神病理学的机制包括:
促进免疫炎症反应、增加肠道和血脑屏障通透性、NMDA受体激动和神经毒性、诱导神经元凋亡、氧化应激、线粒体功能障碍和由于甲基化受损导致的单胺能神经递质合成失调。
目前对体内维生素水平的检测例如:
抽取血液检测其中维生素的含量水平,可以判断是否存在维生素的缺乏情况。
其他,例如通过肠道菌群健康检测,也可以查看近期体内维生素状况。
与通过血液进行维生素检测不同,肠道菌群的评估更加反映一段时间 ( 一般2周左右 ) 的长期状态,如部分B族维生素无法在体内留存,需要每日补充,血液检测波动较大。
注:菌群会受检测前一天饮食的影响,造成15~30%的菌群改变,同样也会反映在营养状况的评估上,因此建议检测前一天尽量保持近期正常饮食 ,这样能更好的反映真实的营养饮食状态。
在了解补充维生素的干预措施之前,我们先从肠道菌群的角度,来了解一下影响维生素合成吸收的因素。
人类基因的变异与肠道结构和微生物组组成有关。人类肠道微生物群中存在不同的维生素 B 生物合成途径支持人类遗传变异影响维生素 B 合成的观点。
维生素的合成吸收不仅需要靠饮食补充,还与吸收相关。而维生素的吸收涉及到相关基因,例如:
MTHFR 基因的突变会影响我们产生加工维生素 B9的酶——亚甲基四氢叶酸还原酶。
亚甲基四氢叶酸还原酶是叶酸代谢通路中的一种重要的辅酶,亚甲基四氢叶酸还原酶基因缺陷,容易造成叶酸在体内的代谢障碍,MTHFR基因最主要的两种突变为C677T、A1298C基因多态性。该两种位点同时突变可显著降低MTHFR活性进而降低叶酸水平。
VDR基因(维生素 D 受体):维生素 D(来自阳光、食物或补充剂)经过转化步骤后,活性形式骨化三醇 (1,25(OH)2D3 ) 可以通过VDR在细胞内发挥作用,是打开或关闭基因的转录因子。该基因突变可能导致维生素D缺乏引起的佝偻病。
维生素缺乏是一个严重的问题,尤其是在老年人中。随着年龄的增长,营养需求会随之变化。
由于食物中的维生素B12 需要胃酸及胃蛋白酶的作用才能释放出来被吸收,而老年人胃酸及胃蛋白酶分泌减少,就会影响维生素B12 的吸收。
患有维生素B12缺乏症的老年人可能出现神经精神或代谢缺陷。
一些药物会改变营养物质的吸收或代谢方式。例如,抗惊厥药也会减少叶酸的吸收。
肠道菌群通过各种代谢途径影响维生素的合成,例如拟杆菌属、肠球菌属和双歧杆菌属等人类肠道共生菌可以从头合成维生素 K 和大多数水溶性 B 族维生素,这在前面第二章节的表已经详细阐述。
在 B 族维生素合成中暴露于抗生素的反应因使用的抗生素类型而异。例如,在饮食中添加青霉素和金霉素会增加雄性大鼠的肝脏维生素 B2 浓度,以及 B2 和 B3 在尿液中的排泄。然而,链霉素和放线菌酮的施用降低了肝脏中维生素 B9 和 B12 的浓度。维生素合成对抗生素暴露的混合反应尚不清楚,但它们可能是由肠道微生物群的选择性改变引起的。
自由基是含有不成对电子的化学物质,可以诱导氧化应激。一个这样的例子是一氧化氮,它与金属离子形成复合物,包括钴,维生素 B12 的一种结构成分,因此使其无法用于细菌维生素 B12 的生物合成。此外,维生素生产者(如脆弱拟杆菌)暴露于过氧化氢等自由基会抑制其生长 ,从而降低维生素的生物合成能力。
维生素主要在小肠中吸收,其生物利用度取决于食物成分,相关相互作用等。
饮食和膳食的组成会通过影响肠道转运时间和/或混合胶束的肠道形成来影响某些维生素的吸收。
饮食中足量的水和膳食脂肪对于分别吸收水溶性和脂溶性维生素至关重要。
*水溶性维生素包括:B族维生素,维生素C;
脂溶性维生素包括:维生素 A、D、E 、K.
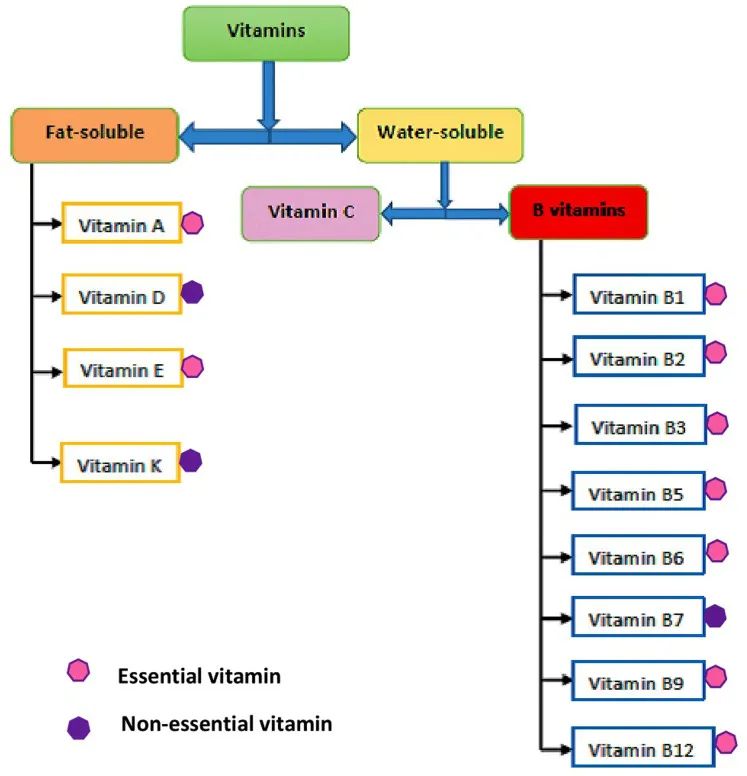
doi: 10.7717/peerj.11940
由于脂溶性维生素可以溶解在脂肪中,因此与膳食脂肪一起食用时最容易被吸收。例如,一种富含维生素 A 的小胡萝卜,如果单独食用,将在食物中获取维生素 A,但如果它是在含有一些膳食脂肪的食物成分中(比如说,橄榄油),将增加体内维生素 A 的吸收。
食物的性质(物理状态)也会影响维生素的吸收效率。例如,存在于可消化性较差的纤维植物材料中的类胡萝卜素已被证明相对于维生素A表现出较低的生物利用度。
当我们看到维生素缺乏的时候,可能希望通过饮食来补充相应缺乏的维生素,下表列出了常见的维生素的食物来源,可供参考。
此外,宿主饮食作为肠道中细菌的底物,其对肠道微生物分布的影响已被广泛研究。含有益生元和其他膳食营养素(如微量营养素和多酚)的饮食可以显着影响有益细菌的生长,包括维生素生产菌。
一些维生素,如核黄素,可作为氧化还原介质并刺激营养缺陷菌(如Faecaibacterium prauznitsii)的生长。
在即将形成共生关系的环境中,限制这些基质会增加微生物和微生物与宿主之间的竞争。
除了通过饮食直接补充之外,我们还可以通过补充益生菌来调节维生素水平,从而改善疾病。
双歧杆菌
在健康成人中补充益生菌菌株青春双歧杆菌DSM 18350、青春双歧杆菌DSM 18352 和假链双歧杆菌DSM 18353,导致粪便中叶酸浓度显着增加。
乳酸菌
乳酸菌通过不同的机制抑制炎症过程,包括调节IBD患者肠道菌群紊乱、保护肠道屏障和黏膜的正常功能、调节人体免疫反应等。乳酸菌通过产生核黄素(维生素 B2)和叶酸发挥抗炎和抗氧化作用。
产维生素的乳酸菌不仅对急性肠炎有抗炎作用,还能有效缓解复发性结肠炎。此外,在与美沙拉秦合用过程中,可有效降低不良反应,提高疗效。
研究人员发现注射产生叶酸的乳酸菌会缓解 5-FU 引起的肠炎小鼠的腹泻,改善结肠组织的结构和功能。这一发现降低了癌症化疗期间发生的肠黏膜炎症的严重程度,并提高了药物有效性;因此,这提高了患者的生活质量。
此外,乳酸菌 和 5-FU 的联合使用可减少 5-FU 引起的血细胞计数减少,并使患者获得完整的治疗周期。
产维生素的益生菌在肠道疾病中的作用

doi.org/10.3390/nu14163383
研究人员从 150 个收集的人类粪便样本中分离出三种产生核黄素和叶酸的益生菌;他们用它们来治疗乙酸引起的大鼠结肠炎。他们发现这些益生菌可以保护结肠黏膜,促进溃疡性病变的愈合;此外,它们具有抗炎和抗氧化应激作用。
一种新分离的具有产生叶酸能力的细菌——清酒乳杆菌LZ217,具有促进丁酸产生和改善肠道菌群组成的作用。
Akkermansia muciniphila 是肠道中的一种常见细菌,可调节 CLT 以保护肠道免受炎症和肿瘤侵袭;它还产生维生素 B12 以缓解 IBD 患者的维生素缺乏症。
研究发现,丙酸杆菌菌株 P. UF1 合成维生素 B12;这对肠道免疫和肠道健康有积极的调节作用。
大肠杆菌通过产生维生素来缓解 IBD. 使用大肠杆菌生产两种产生β-胡萝卜素的菌株来治疗维生素A缺乏症。这些结果显示出巨大的临床潜力。
维生素 A 及其代谢物与短乳杆菌KB290 的组合提高了 CD11c + MP/CD103-DC 比率;因此,这在结肠炎的治疗中起着积极的作用。
此外,肠道中的分段丝状细菌 (SFB) 可以产生 AtRA,以抵消感染对肠道的损害。
益生菌对维生素D及其受体活性有积极作用,如鼠李糖乳杆菌GG(LGG)和植物乳杆菌(LP);同样在沙门氏菌结肠炎模型中,使用 VDR (-/-) 小鼠验证 LGG 对 IBD 的缓解作用是通过 VDR 信号通路。
此外,胆汁盐水解酶 (BSH)活性罗伊氏乳杆菌NCIMB 30,242 可调节血浆中的活性维生素 D 水平。磷虾油 (KO)、益生菌罗伊氏乳杆菌和维生素 D 的混合物显着降低病理评分和炎症因子的释放,促进黏膜愈合并减少机会性感染的发生。
经益生菌 VSL#3 预处理后,VDR 水平显着提高,共同保护肠黏膜,防止损伤;这对预防CRC的发展起到一定的作用。
用从韩国泡菜中分离的乳酸菌条件培养基处理 HCT116 细胞或肠类器官后,其分泌的蛋白质 P40 和 P75 与 VDR 的表达增加有关;它们还增强自噬反应,共同具有抗炎作用。肠道微生物合成的石胆酸 (LCA) 充当连接 VDR 与微生物的桥梁,从而提高维生素 D 水平。
益生菌配方有助于抑郁症患者维生素水平的增加
一项随机对照试验中,重度抑郁症患者接受了多种益生菌配方,其中含有双歧杆菌W23、乳双歧杆菌W51、乳双歧杆菌W52、嗜酸乳杆菌W22、干酪乳杆菌W56、副干酪乳杆菌W20、植物乳杆菌W62、唾液乳杆菌W24、乳酸乳杆菌W19。
此外,益生菌组和安慰剂组的患者接受了相同剂量的维生素 B7。在两组中,抑郁症的临床参数都有所改善,然而,益生菌干预组与安慰剂组相比,仅在微生物 β 多样性方面存在差异,临床结果指标没有差异。有趣的是,尽管两组都接受了相同剂量的生物素,但接受益生菌的那组维生素 B6 和 B7 的合成上调。
多种益生菌相结合通过增加叶酸和维生素 B12血浆水平,改善精神疾病
八周的个性化饮食与含有多种益生菌的菌株相结合:婴儿双歧杆菌DSM 24737、长双歧杆菌DSM 24736、短双歧杆菌DSM 24732、嗜酸乳杆菌DSM 24735 、德氏乳杆菌、保加利亚乳杆菌DSM 24734、副干酪乳杆菌DSM 24733、植物乳杆菌DSM 24730 、嗜热链球菌DSM 24731 (VSL#3),在健康老年人中增加了叶酸和维生素 B12 血浆水平并降低了 Hcy 血浆水平。
此外,益生菌的添加导致粪便双歧杆菌浓度增加,这种变化与叶酸和维生素 B12 水平呈正相关。
在精神病患者中引入高同型半胱氨酸的评估和治疗可能非常有价值,益生菌可能成为治疗工具之一。
维生素是相互关联的、具有协同作用的微量营养素,当它们处于适当的平衡状态时,它们的全部潜力就会得到充分发挥。
因此,在食用益生菌和发酵食品时,应考虑维生素生产者与代谢者之间复杂的相互作用。
除了以上方式干预菌群之外,也可以通过良好的生活方式调理菌群,从而使维生素达到一个相对健康稳定的水平,减少各类疾病风险。
▸在服用维生素的同时可以服用益生菌吗?
可以。在大多数情况下,服用益生菌不会影响其他补充剂的效果。
一项 2021 年对临床试验的系统评价发现,益生菌可以改善健康人群的微量营养素水平,特别是维生素 B12、叶酸(维生素 B9)、钙、铁和锌。
2017 年的一项非随机临床试验发现,服用益生菌和铁补充剂的参与者比不服用益生菌的铁吸收明显更多。
有研究表明,维生素 D 和益生菌之间存在协同关系。
随机对照试验发现,维生素 D 补充剂与益生菌一起可以改善多囊卵巢综合征患者和同时患有冠心病的糖尿病患者的各种心理健康参数、一般健康状况、代谢和炎症标志物。
2019 年对随机对照试验的系统评价和荟萃分析发现,维生素 D 强化酸奶(富含益生菌嗜酸乳杆菌)有助于改善维生素 D 和胆固醇水平、代谢功能和身体测量值。
然而以上研究都没有单独研究维生素 D 和益生菌的作用,因此尚不清楚结果是否与两者的综合影响有关。
研究人员认为,无论有没有维生素,服用益生菌的时间很重要。作为一般规则,服用益生菌的最佳时间是空腹,大约在进食前 30 分钟。
研究人员担心胃酸的存在会影响益生菌的生存能力。在餐前或餐后几个小时服用时,当胃酸自然降低时,益生菌可以进入肠道,从而提高其生存几率。
何时服用维生素取决于维生素的种类。复合维生素通常最好在早上第一时间服用,非常适合搭配早餐前的益生菌。脂溶性维生素,如 A、D、E 和 K 以及一些矿物质,包括铁和镁,最好与食物一起服用。否则可能会导致胃部不适。
▸应该从食物中补充维生素还是通过维生素补充剂?
2020 年的一篇文献综述发现,与浓缩补充剂相比,许多微量营养素在其全食物形式中的生物利用度更高。因此提倡补充方式以食物为先。
一般认为,对于健康人来说,营养均衡的饮食可以提供身体需要的维生素,不需要额外补充,但对于可能存在免疫功能、肠道健康、吸收不良等问题的人群,可以考虑维生素补充剂进行补充,具体补充剂量请遵医嘱。
下表是维生素易缺乏的高风险人群:

▸可以长期服用维生素补充剂吗?补充过量会带来副作用吗?
一般健康人不需要长期服用维生素补充剂。
对于服用复合维生素片,多余的维生素会被排出体外,因此不用过于担心会带来危害。但是如果长期十倍以上的用量,对身体是有危害的。

doi: 10.7717/peerj.11940
在发现维生素缺乏的症状的时候,我们可能希望通过补充相应的维生素补充剂来改善健康。然而服用任何补充剂之前,我们应该寻找其根本原因而不是直接根据症状盲目补充。
通过肠道菌群健康检测可以了解维生素缺乏状况,且可以根据各类菌群丰度来推断维生素的菌群代谢状况。如果是由于菌群的代谢异常,可能直接补充并没有太大效果,这时候优先调节菌群或许是更好的选择。
如果维生素指标都显示正常没有缺乏(如下图),保持常规饮食不需要刻意补充。还想要更健康,指标更接近70的话,可以在数值略小的指标上,针对性地通过饮食进行补充调理。
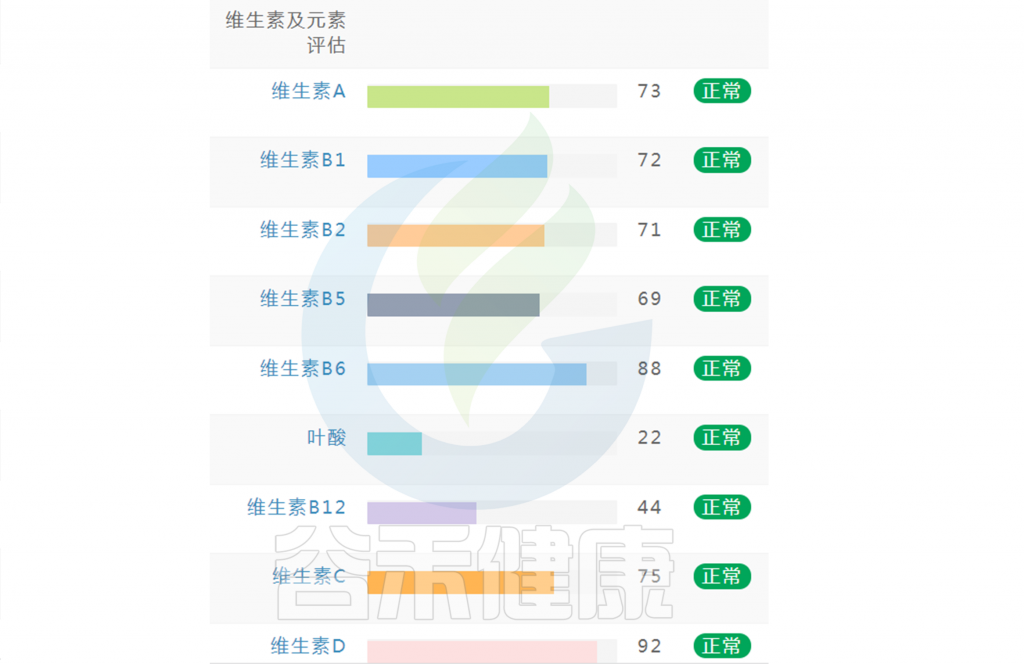

如果维生素指标中出现个别指标缺乏或偏低(如下图),可以通过饮食针对性地进行改善调整,如果已经出现对应症状,例如缺乏维生素A,同时出现干眼症或者夜盲症等相应的症状,可以使用相应的维生素补充剂进行干预,或者根据菌群代谢通路判别,通过菌群调理进行相应干预。
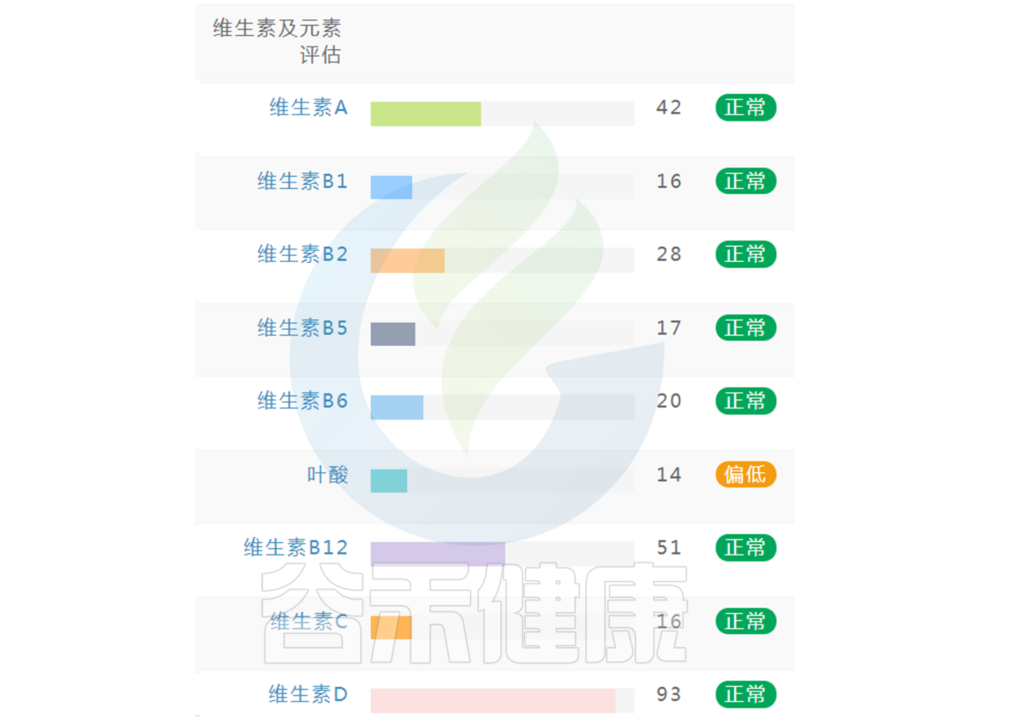
如果维生素指标中出现缺乏或偏低的指标较多,则需要选用复合维生素,各类维生素之间可能存在协作关系,同时配合饮食、菌群进行干预。
选择补充剂,应优先考虑生产规范良好的产品,比如说可以查看是否有“OTC”标志。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Zhai Z, Dong W, Sun Y, Gu Y, Ma J, Wang B, Cao H. Vitamin-Microbiota Crosstalk in Intestinal Inflammation and Carcinogenesis. Nutrients. 2022 Aug 17;14(16):3383. doi: 10.3390/nu14163383. PMID: 36014889; PMCID: PMC9414212.Zhai Z, Dong W, Sun Y, Gu Y, Ma J, Wang B, Cao H. Vitamin-Microbiota Crosstalk in Intestinal Inflammation and Carcinogenesis. Nutrients. 2022 Aug 17;14(16):3383. doi: 10.3390/nu14163383. PMID: 36014889; PMCID: PMC9414212.
Bellerba F, Muzio V, Gnagnarella P, Facciotti F, Chiocca S, Bossi P, Cortinovis D, Chiaradonna F, Serrano D, Raimondi S, Zerbato B, Palorini R, Canova S, Gaeta A, Gandini S. The Association between Vitamin D and Gut Microbiota: A Systematic Review of Human Studies. Nutrients. 2021 Sep 26;13(10):3378. doi: 10.3390/nu13103378. PMID: 34684379; PMCID: PMC8540279.
Ofoedu CE, Iwouno JO, Ofoedu EO, Ogueke CC, Igwe VS, Agunwah IM, Ofoedum AF, Chacha JS, Muobike OP, Agunbiade AO, Njoku NE, Nwakaudu AA, Odimegwu NE, Ndukauba OE, Ogbonna CU, Naibaho J, Korus M, Okpala COR. Revisiting food-sourced vitamins for consumer diet and health needs: a perspective review, from vitamin classification, metabolic functions, absorption, utilization, to balancing nutritional requirements. PeerJ. 2021 Sep 1;9:e11940. doi: 10.7717/peerj.11940. PMID: 34557342; PMCID: PMC8418216.
Steinert RE, Lee YK, Sybesma W. Vitamins for the Gut Microbiome. Trends Mol Med. 2020 Feb;26(2):137-140. doi: 10.1016/j.molmed.2019.11.005. Epub 2019 Dec 17. PMID: 31862244.
Pham VT, Dold S, Rehman A, Bird JK, Steinert RE. Vitamins, the gut microbiome and gastrointestinal health in humans. Nutr Res. 2021 Nov;95:35-53. doi: 10.1016/j.nutres.2021.09.001. Epub 2021 Oct 21. PMID: 34798467.
Hossain KS, Amarasena S, Mayengbam S. B Vitamins and Their Roles in Gut Health. Microorganisms. 2022 Jun 7;10(6):1168. doi: 10.3390/microorganisms10061168. PMID: 35744686; PMCID: PMC9227236.
Rudzki L, Stone TW, Maes M, Misiak B, Samochowiec J, Szulc A. Gut microbiota-derived vitamins – underrated powers of a multipotent ally in psychiatric health and disease. Prog Neuropsychopharmacol Biol Psychiatry. 2021 Apr 20;107:110240. doi: 10.1016/j.pnpbp.2020.110240. Epub 2021 Jan 9. PMID: 33428888.
Barone M, D’Amico F, Brigidi P, Turroni S. Gut microbiome-micronutrient interaction: The key to controlling the bioavailability of minerals and vitamins? Biofactors. 2022 Mar;48(2):307-314. doi: 10.1002/biof.1835. Epub 2022 Mar 16. PMID: 35294077; PMCID: PMC9311823.

谷禾健康

每个人的一生都会经历很多,从出生到长大,健康到衰老疾病。你的出生、遗传、家庭环境、很大程度上决定的人生起点,日常的饮食、行为习惯决定你的身体成长,一些不同的选择或意外的事件又会让人生有很多起伏和不同。
每个人的菌群和我们的人生一样也是独一无二的,我们菌群的特点反映着不同人各自生活的烙印。从母亲的腹中开始影响和决定了我们最初的菌群,出生方式、喂养的食物、用药等都决定了我们的菌群基数。当我们开始从喝奶到开始摄入辅食,我们的菌群也同样迎来巨大的演变。当我们生病、感染、运动、饮食、社交、虚弱、衰老这些同样反映在我们菌群的变化和演替上。
相对的,当我们更多的了解我们的菌群,善待和改善它们,同样的变化也会出现在我们的身体和生活中。
越来越多的证据表明,年龄与人类微生物群之间的关联很大,肠道微生物群是许多年龄相关变化的核心,包括免疫系统失调和疾病易感性。几个身体部位的微生物组成可以相对准确地预测人类的年龄。
谷禾健康肠道菌群检测数据库中,也有关于肠道年龄预测:
谷禾健康-肠道年龄预测模型图
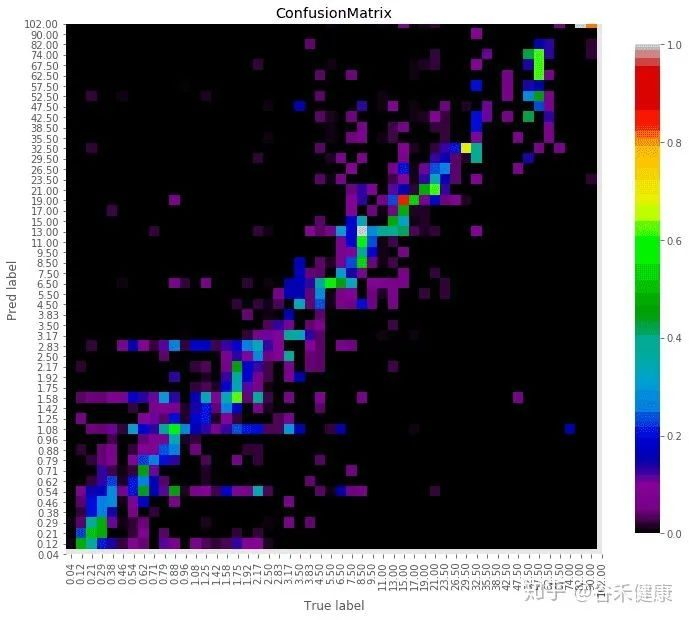
<来源:谷禾健康肠道菌群数据库>
可以看到,肠道年龄和生理年龄基本是符合的。健康人的肠道菌群年龄恰恰是最符合真实年龄的,与真实年龄差异大意味着肠道菌群出现偏离。
健康的人存在更多样化且平衡的肠道菌群。微生物群中与年龄相关的变化归因于生理,生活方式和健康状况。这些因素中的每一个都与某些菌群的相对丰度变化有关。
例如,饮食、卫生、兄弟姐妹、宠物、过敏、儿童疾病和抗生素是影响儿童微生物组的一些突出因素。到了成年期微生物群相对稳定,而到了老年期,一些有益菌开始逐渐下降,菌群又向另一个阶段过渡。
在从出生到死亡和分解的每个生命阶段,微生物群落都是身体的动态组成部分。研究微生物群的自然和诱导变化有可能彻底改变我们对人类生物学的理解。
本文介绍了健康人的微生物群在一生中的变化,讨论了从出生时菌群构成,到疾病或抗生素使用时的变化,再到死亡时的微生物扩展的各个阶段,以及这些阶段在身体部位和组成(细菌、真菌或病毒)上的差异。了解微生物群与年龄关系的未来研究方向,以此对人体微生物群及基于此的干预有更好的了解。
微生物群落存在于人体的每个粘膜表面,人的每个身体部位都有一个独特的生态学。每个人的微生物群像指纹一样,都是独特的。
在个体内,特定的身体部位、地理位置和个体的年龄与健康微生物群具有极强的关系。年龄驱动人类微生物群的α多样性和β多样性。
在了解各个阶段的微生物群变化之前,我们先了解一个概念:微生物演替。
微生物演替是指微生物群落中一种或多种生物的存在、相对丰度或绝对丰度的变化。
在正常或健康衰老期间,微生物演替的三个主要阶段自然发生在人类生活中。
✦初级演替(出生时先锋菌群定植,快速变化直到童年晚期)
第一阶段,初级演替,从先锋物种首次建立群落时开始,随后微生物群落发生快速变化。从出生到童年,变化率降低,许多中间物种存在于出生到童年晚期之间。
初级演替结束于顶级群落的形成,在青春期实现,并在很大程度上持续到成年;该群落的特征是其相对稳定。
虽然成年期的微生物群比儿童期更稳定,但仍然存在变异,这引发了关于人类微生物群中是否存在顶级群落的争论。成年微生物群的自然变异存在于小时(昼夜节律)到年(老化)的时间尺度上,但微生物群相对稳定,除非存在干扰,如饮食或药物的改变。
✦次生演替(菌群的改变,重建)
下一个阶段,即次生演替,发生在一个先前存在的稳定群落一部分被改变或移除之后,然后群落再生到相同的状态或不同的状态。这可以通过抗生素等医疗手段人为实现,也可以通过霍乱弧菌感染等疾病自发实现。
人类的次生演替的特征是至少有一段时间的随机过程占主导地位。在诱导条件下,如单疗程抗生素,群落遵循类似于初级演替的过程,其中现有微生物群落的一部分充当“微生物记忆”,帮助重建一个类似于以前存在的群落。
这一过程被认为是由核心微生物群驱动的,而不是驱动初级演替的先锋微生物。
✦末期演替(自然衰老和死亡阶段)
最终的末期演替是宿主自然衰老和死亡的一部分。在老年期间,微生物群落再次以更高的变化率,成功产生了一个由更少成员组成的群落,通常变形菌门(也称为假单胞菌)的相对丰度增加,有时占总优势。
研究演替的每个阶段使研究人员能够解决与人类相关的微生物群落是如何形成和维持的。通过了解这些过程,我们可以更好地了解微生物群随着年龄的增长的变化及其与人类健康的关系,了解如何管理微生物群。
人类相关微生物群从受孕到死亡的变化
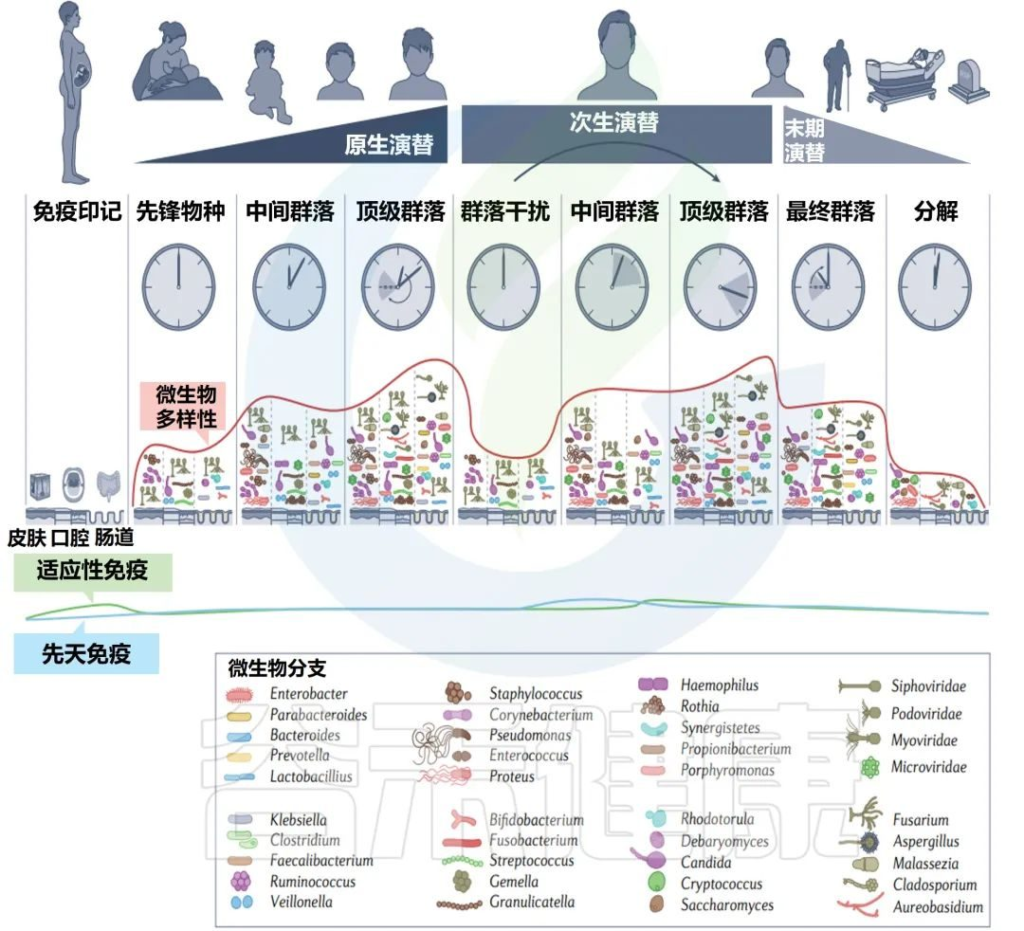
Martino C,et al.Nat Rev Microbiol.2022
常驻细菌、真菌和病毒的多样性在人类生命的各个阶段都会发生变化。模拟时钟代表每个微生物群落阶段发育的宿主年龄的相对时间。
免疫印记在出生前通过母亲的微生物群及其代谢物开始(第一栏)。先锋物种的初始定殖始于出生,身体部位特定的微生物群落出现(第二栏)。这些群落的复杂性不断增加,直到它们达到相对稳定的群落结构(第三列和第四列)。
这些微生物群落的次生演替可能来自内部和外部扰动(第五栏)。中间微生物重新建立初始群落,并再次达到稳定状态(第六列和第七列)。
在晚年,随着寄主接近自然死亡,群落经历了最后的演替和变化(第八栏)。微生物演替的最后阶段发生在腐败和分解阶段。在此阶段,多样性进一步下降,在最初的24-48小时内,许多人类微生物群结构保持不变,但随后很快开始侵蚀分解(第九栏)。
绿线和蓝线分别显示了微生物演替不同阶段的适应性免疫和先天免疫的相对强度。
不同年龄段的细菌多样性测量
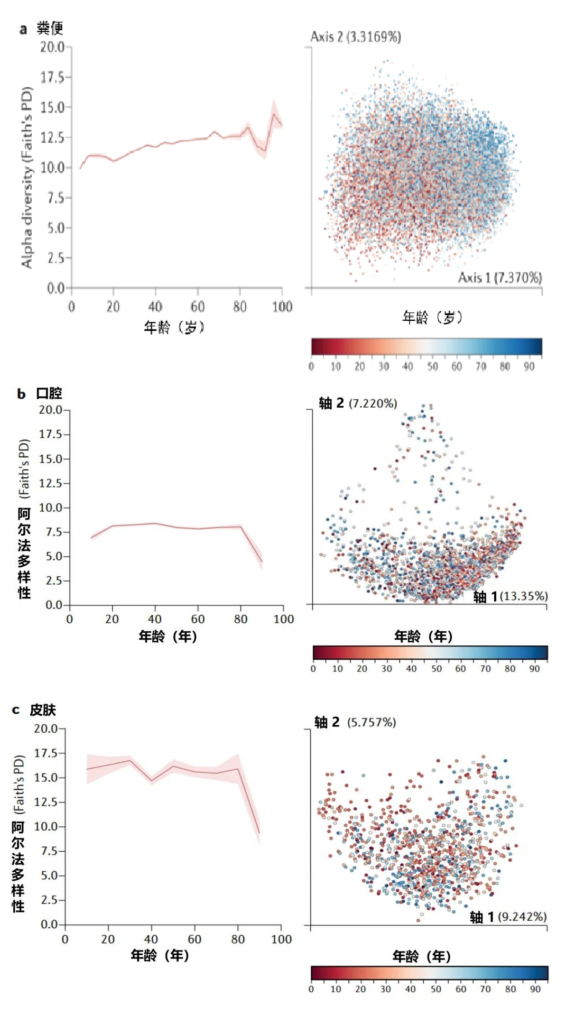
Martino C,et al.Nat Rev Microbiol.2022
美国一个肠道项目集中测量了从儿童到老年的人类粪便(a部分)、口腔(b部分)和皮肤(c部分)微生物群的细菌多样性和系统发育史,该项目包含21919个粪便、1920个口腔和998个皮肤微生物群样本,带有16S核糖体RNA基因扩增子序列。
α多样性,一种对样本中不同类型微生物数量的定量测量,通过Faith的系统发育多样性(PD)α多样性度量跨年龄测量。
UniFrac β多样性主坐标分析,一种用于比较微生物群落相似性的方法,其中空间上接近的点表示相似的样本,空间上远离的点表示不同的样本,按年龄着色。
✦胎儿时期——菌群及代谢物影响免疫发育
塑造人类微生物群的第一个因素来自胎儿发育过程中的母亲。
胎儿通过胎盘接触到母亲微生物群落产生的代谢物,这些代谢物会影响其免疫系统,并会影响正常微生物群和后期病理学的各个方面。代谢物,如短链脂肪酸(乙酸盐)和其他微生物化合物,可以通过胎盘转移到胎儿体内,并影响免疫发育。母亲的饮食和健康也会影响这些代谢物。
胎儿组织中的乙酸盐影响与成人调节性T细胞生成相关的表观遗传印记,其与防止生命后期哮喘的发展相关。
✦出生后——菌群受出生模式,饮食,环境等影响
出生后,微生物群落根据身体部位迅速分化。
在最初的时候,先锋物种和未来4年的群落发展可能会受到出生模式和妊娠时间的影响。中间群落由饮食影响,如母乳或配方奶粉的消费,以及环境。
最后,饮食和环境再次塑造了稳定的顶级群落。主要由真菌、细菌和病毒组成。
子宫内和生命早期的主要演替
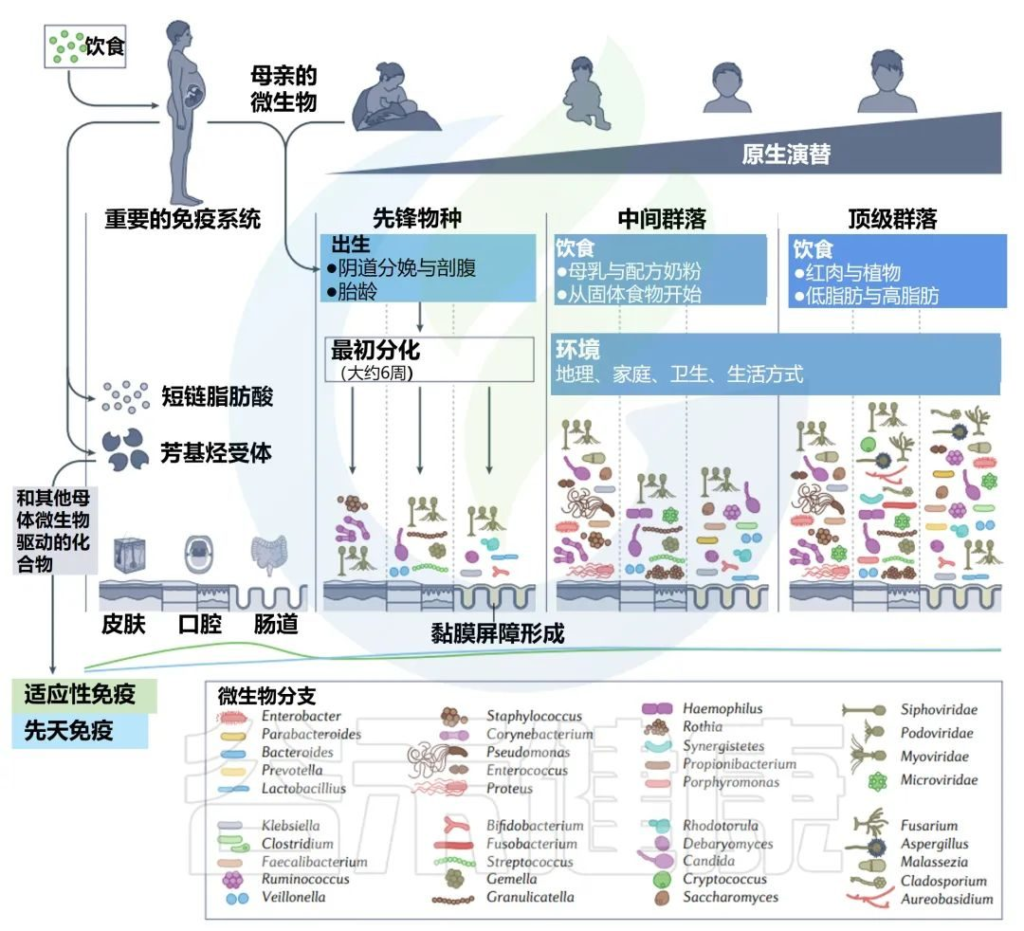
微生物代谢物和配体调节宿主芳基烃受体,这有助于塑造新生儿微生物和免疫发育。母亲使用抗生素和胃肠道相关疾病,如炎症性肠病,也被认为会通过胎儿免疫系统的印记增加后代的病理风险。
然而,这些联系仅在非人类实验中研究过。在一个案例中,由患有炎症性肠病的孕妇或其新生儿的微生物群所定殖的无菌小鼠继续发展出异常微生物群和指示炎症性肠病的免疫发育。
✦怀孕期间母体的微生物群与免疫系统的变化
在怀孕期间,母亲的微生物群和免疫系统也发生了改变。母亲的阴道微生物群变得更加多样化,通常由在其他身体部位发现的许多微生物群组成。
孕期母体免疫系统与胎儿形成协同作用,包括通过胎盘转移IgG抗体。
关于出生时获得的微生物群是否通过混合来源于阴道和粪便,或者阴道微生物群本身在出生时是否具有多能性,是否是微生物先驱的主要来源,存在一些争议。
无论确切的母体来源如何,这一阶段的特征是先锋细菌种类。包括下列菌群:
然后这些细菌定居在常规身体部位:肠道、口腔和皮肤。
许多先锋细菌是兼性厌氧菌,它们会消耗氧气,从而使专性厌氧菌能够在以后的每个环境中定居。起初,新生儿的每个身体部位都相对未分化,但先锋微生物很快开始启动身体部位依赖性微生物多样性的级联,至少在生命的第4到第6周,每个部位的细菌都可以很容易地区分。
先锋细菌进驻后,生命早期的微生物群逐渐开始形成。接下来的章节我们来了解生命早期的肠道,口腔,皮肤等各部位的微生物群(包括细菌、真菌、病毒等)。
✦肠道细菌群——双歧杆菌主导
人类肠道细菌群落的发展已经得到了很好的研究。
双歧杆菌属一直占主导地位,直到在生命的第一年结束时,它们被双歧杆菌、梭状芽孢杆菌和拟杆菌属的组合所取代。拟杆菌属的丰度增加,而双歧杆菌属等物种的丰度相对减少。
双歧杆菌分解母乳低聚糖,开始终生影响免疫系统
最近,一项研究发现,双歧杆菌等细菌含有母乳低聚糖分解代谢所需的基因,与婴儿免疫发育之间存在功能联系。特别是,接受Bifidobacterium infantis EVC001极化初始T细胞的婴儿的粪便水与来自对照组的粪便水平不同,其方式与减少肠道炎症有关。
其他菌属也可降解母乳低聚糖(如拟杆菌、阿克曼菌)
到3-6岁时,肠道细菌群落汇聚到整个成年期持续的顶级群落。这一微生物群是已知的密度最大、多样性最强的生态群落之一。通常,在这段时间内,普通健康人中只有两个细菌门占优势:厚壁菌门和拟杆菌门。
✦肠道其他微生物群——真菌、古细菌、病毒
在人类肠道发育过程中,对病毒组、真菌组和古菌组的研究远远少于细菌组。在整个生命周期中,真菌群落所占的总数远远少于细菌组或病毒组。
//真菌群落
真菌群落在生命的最初几天含有大量的Rhodotorula和Debaryomyces,接下来的一个月则是CandidaCryptococcus和Saccharomyces spp.。
到成年时,主要的真菌属是Aspergillus, Candida和Saccharomyces。
//古细菌群落
发育期间肠道的古细菌群落尚不清楚,但古细菌是一些最早的移生菌落,但丰度较低。
早期定植的古细菌包括Methanosphaera和Methanobrevibacter。
// 病毒群落:噬菌体家族在出生后就开始流行
主要由噬菌体组成的病毒群落在出生后的第一周数量众多。噬菌体家族Siphoviridae、Podoviridae和Myoviridae在出生后立即流行,主要以溶原形式整合到细菌基因组中。
到生命的第四个月,有尾噬菌体目大量生长,成员更常为裂解型(传染性噬菌体颗粒或主动复制的噬菌体)。
在成人中,Caudovirales和Microviridae在肠道噬菌体群落中占主导地位,但噬菌体肠道病毒组对个体具有高度特异性,其演替仍有许多未知之处。
与噬菌体不同,感染真核病毒的肠道病毒组主要与儿童和成人的病理相关。最近,在健康儿童和健康成人中也观察到一些感染真核细胞的病毒丰度较低,但其发生时间和流行率尚不清楚。
✦口腔细菌群:出生后几个月逐渐趋于稳定,牙齿形成后再次转变
在出生时,口腔细菌群在以下菌属中的流行率很高:
在接下来的几个月里,Lactobacillus和Fusobacterium也开始流行。Staphylococcus的丰度在出生后3个月左右达到峰值,然后稳步下降,让位与更高丰度的GemellaGranulicatella, Haemophilus和Rothia spp.
牙齿形成后,口腔微生物群再次转变,在成年期具有更高丰度的梭杆菌门, Synergistetes, Tenericutes, Saccharibacteria (TM7), SR1 。
✦口腔其他微生物:成年口腔含产甲烷菌,最常见的噬菌体群是尾状病毒
口腔真菌群落被认为比皮肤和内脏的真菌多样性少。Candida spp.是口腔的第一批真菌定植菌。对中级口腔真菌群落知之甚少,但成年人CandidaCladosporiumAureobasidium
AspergillusFusarium和Cryptococcus spp.的丰度较高。
发育过程中的口腔古菌体尚不清楚,但成年口腔中含有许多古菌产甲烷菌,包括甲烷杆菌属。
目前对人类婴儿口腔中病毒的知之甚少。在成年人中,与肠道类似,最常见的噬菌体群是尾状病毒。
口腔病毒群在本质上通常被视为病理性的(例如柯萨奇A病毒、麻疹病毒、红疹病毒和人乳头瘤病毒),并且没有对病毒群落组成进行纵向研究。然而,在无症状和健康成人中也观察到许多真核病毒分类群。
✦皮肤细菌群落:出生时母亲阴道乳杆菌属占据较多,4-5周与成人相似
皮肤细菌群落在出生时含有大量的母亲阴道乳杆菌属。到第4-5周,婴儿皮肤微生物群与成人皮肤微生物群相似,但在青春期继续变得更具位点特异性。
Staphylococcus和Corynebacterium在不同位点PseudomonasEnterobacterEnterococcus,
Proteus和Klebsiella在特定位点(如腋窝与前臂)。
✦皮肤其他微生物:马拉色菌占比较高,古细菌占4%左右
在皮肤真菌群落中,MalasseziaCandida和 Saccharomyces在生命的前30天最为普遍。对于中间群落的确切组成知之甚少,但成年真菌群落中Malassezia的丰度通常很高,估计约占真菌群落总组成的75%至90%。
关于皮肤古细菌群落的发育情况了解较少,但古细菌约占成年人菌群的4%。大体上,成年人皮肤古细菌群由Thaumarchaeota门和Euryarchaeota门代表。在成人皮肤上也发现了Halobacteriaceae和 Methanobrevibacter。
与肠道和口腔不同,健康的皮肤微生物群拥有相对较少的已知病毒多样性,很少有对其进行研究,可能是由于与低生物量样本相关的技术限制。不过,皮肤上有一些自然存在的病毒群。
以上了解关于生命早期肠道、口腔、皮肤的微生物群,那么哪些因素会给生命早期的微生物群发展带来影响?
在生命的最初几年中,有几个因素塑造并区分了微生物群落的发展。
✦出生方式和母体抗生素的使用
出生方式和母体抗生素的使用是影响人类微生物群落的研究最好、最清楚的因素之一。然而,微生物的发育可能会导致独特的结果,即使是在同居的同卵双胞胎中,这可能是由于许多未知或随机的过程。
通过剖腹产和围产期和新生儿抗生素暴露,自然微生物群落的建立过程可能会在所有身体部位受到干扰。这一发现突出了阴道微生物群落的重要性,阴道微生物群落自然含有大量Lactobacillus spp.,但在青春期发生改变,对女性健康至关重要。
一些最佳样本的婴儿发育研究,通常缩写为DIABIMMUNE ECAM和TEDDY,在婴儿出生后的前2年和3年进行了随访,重点关注抗生素使用或出生方式的影响。
在上述所有研究中,阴道分娩的婴儿的拟杆菌属相对丰度高于剖腹产婴儿。
由于缺乏建立微生物群落的天然先锋微生物群,导致可变的群落组成被认为是由随机过程而不是确定性过程驱动的,出生模式对微生物群落组成的影响直到生命的第四年仍然可见。
出生模式影响的一个例外是早产,可能是由于在出生后的头几天大量使用抗生素,其特点是无论出生模式如何,微生物发育都不稳定。婴儿微生物群自然发育的这种改变与感染、免疫疾病、肥胖和神经内分泌异常的风险增加相关。
✦母乳喂养:母乳低聚糖给菌群带来稳定性
其次,与其他因素相比,母乳喂养对微生物群的发育有很大影响。与母乳喂养相比,配方奶粉的使用导致了更高的多样性和更不确定的微生物群落。
例如,考虑到出生时肠道中双歧杆菌科的自然优势,缺乏某些母乳低聚糖作为主要营养源可能会导致初始定植的不稳定性。然而,微生物群、牛奶代谢组和免疫系统发育的多组学整合是一个活跃且快速发展的研究领域。
除了母乳低聚糖,母乳还含有其他免疫调节化合物,例如革兰氏阴性细菌的脂多糖、分泌性IgA、先天免疫因子、抗菌肽和益生元因子。
最后,所有这些因素都会影响人类免疫发育。微生物相关分子模式识别受体与微生物群衍生分子相互作用,代谢物如短链脂肪酸(与GPR43、GPR41和GPR109相互作用)和次级胆汁酸(与FXR相互作用)直接影响免疫发育。
//
这些因素加在一起,有助于形成一个独特的、相对稳定的细菌、真菌和病毒微生物群落,这种微生物群落在人类生命的大部分时间都持续存在。
前面章节了解了婴儿期初级演替期间发生的巨大变化,与之相比,成年期微生物群基本上是稳定的(15-65岁),但该群落可能会受到干扰,因此本章节从以下三方面展开讨论:
健康成年人中某些细菌的基因组随着时间的推移而进化,表明在次生演替中,功能和组成进化以稳定状态发生。
• 昼夜节律影响菌群变化
成人微生物群也会发生自然的短期变化,时间尺度为一天到数月或数年。
短期变化的一个典型例子是微生物群落组成的昼夜节律。与昼夜节律相关的人类基因表达和免疫激活,以及肠道微生物群中细菌的丰度和组成也遵循这种模式。
在小鼠中表现出昼夜循环的细菌家族包括瘤胃球菌科、毛螺菌科、Muribaculaceae和疣微菌科,但对人体的等效周期知之甚少。
青春期和成年生活中的二次演替
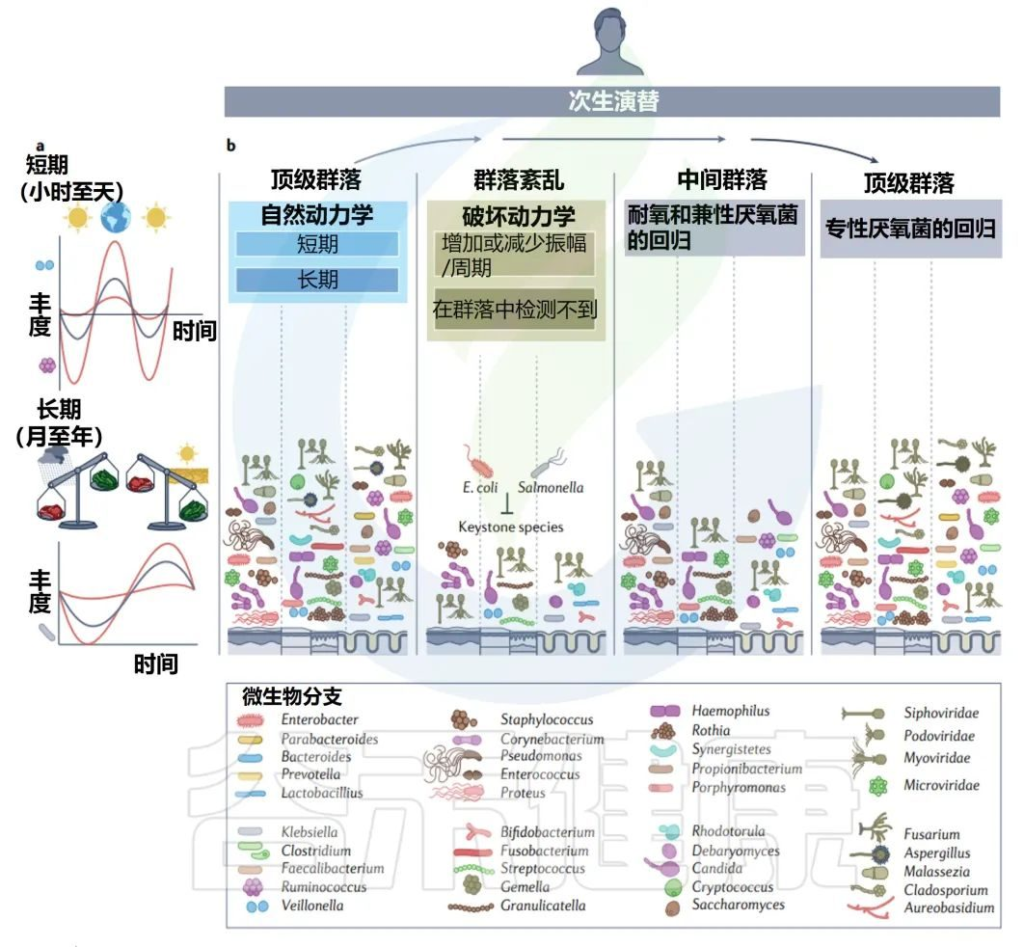
Martino C,et al.Nat Rev Microbiol.2022
• 口腔和皮肤的微生物群随清洗而变化
在口腔中,整组真菌和细菌的每日振幅与刷牙频率一致。在皮肤上,真菌和细菌每天的变化也与洗涤频率一致,并依赖于个人护理产品。
• 饮食会影响肠道微生物群
一个经过充分研究的发生在几周到几年范围内的变化的例子是饮食驱动的肠道微生物群的改变。饮食对微生物群落有很大影响,可以包括群落中的自然和可逆变化。
例如,坦桑尼亚哈扎部落在旱季食用富含肉类和块茎的饮食,但在雨季食用富含蜂蜜和浆果的饮食,在拟杆菌等属中表现出较大的季节波动。
饮食对微生物群形成的巨大影响也可能在人类健康中发挥作用,许多工作致力于了解特定的饮食成分和总体饮食模式如何影响微生物群及其对健康的影响。
肠道细菌喜欢大量的水果、蔬菜、全谷物、橄榄油等健康食物。研究表明,饮食主要由富含纤维的食物(如地中海饮食)组成的人具有更大的微生物组多样性,并且通常更健康。
此外例如,西方饮食中红肉含量高,这与全因死亡率有关。肠道微生物群可能以有害的方式将红肉中富含的左旋肉碱转化为三甲胺,而肝脏则将三甲胺转化为三甲胺氮氧化物,据推测这会促进动脉粥样硬化。
肠道微生物群也可以起到保护作用,例如,在红肉被肠道吸收之前将其分解,以防止炎症。除了饮食,还有许多其他因素有助于形成成年微生物群,包括遗传学、地理、宿主因素,如代谢病和药物。
扩展阅读:深度解析 | 炎症,肠道菌群以及抗炎饮食
• 抗生素对微生物群的影响巨大
由于微生物群的破坏而发生的次生演替已被广泛研究和审查。在破坏微生物群的众多因素中,抗生素是最强的,治疗后的恢复率往往各不相同。
抗生素治疗后肠道微生物群反弹的能力被认为取决于特定的群落成员,如拟杆菌和青春双歧杆菌。
扩展阅读:抗生素对微生物组及对人体健康的影响
细菌的天敌抗生素,如何用好这把救命的双刃剑?
疾病本身也会破坏微生物群,无论这种变化是由微生物群落内部、宿主还是多种因素共同引起的。
• 疾病破坏菌群
——肠道:炎症破坏菌群
肠道中的许多其他疾病,如炎症性肠病,破坏了微生物群落,但没有达到新的稳定群落组成,而是在没有干预的情况下继续长期不稳定。
——皮肤:炎症引起金黄色葡萄球菌大量增殖
在皮肤上,特应性皮炎的特征是免疫介导的炎症引起的金黄色葡萄球菌大量繁殖和细菌多样性减少。在金黄色葡萄球菌大量繁殖期间观察到马拉色菌属的数量减少,反之亦然,真菌数量增加导致金黄色葡萄菌数量减少,这部分可能是由于真菌产生蛋白酶的能力,蛋白酶消化金黄色葡萄球菌生物膜并降低细菌逃避免疫系统的能力。
——口腔:细菌和真菌间的竞争和协同
口腔中也存在类似的跨界相互作用;例如,真菌白色念珠菌的定殖依赖于细菌生物膜,但同时,Pseudomonas和Staphylococcus等细菌属分别形成竞争和协同关系。
这些例子强调了微生物群落的相互作用和演替是如何跨域和与宿主作用的,但由于其高阶相互作用的复杂性质,仍然没有完全理解。
干扰后微生物群落恢复的障碍导致许多研究人员探索有针对性地恢复微生物群落的干预措施的可能性。微生物群落恢复包括定向重新播种或某些物种的富集或耗竭,旨在促使微生物群落恢复到接近扰动前的水平。
这可以通过益生菌、益生元、抗生素或其他药物、从健康个体移植完整的微生物联合体或这些的组合来尝试。
尽管这些疗法在某些特征明确的环境中可以非常有效地恢复健康的微生物群落,但它们往往因缺乏与现有群落相互作用的机理知识,或因其仅短暂移植的能力而受到限制。
为了解决这些,研究集中在两个领域:
第一个领域涉及更好地了解群落是如何组合的。例如,对人类发育的研究有助于确定微生物群落在发育过程中如何聚集,以及这种聚集在生命后期的影响。
其次,正在开发新方法,通过探索微生物群落相互作用来确定机制,包括计算和实验,包括高通量共培养和微生物群落的基因组编辑。
为了解决瞬时性问题,采用了两种主要方法:
首先,微生物群疗法的短暂和个性化影响是由每个人的微生物群的个体性质决定的。因此,精准医学将群落改变的目标定位于每个人独特的微生物群,前景广阔。例如,基于微生物群落组成的个性化营养在盲法随机对照干预中有效地改善了餐后血糖。
另外,超越细菌组,探索病毒组和真菌群落及其之间的相互作用,具有巨大的前景。例如,噬菌体疗法已经用于严重的耐药细菌感染,并且对目标细菌菌株具有高度特异性。但大多数此类干预措施仍处于初步研究阶段,且规模成本高昂。
前面章节我们了解了成年微生物群的变化,以及变化后的恢复情况等,成年稳定微生物群在老年时转变为最终群落,本章节来详细了解老年微生物群。
“老年”的确切时间尺度取决于其他几个与宿主相关的因素,如疾病,但迄今为止大多数文献将“老年人”定义为65岁及以上的人。
接近寿命终点的晚期演替
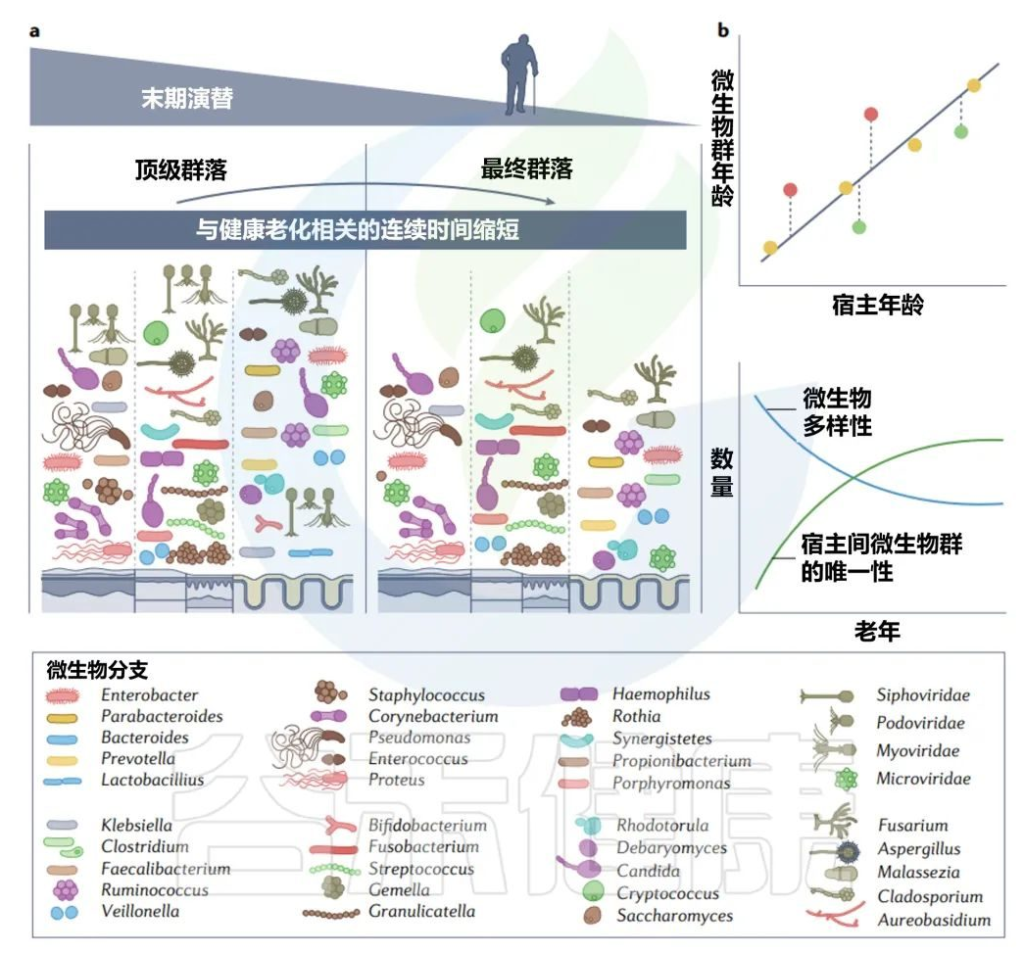
由于生物编程和生命中损伤的累积而导致的衰老影响细胞功能的各个方面,微生物群也不例外。随着年龄的增长,肠道微生物群α多样性减少,β多样性增加。
关于老年微生物群,仍有许多未知之处,而文献也有些矛盾(一项报告称65岁及以上成年人拟杆菌数量增加,与其他研究相矛盾),大多数研究都集中在肠道细菌上。
老年微生物群:年轻优势菌丰度减少
一般而言,肠道中观察到的群落演替是年轻成年人中占优势和普遍的细菌属丰度减少,如Bifidobacteria, Bacteroides, Lactobacillus, 抵御机会细菌爆发的能力降低。
• 皮肤
在65岁及以上的人群中,genera Cutibacterium和Staphylococcus的皮肤细菌数量减少,同时观察到的Corynebacterium。
• 口腔
在口腔部位,Rothia和Streptococcus spp.是核心口腔细菌群落,PorphyromonasTreponema和Faecalibacterium spp.的数量持续减少。
• 肠道
老年期肠道真菌群落的特征是Penicillium, CandidaAspergillus和Saccharomyces spp.的优势度增加。
在皮肤和口腔部位的研究很少,但老年期皮肤上的Malasseziaspp.和口腔内的Candidaspp.丰度减少。
在肠道噬菌体中,成年期的Siphoviridae占主导地位,而老年期的Microviridae和Podoviridae则占主导地位。与肠道细菌、真菌和噬菌体群体相比,真核病毒的多样性在童年后和整个余生中保持不变。
研究重点
由于个体之间的高度变异性,老年微生物演替的研究重点主要是比较健康和不健康的衰老。
目前尚不清楚微生物群是否在健康衰老中起着机械作用,还是仅仅是其他变量的一个有力指标,如饮食、运动和药物。然而,在那些长寿健康的人中,可以观察到在健康成年人中高度流行的菌群的持续保留方面的共同点。
然而,百岁老人表现出更独特的微生物群,α多样性增加,群落组成的个体间差异更大,使“健康”和“不健康”年龄之间的比较复杂化。次生胆汁酸在百岁老人中含量丰富,也可能在健康老龄化中发挥作用。尽管前景看好,但这一研究领域仍处于起步阶段。
扩展阅读:肠道菌群与健康长寿
• 微生物的演替不会随着个体的死亡而结束
宿主的死亡可以视为微生物群的生态干扰。心脏停止后,组织立即因缺氧而开始分解。细胞功能持续,直到所有剩余的氧气耗尽,二氧化碳不再能够从组织中运输为止。细胞内二氧化碳的积累创造了一个缺氧的酸性环境,导致细胞破裂。
细胞成分,例如酶会泄漏到周围环境中,在被称为“自溶”的过程中进一步促进组织分解。自溶通过消除免疫系统、松开细胞连接并为微生物群提供营养,触发了一系列负责组织分解的微生物过程。
死亡后的微生物群
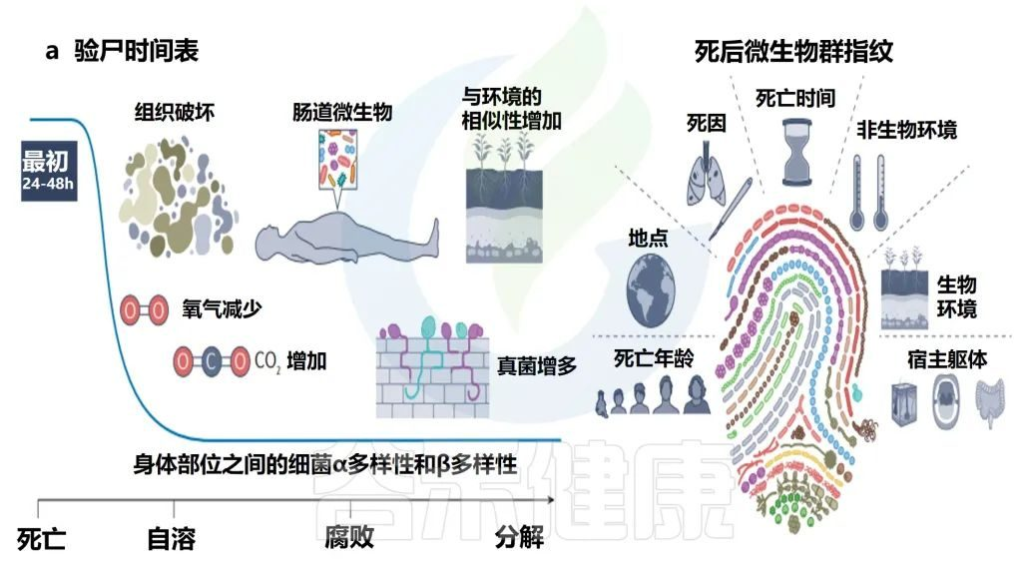
Martino C,et al.Nat Rev Microbiol.2022
• 死亡后微生物群分解
人类微生物群在死亡后的前24-48小时内相对稳定,具有不同的身体部位微生物生态、年龄的α多样性模式和可识别的个性化皮肤微生物群特征。
在分解的最初几天到几周内,腐败主要由细菌进行,但随着分解的进行,真菌的作用增加。然而,在这个过程中,对病毒组的演替和功能作用了解甚少。
随后,环境变化促进了微生物的演替,改变了人体和微生物群,不再像活着的个体(除非身体被冷冻)。
由于缺乏宿主生活中先前遇到的环境限制,使得微生物的相对丰度发生了快速变化以及在身体各部位的移动。迁移的细菌群成为从肠道转移到肠外部位的先锋物种,根据身体部位参与初级演替或次级演替。
• 死亡微生物群——生物指示器
死亡微生物群因其对法医调查的影响而引起了越来越多的关注。与多个个体和身体部位相关的一致的时间序列模式证明,死后微生物群可以作为死后间隔的生物指示器。
每个尸体的死后微生物群都是独一无二的,并且根据死亡时间、死因、环境、死亡地点和年龄以及开始时身体部位之间的差异,尸体之间的微生物群是不同的。
当微生物演替包括群落成员的快速更替时,在分解的早期阶段(即死亡后的前2-3周),死后时间间隔估计更为准确,但在分解的后期阶段(例如骨骼)仍然有用,因为几乎没有证据可以估计死后时间间期。
• 死亡原因与微生物群存在联系
还证明了与死亡原因和微生物群存在的联系。例如,在死于心脏病的个人的口腔微生物群中发现了的Rothia spp.。
此外,皮肤微生物群脱落可能通过将个人与他们接触过的物品联系起来,从而有助于追踪证据;然而,这一独特特征能够准确匹配到个体的时间取决于对象的材料和用途。
人类微生物群是动态的。考虑到这一点,设计一种能够捕捉微生物群的时间和空间变异性的采样策略非常重要,特别是当这些波动与所提出的科学问题相关时。
✦测量时间不同:多个时间点的样本采集
横断面研究从每个个体收集一个样本,而重复测量研究在多个时间点或身体部位收集样本。随着时间的推移,采样频率应该调整到研究人员试图观察的现象。
例如,小鼠昼夜节律研究通常每2-4小时收集一次粪便样本;而在炎症性肠病中,在一周内对患者进行三到五次采样可以改善疾病分类。
在其他应用中,例如研究特定治疗对个体微生物群的影响,这可能与进行“一对一”研究有关,在该研究中,同一参与者被反复检测其微生物群的结果变化;治疗前采集的样本被视为个体水平的对照。
✦测量空间不同:城市化/农村环境不同
同样重要的是要考虑到人口的微生物群高度依赖于地理和种族。
例如,在一个大型中国群体中,一种与年龄高度相关的微生物在一个美国大型群体中根本没有检测到。
另一个具体的例子涉及城市化社会的“建筑环境”;城市化人群通常较少接触环境微生物,更多地使用家用抗菌剂,与来自农村社会的人类微生物群相比,这导致了重大变化。
这些考虑因素与微生物群领域尤其相关,因为大多数公共微生物群数据来自城市化的北美和欧洲人。因此,现有数据集的结论可能无法很好地推广到全球人口。
从人类微生物群和微生物群研究中生成的测序数据的主要类别是扩增子测序数据和鸟枪测序数据。
✦扩增子测序
在扩增子测序中,对已建立的高变区的PCR产物(扩增子)进行深度测序,从而能够通过与个体“条形码”匹配来识别和测量群体成员。
这里有两种选择:要扩增的基因和该基因的哪一部分要扩增。微生物基因组的常见扩增区域包括:细菌的16S核糖体RNA基因、真核微生物的18S核糖体DNA基因和真菌的内部转录间隔区。
每个特定基因中高变区的选择取决于要捕获的特定微生物,但广泛使用的高变区包括来自地球微生物组项目的V4区。
✦肠道微生物群参与人体的调节
在鸟枪测序中,所有微生物DNA都被测序,而不仅仅是PCR产物,从而能够对微生物进行更具体的分类。由于鸟枪测序不依赖于任何标记基因,因此与扩增子测序相比,它对某些微生物的偏向性较小。
然而,鸟枪测序的成本要高得多,并且需要更大的计算能力,这使得在不需要提高鸟枪序列分辨率的情况下,扩增子测序具有吸引力。
结合其他技术进行扩增子或宏基因组测序可以丰富对微生物群和宿主的理解。定量PCR和荧光激活细胞分选等技术通过将相对丰度锚定到可靠的绝对丰度测量值,为相对丰度提供了更多的背景。
酶联免疫吸附试验和单细胞测序可以通过提供宿主细胞类型或宿主免疫信息与宏基因组测序很好地配对。
培养组学使研究人员能够通过实验验证功能或活性的基因组预测,并将微生物转化为益生菌。微生物产生的代谢物或蛋白质,即微生物群的下游效应物,可以分别通过代谢组学和蛋白质组学进行探测。
最后,宿主基因组学和转录组学越来越多地与扩增子或宏基因组学数据配对,以深入了解宿主基因表达和微生物群之间的联系。
最后,从被调查的参与者那里收集数据至关重要。一般微生物群研究的一些重要元数据类别包括人口统计、临床信息和饮食信息;然而,使用的确切元数据因研究而异。应采用产生标准化元数据的实践,以便结果可重复使用和再现。
本文描述了目前对不同年龄和不同身体部位的人类常驻微生物群落组成的研究现状。
人类健康与微生物群组成之间存在许多联系,对肠道菌群的干预可能改善健康。侧重于整个微生物群而不是单一物种的富集或消除的干预措施,需要了解这些群落是如何形成和维持的。
不同人群年龄,不同部位的微生物群需要依托于大样本数据库的构建,这为微生物群研究的准确性提供了保障。
通过研究人类整个生命周期中的微生物群,我们可以更好地了解这些微生物群复杂的相互作用,以及如何有效地将微生物群推向宿主所需的组成。此外也正应用于除人类健康外的其他领域,如法医学。随着微生物群的相关研究不断突破,将给人类生命健康和生产生活带来巨大的影响。
主要参考文献:
Martino C, Dilmore AH, Burcham ZM, Metcalf JL, Jeste D, Knight R. Microbiota succession throughout life from the cradle to the grave. Nat Rev Microbiol. 2022 Jul 29. doi: 10.1038/s41579-022-00768-z. Epub ahead of print. PMID: 35906422.
Lim, A. I. et al. Prenatal maternal infection promotes tissue-specific immunity and inflammation in offspring. Science 373, eabf3002.
Al Nabhani, Z. & Eberl, G. Imprinting of the immune system by the microbiota early in life. Mucosal Immunol. 13, 183–189.
Helve, O. et al. 2843. Maternal fecal transplantation to infants born by cesarean section: safety and feasibility. Open. Forum Infect. Dis. 6, S68.
Seppo, A. E. et al. Infant gut microbiome is enriched with Bifidobacterium longum ssp. infantis in old order mennonites with traditional farming lifestyle. Allergy 76, 3489–3503.

谷禾健康
人类肠道菌群复杂多样,在与人类长期的共同进化过程中,具备了调节人体免疫应答、影响疾病发展等作用。这种作用与肠道菌群本身的多样性和关键核心菌种的是否存在等具有紧密联系。
在前面的文章我们已经了解到,肠道菌群失调与很多疾病相关,详见:
肠道菌群失衡的症状、原因和自然改善
造成菌群失调的原因有很多,比如抗生素的使用,膳食营养不均衡,感染,重金属污染,疾病发生以及过渡清洁肠道等。
一般肠道菌群失衡可以通过一些明显的迹象表明肠道菌群失衡,如腹胀气、腹泻、便秘、间歇性或慢性腹泻、肠易激综合征、溃疡性结肠炎和克罗恩病,频繁呼吸道感染、过敏、神经问题、免疫低下或代谢异常等来判别。
说到对改善修复肠道菌群,一般是针对菌群存在异常或者偏离健康状态的特定情况才进行针对性调节,这些调节思路主要包括 “清除”,“补充”,“置换”,“塑造”。常用的手段或措施如,使用抗生素或抗菌剂,益生菌,益生元,膳食纤维,粪菌移植,饮食或天然补充物等。
以上改善措施单一或者组合对改善和调节宿主微生态平衡发挥重要作用。不过个体的菌群构成和状态差异很大,由此带来的干预对不同个体和状态的干预效果同样有很大差异,这也反映在很多菌群干预临床研究上。
所以盲目的补充益生菌,益生元等单纯的从菌量或功效来评价益生菌产品的好坏,都可能不利于有效的改善健康状况和调整微生态平衡。除了对比如益生菌菌株,益生元结构区分等进行更加精细化的功能分析外,还需要结合肠道菌群检测,基于不同肠道菌群特点进行精准化的匹配干预和临床研究。
今天我们主要简单讲下不同的一些益生菌、益生元、天然调节剂等对肠道菌群的调节以及对宿主健康的影响及其差异化。
益生菌的现代定义为“活的微生物,当给予足够的剂量时,会赋予宿主健康”。益生菌主要存在于人体肠道内,通过维持肠道微生物平衡,在宿主体内发挥有益作用。在日常生活中,常见的益生菌,如乳酸杆菌或双歧杆菌,通常作为活性菌制剂食用。
近年来,益生菌的研究取得了重大进展。例如,益生菌益生菌可以改善肠道菌群的组成缓解便秘,IBS,IBD,改善腹泻,修复多种与肠道相关的损伤等,此外,益生菌可以在慢性炎症性疾病的治疗中发挥作用,具有抗癌、抗肥胖和抗糖尿病等作用。
本章节我们列举一些常见的益生菌及其功效。
双歧杆菌
人体内双歧杆菌的数量实际上随着年龄的增长而下降。双歧杆菌在提高整体免疫力、减少和治疗胃肠道感染以及改善腹泻、便秘和湿疹等方面发挥作用。
双歧杆菌中常见的种类有:双歧双歧杆菌、长双歧杆菌、婴儿双歧杆菌、乳酸双歧杆菌、短双歧杆菌等。
双歧双歧杆菌B.bifidum是一种通常用于改善消化问题的益生菌。B.bifidum与健康饮食相结合还可以改善血糖控制、减轻压力并帮助对抗感染,有助于增强免疫系统并减少过敏。
双歧双歧杆菌是在母乳喂养婴儿中发现的第二大菌种。在成年期,双歧杆菌的水平显著下降,但保持相对稳定 (2-14%),在老年时再次开始下降。
对其他肠道菌群的影响
在一项针对 27 名健康志愿者的临床试验中,双歧杆菌的摄入量减少了普氏菌科和普氏菌属,并增加了瘤胃球菌科和Rikenellaceae。
在一项针对 53 名慢性肝病患者的临床试验中,双歧双歧杆菌是成功防止小肠细菌过度生长的益生菌之一。同样,在一项针对 66 名酒精性肝损伤患者的试验中,它与植物乳杆菌(后面会讲到)的组合恢复了肠道菌群。
在对 30 人进行的另一项试验中,双歧双歧杆菌与嗜酸乳杆菌(后面会讲到)结合也在抗生素治疗后恢复了肠道菌群。
健康益处


双歧杆菌除在以上列举的疾病发挥作用之外,还在压力、过敏等方面发挥作用(小规模研究或临床试验单一)。
安全性
B. bifidum一般都是安全的,但应避免在免疫功能低下的个体、器官衰竭和“肠漏”的人群中使用。在这些情况下,益生菌可能会导致感染。在具有自身免疫性甲状腺疾病遗传易感性的人群中,双歧杆菌可能导致其发展和恶化。
短双歧杆菌是一种有益细菌,可以在人类母乳以及婴儿和成人的胃肠道中找到。随着个体年龄的增长,其肠道内的短双歧杆菌减少。
对肠道菌群的影响
在一项对 30 名没有其他畸形、染色体异常或宫内感染的低出生体重婴儿的研究中,早期给予短双歧杆菌促进了双歧杆菌的定植和正常肠道菌群的形成。
B. breve还显著减少了 10 名极低出生体重婴儿的吸入空气量并改善了体重增加。
健康益处


短双歧杆菌除在以上列举的疾病发挥作用之外,还在肥胖、坏死性小肠结肠炎、乳糜泻、感染等疾病中发挥作用(小规模研究或临床试验单一)。
目前已有文献中,部分关于短双歧杆菌菌株的研究:
短双歧杆菌M -16V (B. breveM-16V) 显着抑制 Th2 和 Th17 淋巴细胞亚群。
同时,B. breve M-16V 可能激活 MyD88 表达并促进 Th1 相关细胞因子 IL-12 的产生。此外,B. breve M-16V 可能部分恢复肠道菌群失调。
B. breve CCFM1025 是一种很有前途的候选精神生物菌株,可减轻抑郁症和相关的胃肠道疾病。
B. breve FHNFQ23M3可以缓解腹泻症状。
母乳分离的益生菌菌株B. breve CECT7263 是一种安全有效的婴儿绞痛治疗方法。
B. breve UCC2003 在生命早期驱动肠上皮稳态发育中发挥着核心作用。
安全性
B. breve被证明是适合早产儿常规使用的益生菌。
与使用短双歧杆菌相关的不良事件发生率极低,且严重程度较轻。
长双歧杆菌是一种革兰氏阳性、杆状细菌,天然存在于人体胃肠道中。它可以改善人体免疫反应并帮助预防肠道疾病。早期证据表明,它还可以抑制过敏、降低胆固醇和改善皮肤健康。
我们之前这篇文章有详细介绍,详见:双歧杆菌:长双歧杆菌
乳酸杆菌
鼠李糖乳杆菌是一种革兰氏阳性乳酸菌,是人类正常肠道菌群的一部分。通常都是安全的,并已广泛用于食品和保健品中。
健康益处


鼠李糖乳杆菌除在以上列举的疾病发挥作用之外,还在体重管理、肝功能、牙齿健康、免疫、怀孕与分娩等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
鼠李糖乳杆菌在健康成人中是安全的并且耐受性良好,并且似乎不会对年轻或老年受试者造成不良影响。
但是,免疫功能低下的人不应服用它,因为它可能导致菌血症。在器官衰竭、免疫功能低下状态和肠道屏障功能失调的患者中使用益生菌可能导致感染。
短乳杆菌L. brevis是一种植物来源的乳酸菌,L. brevis可以在酸菜和泡菜等发酵食品中找到。它也是人体肠道微生物群的正常组成部分。
健康益处


短乳杆菌除在以上列举的疾病发挥作用之外,还在睡眠、口腔黏膜炎等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
L. brevis被认为对人类食用是安全的。
L. brevis可以产生生物胺,如酪胺和腐胺。
对于器官衰竭、免疫功能低下和肠道屏障机制功能障碍的患者,应避免使用益生菌,因为可能会导致感染。为避免任何不利影响或意外相互作用,请在服用短乳杆菌之前咨询医生。
干酪乳杆菌是一种革兰氏阳性、非致病性乳酸菌。它存在于发酵乳制品(例如奶酪)、植物材料(例如葡萄酒、泡菜)以及人类和动物的生殖和胃肠道中。
作为一种营养补充剂,干酪乳杆菌已被证明可以改善肠道微生物平衡、关节炎、2 型糖尿病,并具有潜在的抗癌特性。
干酪乳杆菌在动物消化道中的运输过程中增强了免疫系统,可以刺激一氧化氮、细胞因子和前列腺素的产生。
干酪乳杆菌通过激活自然杀伤 (NK) 细胞、细胞毒性 T 细胞和巨噬细胞来促进小鼠化疗药物引起的免疫抑制的恢复。这些都是识别和消除肿瘤细胞和感染细胞的白细胞。
对其他肠道菌群的影响
干酪乳杆菌与普氏菌属、乳酸杆菌属、粪杆菌属、丙酸杆菌属、双歧杆菌属和一些拟杆菌科和毛螺菌属呈正相关,与梭菌属、芽孢杆菌属、沙雷氏菌属、肠球菌属、志贺氏菌属和希瓦氏菌属的存在呈负相关。
在志愿者实验中,L. casei 抑制了潜在有害的假单胞菌和不动杆菌。
含有干酪乳杆菌的发酵乳保留了肠道微生物群多样性,缓解了腹部功能障碍,在学业压力的健康医学生中,它并防止了皮质醇水平升高。
健康益处


干酪乳杆菌除在以上列举的方面发挥作用之外,还在压力、免疫力、呼吸道和胃肠道感染、病毒感染、炎症、关节炎、过敏、牙齿健康、心血管疾病、糖尿病、吸烟的并发症等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
干酪乳杆菌通常具有良好的耐受性。应避免在器官衰竭、免疫功能低下和肠道屏障功能障碍的患者中使用益生菌。为避免不良反应,请在开始任何新的益生菌补充剂之前咨询医生。
格氏乳杆菌是一种乳酸菌,具有抗菌活性、产生细菌素以及调节先天和适应性免疫系统。
健康益处


格氏乳杆菌除在以上列举的疾病发挥作用之外,还在胆固醇、免疫力、肠道健康(腹泻、溃疡、幽门螺杆菌)、过敏、疲劳、子宫内膜异位症等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
一般认为是安全的。然而,应避免在器官衰竭、免疫功能低下状态和肠道屏障功能障碍的患者中使用益生菌。为防止不良副作用,请在开始服用新的益生菌补充剂之前咨询医生。
嗜酸乳杆菌是一种革兰氏阳性乳酸菌,传统上广泛用于乳制品行业,最近还用作益生菌。
嗜酸乳杆菌因其风味和益生菌作用而被添加到商业酸奶和乳制品配方中,并且是最常选择的用于饮食的乳酸菌之一。
对其他肠道菌群的影响
接受嗜酸乳杆菌和纤维二糖的健康志愿者表现出乳酸杆菌、双歧杆菌、柯林氏菌和真杆菌的水平升高,而Dialister降低了。
酸奶中的嗜酸乳杆菌可正向改变肥胖小鼠的肠道微生物群并增加肠道双歧杆菌。
嗜酸乳杆菌增加了大鼠中乳酸杆菌和双歧杆菌的数量,增加了乙酸、丁酸和丙酸的水平,并降低了人体微生物群模拟器中的铵盐。


嗜酸乳杆菌除在以上列举的疾病发挥作用之外,还在改善儿童叶酸和 B12 状态、糖尿病、轻微肝性脑病、老化、疲劳等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
嗜酸乳杆菌通常耐受性良好。然而,应避免在器官衰竭、免疫功能低下状态和肠道屏障功能障碍的患者中使用益生菌,因为它可能导致感染。
肠道微生物植物乳杆菌是一种很有前途的,用于治疗腹泻、高胆固醇和特应性皮炎的益生菌。植物乳杆菌是一种广泛分布的乳酸菌。它常见于许多发酵的植物产品中,例如酸菜、泡菜、卤橄榄和韩国泡菜。
植物乳杆菌是一种具有抗癌、抗炎、抗肥胖和抗糖尿病特性的抗氧化剂。植物乳杆菌可以减少促炎细胞因子(IL-6、IL-8和MCP-1)的产生,增加抗炎细胞因子 ( IL-10 ) 的产生,降低 ALT 和 AST,减少NF-κB.
营养益处
从生牛奶中分离出的植物乳杆菌能够产生 B 族维生素核黄素(B2) 和叶酸(B9)。
植物乳杆菌可使健康女性从果汁饮料中吸收的铁增加约 50%。
植物乳杆菌可以将女性从燕麦基质中的铁吸收提高 100% 以上。
含有植物乳杆菌的发酵乳表现出更高的钙保留摄取。


植物乳杆菌除在以上列举的疾病发挥作用之外,还在改善肥胖、血糖、伤口愈合、牙齿健康、免疫、过敏、念珠菌病等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
在大鼠中未观察到任何类型的不良反应,即使在大量食用后也是如此。然而,与其他益生菌一样,用于器官衰竭、免疫功能低下状态和功能失调的肠道屏障机制的患者可能会导致感染。为了避免不良事件,请在使用益生菌之前咨询医生。
菊粉(不要与胰岛素混淆,胰岛素是一种控制血糖水平的激素)是一种存在于多种植物中的可溶性纤维。纤维是不被人体肠道消化或吸收的化合物。可溶性纤维吸水并在消化过程中变成凝胶。
来源及用处
菊粉存在于 36,000 种植物中,包括我们日常饮食中食用的植物,如小麦、洋葱、香蕉、大蒜和芦笋。它们也存在于不太常见的食物中,例如菊芋,尤其是菊苣,菊粉是商业提取菊粉的主要来源。
菊粉的其他天然来源有:菊苣根、龙舌兰、雪莲果根、新鲜香草等。不太常见的菊粉来源是蒲公英根、松果菊、牛蒡根等。
含有菊粉的植物用它来储存能量和抵御低温。当暴露于低温时,菊粉起到防冻剂的作用。
菊粉的溶解度使其能够吸收大量水分。当它膨胀时,它会形成一种凝胶,沿途聚集脂肪颗粒并将它们排出体外。
此外,它通过充当有益菌的食物,来增加肠道中有益细菌的数量。
对其他肠道菌群的影响
前面我们知道,双歧杆菌是肠道中的有益菌。菊粉基本上是双歧杆菌的食物并刺激它们的生长和活动。
多项研究表明,菊粉可刺激双歧杆菌的生长。例如:
8 名健康受试者被给予低聚果糖 15 天,并监测他们的粪便。虽然粪便中的细菌总数没有变化,但双歧杆菌成为主要类型。
在另一项研究中,10 名便秘的老年患者服用菊粉 19 天,并监测他们的大便情况。这些患者还表现出双歧杆菌数量增加,同时有害细菌减少。
此外,其他菌群似乎也受到菊粉的影响。
在一项针对 165 人的临床试验中,这种纤维还增加了厌氧菌的丰度(可以通过产生丁酸改善消化,甚至预防结肠癌),并减少嗜胆菌(与大便和便秘有关)。
不一样的研究结果
对实验室培养的细菌进行的一些研究表明,菊粉还会增加沙门氏菌等有害细菌,以及那些不会在正常人中引起疾病但可能导致免疫系统较弱的人感染的细菌,例如克雷伯氏菌和大肠杆菌。然而,其他实验室研究表明,菊粉通过增加双歧杆菌的生长来抑制艰难梭菌等有害细菌的生长。


菊粉除在以上列举的疾病发挥作用之外,还在增加钙和镁的摄取、骨骼健康、炎症性肠病、预防结肠癌的发展等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
菊粉可能对敏感个体产生某些副作用,或者如果使用的剂量太大产生不良反应。这些包括:
肠道不适,包括胀气、腹胀、胃部噪音、嗳气和痉挛、结肠肿胀、腹泻等。
此外可能会发生严重的过敏反应,但很罕见。在一些孤立的案例中,它会导致过敏反应,可能与食物过敏反应有关。
此外,对于在怀孕和哺乳期间补充菊粉的效果知之甚少。因此,孕妇应避免服用菊粉补充剂。
对于肠易激综合征 (IBS) 患者,低剂量可能会调节肠道细菌并减轻症状,但大剂量可能会产生中性甚至负面影响。
果胶是一种复杂的碳水化合物(多糖),存在于植物细胞壁中,有助于维持其结构。它是一种粘性可溶性纤维,具有形成凝胶的能力。果胶由主要在大肠(结肠)中的有益菌群发酵,产生短链脂肪酸。
由于其凝胶状稠度,果胶是一种流行的食品添加剂,作为增稠剂和纤维的重要来源,具有许多潜在的健康益处。研究表明,它可能有助于治疗高胆固醇、反酸、减肥和糖尿病。
果胶含量高的水果和食物
果胶存在于水果、蔬菜、豆类和坚果中。柑橘皮中的果胶含量最高,如橙皮、柠檬皮和葡萄柚皮(30% 至 35%)和苹果果肉(15% 至 20%)。其他主要来源包括木瓜、李子、醋栗、樱桃、杏子、胡萝卜等 。


在食品工业中用作胶凝剂(用于果酱和果冻)或用作稳定剂(用于糖果、果汁和奶饮料)的果胶主要从苹果果肉或柑橘类水果的果皮中提取。


果胶除在以上列举的疾病发挥作用之外,还在改善糖尿病、减肥、辐射损伤、便秘、呕吐、降血压、溃疡性结肠炎、铅毒性等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
对肠道菌群的影响
果胶在结肠中由不同的细菌属发酵,如双歧杆菌、乳酸杆菌、肠球菌、直肠真杆菌、普氏粪杆菌、梭菌、厌氧菌、Roseburia属,以促进其生长。
果胶的降解由不同的细菌衍生酶(如果胶酶、甲基酯酶、乙酰酯酶和裂解酶)促进,产生不同的POS,其取决于微生物群组成和果胶结构。
体外发酵系统报告的果胶效应


Blanco-Pérez F, et al., Curr Allergy Asthma Rep. 2021
果胶通过增加拟杆菌的丰度来改变肠道菌群的组成,并改善酒精诱导的肝损伤(在非酒精性脂肪肝中,拟杆菌的丰度降低)。
膳食纤维果胶可以改变肠道和肺微生物群中厚壁菌门与拟杆菌门的比例,增加粪便和血清中短链脂肪酸的浓度。
通过果胶产生的短链脂肪酸进行免疫调节
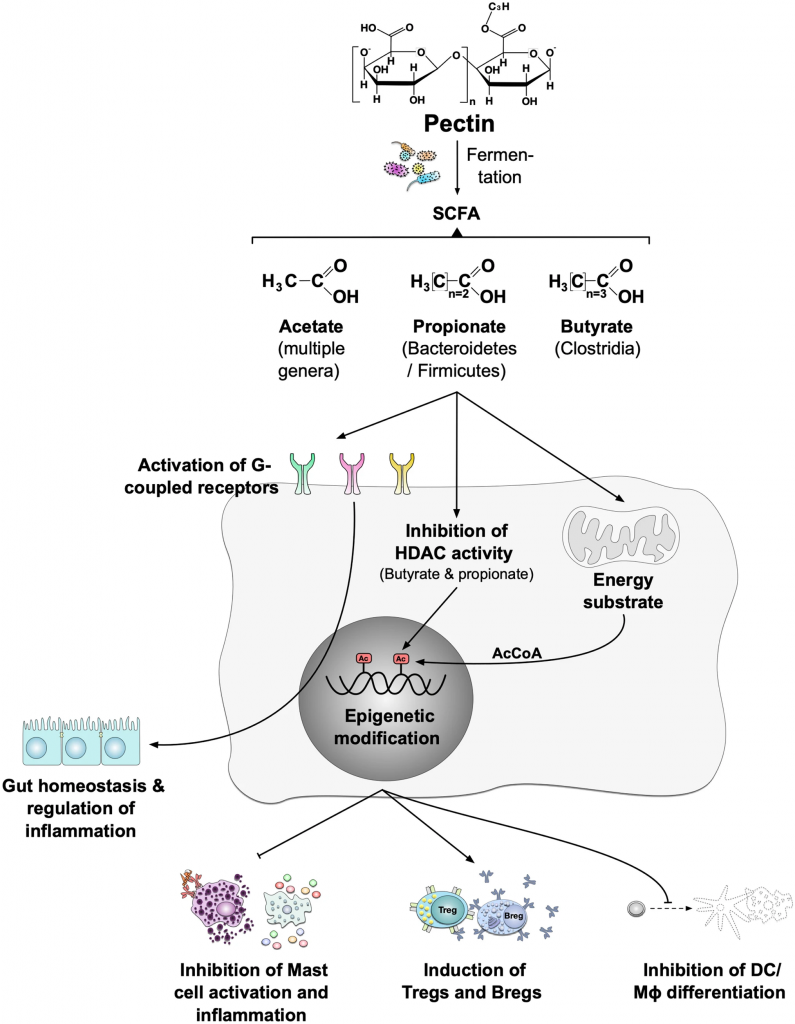

Blanco-Pérez F, et al., Curr Allergy Asthma Rep. 2021
果胶经肠道菌群发酵可产生短链脂肪酸。不同的属可以产生不同的短链脂肪酸。例如,乙酸盐可以由许多不同的属生产;丙酸主要由拟杆菌门和厚壁菌门产生,丁酸主要由梭状芽胞杆菌产生。短链脂肪酸结合“代谢感知”G蛋白偶联受体,如GPR41、GPR43、GPR109A和嗅觉受体(Olfr)-78。这些受体促进肠道内稳态和炎症反应的调节。GPRs及其代谢产物影响Treg活化、上皮完整性、肠道稳态、DC生物学和IgA抗体反应。通过抑制HDAC的表达或功能,短链脂肪酸还影响许多细胞和组织中的基因转录。
过敏:果胶在过敏反应中的作用存在争议
一些临床报告表明,食用果胶后出现过敏反应,这可能归因于果胶和过敏原之间的交叉反应。此外,果胶还被描述为防止胃中过敏原的消化,促进完整的过敏原分子到达肠道并诱发过敏反应。
然而,其他人则认为果胶有直接和间接免疫调节作用。已经提供了一系列广泛的证据,描述了应用果胶诱导有益微生物群的转变和SCFA水平的增加,这两者都与减少体内外的炎症和过敏反应有关。由于不同的果胶增加或减少了与人类健康相关的细菌数量,因此,施用果胶可能会对肠道中的菌群进行特异性调节。
果胶能够通过与TLR2的静电相互作用直接与免疫细胞(如DC和巨噬细胞)相互作用,从而抑制促炎症TLR2-TLR1途径,同时不影响TLR2-TLR6耐受途径。
此外,它能够结合LPS,影响其与TLR4的结合。其他类型的细胞,如T细胞、B细胞和NK细胞也被果胶激活,而腹腔巨噬细胞中的iNOS和COX-2表达则被IKK活性、MAPK磷酸化和NF-κB激活抑制,表明其具有抗炎特性。
炎症性肠病:果胶调节IBD相关菌群
在短链脂肪酸中,丁酸能滋养结肠细胞并抑制结肠肿瘤,因此在大肠中表现出促进局部健康的特性。
产丁酸菌(主要属于厚壁菌门)的流失被认为是IBD期间微生物失调的一个特征。果胶可以促进厚壁菌门中许多丁酸生产者的生长。
果胶物质在调节 IBD 相关肠道微生物群中的综合概况
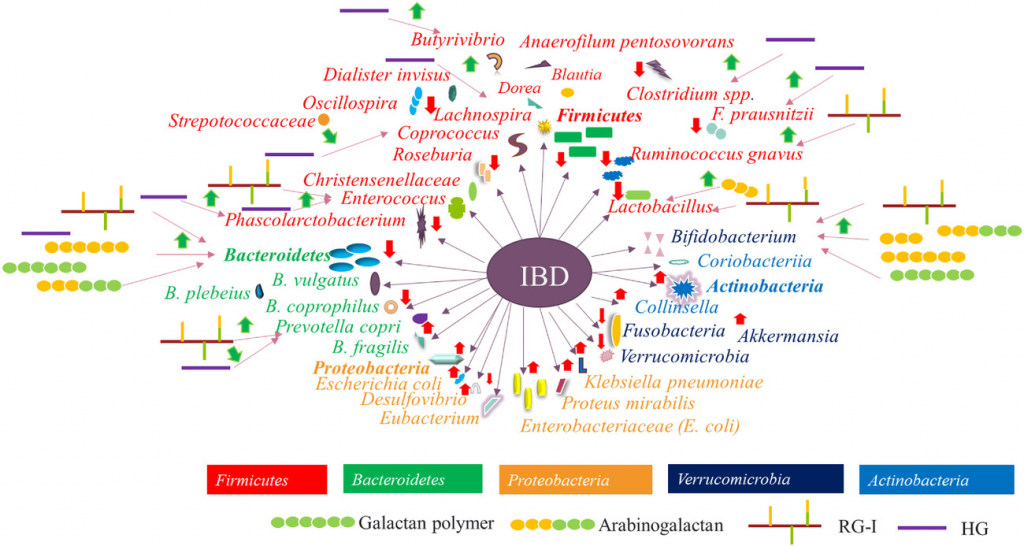

Wu D, et al., Compr Rev Food Sci Food Saf. 2021
注:不同颜色表示不同的细菌门。绿色箭头表示果胶物质对细菌的调节作用,红色箭头表示 IBD 与特定微生物群之间的正相关或负相关。
注意事项
果胶通常对人类食用是安全的。然而,在临床试验中,纤维与果胶的混合物(每天 20 克,持续 15 周)会引起一些与肠道相关的副作用,例如腹泻、肠胃胀气和稀便。
与药物相互作用:
在 3 名高胆固醇患者中,每天服用 15 克果胶和 80 毫克降胆固醇药物(洛伐他汀)会增加 LDL 水平。
建议把果胶和地高辛分开至少 2 小时。
在一项对 7 名健康受试者进行的研究中,他们服用 12 克柑橘果胶和 25 毫克 β-胡萝卜素,果胶将 β-胡萝卜素(维生素 A的前体)血液水平降低了 50% 以上。
姜黄是一种来自植物的香料,通常用于调味或着色咖喱粉、芥末和其他食物。姜黄根也用于制造替代药物。
姜黄已被用于替代医学中,作为降低血液胆固醇、减轻骨关节炎疼痛或缓解慢性肾病引起的瘙痒的一种可能有效的帮助。
姜黄含有几种被称为类姜黄素的主要成分,姜黄素是姜黄中最活跃的植物化学物质。它占类姜黄素的 77%.
姜黄素的健康益处
姜黄素和整个姜黄根茎在治疗慢性疾病如胃肠道、心血管和神经系统疾病、糖尿病和几种癌症方面具有一些有益作用。


姜黄素除在以上列举的疾病发挥作用之外,还在关节痛和关节炎、克罗恩病(肠蠕动、腹泻和胃痛)、狼疮、糖尿病、经前综合症等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。

姜黄素目前已被认为可以治疗许多疾病,肠道微生物群在姜黄素生物活性机制中可能产生的作用,是一个有趣且有吸引力的研究领域。下面我们来看它们之间有怎样的互作关系。
姜黄素与肠道菌群的相互作用
★ 姜黄素直接调节肠道菌群
食用姜黄素与梭状芽孢杆菌、拟杆菌属物种的增加以及Blautia、Ruminococcus的减少有关。
研究证实,口服姜黄素能够显著改变肠道微生物群落中有益细菌和有害细菌的比例,有利于有益细菌菌株的生长,如双歧杆菌、乳酸杆菌和产丁酸菌,并减少致病菌的丰度,如普雷沃氏菌科、Coriobacteries、肠杆菌、Rikenellaceae.
姜黄素治疗会物种的微生物丰度,例如发现结直肠癌患者粪便中的普雷沃氏菌多。患有结肠癌的小鼠被喂食不同的颗粒饲料,姜黄素的计算人体等效剂量为8/mg/kg/天-162 mg/kg/天。最高剂量的姜黄素给药可减少或消除结肠肿瘤负担,增加乳酸杆菌,减少Coriobacteries。
还清楚地证明,姜黄素治疗可减少几种瘤胃球菌;这是一个有趣的发现,因为瘤胃球菌种类的增加与大肠癌的发生有关。此外,在使用致突变化合物治疗的小鼠中,膳食姜黄素能够将乳酸杆菌的数量恢复到控制水平,这已被证明具有抗肿瘤功能。
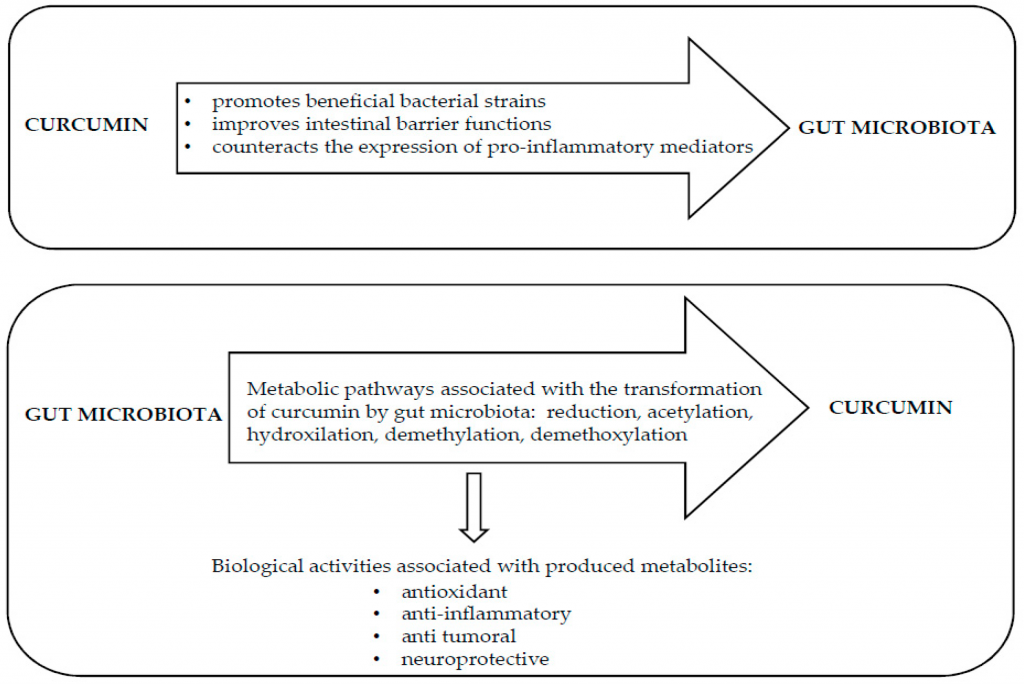

Scazzocchio B, et al., Nutrients. 2020
★ 肠道菌群对姜黄素进行生物转化,产生活性代谢物
姜黄素的代谢转化不仅发生在肠细胞和肝细胞中,还通过肠道微生物群产生的酶进行,这些酶产生许多活性代谢物。姜黄素代谢产物的生物活性可能不同于天然姜黄素,姜黄素的特定生物学特性实际上取决于肠道微生物群消化产生的生物活性代谢产物。
已经鉴定出几种能够修饰姜黄素的肠道细菌:对从人类粪便中分离的微生物的分析表明,大肠杆菌代表了姜黄素代谢活性最高的细菌,通过NADPH依赖的姜黄素/二氢姜黄素还原酶。这种酶能够将姜黄素转化为二氢姜黄素,然后转化为四氢姜黄素。
其他菌群,如长双歧杆菌、假链状双歧杆菌、粪肠球菌、嗜酸乳杆菌和干酪乳杆菌,代表了能够代谢姜黄素的相关菌株,母体化合物的还原率高于50%.
姜黄素代谢物具有与姜黄素相似的特性和效力:四氢姜黄素表现出与母体化合物相同的生理和药理特性,可能是通过β-二酮部分以及酚羟基。此外,四氢姜黄素能够预防氧化应激和神经炎症,还表现出抗癌作用,这可能是由于抑制了显着的细胞因子释放,例如 IL-6 和 TNFα。因此,在对姜黄素的进一步研究中应考虑细菌分解产物,因为它们可能具有有益作用。
对肠道屏障的影响
体外研究表明,姜黄素是一种潜在的化合物,可以恢复被破坏的肠道通透性。在 CaCo2 细胞中,姜黄素能够减轻肠上皮屏障功能的破坏,抵消 LPS 诱导的 IL-1β 分泌并防止紧密连接蛋白破坏。此外,姜黄素还能够减少由 IL-1β 诱导的 p38 MAPK 活化,以及随后紧密连接蛋白磷酸化的升高。
对肠道炎症的影响
代谢组学分析显示姜黄素对氧化应激和炎症的生物标志物具有有益作用,作者认为,姜黄素治疗抵消了非酒精性脂肪肝进展过程中一些细菌菌株的增加。
一项活体动物研究报告,新开发的纳米姜黄素通过抑制促炎介质的表达和诱导Treg扩张(同时伴随粪便丁酸水平的增加)积极改善DSS-结肠炎小鼠的炎症。将姜黄素与正常啮齿类动物饮食的粉末形式(含有0.2%(w/w)纳米姜黄素)混合:该化合物能够抑制NF-κB的激活和治疗小鼠结肠上皮细胞中促炎症介质的表达。
或者,姜黄素可以通过抑制TLR4/MyD88/NF-κB信号通路的激活来减轻LPS诱导的炎症。此外,姜黄素能抑制NF-κB核转位,并减轻其他在癌症中过度激活的促炎症基因的表达。
在喂食添加姜黄素(300 mg/kg姜黄素,与正常饲料混合)28天的断奶仔猪中,Gan等人证明,这种多酚能够通过抑制大肠杆菌增殖来减轻炎症,下调TLR4的表达。
虽然姜黄素迄今为止在体内研究中描述了所有有益的作用,但这些结果必须通过更大的人体临床试验得到一致的支持。
潜在风险和副作用
姜黄素通常耐受性良好。
常见的副作用包括便秘、消化不良(消化不良)、腹泻、腹胀、胃食管反流(胃酸反流)、恶心、呕吐和其他肠道问题。
极少的情况下,姜黄素会引起瘙痒或凹陷性水肿。
姜黄涂在皮肤上可能会引起过敏性接触性皮炎。
在高剂量体外模型中,姜黄素可引起细胞毒性和 DNA 损伤。
协同效应
添加胡椒碱(来自黑胡椒)可能会增加姜黄素在血液中的吸收。研究人员估计它可能会将姜黄素的生物利用度提高多达 2000%.
白藜芦醇是一种多酚,主要存在于葡萄皮和红酒中。
白藜芦醇是一种小多酚,在 1990 年代引起了科学界的关注。这种化合物被戏称为“瓶中的法国悖论”,因为在红酒中发现了白藜芦醇,法国人喜欢在高饱和脂肪饮食的同时食用不太适量的白藜芦醇。然而,法国人的心脏病发病率非常低。
虽然红酒中的白藜芦醇不太可能完全解释这一悖论,但一些科学家表示它可能是一个促成因素。
葡萄皮中的白藜芦醇含量很高,因为葡萄会产生白藜芦醇来防御毒素和寄生虫。它也存在于各种浆果、花生、大豆中。
有限的研究探索了它的抗氧化、抗炎、抗衰老和植物雌激素活性。白藜芦醇确实具有改善慢性疾病的一些潜力。
白藜芦醇有一个主要缺陷:生物利用度差。
白藜芦醇比其他多酚(如槲皮素)更容易从肠道吸收到血液中。但它会很快分解,在血液中留下很少的游离白藜芦醇。
与肠道菌群之间的关系
白藜芦醇和肠道菌群之间的双向相互作用:肠道菌群进行白藜芦醇生物转化,白藜芦醇对肠道菌群进行相互靶向,从而维持肠道稳态。
白藜芦醇的长期摄入改变了DSS诱导小鼠的肠道菌群,厚壁菌门/拟杆菌门的比例显著提高,这反过来又改变了白藜芦醇的代谢。
白藜芦醇补充对肠道生态系统的作用
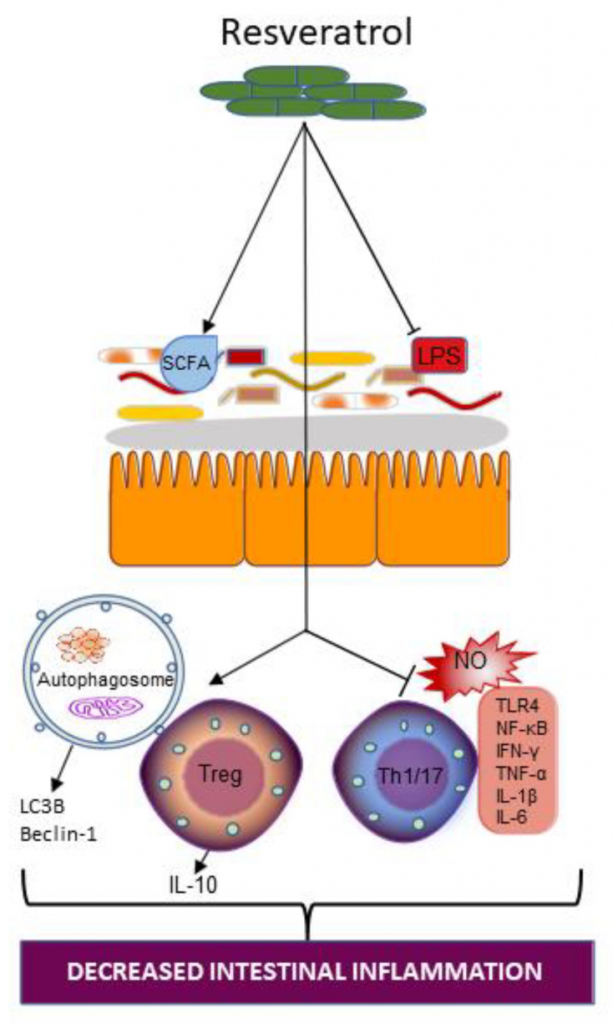

Wellington VNA, et al., Int J Mol Sci. 2021
白藜芦醇添加增加了产短链脂肪酸菌,同时减少了产生LPS的肠道细菌。
补充白藜芦醇也可以通过增加自噬小体的数量和诱导微管相关蛋白1A/1B-light chain 3和Beclin-1的表达来恢复自噬,这两种蛋白在自噬中都是重要的蛋白。白藜芦醇补充也可能会中断Th1/17和细胞因子依赖的促炎通路,一氧化氮依赖的促氧化通路,并干扰toll样受体(TLR) 4信号转导。
白藜芦醇能减轻LPS对小鼠肠道和肝脏的炎症损伤。白藜芦醇减少了拟杆菌和Alistipes的相对丰度,增加了乳酸杆菌的相对丰度。白藜芦醇治疗降低了肝脏中TNF-α、IL-6、IFN-γ、髓过氧化物酶和丙氨酸转氨酶的水平。
此外,益生菌Ligilactobacillus salivarious Li01促进白藜芦醇大量代谢为二氢藜芦醇、硫酸白藜芦醇和白藜芦醇葡萄糖苷酸。在代谢产物中,二氢藜芦醇水平升高最为显著。
肠道菌群的存在促进了二氢藜芦醇的产生,同时促进了硫酸白藜芦醇和白藜芦醇葡萄糖苷酸的消除。

补充剂量
大多数补充剂含有 50 – 500 毫克白藜芦醇。有些含有更高的剂量,高达 1,200 毫克。
临床数据仍然有限。可用的临床研究使用典型的白藜芦醇剂量:
口服纯白藜芦醇的剂量在 150 – 500 毫克/天之间变化。每天喝 1 – 2 杯葡萄酒(100 – 300 毫升)可降低患心脏病的风险并改善血管健康。不含酒精的葡萄酒可能更有益,尤其是对于已经有患心脏病风险的人。
注意:对于有自身免疫和组胺问题的人来说,葡萄酒可能不合适。某些慢病患者如果不确定每天喝一杯葡萄酒是不是安全,请咨询医生。
在接受高剂量(每天 2.5 克或 5 克)白藜芦醇 29 天的人中观察到频繁的胃肠道不适/腹泻。根据 NOAEL 研究,使用 10 倍的安全系数,对于体重 60 公斤的个体,每日 450 毫克白藜芦醇的剂量被认为是安全的。
补充形式
白藜芦醇有多种形式作为口服补充剂:
大多数研究得出结论,反式白藜芦醇是更活跃的白藜芦醇形式。
增加生物利用度的方法
一些可能增加白藜芦醇生物利用度的方法包括:
协同效应
在研究中探索了以下白藜芦醇协同作用:


与药物相互作用
白藜芦醇可能与肠道或肝脏中的药物相互作用,尤其是那些被相同肝酶 (CYP450) 分解的药物。
白藜芦醇还可以减少血液凝固,增强抗凝血药物(抗凝血剂或抗血小板药物,如阿司匹林、氯吡格雷、达肝素、肝素和华法林)的活性。
一起来看下白藜芦醇可能与之相互作用的药物:
“
他汀类药物(Mevacor)
降低高血压的药物(如硝苯地平)
用于减少心律失常的药物(胺碘酮)
抗真菌剂(Sporanox)
抗组胺药(Allegra)
镇静剂/抗焦虑药(安定等苯二氮卓类药物)
抗抑郁药(Halcion)
抗病毒药物和 HIV 药物(蛋白酶抑制剂)
降低免疫反应的药物(免疫抑制剂)
勃起功能障碍(ED)药物
抗凝血药物
NSAID 止痛药/抗炎药,如双氯芬酸 (Voltaren)、布洛芬 (Advil, Motrin)、萘普生 (Anaprox)
……
来源
你知道葡萄酒中含有多少白藜芦醇吗?
通常,白藜芦醇的总浓度为:
红葡萄酒中 0.2 – 5.8 mg/L(平均约为 2 mg/L)
白葡萄酒中仅约 0.68 mg/L
红葡萄酒的反式白藜芦醇含量是白葡萄酒的六倍;白葡萄酒含有高水平的顺式白藜芦醇。红葡萄酒是在不去除葡萄皮的情况下提取的。
白藜芦醇的其他食物来源包括:
黑巧克力、各种浆果、大豆和生或煮花生。
1 杯煮花生含有 1.28 毫克白藜芦醇,大多数食物中的白藜芦醇含量可能太低,无法指望太多特定的健康益处。
副作用
在对健康人进行的临床研究中,每天服用 500 毫克的白藜芦醇具有良好的耐受性。
给予癌症患者高剂量的高生物利用度白藜芦醇(每天 5 克)不会引起任何严重的副作用,但一些患者会出现恶心和胃部不适。
由于缺乏适当的安全数据,儿童应避免使用白藜芦醇。
有人提出,补充白藜芦醇在怀孕期间有益于平衡新陈代谢和产前健康。不过,没有充分的临床研究调查孕妇中的白藜芦醇。
注意事项
白藜芦醇可减少铁吸收和/或血液水平,这可能会恶化贫血。
白藜芦醇转向代表涉及铁代谢(肝素)的重要蛋白质的基因,这可能降低铁吸收。另一方面,白藜芦醇对铁代谢的影响可能是有益的铁过载。
“
肠道菌群的维护和有益菌等的获得以及核心菌群的定植等,与每个人自身的饮食,遗传,生活环境等息息相关,尽量保持饮食多样化,每天食物应该包括蛋白,肉,全谷物,蔬菜,水果,坚果,鱼油/亚麻籽,发酵和多酚食物,食材选择新鲜,无过渡添加/烹饪同时清洁干净的食物,此外,不滥用抗生素或过渡清洁肠道,合理睡眠,适量运动,保持乐观,将有利于肠道和菌群健康。
主要参考文献:
Kato-Kataoka A, Nishida K, Takada M, et al., Fermented Milk Containing Lactobacillus casei Strain Shirota Preserves the Diversity of the Gut Microbiota and Relieves Abdominal Dysfunction in Healthy Medical Students Exposed to Academic Stress. Appl Environ Microbiol. 2016 May 31;82(12):3649-58. doi: 10.1128/AEM.04134-15. PMID: 27208120; PMCID: PMC4959178.
Segers ME, Lebeer S. Towards a better understanding of Lactobacillus rhamnosus GG–host interactions. Microb Cell Fact. 2014;13 Suppl 1(Suppl 1):S7. doi:10.1186/1475-2859-13-S1-S7
Ren JJ, Yu Z, Yang FL, et al. Effects of Bifidobacterium Breve Feeding Strategy and Delivery Modes on Experimental Allergic Rhinitis Mice. PLoS One. 2015;10(10):e0140018. Published 2015 Oct 7. doi:10.1371/journal.pone.0140018
Diaz Ferrer J, Parra V, Bendaño T, Montes P, Solorzano P. Utilidad del suplemento de probioticos (Lactobacillus acidophilus y bulgaricus) en el tratamiento del sindrome de intestino irritable [Probiotic supplement (Lactobacillus acidophilus and bulgaricus) utility in the treatment of irritable bowel syndrome]. Rev Gastroenterol Peru. 2012 Oct-Dec;32(4):387-93. Spanish. PMID: 23307089.
Jeun J, Kim S, Cho SY, Jun HJ, Park HJ, Seo JG, Chung MJ, Lee SJ. Hypocholesterolemic effects of Lactobacillus plantarum KCTC3928 by increased bile acid excretion in C57BL/6 mice. Nutrition. 2010 Mar;26(3):321-30. doi: 10.1016/j.nut.2009.04.011. Epub 2009 Aug 19. PMID: 19695834.
Yoo JY, Kim SS. Probiotics and Prebiotics: Present Status and Future Perspectives on Metabolic Disorders. Nutrients. 2016;8(3):173. Published 2016 Mar 18. doi:10.3390/nu8030173
Tursi A, Brandimarte G, Giorgetti GM, Forti G, Modeo ME, Gigliobianco A. Low-dose balsalazide plus a high-potency probiotic preparation is more effective than balsalazide alone or mesalazine in the treatment of acute mild-to-moderate ulcerative colitis. Med Sci Monit. 2004 Nov;10(11):PI126-31. Epub 2004 Oct 26. PMID: 15507864.
van Zanten GC, Krych L, Röytiö H, Forssten S, Lahtinen SJ, Abu Al-Soud W, Sørensen S, Svensson B, Jespersen L, Jakobsen M. Synbiotic Lactobacillus acidophilus NCFM and cellobiose does not affect human gut bacterial diversity but increases abundance of lactobacilli, bifidobacteria and branched-chain fatty acids: a randomized, double-blinded cross-over trial. FEMS Microbiol Ecol. 2014 Oct;90(1):225-36. doi: 10.1111/1574-6941.12397. Epub 2014 Sep 5. PMID: 25098489.
Kadooka Y, Sato M, Ogawa A, Miyoshi M, Uenishi H, Ogawa H, Ikuyama K, Kagoshima M, Tsuchida T. Effect of Lactobacillus gasseri SBT2055 in fermented milk on abdominal adiposity in adults in a randomised controlled trial. Br J Nutr. 2013 Nov 14;110(9):1696-703. doi: 10.1017/S0007114513001037. Epub 2013 Apr 25. PMID: 23614897.
Fujii T, Ohtsuka Y, Lee T, Kudo T, Shoji H, Sato H, Nagata S, Shimizu T, Yamashiro Y. Bifidobacterium breve enhances transforming growth factor beta1 signaling by regulating Smad7 expression in preterm infants. J Pediatr Gastroenterol Nutr. 2006 Jul;43(1):83-8. doi: 10.1097/01.mpg.0000228100.04702.f8. PMID: 16819382.
Kanjan P, Hongpattarakere T. Prebiotic efficacy and mechanism of inulin combined with inulin-degrading Lactobacillus paracasei I321 in competition with Salmonella. Carbohydr Polym. 2017 Aug 1;169:236-244. doi: 10.1016/j.carbpol.2017.03.072. Epub 2017 Apr 1. PMID: 28504142.
Micka A, Siepelmeyer A, Holz A, Theis S, Schön C. Effect of consumption of chicory inulin on bowel function in healthy subjects with constipation: a randomized, double-blind, placebo-controlled trial. Int J Food Sci Nutr. 2017 Feb;68(1):82-89. doi: 10.1080/09637486.2016.1212819. Epub 2016 Aug 5. PMID: 27492975.
Blanco-Pérez F, Steigerwald H, Schülke S, Vieths S, Toda M, Scheurer S. The Dietary Fiber Pectin: Health Benefits and Potential for the Treatment of Allergies by Modulation of Gut Microbiota. Curr Allergy Asthma Rep. 2021 Sep 10;21(10):43. doi: 10.1007/s11882-021-01020-z. PMID: 34505973; PMCID: PMC8433104.
Wu D, Ye X, Linhardt RJ, Liu X, Zhu K, Yu C, Ding T, Liu D, He Q, Chen S. Dietary pectic substances enhance gut health by its polycomponent: A review. Compr Rev Food Sci Food Saf. 2021 Mar;20(2):2015-2039. doi: 10.1111/1541-4337.12723. Epub 2021 Feb 16. PMID: 33594822.
Scazzocchio B, Minghetti L, D’Archivio M. Interaction between Gut Microbiota and Curcumin: A New Key of Understanding for the Health Effects of Curcumin. Nutrients. 2020;12(9):2499. Published 2020 Aug 19. doi:10.3390/nu12092499
Ding S, Jiang H, Fang J, Liu G. Regulatory Effect of Resveratrol on Inflammation Induced by Lipopolysaccharides via Reprograming Intestinal Microbes and Ameliorating Serum Metabolism Profiles. Front Immunol. 2021 Nov 15;12:777159. doi: 10.3389/fimmu.2021.777159. PMID: 34868045; PMCID: PMC8634337.
Wellington VNA, Sundaram VL, Singh S, Sundaram U. Dietary Supplementation with Vitamin D, Fish Oil or Resveratrol Modulates the Gut Microbiome in Inflammatory Bowel Disease. Int J Mol Sci. 2021;23(1):206. Published 2021 Dec 24. doi:10.3390/ijms23010206
Yao M, Fei Y, Zhang S, et al. Gut Microbiota Composition in Relation to the Metabolism of Oral Administrated Resveratrol. Nutrients. 2022;14(5):1013. Published 2022 Feb 28. doi:10.3390/nu14051013
Del Follo-Martinez A, Banerjee N, Li X, Safe S, Mertens-Talcott S. Resveratrol and quercetin in combination have anticancer activity in colon cancer cells and repress oncogenic microRNA-27a. Nutr Cancer. 2013;65(3):494-504. doi: 10.1080/01635581.2012.725194. PMID: 23530649.
Malhotra A, Nair P, Dhawan DK. Curcumin and resveratrol synergistically stimulate p21 and regulate cox-2 by maintaining adequate zinc levels during lung carcinogenesis. Eur J Cancer Prev. 2011 Sep;20(5):411-6. doi: 10.1097/CEJ.0b013e3283481d71. PMID: 21633290.

谷禾健康

从生命早期到成年,微生物群对婴儿的健康起着至关重要的作用。生命早期的微生物群不仅是婴儿健康的关键调节剂,而且与长期健康有关。怀孕到生命早期是婴儿微生物群建立的黄金时期,受环境和遗传因素的影响。
最近,关于微生物群在人类疾病中作用的 研究呈爆炸式增长,但在疾病或健康方面的应用相对有限,因为人类微生物群的许多方面仍然存在争议,尤其是婴儿微生物群。
在怀孕期间,母体微生物群会影响胎儿的发育,尤其是大脑发育,如子宫微生物群、阴道微生物群、胃肠道微生物群、胎盘微生物群(有争议的)和口腔微生物群。值得注意的是,母体微生物群的紊乱会导致不良妊娠结局,严重威胁后代的健康。出生后,受环境和遗传因素影响的婴儿微生物群迅速建立,以确保健康成长。
孕期母体微生物群
以前,胎儿宫内感染的罪魁祸首被认为是来自阴道的微生物,如细菌、病毒和真菌。然而,随着科学技术的发展,人们发现口腔和肠道微生物群也与胎儿的健康有关,因为这些部位的微生物群可以通过血液传播。
在怀孕期间,母亲的肠道、口腔和阴道微生物群都会发生变化。这些变化相关的各种因素,包括饮食,抗生素的使用,感染,应激和宿主基因(下图)。
影响母婴微生物群的因素以及微生物群调节的机会窗口

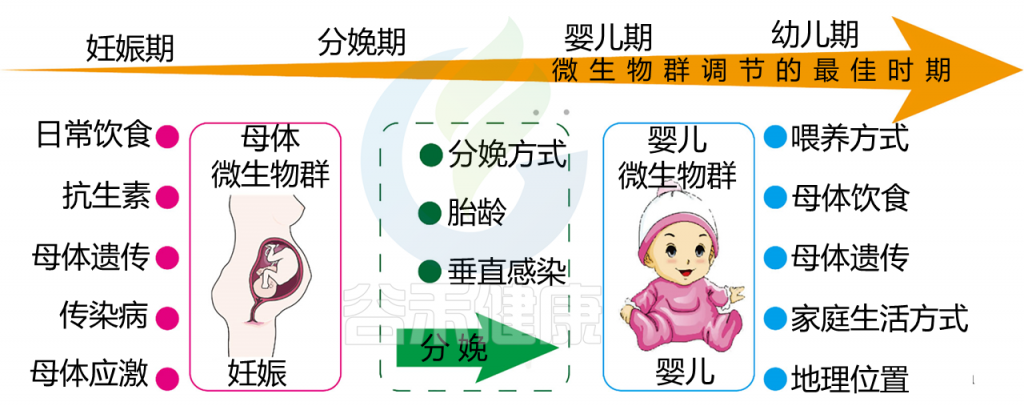
Yao Y, et al. Front Immunol. 2021
研究已经揭示健康孕妇阴道微生物群的稳定性高于健康非孕妇,乳酸菌是健康孕妇阴道微生物群的主要成分。传统上,子宫被认为是无菌的,但这个概念直到最近几年才被打破。子宫内膜有自己的微生物群,尽管这些微生物群的生物量比较低。遗憾的是,目前对子宫内膜微生物群的了解有限,其在胎儿发育和妊娠结局中的作用仍有待充分阐明。
新出现的证据表明,孕妇肠道菌群的丰富度和均一性与正常女性没有显着差异,但分布和组成发生了明显变化。此外,患有妊娠并发症的孕妇肠道微生物群的多样性降低,这对母亲和胎儿的健康都是不利的。例如,妊娠期慢性高血压大鼠的肠道微生物重塑受损。先兆子痫孕妇肠道微生物群中产生短链脂肪酸的粪球菌的丰度降低。

谷禾健康
2型糖尿病是一种血糖水平升高(高血糖)的慢性代谢疾病,主要由胰岛素抵抗和胰岛素分泌不足引起。2型糖尿病全球患病率在不断上升。
截止到2020年,根据美国糖尿病学会评估标准,糖尿病患病率已达到12.8%。其实在我国成年人中,已经有将近一半的人存在血糖异常,未来极有可能发展为2型糖尿病。如果不加干预治疗,会引发许多不良后果。
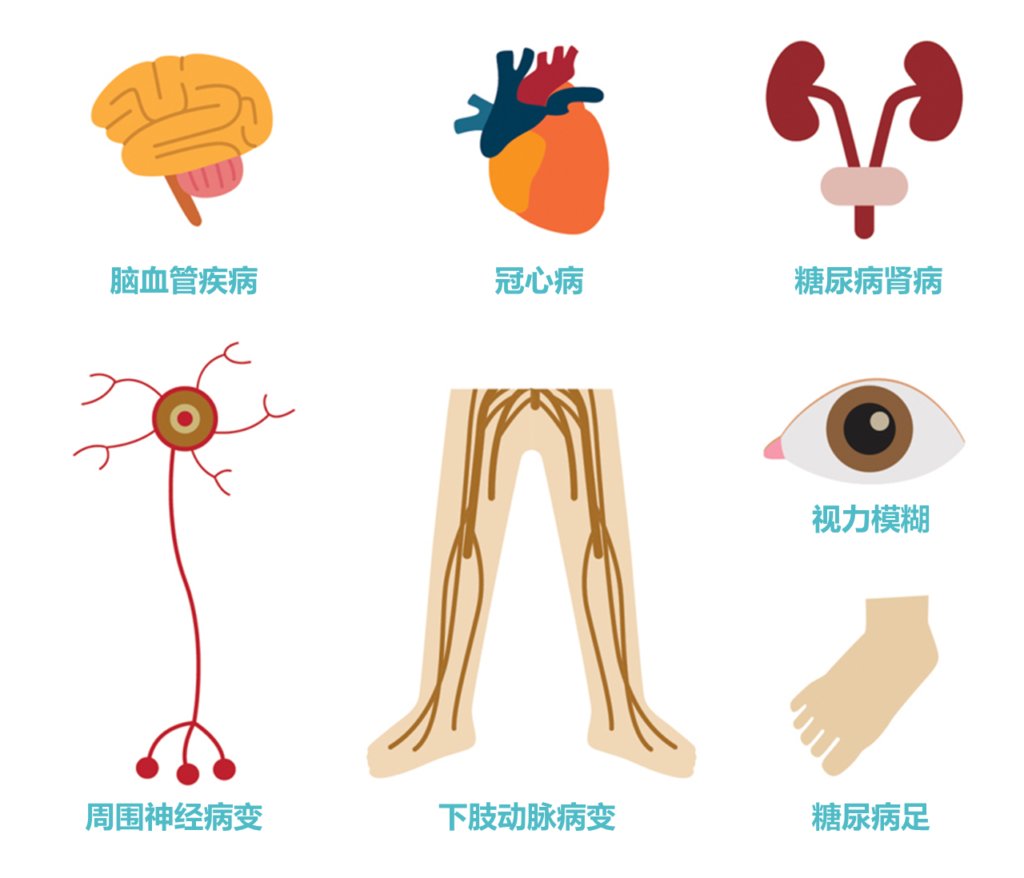
很多研究表明,肠道菌群在宿主的代谢和疾病状态中起着重要的作用。特别是2型糖尿病,其病因复杂,包括肥胖、慢性低度炎症,受肠道微生物群和微生物代谢产物的调节。
本文将从肠道菌群的角度了解其与2型糖尿病的关系;肠道菌群及其代谢物对葡萄糖代谢、免疫系统的影响;
从影响肠道菌群变化的因素来了解各种干预措施,包括药物,饮食,益生菌/益生元,粪菌移植,间接性禁食等方式。
葡萄糖主要通过食用的食物和饮料进入人体。胰腺会产生一种叫做胰岛素的激素,以帮助血液中的葡萄糖进入肌肉、脂肪和肝脏,用作能量。
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像钥匙打开锁一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
刚开始的时候,胰腺会觉得自己使不上力,于是不甘心开始拼命工作,产生更多的胰岛素来克服这种抵抗。
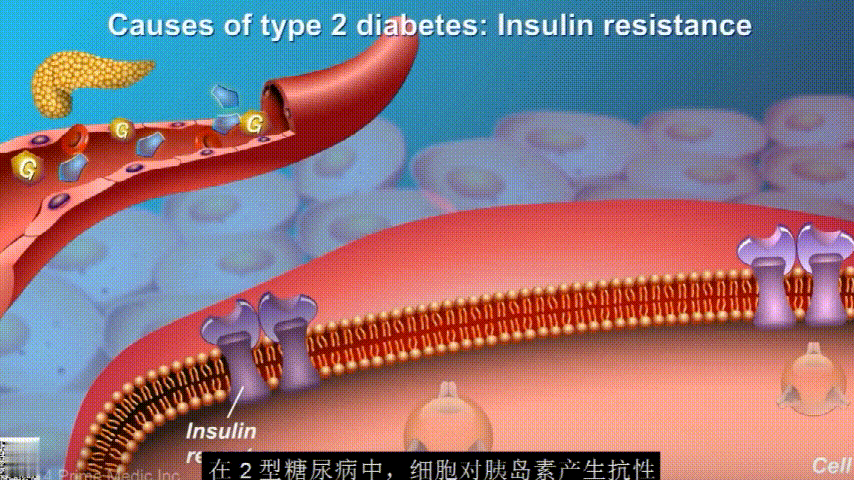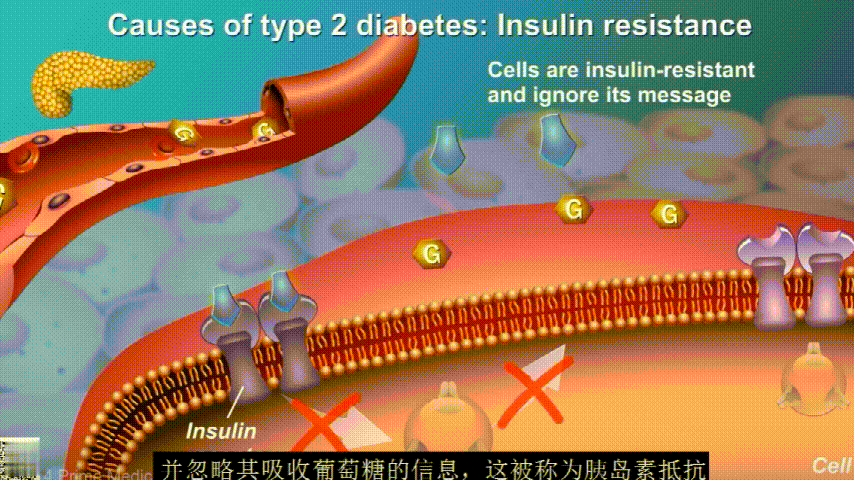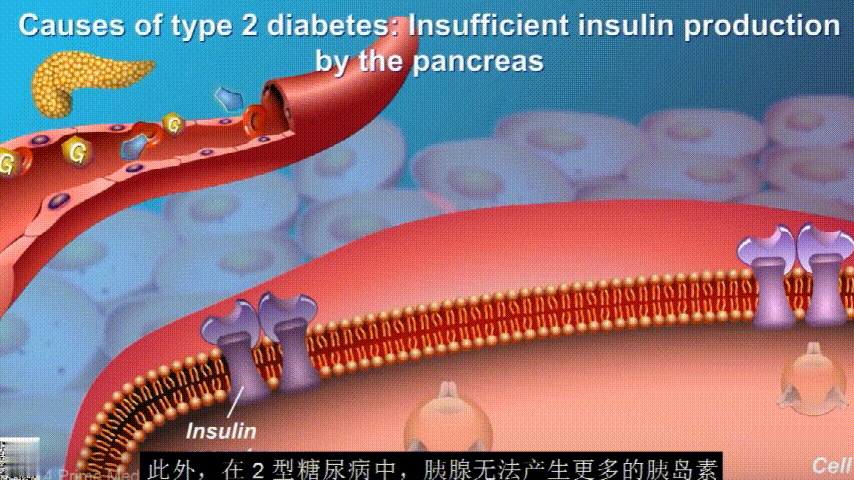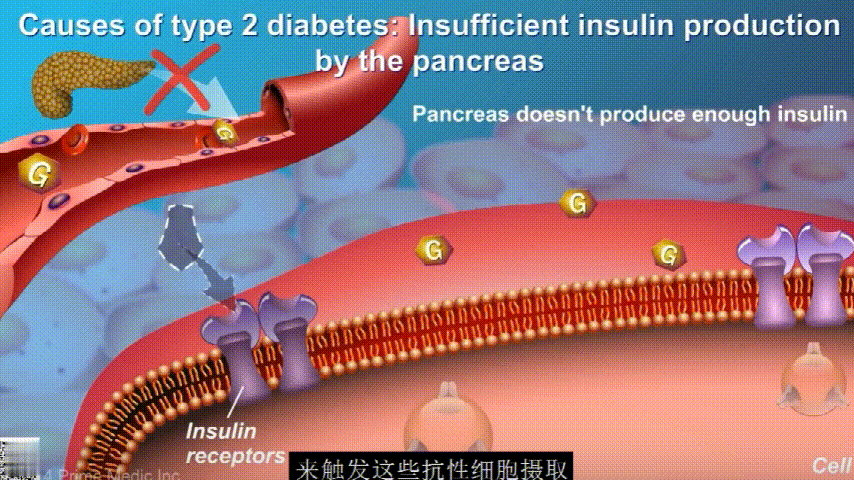
随着时间的推移,胰腺开始累了,力不从心,不能产生更多的胰岛素,这时候就是2型糖尿病开始了。
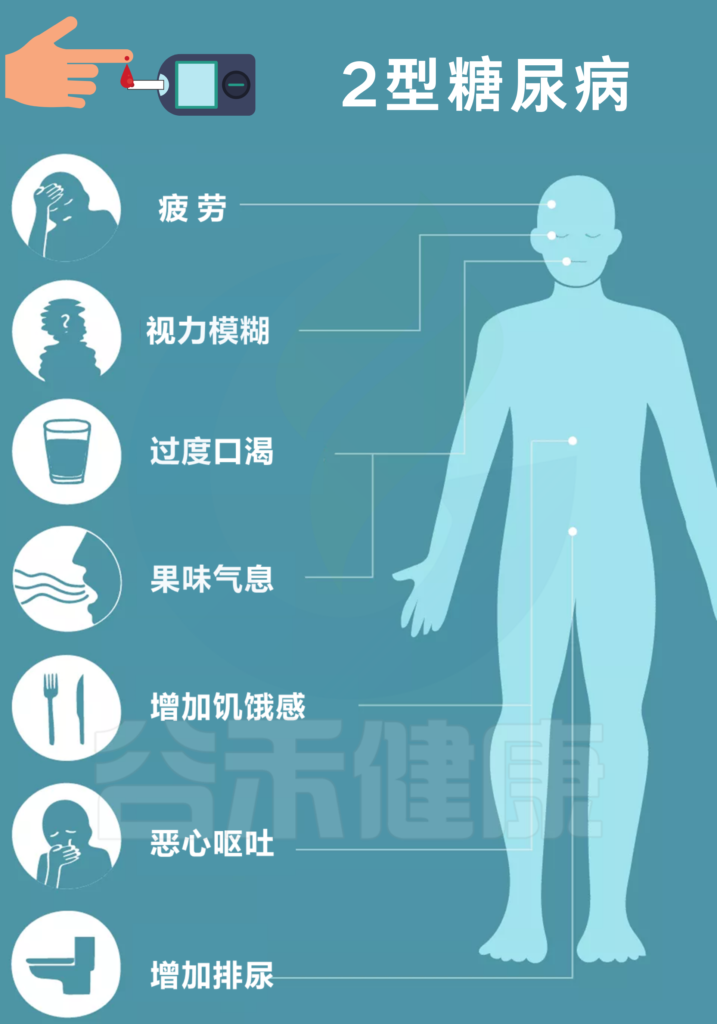
肠道微生物群可以直接或间接地影响人类健康,肠道微生物群失调可能会增加促炎疾病的患病率,如肥胖、炎症性肠病、2 型糖尿病、关节炎和癌症。
2型糖尿病人群中个体微生物群的差异

Cunningham A L et al., Gut Pathog, 2021
在2型糖尿病患者普遍具有相对高丰度的特定属:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
2型糖尿病患者中,产生丁酸菌特别缺乏,特别是梭菌目,包括:
Ruminococcus、Subdoligranulum,Eubacterium rectale、Faecali prausnitzii、Roseburia intestinalis 、
Roseburia inulinivorans
2型糖尿病患者中,其他明显较少的菌属有:
拟杆菌属、普雷沃氏菌属、双歧杆菌属

谷禾健康
你知道吗?有一种菌群可改善人体免疫反应并有助于预防肠道疾病。还具有抑制过敏,降低胆固醇并改善皮肤健康的作用。它就是——长双歧杆菌Bifidobacterium longum。
接下来带你探索它的秘密……
定义发现
双歧杆菌是从六个不同的生态位中分离出来的,其中三个与人类和动物的肠道环境直接相关。例如:人、动物的肠道(牛,兔,鼠,鸡和昆虫)和口腔,而其他的则是污水,血液和食物,也可能是胃肠道污染的结果。
双歧杆菌广泛分布在为它们的后代提供有父母进行照料的活生物体中,例如:哺乳动物,鸟类和社交昆虫。到目前为止,尚未从其他动物(如爬行动物和鱼类)中分离出双歧杆菌。因此,它们的生态分布的重要原因可能是由亲代/照护者直接将双歧杆菌细胞传给后代。
长双歧杆菌是自然存在于人类胃肠道中的革兰氏阳性棒状细菌,是最早在婴儿通过产道时在肠道内定殖的细菌之一。这些细菌也被称为益生菌。婴儿双歧杆菌Bifidobacterium infantis和猪双歧杆菌Bifidobacterium suis 是长双歧杆菌的亚种。
结构代谢
双歧杆菌是革兰氏阳性,厌氧性和分支杆状细菌。它们也是非运动的和非孢子形成的。
双歧杆菌通过磷酸酮醇酶途径产生己糖代谢。果糖-6-磷酸磷酸酮醇酶(F6PPK)是其重要组成部分。
长双歧杆菌将糖发酵成乳酸,这有助于降低肠道的pH值。“它具有修复氧化损伤的酶的同系物,例如NADH氧化酶和NADH过氧化物酶。它还含有逆转氧化损伤的蛋白质和脂质,如:硫醇过氧化物酶,烷基过氧化氢还原酶(ahp C),肽甲硫氨酸亚砜还原酶。”
长双歧杆菌基因组存在编码各种专门用于分解寡糖的蛋白质。该菌在结肠中长期存在,是因为它能代谢宿主或其他肠道菌群吸收不良的底物。
1 增强免疫力
一项针对婴儿双歧杆菌的小型研究表明,婴儿双歧杆菌可起到预防脊髓灰质炎病毒的作用。婴儿双歧杆菌改善了实验志愿者的免疫反应。
我们知道从婴儿期开始肠道健康就关系到未来生活中与健康相关的状况和疾病危险因素。研究已将肠道菌群的改变与多种疾病联系起来,包括自身免疫性疾病,如腹腔疾病和1型糖尿病,代谢综合征,过敏,哮喘和炎症性肠病等。
多种因素可以促进肠道健康。健康的肠道菌群是支持肠道健康,改善免疫功能并可能降低某些疾病风险的因素之一。
研究人员认为,双歧杆菌对早期生命疾病的保护能力是通过产生短链脂肪酸(SCFA)和乳酸,通过特定的免疫刺激和肠道环境酸化来发挥作用。
长双歧杆菌还激发了45名接受过流感疫苗的住院的年迈患者的免疫功能。与其他知名的菌株相比,婴儿双歧杆菌在老年患者的血液中具有较强的免疫调节作用。
2 降低传染病
实验表明,长双歧杆菌通过微调炎症反应和加快肺恢复来保护小鼠免受肺炎诱发的死亡。婴儿双歧杆菌可以抑制小鼠轮状病毒感染,口服长双歧杆菌可以保护小鼠免受铜绿假单胞菌引起的肠道败血症的侵害,且大大提高了伤寒沙门氏菌感染小鼠的存活率。
用长双歧杆菌喂养的婴儿显示出呼吸道感染的比率较少。在27名接受流感疫苗的老年受试者中,长双歧杆菌补充剂减少了流感和发烧率。
3 减轻和治疗胃肠道感染
益生菌通常与抗生素结合使用,以降低胃肠道感染的风险并防止有益菌的死亡。此外,一些研究表明,用含有双歧杆菌的益生菌进行治疗可以通过减少腹泻来帮助治疗类似艰难梭菌的感染。
4 改善腹泻和便秘
肠易激综合征(IBS)通常以腹痛或不适为特征,并伴有大便次数和/或稠度变化,可能导致腹泻和/或便秘。
关于IBS的临床实践指南得出结论,根据一些随机临床对照试验,长双歧杆菌可以改善IBS患者的总体症状。
婴儿长双歧杆菌可以改善腹部疼痛/不适,腹胀,排便困难。
长双歧杆菌还降低了IBS小鼠的内脏超敏性,显著降低大鼠第一疼痛行为和总疼痛行为的内脏痛阈压。
美国家庭医师学会指出,“益生菌可减少抗生素相关性腹泻的发病率,减少所有因感染性腹泻的持续时间和疼痛的严重程度和患者腹胀。” 作用的有益程度取决于所使用的类型,配方和给定的量。
5 预防湿疹
许多研究表明,使用含有双歧杆菌菌株的益生菌在妊娠和哺乳期给予母亲以及婴儿,可以预防婴儿和儿童的湿疹。但当涉及湿疹治疗时,益生菌的有益用途是多样的,所以需要更多的研究来确定其益处。当给孩子进行任何补充之前,请应该先进行肠道菌群检测或咨询医生的建议。
6 减轻过敏
在柳杉花粉过敏患者中,摄入添加长双歧杆菌的酸奶或粉末可减轻主观症状并影响过敏的血液标志物。鼻症状,如瘙痒,鼻漏,堵塞以及喉咙症状往往可以得到缓解。

实验表明,双歧杆菌菌株减轻了小鼠的过敏性气道炎症和食物过敏症状。口服长双歧杆菌可抑制IgE水平并改善IgG2a / IgG1比例。它也增加了小鼠的Th1细胞因子并降低了Th2细胞因子的产生。长双歧杆菌平衡了Th1 / Th2反应并减轻了小鼠的β-乳球蛋白过敏性炎症。
7 减少胆固醇
长双歧杆菌降低了总胆固醇,特别是在中度高胆固醇血症患者中。长双歧杆菌补充剂可明显降低高胆固醇血症大鼠的总胆固醇,肝脂质沉积和脂肪细胞大小,并积极影响肝肾功能。
给大鼠喂食富含胆固醇的食物,并补充长双歧杆菌,结果发现,甘油三酯、低密度脂蛋白胆固醇(LDL-C)、超低密度脂蛋白(VLDL)胆固醇和丙二醛显著降低。
8 减轻精神分裂症
每天服用长双歧杆菌可减轻小鼠的精神分裂症饲养行为,降低静息时的血浆皮质酮水平以及犬尿氨酸与色氨酸的比率。
9 治疗焦虑和抑郁症
长双歧杆菌可以使感染性结肠炎小鼠焦虑样行为和海马脑源性神经营养因子(BDNF)正常化。
服用婴儿双歧杆菌可逆转抑郁症。长期服用婴儿双歧杆菌可保护大鼠免于因母体分离引起的压力而导致的抑郁症状。

目前已经有研究了长双歧杆菌对细胞水平的影响。这些可能反映长双歧杆菌在人体中的作用机制。
以下列举的均有研究文献支持。
炎性条件
● 降低的Th1相关的细胞因子(T-bet的,IL-2 ,和IFN-γ)和Th17相关的细胞因子(IL-12p40的,RORγt,IL-17A,IL-21,和IL-23),并增加了调节性T细胞-相关分子(Foxp3的,IL-10 ,和TGF-β)。
● 降低IL-1α,IL-1β,IL-6,IL-18,TNF-α的表达。
● IL-27升高。
● 降低CD80,CD40,CXCL1 ,CRP,iNOS的和抗微生物肽Reg3b和Reg3g 。
传染性条件
● 增加天然杀伤(NK)细胞活性。
● 血清IgA增加和IgG2a产生减少。
● IL-2,IL-1 2和IL-18升高。
● 降低IL-6和IL-8。
● TNF-α降低。
● 既增加了和减少IL-10,并降低和增加的IFN-γ
变态反应
● 减少IgE和改进了的IgG2a / IgG1的比。
● IgA增加。
● Th1细胞因子增加而Th2细胞因子产生减少。
● 降低IL-4和IL-5。
● 增加IL-10,IL-12和TGF-β。
● 增加或降低的IFN-γ。
● 抑制了MDC和TARC。
● CD4 + CD25 + Foxp3 + Treg细胞增加。
乳糜泻
● 降低TNF-α。
● NFκB增加。
● IL-10升高。
● 减少的CD3+ T,CD4+和CD4+ / Foxp3+细胞和增加的CD8+ T。
● MIP-1β升高。
下面具体以长双歧杆菌BB536为例,对长双歧杆菌的缓解过敏感染,调节代谢,调节免疫等作用进行详细阐述。
长双歧杆菌BB536与肠道微生物群协同作用,改善胃肠健康,调节宿主免疫稳态,缓解过敏性疾病和感染状况。
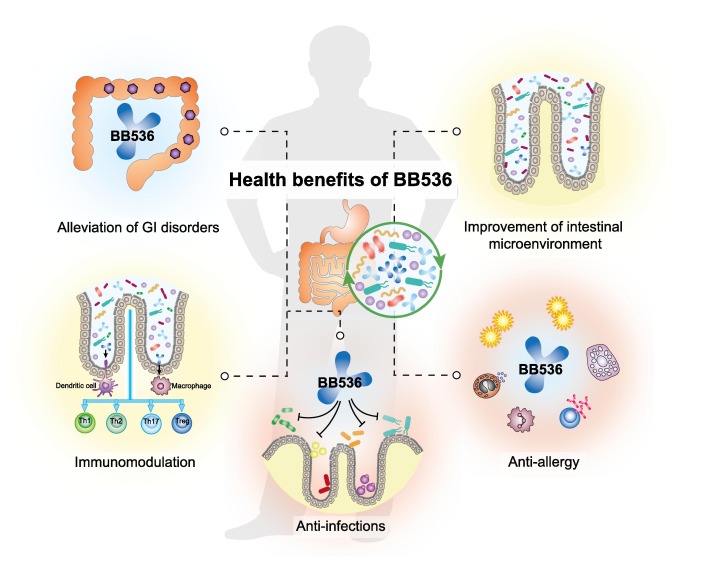
Wong C B, et al., Journal of Functional Foods, 2019
长双歧杆菌BB536通过与人体肠道微生物群串扰调节肠道代谢。
Wong C B, et al., Journal of Functional Foods, 2019
(A) BB536通过促进前体庚二酸的产生调节生物素的生物合成,并使Bacteroides caccae将其进一步代谢为生物素,从而促进宿主肠道内稳态。
(B) BB536通过交叉喂养机制影响共生丁酸生产菌(如直肠真杆菌)的代谢活性。BB536在碳水化合物发酵过程中产生的乙酸盐作为底物,维持Eu. rectale的生长,刺激丁酸盐的产生。
长双歧杆菌BB536的免疫调节作用
Wong C B, et al., Journal of Functional Foods, 2019
(A) 肠道微生物群的波动,特别是脆弱拟杆菌的过量,有助于干扰宿主免疫和发展过敏性疾病。在过敏反应中,一种过敏原被树突状细胞吸收,呈现给初始型T细胞(Th0),然后转化为辅助性T细胞2型(Th2)。Th2细胞分泌白细胞介素-4和白细胞介素-5,随后刺激记忆B细胞转换为过敏原特异性体液反应,主要由产生免疫球蛋白E(IgE)抗体。这些IgE抗体附着于肥大细胞和嗜碱性粒细胞,从而使它们对随后的暴露和过敏症状的发展敏感。
(B) BB536通过间接和直接机制调节宿主-微生物相互作用中的免疫稳态并减轻过敏性疾病。
(i) BB536通过纠正脆弱拟杆菌的流行,从而恢复Th1/Th2平衡,减轻过敏症状,促进肠道微生物群的稳定。
(ii)BB536通过其细菌成分直接影响抗原诱导的IgE介导的Th2倾斜免疫平衡。
1 剂量与特征
在使用双歧杆菌之前,请咨询医生。如果有某些慢病,可能无法使用双歧杆菌。
双歧杆菌有胶囊,片剂,散剂和咀嚼片形式。在没有医疗建议的情况下,请勿同时使用不同的配方。
以下情况需咨询是否可以安全使用该产品:
● 牛奶过敏或乳糖不耐症
● 正在服用抗生素药物期间
●孕妇或母乳喂养期间
应该如何判断益生菌的质量?
益生菌根据菌落形成单位(CFU)进行标记。这表明活细菌的密度或强度。益生菌中CFU的数量越高,就意味着它对肠道菌群中有益细菌的生长产生更大的影响。现在市面上很多产品把CFU的数量作为一种活菌标识。
有研究人员认为,关于CFU的特定剂量研究较少,可能不太重要。更重要的是找到一种经过适当加工和存储的高质量产品,这样就可以得到一种含有大量活细菌的产品。
未正确准备和存储的产品可能会导致细菌死亡,从而导致没有效果或者浪费。为了防止这种情况的发生,一些公司封装了他们的产品。
有效益生菌满足什么样的条件?
1. 它一定不能有毒或致病的。
2. 它必须保留已被证明对宿主(使用它的人)有益的特征。
3. 每单位必须包含足够数量的活微生物。
4. 它必须能够生长并在制造过程中存活,并能够通过胃和小肠运输。
5. 在存储和使用期间,它要保持活的状态。
如果需要开始补充,请尽量缓慢并逐渐增加。剂量范围很广,太高的剂量可能会引起胃部不适。
2 获取方法
每天食用富含有益菌的食物。发酵的食品和饮料,如酸菜,泡菜,开菲尔,康普茶,酸奶和人工培养的蔬菜,都是活益生菌和活性益生菌的绝佳来源。
* 开菲尔是一种发酵的乳制品,可以在酸奶和牛奶之间混合使用,可以作为早餐的不错选择。
如果想服用补充剂,请记住,益生菌菌株有很多不同的类型,每种类型的作用都略有不同。当寻找双歧杆菌时,请寻找完整的名称,包括属,种和菌株。
例如,在“Bifidobacterium adolescentis. 22L”中,“Bifidobacterium” 代表双歧杆菌属,种类是adolescentis,菌株为22L。
以正确的比例选择正确的活细菌类型非常重要。
冻干益生菌补充剂要特别小心。可以选择,但是,“它们暴露在湿气中会迅速降解,因此可能无法长期保持稳定” 。
3 如何储存
益生菌对光,热和水分敏感。优质的益生菌应保存在黑暗的玻璃瓶中,以防止细菌死亡。大多数类型的益生菌都需要冷藏。尽可能遵循厂商的说明进行最佳存储。
1 服用双歧杆菌时应避免什么?
请勿将口服粉与热液体或食物混合。
2 错过服用怎么办?
跳过错过的时间,并在常规时间使用下一个剂量。不要一下子服用两次的剂量。
3 服用过量怎么办?
咨询医生,寻求紧急医疗救护。
4 有可能出现的副作用?
如果你有过敏反应的迹象需就医:
荨麻疹; 呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
常见的副作用可能包括:胃腹胀或不适。也可能会发生其他副作用。
5 是否一定要服用?
不一定。首先确定体内是否缺少益生菌,尤其是双歧杆菌。结合长双歧杆菌的健康益处和每个人的健康状况,可以在进行肠道菌群检测后,发现双歧杆菌(尤其长双歧杆菌)缺少的情况下进行服用,或遵医嘱。这样可以更加有针对性地改善某些症状,从而达到更好的效果。
附录:双歧杆菌的历史演变
自1900年,亨利·蒂西埃从新生婴儿的粪便中发现了双歧杆菌,蒂西埃便称他为革兰氏阳性弯曲和分叉(裂开,X形或Y形)杆状细胞双歧杆菌。现如今,蒂西埃的原始分离株被称为双歧双歧杆菌。
不久之后,作为诺贝尔奖获得者,蒂西埃研究所的同事——梅契尼科夫(Elie Metchnikoff)将蒂西埃的杆菌加入了他所研究的一份关于活力和长寿理论中。虽然早期有关于发酵乳的报道已经隐含说出关于发酵乳对于健康的益处,但梅契尼科夫是率先将其作为科学依据的。
梅契尼科夫的理论,从摄入的乳酸杆菌含量对健康和长寿的影响进行分析,目前酸奶是最有益的食品,其他如酸牛奶,纯牛奶等也含有。梅契尼科夫这一言论导致了20年以来公众对酸牛奶产品的需求逐增。梅契尼科夫不仅提出并延续了该理论——即肠道微生物群不仅可以控制肠道病原体感染的结果,还可以调节自然的慢性毒血症,这在降低衰老和死亡率中起着重要作用。
虽然由于第一次世界大战的爆发以及梅契尼科夫在71岁的时候去世,导致了人们对细菌疗法的兴趣大幅度降低。但是,关于在饮食中使用乳酸菌的研究一直持续了一个世纪,并在现今依然流行着。在健康的母乳所喂养的婴儿中发现了大量的双歧杆菌以及双歧杆菌的发酵/酸化性质,以此来暗示着双歧杆菌对人类营养方面和胃肠道健康有很大的益处。
如今,随着研究逐步扩大,双歧杆菌不仅通过食用益生菌培养物对人类进行了有益效果评估,还对家畜和其他动物进行了评估。
参考文献:
Wong C B, Odamaki T, Xiao J. Beneficial effects of Bifidobacterium longum subsp. longum BB536 on human health: Modulation of gut microbiome as the principal action[J]. Journal of Functional Foods, 2019, 54: 506-519.
Smecuol E, Hwang HJ, et al., Exploratory, randomized, double-blind, placebo-controlled study on the effects of Bifidobacterium infantis natren life start strain super strain in active celiac disease. J Clin Gastroenterol. 2013 Feb;47(2):139-47.
Smecuol E, Hwang HJ, et al., Exploratory, randomized, double-blind, placebo-controlled study on the effects of Bifidobacterium infantis natren life start strain super strain in active celiac disease. J Clin Gastroenterol. 2013 Feb;47(2):139-47.
Takahashi N, Kitazawa H, et al., Oral administration of an immunostimulatory DNA sequence from Bifidobacterium longum improves Th1/Th2 balance in a murine model. Biosci Biotechnol Biochem. 2006 Aug;70(8):2013-7.
Xiao JZ, Kondo S, et al., Effect of probiotic Bifidobacterium longum BB536 [corrected] in relieving clinical symptoms and modulating plasma cytokine levels of Japanese cedar pollinosis during the pollen season. A randomized double-blind, placebo-controlled trial. J Investig Allergol Clin Immunol. 2006;16(2):86-93.
Desbonnet L, Garrett L, et al., Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience. 2010 Nov 10;170(4):1179-88.
Takahashi N, Kitazawa H, et al., An immunostimulatory DNA sequence from a probiotic strain of Bifidobacterium longum inhibits IgE production in vitro. FEMS Immunol Med Microbiol. 2006 Apr;46(3):461-9.
Namba K, Hatano M, et al., Effects of Bifidobacterium longum BB536 administration on influenza infection, influenza vaccine antibody titer, and cell-mediated immunity in the elderly. Biosci Biotechnol Biochem. 2010;74(5):939-45.
Jonathan Ritter, Puya Yazdi, Scientific Health Benefits of Bifidobacterium longum, 2020
Silva AM, Barbosa FH, et al., Effect of Bifidobacterium longum ingestion on experimental salmonellosis in mice. J Appl Microbiol. 2004;97(1):29-37.
Akatsu H, Iwabuchi N,et al.,Clinical effects of probiotic Bifidobacterium longum BB536 on immune function and intestinal microbiota in elderly patients receiving enteral tube feeding. JPEN J Parenter Enteral Nutr. 2013 Sep;37(5):631-40.