 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
拥有健康的肠道菌群可以带来许多健康益处,包括减肥,改善消化,增强免疫功能,皮肤健康以及降低许多疾病的风险[1,2]。益生菌是有益的细菌,食用后会带来健康益处。目前,益生菌通常被当作补充剂服用,用于促进健康的微生物和改善肠道健康。
本文我们主要针对益生菌及其功能做一个详细的介绍。
益生菌是一种活的微生物(酵母或细菌),它有助于我们的健康[3]。当摄入适量的微生物时可提供健康益处。
益生菌哪儿来?
益生菌可以从补充剂以及细菌发酵制备的食物中获取。益生菌食品包括酸奶,开菲尔,酸菜,豆和泡菜。注意不要将益生菌与益生元混淆,益生元是膳食纤维,有助于喂养肠道内已经存在的有益菌[4]。


数十种不同的益生菌有利于健康。最常见的菌包括乳酸杆菌和双歧杆菌。分别包括不同的种,并且每个物种具有许多菌株。
有趣的是,不同的益生菌可以应对不同的健康状况。因此,正确选择一种或多种益生菌至关重要。
一些益生菌产品(称为广谱益生菌或多益生菌)在同一产品中结合了不同的物种。尽管有科学证据,但仍需要对益生菌的健康益处进行更多的研究[5]。
肠道中复杂的微生物群落称为肠道菌群或微生物群[6]。据估算,你的肠道含有数百种不同类型的微生物多达1000多种,其中包括细菌,真菌和病毒,细菌占绝大多数。

大部分肠道菌群都存在于结肠或大肠中,这是消化道的最后一部分。肠道菌群的代谢活动类似于器官的代谢活动。因此,一些科学家将肠道菌群称为“被遗忘的器官”[7]。
肠道菌群有许多重要的功能。例如生成维生素,包括维生素K和某些B族维生素[8]。
它还可以将纤维转变成短链脂肪酸,例如丁酸,丙酸和乙酸,它们可以喂饱肠壁并执行许多新陈代谢功能[9,10]。还可以刺激您的免疫系统并增强肠壁。这可以帮助防止有害物质进入您的体内并引起免疫反应[11,12,13,14]。
但是并非肠道中的所有菌都是有益的,也有部分有害菌。
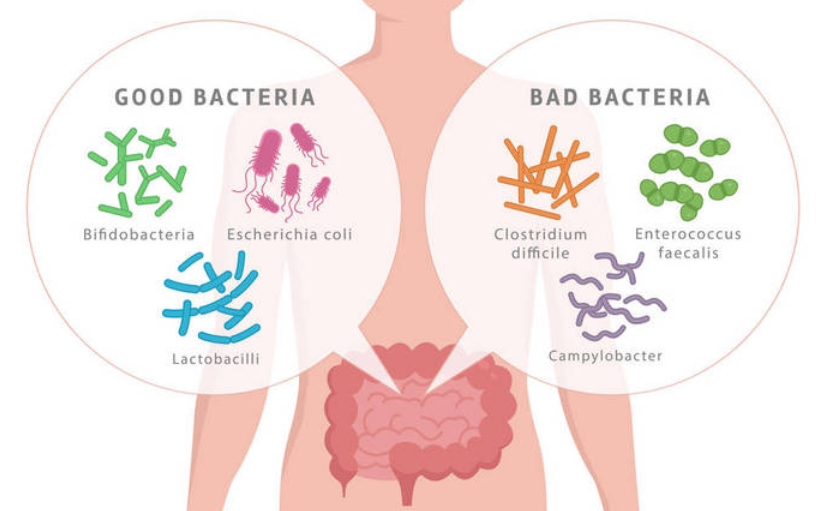

研究表明,肠道菌群失衡与多种疾病有关[15,16]。这些疾病包括肥胖,2型糖尿病,代谢综合征,心脏病,大肠癌,阿尔茨海默氏症和抑郁症等[17,18,19,20]。
益生菌和益生元纤维可以帮助调整肠道平衡,确保肠道发挥最佳功能[21]。


益生菌对消化系统的影响已有广泛的研究[22]。有许多的证据表明,益生菌补充剂可以帮助治愈与抗生素有关的腹泻[23,24,25]。
当人们服用抗生素时,尤其是长期服用抗生素,即使在根除感染后很长时间,他们也经常会腹泻。这是因为抗生素杀死了肠道中的许多天然细菌,从而改变了肠道平衡,并使有害菌得以繁衍。
益生菌还可以辅助治疗肠易激综合症(IBS)(一种常见的消化系统疾病),减少气体,腹胀,便秘,腹泻和其他症状[26,27,28]。
还有一些研究指出,它能对炎症性肠病(例如克罗恩氏病和溃疡性结肠炎)的治疗带来帮助[29]。
此外,益生菌可以帮助治疗幽门螺杆菌感染,幽门螺旋杆菌感染会导致溃疡和胃癌[30,31,32,33]。
如果你现在有难以治愈的消化系统问题,则可以考虑使用益生菌补充剂,当然也应该考虑咨询医生。
益生菌可以帮你减少从食物中吸收热量。它们还会影响与食欲和脂肪储存有关的激素和蛋白质。它们也可以减轻炎症,而炎症可以促使肥胖 [34]。
某些益生菌可能会抑制人体从饮食中吸收脂肪,增加粪便排出的脂肪量[35]。换句话说,它们让你从饮食中获取更少的卡路里。


已发现某些细菌(例如来自乳杆菌家族的细菌)以这种方式起作用[35,36]。
益生菌还可以通过其他方式抵抗肥胖:
• GLP-1的释放:益生菌可能有助于释放饱腹感激素GLP-1,从而减少食欲。增加这种激素的水平可能会帮助您燃烧卡路里和脂肪[37,38]。
• ANGPTL4的增加:益生菌可能会增加ANGPTL4的水平。这可能导致脂肪储存减少[39]。
还有很多证据表明,肥胖与大脑炎症有关。通过改善肠道健康,益生菌可减少全身性炎症和防止肥胖等疾病[40]。
但是,目前这些机制研究还需要深入研究,以及扩大样本量。
肥胖者与瘦人的肠道菌群不同[41]。动物研究表明,从瘦者身上取菌群,进行粪便移植到肥胖动物,可以使肥胖的动物减轻体重[42,43]。因此,许多科学家认为,肠道菌群对于维持体重很重要[44,45]。


尽管还需要更多的研究,但一些益生菌菌株似乎有助于减轻体重[46]。在一项针对210名腹部脂肪过多的中枢性肥胖患者的研究中发现,每天服用益生菌格氏乳杆菌可在12周内使腹部脂肪减少8.5%[47]。当参与者停止服用益生菌时,他们会在四个星期内恢复腹部脂肪。
证据还表明,鼠李糖乳杆菌和乳酸双歧杆菌可以帮助减肥和预防肥胖,当然这需要更多的研究[48]。
相反,也有一些研究甚至发现某些益生菌菌株可能导致体重增加,而不是体重减轻。这包括嗜酸乳杆菌[49]。一项最新研究回顾了4项对照临床研究。结论是,益生菌不能降低超重或肥胖成年人的体重,BMI或体脂水平[50]。
益生菌具有广泛的健康益处。然而,它们对体重的影响是复杂的,并且似乎取决于益生菌的类型。
便秘的特征是排便困难,不易通过且频率较低。每个人有时都会经历便秘,但在某些人中,这已成为一个长期的问题。
慢性便秘在卧床的老年人和成年人中最常见,当然也有可能在儿童中发生。此外,一些肠易激综合症(IBS)的人主要表现为持续便秘。这就是便秘型IBS。
常规治疗包括泻药和粪便软化剂。但是,近年来,饮食改变和益生菌补充剂已成为越来越受欢迎的替代方法[51]。
许多研究表明,补充某些益生菌菌株可以减少成人和儿童的便秘[52,53,54,55,56]。在一项比较IBS患儿益生菌和益生元的研究中发现,乳酸杆菌可显着缓解便秘。
与益生菌组相比,益生菌组饭后的腹部胀和腹胀少[53]。


其他可能改善便秘的益生菌包括长双歧杆菌,酿酿酒酵母(S.Boulardii)和嗜酸乳杆菌,罗伊氏乳杆菌,植物乳杆菌,鼠李糖乳杆菌和动物双歧杆菌[55,56]。
腹泻被定义为比正常情况更频繁发生的,液体散乱到大便。一般是短暂的,但在某些人中可能会变得趋于慢性。
已发现益生菌可以减少因食物中毒和肠胃炎(通常称为“胃流感”)而引起的感染型腹泻的大便频率[57]。
针对34项研究的回顾发现,益生菌可将各种原因引起的腹泻风险降低34%。有效菌株包括鼠李糖乳杆菌GG,嗜酸乳杆菌和保加利亚乳杆菌[58]。
抗生素的使用是腹泻的另一个常见原因。当抗生素疗法杀死引起感染的有害菌时,有益菌也会被一同破坏。菌群平衡的改变可能导致炎症和腹泻。对儿童和成人的研究表明,服用益生菌可以帮助减少因抗生素治疗而引起的腹泻[59,60]。

针对82项对照研究的大型回顾发现,服用益生菌补充剂可使患抗生素相关性腹泻的风险降低42%。但是,该研究没有讨论到最有效的益生菌菌株[60]。
IBS患者中部分人因便秘而挣扎,还有一部分经常腹泻,这被称为腹泻型IBS。研究表明,某些益生菌似乎对腹泻型肠易激综合征特别有效,包括益生菌B.coagulans、酿酒酵母菌以及几种乳酸杆菌和双歧杆菌菌株的组合[61,62,63]。也有一项研究表明,接受酿酒酵母S. boulardii治疗的IBS患者的腹泻没有任何明显改善[64]。(注:酿酒酵母S. Boulardii是法国科学家 Henri Boulard 于1923年从印尼荔枝中分离得到的一种益生菌,是酿酒酵母的亚种)
有时,IBS的主要症状与粪便的稠度或频率无关。取而代之的是,有些人会定期出现腹胀,恶心和下腹部疼痛。

基于19项研究的回顾发现,虽然有人报告服用益生菌后IBS症状有所改善,但总体而言结果因人而异。研究人员无法确定究竟是哪种益生菌最有效[65]。
此外,由于IBS的症状非常多样,因此有时一种症状会改善,而其他症状则不会。例如,一项针对以便秘为主的IBS患者的研究发现,尽管酿酒酵母改善了便秘,但对腹痛或不适感影响不大[66]。
在另一项研究中,腹泻为主的IBS患者服用了一种称为VSL#3的补充剂,该补充剂包含乳酸杆菌,双歧杆菌和链球菌菌株。结果显示,排便频率和一致性没有改善,但腹胀有所改善[67]。
还有一项研究发现,使用VSL#3治疗期间疼痛和腹胀明显减少。研究人员认为,益生菌会导致褪黑素增加,褪黑素是一种参与消化功能的激素[68,69]。
肠道与大脑健康之间有着密切的联系。结肠中的细菌将纤维消化并发酵成短链脂肪酸,研究表明,这也可能有益于大脑和神经系统[70]。
一项针对动物和人类的38项研究综述发现,各种益生菌有助于改善焦虑症,抑郁症,自闭症,强迫症和记忆力低下的症状[71]。在这些研究中最常见的菌株是长双歧杆菌,短双歧杆菌,婴儿双歧杆菌,瑞士乳杆菌和鼠李糖乳杆菌。
益生菌似乎对广泛性焦虑和与特定原因相关的焦虑均有效[72,73,74]。
一项研究发现,喉癌患者在手术前两周服用益生菌后,血液中的压力激素水平降低,焦虑症降低了48%[74]。
在其他研究中,已证明益生菌可以改善健康个体和患有慢性疲劳综合症的人整体情绪并减少其悲伤感[75,76,77]。

服用益生菌补充剂也可以帮助患有抑郁症的人,包括患有严重抑郁症的人[78,79]。在一项为期八周的重度抑郁症患者研究中,服用嗜酸乳杆菌,干酪乳杆菌和双歧双歧杆菌的患者抑郁症明显减少。更重要的是,他们的胰岛素水平和炎性标记降低了[79]。
服用某些益生菌补品可能有助于降低低密度脂蛋白胆固醇(LDL),提高高密度脂蛋白胆固醇(HDL)并降低血压。
服用益生菌可能有助于降低患心脏病的风险。几项研究发现,酸奶或益生菌补品中的某些细菌可能导致心脏健康指标发生有利变化。其中包括降低“不良” LDL胆固醇和增加“良好” HDL胆固醇[80,81,82,83,84]。
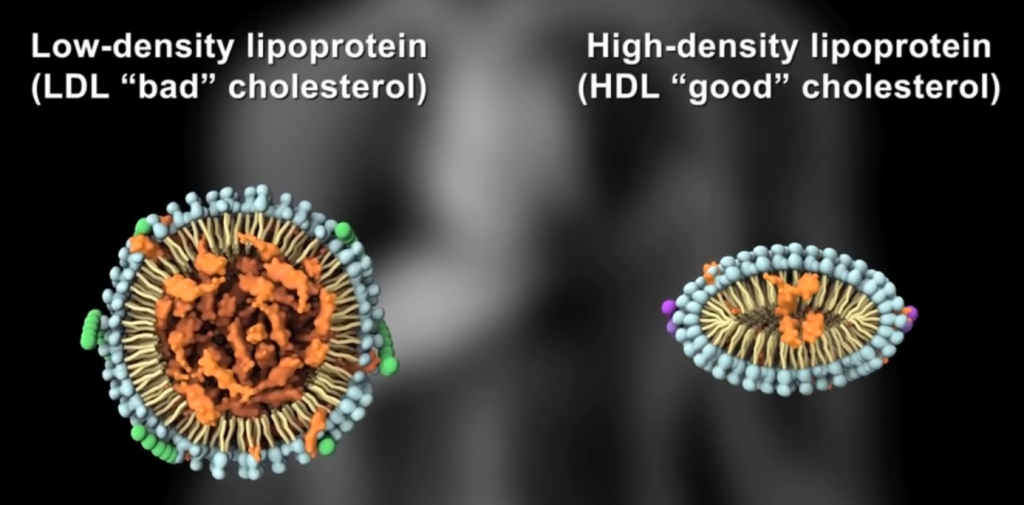

能有效降低胆固醇水平的特定细菌菌株包括嗜酸乳杆菌,长双歧杆菌和罗伊氏乳杆菌。
基于14项研究的分析发现,益生菌可导致LDL胆固醇平均下降,HDL小幅上升和甘油三酸酯下降[84]。
对LDL胆固醇的影响可能有几种过程,包括脂肪代谢的改变和肠道中胆固醇的吸收减少[85]。
另外益生菌也可以帮助降低血压。一项针对九组对照研究的评论发现,服用益生菌的人血压有一定程度的降低。但是,只有每天益生菌剂量超过100亿CFU的疗程超过8周才有显著效果[86]。
服用益生菌可能有助于增强免疫系统,并降低感染和患病的风险。研究表明,服用益生菌补充剂可能会改变肠道细菌的平衡,从而增强人体抵抗过敏,感染和癌症的能力[87]。
特别值得注意的是:乳杆菌GG,卷曲乳杆菌,乳杆菌,两歧双歧杆菌和长双歧杆菌。这些细菌可以降低儿童呼吸道疾病和湿疹的风险,以及成年女性的尿路感染[88,89,90]。
此外,已显示益生菌可减少炎症。在一项研究中,老年人食用加氏乳杆菌,双歧双歧杆菌和长双歧杆菌的混合物或安慰剂,每次食用三周。
服用益生菌制剂后,炎性标志物减少,抗炎性标志物增加,肠道菌群平衡,肠道类型变得更像年轻,健康的人常见的类型[91]。
某些益生菌也可能有助于预防牙龈炎或牙龈感染一项为期14天的研究调查了在接受短乳杆菌或安慰剂治疗时,不刷牙和使用牙线的成年人。安慰剂组的牙龈炎发展更快,这表明益生菌有助于预防感染[92]。
某些益生菌菌株可以降低儿童和婴儿的湿疹严重程度。
一项研究发现,与未添加益生菌喂养的婴儿相比,添加了益生菌补充牛奶的婴儿的湿疹症状有所改善[93]。
另一项研究跟踪了在怀孕期间服用益生菌的妇女生下的孩子。这些孩子在出生后的头两年患湿疹的风险降低了83%[94]。
然而,益生菌与减少湿疹严重程度之间的联系仍然很薄弱,需要做更多的研究[95,96]。一些益生菌还可以减少牛奶或乳制品过敏者的炎症反应。但是,证据薄弱,需要进一步研究[97]。
益生菌还有许多其他好处。
比如炎症:益生菌减少全身性炎症[98];
皮肤健康:有证据表明,益生菌可用于治疗痤疮,酒渣鼻和湿疹以及其他皮肤疾病[99]。
这只是益生菌带来益处的一小部分,因为正在进行的研究表明,其影响健康十分广泛。
除了针对特定的疾病和状况,您还可以服用益生菌以促进整体健康。
一项针对健康成年人的最新研究表明,服用双歧双歧杆菌4周有助于增加短链脂肪酸的产生[100]。
还有一些证据表明,益生菌可以通过延缓随着年龄增长发生的炎症带来的衰老[101,102]。
当然,重要的是要确保您摄取健康的饮食,并保持其他促进健康的行为。不能光指望益生菌保持健康。
此外,尽管益生菌对大多数人来说是安全的,但它们可能会对病情严重或免疫系统受损的人造成伤害[103]。
益生菌通常具有良好的耐受性,并被认为对大多数人是安全的[104]。但是,在开始的几天里,可能会出现于消化有关的副作用,例如胀气和轻度的腹部不适[105]。
调整后,消化会开始逐渐改善。对于免疫系统受损的人,包括那些患有艾滋病毒,艾滋病和其他几种疾病的人,益生菌可能会导致危险的感染[106]。
对于部分特殊疾病的患者,请在服用益生菌补充剂之前咨询医生。
拥有健康的肠道微生物群对健康至关重要,定期检测肠道菌群,分析肠道菌群构成及有益菌的丰度,选择正确的益生菌可以帮助您解决特定的健康问题,并改善整体健康状况和生活品质。
当然,需要注意的是保持健康的肠道不仅仅需要服用益生菌,日常饮食和运动同样重要,因为许多生活方式和环境因素都会影响肠道细菌。
【参考文献】
1 Lemente CC,.Ursell LK, Parfrey LW, et al. The Impact of the Gut Microbiota on Human Health: An Integrative View Author links open overlay panelJose. Journal home page for Cell Review.
2012; 148(6)1258-1270.
2 West CE, Renz H, Jenmalm MC, et al. The gut microbiota and inflammatory noncommunicable diseases: associations and potentials for gut microbiota therapies. J Allergy Clin Immunol. 2015;135(1):3-14. doi:10.1016/j.jaci.2014.11.012
3 Hill C, Guarner F, Reid G, et al. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol. 2014;11(8):506-514. doi:10.1038/nrgastro.2014.66
4 Parnell JA, Reimer RA. Prebiotic fiber modulation of the gut microbiota improves risk factors for obesity and the metabolic syndrome. Gut Microbes. 2012;3(1):29-34. doi:10.4161/gmic.19246
5 Kris Gunnars, BSc Probiotics 101: A Simple Beginner’s Guide. 2018; 12. healthline.
6 Guarner F, Malagelada JR. Gut flora in health and disease. Lancet. 2003;361(9356):512-519. doi:10.1016/S0140-6736(03)12489-0
7 O’Hara AM, Shanahan F. The gut flora as a forgotten organ. EMBO Rep. 2006;7(7):688-693. doi:10.1038/sj.embor.7400731
8 Cummings JH, Macfarlane GT. Role of intestinal bacteria in nutrient metabolism. JPEN J Parenter Enteral Nutr. 1997;21(6):357-365. doi:10.1177/0148607197021006357
9 Natarajan N, Pluznick JL. From microbe to man: the role of microbial short chain fatty acid metabolites in host cell biology. Am J Physiol Cell Physiol. 2014;307(11):C979-C985. doi:10.1152/ajpcell.00228.2014
10 Kim CH, Park J, Kim M. Gut microbiota-derived short-chain Fatty acids, T cells, and inflammation. Immune Netw. 2014;14(6):277-288. doi:10.4110/in.2014.14.6.277
11 Lei YM, Nair L, Alegre ML. The interplay between the intestinal microbiota and the immune system. Clin Res Hepatol Gastroenterol. 2015;39(1):9-19. doi:10.1016/j.clinre.2014.10.008
12 Caricilli AM, Castoldi A, Câmara NO. Intestinal barrier: A gentlemen’s agreement between microbiota and immunity. World J Gastrointest Pathophysiol. 2014;5(1):18-32. doi:10.4291/wjgp.v5.i1.18
13 Cox AJ, West NP, Cripps AW. Obesity, inflammation, and the gut microbiota. Lancet Diabetes Endocrinol. 2015;3(3):207-215. doi:10.1016/S2213-8587(14)70134-2
14 Piya MK, Harte AL, McTernan PG. Metabolic endotoxaemia: is it more than just a gut feeling?. Curr Opin Lipidol. 2013;24(1):78-85. doi:10.1097/MOL.0b013e32835b4431
15. Sekirov I, Russell SL, Antunes LC, Finlay BB. Gut microbiota in health and disease. Physiol Rev. 2010;90(3):859-904. doi:10.1152/physrev.00045.2009
16 Gargano LM, Hughes JM. Microbial origins of chronic diseases. Annu Rev Public Health. 2014;35:65-82. doi:10.1146/annurev-publhealth-032013-182426
17 DiBaise JK, Zhang H, Crowell MD, et al., Gut Microbiota and Its Possible Relationship With Obesity. Mayo Clinic Proceedings. 2008; 83(4) 460-469
18 Musso G, Gambino R, Cassader M. Interactions between gut microbiota and host metabolism predisposing to obesity and diabetes. Annu Rev Med. 2011;62:361-380. doi:10.1146/annurev-med-012510-175505
19 Tremaroli V, Bäckhed F. Functional interactions between the gut microbiota and host metabolism. Nature. 2012;489(7415):242-249. doi:10.1038/nature11552
20 Tuohy KM, Fava F, Viola R. ‘The way to a man’s heart is through his gut microbiota’–dietary pro- and prebiotics for the management of cardiovascular risk. Proc Nutr Soc. 2014;73(2):172-185. doi:10.1017/S0029665113003911
21 Quigley M.M. Prebiotics and probiotics; modifying and mining the microbiota. Pharmacological Research. 2010; 61(3) 213-218
22 Ritchie ML, Romanuk TN. A meta-analysis of probiotic efficacy for gastrointestinal diseases. PLoS One. 2012;7(4):e34938. doi:10.1371/journal.pone.0034938
23 Hempel S, Newberry SJ, Maher AR, et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA. 2012;307(18):1959-1969. doi:10.1001/jama.2012.3507
24 Goldenberg JZ, Ma SSY, Saxton JD, Martzen MR, Vandvik PO, Thorlund K, Guyatt GH, Johnston BC. Probiotics for the prevention of Clostridium difficile‐associated diarrhea in adults and children. Cochrane Database of Systematic Reviews 2013, Issue 5. Art. No.: CD006095. DOI: 10.1002/14651858.CD006095.pub3.
25 Johnston BC, Ma SS, Goldenberg JZ, et al. Probiotics for the prevention of Clostridium difficile-associated diarrhea: a systematic review and meta-analysis. Ann Intern Med. 2012;157(12):878-888. doi:10.7326/0003-4819-157-12-201212180-00563
26 Hungin AP, Mulligan C, Pot B, et al. Systematic review: probiotics in the management of lower gastrointestinal symptoms in clinical practice — an evidence-based international guide. Aliment Pharmacol Ther. 2013;38(8):864-886. doi:10.1111/apt.12460
27 Moayyedi P, Ford AC, Talley NJ, et al. The efficacy of probiotics in the treatment of irritable bowel syndrome: a systematic review. Gut. 2010;59(3):325-332. doi:10.1136/gut.2008.167270
28 Hoveyda N, Heneghan C, Mahtani KR, Perera R, Roberts N, Glasziou P. A systematic review and meta-analysis: probiotics in the treatment of irritable bowel syndrome. BMC Gastroenterol. 2009;9:15. Published 2009 Feb 16. doi:10.1186/1471-230X-9-15
29 Ghouri YA, Richards DM, Rahimi EF, Krill JT, Jelinek KA, DuPont AW. Systematic review of randomized controlled trials of probiotics, prebiotics, and synbiotics in inflammatory bowel disease. Clin Exp Gastroenterol. 2014;7:473-487. Published 2014 Dec 9. doi:10.2147/CEG.S27530
30 Ruggiero P. Use of probiotics in the fight against Helicobacter pylori. World J Gastrointest Pathophysiol. 2014;5(4):384-391. doi:10.4291/wjgp.v5.i4.384
31 Ayala G, Escobedo-Hinojosa WI, de la Cruz-Herrera CF, Romero I. Exploring alternative treatments for Helicobacter pylori infection. World J Gastroenterol. 2014;20(6):1450-1469. doi:10.3748/wjg.v20.i6.1450
32 Pacifico L, Osborn JF, Bonci E, Romaggioli S, Baldini R, Chiesa C. Probiotics for the treatment of Helicobacter pylori infection in children. World J Gastroenterol. 2014;20(3):673-683. doi:10.3748/wjg.v20.i3.673
33 Park SH, Kangwan N, Park JM, Kim EH, Hahm KB. Non-microbial approach for Helicobacter pylori as faster track to prevent gastric cancer than simple eradication. World J Gastroenterol. 2013;19(47):8986-8995. doi:10.3748/wjg.v19.i47.8986
34 Hrefna Palsdottir, MS. How Probiotics Can Help You Lose Weight and Belly Fat. 2017. Healthline.
35 Ogawa A, Kobayashi T, Sakai F, Kadooka Y, Kawasaki Y. Lactobacillus gasseri SBT2055 suppresses fatty acid release through enlargement of fat emulsion size in vitro and promotes fecal fat excretion in healthy Japanese subjects. Lipids Health Dis. 2015;14:20. Published 2015 Mar 20. doi:10.1186/s12944-015-0019-0
36 Hamad EM, Sato M, Uzu K, et al. Milk fermented by Lactobacillus gasseri SBT2055 influences adipocyte size via inhibition of dietary fat absorption in Zucker rats. Br J Nutr. 2009;101(5):716-724. doi:10.1017/S0007114508043808
37 Yadav H, Lee JH, Lloyd J, Walter P, Rane SG. Beneficial metabolic effects of a probiotic via butyrate-induced GLP-1 hormone secretion. J Biol Chem. 2013;288(35):25088-25097. doi:10.1074/jbc.M113.452516
38 Pannacciulli N, Bunt JC, Koska J, Bogardus C, Krakoff J. Higher fasting plasma concentrations of glucagon-like peptide 1 are associated with higher resting energy expenditure and fat oxidation rates in humans. Am J Clin Nutr. 2006;84(3):556-560. doi:10.1093/ajcn/84.3.556
39 Aronsson L, Huang Y, Parini P, et al. Decreased fat storage by Lactobacillus paracasei is associated with increased levels of angiopoietin-like 4 protein (ANGPTL4). PLoS One. 2010;5(9):e13087. Published 2010 Sep 30. doi:10.1371/journal.pone.0013087
40 Pereira SS, Alvarez-Leite JI. Low-Grade Inflammation, Obesity, and Diabetes. Curr Obes Rep. 2014;3(4):422-431. doi:10.1007/s13679-014-0124-9
41 Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Microbial ecology: human gut microbes associated with obesity. Nature. 2006;444(7122):1022-1023. doi:10.1038/4441022a
42 Million M, Lagier JC, Yahav D, Paul M. Gut bacterial microbiota and obesity. Clin Microbiol Infect. 2013;19(4):305-313. doi:10.1111/1469-0691.12172
43 Walker AW, Parkhill J. Fighting Obesity with Bacteria. Science. 2013;341(6150):1069-1070 DOI: 10.1126/science.
44 Zhao L. The gut microbiota and obesity: from correlation to causality. Nat Rev Microbiol. 2013;11(9):639-647. doi:10.1038/nrmicro3089
45 Shen J, Obin MS, Zhao L. The gut microbiota, obesity and insulin resistance. Mol Aspects Med. 2013;34(1):39-58. doi:10.1016/j.mam.2012.11.001
46. Angelakis E, Merhej V, Raoult D. Related actions of probiotics and antibiotics on gut microbiota and weight modification. Lancet Infect Dis. 2013;13(10):889-899. doi:10.1016/S1473-3099(13)70179-8
47 Kadooka Y, Sato M, Ogawa A, et al. Effect of Lactobacillus gasseri SBT2055 in fermented milk on abdominal adiposity in adults in a randomised controlled trial. Br J Nutr. 2013;110(9):1696-1703. doi:10.1017/S0007114513001037
48 Mekkes MC, Weenen TC, Brummer RJ, Claassen E. The development of probiotic treatment in obesity: a review. Benef Microbes. 2014;5(1):19-28. doi:10.3920/BM2012.0069
49 Million M, Angelakis E, Paul M, Armougom F, Leibovici L, Raoult D. Comparative meta-analysis of the effect of Lactobacillus species on weight gain in humans and animals. Microb Pathog. 2012;53(2):100-108. doi:10.1016/j.micpath.2012.05.007
50 Park S, Bae JH. Probiotics for weight loss: a systematic review and meta-analysis. Nutr Res. 2015;35(7):566-575. doi:10.1016/j.nutres.2015.05.008
51 Liu LW. Chronic constipation: current treatment options. Can J Gastroenterol. 2011;25 Suppl B(Suppl B):22B-28B.
52 Miller LE, Zimmermann AK, Ouwehand AC. Contemporary meta-analysis of short-term probiotic consumption on gastrointestinal transit. World J Gastroenterol. 2016;22(21):5122-5131. doi:10.3748/wjg.v22.i21.5122
53 Baştürk A, Artan R, Yılmaz A. Efficacy of synbiotic, probiotic, and prebiotic treatments for irritable bowel syndrome in children: A randomized controlled trial. Turk J Gastroenterol. 2016;27(5):439-443. doi:10.5152/tjg.2016.16301
54 Choi CH, Kwon JG, Kim SK, et al. Efficacy of combination therapy with probiotics and mosapride in patients with IBS without diarrhea: a randomized, double-blind, placebo-controlled, multicenter, phase II trial [published correction appears in Neurogastroenterol Motil. 2015 Nov;27(11):1684-5. Dosage error in article text]. Neurogastroenterol Motil. 2015;27(5):705-716. doi:10.1111/nmo.12544
55 Amenta M, Cascio MT, Di Fiore P, Venturini I. Diet and chronic constipation. Benefits of oral supplementation with symbiotic zir fos (Bifidobacterium longum W11 + FOS Actilight). Acta Biomed. 2006;77(3):157-162.
56 Mezzasalma V, Manfrini E, Ferri E, et al. A Randomized, Double-Blind, Placebo-Controlled Trial: The Efficacy of Multispecies Probiotic Supplementation in Alleviating Symptoms of Irritable Bowel Syndrome Associated with Constipation [published correction appears in Biomed Res Int. 2019 Apr 9;2019:9042956]. Biomed Res Int. 2016;2016:4740907. doi:10.1155/2016/4740907
57 Allen SJ, Martinez EG, Gregorio GV, Dans LF. Probiotics for treating acute infectious diarrhoea. Cochrane Database Syst Rev. 2010;2010(11):CD003048. Published 2010 Nov 10. doi:10.1002/14651858.CD003048.pub3
58 Sazawal S, Hiremath G, Dhingra U, Malik P, Deb S, Black RE. Efficacy of probiotics in prevention of acute diarrhoea: a meta-analysis of masked, randomised, placebo-controlled trials. Lancet Infect Dis. 2006;6(6):374-382. doi:10.1016/S1473-3099(06)70495-9
59 Johnston BC, Supina AL, Ospina M, Vohra S. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database Syst Rev. 2007;(2):CD004827. Published 2007 Apr 18. doi:10.1002/14651858.CD004827.pub2
60 Hempel S, Newberry SJ, Maher AR, et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA. 2012;307(18):1959-1969. doi:10.1001/jama.2012.3507
61 Majeed M, Nagabhushanam K, Natarajan S, et al. Bacillus coagulans MTCC 5856 supplementation in the management of diarrhea predominant Irritable Bowel Syndrome: a double blind randomized placebo controlled pilot clinical study. Nutr J. 2016;15:21. Published 2016 Feb 27. doi:10.1186/s12937-016-0140-6
62 Dolin BJ. Effects of a proprietary Bacillus coagulans preparation on symptoms of diarrhea-predominant irritable bowel syndrome. Methods Find Exp Clin Pharmacol. 2009;31(10):655-659. doi:10.1358/mf.2009.31.10.1441078
63 Ki Cha B, Mun Jung S, Hwan Choi C, et al. The effect of a multispecies probiotic mixture on the symptoms and fecal microbiota in diarrhea-dominant irritable bowel syndrome: a randomized, double-blind, placebo-controlled trial. J Clin Gastroenterol. 2012;46(3):220-227. doi:10.1097/MCG.0b013e31823712b1
64 Kabir MA, Ishaque SM, Ali MS, Mahmuduzzaman M, Hasan M. Role of Saccharomyces boulardii in diarrhea predominant irritable bowel syndrome. Mymensingh Med J. 2011;20(3):397-401.
65 Siah KT, Wong RK, Ho KY. Melatonin for the treatment of irritable bowel syndrome. World J Gastroenterol. 2014;20(10):2492-2498. doi:10.3748/wjg.v20.i10.2492
66 Wong RK, Yang C, Song GH, Wong J, Ho KY. Melatonin regulation as a possible mechanism for probiotic (VSL#3) in irritable bowel syndrome: a randomized double-blinded placebo study. Dig Dis Sci. 2015;60(1):186-194. doi:10.1007/s10620-014-3299-8
67 Samejima N, Nakajima S. New electric drill biopsy apparatus for breast tumors. Surgery. 1976;79(5):590-591.
68 Spiller R, Pélerin F, Cayzeele Decherf A, et al. Randomized double blind placebo-controlled trial of Saccharomyces cerevisiae CNCM I-3856 in irritable bowel syndrome: improvement in abdominal pain and bloating in those with predominant constipation [published correction appears in United European Gastroenterol J. 2017 Mar;5(2):304]. United European Gastroenterol J. 2016;4(3):353-362. doi:10.1177/2050640615602571
69 Moayyedi P, Ford AC, Talley NJ, et al. The efficacy of probiotics in the treatment of irritable bowel syndrome: a systematic review. Gut. 2010;59(3):325-332. doi:10.1136/gut.2008.167270
70 Food for thought: The role of nutrition in the microbiota-gut–brain axis Author links open overlay panelClara SeiraOriachad1Ruairi C.Robertsonbcd1CatherineStantoncdJohn F.CryandeTimothy G.Dinanad Clinical Nutrition Experimental Volume 6, April 2016, Pages 25-
71 Wang H, Lee IS, Braun C, Enck P. Effect of Probiotics on Central Nervous System Functions in Animals and Humans: A Systematic Review. J Neurogastroenterol Motil. 2016;22(4):589-605. doi:10.5056/jnm16018
72 Mohammadi AA, Jazayeri S, Khosravi-Darani K, et al. The effects of probiotics on mental health and hypothalamic-pituitary-adrenal axis: A randomized, double-blind, placebo-controlled trial in petrochemical workers. Nutr Neurosci. 2016;19(9):387-395. doi:10.1179/1476830515Y.0000000023
73 Messaoudi M, Lalonde R, Violle N, et al. Assessment of psychotropic-like properties of a probiotic formulation (Lactobacillus helveticus R0052 and Bifidobacterium longum R0175) in rats and human subjects. Br J Nutr. 2011;105(5):755-764. doi:10.1017/S0007114510004319
74 Yang H, Zhao X, Tang S, et al. Probiotics reduce psychological stress in patients before laryngeal cancer surgery. Asia Pac J Clin Oncol. 2016;12(1):e92-e96. doi:10.1111/ajco.12120
75 Rao AV, Bested AC, Beaulne TM, et al. A randomized, double-blind, placebo-controlled pilot study of a probiotic in emotional symptoms of chronic fatigue syndrome. Gut Pathog. 2009;1(1):6. Published 2009 Mar 19. doi:10.1186/1757-4749-1-6
76 Steenbergen L, Sellaro R, van Hemert S, Bosch JA, Colzato LS. A randomized controlled trial to test the effect of multispecies probiotics on cognitive reactivity to sad mood. Brain Behav Immun. 2015;48:258-264. doi:10.1016/j.bbi.2015.04.003
77 Messaoudi M, Violle N, Bisson JF, Desor D, Javelot H, Rougeot C. Beneficial psychological effects of a probiotic formulation (Lactobacillus helveticus R0052 and Bifidobacterium longum R0175) in healthy human volunteers. Gut Microbes. 2011;2(4):256-261. doi:10.4161/gmic.2.4.16108
78 Huang R, Wang K, Hu J. Effect of Probiotics on Depression: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients. 2016;8(8):483. Published 2016 Aug 6. doi:10.3390/nu8080483
79 Akkasheh G, Kashani-Poor Z, Tajabadi-Ebrahimi M, et al. Clinical and metabolic response to probiotic administration in patients with major depressive disorder: A randomized, double-blind, placebo-controlled trial. Nutrition. 2016;32(3):315-320. doi:10.1016/j.nut.2015.09.003
80 Agerholm-Larsen L, Bell ML, Grunwald GK, Astrup A. The effect of a probiotic milk product on plasma cholesterol: a meta-analysis of short-term intervention studies. Eur J Clin Nutr. 2000;54(11):856-860. doi:10.1038/sj.ejcn.1601104
81 Kiessling G, Schneider J, Jahreis G. Long-term consumption of fermented dairy products over 6 months increases HDL cholesterol. Eur J Clin Nutr. 2002;56(9):843-849. doi:10.1038/sj.ejcn.1601399
82 Jones ML, Martoni CJ, Parent M, Prakash S. Cholesterol-lowering efficacy of a microencapsulated bile salt hydrolase-active Lactobacillus reuteri NCIMB 30242 yoghurt formulation in hypercholesterolaemic adults. Br J Nutr. 2012;107(10):1505-1513. doi:10.1017/S0007114511004703
83 Sun J, Buys N. Effects of probiotics consumption on lowering lipids and CVD risk factors: a systematic review and meta-analysis of randomized controlled trials. Ann Med. 2015;47(6):430-440. doi:10.3109/07853890.2015.1071872
84 Sharma S, Kurpad AV, Puri S. Potential of probiotics in hypercholesterolemia: A meta-analysis [published correction appears in Indian J Public Health. 2017 Jan-Mar;61(1):63]. Indian J Public Health. 2016;60(4):280-286. doi:10.4103/0019-557X.195859
85 Reis SA, Conceição LL, Rosa DD, Siqueira NP, Peluzio MCG. Mechanisms responsible for the hypocholesterolaemic effect of regular consumption of probiotics. Nutr Res Rev. 2017;30(1):36-49. doi:10.1017/S0954422416000226
86 Khalesi S, Sun J, Buys N, Jayasinghe R. Effect of probiotics on blood pressure: a systematic review and meta-analysis of randomized, controlled trials. Hypertension. 2014;64(4):897-903. doi:10.1161/HYPERTENSIONAHA.114.03469
87 Reid G, Jass J, Sebulsky MT, McCormick JK. Potential uses of probiotics in clinical practice. Clin Microbiol Rev. 2003;16(4):658-672. doi:10.1128/cmr.16.4.658-672.2003
88 Hatakka K, Savilahti E, Pönkä A, et al. Effect of long term consumption of probiotic milk on infections in children attending day care centres: double blind, randomised trial. BMJ. 2001;322(7298):1327. doi:10.1136/bmj.322.7298.1327
89 Kim HK, Rutten NB, Besseling-van der Vaart I, et al. Probiotic supplementation influences faecal short chain fatty acids in infants at high risk for eczema. Benef Microbes. 2015;6(6):783-790. doi:10.3920/BM2015.0056
90 Stapleton AE, Au-Yeung M, Hooton TM, et al. Randomized, placebo-controlled phase 2 trial of a Lactobacillus crispatus probiotic given intravaginally for prevention of recurrent urinary tract infection. Clin Infect Dis. 2011;52(10):1212-1217. doi:10.1093/cid/cir183
91 Spaiser SJ, Culpepper T, Nieves C Jr, et al. Lactobacillus gasseri KS-13, Bifidobacterium bifidum G9-1, and Bifidobacterium longum MM-2 Ingestion Induces a Less Inflammatory Cytokine Profile and a Potentially Beneficial Shift in Gut Microbiota in Older Adults: A Randomized, Double-Blind, Placebo-Controlled, Crossover Study. J Am Coll Nutr. 2015;34(6):459-469. doi:10.1080/07315724.2014.983249
92 Lee JK, Kim SJ, Ko SH, Ouwehand AC, Ma DS. Modulation of the host response by probiotic Lactobacillus brevis CD2 in experimental gingivitis. Oral Dis. 2015;21(6):705-712. doi:10.1111/odi.12332
93 Isolauri E, Arvola T, Sütas Y, Moilanen E, Salminen S. Probiotics in the management of atopic eczema. Clin Exp Allergy. 2000;30(11):1604-1610. doi:10.1046/j.1365-2222.2000.00943.x
94 Rautava S, Kainonen E, Salminen S, Isolauri E. Maternal probiotic supplementation during pregnancy and breast-feeding reduces the risk of eczema in the infant. J Allergy Clin Immunol. 2012;130(6):1355-1360. doi:10.1016/j.jaci.2012.09.003
95 Boyle RJ, Bath-Hextall FJ, Leonardi-Bee J, Murrell DF, Tang ML. Probiotics for treating eczema. Cochrane Database Syst Rev. 2008;(4):CD006135. Published 2008 Oct 8. doi:10.1002/14651858.CD006135.pub2
96 Cuello-Garcia CA, Brożek JL, Fiocchi A, et al. Probiotics for the prevention of allergy: A systematic review and meta-analysis of randomized controlled trials. J Allergy Clin Immunol. 2015;136(4):952-961. doi:10.1016/j.jaci.2015.04.031
97 Pelto L, Isolauri E, Lilius EM, Nuutila J, Salminen S. Probiotic bacteria down-regulate the milk-induced inflammatory response in milk-hypersensitive subjects but have an immunostimulatory effect in healthy subjects. Clin Exp Allergy. 1998;28(12):1474-1479. doi:10.1046/j.1365-2222.1998.00449.x
98 David W. Probiotics as regulators of inflammation: A review, Lescheid. 2014; 4;7
99 Baquerizo Nole KL, Yim E, Keri JE. Probiotics and prebiotics in dermatology. J Am Acad Dermatol. 2014;71(4):814-821. doi:10.1016/j.jaad.2014.04.050
100 Gargari G, Taverniti V, Balzaretti S, et al. Consumption of a Bifidobacterium bifidum Strain for 4 Weeks Modulates Dominant Intestinal Bacterial Taxa and Fecal Butyrate in Healthy Adults. Appl Environ Microbiol. 2016;82(19):5850-5859. Published 2016 Sep 16. doi:10.1128/AEM.01753-16
101 Kumar M, Babaei P, Ji B, Nielsen J. Human gut microbiota and healthy aging: Recent developments and future prospective. Nutr Healthy Aging. 2016;4(1):3-16. Published 2016 Oct 27. doi:10.3233/NHA-150002
102 Ouwehand AC, Bergsma N, Parhiala R, et al. Bifidobacterium microbiota and parameters of immune function in elderly subjects. FEMS Immunol Med Microbiol. 2008;53(1):18-25. doi:10.1111/j.1574-695X.2008.00392.x
103 Didari T, Solki S, Mozaffari S, Nikfar S, Abdollahi M. A systematic review of the safety of probiotics. Expert Opin Drug Saf. 2014;13(2):227-239. doi:10.1517/14740338.2014.872627
104 Franziska Spritzler, RD, How to Choose the Best Probiotic Supplement. 2017. Healthline.
105 Benjamin K, Cohrssen A, Probiotics. Am Fam Physician. 20088(9):1073-1078.
106 Didari T, Solki S, Mozaffari S, Nikfar S, Abdollahi M. A systematic review of the safety of probiotics. Expert Opin Drug Saf. 2014;13(2):227-239. doi:10.1517/14740338.2014.872627

谷禾健康
随着多年来科技的发展与生活脚步的加快,各种慢性疾病开始困扰着我们,且有年轻化的趋势。我们都希望一直能保持健康,那么具体该怎么做?
本文将从食物消化的过程开始,详细讲述如何改善健康。
通常,食物需要24到72个小时才能通过消化道。确切的时间取决于所吃食物的数量和类型。
首先,食物通过消化系统的速度相对较快。在6到8个小时内,食物通过了胃,小肠和大肠。胃排空(2至5小时),小肠转运(2至6小时),结肠转运(10至59小时)和整个肠道转运(10至73小时)。
消化率还取决于你吃的食物类型。
· 肉和鱼可能需要长达2天的时间才能完全消化。它们所含的蛋白质和脂肪是复杂的分子,需要更长的时间才能在身体内被分解。
· 纤维含量高的水果和蔬菜可在不到一天的时间内消化。这些高纤维食物通常可以帮助你的消化道更有效地运转。
· 消化最快的是加工过的含糖垃圾食品,例如糖果。身体会在几个小时内排出,很快你就又感觉到饿了。
消化是人体分解食物并吸收人体所需的营养的过程。剩下的就是废物,身体会清除掉。
消化系统由五个主要部分组成:口、食管、胃、小肠、大肠。

口 腔
咀嚼时,口腔中的腺体会分泌唾液。这种消化液含有分解食物淀粉的酶,咀嚼是为了将食物弄成一种糊状的团状物,或者更容易吞咽的丸状物。
食 道
吞咽时,食物会向下移动到食道。食道是连接嘴和胃的管道。食管下括约肌下端的肌肉门打开,食物就会进入胃中。
胃
胃中的酸会进一步破坏食物,然后产生混合着胃液和部分消化的食物,称为食糜。这种混合物继续下去,进入小肠。
小 肠
在小肠中,胰脏和肝脏会贡献自己的消化液。胰液分解碳水化合物,脂肪和蛋白质。胆囊中的胆汁可溶解脂肪。维生素,其他营养物质和水穿过小肠壁进入血液。剩余的未消化部分接着往下,进入大肠。
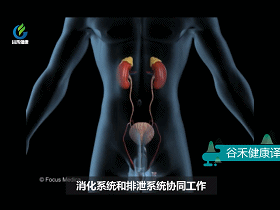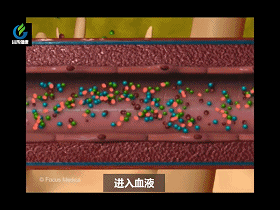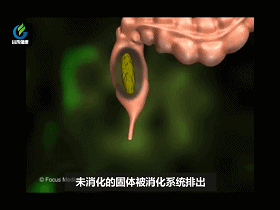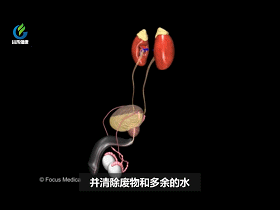
大 肠
大肠从食物中吸收所有剩余的水分和剩余的营养。其余部分变成固体废物,称为粪便。直肠会储存大便,直到要排便为止。
正常的大便每周3次至每天3次。尽管每个人的肠道都是不同的,但是健康的肠道通常会有一定的规律。食物通常需要24到72个小时才能通过消化道。直到六到八个小时后,食物才到达大肠(结肠),然后开始要上厕所。
如果一直没有感觉,可能是便秘。便秘有很多原因,从脱水或低纤维到甲状腺等各种问题,但最好的选择是首先检查饮食和肠道状况。确保你已经喝了足够的水,并在饮食中加入了各种水果和蔬菜,保持肠道状况良好。
我们的肠道负责让我们的身体维持正常工作状态。当我们吃的食物被分解时,肠道会吸收支持我们身体功能的营养物质-从产生能量到荷尔蒙平衡,从皮肤健康到心理健康,甚至消除毒素和废物。
此外,关于免疫系统的70%在肠道中,因此确保我们的消化系统处于最佳状态对于解决我们的许多身体疾病至关重要。
为了使食物在消化系统中顺畅流动并防止腹泻和便秘等问题,可以进行以下选择:
01多吃蔬菜,水果和全谷物
蔬菜,水果和全谷物都是纤维的丰富来源。纤维有助于食物更轻松,更彻底地通过消化系统。

02 限制红肉和加工食品
研究已经表明红肉产生与心脏病有关的化学物质。加工食品可能会导致胃肠道内壁发炎,而胃肠道内壁正是吸收食物的主要位置。你的肠胃可能无法识别你吃进去的可消化食物,更有可能将高果糖玉米糖浆或人造成分等食物识别为“攻击者”,从而引起炎症反应。我们的身体实际上在抵抗这些食物,就好像是感染一样。
因此尽可能食用更多的绿色食品,例如绿色水果,蔬菜和未加工的肉类,可以降低对身体造成的压力。
03 坚持运动
身体运动也会带动消化道运动。饭后散散步可以防止气体和腹胀。运动还可以控制体重,从而降低罹患某些癌症和消化系统其他疾病的风险。

04 保证充足的睡眠
睡眠不足与肥胖有关,肥胖可能导致消化系统出现问题。
05 适当解压
过度的压力会加剧消化系统疾病,例如烧心和肠易激综合症。诸如冥想和瑜伽等缓解压力的技术可以帮助您放松心情。
06 尽量避免引起过敏
我国在2011年4月发布了新的《预包装食品标签通则》,其中增加了食品中可能含有致敏物质时的推荐标示要求。在推荐标示内容部分,特别对致敏物质做了标示的详细规定。对食品及其制品中选用了某些可能导致人体产生过敏反应的配料,宜在配料表中使用易辨识的名称,或在配料表邻近位置加以提示。
例如上世纪80年代, 欧美有不少人发现他们对自己的主食面包过敏。就在于肠胃对面筋蛋白质中的醇溶谷蛋白的过敏反应。于是欧美兴起了轻/无麸质食品。
注:麸质(Gluten)是存在于多种谷物中的一种谷蛋白,亦称面筋蛋白,对中国人来说,就是俗称的“面筋”,它是大麦、小麦、燕麦、黑麦等谷物中的精华物质,具有弹性,能给面食带来“劲道”的口感。

人类的肠道内有超过100万亿种细菌,被称为“肠道菌群”。拥有健康的肠道菌群对于你整体健康至关重要。破坏肠道菌群与许多健康问题有关。
有意思的是,许多饮食,生活方式和其他环境因素都可能对肠道菌群产生负面影响。饮食和生活方式因素,包括不良的睡眠质量,饮酒和缺乏运动,都可能会损害肠道细菌。
1 饮食不均衡
由水果,蔬菜和全谷物等各种各样的整体食物组成的饮食会导致肠道菌群更加多样化。实际上,仅改变几天的饮食习惯就可以改变肠道菌群。这是因为您吃的食物提供了有助于细菌生长的营养。富含全食物的饮食可以为肠道提供多种营养,帮助促进各种细菌的生长,从而导致肠道菌群更加多样化。
通常丰富多样的肠道菌群被认为是健康的。肠道菌群缺乏多样性,不利于从感染或抗生素等有害影响中的恢复。
不幸的是,在过去的几十年中,许多多样性饮食已经丧失。据报道,全球75%的粮食供应仅来自12种植物和5种动物。有意思的是,研究表明,生活在非洲和南美农村地区的人的肠道菌群要比生活在美国和欧洲的人更为丰富。他们的饮食通常不受西方饮食的影响,富含纤维和多种植物蛋白。

2 饮食缺乏益生元
益生元可以在通过上消化道时不被消化,却能被肠道菌群发酵,可促进肠道中有益菌的生长和活动。许多食物,包括水果,蔬菜和全谷物,都含有益生元。饮食中缺乏它们可能对您的整体消化健康有害。
益生元含量高的食物包括:
小扁豆,鹰嘴豆和豆类;燕麦;香蕉;菊芋;芦笋;大蒜;韭菜;洋葱;坚果类

一项针对30位肥胖女性的研究发现,每天服用益生菌补充剂三个月可以促进有益菌例如双歧杆菌生长。
益生元纤维补充剂还促进短链脂肪酸的产生。这些脂肪酸是结肠细胞的主要营养来源。它们可以被吸收到您的血液中,从而促进新陈代谢和消化系统的健康,减少炎症并降低结直肠癌的风险。
此外,富含益生元纤维的食物可能会降低胰岛素和胆固醇水平。
3 饮酒过多
一般来说,饮酒会对肠道细菌产生有害影响。但是,适量食用时,红酒中的多酚含量可能对肠道细菌具有保护作用。酒精会上瘾,大量饮酒会对身体和精神产生有害影响。在肠道健康方面,长期饮酒会引起严重的问题,包括营养不良。
一项研究检查了41名酗酒者的肠道菌群,并将其与10名几乎不喝酒的健康个体进行了比较。酗酒者肠道菌群失调占27%,但在任何健康个体中都没有。
另一项研究比较了三种不同类型的酒精对肠道健康的影响。在20天内,每天喝272毫升的红酒,272毫升的脱醇红酒(一种酒精含量极低的葡萄酒)或100毫升杜松子酒(一种烈酒)。
其中杜松子酒减少了肠道中有益菌的数量,而红酒实际上增加了已知可促进肠道健康的细菌数量,减少了梭菌等有害菌的数量。

适量饮用红酒对肠道细菌的有益作用似乎是由于其多酚含量的缘故。多酚可以逃避消化,并被肠道细菌分解的植物化合物。它们还可以帮助降低血压并改善胆固醇水平。
4 抗生素的使用
抗生素是用于治疗细菌引起的感染和疾病的重要药物,例如尿路感染等。它们通过杀死细菌或防止细菌繁殖而起作用,并在过去80年中挽救了数百万人的生命。
但是,抗生素的缺点之一是它们同时影响好细菌和坏细菌。实际上,即使是单一抗生素治疗也可能导致肠道菌群组成和多样性的变化。
短期改变
抗生素通常会导致有益细菌(例如双歧杆菌和乳杆菌)的短期减少,并会暂时增加有害细菌(如梭菌)。
长期改变
但是,抗生素也会导致肠道菌群的长期改变。服完一定剂量的抗生素后,大多数细菌会在1-4周后返回,但它们的数量通常不会恢复到以前的水平。
一项研究发现,单剂量抗生素减少了拟杆菌的丰度,并增加了耐药菌株的数量。这些影响可能会持续两年。
尤其是在生命早期使用抗生素可能导致某些个体长期破坏生态系统,这在我们之前的文章里面也有详细阐述。
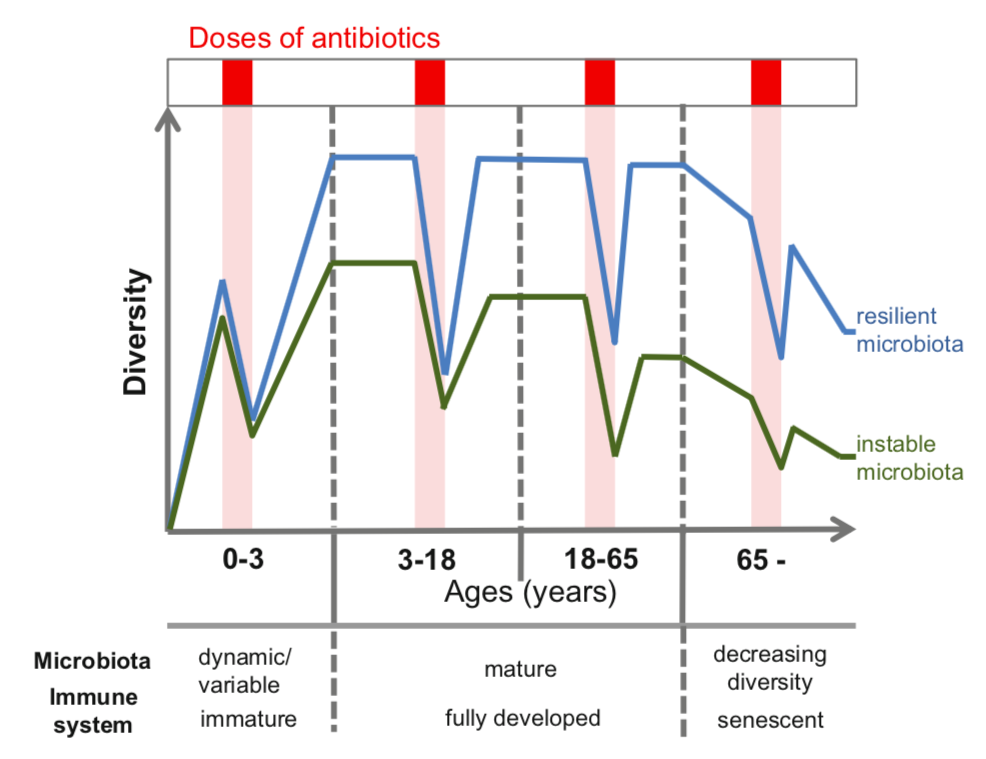
Thiemann S,et al, 2016
5 缺乏规律的体育锻炼
体育活动被简单地定义为身体燃烧能量的任何运动。散步,园艺,游泳和骑自行车都是体育锻炼的例子。我们都知道锻炼身体可以带来许多健康益处,包括减肥,解压和降低患慢性病的风险等。
此外,最近的研究表明,体育锻炼也可能会改变肠道细菌,改善肠道健康。较多的锻炼与更多的丁酸以及丁酸产生菌有关(丁酸是一种对整体健康至关重要的短链脂肪酸)。这在我们之前短链脂肪酸的文章中也有详细阐述。
一项研究发现,与体重,年龄和性别相匹配的对照组相比,职业橄榄球运动员的肠道菌群更加多样化,细菌种类增加了一倍。此外,运动员的Akkermansia含量较高,该细菌被证明在代谢健康和预防肥胖中起重要作用。
女性群体中也有类似的报道。一项研究比较了19名经常体育锻炼女性的肠道菌群和21名不常体育锻炼女性的肠道菌群。经常体育锻炼的女性有很多促进健康的细菌,包括双歧杆菌和阿克曼菌属等,这表明经常体育锻炼,即便是在低强度到中等强度,定期进行体育锻炼也是有益的。
6 抽烟
吸烟会对体内几乎所有器官产生有害影响。戒烟可以增加肠道菌群的多样性,从而改善肠道健康,这种情况会在九周后发生。
烟草烟雾由数千种化学物质组成,其中70种会导致癌症。吸烟会对人体几乎所有器官造成伤害,并增加患心脏病,中风和肺癌的风险。
吸烟也是引起炎症性肠病的最重要的环境风险因素之一,这种疾病的特征是持续的消化道炎症。此外,吸烟者罹患克罗恩氏病(一种常见的炎症性肠病)的可能性比不吸烟者高两倍。在一项研究中,戒烟增加了肠道菌群多样性,这是健康肠道的标志。

7 睡眠不足
保证良好的睡眠对整体健康非常重要。研究表明,睡眠不足与许多疾病有关,包括肥胖和心脏病。睡眠是如此重要,你的身体拥有自己的昼夜节律。这是一个24小时的内部时钟,会影响您的大脑,身体和激素。它可以使您保持警觉和清醒,但也可以告诉您何时应该入睡。
肠道也遵循日常的昼夜节律。由于缺乏睡眠,或者倒班,或者在深夜进食都会干扰生物钟,可能会对肠道菌群产生有害影响。

2016年的一项研究首次探讨了短期睡眠剥夺对肠道菌群组成的影响。该研究比较了九名男性中两晚睡眠不足(每晚约4小时)与正常睡眠时间两晚(8.5小时)的影响。睡眠不足两天导致肠道菌群发生细微变化,并增加了与体重增加,肥胖,2型糖尿病和脂肪代谢有关的细菌数量。然而,睡眠剥夺对肠道细菌的影响是一个新的研究领域。需要进一步研究以确定睡眠不足和睡眠质量差对肠道健康的影响。摘要:身体有一个称为昼夜节律的24小时内部时钟。睡眠不足会破坏昼夜节律,这似乎对肠道细菌有有害影响。
8 压力过大
压力过大会增加有害细菌(如梭菌)和减少有益细菌(如乳酸菌),过度应激会降低肠道菌群多样性,改变肠道菌群分布。
我们说健康不仅仅是饮食,体育锻炼和充足的睡眠,还需要适当解压。高压力水平也会对身体产生有害影响。
在肠道中,应激会增加敏感性,减少血液流量并改变肠道细菌。对小鼠的研究表明,不同类型的压力(例如隔离,拥挤和热应激)可以减少肠道菌群多样性并改变肠道状况。小鼠在压力暴露下也会影响菌群构成,导致梭状芽胞杆菌等潜在有害菌增加,而乳酸杆菌(Lactobacillus)等细菌的有益菌减少。
一项针对人体的研究探讨了压力对23名大学生的肠道细菌组成的影响。在学期开始时和学期末进行肠道菌群检测。期末考试带来的高压力导致包括乳酸杆菌在内的有益菌的减少。有关压力与肠道菌群之间关系的研究还很新,目前对人类的研究还很有限。
健康的肠道菌群富含有益菌,对于整体健康至关重要。有很多方法可以改善肠道健康。饮食健康,多样化的饮食,良好的睡眠和减轻压力的程度,都是改善肠道菌群的好方法。
以下是有关如何改善肠道菌群的一些技巧:
肠道菌群检测
每个人都有自己独特的肠道菌群,处于自己独特的平衡中。不同的食物将以不同的方式影响我们所有人。也许令你感到不适的食物会使别人充满活力和健康,对你有效的药物对别人无效。
通过肠道菌群检测,可以更科学准确了解自己的肠道健康状况并制定相应的营养计划以满足自身需求。人们会越来越倾向于采用个性化的方式以维持健康。
多吃富含益生元的食物
多吃富含益生元纤维的食物,例如豆类,洋葱,芦笋,燕麦,香蕉等。

食用更多的益生菌
益生菌可能会增加健康的肠道细菌数量。发酵食品,例如酸奶,泡菜,干酪、酒酿、酱油、食醋等都是极好的来源。当然也可以服用益生菌补充剂。
留出充足的睡眠时间
要改善睡眠质量,傍晚之后请尽量不碰咖啡因,尽可能在完全黑暗的环境中睡觉,并进行有条理的睡眠,以便于每天都可以在同一时间入睡和起床。
减轻压力
定期运动,冥想和深呼吸运动可能有助于减轻压力水平。如果您经常感到压力很大,苦不堪言,对任何事物都提不起兴趣,则需考虑去看心理医生。
吃富含多酚的食物
优质食物包括蓝莓,红酒,黑巧克力和绿茶。多酚的消化效率不高,通常会进入结肠,在结肠中被细菌消化。

保证均衡饮食
《美国国家科学院院刊》上发表的一篇关于营养科学的文章指出,营养物质对于维持身体健康至关重要。这包括41种营养素,这些营养素包括14种已知的维生素(维生素A,B-1,B-2,B-6,B-12,C,D,E,K,生物素,胆碱,叶酸,烟酸和泛酸)和16种必需矿物质(钙,氯,铬,钴,铜,碘,铁,锰,镁,钼,磷,钾,硒,钠,硫和锌),以及11种其他物质,这些物质目前尚未归类为维生素,但应该归为维生素,包括两种类型的omega-3脂肪酸和9个氨基酸。
而大多数营养素都藏在我们日常的食物中,我们可以尽可能选择多种类的食物来加以均衡。这些营养素一旦缺乏,就会对健康带来不利影响。
随着现代医学的发展,对疾病的预防开始逐渐成为医学上的重要环节,从预防做起能更多地免受疾病之苦。最后,希望大家从饮食的点滴开始,调整生活方式,找到属于自己的最佳健康状态。
【主要参考文献】
向上滑动阅览
Archer SN, Oster H. How sleep and wakefulness influence circadian rhythmicity: effects of insufficient and mistimed sleep on the animal and human transcriptome. J Sleep Res. 2015;24(5):476‐493. doi:10.1111/jsr.12307
Aschoff J, Wever R. Human circadian rhythms: a multioscillatory system. Fed Proc. 1976;35(12):.
Ayas NT, White DP, Manson JE, et al. A prospective study of sleep duration and coronary heart disease in women. Arch Intern Med. 2003;163(2):205‐209. doi:10.1001/archinte.163.2.205
Bermon S, Petriz B, Kajėnienė A, Prestes J, Castell L, Franco OL. The microbiota: an exercise immunology perspective. Exerc Immunol Rev. 2015;21:70‐79.
Cardona F, Andrés-Lacueva C, Tulipani S, Tinahones FJ, Queipo-Ortuño MI. Benefits of polyphenols on gut microbiota and implications in human health. J Nutr Biochem. 2013;24(8):1415‐1422. doi:10.1016/j.jnutbio.2013.05.001
Claesson MJ, Jeffery IB, Conde S, et al. Gut microbiota composition correlates with diet and health in the elderly. Nature. 2012;488(7410):178‐184. doi:10.1038/nature11319
Clarke SF, Murphy EF, O’Sullivan O, et al. Exercise and associated dietary extremes impact on gut microbial diversity. Gut. 2014;63(12):1913‐1920. doi:10.1136/gutjnl-2013-306541
Clemente JC, Pehrsson EC, Blaser MJ, et al. The microbiome of uncontacted Amerindians. Sci Adv. 2015;1(3):e1500183. doi:10.1126/sciadv.1500183
Corrao G, Rubbiati L, Bagnardi V, Zambon A, Poikolainen K. Alcohol and coronary heart disease: a meta-analysis. Addiction. 2000;95(10):1505‐1523. doi:10.1046/j.1360-0443.2000.951015056.x
Daisy Coyle, APD. 8 Surprising Things That Harm Your Gut Bacteria. healthy.net
David LA, Maurice CF, Carmody RN, et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014;505(7484):559‐563. doi:10.1038/nature12820
De Filippo C, Cavalieri D, Di Paola M, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Natl Acad Sci U S A. 2010;107(33):14691‐14696. doi:10.1073/pnas.1005963107
De La Cochetière MF, Durand T, Lepage P, Bourreille A, Galmiche JP, Doré J. Resilience of the dominant human fecal microbiota upon short-course antibiotic challenge. J Clin Microbiol. 2005;43(11):5588‐5592. doi:10.1128/JCM.43.11.5588-5592.2005
De Palma G, Blennerhassett P, Lu J, et al. Microbiota and host determinants of behavioural phenotype in maternally separated mice. Nat Commun. 2015;6:7735. Published 2015 Jul 28. doi:10.1038/ncomms8735
Dethlefsen L, Huse S, Sogin ML, Relman DA. The pervasive effects of an antibiotic on the human gut microbiota, as revealed by deep 16S rRNA sequencing. PLoS Biol. 2008;6(11):e280. doi:10.1371/journal.pbio.0060280
Dethlefsen L, Relman DA. Incomplete recovery and individualized responses of the human distal gut microbiota to repeated antibiotic perturbation. Proc Natl Acad Sci U S A. 2011;108 Suppl 1(Suppl 1):4554‐4561. doi:10.1073/pnas.1000087107
Dewulf EM, Cani PD, Claus SP, et al. Insight into the prebiotic concept: lessons from an exploratory, double blind intervention study with inulin-type fructans in obese women. Gut. 2013;62(8):1112‐1121. doi:10.1136/gutjnl-2012-303304
Ensari I, Sandroff BM, Motl RW. Effects of Single Bouts of Walking Exercise and Yoga on Acute Mood Symptoms in People with Multiple Sclerosis. Int J MS Care. 2016;18(1):1‐8. doi:10.7224/1537-2073.2014-104
Gangwisch JE, Malaspina D, Boden-Albala B, Heymsfield SB. Inadequate sleep as a risk factor for obesity: analyses of the NHANES I. Sleep. 2005;28(10):1289‐1296. doi:10.1093/sleep/28.10.1289
Gibson GR, Beatty ER, Wang X, Cummings JH. Selective stimulation of bifidobacteria in the human colon by oligofructose and inulin. Gastroenterology. 1995;108(4):975‐982. doi:10.1016/0016-5085(95)90192-2
Gim MN, Choi JH. The effects of weekly exercise time on VO2max and resting metabolic rate in normal adults. J Phys Ther Sci. 2016;28(4):1359‐1363. doi:10.1589/jpts.28.1359
Heiman ML, Greenway FL. A healthy gastrointestinal microbiome is dependent on dietary diversity. Mol Metab. 2016;5(5):317‐320. Published 2016 Mar 5. doi:10.1016/j.molmet.2016.02.005
Jernberg C, Löfmark S, Edlund C, Jansson JK. Long-term ecological impacts of antibiotic administration on the human intestinal microbiota [published correction appears in ISME J. 2013 Feb;7(2):456]. ISME J. 2007;1(1):56‐66. doi:10.1038/ismej.2007.3
Jumpertz R, Le DS, Turnbaugh PJ, et al. Energy-balance studies reveal associations between gut microbes, caloric load, and nutrient absorption in humans. Am J Clin Nutr. 2011;94(1):58‐65. doi:10.3945/ajcn.110.0101
Konturek PC, Brzozowski T, Konturek SJ. Stress and the gut: pathophysiology, clinical consequences, diagnostic approach and treatment options. J Physiol Pharmacol. 2011;62(6):591‐599.
Lee YY, Erdogan A, Rao SS. How to assess regional and whole gut transit time with wireless motility capsule. J Neurogastroenterol Motil. 2014;20(2):265‐270. doi:10.5056/jnm.2014.20.2.265
Leonel AJ, Alvarez-Leite JI. Butyrate: implications for intestinal function. Curr Opin Clin Nutr Metab Care. 2012;15(5):474‐479. doi:10.1097/MCO.0b013e32835665fa
Liang X, Bushman FD, FitzGerald GA. Rhythmicity of the intestinal microbiota is regulated by gender and the host circadian clock. Proc Natl Acad Sci U S A. 2015;112(33):10479‐10484. doi:10.1073/pnas.1501305112
Lozupone CA, Stombaugh JI, Gordon JI, Jansson JK, Knight R. Diversity, stability and resilience of the human gut microbiota. Nature. 2012;489(7415):220‐230. doi:10.1038/nature11550
Macfarlane GT, Steed H, Macfarlane S. Bacterial metabolism and health-related effects of galacto-oligosaccharides and other prebiotics. J Appl Microbiol. 2008;104(2):305‐344. doi:10.1111/j.1365-2672.2007.03520.x
Meyer JD, Koltyn KF, Stegner AJ, Kim JS, Cook DB. Influence of Exercise Intensity for Improving Depressed Mood in Depression: A Dose-Response Study. Behav Ther. 2016;47(4):527‐537. doi:10.1016/j.beth.2016.04.003
Parnell JA, Reimer RA. Prebiotic fiber modulation of the gut microbiota improves risk factors for obesity and the metabolic syndrome. Gut Microbes. 2012;3(1):29‐34. doi:10.4161/gmic.19246
Pinder RM, Sandler M. Alcohol, wine and mental health: focus on dementia and stroke. J Psychopharmacol. 2004;18(4):449‐456. doi:10.1177/0269881104047272
Plovier H, Everard A, Druart C, et al. A purified membrane protein from Akkermansia muciniphila or the pasteurized bacterium improves metabolism in obese and diabetic mice. Nat Med. 2017;23(1):107‐113. doi:10.1038/nm.4236
Queipo-Ortuño MI, Boto-Ordóñez M, Murri M, et al. Influence of red wine polyphenols and ethanol on the gut microbiota ecology and biochemical biomarkers. Am J Clin Nutr. 2012;95(6):1323‐1334.doi:10.3945/ajcn.111.027847
Ríos-Covián D, Ruas-Madiedo P, Margolles A, Gueimonde M, de Los Reyes-Gavilán CG, Salazar N. Intestinal Short Chain Fatty Acids and their Link with Diet and Human Health. Front Microbiol. 2016;7:185. Published 2016 Feb 17. doi:10.3389/fmicb.2016.00185
Ruairi Robertson,PhD. 10 Ways to Improve Your Gut Bacteria, Based on Science. healthy.net
Slavin J. Fiber and prebiotics: mechanisms and health benefits. Nutrients. 2013;5(4):1417‐1435. Published 2013 Apr 22. doi:10.3390/nu5041417
Sonnenburg ED, Smits SA, Tikhonov M, Higginbottom SK, Wingreen NS, Sonnenburg JL. Diet-induced extinctions in the gut microbiota compound over generations. Nature. 2016;529(7585):212‐215. doi:10.1038/nature16504
Sullivan A, Edlund C, Nord CE. Effect of antimicrobial agents on the ecological balance of human microflora. Lancet Infect Dis. 2001;1(2):101‐114. doi:10.1016/S1473-3099(01)00066-4
Thaiss CA, Zeevi D, Levy M, et al. Transkingdom control of microbiota diurnal oscillations promotes metabolic homeostasis. Cell. 2014;159(3):514‐529. doi:10.1016/j.cell.2014.09.048
Vulevic J, Juric A, Tzortzis G, Gibson GR. A mixture of trans-galactooligosaccharides reduces markers of metabolic syndrome and modulates the fecal microbiota and immune function of overweight adults. J Nutr. 2013;143(3):324‐331. doi:10.3945/jn.112.166132

人体肠道微生物群是一个复杂的生态系统,可以调节宿主与环境的相互作用。同样的功能性食品或药物在不同人身上可能存在生物利用度差异许多药物会对人产生不同的影响,举个例子,大约40%的抑郁症患者对抗抑郁药物反应不佳,其中一个重要的原因是个人肠道微生物差异造成的。
之前的文章我们已经知道,用药(例如抗生素)会影响肠道菌群,从而影响健康。但肠道菌群和药物(非抗生素药物)之间的关系更多的是双向作用:肠道菌群不仅受药物影响,肠道微生物可以通过酶作用改变药物结构,改变药物的生物利用度、生物活性或毒性,从而提高药物的疗效和安全性。例如,口服抗病毒药物布里夫定可以被宿主和肠道微生物区系代谢为溴乙烯基尿嘧啶,后者具有肝脏毒性。
此外,用于治疗帕金森病的左旋多巴是微生物影响药物疗效的一个典型的例子:研究表明,代谢左旋多巴药物的酶(TyrDC)是由粪肠球菌驱动的。在粪肠球菌中突变tyrDC可以阻止细菌从左旋多巴到多巴胺的代谢,从而提高药物疗效。
本文综合整理研究文献综合阐述肠道微生物如何影响药物药效和功能性食品的生物利用度。
首先,我们来了解下,什么是生物利用度?
生物利用度:是指药物活性成分从制剂释放吸收进入全身循环的程度和速度。也就是说吃的功能性食品的成分或者药物成分被生物体特定部位吸收和利用的程度和速度。
口服药物的生物利用度取决于到达全身循环前肠道和肝脏酶的首次代谢程度。然而,口服药物在到达宿主组织之前可能会遇到一个重要部位——肠道微生物群。
最近,肠道微生物群在研究方面取得了巨大进展,肠道微生物群对功能性食品或药物中成分利用的影响可能解释了这种差异。
◆ ◆ ◆ ◆
在人类历史上,大量肠道细菌已经在人类肠道内定植。这些微生物由于其丰富的数量和重要的作用被称为人体第二基因组。
肠道微生物群也被发现是能量获取的一个强有力的调节器;因此,已显示出与诸如脂代谢、糖代谢、肠道感染、脑功能、免疫和肿瘤发生等过程的显著相关性。肠道菌群受到遗传和环境因素的影响,当然环境因素更重要。
肠道微生物群可以帮助宿主通过仅由细菌分泌的酶和粪便能量的排泄来消化摄入的食物或药物。 研究表明,主要的代谢反应是由肠道微生物酶进行的,包括β-葡萄糖苷酶、β-葡萄糖醛酸酶、氮还原酶、硫酸盐酶、硝基还原酶和硝酸盐还原酶。重要的生物转化,包括还原代谢、水解反应、去甲基化、脱氨、脱羟基化、去酰化、脱羧和氧化,被认为是由特定的肠道微生物进行的。
肠道微生物对食物的消化和有益的生物活性物质的合成有重要影响,如短链脂肪酸(SCFAs)和维生素,以及有害分子,如脂多糖(LPSs)、支链氨基酸(BCAAs)、胆汁酸和三甲胺(TMA),TMAN-氧化物(TMAO)的前体。
因此,尽管有些物质对人类健康有直接影响,但许多生物功能是由肠道微生物从食物或药物中转化而来的小生物活性分子发挥的。
异源物质代谢的微生物学机制/通路
肠道微生物群通过催化各种生物转化直接与外源生物相互作用。反过来,许多外来生物抑制微生物生长或造成细胞损伤。
间接相互作用,包括微生物对宿主异种代谢成分的表达和活性的影响。
◆ ◆ ◆ ◆
膳食纤维可直接代谢为生物活性物质,即对提高短链脂肪酸水平具有生物效应的物质,短链脂肪酸可通过富集短链脂肪酸生产者从膳食碳水化合物中获得。另一方面,基于肠道菌群的功能,膳食纤维还可以通过重塑肠道菌群结构来降低TMA、TMAO和LPS的代谢。
重要的是,即使我们发现某些水提取物或功能性食品或药物的粗提取物具有生物效应,这些提取物本身也很有可能不具有生物效应,而肠道微生物群产生的小生物活性物质很可能在这些生物过程中发挥作用。
有研究表明,肠道微生物群通过四种途径对生物活性小分子的形成有显著影响。接下来主要来介绍下这四种途径。
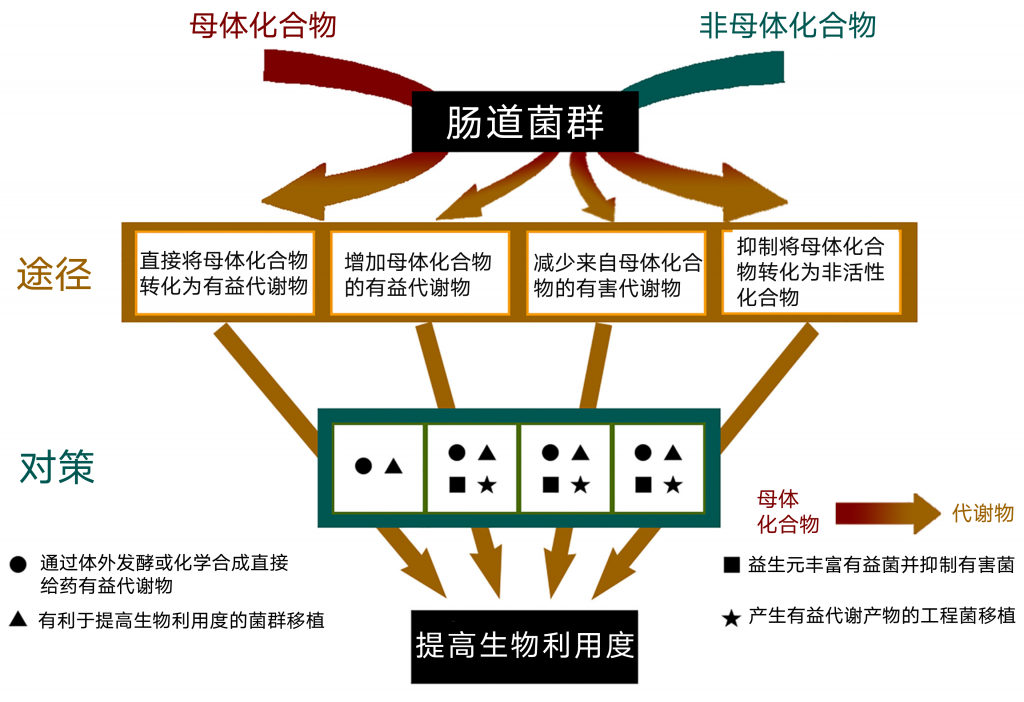

肠道微生物通过四种途径提高摄入物质的生物利用度,以促进这些物质的治疗效果。 这四条途径也为随后在寻找功能性食品和新药方面的突破奠定了基础。
◆ ◆ ◆ ◆
途径1肠道微生物将母体化合物直接转化为有益代谢物
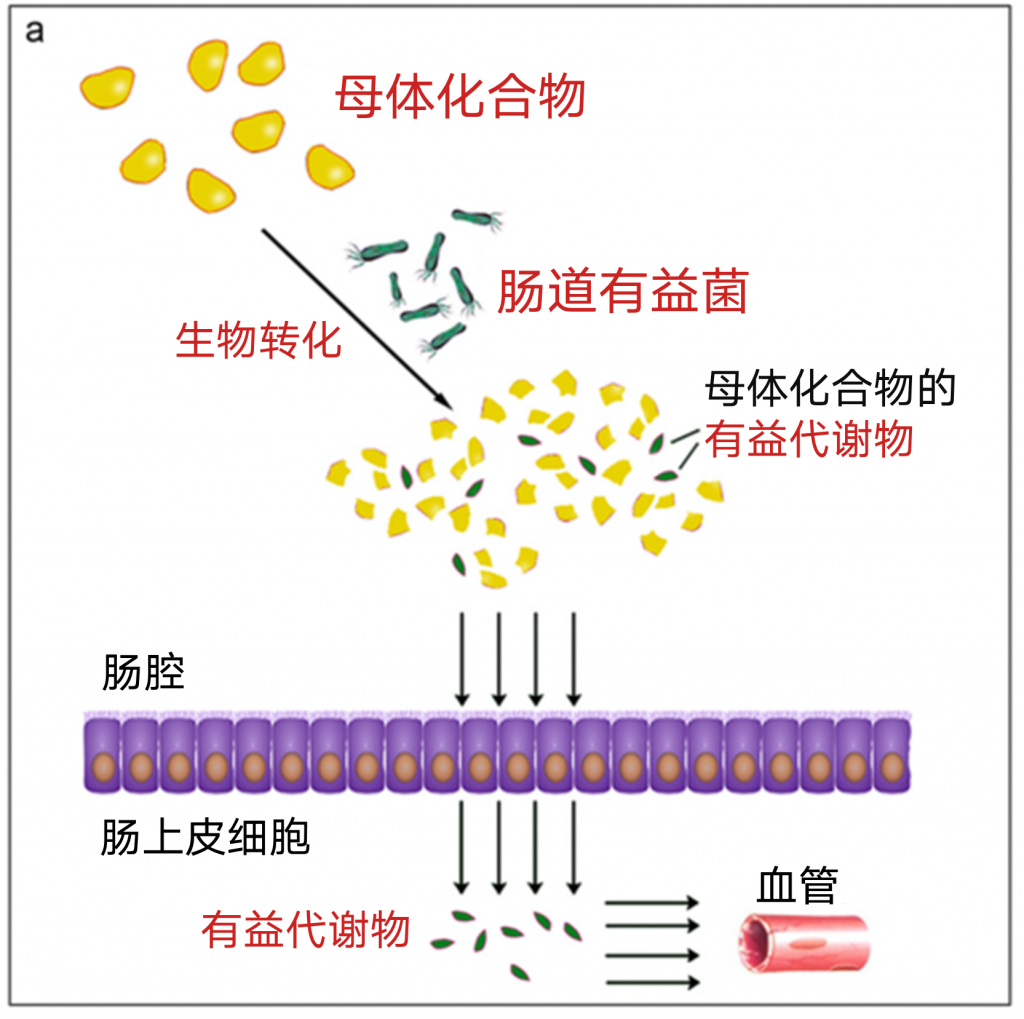

大量证据表明,肠道微生物群可以与不可消化的膳食化合物和草药(如多糖、低聚糖、皂甙和酚类化合物)相互作用,直接将这些分子转化为更活跃的化合物,提高其口服生物利用度。
注:什么是母体化合物?
命名有机化合物时,常把选定为命名主体的化合物也称母体化合物。在系统命名法中,选出最长的碳链的化合物就是母体化合物。
1
难消化的碳水化合物
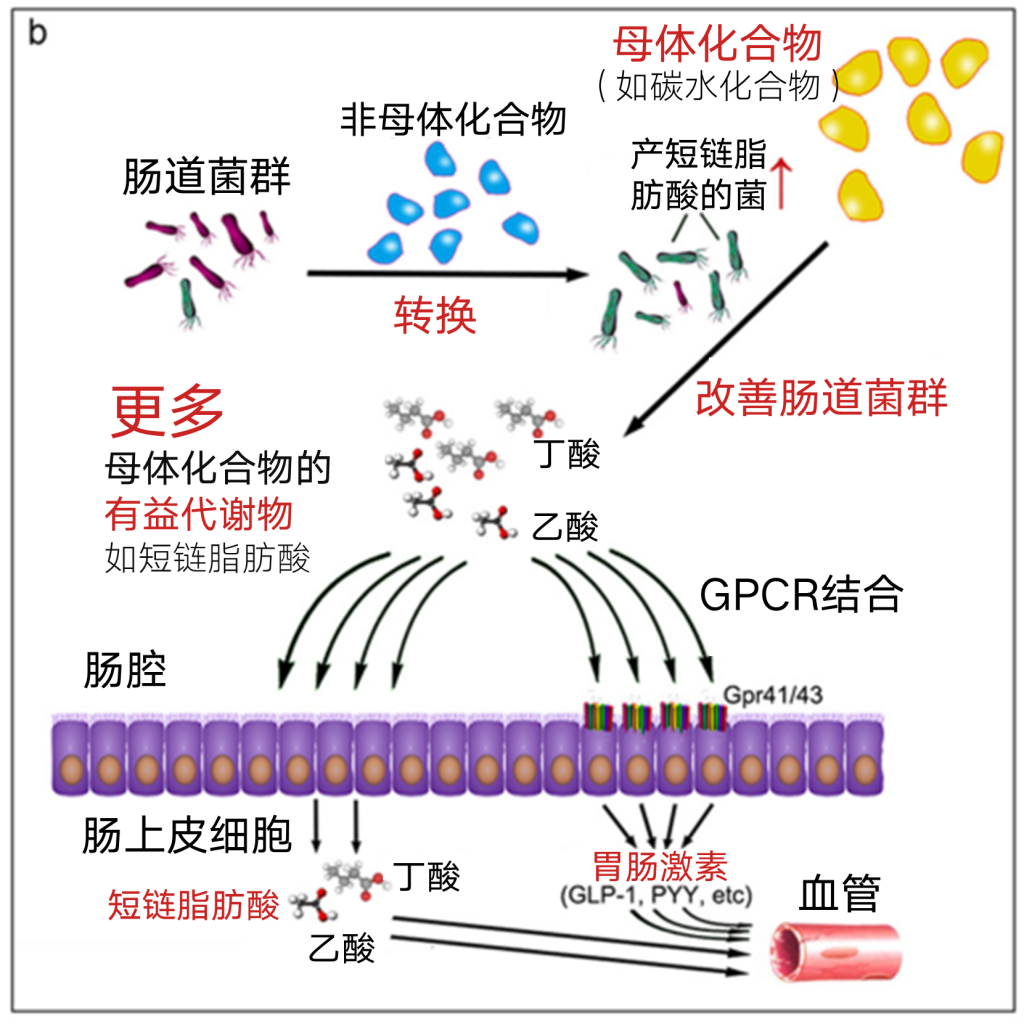
碳水化合物包括膳食纤维、多糖和低聚糖,已被证明是许多药物和功能性食品的活性成分。然而,这些化合物在小肠内不易消化。许多研究表明,重要的代谢产物短链脂肪酸是潜在有益菌发酵多糖或低聚糖的主要最终产物。
在一项随机对照临床研究中,膳食纤维能极大地富集乙酸和丁酸产生菌。因此,在干预期间,这两种SCFAs的浓度也随之升高。2型糖尿病(T2DM)的缓解与肠道微生物群的改善、SCFA生成的上调、血清胰高血糖素样肽1(GLP-1)和肽YY(PYY)水平的升高有关。值得注意的是,根据15个SCFA生产商的数学模型,提高一个指数可以预测糖化血红蛋白(HbA1c,一个重要的糖代谢参数)的减少,表明有益肠道细菌产生的SCFAs在缓解T2DM中的重要作用。
药用和食用植物以及海洋生物中的多糖不仅被代谢产生高水平的SCFA,还可以减少代谢综合症或发挥免疫调节功能;此外,这些化合物通过富集产生SCFA的肠道细菌在临床应用中表现出更好的治疗效果。
例如,灵芝多糖可以调节肠道菌群(改变下图中菌群相对丰度),在生物活性中发挥核心作用,提高大鼠肠道SCFAs和分泌性免疫球蛋白a的浓度。高脂肪饮食消耗与血清LPS水平升高有关,也称为代谢性内毒素血症。代谢性内毒素血症诱导肝脏和脂肪组织炎症,激活肝脏TLR4途径。高脂肪饮食消耗还伴随着胰岛素抵抗导致的肝脂肪生成增加,而灵芝水提物减少了代谢改变。
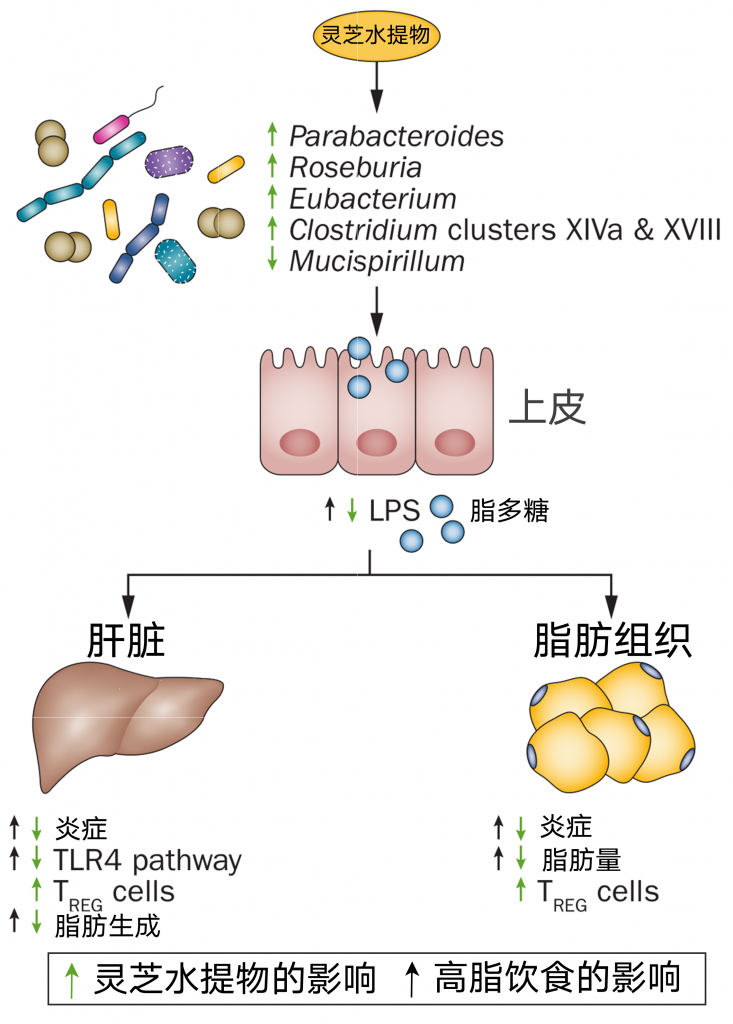

玉竹多糖能使高脂饮食(HFD)大鼠受损肠道菌群组成恢复到正常对照组水平增加产生SCFA的细菌的数量,这与肥胖参数的改善相关。
冬虫夏草多糖能显著提高肠道菌群产生的丁酸盐水平,不仅能改善组蛋白H3乙酰化,介导T(Treg)细胞特异性Foxp3,而且能显著逆转环磷酰胺诱导的小鼠白细胞介素17(IL-17)和IL-21水平的升高。
寡糖对肠道菌群有明显的调节作用,导致各种SCFAs的产生,对代谢紊乱和结肠运动有良好的影响。
例如,低聚果糖(FOS)、低聚半乳糖(GOS)和低聚异麦芽糖(IMO)处理增加了SCFA产生菌的水平,包括乳酸杆菌和双歧杆菌。
丁酸等短链脂肪酸能纠正无菌小鼠的运动,可能是通过增加肠神经元的组蛋白H3乙酰化,从而通过增强迷走神经活动减轻便秘。
此外,FOS的摄入促进了胃饥饿素、葡萄糖和胰岛素水平的降低和PYY水平的升高。
低聚木糖(XOS)和菊糖型果聚糖还可以增加双歧杆菌的数量,增加丁酸和乙酸的含量,显著缓解慢性肾脏疾病和溃疡性结肠炎。
因此,虽然含有多糖或寡糖的中草药和功能性食品的生物利用度较低,但有益菌从这两种复杂的碳水化合物成分代谢而来的SCFAs可能是关键的生物活性分子。检测短链脂肪酸水平可能比关注含有这两种复合碳水化合物的草药和功能性食品的生物利用度重要得多。
肠道微生物群主要通过琥珀酸途径、丙烯酸酯途径和丙二醇途径从碳水化合物中生物转化出丙酸等短链脂肪酸。琥珀酸途径是许多拟杆菌合成丙酸的主要途径。琥珀酸途径也存在于黄色瘤胃球菌中,产生琥珀酸,但不是丙酸,琥珀酸是丙酸的前体。乳酸转化为丙酸的过程包括琥珀酸途径和丙烯酸酯途径,这在韦荣氏球菌属(通过琥珀酸途径)和巨球形菌属 /巨球形菌属(通过丙烯酸酯途径)中观察到。大肠杆菌、粪厌氧棒状菌和拟杆菌都可以降解通过丙二醇途径还原糖。
SCFAs可与肠上皮细胞上的G蛋白偶联受体(GPCRs)结合,主要是GPR41(称为FFAR3)和GPR43(称为FFAR2),调节炎症反应,并触发肠激素分泌,主要是GLP-1和PYY。GPR41和GPR43被发现存在于肠细胞以外的其他细胞,如脂肪细胞、内分泌细胞和免疫细胞。血流中的SCFA可以到达这些细胞并与这些SCFA敏感受体结合。
皂苷
已发现许多循环不良的生物可利用的草药在不产生SCFA的情况下发挥药理作用。近年来,越来越多的生物活性分子被肠道微生物群从这些功能性药物中代谢出来。皂苷是具有抗炎和抗癌活性的有价值的生物活性成分。然而,这些分子很难被人体血液吸收,导致在人体组织中的功效很低。
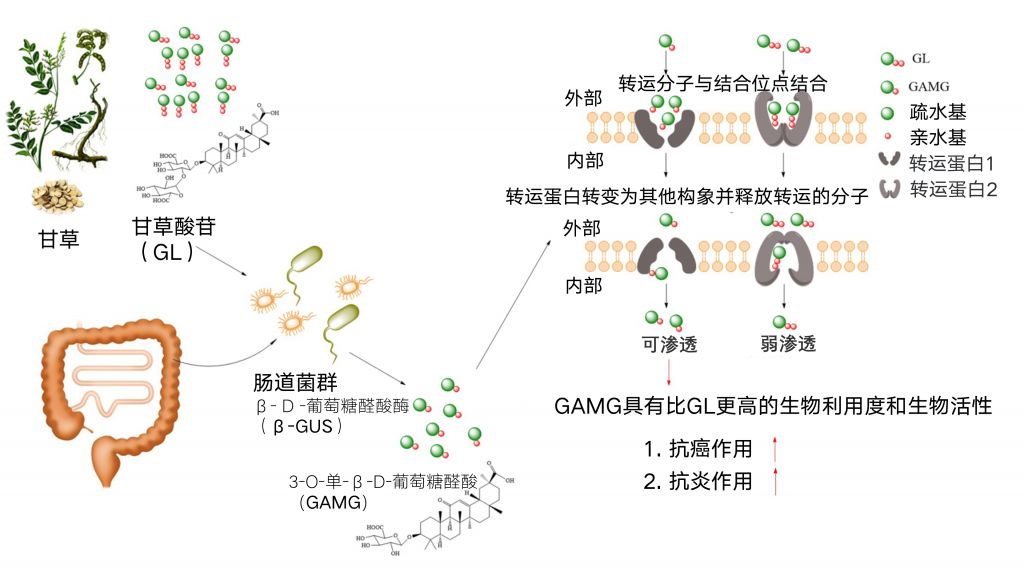
肠道微生物群通过将这些化合物转化为有益的代谢物,为克服皂苷的生物利用度差提供了新的机会。其中甘草酸苷(glycyrrhizin,GL)是从甘草中提取的一种典型的三萜皂苷,具有抗病毒、抗氧化、抗癌、抗炎等多种药理作用,引起了人们的广泛关注。它也是少数几个经过特定肠道微生物群代谢后相对明朗的成分之一。
基于这一发现,甘草次酸3-O-单-D-葡萄糖醛酸(GAMG)是一种比母体化合物GL具有更高生物利用度的代谢物,已在日本食品和制药工业中通过直接生物转化进行商业开发。
当人体口服GL时,不易从肠道吸收到血液中,由于其结构由两个葡萄糖醛酸分子组成,具有强极性。然而,GL的一个末端葡萄糖醛酸可以被来自肠道细菌的β-D-葡萄糖醛酸酶(β-GUS)水解,然后转化为GAMG,GAMG表现出适度的膜通透性和适当的分子极性,可能是由于该分子中的糖结合,导致生物利用度的提高。
肠道细菌,包括真杆菌属GLH、瘤胃球菌属PO1-3和无害梭菌ES24-06,在改变GL的化学结构以产生其他相关的肠道吸收代谢物(如GAMG、3-α羟基甘草次酸[3α-羟基GA]和3-氧代甘草次酸[3-oxoGA])方面发挥着重要作用具有较强的药理活性(下图)。
图 途径1应用前景良好的典型例子:通过调节肠道菌群将母体化合物(如甘草酸)代谢为增值化合物。

Timosaponin AIII(TA)是另一种皂甙类化合物,通过肠道微生物群对TA的糖基部分进行裂解,在肠道内代谢为活性代谢物sarssapogenin(SG),发挥多种药理作用。
有趣的是,与母体化合物(TA)相比,SG具有更高的抗炎作用,主要通过抑制LPS刺激的巨噬细胞中NF-B活化和促炎细胞因子(肿瘤坏死因子α[TNF-]、IL-1 和IL-6)的表达。
人参,其药理活性主要归因于人参皂甙,通常表现出恢复作用,强直性和振兴作用。人参和人参源性三萜皂苷,人参皂苷Rb1,根据肠道细菌Rb1水解电位的不同,在个体患者中表现出不同的疗效。
结果还表明,Rb1作为一种天然前药口服后,不能被天然形式的高吸收以发挥健康效益。Rb1可水解成其活性形式20-O-β-D-吡喃葡萄糖基-20(S)-原人参二醇,通过糖基部分的裂解使Rb1水解肠道细菌,使Rb1到达血浆,从而发挥其强大的抗转移活性。这些研究揭示母体皂甙被脱糖基化为相应的代谢物以发挥生物活性,主要由肠道微生物群分泌的消化酶介导。
2
酚类化合物
酚类化合物,分为黄酮类和非黄酮类,在食用植物中普遍存在。这些化合物具有很强的抗氧化作用,影响人体健康。然而,这些化合物的生物利用度因其巨大的结构多样性而不同。一部分酚类化合物被宿主衍生酶转化为生物活性代谢物,而另一部分酚类化合物不被小肠吸收,可能被肠道微生物群发酵和转化。
2.1 芹黄素-7-葡萄糖苷(A7G)
黄酮是主要的黄酮类化合物,芹黄素是黄酮苷元。芹黄素-7-葡萄糖苷(A7G)是芹黄素的母体化合物,具有抗突变、抗增殖和抗过敏作用。
通过将A7G应用于无菌大鼠和人类微生物群相关的大鼠,Hanske等人结果表明,无菌大鼠的尿液和粪便中A7G代谢物相对较少;无菌大鼠和人类微生物群相关大鼠中A7G代谢物主要分别为芹菜素和3-(4-羟基苯基)丙酸,无菌大鼠血液中检测到的化合物为芹黄素结合物,而在人类微生物群相关大鼠血液样本中检测到的化合物是根皮素。
这些结果表明,人体肠道菌群影响A7G代谢,影响黄酮类化合物的生物利用度。
2.2 花青素
花青素,另一种类黄酮,在以前的研究中被误认为比其他类黄酮亚类生物利用度低得多。最近的研究表明花青素是非常有效的,这些化合物的生物利用度被低估了。大部分摄取的花青素可能到达结肠并被结肠微生物群代谢。通过给回肠造口患者喂树莓、蓝莓和葡萄,发现大约40%的摄取花青素残留在回肠排出物中。
在拥有完整结肠的健康人中,花青素可以进入结肠并被去糖基化。C环的解离导致苷元的分解,这些分子转化为若干酚类成分,并产生附加效应。
2.3 姜黄素
作为黄酮类化合物的另一个例子,姜黄素在治疗某些疾病,包括癌症、心血管疾病、糖尿病、肝病和神经退行性疾病方面表现出抗氧化、抗炎、抗病毒、抗菌和有益的作用,受到了广泛的关注。
由于姜黄素结构中含有β-二酮,该化合物具有高的疏水性、低的溶解性和“生物利用度”,因此,每天大量摄入姜黄素,可以观察到对健康的促进作用。不幸的是,大量摄入姜黄素可能会产生有害影响并降低疗效,这会导致限制了姜黄素在疾病预防中的应用。
由肠道细菌产生的姜黄素代谢物具有生物效应,而不是姜黄素的原始形式。
据报道,姜黄素是由人肠道细菌Blautia 菌株MRG-PMF1通过甲基芳醚裂解,转化为去甲基姜黄素和双去甲基姜黄素的。有证据表明,未被吸收的姜黄素可以间接调节结肠微生物群,通过产生额外的生物可利用和生物活性分子(如二氧去甲基姜黄素和二甲氧基姜黄素)对多种疾病产生有益的影响。
以下是非黄酮类化合物。
2.4 绿原酸
作为常见的非黄酮类化合物,咖啡豆中含有丰富的绿原酸(没食子酸),可以防止人体低密度脂蛋白(LDL)的氧化,而LDL在动脉粥样硬化斑块的形成中起着关键作用。
斯大马等人的研究结果表明,绿原酸的吸收主要发生在大肠和小肠。大多数绿原酸完好无损地到达结肠,一些细菌产生一些酯酶来水解酚-奎宁酸键。释放的绿原酸很容易被细菌转化为二氢形式,如二氢铁酸和二氢咖啡酸,然后被结肠上皮吸收。其次,二氢阿魏酸、二氢铁酸硫酸盐等可在高浓度下进入循环。此外,一些其他生物利用度较低的酚类化合物,如迷迭香酸、依地考黄和一些槲皮素衍生物,被结肠微生物群发酵成可吸收和生物活性的酚酸,如羟基苯丙酸、苯丙酸和3,4-二羟基苯乙酸。
这些具有生物活性的微生物代谢物可被循环系统吸收和运输到器官和组织,或在肠腔发挥作用。
上述所有实例都表明,改善肠道微生物群可能是评价母体物质生物利用度的一个良好策略。然而,大量生物利用度较低的功能性食品和药物的代谢产物尚不清楚。此外,在确定提高食品和药物生物利用度的方法时,应考虑到单个肠道微生物的特性。
2.5 硫酸软骨素(CS)制剂
具体来说,口服硫酸软骨素(CS)制剂(一种高分子量的糖胺聚糖)已被用作治疗骨关节炎的药物很长一段时间。遗憾的是,临床试验中需要每天1200毫克才能观察到预期的疗效。CS在小肠的吸收率较低,口服后CS的生物利用度仅为0-13%。CS在胃和小肠中不可降解,口服后主要被结肠微生物群清除或降解。
通过分析6名健康受试者远端胃肠道肠道微生物群对CS的降解情况,研究人员发现每个个体的CS降解菌(多形拟杆菌J1、多形拟杆菌82、卵形拟杆菌E3和哈氏梭菌R4)具有不同的降解效果,但所有的产物都是2-乙酰氨基-2-脱氧-3-O-(β-D-葡萄糖-4-Δ 烯基吡喃糖醛酸)-4-Osulpho-D-半乳糖(Δ-UA-GalNAc4S)。
本研究表明虽然不同个体携带的细菌具有相同的功能,但该物种可能决定药物的降解率,从而导致生物利用度的差异。因此,我们认为,食品或药物的生物利用度不仅取决于物质本身,还取决于个人的肠道功能菌群。
◆ ◆ ◆ ◆
途径2非母体化合物富集的肠道细菌增加母体化合物的有益代谢产物
一些药物成分,如生物碱(黄连素等)和二甲双胍,不能被肠道菌群转化为短链脂肪酸,但这些化合物可以引发肠道菌群从膳食碳水化合物中产生短链脂肪酸的增加。

我们常见的药物黄连素是从黄连等中草药中提取的一种提取物,以前被认为是治疗腹泻的抗生素药物,最近在治疗2型糖尿病的过程中被发现能提高糖耐量。然而,由于黄连素口服生物利用度较低,其临床疗效难以解释。
与黄连素相比,二甲双胍具有较高的口服生物利用度,二甲双胍治疗代谢性疾病的作用疾病的机制被很好地理解,即通过激活AMP活化蛋白激酶(AMPK)抑制肝脏糖异生。最近的研究表明肠道微生物群对二甲双胍的疗效有重要影响。
来自欧洲分子生物学实验室联合其他众多研究机构的研究人员的一项研究发表在《Nature》,用784个可用的人类基因组数据对抗糖尿病药物二甲双胍进行了详细分析。
他们支持二甲双胍通过短链脂肪酸(SCFA)产生治疗作用的微生物介导,以及已知肠道不良反应背后潜在的微生物群介导的机制,即埃希氏杆菌属的丰度相对增加。
在二甲双胍治疗的控制下,一个在T2D中肠道微生物群移动的统一特征:产生丁酸菌减少。这些反过来又会引起功能性微生物群的变化,部分缓解了二甲双胍引起的变化。
二甲双胍和黄连素对HFD(高脂饮食)引起的肠道菌群组成改变有明显的对比作用。黄连素和二甲双胍富集了可能产生SCFA的细菌,包括支原体菌科的Allobaculum、拟杆菌、Blautia、Butyricicoccus和考拉杆菌属。有趣的是,某些类型的SCFAs甚至可以触发肠道微生物群产生其他类型的SCFAs或有机酸。
向HFD中添加单缬氨酸(MV)和三缬氨酸(TV)不仅可以改善脑中的缬草酸水平,还可以改善脑中的乙酸水平。然而,MV和TV有降低盲肠中乙酸浓度的趋势,提示盲肠中乙酸可以转移到大脑中。
此外,大脑中的乙酸水平与TM7、S24-7家族和rc4-4的丰度呈显著负相关,与盲肠微生物群中的
Anaeroplasma 和 Tenericutes 丰度呈显著正相关。这些结果提示,脑内乙酸水平的升高可能与MV和TV引起盲肠内微生物的改变有关。
总之,一些研究表明,某些药物和功能性食品的提取物生物利用度低,但对宿主健康影响大。非母体化合物可以通过调节肠道微生物群代谢母体化合物而不是对宿主产生直接影响来增强生物效应。
此外,一些生物活性分子的功能有时来源于有益细菌产生的母体化合物的代谢产物,如多糖和低聚糖,而不是母体化合物本身。然而,只有在摄入有益的食物或药物后,才能经常检测到生物活性效应。迄今为止,很少能够确定有益分子是通过肠道微生物群的代谢直接或间接发挥作用。因此,不容易区分途径1和2。研究人员认为有必要通过代谢组学研究和每一种单独的代谢产物与宿主表型的相关性分析来鉴定治疗分子,并试着增加这些分子在血液中的分布。
◆ ◆ ◆ ◆
途径3通过非母体化合物调节肠道微生物,减少母体化合物中有害代谢物
除了通过调节肠道微生物群来上调有益分子外,下调微生物群对有害分子的吸收也可能有益于人类健康。有害微生物也通过许多可预测的途径与宿主相互作用。
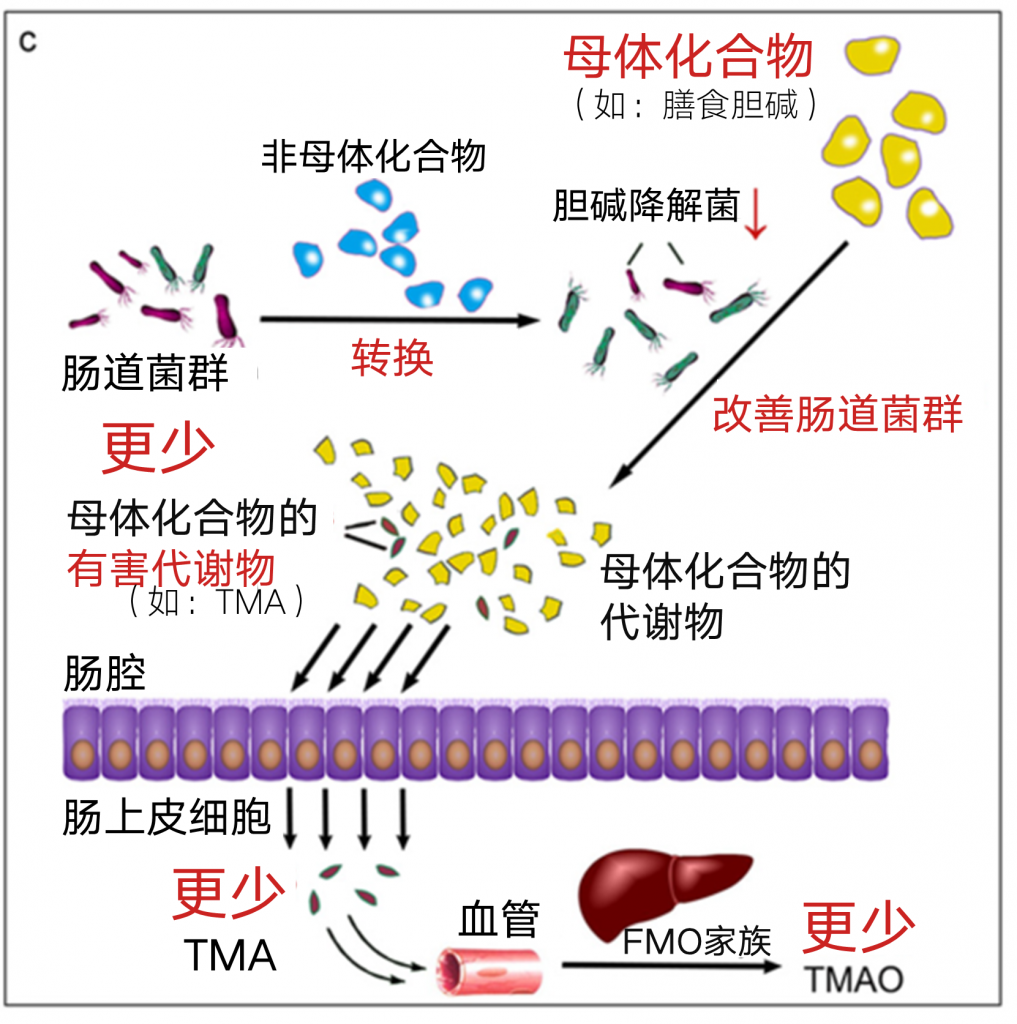

一些食物,如富含红肉的饮食,会诱发肠道微生物群产生有害分子,如TMA(三甲胺)/TMAO(TMA氮氧化物前体)和胆汁酸/胆固醇。越来越多的证据表明,生物利用度低的酚类植物化学物质可以降低有害化合物的水平,主要是通过肠道微生物群的重塑。TMA是由肠道微生物群降解胆碱和左旋肉碱而产生的,它被血液吸收,然后被肝脏的一种含黄素单加氧酶3(FMO3)迅速氧化为TMAO。
白藜芦醇(一种天然酚类化合物)通过重塑肠道微生物群来减少TMA和TMAO的合成。属级分析表明,白藜芦醇增加了拟杆菌、乳酸杆菌、双歧杆菌和阿克曼西亚的相对丰度。同时,白藜芦醇的使用导致普雷沃菌和瘤胃球菌科的相对丰度下降,TMA和TMAO的合成下降。除了天然药物,膳食纤维还通过改变肠道来降低TMAO水平微生物组。
研究表明,饲喂膳食纤维改变了小鼠肠道微生物生态,促进了阿克曼菌、双歧杆菌等的生长,抑制了有害物种的生长,通过重塑肠道微生物群落结构降低了TMA和TMAO的代谢。
此外,食物中的一些生物活性分子,如蒜素,也会影响TMA和TMAO的产生。
脂多糖(LPS)是革兰氏阴性菌的膜成分,是另一类非肠道代谢产物的有害物质。2018年研究结果表明,膳食纤维的摄入抑制了T2DM患者体内潜在有害细菌的生长,降低了LPS水平,但增加了SCFA产生菌的数量。洛佩兹等人提示染料木素作为大豆中的一种膳食生物活性成分,通过增加普氏菌属和阿克曼菌属的数量,对HFD小鼠肠道微生物群有调节作用。这些增加导致循环中脂多糖水平减少和代谢性内毒素降低。
另外,还有很多慢性肾脏病患者肠道微生物群的重建可以减少血液中有害的代谢产物,如由微生物群产生的硫酸吲哚和硫酸对甲酚。
总之,功能成分可以通过重塑肠道微生物群来减少有害肠道代谢物的产生。为了充分了解生物利用度,必须考虑到有害生物可利用分子水平的下降。因此,降低有害分子的生物利用度也可以缓解代谢疾病。在许多情况下,一些功能性食品或药物不仅可以增加有益菌(通常是SCFA产生菌)的数量,而且减少有害菌的数量以改善各种疾病。
◆ ◆ ◆ ◆
途径4抑制特定的肠道细菌,使母体化合物由非母体化合物转化为非活性形式
在途径1中,我们描述了一组能够将非活性成分转化为高效生物活性和可吸收的化合物。相反,特定肠道细菌对药物或食品中某些功能成分的降解会降低这些化合物的生物利用度。与在途径1中富集有益菌的策略相反,抑制降解生物活性母体药物的肠道细菌的有效方法可能增加这些药物的生物利用度。

口服给药后,药物在肠道和肝脏经历首次通过代谢,这主要影响药物的疗效和不良反应。许多药物进入肠道,由肠道微生物群代谢,导致疗效降低。例如,齐默尔曼等人发现在哺乳动物肠道菌群中代表5个优势门的8种细菌,多形拟杆菌和卵形拟杆菌在将BRV转化为BVU方面表现出最高的代谢活性,而BVU则能与其他药物相互作用并引发致命影响。
索里夫定(SRV),在结构上类似于BRV,可以被多形拟杆菌缓慢地转化为BVU。多形拟杆菌还可以参与二硫卓的脱乙酰化反应,生成脱乙酰二硫卓。此外,舒林酸被肠道微生物群还原为硫舒林酸。地高辛在体外可以转化为二氢地高辛和二氢地高辛。这些衍生物导致心脏活动减弱。
一些研究表明,某些化学键可以被特定肠道细菌携带的酶转化。例如,抗炎药物磺胺吡啶的偶氮键被结肠细菌偶氮酶还原成氨基水杨酸和磺胺吡啶。磺胺吡啶在结肠中的吸收会导致一些不良反应,如恶心、皮疹、头痛、头晕和食欲下降。
硝基安定在肠道细菌酶的催化下发生了硝基还原反应,但其产物具有致畸作用。肠道微生物群主要参与一种修饰,其中佐尼酰胺主要通过还原苯并异唑环转化为2-氨磺酰乙酰基苯酚。
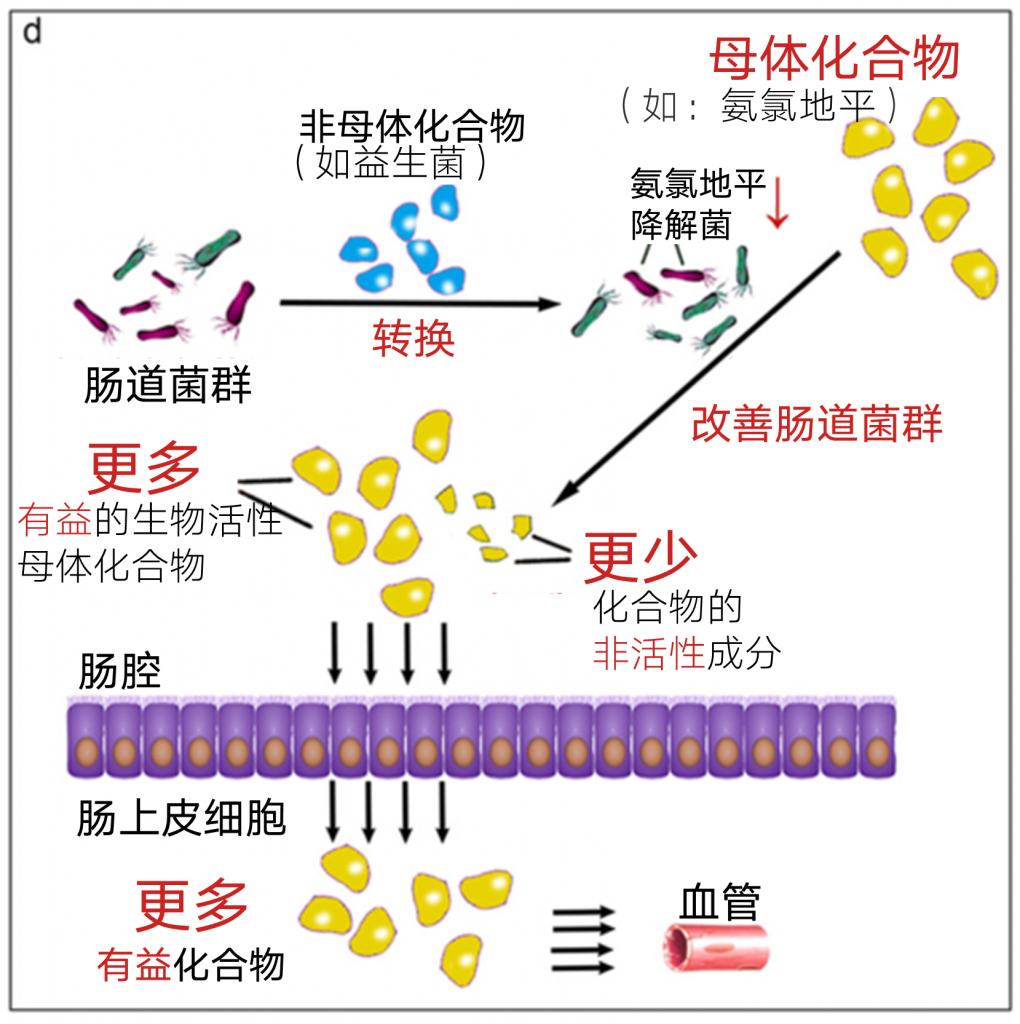
另一个例子巧妙地证明了肠道微生物对活性母体药物降解为非活性成分的影响。 氨氯地平是治疗高血压最常用的处方药之一,在胃肠道被吸收,口服后生物利用度约为60%。一些肠道微生物靶向方法已经被开发出来以提高生物利用度。
结果表明,氨氯地平与抗生素合用可增加胃肠道对氨氯地平的吸收。 研究人员发现氨氯地平可以被肠道微生物酶代谢,产生主要的吡啶代谢物,这表明肠道微生物与氨氯地平的代谢有关。 此外,氨氯地平与抗生素的联合给药使氨氯地平人血浆浓度增加到氨氯地平单药组的近两倍。
抗生素的使用可以改变肠道微生物群,导致合用抗高血压药物的代谢变化。这一发现有力地表明肠道微生物群可能影响抗高血压药物的药代动力学。然而,抗生素有引起肠道微生物群失调的相关风险,这限制了抗生素的使用提高氨氯地平生物利用度的化合物。
与氨氯地平单药治疗相比,与植物乳杆菌IS-10506合用能显著提高氨氯地平的浓度。研究人员推测植物乳杆菌IS-10506可以增强红细胞和红细胞压积,导致较低的沉降率和血浆蛋白水平的增加,而血浆蛋白与氨氯地平结合。
此外,益生菌大肠杆菌Nissle 1917的活菌悬液增强了抗心律失常药物胺碘酮在大鼠和嗜酸乳杆菌、乳酸双歧杆菌和鼠李糖乳杆菌混合培养物中的生物利用度,增加了糖尿病大鼠对抗糖尿病药物格列齐特的生物利用度。有益菌可以限制竞争性机会病原体的扩张。
因此,在我们看来,这种生物利用度的提高可能与由于有益菌的竞争压力而导致的药物降解细菌的数量减少有关。
益生元也能调节肠道微生物群。据报道,益生元的使用还可以增强某些母体化合物的吸收。例如,染料木苷和FOS的合用提高了染料木苷的吸收,导致该化合物高效地到达其靶组织,如骨。然而,根本机制尚未得到解释。
另外,肠道微生物可以通过相应的代谢物与肝脏和其他器官的受体相互作用。吲哚是微生物色氨酸代谢产物,已被证明能诱导一些细胞色素P450s,它们负责大多数治疗药物的代谢,并通过芳香烃受体介导的机制在生物利用度和药物相互作用中发挥重要作用肝脏。
此外,抗生素还降低了肝细胞色素P450 3a的表达和酶活性,无论是直接(肠内)还是间接(肝内)影响首次通过代谢,肠道微生物群都可能在这些过程中发挥重要作用。综上所述,这些结果表明抗生素、有益细菌和益生元能够通过抑制药物降解菌的数量来增加某些口服药物的吸收。
◆ ◆ ◆ ◆
肠道微生物与药物之间的相互作用是复杂的和双向的:肠道微生物群的组成可以受到药物的影响,但反之亦然,肠道微生物群也可以通过酶促改变药物的结构并改变其生物利用度、生物活性或毒性(药物微生物学)来影响个人对药物的反应。
同样的功能性食品或药物在不同人身上可能存在生物利用度差异,结合肠道菌群健康检测可以了解更多关于自身肠道菌群丰度,未来研究方向或以这样的形式展开:在开药方之前对一个人的微生物群进行评估,他的微生物群需要预先调整以增强药物的效果,或者可能会开出一种不同的药物,这种药物的设计对某些细菌具有更强的耐受性。
另外也可以考虑靶向抑制剂疗法,通过靶向抑制剂来抑制功能性成分的细菌降解以提高药物和食品的生物利用度,当然也需要考虑这两者之间的相互作用以及是否会人体产生副作用。
总而言之,肠道菌群调节将是一种新的策略,用于提高生物利用度、减轻副作用以及开发和设计新型药物。与人类基因不同,肠道微生物群是可修改的,使其成为优化治疗的有吸引力的治疗目标。在癌症治疗中,肠道微生物群也可以间接影响个体对免疫治疗的反应。了解微生物群是如何代谢药物和降低治疗效果的,将开启调节肠道微生物群以改善治疗的可能性。
【附录】
质子泵抑制剂(PPI)
质子泵抑制剂是世界上最常用的药物之一,用于治疗消化不良以及与胃酸相关疾病,以及预防非甾体丙氨酸炎性药物引起的胃十二指肠病和出血。
来自荷兰的大规模基于人群的研究表明,PPI是与肠道微生物群多样性减少和分类变化最相关的药物。这项分析表明使用PPI的人群中有高达20%的人,体内菌群的相对丰度发生了改变(或减少或增加)。
在一项分析1827对双胞胎粪便样本的16S数据的研究中观察到,微生物多样性较低,肠道共生菌的丰度也较低。总体而言,PPI使用者粪便样本的分类变化显示,肠道共生菌数量减少,口腔细菌数量增加。
一项使用了宏基因组测序的研究表明,PPI与24个分类群和133条代谢通路显著相关。预测的功能变化包括脂肪酸和脂质生物合成的增加,发酵烟酰胺腺嘌呤二核苷酸(NAD)的代谢,L-精氨酸的生物合成和嘌呤脱氧核糖核苷的降解。PPI引起的胃酸降低被认为是观察到的微生物变化的原因,因为它使口腔细菌能够在肠道微生物群中定居,从而导致分类上的同源性变化。
二甲双胍
二甲双胍是一种口服降糖化合物,用于治疗2型糖尿病(T2D)。二甲双胍可以抑制肝脏的糖异生,它的一些有益作用是由肠道微生物群介导的。
在一项对健康志愿者的干预研究中,与接受安慰剂的对照组相比,使用二甲双胍导致了超过80种物种的变化。二甲双胍治疗显著增加了大肠杆菌,降低了肠杆菌丰度。随后,将接受二甲双胍治疗或安慰剂治疗的捐赠者的粪便样本移植到无菌小鼠身上,观察到接受二甲双胍治疗志愿者粪便样本的小鼠血糖水平较低,这意味着肠道微生物群对血糖水平有直接影响。此外,在临床上,服用二甲双胍的患者中有多达三分之一的人报告了腹泻、腹胀和恶心等胃肠道副作用。
二甲双胍和肠道微生物群之间的关系揭示了一种常用药物如何改变肠道微生物群,并解释该药物的部分治疗功能,以及它的一些副作用。
需要注意的是,在对特定疾病或情况进行微生物组研究时,要严格控制混杂因素,如药物使用(包括二甲双胍、抗生素、PPI和其他药物)。
其他常用非抗生素药物
其他常用药物,包括泻药、他汀类药物、抗抑郁药和阿片类药物,也导致了肠道微生物群组成的一些差异。在服用泻药的个体中观察到拟杆菌的数量增加。
在一项对暴露在聚乙二醇(PEG)中的小鼠的独立研究中,发现拟杆菌增加。PEG诱导的轻度渗透性腹泻导致肠道微生物群的长期变化,粘液屏障的短暂破坏,以及随后的先天和获得性免疫反应。
在小鼠身上的发现,泻药的使用很可能对肠道微生物群组成有短期和长期影响,这些影响与粪便浓度和每个样本的细菌数量无关。
【参考文献】
Zhang F, He F, Li L, Guo L, Zhang B, YuS, Zhao W. 2020. Bioavailability based on the gut microbiota: a new perspective. Microbiol Mol Biol Rev 84:e00072-19. https://doi.org/10.1128/MMBR.00072-19
The microbial pharmacists within us: a metagenomic view of xenobiotic metabolism,Nat Rev Microbiol. 2016 April ; 14(5): 273–287. doi:10.1038/nrmicro.2016.17.
Haiser H J, Turnbaugh P J. Is It Time for a Metagenomic Basis of Therapeutics[J]. Science, 2012, 336(6086): 1253-1255
Kristoffer Forslund, Falk Hildebrand et al. Disentangling type 2 diabetes and metformin treatment signatures in the human gut microbiota[J].Nature,2015,528:262–266
Weersma RK, Zhernakova A, Fu J. Interaction between drugs and the gut microbiome [published online ahead of print, 2020 May 14]. Gut. 2020;gutjnl-2019-320204. doi:10.1136/gutjnl-2019-320204
Zimmermann M, Zimmermann-Kogadeeva M, Wegmann R, Goodman AL. Mapping human microbiome drug metabolism by gut bacteria and their genes. Nature. 2019;570(7762):462‐467. doi:10.1038/s41586-019-1291-

谷禾健康 编辑
刚刚,来自美国耶鲁大学的免疫学专家Martin Kriegel及其同事在自然评论《Nature Reviews》上在线发表了综合评论文章:Host–microbiota interactions in immune-mediated diseases(免疫介导疾病中的宿主-微生物群相互作用)。

以下是文章内容。
宿主-微生物相互作用是免疫系统发展的基础。 现代环境和生活方式的剧烈变化导致了这一古老进化过程的不平衡,同时免疫介导的疾病,如自身免疫性、过敏性和慢性炎症性疾病急剧上升。
本文从宿主-微生物免疫相互作用的进化概述开始,探讨了在宿主易感基因的背景下,微生物群如何促进免疫介导疾病的易感、起始和延续的机制。这些机制对未来以微生物群为中心的预防和治疗方法具有启示意义。
阅读本文前,可先浏览下文中名词解释
模式识别受体(Pattern recognition receptors)
先天免疫的关键检测系统,具有不同的类别,能够识别各种进化保守的微生物相关分子模式
Toll-Like 受体 (TLRs)
进化保守的模式识别受体识别表面以及内质体配体。
固有免疫
第一道防线,包括物理、化学和各种上皮和固有免疫反应,这些反应迅速(在数小时内)和专注于发现进化上保守的模式。
适应(获得)性免疫
第二道防线由淋巴细胞使用体细胞重排受体,可以识别任何抗原,最初是缓慢的(在几天内),然后形成免疫记忆。
淋巴集结(Peyer’s patches)
小肠的解剖结构由聚集的淋巴滤泡组成,在肠道相关淋巴组织中充当免疫传感器。
分泌型IgA
在粘液分泌物中发现的免疫球蛋白的主要亚类,通常以二聚体形式存在。
肠系膜淋巴结(Mesenteric lymph nodes (MLNs).)
肠系膜内有组织的次级淋巴器官,含有外周淋巴结的所有免疫成分,但接受来自肠道的引流淋巴。
抗菌肽
在屏障表面分泌小分子,具有抗菌活性,含有微生物和病原体。
核苷酸结合寡聚结构域(NOD)样受体
进化上保守的模式识别受体传感细胞内配体,如细菌肽聚糖。
炎症性肠病(IBD)
溃疡性结肠炎和克罗恩病的疾病谱,由于对肠道微生物、肠道上皮和周围组织的过度免疫反应而影响大或小的肠道
I型糖尿病(T1D)
器官特异性自身免疫性疾病,其特征在于内分泌胰腺,尤其是葡萄糖稳态所需的产生胰岛素的β-胰岛细胞的破坏。
自身免疫性胰腺炎
由于胰腺外分泌组织的自身免疫攻击引起的慢性器官特异性自身免疫疾病,并伴有血清IgG4升高。
系统性红斑狼疮(SLE)
慢性,全身性自身免疫综合症会影响肾脏,皮肤,关节,大脑和其他器官,但很少累及肠道。
自身免疫性肝炎
肝脏的慢性器官特异性自身免疫病,导致免疫细胞介导的肝细胞损伤,并与循环自身抗体有关。
无菌实验
培养或培养生物的环境,其中所有的微生物要么是已知的,要么是被排除在外的(无菌的)。
原发性硬化性胆管炎(PSC)
慢性自身免疫性疾病破坏肝脏外部和内部的胆管,通常与炎症性肠病有关。
病原微生物
菌群中所有可能致病的微生物,在体内稳态下均无害,但可在易感宿主中引起非传染性疾病; 区别于易感宿主中引起传染病的机会病原体。
移植物抗宿主病
来自供体(移植物)的免疫细胞对宿主组织的急性或慢性同种免疫攻击。 异体移植或干细胞移植后发生移植物抗宿主病。
类风湿性关节炎
系统性风湿性自身免疫病,主要引起广泛的关节内膜炎症(滑膜炎),导致小关节和大关节的软骨和骨质破坏。 它还会影响内部器官,例如肺,导致间质性肺疾病。
过敏性皮炎
皮肤炎性疾病,其特征是由皮肤屏障功能障碍和T helper 2细胞倾斜的免疫失调介导的慢性复发性瘙痒性皮疹。
干燥综合征
针对唾液和泪腺的慢性自身免疫性疾病,会导致眼睛和嘴巴干燥以及全身器官受累,并增加淋巴瘤的风险。
肾小球免疫复合物沉积
自体抗体-自体抗原复合物在肾脏肾小球的沉积,可导致肾脏损害和功能损害。
狼疮性肾炎
系统性红斑狼疮的肾脏炎症,由肾小球免疫复合物沉积和间质炎症引起。
亚急性皮肤红斑狼疮
红斑狼疮一种影响皮肤的红斑狼疮亚型,可与全身性红斑狼疮有关,由淋巴细胞浸润和皮肤中沉积的免疫复合物介导。
白癜风
一种T细胞介导的皮肤自身免疫性疾病,表现为由于T细胞介导的破坏而导致皮肤黑色素细胞丢失,随后皮肤脱色
多发性硬化
慢性进行性或复发性自身免疫性神经系统疾病,由于免疫介导的髓鞘破坏引起不同程度的中枢神经系统功能障碍。
模拟表位
模拟蛋白质、碳水化合物或脂类抗原的表位结构的肽序列;蛋白质自身抗原的一个模仿区可以模仿氨基酸的线性或构象延伸
脊柱关节炎
风湿性疾病谱,包括强直性脊柱炎,主要影响脊柱,导致融合或强直性关节炎。
脊椎关节炎还会累及周围关节、皮肤、肠道和眼睛。
免疫系统的进化不仅是为了抵御病原体,而且也是为了耐受进化到与宿主共生的有益微生物。从免疫学的观点来看,这可能是最好的例证,不仅可以抑制病理免疫反应,还可以通过调节性T(Treg)细胞识别自身抗原和普通抗原。因此,在免疫稳态下,免疫系统耐受有益的共生细菌,但在组织破坏或其他稳态扰动期间,可以对这些相同的微生物作出反应。
宿主抗原的自我—非自我鉴别是一个基本过程,是由明确的中心和外周耐受机制建立和维持的(见后面蓝色部分:免疫耐受的机制)。宿主免疫系统如何发展和对微生物群的反应仍然是一个自我—非自我辨别的免疫难题,人们对此知之甚少。
当耐受性机制被破坏时,免疫介导的疾病在遗传易发的个体中发生。 这些疾病的特点是免疫介导的组织损伤,要么针对自我抗原(自身免疫),移植或转染抗原(同种免疫),吸入或摄入的无害环境制剂(过敏)或在缺乏特定抗原(自身炎症)的情况下(方框2)。
人们越来越多地了解微生物群直接和间接调节耐受性过程,从而控制炎症反应。这些反应可能发生在屏障表面(例如粘膜上皮)和周围(例如血液和非肠器官),对宿主有可能产生长期影响。因此,微生物群丰度、功能或解剖定位的失调可能导致耐受性的丧失,从而导致炎症和免疫介导的病理的发展。
最近的研究强调了异常的宿主-微生物相互作用如何对免疫介导的疾病的发展和解决产生病理后果。
微生物对免疫介导的疾病的影响超出了微生物自然定植的屏障表面(即肠道、皮肤、肺和其他粘膜表面),延伸到影响非屏障器官的疾病,如肝脏、肾脏、关节、肺、眼睛和大脑。例如,对自身抗原的耐受性可能由于微生物的自身抗原同源物的表达而被破坏,或由于微生物依赖的翻译后修饰而增加自身抗原的免疫原性。在细胞水平上,免疫细胞从肠道向非肠道组织的迁移可能是微生物依赖的。
此外,某些肠道共生体可以在肠道外移位,导致与非肠道组织中免疫细胞的异常相互作用和耐受性的破坏。这些和其他例子正在改变我们对宿主-微生物关系如何影响免疫介导的疾病的理解的范式。
免疫耐受的机制
免疫耐受是由胸腺和骨髓的中枢机制以及次级淋巴器官和免疫激活部位的外周机制建立的。在胸腺中,与主要组织相容性复合物(MHC)I类或II类反应的T细胞被选择存活,分别导致CD8+或CD4+ T细胞的选择,而与自身过度紧密结合的T细胞不被选择存活并通过凋亡而死。
自身抗原由胸腺上皮细胞表达,表达受转录因子(如AIRE和FEZF2)的调控。骨髓中的B淋巴细胞也发生了类似的选择过程。 退出外围后,成熟的T细胞和B细胞受到额外的耐受性机制,因为中心耐受性(即去除对自我反应的发育中细胞)是不完整的。明确的直接和间接机制确保逃逸到边缘的自反应性淋巴细胞被抑制或移除。
调节性T细胞积极抑制自身反应性淋巴细胞,这些淋巴细胞也可以通过凋亡(如果对自我过度反应)、无反应(当通过抗原受体接收信号1而没有通过共受体接收信号2时,也称为无反应)来沉默,或者不知道自我抗原是否仅隐藏或表达在免疫特权部位,如眼睛、胎盘或睾丸。
宿主防御病原体是一个基本的生物过程。 原始防御反应依赖于生殖细胞编码的模式识别受体,如Toll样受体(TLRs)来识别和响应保守的微生物模式,如脂多糖(LPs),这些系统是先天免疫的组成部分。
随着多细胞真核生物的进化,选择性压力推动了二次反应的发展,通过体细胞重组和突变,理论上可以识别任何形式的非自身;这些系统统称为适应性免疫。
在脊椎动物中,先天和适应性免疫反应相互沟通,目的是识别和消除非自我,同时尽量减少对自我的损害。随着后生动物免疫系统的进化,耐受有益微生物的需要对这个系统施加了反选择性的压力。经过数千年的选择和反选择,后生动物已经进化出高度专业化的非自我识别系统,消除病原体和对有益微生物的耐受性。
间接证据证明,免疫介导的疾病在当代社会的兴起与宿主与其微生物之间的稳态崩溃有关。
微生物有助于消化、代谢、器官发育、免疫细胞和神经分化,与宿主生理学的古老进化相互联系。 某些微生物,如产碱杆菌属(alcaligenes spp),栖息在小鼠、非人类灵长类动物和人类的派尔集合淋巴结(Peyer‘s斑块,Peyer patch)中,以诱导免疫成分(大多数分泌性IgA),支持它们在上皮屏障之外的定植。产碱杆菌属和其他淋巴组织内的细菌通过诱导组织保护因子来促进关系。
其他,如小鼠分段丝状细菌(SFB),直接附着在小肠上皮细胞上,诱导胃肠免疫发育和宿主对病原体的保护免疫。在小鼠中,共生细菌也被树突状细胞携带到肠系膜淋巴结(MLNs),在那里它们局部诱导宿主保护性免疫反应。宿主-微生物共同进化因此导致了局部的、直接的肠道免疫相互作用,在MLNs、Peyer‘s斑块和上皮屏障上,通过先天和适应性免疫反应促进相互作用.
最后,抗生素的出现和卫生水平的提高改变了人类如何遇到外源和共生微生物。 在过去的几十年中,宿主-微生物相互作用的这种变化和免疫介导的疾病发病率的增加被认为是相互联系的。这种联系被称为“卫生假说”,并将过去几十年来发达国家免疫介导的疾病的迅速上升与宿主微生物多样性的下降和包括寄生虫在内的病原体的消除联系起来,特别是在生命早期。
对卫生假设的支持来自观察,即在新生儿时期减少微生物暴露(在人类群体中)或无菌状态(在动物中),在生命后期易患过敏和自身免疫性疾病。虽然人类仍然缺乏强有力的证据,但动物研究表明,带有微生物的新生儿定植有助于先天和适应性免疫发育,影响生命后期的炎症控制。因此,卫生假说将早期生命相互作用的破坏与微生物群和免疫介导的疾病如过敏和自身免疫联系起来。
防止对微生物产生旺盛免疫反应的最明显的方法是保持上皮屏障。 然而,屏障需要有选择性地渗透,使营养物质进入宿主,有益的微生物与免疫细胞相互作用,以促进成熟和分化。
粘膜屏障只含有单层上皮细胞,但被厚厚的粘液层和其他各种物理(例如蠕动)和生化手段(例如分泌型IgA、抗菌肽,如α防御素和c型凝集素,以及溶菌酶)屏蔽。
屏障功能是由复杂的细胞生物学过程维持的,这些过程受到严格的调控。 多种微生物信号促进肠道稳态、屏障完整性和免疫成熟,部分是通过先天和适应性免疫信号来实现的。例如,通过TLR途径激活强直性微生物是维持肠道屏障稳态和保护小鼠免受微生物依赖性结肠炎的必要条件。
同样,通过另一个细胞内天然免疫传感器家族的共生信号,核苷酸结合寡聚结构域(NOD)样受体,如NOD1,是小鼠肠道相关淋巴组织成熟和维持所必需的。
此外,与小鼠肠上皮细胞的共生相互作用诱导了血清淀粉样蛋白A等因子,这些因子是肠道t辅助17(Th17)细胞适应性免疫发育所必需的。
然而,影响适应性免疫成熟的共生物质的另一个例子是微生物衍生的短链脂肪酸(SCFAs)促进抗炎环境,以诱导Treg并促进小鼠的屏障稳态。适应性调节机制的丧失、屏障功能障碍或先天免疫缺陷都是免疫介导的肠道疾病的发病机制。
肠道屏障宿主-微生物群稳态的破坏增加了对微生物的旺盛免疫反应的可能性,从而促进炎症性肠病。同样,在这种情况下,对饮食成分的异常反应可能会发生,引发食物过敏和腹腔疾病。导致屏障完整性破坏的确切宿主-微生物相互作用仍有待确定。
先天和适应性免疫反应对肠道共生也可能发生在肠道外的器官。与肠道解剖连接的器官(特别是胰腺和肝脏)最有可能直接受到肠道微生物群及其产物的影响。胰腺从原始肠道的解剖发育导致腹膜后定位和与肠腔的功能连接。 这使胰腺特别容易受到肠道微生物易位的影响,在模型中促进1型糖尿病(T1D)和自身免疫性胰腺炎。
同样,肝脏和胆管在解剖学上来源于原始肠管,因此容易受到微生物群的直接影响。肝脏和MLNs都是肠道上皮、血管或淋巴屏障破坏后的“防火墙”,这些屏障容易受到肠道微生物免疫刺激。
因此,解剖上与肠道相连的器官,特别是胰腺和肝脏,可能受到微生物依赖的自身免疫的影响,并作为各种非肠道系统性自身免疫性疾病的放大器。
肠-肝轴在免疫病理中的作用被最近的肠道上皮屏障破坏导致肝脏和全身免疫病理的例子所强调。这些包括从小鼠小肠转运到MLNs、肝脏和随着时间的推移,脾脏的肠球菌,通过各种机制驱动器官特异性和全身自身免疫(图1)。这种细菌在人类中易位的支持表现在系统性红斑狼疮(SLE)和自身免疫性肝炎患者的肝脏活检中存在鸡肠球菌(E. gallinarum)DNA,而且该菌在人原代肝细胞中激活的类似小鼠中的激活途径。
图1 鸡肠球菌易位通过多种机制驱动器官特异性和系统性自身免疫
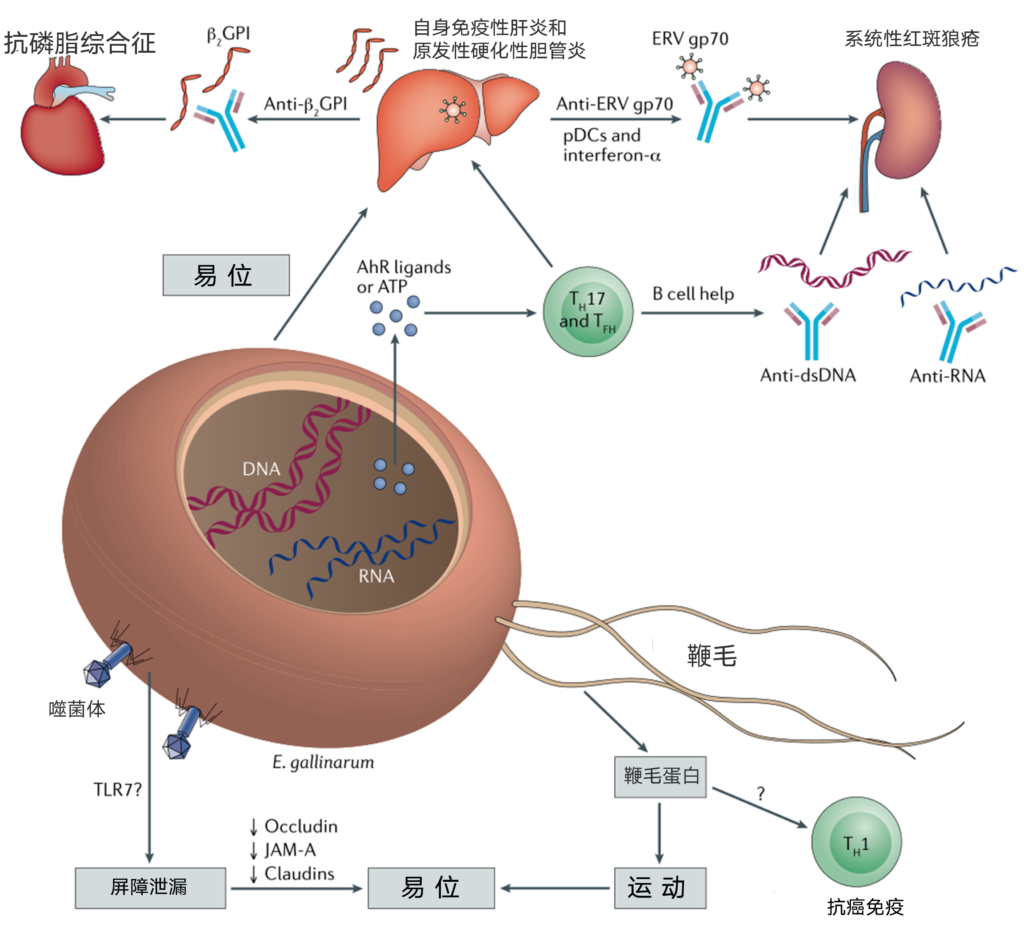
微生物群与免疫介导疾病之间存在着多种联系。由于自身免疫的共同免疫途径受到影响,相同的致病菌可能在多种无关的免疫介导疾病中引发炎症。
本文描述了一种自身免疫性致病菌(E.gallinarum)及其如何导致免疫耐受中断的例子。所示的鞭毛细菌含有DNA、RNA、噬菌体和代谢产物,它们能介导宿主对内脏器官的某些转位作用。肝脏移位促进与自身免疫性肝病(自身免疫性肝炎和溃疡性结肠炎相关的原发性硬化性胆管炎)相关的器官特异性炎症。
此外,诱导自身抗原(β-2糖蛋白I(β2GPI)和内源性逆转录病毒(ERV)gp70)和先天性免疫刺激(如浆细胞样树突状细胞(pDCs))可促进系统性自身免疫性疾病(系统性红斑狼疮和抗磷脂综合征)。
类似地,T辅助细胞17(TH17)和T滤泡辅助细胞(TFH)在次级淋巴器官中的诱导,通过与抗原提呈细胞或代谢物如芳香烃受体(AhR)配体(和潜在的ATP)的直接相互作用,促进系统性和器官特异性自身免疫。交叉反应反应,如其他共生细菌(见正文)和表位扩散所示,可能有助于RNA和双链DNA(dsDNA)自身抗体由易位的鸡肠球菌(E.gallinarum)诱导。屏障渗漏是由鸡肠球菌通过未定义的途径诱导的,这可能涉及Toll样受体7(TLR7)触发,一种最近被证明改变屏障功能的受体。鸡肠球菌定殖降低小肠紧密连接蛋白(封闭蛋白、连接粘附分子-A(JAM-A)和claudins)的表达。最后,某些鸡肠球菌菌株也具有抗肿瘤活性,这与通过鞭毛蛋白触发TLR5有关。
利用溃疡性结肠炎和原发性硬化性胆管炎(PSC)患者粪便样本,进一步支持细菌易位对人类自身免疫性疾病的影响,这些研究来自于人类器官和小鼠的诊断学研究。在此背景下,一株人肺炎克雷伯菌分离物被证明与其他人类致病菌协同作用,以促进无菌小鼠的PSC。肺炎克雷伯菌破坏人体器官上皮屏障,并在小鼠肠道屏障之外转运,在那里它驱动Th17的炎症反应。
有趣的是,这项研究还确定了鸡肠球菌是一种人体肠道转运的致病菌,这支持了一种观点:即这些转运细菌通过诱导致病性Th17细胞来促进自身免疫性肝病,如自身免疫性肝炎和PSC,从而导致肝胆损伤。
免疫复合物和与内源性逆转录病毒(ERV)的相互作用可介导自身免疫向非易位致病菌定植的器官的系统性传播(下文将进一步讨论)。此外,肠道细菌易位也会影响移植物抗宿主病模型的同种免疫(见后面蓝色部分:免疫介导的疾病类别),这是由肠道微生物衍生的短链脂肪酸调控的。重要的是,宿主-肠道微生物群的相互作用不仅局限于肠-肝轴,而且还会影响其他器官系统,如神经系统。
肠道微生物群的系统影响通过肠-脑轴到达中枢神经系统,这可以影响动物的基本功能,如宿主行为。肠-脑效应是由微生物代谢物、神经递质以及免疫和神经元信号介导的,但还没有发现活细菌向大脑的易位;这一过程需要突破肠道和大脑的障碍。
有趣的是,血脑屏障与小鼠肠道屏障有结构和功能上的相似之处,影响肠道屏障功能的微生物代谢物也改变了小鼠血脑屏障。这些过程可以影响小胶质细胞的发育和功能,并对神经免疫炎症和自身免疫有影响。 影响这些系统的确切微生物和代谢物的定义不明确,人类关联研究也很少;然而,新出现的机制将在下文进一步讨论。
过敏性反应
无害的环境或饮食抗原触发2型免疫反应(涉及嗜酸性粒细胞、肥大细胞、2组固有淋巴样细胞、t辅助2细胞和IgE),导致暴露组织的炎症和损伤。例如过敏性接触性皮炎、过敏性鼻炎、过敏性哮喘和食物过敏。
同种异体免疫
来自同一物种的非自抗原触发免疫反应,即体液(抗体介导)或细胞介导的免疫反应,导致外来组织或器官的细胞毒性和破坏。 反之亦然,移植到宿主体内的外来免疫细胞会攻击和损伤宿主组织。 例如,移植物抗宿主病、输血反应和器官移植排斥反应
自身免疫性
自我抗原被自身反应性的T和B细胞不适当地靶向,从而逃避耐受机制,导致抗体或细胞介导的组织损伤。 自身免疫可分为器官特异性或系统性,根据主要影响一个或多个器官的临床表现。例如,类风湿关节炎、干燥综合征和系统性红斑狼疮(系统性例子),I 型糖尿病、多发性硬化症和自身免疫性肝炎(器官特异性例子)。
自体炎症
在没有传染性药物的情况下,由于天然免疫细胞激活(中性粒细胞和巨噬细胞)而导致组织损伤后的自身炎症性疾病。与自身免疫相反,损伤发生在没有明显的T和B细胞参与或自身抗体的情况下。 自身炎症主要发生在单基因综合征和晶体驱动的疾病,如痛风,但也发生在一些自身免疫性疾病,具有突出的自身炎症成分(特别是炎症性肠病和脊椎关节病)。例如,家族性地中海热和肿瘤坏死因子受体相关周期综合征。
慢性炎症性疾病
广义的定义组织损伤,由于过度的持续炎症,由于先天或适应性免疫回路触发的非传染性刺激(自我或外国)。 炎症的易感性与遗传、表观遗传和环境因素有关。 例如,慢性自身免疫、同种免疫、过敏或自身炎症引起的疾病。
食物不耐受引起的自身免疫性疾病
不适当的免疫反应的饮食成分在遗传易感性的个人,导致自身免疫反应的自我。 这些疾病将与食物不耐受区分开来,而不依赖于免疫反应(例如,酶缺乏引起的乳糖不耐受)或复杂的非免疫超敏反应综合征(例如肠易激综合征)的功能障碍。 食物过敏的主要区别是饮食抗原引起的适应性免疫反应类型,例如腹腔疾病。
口腔是另一个粘膜部位,携带不同的生态位依赖的微生物群。定植于此部位的共生体对口腔健康和炎症有重要作用。例如,口腔菌群失调导致Th17介导的牙周炎症和骨丢失。
此外,口腔微生物群还与全身炎症性疾病有关。一个在人类风湿病中研究得很好的例子是放线菌群,一种口腔共生菌,通过毒素促进类风湿关节炎自身抗原瓜氨酸化。牙龈卟啉单胞菌是牙周炎的一种公认的致病因子,也与类风湿性关节炎有关,牙齿和关节破坏的相似性表明在侵蚀性类风湿关节炎中具有致病作用。
有趣的是,口腔共生菌也可以在健康的个体中定植,尽管数量很少。然而,一些口腔共生菌包括梭杆菌科和韦荣氏球菌科的成员,在以下几种疾病患者的粪便菌群中显著增加,包括溃疡性结肠炎、PSC、长期质子泵抑制剂、酒精中毒和IBD患者。
利用克罗恩病患者的唾液微生物群和唾液来源的肺炎克雷伯菌分离株足以引起严重的粘膜炎症。同样,Actinomyces massiliensis是一种表达狼疮自身抗原Ro60的同源物的人类口腔共生菌,在患有SLE的个体中被转移到肠道。因此,某些口腔共生菌在肠道中的不适当定植可能触发自身免疫。
广泛的流行病学证据表明,在特应性皮炎和哮喘等特应性疾病中微生物群失调。所有屏障表面,特别是皮肤,都有区域生态位,有独特的菌群,因此可能影响局部和全身的免疫反应。
在出生时,皮肤屏障由Treg细胞主导,需要接触共生物质,以培养对这些微生物的耐受性。小鼠记忆Treg细胞优先积累在毛囊中,这是一个富含脂质的部位,有厌氧菌密集定植,Treg细胞的积累依赖于毛囊的发育和暴露于共生体中。与暴露于共生体后持续的皮肤Treg细胞产生相似,与皮肤病理生物和病原体的相互作用可能促进类似的皮肤驻留效应记忆群体。这些事件可能形成一个区域“经验图”暴露于微生物和环境抗原建立在一生中。
区域失调可能部分解释炎症皮疹的特征性解剖分布,如特应性皮炎。 这种区域性的“记忆”也可能存在于肺等粘膜部位,但目前还没有得到充分的研究。早期与人类皮肤微生物群相互作用的重要性体现在观察到,在新生儿窗口期间的皮肤失调,如在剖腹产后的头几周发生的,与日后的过敏和炎症反应的风险增加有关。
早期暴露于保护性皮肤共生体,如表皮葡萄球菌,可启动致敏Treg细胞,导致共生特异性皮肤驻留记忆和效应T细胞,也可促进先天微生物防御和伤口愈合。组织特异性Treg细胞功能的缺失导致Th2细胞介导的伤口愈合途径的结构性激活,导致小鼠特应性皮炎样表型,其特征是过度的皮肤IL-5、IL-13和嗜酸性粒细胞,机制上将卫生假说与人特应性皮炎中Th2异常激活联系起来。
表皮葡萄球菌等保护性人类共生菌缺乏皮肤定植,与金黄色葡萄球菌的生长有关,这加剧了特应性皮炎的皮肤炎症。特应性皮炎的特点是遗传皮肤屏障缺陷,这种缺陷会导致金黄色葡萄球菌的过度生长导致微生物失调。 此外,葡萄球菌的不同种类和菌株之间存在着直接竞争。因此,葡萄球菌的生物合成障碍似乎是特应性皮炎中皮肤屏障受损的原因和结果。 微生物通过皮肤屏障易位到表皮下隔间来引发炎症的概念已经得到了初步探索,可能会促进特应性皮炎。
特应性皮炎主要与Th2表型有关,尽管某些个体还具有Th17细胞介导的炎症,特别是早期儿童特应性皮炎和高IgE水平的个体。虽然酵母共生马拉色菌在特应性皮炎中的作用存在争议,但皮肤马拉色菌定殖受TH17细胞免疫调节,特应性皮炎患者对马拉色菌有更多的记忆CD4+ T细胞应答,CCR6+ 产生IL-17,CCR6- 产生IL-4和IL-5。共生马拉色菌在其他炎症性皮肤病(如脂溢性皮炎)中有已知的作用, 但也可能导致特应性皮炎患者的炎症。
最近的研究还涉及皮肤共生菌在自身免疫性疾病,如SLE通过抗原在易感人群中交叉反应。患有SLE和干燥综合症的个体通常产生抗进化保守的RNA结合蛋白Ro60的抗体,也称为干燥综合症相关抗原A。
多种常见的共生体,包括人类皮肤共生假丙酸杆菌(原称丙酸杆菌),由于其在物种间的进化保守性,表达与人类Ro60具有高度序列同源性的Ro60同源物。抗Ro60阳性狼疮个体的血清免疫沉淀共生Ro60核糖核酸蛋白和人狼疮T细胞克隆对人和共生Ro60肽和蛋白质都有反应。无菌小鼠定殖于产生Ro60的肠道中,可产生T和B细胞Ro60反应性,并具有模拟狼疮性肾炎的肾小球免疫复合物沉积。
因此,与主要自身抗原的同源交叉反应诱导并维持系统性自身免疫。 这一过程也有望驱动局部自身免疫性炎症,如亚急性皮肤红斑狼疮,因为丙酸丙酸杆菌的分布与这种情况下的皮疹分布相似,丙酸丙酸杆菌在亚急性皮肤红斑狼疮患者的皮肤活检中富集。同样,在其他局部皮肤微环境中,对共生体的自身免疫反应可能解释了在多种皮肤病中看到的皮疹的特征模式。
肠道-皮肤轴也可能有助于皮肤自身免疫。 白癜风是一种T细胞介导的自身免疫性疾病,导致皮肤黑素细胞丢失和随后的脱色。在白癜风小鼠模型中,口服抗生素氨苄青霉素治疗后,皮肤和头发的加速发病和扩张,而不是新霉素,提示特定肠道细菌群落的改变影响疾病活性。
抗生素对皮肤微生物群影响不大,但改变了肠道微生物群,减少了皮肤中的T细胞数量。 同样,新生儿口服抗生素可以通过增加皮肤IL-22产生γδT细胞来促进小鼠模型中的银屑病。这些研究支持肠道微生物在皮肤病中的作用。
皮肤-肠轴也是生物学相关的。 在天然免疫刺激(使用TLR7激动剂,咪喹莫特)引起的皮肤银屑病炎症模型中,与无皮肤炎症的对照动物相比,肠道的化学刺激会导致严重的结肠炎。然而,目前尚不清楚这种对肠道的影响是否可能是由于动物舔掉了皮肤。 如果未来的对照研究支持这些发现,他们表明,不仅有一个肠道-皮肤轴,皮肤和肠道之间也有交流。此外,机械性皮肤损伤易导致小鼠胃肠肥大细胞扩张,也支持这一模式。
肺血—气屏障和定植微生物群也与免疫介导的疾病有关。新生小鼠暴露于室内尘螨过敏原后,气道嗜酸性粒细胞增多,Th2细胞因子释放随着肺中细菌负荷的增加而减少。
在另一种过敏性哮喘模型中,无菌小鼠肺中产生Th2细胞因子IL-4和IL-13的不变自然杀伤T细胞水平也增加。新生小鼠的微生物定植可逆转过敏反应,而成年小鼠则不然。因此,气道高反应性伴Th2细胞偏向,类似于过敏性哮喘,在出生时最强,暴露于不同的区域微生物后减弱。
先天Th2细胞偏见的原因尚不清楚,但可能与我们的进化历史有关,当时Th2细胞的反应对于防止寄生虫和有害环境物质以及组织修复至关重要。除了抑制Th2细胞反应外,儿童早期健康的共生呼吸微生物群对病毒感染有保护作用,这是过敏性哮喘发展的另一个危险因素。
肠-肺轴是另一种使微生物影响免疫介导的疾病的机制。肠道微生物失调与哮喘风险有关,有哮喘风险的新生儿肠道菌群减少的小鼠,新生儿定植对卵清蛋白诱导的过敏性哮喘的保护作用。
肠道微生物代谢物的保护作用,特别是纤维发酵的短链脂肪酸,得到了广泛的研究。肠道微生物衍生的代谢物也会影响远处的器官包括肺,这可能通过降低Th2细胞因子水平和增加Treg细胞的数量来保护宿主免受哮喘的影响。
此外,小鼠母体饮食中的短链脂肪酸被证明对后代的过敏性呼吸道疾病有保护作用,部分原因是胎儿肺中基因表达的改变。相关的人类研究与小鼠模型中的这些发现相一致:粪便中丁酸含量最高的1岁儿童,3至6岁的儿童过敏的风险显著降低。虽然肠道微生物向肺的易位没有直接与哮喘有关,但这可能在机制上是合理的。在败血症的背景下,观察到拟杆菌和肠球菌从下消化道转移到肺。
肠道寄生虫感染是肠—肺轴的另一个潜在介质,通过诱导Th2细胞和IgE,可以部分解释在发达国家很少接触寄生虫的人群中,特应性疾病的高发率。仅儿童钩虫感染与哮喘的未来发展比值为0.5(即概率降低一半)相关。此外,重组钩虫抗炎蛋白2通过诱导Treg细胞对卵清蛋白诱导的气道高反应性有保护作用。
除了直接免疫激活外,小鼠蠕虫感染似乎通过改变肠道微生物群进一步影响哮喘的风险,导致短链脂肪酸产生和肺Treg细胞增加。相关研究表明,蠕虫感染会促进肠道细菌多样性,从而保护人类免受哮喘的侵害。因此,特应性疾病的卫生假设可能与保护性定植和感染有关,后者介导局部和远处组织中的免疫-微生物相互作用。
遗传和微生物之间的相互作用
免疫疾病通常是多因素的,并遵循多步骤的发病机制(图 2)。遗传学是慢性免疫介导疾病的基础,但环境触发因素和微生物失调是渗透疾病表型所必需的。明确定义的宿主遗传关联在人类自身免疫中具有特征,最显著的是人类白细胞抗原(HLA)多态性,但在先天性和适应性免疫途径中也有其他基因。
图2 系统性红斑狼疮和1型糖尿病多阶段发病机制研究
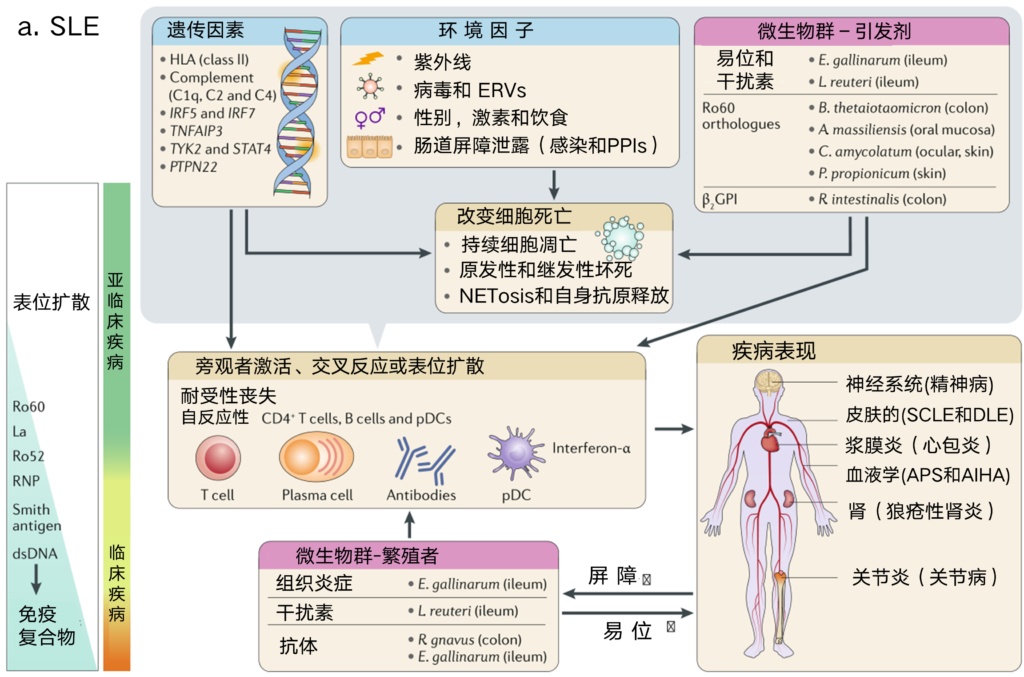
a |系统性红斑狼疮(SLE)作为受微生物群影响的系统性自身免疫性疾病的一个范例。通过向内脏器官转移、先天性(I型干扰素和旁观激活)和适应性(自身抗原诱导、T辅助细胞歪斜和表位扩散)免疫机制,启动致病菌促使SLE的发病。特别是,与早期自身抗原如Ro60【以及在一些SLEβ-2糖蛋白I(β2GPI)患者中】的交叉反应,使T细胞和B细胞对过度细胞死亡时释放的自身抗原产生反应。所有这些过程最终导致外周免疫耐受完全丧失,T细胞-B细胞协作,先天性免疫刺激(例如,浆细胞样树突状细胞(pDC)激活),具有I型干扰素特征和免疫复合物的形成。免疫复合物沉积在各种器官,如肾脏、大脑或浆膜。这种恶性循环被作为传播者和引发者的病理生物(例如,鸡肠球菌和罗伊氏乳杆菌)所促进,而一些在狼疮性肾炎(gnavus瘤胃球菌)暴发期间选择性生长。没有显示某些环境因素可以作为传播者(如病毒感染或紫外线(UV)照射)。
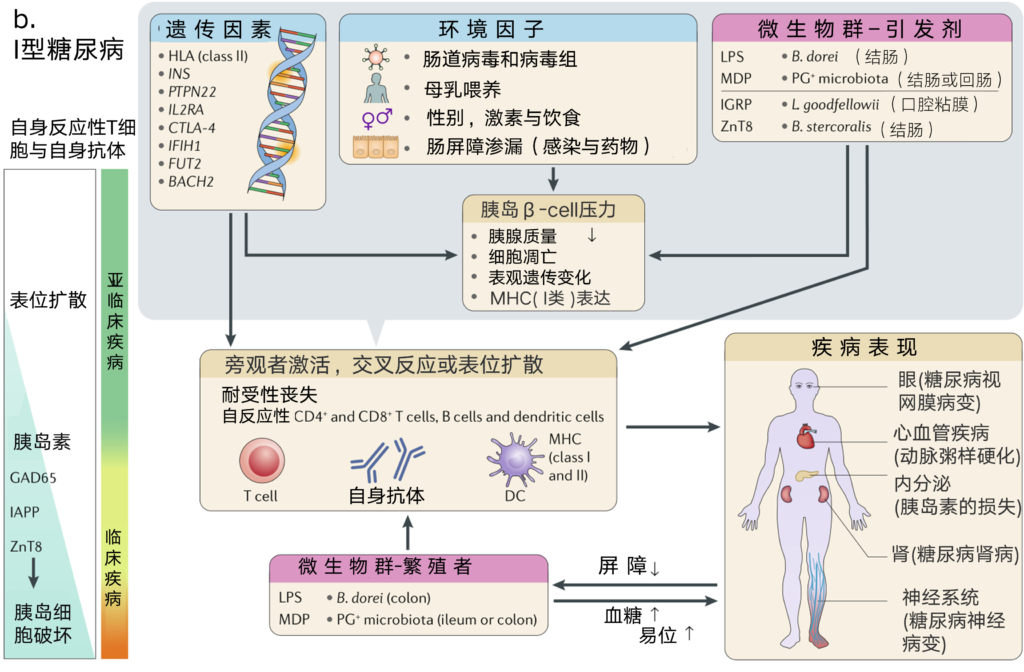
b | 1型糖尿病作为受微生物群影响的器官特异性自身免疫疾病的范例。起始的病理生物可能通过脂多糖(LPS)或壁酰二肽(MDP)转移到胰腺淋巴结或提供先天性免疫刺激。微生物群某些成员中的交叉反应抗原可触发对自身抗原的反应(例如,胰岛素特异性葡萄糖-6-磷酸酶催化亚单位相关蛋白(IGRP)和锌转运蛋白8(ZnT8))。
此外,遗传和环境因素会导致胰岛中产生胰岛素的β细胞受到应激,导致抗原的递呈和释放。这些过程共同促进了外周免疫耐受的丧失,包括T细胞与B细胞的协同作用和先天免疫刺激,最终导致胰岛细胞的破坏和胰岛素的分泌减少。随后的高血糖会随着时间的推移导致器官损伤的终止以及肠道屏障功能障碍的增加,这会加剧肠道微生物的移位,从而在可逆期(所谓的“蜜月期”)之后的恶性循环中进行胰岛细胞的破坏。
对于a图和b图,蓝框包含选择的遗传和环境因素,这些因素为自身免疫易感性提供了基础。紫色盒子包含细菌微生物群内疾病的潜在引发者和传播者,重点是病理生物。为了简单起见,此处不包括有益微生物群或其代谢产物的损失。
AIHA,自身免疫性溶血性贫血;APS,抗磷脂综合征;DC,树突状细胞;DLE,盘状红斑狼疮;dsDNA,双链DNA;ERVs,内源性逆转录病毒;GAD65,谷氨酸脱羧酶;HLA,人类白细胞抗原;IAPP,胰岛淀粉样多肽;NETosis,中性粒细胞胞外陷阱激活与释放;PG,肽聚糖;PPIs,质子泵抑制剂;RNP,核糖核蛋白颗粒;SCLE,亚急性皮肤红斑狼疮
双胞胎研究和无症状携带者的风险遗传变异支持额外的因素是需要疾病渗透。在小鼠中测试时,只有罕见的中枢耐受性缺陷被认为独立于微生物群或环境信号;然而,人类单基因表型的严重程度和临床异质性也很可能受到微生物群的调节。
多基因疾病通常被微生物所修饰。 先天或适应性免疫基因功能的改变导致依赖于微生物的动物模型中的炎症表型。例如,肿瘤坏死因子-α(TNFα)诱导的蛋白3(NFAIP3,编码蛋白A20)或自噬相关基因ATG16L1对结肠炎易感性的影响。
同样,携带自身免疫驱动的主要组织相容性复合体(MHC)单倍型。 在啮齿动物模型中,只有在微生物存在的情况下才会导致肠道和关节炎症性疾病。相反,某些MHC多态性可以选择免疫介导的疾病中的保护性微生物。
此外,TLR7通路,或ATP门控阳离子通道P2X7受体的遗传改变影响宿主免疫和肠道屏障功能,从而增加微生物易位和自身免疫的易感性。这些只是一些选定的例子来说明遗传危险因素在微生物群背景下易患免疫学疾病的各种情况。
药物
药物特别是抗生素,是明显的“环境”因素,广泛影响人类微生物群。抗生素分别影响自身免疫性和过敏性疾病模型的发生率或严重程度。在人类中,众多研究表明,类似的影响可能发生在某些抗生素上。
重要的是,有一些众所周知的例子,非抗生素药物通过肠道微生物群影响免疫介导的疾病。例如,柳氮磺胺吡啶是一种前药,在风湿病中发挥免疫调节作用之前,需要由肠道微生物群激活。在许多其他药物中,这种转化最近已映射到人类微生物组。
代谢物
此外,肠道微生物产生一种竞争性代谢物,影响对乙酰氨基酚(也称为对乙酰氨基酚)的肝脏代谢,这是一种广泛使用的治疗各种炎症性发热疾病的辅助药物。其他药物已知抗菌活性,但常规用于全身自身免疫性疾病,最显著的是抗疟药物——羟氯喹。目前尚不清楚这种药物是否通过对细菌或真菌微生物的抗菌作用部分作用于宿主,但鉴于其已知的作用模式,这是合理的。
饮食
除了药物外,饮食是一个重要的环境变量,广泛影响免疫系统和微生物群。不同纤维、色氨酸或脂肪酸含量的饮食可以通过各种机制调节免疫介导的疾病。低膳食纤维与能够将膳食纤维发酵成短链脂肪酸的微生物群减少有关,通过G蛋白偶联受体介导的致耐受机制。膳食纤维的增加与短链脂肪酸的产生增加有关,从而导致调节免疫反应,并在各种模型中防止过敏和炎症。
此外,饮食敏感的乳酸菌可以在神经炎症中起保护作用,但也可以通过I型干扰素反应来促进炎症和抗病毒免疫,从而根据I型干扰素的作用来调节自身免疫性疾病,例如促进SLE或改善动物模型中的多发性硬化。在狼疮易发的宿主中,一种致病性的罗伊氏乳酸杆菌菌株被一种高抗性淀粉的饮食所抑制,这种淀粉发酵成短链脂肪酸,限制了罗伊氏乳酸杆菌的生长,降低了肠道的通透性。
纤维和相关的短链脂肪酸一直是免疫介导疾病中宿主-微生物相互作用的主要焦点,其他膳食成分对微生物群的影响还需要进一步研究。例如,盐是一种意想不到的食品添加剂,影响免疫过程。氯化钠的增加与通过称为血清/糖皮质激素调节激酶1(SGK1)的离子通道激活激酶诱导Th17细胞介导的自身免疫有关。重要的是,膳食盐已被证明通过肠道微生物作用于宿主,特别是通过减少小鼠的鼠乳杆菌,这反过来促进Th17细胞的诱导,并加剧多发性硬化症的模型。
紫外线
化学或物理环境因素对宿主-微生物相互作用的影响也得到了初步研究。例如,太阳照射可能具有多向性效应,因为抗菌肽被紫外线(UV)辐射改变。此外,紫外线可能直接作用于皮肤微生物群。有趣的是,人类狼疮相关的同系物自抗原Ro60,由人类皮肤共生丙酸丙酸杆菌表达,在环境细菌中传递对辐射的抵抗力。
吸烟
吸烟类似于紫外线,对宿主和可能的微生物有多向作用。与类风湿性关节炎有关的一个独特的例子是,吸烟瓜氨酸化类风湿性关节炎自身抗原,这一过程也是由口腔致病菌放线菌所致的,如上文所述。吸烟改变的呼吸道微生物群是否有促使类风湿关节炎的发病机制尚不清楚。
卫生和生活方式的差异影响微生物的组成,这反过来又改变了自身免疫性和过敏性。
性激素
最后,应该注意的是,除了这些环境因素外,性激素还会影响肠道微生物,从而影响自身免疫。自身免疫倾向的雌性无菌小鼠从同一小鼠株的雄性小鼠获得一个微生物群,可防止进展为胰岛细胞自身免疫。特定微生物群如何影响小鼠自身免疫的一种可能性是通过血液睾酮水平的适度升高,这反过来影响免疫反应,但不影响女性的生殖发育和健康状况。最终,环境因素、性激素和微生物群之间的联系仍有待在精心设计的、涉及免疫介导疾病个体的纵向研究中评估。
正如前面的章节所总结的,遗传学、表观遗传学和环境因素导致免疫失调和外周耐受的断裂,这反过来又会导致对微生物群的异常免疫反应和失调。这些影响可能在幼儿期发展,也可能在青春期后荷尔蒙变化中触发,那时许多免疫介导的疾病出现了。根据卫生假说,失调菌群也可能被遗传给后代,并可能导致免疫介导的疾病的迅速上升。
图3 免疫介导疾病发病机制中的病理-宿主免疫相互作用
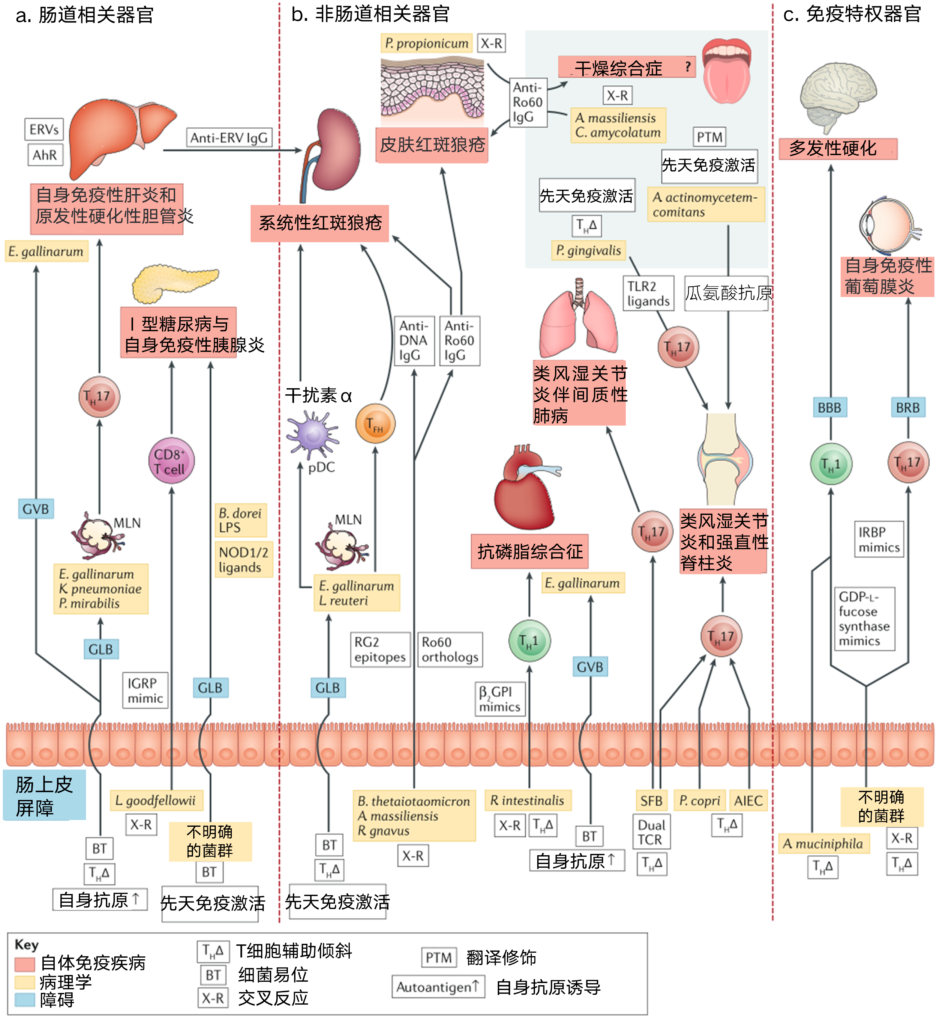
自身免疫性疾病分为肠道相关疾病、非肠道相关疾病和免疫特异性疾病。非细菌性诱因、过敏性或异基因炎症性疾病以及有益共生体的丧失均未显示。
肠道相关器官是肝脏,由血液和肠道微生物代谢产物通过门静脉和胰腺直接供应,接受来自肠道的淋巴引流。
宿主-微生物群的相互作用被几个屏障分开,即肠上皮屏障、肠淋巴屏障(GLB)、肠血管屏障(GVB)、血脑屏障(BBB)和血视网膜屏障(BRB),后两个屏障导致大脑和眼睛的免疫特权状态。其机制包括细菌移位、天然免疫激活、T辅助细胞(TH)歪斜、与自身抗原的交叉反应和翻译后修饰,以及识别微生物抗原和自身抗原的双T细胞受体(TCRs)。
未显示表位扩散和旁观者激活,这可能发生在所有情况下,当病理生物转移到内脏器官。
a| 肠相关器官。鸡肠球菌向肝脏的转移促进了自身免疫性肝炎,并与肺炎克雷伯菌和奇异变形杆菌一起,通过包括TH17分化在内的多种机制导致原发性硬化性胆管炎。鸡肠球菌诱导的肝芳香烃受体(AhR)和内源性逆转录病毒(ERV)也参与了小鼠狼疮性肾炎(一种非肠道相关器官)的系统性抗ERV反应。
Leptotrichia goodfellowii 能与小鼠Ⅰ型糖尿病自身抗原胰岛特异性葡萄糖-6-磷酸酶催化亚单位相关蛋白(IGRP)发生交叉反应。在小鼠Ⅰ型糖尿病中,未定义的微生物群易位到胰腺淋巴结并激活NOD2,而来自微生物群的NOD1配体的易位驱动自身免疫性胰腺炎。
b| 非肠道相关器官。鸡肠球菌和乳杆菌在系统性红斑狼疮模型中向肠系膜淋巴结(MLNs)、肝脏和脾脏转移,从而激活先天性(浆细胞样树突状细胞(pDC))途径。
鸡肠球菌还刺激狼疮患者滤泡辅助因子(TFH)和自身抗体的产生。Ro60直系表达细菌在狼疮患者中引起Ro60自身免疫反应;肠道中的类泰奥托米克龙杆菌、口腔或肠道中的大量放线菌和阿米巴棒状杆菌,除了狼疮外,还可能导致Sjógren综合征,丙酸假丙酸杆菌与亚急性皮肤狼疮皮损通过交叉反应。
gnavus瘤胃球菌在狼疮性肾炎时扩张,可与狼疮双链DNA发生交叉反应。抗磷脂综合征是一种凝血性自身免疫性疾病,鸡肠球菌传染性支气管炎也加重了这种疾病,它诱导肝脏中的自身抗原β2GPI。
口腔牙龈卟啉单胞菌、结肠copri菌和小肠节段丝状菌(SFB)的TH17偏斜均与类风湿关节炎的发病有关。同样,粘附性侵袭性大肠杆菌(AIEC)可导致克罗恩病相关性脊柱炎。在关节炎模型(未显示)中,SFB还使CD4+T细胞向TFH细胞倾斜,并通过携带双TCRs的TH17细胞在同一模型中引发间质性肺病。口腔中的放线菌群通过一种也能激活中性粒细胞的毒素,瓜氨酸化类风湿关节炎中的系统自身抗原。
c | 免疫特权器官。阿克曼菌(Akkermansia muciniphila )在多发性硬化症中增强TH1反应,并且未定义的微生物群与GDP-l-岩藻糖合酶(一种神经炎症疾病的自身抗原)交叉反应。未定义的小鼠肠道微生物群与TH17细胞交叉反应,识别自身免疫性葡萄膜炎的自身抗原——视黄酸结合蛋白(IRBP)。
重要的是,微生物失调本身通过各种机制引起失调的免疫反应,包括T辅助细胞倾斜、旁观激活、表位扩散、交叉反应和双T细胞受体(TCR)刺激(图3),它们分别作用于疾病的易感性、引发和传播(表1)。
表1 微生物群对非肠道自身免疫性疾病的起始,繁殖和改善的影响
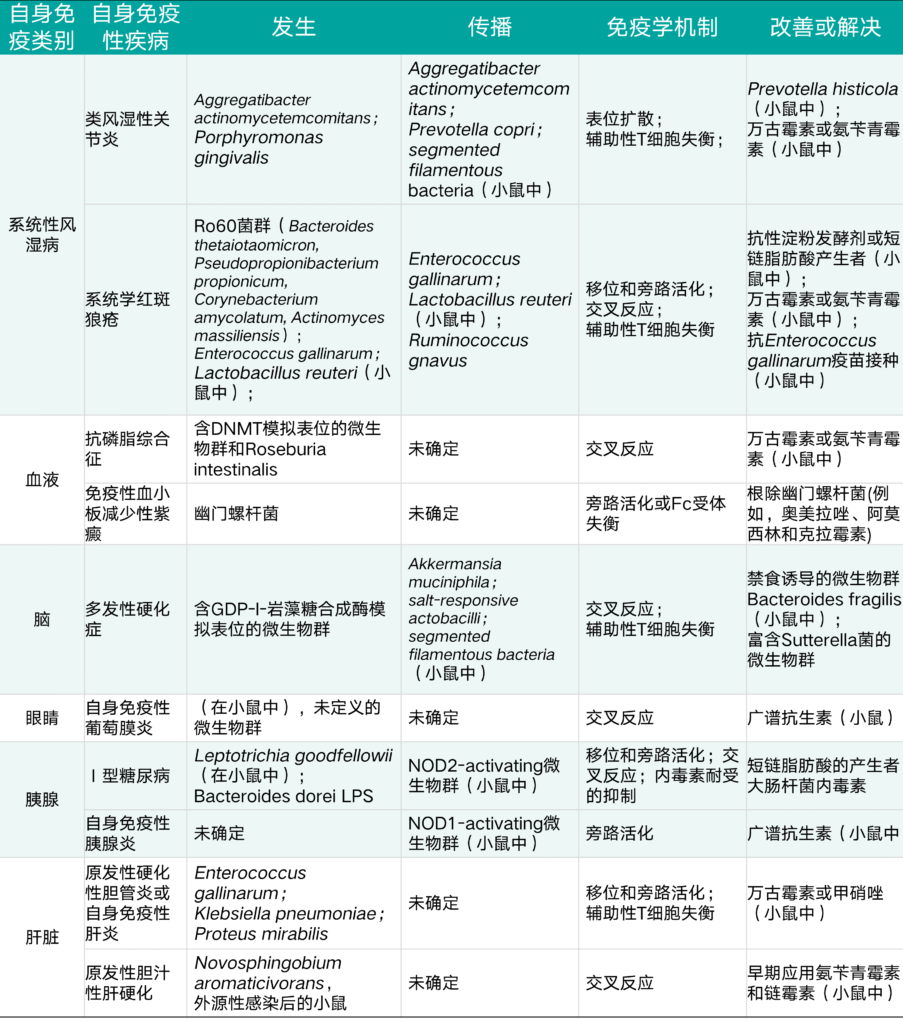
在本节中,我们重点讨论了自身免疫性疾病中发生的免疫机制,尽管它们同样适用于过敏性和同种免疫性疾病。此外,一旦免疫耐受被打破,组织耐受性决定了器官损伤是否会发生。
T辅助细胞倾斜
Th1和Th17细胞反应导致炎症组织损伤。在病原体感染或组织损伤期间,对微生物群的稳态免疫反应可分别向促炎或修复程序倾斜。重要的是,感染过程中的细胞凋亡被证明导致Th17细胞的反应是自发的。此外,某些共生诱导粘膜T细胞向Th1、Th17、T滤泡辅助细胞或细胞毒性CD8+T细胞分化,促进易感宿主的免疫介导疾病。
此外,肠道中的某些辅助性T亚群可以进一步根据共生菌与肠道病原体诱导的细胞因子分泌谱进行功能分离。例如,小鼠SFB在稳定状态下促进IL-10+非炎症Th17细胞,而小鼠肠道致病菌鼠柠檬酸杆菌在肠道感染过程中诱导干扰素γ+炎性Th17细胞。
值得注意的是,当在稳态与炎症过程中由相同的共生物种诱导时,T辅助亚群的分化甚至可能是不同的。阿克曼菌Akkermansia muciniphila在体内诱导小鼠T滤泡辅助细胞和Th17细胞在炎症中的作用。艾克曼菌也能促进人Th1细胞的体外倾斜,并在多发性硬化症患者中富集。这些研究只强调了支持微生物对T辅助细胞倾斜的影响的多个证据之一。
旁观激活
病原体可以在感染过程中以与抗原无关的方式激活自身反应性的T和B淋巴细胞,其途径是产生炎症环境,这种机制被称为旁观者激活。类似的情况可能是微生物群中的致病生物,它们促进促炎症而不是耐受性信号。 几种共源MAMPs,如LPS、肽聚糖和其他尚未定义的MAMPs已被证明了能激活先天传感器,核苷酸结合寡聚结构域(NOD)样受体和TLRs,进而导致自身免疫性和炎症性疾病。
表位扩展
病毒和其他溶细胞感染可导致抗原释放和分子内以及分子间表位扩散。在病毒感染或肠道屏障功能改变等炎症条件下,破坏组织的肠道微生物群也可能参与这一机制。例如,鸡肠球菌从肠道转运到内脏,从而诱导RNA和双链DNA的自身抗体,并促进对β2-糖蛋白I和ERV抗原的自身免疫。自身抗原的翻译后修饰是另一种可能促进多个表位靶向性的机制,如口腔致病菌放线菌在类风湿关节炎中瓜氨酸化自体抗原所示。
交叉反应
交叉反应,通常在自身免疫中被称为分子模拟,在统计上很可能是由于来自微生物群的大量抗原。在具有适当MHC单倍型的宿主中,与交叉反应微生物群的持续定殖可代表免疫介导疾病对肠道和远处器官的持续触发。在人类微生物群中编码的自身抗原的同源抗原或非同源基因模拟表位提供了交叉反应抗原,刺激从患者中分离出的自活性T细胞和B细胞。
结合遗传或环境免疫过度激活,这些人类交叉反应的适应性免疫反应被证明在生物模型中介导远距离组织损伤。同样,与人类共栖抗原的交叉反应性与影响非肠道器官的耀斑有关。在这些环境中,细菌易位可能不是非肠自身免疫所必需的,特别是如果淋巴细胞的异常肠道归巢容易导致自身免疫反应的传播,但每当肠道屏障完整性受到损害时,细菌易位很可能起作用。
双T细胞受体
携带TCRs的T细胞可以识别微生物抗原和自抗原,这是在某种情况下肠道共生体如何触发自身免疫的另一个机制。在小鼠中,SFB通过双TCR淋巴细胞诱导遗传倾向关节炎模型中Th17细胞反应,以增强肺自身免疫。人类共生体是否通过双重TCR刺激导致人类自身免疫性疾病尚不清楚。
在克罗恩病相关脊柱炎患者的微生物群中发现的IgA包覆的粘附性侵袭性大肠杆菌,在同一诊断性关节炎模型中促进了系统性同源抗原特异性TH17细胞和自身抗原特异性抗体。
正如前面各节所总结的,新生儿的影响(例如,儿童的分娩方式和抗生素治疗)以及青春期和衰老期间激素的变化影响微生物群,从而有助于发病、慢性和改善免疫介导的疾病随着时间的推移。如前几节所述,新生儿的影响(例如,儿童的分娩方式和抗生素治疗)和青春期和衰老期间的激素变化影响微生物群落,从而随着时间的推移,促使免疫介导疾病的发病和改善。
在这些变化过程中生长出来的某些肠道共生体可以通过降解粘液或IgA或增加肠道上皮通透性降低肠道屏障功能,其他的则使T辅助细胞分化倾向于促炎症表型,还有一些则通过促炎性MAMPs和代谢产物提供先天性刺激和旁观者激活。 这些事件导致对交叉反应共生抗原的增强反应,而交叉反应共生抗原是无害的,在健康人群中可能普遍存在。
另外,细菌易位促进进一步的免疫活化,并且根据易位菌株,可促进远处组织的自身免疫病理。所有这些机制都可能协同作用,并涉及多个致病菌或伴随或丧失多种有益菌。
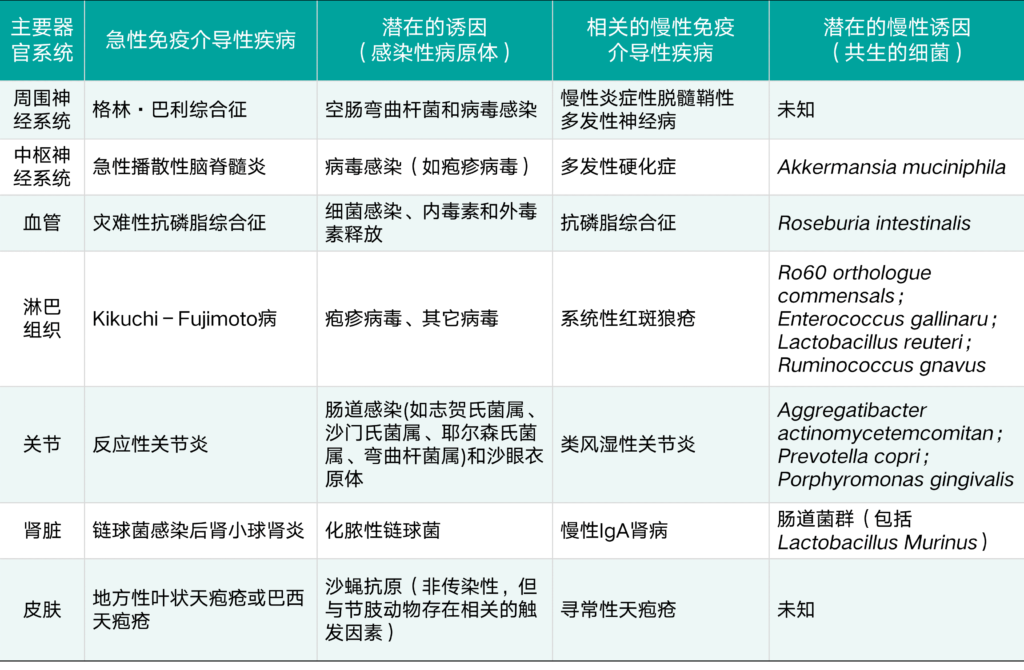
此外,由于环境因素(例如饮食,药物和感染),致病菌的屏障紧密度和向外生长的变化可能解释了慢性免疫介导疾病与致病菌而非因病引发的急性疾病相比的发展过程。并在病原体清除后再次汇出(表2)。 所有这些因素都导致了慢性免疫介导疾病的异质性,并需要一种个性化的方法来理解,诊断和治疗这些疾病。
表2 免疫介导疾病及其与传染源的关系及与病原菌的慢性定殖
基于微生物群的个性化治疗
考虑到遗传易感宿主中宿主与微生物群相互作用的复杂性,针对微生物群的疗法在理想情况下是个性化的。
微生物谱分析以及免疫介导疾病个体的遗传图谱可进行风险分层,并选择可能受益于微生物群靶向治疗的患者。粪便微生物群移植和益生菌是相对非特定的方式提供有益的微生物并导致个体间的可变反应。系统地鉴定介导抗炎作用的微生物组中的小分子是可取的,并且是迅速发展的。
除了开发利用细菌代谢产物或联合体的治疗方法外,抑制病理生物以更有选择性地从微生物组中去除免疫原性触发器也很有吸引力。
去除诸如“关键致病菌”之类的持续性诱因可能会导致某些人缓解,或预防易感人群中疾病的发展。 取决于致病菌的生理功能,此类干预措施可能会对宿主产生负面健康影响,也可能不会产生负面影响。
因此,去除致病菌的概念代表了个性化医疗的极端要求,并且需要对正确的患者队列进行初步鉴定。 一种类似的方式是针对单基因疾病的靶向基因疗法。可以设想几种基于微生物的个性化方法,下面将进行讨论。
靶向微生物群的抗生素
动物研究表明,使用常规抗生素可以改善或预防免疫介导的疾病。也有涉及常规抗生素的罕见病例案例研究。我们需要更有选择性的抗生素,以避免旁观激活,同时也需要制定新的预防抗生素耐药性的行动机制。
然而,即使有针对性地去除,也有可能通过间接改变微生物生态系统而产生意想不到的后果。我们还需要做更多的工作来开发更有选择性的抗生素或替代方法,如原位微生物群落工程。
免疫病原体
预防传染病的疫苗已经彻底改变了医疗保健,延长了数百万人的生命。疫苗方法是安全、持久和有效的。鉴于致病菌与传染源具有相似的免疫靶点,这种方法可能对免疫介导的微生物感染性疾病有用。
然而,根除致病菌的风险在于,它们可能在另一种疾病环境或健康宿主中具有有益的作用。
在动物模型中,肌肉注射抗易位致病菌鸡肠球菌的疫苗在防止易位到内脏和系统性自身免疫方面是安全和有效的。考虑到肠道粘膜的耐受环境,口服疫苗可能更难开发,但可以设想用于非易位共有体,例如肠道中的交叉反应触发,尽管应注意避免触发对交叉反应表位的反应。
肠道微生物的饮食调节
在一个高度控制的环境中,饮食被实验证明是恢复菌群失调小鼠肠道微生物群中的优生状态和抑制致病菌生长的一种简单方法;然而,鉴于个人饮食和反应的多样性,人类的饮食调节需要一种高度个性化的方法。
在实践中可能很难坚持特定的饮食方案,但是实验模型已经显示了饮食干预的明显益处,饮食干预可以改变免疫介导疾病中的微生物群。从理论上讲,将宿主遗传学和微生物组对饮食的反应结合起来,应该能够为患有慢性免疫介导性疾病的人制定个性化的饮食方案,对于患有代谢性疾病的人而言也在不断发展。鉴于人类研究数量有限以及介导治疗反应的因素十分复杂,饮食作为一种治疗方式仍未在实践中使用。
如上所述,各种饮食代谢物和饮食敏感的微生物来源的分子在动物模型中过敏性,神经炎性,风湿性和器官特异性自身免疫性疾病的严重程度或结果。
饮食可以直接影响免疫系统或通过肠道菌群介导宿主效应。饮食还可以加强肠道屏障,从而改善微生物群和宿主之间的界面。在饮食-微生物-宿主相互作用这一复杂领域中,还需要进一步的机理研究。评估定制的饮食调节肠道菌群在预期根据其微生物群落结构做出反应的患者人群中的功效也必不可少。
此外,还应解决饮食引起的肠道微生物群的重组是否持续并具有持久的宿主效应。在健康个体中,肠道微生物群的组成很容易因饮食而改变,一旦停止饮食,便会恢复为原始形态。 有趣的是,饮食不仅会迅速影响人类肠道菌群,还会影响肠道病毒,这也可能有助于研究饮食如何影响免疫介导的疾病。
总体而言,特定宿主中饮食与微生物群落相互作用的复杂性和个体间差异使得为免疫介导的疾病制定特定饮食方案具有挑战性。然而,对于那些寻求通过非微生物方法通过肠道微生物组改变其疾病的个体而言,饮食调整将仍然是一种有吸引力的辅助疗法。
噬菌体靶向治疗
病毒以噬菌体为主导,而噬菌体与微生物群的细菌成员共同进化。天然噬菌体和合成噬菌体都可以代表一种针对性强的方法,与抗药性病原体类似,可以消灭免疫介导疾病中的致病菌。例如,针对参与IBD发病机制的肺炎克雷伯菌菌株的噬菌体目前正被生物技术公司评估用于干预。
最近在动物模型中证明了在酒精性肝病中成功地将噬菌体靶向肠球菌。该方法对于其他与免疫介导的疾病有关的肠球菌属也是可行的,它会遵循上面提到的个性化医疗保健模式,特别适合那些易患免疫介导疾病并被“关键病理生物”定植的个体。
还可以构想组合噬菌体疗法,以解决涉及免疫介导疾病的几种不同菌株,例如PSC(其中三个物种协同作用:肺炎克雷伯氏菌,变形杆菌和鸡肠球菌)。与疫苗接种方法类似,噬菌体疗法可能仍然存在理论上的风险,即在不同的情况下去除菌株可能是有益的。然而,这两种方法都比传统的抗生素更有针对性,会导致多种脱靶效应。
自身免疫性真菌
健康人的肠道菌群,即共生真菌群落,其多样性似乎不如微生物群的细菌组成部分,但仍相当丰富。对IBD患者的研究一直显示,真菌多样性总体下降,念珠菌种类过度生长。众所周知,克罗恩病患者会产生高滴度的抗酿酒酵母抗体。这些抗体针对在许多真菌(不是所有)细胞壁中发现的甘露聚糖,并且带有酿酒酵母的无菌小鼠的定植加剧了结肠炎。
值得注意的是,检测真菌抗原的基因突变,如CARD9和CLEC7A与IBD有关。此外,马拉色菌限制性结肠炎与克罗恩病患者的结肠粘膜有关,特别是那些具有CARD9多态性的患者,并且限制性马拉色菌通过CARD9信号加重小鼠的结肠炎。
另外,β-葡聚糖不仅在动物模型中引发克罗恩病,而且还引发不同类型的自身免疫性关节炎;然而,目前尚不清楚分枝杆菌是否是该MAMP的来源。虽然很少被发现,真菌也可能在皮肤或肺生态位中很重要。有证据表明肠道菌群失调在过敏性气道炎症中起作用。这些研究支持了真菌失调在影响气道疾病的肠-肺轴中的作用,该轴已被公认是微生物群的细菌组成。
自身免疫性病毒
人类有一个由单链RNA、双链RNA、单链DNA和双链DNA病毒组成的多样性病毒群。其中许多是噬菌体,但病毒组也包括人和动物病毒,以及通常感染植物、古细菌和真菌的ERV和病毒。
考虑到病毒在宿主细胞内复制的内在要求,病毒是否真的可以被认为是共生的还有待于理解,不过,从多器官系统宿主的角度来看,病毒可以通过促进免疫发育提供益处,影响组织结构和促进对癌症的免疫监测。
有多种动物模型和相关的人类研究发现致病性病毒在自身免疫性中起作用。此外,早期和频繁接触呼吸道病毒与人类哮喘的发展密切相关,尽管病毒是否会引发哮喘,或者TH2细胞的免疫反应是否会增加病毒感染的易感性仍然存在争议。
不同的病毒在保护或加剧免疫介导疾病方面可能有不同的作用,这取决于环境。
跨界合作
微生物群落中不同界并非孤立地行动。新的证据表明,细菌、病毒、真菌、古细菌和真核生物(如蠕虫和原生动物)之间存在着直接和间接的(即通过宿主免疫)越界相互作用。这可能解释了不同人类宿主之间的许多差异。
肠道共生菌在相互作用中促进或防止病毒感染
在小鼠中进行的几项研究表明,肠道共生菌在相互作用中促进或防止病毒感染。这些相互作用可能会超出短暂的病毒感染,从而影响慢性自身免疫和炎性疾病。
例如,在人类克罗恩病中发现的一种常见基因变体ATG16L1,仅在小鼠感染诺如病毒时,才重新表现出小鼠克罗恩病样。鼠诺如病毒还引起IL-10缺陷的肠道炎症,但未引起野生型小鼠的肠道炎症。 在这些模型中,病毒引起的肠道炎症均取决于细菌的存在。
饮食-细菌-噬菌体的相互作用可能在调节系统性自身免疫中起作用
另一个新兴的跨界实例涉及基于两项无关研究的罗伊氏乳杆菌内的噬菌体。在TLR7转基因模型中,通过广泛增加浆细胞样树突状细胞和干扰素信号,一株罗伊氏菌与系统性狼疮有关。
如上所述,高抗性淀粉的饮食导致短链脂肪酸的产生,抑制了罗伊氏杆菌,保护小鼠免受疾病侵害。从机理上讲,短链脂肪酸介导的抑制可能是通过一个噬菌体介导的,该噬菌体在罗伊氏乳酸杆菌和其他乳酸菌中产生,以响应微生物群衍生的短链脂肪酸。
噬菌体的溶解循环反过来可以杀死宿主细菌,从而影响宿主的炎症反应。尽管这仍有待正式评估,饮食-细菌-噬菌体的相互作用可能在调节系统性自身免疫中起作用。
肠道菌群与ERV的相互作用可能与全身免疫反应有关
最后,另一个跨界的相互作用源于ERVs在自身免疫中的潜在作用。ERVs和抗ERV自身反应与狼疮等自身免疫性疾病的发病有关。
在狼疮小鼠模型中,ERV糖蛋白gp70的表达导致免疫复合物沉积引起的肾炎,而ERV沉默蛋白的减少与小鼠和人狼疮中ERV表达的升高有关。
肠致病菌鸡肠球菌易位到狼疮易感小鼠的肝脏可诱导肝细胞ERV gp70的表达。口服不可吸收万古霉素可降低鸡肠球菌以及肝脏和血清中的ERV gp70水平。万古霉素同样降低了抗ERV gp70抗体和免疫复合物,导致狼疮性肾炎的严重程度降低,这一表现可由小鼠的ERV gp70免疫复合物介导。
因此,肠道微生物群与ERV的相互作用可能与全身免疫反应有关,这一领域除了淋巴损伤外,还未被广泛研究。
免疫介导疾病中的宿主-微生物群相互作用越来越清楚。在这篇文章中,我们讨论了适用于几种免疫介导疾病的一般机制,并探索了相关的微生物靶向治疗。细胞机制,如跨屏障的病理转位,促进了作用于宿主细胞的分子机制,包括直接免疫激活和与自身抗原的交叉反应以及自身抗原的修饰。
然而,重要的是,宿主遗传倾向、环境和各种不明确的微生物因素决定了哪些共生体在免疫介导的疾病中发展为病理生物。这种对环境的依赖有助于解释为什么某些细菌在一种疾病中可能有益,但在另一种疾病中可能致病,这与宿主因素的众所周知的例子相似(例如,I型干扰素缓解多发性硬化与促进SLE)。
最后,进化压力可能不仅导致慢性疾病,这些疾病是由控制病原体的过程选择的(例如镰状细胞病和抗疟疾),而且还可能导致非传染性疾病,这些疾病的结果是试图遏制共生体。允许共生体越过障碍进入宿主可能有进化上的好处(如宿主防御)。随着易感宿主中宿主-微生物群相互作用的病理结果得到更好的定义,这是一个值得进一步探讨的有趣问题。
参考文献:
Ruff W E, Greiling T M, Kriegel M A. Host–microbiota interactions in immune-mediated diseases[J]. Nature Reviews Microbiology, 2020: 1-18.

谷禾健康
新冠肺炎是一种由新型冠状病毒(SARS-CoV-2)引起的呼吸道疾病,截至2020年5月1日,全球已有330多万人感染,致病和死亡率高,人类生命受到了极大威胁。近日,来自香港中文大学医学院Siew C. NG教授及其团队在国际顶级期刊《Gastroenterology》发表的一篇题为:Alterations in Gut Microbiota of Patients With COVID-19 During Time of Hospitalization (COVID-19患者住院期间的肠道菌群变化),揭示了COVID-19患者住院期间的肠道菌群特征,及其与疾病程度和粪便病毒载量的关联。虽然此项研究样本量有限,而且只包括中/重度疾病的住院患者,但是研究人员认为这些发现表明个体的肠道微生物组结构可能会影响宿主对SARS-CoV-2感染的敏感性和反应。这些数据突出了一个新的概念,即新颖和有针对性的肠道菌群调节方法可能代表着新冠肺炎及其共病的一条治疗途径。
摘要
虽然知道SARS-CoV-2可以感染胃肠道组织,但关于肠道微生物对感染SARS-CoV-2的易感性和感染严重程度的作用却知之甚少。在本文中,研究人员对15名新冠肺炎患者的粪便样本进行了宏基因组测序分析,并比较了6名社区获得性肺炎患者和15名健康对照的微生物数据,用以调查新冠肺炎患者住院期间的粪便微生物群的变化以及感染严重程度与病毒的粪便排出之间的关联。研究人员发现15名新冠肺炎患者与对照组相比,新冠肺炎患者在入院时和住院期间各时间点的粪便微生物群均有明显变化,主要表现为条件致病菌增多,有益共生菌减少。即使清除了SARS-CoV-2(通过咽拭子确定)和呼吸道症状缓解后,耗竭的共生菌和肠道菌群失调仍然存在。就结果而言,粪便微生物群的改变与粪便中SARS-CoV-2的含量和新冠肺炎的严重程度相关。疾病程度与基线时的粪芽孢菌属、多枝梭菌、哈氏梭菌丰度正相关,与普氏粪杆菌负相关;改变肠道菌群的策略可能会降低疾病的严重程度。

背景
来自武汉的早期报告显示,2-10%的新冠肺炎患者有胃肠道(GI)症状,包括腹泻,但最近的一项Meta分析报告称,高达20%的患者有胃肠道症状。研究发现,在近50%的新冠肺炎患者的肛拭子和粪便样本中都检测到了SARS-CoV-2病毒,这表明消化道可能是病毒复制和活动的肺外部位。此外,有研究证明SARS-CoV-2利用血管紧张素转换酶2(ACE2)受体进入宿主,该受体在呼吸道和胃肠道都高度表达。ACE2在控制肠道炎症和肠道微生物生态中起重要作用。肠道中的共生微生物生态系统是动态的,可以受入侵的病毒调节以促进刺激或抑制反应。研究表明,呼吸道病毒感染可能与肠道微生物群改变有关,这使患者容易受到继发性细菌感染。最近对支气管肺泡灌洗液的宏转录组测序显示,SARS-CoV-2感染患者的微生物群以病原菌或口腔和上呼吸道共生菌为主。了解SARS-CoV-2感染背后的宿主微生物扰动,这可能会影响对感染的应对和未来各种免疫干预措施(如疫苗)的有效性。
实验设计
1.受试者筛选
研究涉及15名经实验室确诊感染SARS-CoV-2并因此住院的新冠肺炎患者和6名社区获得性肺炎住院患者(肺炎对照)以及15名健康人(健康对照)。
其中:
新冠肺炎患者是指对RdRp基因的不同区域进行连续两次RT-PCR检测确认。肺炎对照是指在两份呼吸道样本中SARS-CoV-2的PCR检测结果均为阴性。健康对照是指在过去3个月中没有病史或抗生素摄入史的个体,且SARS-CoV-2的PCR检测结果为阴性。
2.粪便样本采集
新冠肺炎患者每周连续采集粪便标本2~3次,直至出院。

“Cov”指新冠肺炎患者;“D0”表示住院后收集第一次大便的基线日期,以下以“D”开始的时间点表示自基线收集粪便后的天数;“+ve throat swab”表示鼻咽/咽喉/混合拭子检测中首次出现SARS-CoV-2病毒阳性结果;“-ve throat swab”表示在连续两次鼻咽/咽喉/混合拭子检测中首次出现SARS-CoV-2病毒阴性结果,患者随后出院。“Symptom onset”表示首次出现症状;
3.样本分析手段
利用RT-PCR检测技术对粪便样品中的SARS-CoV-2定量。再利用宏基因组测序技术对粪便样品进行微生物分析。
主要结果
1. 新冠肺炎患者肠道菌群变化及病程纵向变化。新冠肺炎患者肠道菌群的特点是条件致病菌富集,而有益共生菌减少。并且这种菌群失调在新冠肺炎病程中持续存在,即便是在SARS-CoV-2清除/恢复之后。
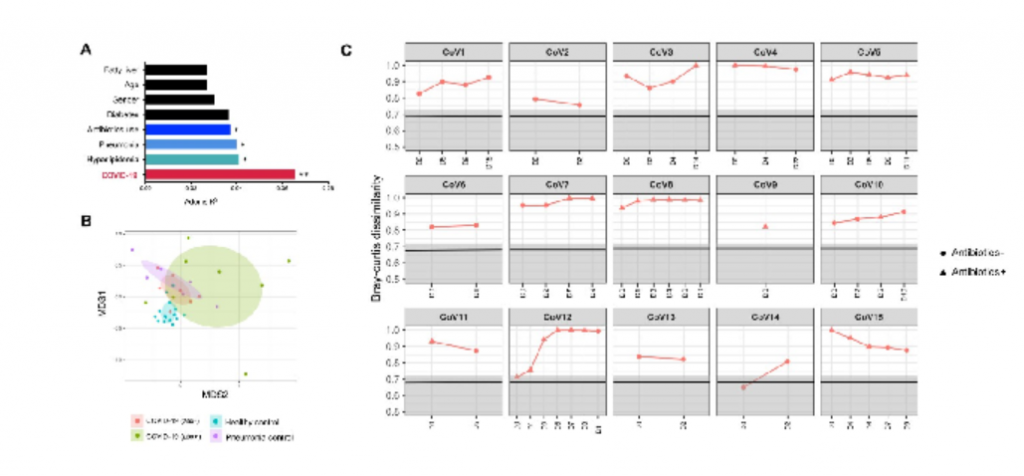

15名新冠肺炎患者中,7名未使用抗生素药物[COVID-19(abx-)],8名在基线(定义为入院后第一次粪便采集之日)接受经验性抗生素使用[COVID-19(abx+)]
A).通过PERMANOVA检验确定脂肪肝、年龄、性别、糖尿病、抗生素使用、高脂血症在肠道菌群组成中的影响大小。结果表示新冠肺炎感染对肠道菌群组成的影响最大(P=0.002,** p<0.01,* p<0.05)
B). 基于Bray-Curtis相异度的NMDS(非度量多维尺度)图观察COVID-19微生物群落的变化。从整个微生物群落水平看,健康对照组和COVID-19(abx-)的粪便微生物群各自聚集,且COVID-19(abx-)的微生物群落更具异质性。新冠肺炎患者伴随着抗生素的使用,其微生物群落组成与健康对照组差异越来越大。
C).新冠肺炎患者在病程中的肠道菌群与健康对照组的不同。Bray-Curtis计算。灰色区域表示健康对照者肠道菌群的Bray-Curtis差异范围,黑色实线表示健康个体之间的中位数差异。“圆点”表示使用了抗生素,“三角形”表示未使用抗生素。总体而言,所有新冠肺炎患者的肠道菌群都保持着稳定,但无论是在疾病进展中还是在SARS-CoV-2清除后,其肠道菌群都与健康对照组明显不同。值得注意的是,患者CoV4在第5天出院,但他在第22天的肠道微生物群与健康人还是持续不同。
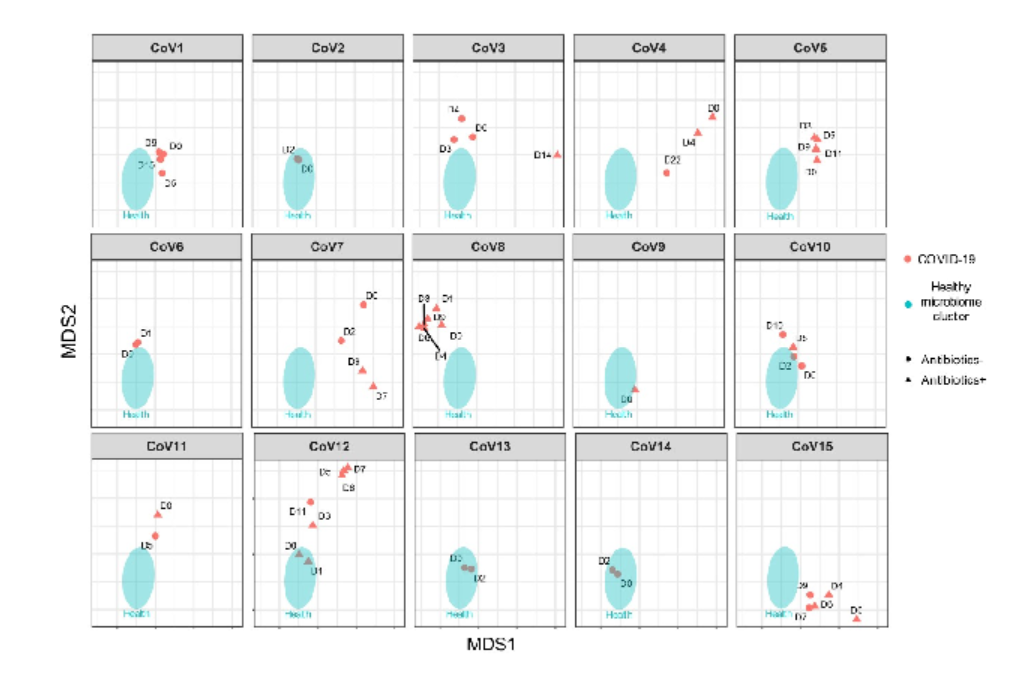

上图所示5名新冠肺炎患者的微生物群(CoV1,4,7,11,15)随着时间的推移显示出与健康微生物群更接近,而患者CoV3,5,8,10和12的微生物群随着时间的推移与健康微生物群变得更加不同
2.肠道菌群与新冠肺炎病情严重程度的相关性。肠道厚壁菌门细菌与COVID-19严重程度的相关性突出表明,细菌成员在调节人类对SARS-CoV2感染的反应和感染严重程度方面具有潜在作用。
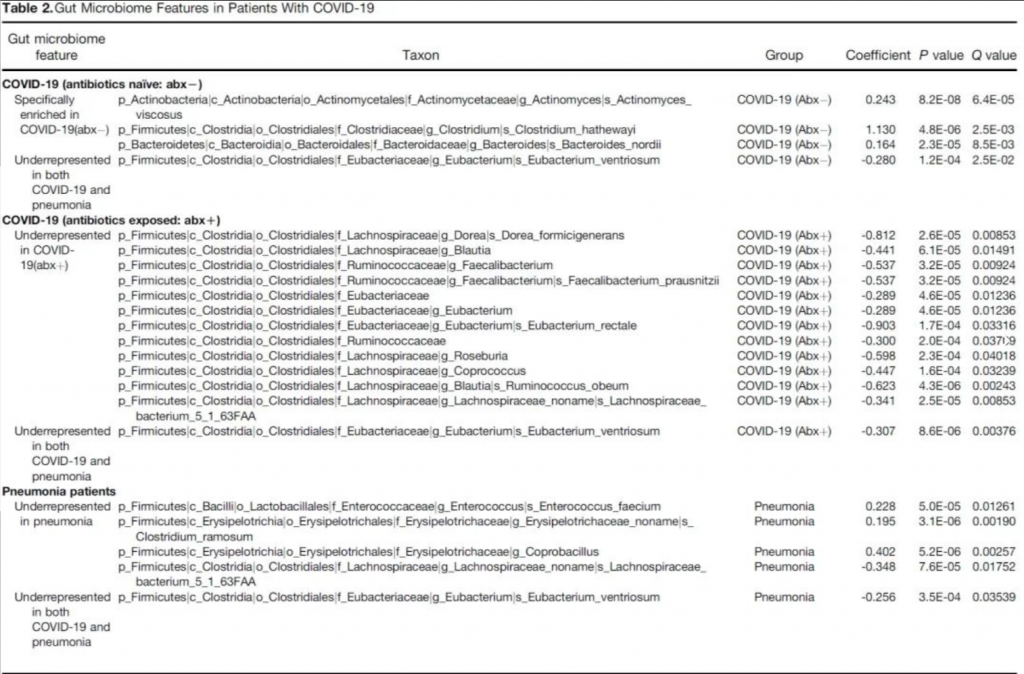

总共发现23个细菌分类群与新冠肺炎病的严重程度密切相关,其中大部分(15个)来自厚壁菌门。与新冠肺炎疾病严重程度最具正相关的细菌有三种,分别为来自厚壁菌门的Coprobacillus菌属,Clostridium
ramosum和Clostridium hathewayi菌种,且Coprobacillus菌已被证明能显著上调ACE2在小鼠结肠中的表达。与此相反,两种最常见的益菌Alistipes onderdonkii和Faecalibacterium
prausnitzii,它们与新冠肺炎的疾病严重程度呈负相关。“correlation coefficient
Rho”表示Spearman相关系数。
3.拟杆菌物种可能通过阻碍SARS-CoV-2通过ACE2进入宿主,而在抗击SARS-CoV-2感染方面具有潜在的保护作用。肠道Erysipelotrichaceae科可能在增强宿主肠道感染SARS-CoV-2方面发挥作用。
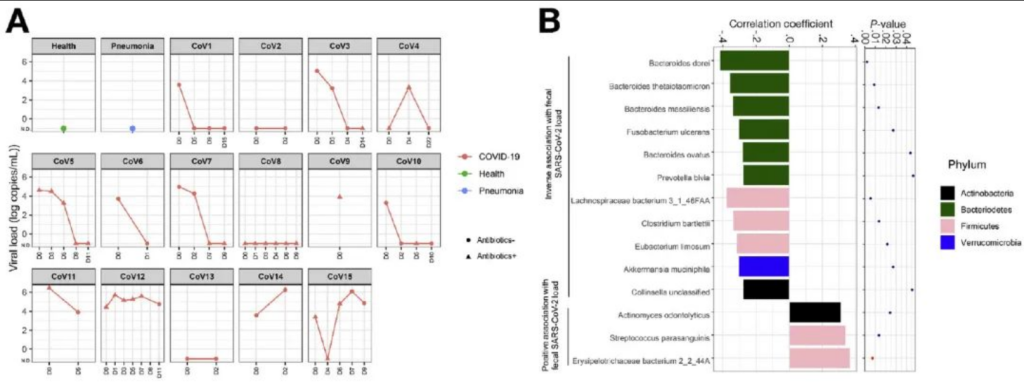

A). 新冠肺炎患者粪便中SARS-CoV-2病毒含量的纵向变化。15名患者中有11名患者住院期间在粪便中检测到SARS-CoV-2核酸,其中5名患者体内的SARS-CoV-2病毒随着时间的推移被清除了。
B).病程期间细菌与粪便病毒含量的Spearman相关分析。在所有粪便样本中,共有14种细菌与粪便中的SARS-CoV-2病毒含量显著相关。4种拟杆菌种包括Bacteroides dorei、Bacteroides thetaiotaomicron , Bacteroides massiliensis和Bacteroides ovatus,与粪便中SARS-CoV-2含量呈显著呈负相关。值得一提的是,这4种物种都与小鼠结肠中的ACE2表达下调有关。Erysipelotrichaceae bacterium
2_2_44A菌种与粪便中SARS-CoV-2含量呈显著正相关。一些研究表明Erysipelotrichaceae科与胃肠道炎症疾病有关。
结论
综上所述,研究发现尽管清除了SARS-CoV-2病毒,但大多数患者仍然在COVID-19中损失了有益的物种,这表明接触SARS-CoV-2感染和/或住院治疗可能对肠道微生物群有更持久的有害影响。在新冠肺炎患者肠道中发现的致病菌中,Clostridium hathewayi的基线丰度越高,新冠肺炎病情越重。而以带有能够抑制结肠ACE2表达的几种拟杆菌与SARS-CoV-2粪便病毒含量呈负相关。这些发现表明个体的肠道微生物组结构可能会影响宿主对SARS-CoV-2感染的敏感性和反应。但此项研究仍具有局限性,研究人员认为最主要的问题是样本量有限,且由于实验设计中只包括中/重度疾病的住院患者,这些发现可能并不适用于所有的新冠肺炎病例,包括轻度或无症状的新冠肺炎。而利用住院后收集的粪便样本进行的微生物群分析并不能代表新冠肺炎发病时真实的基线微生物群,也不能代表发病前的基线微生物群。但研究人员表示他们的研究提供了新冠肺炎会导致长期肠道菌群失调的证据及其与粪便中SARS-CoV-2病毒含量和疾病严重程度的关系。这些数据突出了一个新的概念,即新颖和有针对性的肠道菌群调节方法可能代表着新冠肺炎及其共病的一条治疗途径。
TIPs:
轻度,如果没有肺炎的影像学证据
中度,如果肺炎伴随发烧和呼吸道症状出现
严重,如果呼吸频率≥30次/分钟,呼吸环境空气时血氧饱和度≤93%,或动脉血氧分压/氧体积分数≤300mmHg(1mmHg=0.133kPa)
危重,如果休克或呼吸衰竭需要机械通气或器官衰竭需要重症监护。

近日,美国加州理工的一项研究表明,当防止啮齿动物食用粪便时,它们的小肠微生物群与人类肠道中的微生物群落更为相似。
越来越多的人研究表明肠道微生物群参与人身心健康的许多方面,因为大多数营养和药物都是在这个位置被身体吸收的。为了研究肠道微生物群,研究人员通常使用小鼠和大鼠,因为这些动物很容易照顾、繁殖迅速,并且与人类有许多生物学上的相似之处。 但人类和这些动物之间存在着显著的差异。 其中一个差异-实验室啮齿动物吃自己粪便的倾向-可能对与小肠微生物群有关的研究有重大影响。
近日,发表在“Microbiome”杂志上的一项研究中,RustemI smagilov实验室的研究人员发现标准实验室小鼠(消耗粪便)在其小肠微生物群落中与人类相比可能有重要的差异。
研究界几十年来一直意识到实验室啮齿动物消耗粪便,这是一种被称为共养的做法,但尚未理解的是,这种活动实际上是如何影响小肠内的条件的。大多数研究人员通过将老鼠安置在允许粪便通过电线的地板上来解决共生问题。 然而,老鼠和老鼠非常擅长吃便便,因为它出来了,因此研究人员怀疑电线地板实际上可能没有那么有效。
在这项研究中,进一步实验室小鼠小肠中的微生物群,以了解当这些小鼠被阻止食用自己的粪便时,微生物群及其功能是否不同,如果这样做会使这些实验室小鼠更类似于人类。为了找出答案,研究小组给老鼠安装了“尾巴杯”-基本上是小老鼠尿布,捕捉动物的繁殖力,防止它们吃。研究人员分析这些尿布症小鼠的肠道含量和微生物群落时,他们发现与标准小鼠相比,小肠的肠道存在显着差异。
Bogatyrev称通过共同预防将粪便细菌带入小肠的过程是“自我重新接种”。通过消耗它们自己的粪便,小鼠将细菌从大肠重新引入小肠,并改变上消化道的状况和微生物群落。
遗憾的是,该研究中Bogatyrev博士和他的同事并未试图确定自我再接种一般如何影响涉及小鼠的研究,但他们怀疑,如果小鼠模型的消化系统的行为不像人类的消化系统,那么可能会对许多研究领域产生广泛的影响。
但是研究人员指出:“一个领域可能是饮食研究。” “如果小肠中有更多微生物,反过来会影响那里的胆汁酸成分,饮食中的营养成分可能会被不同地吸收。例如,脂肪。另一个区域可能涉及益生菌和肠道微生物生态自我再接种可能会在控制给药方案中导致不一致的结果,因为您不知道动物本身如何将益生菌重新引入肠道。
此外,对共同预防至关重要的另一个大领域可能是药物研究。研究人员在临床前模型中使用啮齿动物,所施用的药物通常被小肠吸收,在那里它们可能会受到小肠微生物群的影响。这项工作表明,自我再接种的效果需要经过严格控制排除,这将为未来肠道微生物研究带来很多新发现和机会。
参考文献
1. Said R. Bogatyrev, Justin C. Rolando, Rustem F. Ismagilov. Self-reinoculation with fecal flora changes microbiota density and composition leading to an altered bile-acid profile in the mouse small intestine. Microbiome, 2020; 8 (1) DOI: 10.1186/s40168-020-0785-4
2. California Institute of Technology. “Making the mouse gut microbiome more human-like.” ScienceDaily. ScienceDaily, 13 February 2020.

谷禾健康 原创


孩子出现偏瘦小,不太会说话等状况有可能是发育迟缓的信号。
调查显示,有97%的家长不知道宝宝生长发育的基本规律;30%的家长即使发现宝宝出现生长发育迟缓时,也会盲目乐观;还有部分家长甚至认为发育迟缓太少见,根本不会发生在自己孩子身上。
但其实孩子出现发育迟缓的概率比我们想象的更高,关于目前发育迟缓的人数,我们来看一组最新的统计数据:


也就是说,世界上有大约四分之一的五岁以下儿童受发育迟缓的困扰。
此外,儿童营养状况与死亡率的变化也有着密切的关系。据世界卫生组织报告,全球5岁以下儿童死亡归因于营养不良的比例达35%,急性重度营养不良儿童的死亡风险是非营养不良儿童的9倍。
那么发育迟缓究竟是什么?会带来什么后果?所谓的最关键时期是哪个阶段?与哪些因素有关呢?
发育迟缓/矮小是指在生长发育过程中出现速度放慢或是顺序异常等现象。生长发育迟缓表现往往是多方面的,多有体格发育、运动发育及智力发育落后但也可以某一方面为突出表现。
如果家长不引起重视,有可能导致错过了最关键的时期。
《中国0-6岁儿童营养发展报告》指出:儿童早期特别是从胎儿期到出生后2岁(生命早期1000天),是决定其一生营养与健康状况最关键时期。
在这个关键时期的营养不良,可能导致儿童不可逆转的生长和认知发育迟缓,影响智力潜能的发挥,降低学习能力和成年后的劳动生产能力,导致成年后患肥胖、高血压、冠心病、糖尿病等诸多慢性疾病的风险增大。
判断营养状况指标:
MAZ——微生物群 / 年龄 Z评分
HAZ(LAZ)——身高 / 年龄 Z评分
WHZ——体重 / 身高 Z评分
WAZ——体重 / 年龄 Z评分
世界卫生组织定义的生长发育标准:
发育迟缓:年龄在0-59个月的儿童中低于身高/年龄中位数两个标准差的百分比,HAZ ≤ -2.
消瘦:年龄在0-59个月的儿童中低于体重/身高中位数两个标准差的百分比,WHZ ≤ -2.
严重消瘦:年龄在0-59个月的儿童中低于体重/身高中位数三个标准差的百分比,WHZ ≤ -3.
临床评估
母亲怀孕妊娠史、生产过程、新生儿健康指标、家族史、发育史、体格检查、神经系统检查等。
量表评估
从运动、语言、社会适应能力、社交能力等多维度评估。
另外还可以结合影像学评估、基因评估、代谢评估、肠道菌群评估等。
注:早期如需自行观察评估,可对照参考文末附录——发育健康表。
发育迟缓的原因有很多,牵涉到比如母体子宫内生长迟缓、神经内分泌和激素因素、儿童早期腹泻和其他感染频繁、环境肠道功能障碍、环境毒素和遗传因素等。
在20%到25%被认为“发育不良”的婴儿和儿童中,生长发育不良始于母体子宫内:早产和宫内生长受限,尤其是两者的结合,会使产后孩子发育迟缓的风险增加2倍到7倍。
母亲的健康程度、成熟度、经济和社会地位在LBW发病中起着核心作用,并且伴随着孩子出生后的成长。易导致LBW和儿童发育迟缓的因素包括:
有中度或重度产妇营养不良、发育迟缓病史或早孕的病史;
妊娠体重增加不理想;
产妇吸烟;
不合适的婴儿喂养等。
肠道感染带来的影响包括明显的腹泻,以及一系列潜在的长期影响,如生长衰竭、认知障碍和后来的生活代谢综合征,这些可能伴随着‘无症状’(指没有明显的腹泻)或症状性肠道感染。
除了腹泻与认知受损的潜在关联之外,平克顿等人在巴西东北部的研究也报告了腹泻对生长的显著影响。Kvestad等人同时也描述了北印度儿童腹泻与独立于生长发育的认知障碍的关系。
导致这种感染的几种特定的肠道原生动物和细菌病原体包括肠凝性大肠杆菌、隐孢子虫、弯曲杆菌和贾第虫。
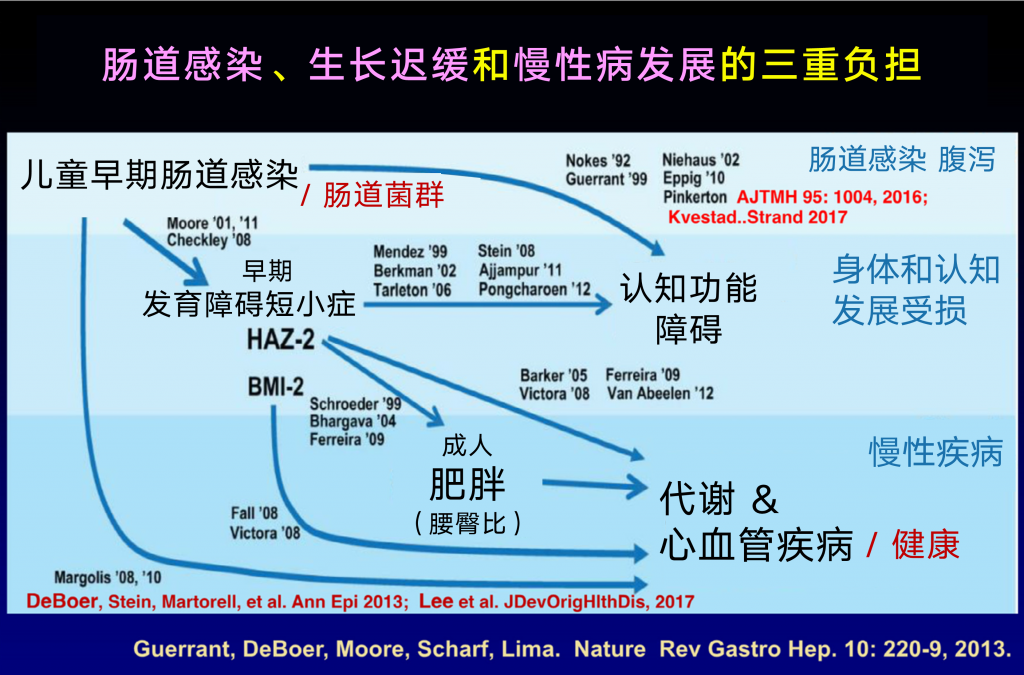

肠道感染,腹泻等状况不能忽视,有可能发展为发育迟缓,从而损害认知功能,甚至伴随着肥胖和慢性病的风险。
即使在没有腹泻的情况下,小肠对碳水化合物和α1-抗胰蛋白酶的通透性也会增加,营养素吸收不良。 许多患有环境肠道功能障碍的儿童也缺乏被小肠吸收的微量营养素,如铁和锌,如果耗尽,会降低食欲、减少绒毛表面积和胃肠吸收能力。
小肠炎症与C反应蛋白水平高有关,伴随细胞因子的释放,从而降低食欲和食物摄入量,并阻碍软骨细胞生长因子的产生和作用。发育迟缓儿童白细胞介素6(IL-6)水平升高,锌的摄入不足和吸收不良也可能减弱线性生长。因此适当进行锌的补充也是有必要的,具体关于食物的干预将在后面的章节详细阐述。
小A —— 1岁,发育迟缓
——本案例数据取自我们的肠道菌群健康检测数据【谷禾健康数据库】
对应的和发育迟缓相关的最主要因素从疾病风险中可以看到,肠炎和过敏性腹泻提示较高风险。其中过敏性腹泻是导致营养不良的很重要因素,提示存在较为严重的过敏情况,需要进行过敏原检查。
肠炎部分通过对照炎症指标发现降钙原素PCT和高敏C反应蛋白都超标,提示存在炎症情况。

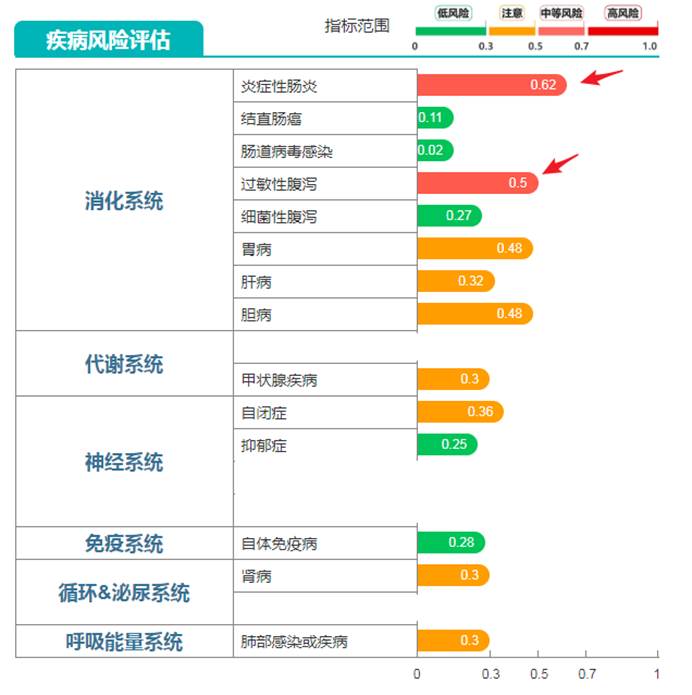
针对过敏的情况,检查肠道屏障和LPS等指标并未发现异常,表明免疫状况并未有异常,主要的可能是之前经历过病原物感染,且肠道炎症一直存在。
炎症本身也会改变肠道菌群,这在后面章节会详细阐述。
在婴儿期或幼儿期出现环境肠道功能障碍(EED)可能会放大宫内和围产期持续的生长缺陷。
环境肠道功能障碍(EED)是一种以绒毛萎缩和隐窝增生为特征的获得性小肠亚临床疾病,病因不明,可能占所有发育迟缓病例的40%以上。


在生活在不卫生条件下的发育迟缓儿童中普遍存在环境肠道功能障碍,与食品和水中的微生物和寄生虫污染有关。对患有环境肠道功能障碍的儿童进行的生物标记研究表明,存在亚临床炎症,这可能是由于暴露于病原体、饮食变化或微生物群的干扰所致。除了炎症,微生物引起的厌食症也可能是一个因素。
决定环境肠道功能障碍的因素
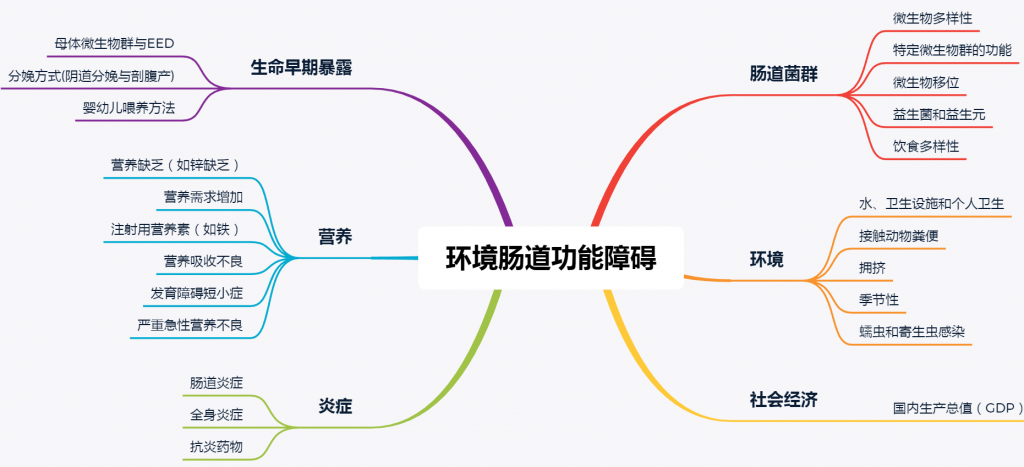

发育迟缓的儿童LAZ值从出生到18至24个月之间通常会下降到最低点,这可能是因为快速成长的婴儿和蹒跚学步的孩子特别容易受到营养、感染和有毒的环境毒害。
结合胎儿、围产期和产后早期的营养缺陷,环境肠道功能障碍可能会限制营养的传递和利用,从而损害小肠上皮细胞、肾单位、胰腺β细胞、骨骼肌细胞和生长板软骨细胞的成熟和增殖。
导致发育迟缓的因素可能包括肠道微生物群的不成熟和某些肠道微生物和/或母乳成分的缺乏,如唾液化低聚糖,这些低聚糖促进肠道屏障完整性、营养利用和组织合成代谢。
肠道微生物群代表了几十万亿个微生物,这些微生物在生命早期是从母体和其他来源获得的,被长期保留,并在生命的第一年经历一种生态演替。这些微生物对宿主生物学有广泛的影响,包括对膳食成分代谢、胆汁酸转化和保护肠道病原体的影响。 在没有腹泻的情况下接触微生物可能会对吸收上皮造成直接损害,从而损害热量的吸收。
最近的一项研究表明,贾第虫感染可能导致肠道异常通过直接破坏肠道微生物群。多项研究表明,一个不成熟的微生物群可能导致生长迟缓。尤其是,肠杆菌科的异常高患病率持续超过6个月的似乎与生长迟缓有关。已发表的研究表明,其中一些细菌可能直接损伤上皮。肠杆菌科以外的细菌,如链球菌,也可能直接造成伤害。越来越多的证据表明,不同的常驻微生物群对宿主既有有益的影响,也有有害的影响。
此外,微生物群培养免疫系统并诱导粘膜IgA的产生。
一项来自美国弗吉尼亚大学的研究,在271名0-24个月的出生队列中,每月对生长、腹泻发病率、疾病、病原体感染和抗生素接触情况进行评估。通过对6、12、18和24个月粪便样本进行16s rRNA测序,来量化肠道菌群多样性和特定菌群的丰度。
腹泻频率、持续时间和严重程度与细菌多样性和丰富性呈负相关(P<0.05)。
出生时发育不良的儿童(LAZ ≤ -2)在取样时也严重发育不良(LAZ ≤ -3),其腹泻相关的细菌多样性减少程度最大,腹泻后菌群多样性恢复最慢。菌群多样性的增加预示着6-18个月后腹泻的减少。
营养不良的儿童与非营养不良儿童的肠道菌群落有显著差异
我们来看一项来自印度南部对发育迟缓幼儿肠道微生物群的纵向分析:
该研究针对印度南部 每3个月至2岁出生队列中10名低出生体重和发育迟缓儿童(病例)和10名出生体重正常、无发育迟缓儿童(对照组)检测其肠道微生物群落组成和粪便微生物多样性。
发现所有儿童的多样性指数均随年龄增长而增加(P<0.0001),但发育不良的儿童的拟杆菌门相对丰度百分比高于对照组(P=0.043)。对照组儿童的微生物群中富含益生菌,包括双歧杆菌和粘膜乳杆菌,而发育不良儿童的微生物群中富含致病菌群,包括脱硫弧菌属和弯曲杆菌目。
在营养不良的情况下,特定细菌群的比例表达发生了改变——致病菌增加,有益菌减少
再来看一组87名6-59个月的儿童的粪便检测数据。
营养不良的两个队列的粪便微生物群落,包括肠杆菌、大肠杆菌、克雷伯氏菌和志贺氏菌在内的变形菌中致病菌群比例增加,在其他地方也已得到证实。不过需要注意与炎症性肠病的区分。
另一方面,在营养不良的肠道中潜在有益菌属被耗尽。在营养不良儿童肠道中缺乏罗斯氏菌、粪杆菌和丁酸梭菌(结肠细胞丁酸的重要来源)以及乳酸杆菌和双歧杆菌(在某些条件下可以减少炎症、增强肠道屏障功能、抑制病原体和介导其他有益作用)。
小A —— 1岁,发育迟缓
——本案例数据取自我们的肠道菌群健康检测数据【谷禾健康】
还是小A的报告,可以看到其有害菌比例偏高。
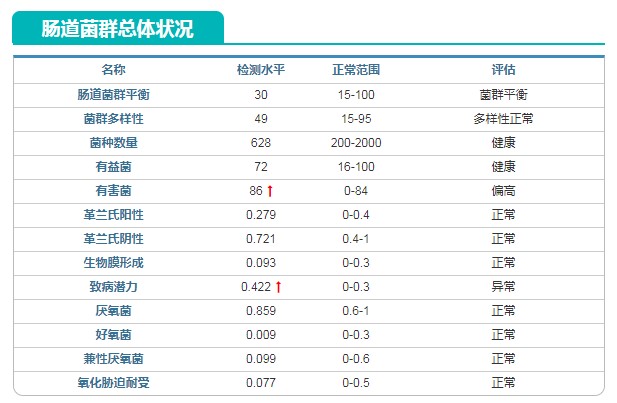

主要菌群中,正常菌以普通拟杆菌为主,此外他的双歧杆菌水平偏低一些。其他的菌均不是健康人的常见菌,且肺炎克雷伯氏菌也存在一定比例,需要对肠道菌群进行一定的干预。
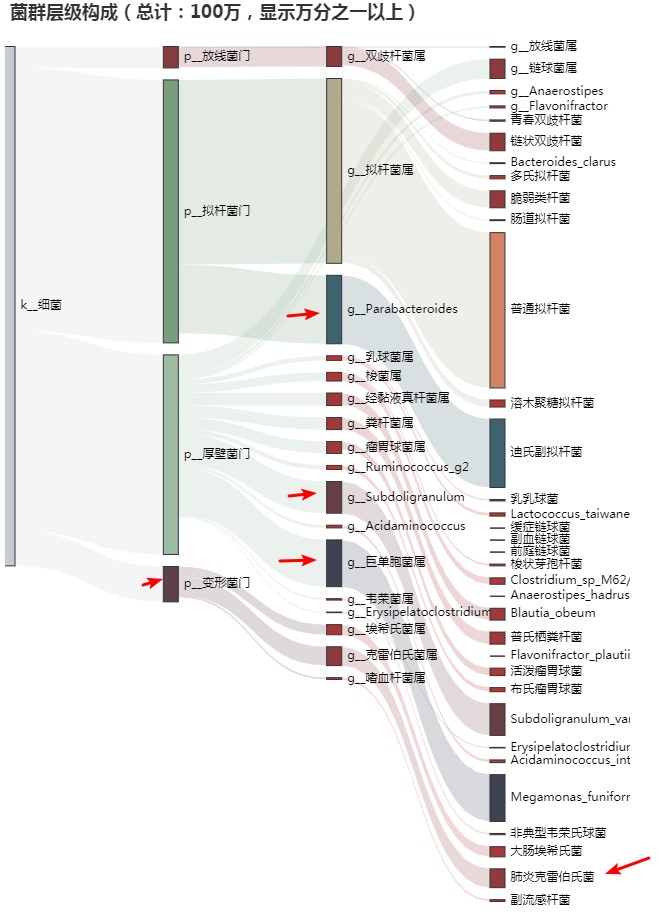

中度或重度急性营养不良与肠道微生物群有因果关系,并与肠道微生物群的持续不成熟有关
美国华盛顿大学基因科学与系统生物学中心的Michelle Smith及其同事对非洲东南部内陆国家马拉维的317对双胞胎婴儿进行了研究,观察到3岁后发现,恶性营养不良(kwashiorkor)的病因除了营养摄入不足,还与肠道菌群有关。
为了验证肠道微生物群正常发育中的干扰与营养不良有因果关系的假设,研究人员首先将随机森林(RF)这一机器学习方法应用于16SrRNA数据集,该数据集是从健康马拉维婴儿和儿童在他们出生后的头三年内的粪便中连续采集的细菌。
基于该模型的指标MAZ用于定义营养不良程度不同的婴儿和儿童粪便微生物群的发育(成熟)状态。
将从6个月和18个月大的健康生长模式或不同程度营养不良的儿童身上获得的粪便样本移植到喂食代表性马拉维饮食的无细菌幼鼠体内。
结果发现:马拉维出生队列中营养不良的儿童肠道微生物群不成熟。与健康儿童的微生物群不同,未发育成熟的微生物群能将生长受损、骨形态改变和肌肉、肝脏和大脑中的代谢异常传递给无菌小鼠。

(A) 马拉维婴幼儿正常肠道微生物群落发育模型,基于25个细菌类群的相对丰度,它们提供了定义个体(粪便)微生物群“年龄”或成熟状态的微生物特征
(B)健康(H)或发育不良和体重不足(Un)的婴儿和儿童的粪便样本移植到喂养马拉维饮食的无菌幼鼠的单独组中。营养不良捐献者的未成熟微生物群向小鼠传递了受损的生长表型。

(C)不成熟的微生物群的其中一部分也有生长发育迟缓的证据。接受了6个月宝宝的健康或营养不良的菌群的小鼠们不久后混在一起同居,导致健康供体微生物群(HCH)中的菌群群侵入营养不良供体在受体动物中的菌群,并防止生长障碍。
肠道菌群的能量收获对宿主代谢有很大的贡献。其影响食物中能量的获取、新的微量营养素合成和胆汁酸的稳态。
菌群通过将不可消化的饮食成分转化为上皮细胞可能吸收的能量形式,微生物群对成人热量需求的估计为10%。然而,体重不足的印度儿童粪便缺乏发酵复杂植物低聚糖和肽聚糖的微生物基因。 同样,在新生小鼠蛋白质-能量营养不良模型中观察到盲肠和结肠细菌的丰度下降,以及它们能够代谢肽聚糖的基因丢失。因此,菌群失调会导致饮食中能量提取效率较低。
一些微生物可以通过从各种饮食或内源性来源(如尿素、氨)中回收氮来合成氨基酸,尽管这些微生物对个人总蛋白质需求的贡献程度尚不清楚。然而,氨基酸代谢是严重营养不良儿童和营养不良小鼠、大鼠和猪代谢组学分析中最严重干扰的生物途径之一。
同样,维生素k和水溶性b族维生素的一部分是由肠道菌群合成的。这些菌株的耗竭在理论上可能影响宿主的维生素状态。营养不良儿童中发现了大量的维生素缺乏症,和蛋白质-能量营养不良的多项研究中的代谢组学分析表明,维生素代谢途径中中间体的浓度发生了变化。
当甘氨酸或牛磺酸结合胆汁酸进入小肠时,其乳化特性促进了膳食脂类和脂溶性维生素的摄取,其抗菌性能调节肠道微生物群落。 一些细菌基因组编码增强其在胆汁中生存能力的酶。这些酶包括胆盐水解酶(BSH),将初级胆汁酸转化为次级胆汁酸。这些微生物活动可能对宿主生理产生深远的影响,包括胃肠道转运和脂质代谢。
姜黄通过增加共轭胆汁酸、牛磺去氧胆酸和牛磺-胆酸硫酸盐的浓度来减缓无菌小鼠的胃肠道转运。此外,克隆BSHs的肠道表达改变了血浆、肝脏和粪便中胆汁酸的浓度,影响了参与脂质代谢的宿主基因的转录,降低了血清胆固醇,肝脏甘油三酯和体重增加。
肠道微生物可以通过降低牛磺酸结合的β-鼠胆酸的浓度来影响回肠胆汁酸转运和代谢相关基因在肝脏中的表达,这是一种核芳烃类x受体拮抗剂。虽然目前尚不清楚改变的微生物种群在多大程度上导致儿童和儿童胆汁酸谱异常,但随着蛋白质-能量不足或环境肠道功能障碍的出现,改变的胆汁酸可能影响能量代谢、膳食脂肪和脂溶性维生素的吸收,并最终影响体重增加。
研究人员熟悉使用标准化生长曲线来评估儿童生长与正常轨迹相比的进展。 Planer博士指出,类似的方法可以应用于肠道微生物的发展,产生一个Z评分(MAZ)。 通过对三组健康孟加拉婴儿和儿童的粪便取样,验证了这一假设。
为了阐明哪些细菌是健康婴儿和儿童IgA反应的靶点,居住在圣路易斯地区的40对双胞胎和他们的母亲被招募为健康对照组,从这些母亲和儿童中获得多个粪便样本。结果表明,儿童IgA靶向性的成熟,24个月大时,儿童的模式与母亲的模式相似。
然后将该方法应用于恶性营养不良综合征(蛋白质缺乏)的马拉维双胞胎,数据显示,与健康的双胞胎相比,患恶性营养不良综合征的双胞胎肠杆菌具有很强的IgA靶向性。给药后,肠杆菌科的IgA靶向性降低。
此外,阿克曼菌(Akkermansia)是健康儿童微生物群中IgA的靶点。进一步的研究表明,从营养不良儿童的肠道微生物群中纯化的IgA阳性细菌群的转基因小鼠受体表现出肠道组织病理学,其特征是肠上皮屏障破坏和体重减轻;可通过从一个健康的微生物群中给药两种IgA靶向细菌来防止这些影响。

如上所述,随着儿童年龄的增长,肠道微生物群落存在着相当可重复的演替。普雷沃菌属在发展中国家正常儿童出生后的头五年中数量普遍增加。相比之下,肠杆菌科减少,是生命前六个月最丰富的。在最初的两年后,韦荣球菌属、链球菌和乳酸杆菌同样减少。
一项研究中对1300名中重度腹泻儿童的粪便中的微生物进行了分析,与来自1735名无腹泻对照儿童的样本相比。这些儿童年龄不到60个月,来自肯尼亚、冈比亚等。 研究表明,某些特定的菌群与生长不良有关。最引人注目的是链球菌和大肠杆菌与生长发育不良的关系。 此外,普雷沃菌属和粪杆菌属在所有年龄类别中都与良好的生长有关。在定植志贺氏菌严重的患者中,发现某些乳酸菌对腹泻有保护作用。唾液乳杆菌菌株在体外培养时抑制了所有志贺氏菌和腹泻大肠杆菌的生长。
此外,唾液乳杆菌的丰度升高与感染志贺氏菌时出现症状的风险之间有很强的相关性。具体来说,粪便中没有唾液乳杆菌的儿童有很高的感染志贺氏菌症状的风险;只要唾液乳杆菌存在,甚至丰度较低时,儿童也会受到保护,免受志贺氏菌引起的疾病。有趣的是,对照组粪便中唾液乳杆菌的水平并不影响微生物群中其他属的丰度,这表明可能产生直接抗菌作用。此外,乳酸菌对其他病原体有预防保护作用。
国际著名临床诊断实验室创始人Stephen Barrie博士对肠道失调定义为“具有有害影响的肠道菌群的生存状态”。
肠道失调有四种类型:腐败、发酵、缺陷和致敏
参考自:Stephen Barrie ND. Intestinal Dysbiosis and the Causes of Disease. healthy.net
一、 腐败
腐败失调是由于饮食中高脂肪和动物肉,低不溶性纤维。这种饮食结构会使粪便中拟杆菌的浓度升高,双歧杆菌的浓度降低。增加胆汁流量,诱导细菌脲酶活性。这种饮食引起的菌群动态变化主要发生在厌氧菌之间,但其影响可通过胆汁或尿胆素原中粪便pH值的升高(部分原因是氨生成量升高)和短链脂肪酸(特别是丁酸)的减少来衡量。
腐败失调有关的菌与疾病风险:
1、拟杆菌、变形杆菌和克雷伯氏菌中发现尿素酶,由高肉含量的饮食诱导,将尿素水解成氨,提高粪便pH值。相对较高的粪便pH值与结肠癌的发病率较高有关。
2、氨基酸的细菌脱羧作用产生血管活性和神经毒性胺,包括组胺、八胺、酪胺和色胺;这些胺通过门静脉循环吸收并在肝脏中脱氨。在严重的肝硬化中,它们进入系统循环,导致脑病和肝功能衰竭低血压。
3、细菌色氨酸酶将色氨酸降解为致癌酚类物质,与脲酶一样,是由高肉类饮食引起的。
4、细菌酶如β-葡萄糖醛酸酶能水解结合的雌激素和胆汁酸。肝脏结合和胆汁排泄是调节体内雌激素水平的重要机制。细菌去连接增加雌激素的肠肝循环。西方饮食会增加粪便中去结合酶的水平,降低粪便中的雌激素水平,提高血液和尿液中的雌激素水平,可能会导致乳腺癌的发生。
5、β-葡萄糖醛酸酶和其他水解细菌酶也能解结合胆汁酸。去结合胆汁酸对结肠上皮有毒并引起腹泻。它们或其代谢物似乎致癌,被认为有助于结肠癌和溃疡性结肠炎的发展。肠道菌群也会将原代胆汁酸(如胆酸和鹅脱氧胆酸盐)还原为次级胆汁酸(如脱氧胆酸(DCA)和石胆酸)。继发性胆汁酸的吸收效率低于原发性胆汁酸,更有可能导致结肠癌的发生。结肠癌的患病率与粪便中DCA的浓度成正比。
二、 发酵
这是由于内源性细菌在胃,小肠和盲肠中过度生长而引起的碳水化合物不耐症。小肠细菌过度生长的原因和影响已得到很好的表征。
胃酸过少,运动异常,手术盲环引起的淤滞,免疫缺陷或营养不良都会促进细菌的过度生长。小肠寄生虫病也可能导致细菌过度生长。小肠细菌过度生长引起的某些损害是由细菌蛋白酶的作用引起的,这些蛋白酶降解胰腺和肠道刷状缘,导致胰腺功能不全,粘膜损害和吸收不良。
在更严重的情况下,肠绒毛变钝变宽,单核细胞浸润固有层。细菌过度生长引起的内毒素血症会导致实验动物的肝损害。
胃细菌过度生长会增加全身感染的风险。胃细菌可以将饮食中的硝酸盐转化为亚硝酸盐和亚硝胺。因此,胃酸过少的人患胃癌的风险增加。小肠的一些细菌感染会增加肠的通透性。
碳水化合物不耐受可能是细菌过度生长的唯一症状,无法与肠道念珠菌病区分开。无论哪种情况,都可以将膳食糖发酵产生内源性乙醇。小肠长期暴露于乙醇本身可能会损害肠道通透性。糖的细菌发酵的另一产物是D-乳酸。小肠发酵可能是这些患者D-乳酸性酸中毒的原因。
根据治疗结果,研究肠道发酵综合症的英国医生初步得出结论,多数病例是由于酵母菌过度生长引起的,大约20%的细菌起源于细菌。症状包括腹胀,碳水化合物耐受不良,疲劳和认知功能受损。
三、 缺陷
缺乏接触抗生素或饮食中的可溶性纤维不足可能会导致正常粪便菌群(包括双歧杆菌,乳杆菌和大肠杆菌)的绝对缺乏。缺乏症和营养不良是相辅相成的疾病,通常一起发生并接受相同的治疗。
四、 致敏
对正常本地肠道菌群成分的异常免疫反应的加剧可能会导致炎症性肠病,脊椎关节病,其他结缔组织病和皮肤病(如牛皮癣或痤疮)的发病。负责任的细菌成分包括内毒素,它们可以激活替代补体途径和抗原,其中一些可能与哺乳动物抗原发生交叉反应。对强直性脊柱炎和炎症性肠病的治疗研究表明,致敏作用可以补充发酵过量,类似的治疗方法对这两种情况都可能有益。
临床研究表明细菌性营养不良与肠内或涉及皮肤或连接组织的多种炎症疾病有关。
炎症可能通过三种关键机制破坏微生物群。
首先,炎症触发免疫反应,将抗菌肽释放到肠腔;这种反应内在地防御病原体,但也可以针对共生微生物群。
第二,炎症增加腔内氧气水平。 氧气通常从粘膜毛细血管网络向管腔扩散,形成一个氧梯度,严格调节氧、微氧和缺氧区内的微生物。这一梯度有助于塑造微生物生态,粘膜表面附近有兼性厌氧菌,缺氧腔中有严格的厌氧菌,并影响细菌转录。炎症过程中腔氧的增加选择性地促进耐气微生物的生长,特别是肠杆菌科及其病原体的生长。
第三,炎症产生活性氧和氮物种,通过促进某些细菌之间的呼吸来塑造微生物群。活性氧与腔内硫化合物结合形成四硫酸氧化产物。 如斑疹伤寒杆菌等能利用四硫磷酸盐作为呼吸电子受体的细菌,比不能利用四硫磷酸盐的细菌具有选择性生长优势。鉴于炎症是环境肠道功能障碍的标志,这些机制可能有助于塑造营养不良儿童观察到的微生物失调。
在这个恶性循环中,肠道微生物群(通常含有来自不卫生环境的肠道病原体)的改变,会引发包括炎症、屏障功能障碍、易受病原体侵袭、转运改变等在内的肠道亚临床病理群,以及营养吸收不良。
这些病理学促进生长衰竭和持续性失调。当这种恶性循环出现在一个关键的早期发育期时,儿童的终身共病风险增加,包括身材矮小、健康和收入潜力下降、认知障碍、肥胖、2型糖尿病和心血管疾病。
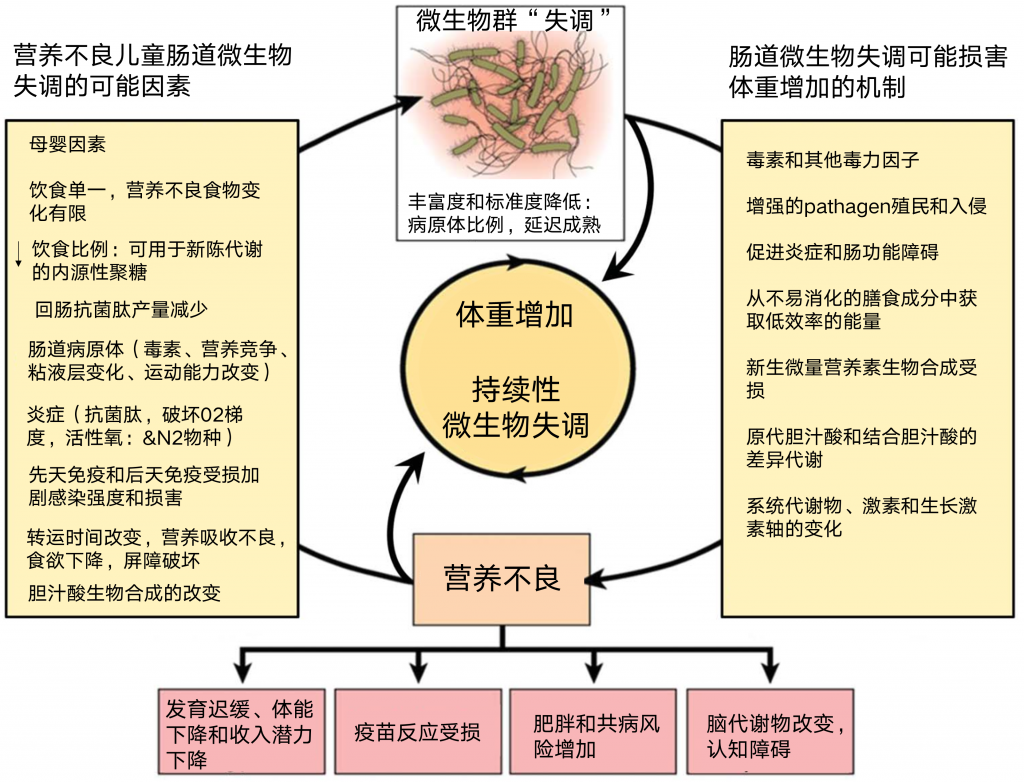

饮食与营养
首先,从饮食习惯来说,宝宝在断奶后,食物供应情况和饮食传统在世界范围内各不相同。发展中地区的个人饮食习惯通常会选择食用富含复杂植物多糖的谷类和植物饮食,而不是西方饮食中的那些动物衍生食品和加工碳水化合物。
来自撒哈拉以南的非洲和欧洲的健康儿童之间的粪便微生物群落差异可能是饮食中碳水化合物的类型和数量的部分原因。与健康的意大利儿童相比,布基纳法索(非洲国家)健康儿童的粪便中含有更大比例的拟杆菌门,具有特定富集的属(普雷沃菌和木聚糖),它们含有代谢不可消化的膳食纤维素和木聚糖的酶,这是布基纳法索饮食中的关键成分。因此,一个培养物的饮食碳水化合物成分可以驱动含有基因组库的细菌的选择,将这些营养物质作为能量来源进行代谢。
小B —— 2岁,发育迟缓
——本案例数据取自我们的肠道菌群健康检测数据【谷禾健康数据库】
小B的报告,营养饮食部分提示的问题更大一些,首先主要营养中蛋白质摄入不足。
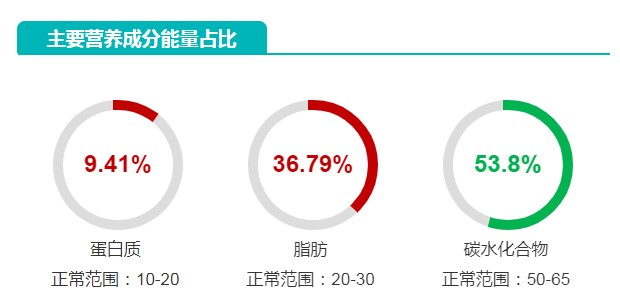

此外,膳食纤维摄入严重不足,这也是双歧杆菌和其他正常菌群占比不高而变形菌门占比很高的主要原因之一。顺带的也导致短链脂肪酸部分出现了两种缺乏。
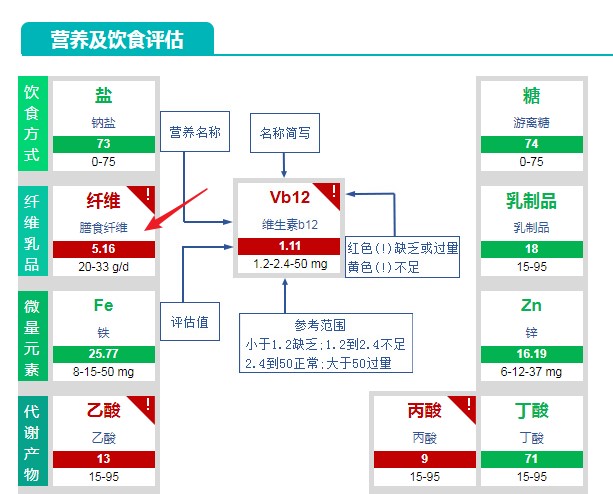

发育迟缓的治疗充满困难。首先,在缺乏生物标志物的情况下,在单个儿童中识别环境肠道功能障碍是有难度的。 此外,临床试验没有强有力的证据表明,特定的干预措施可以治愈或改善。不过好在我们发现有很多相关因素,可以着手干预加以改善。比如说上面的例子我们看到营养饮食部分的问题(主要是三大类营养素),肠道菌群检测报告中的内容则可以提示我们再从更细微的层面去了解缺乏的状况,结合微量元素甚至代谢产物,更容易找到问题的核心所在。
为什么可以通过饮食干预?
从机理上讲,沿着肠道纵轴建立微生物群落是一个多因素甚至部分随机的过程,并在一定程度上受膳食碳水化合物的影响。
简单的碳水化合物被小肠吸收,留下不可消化的复合多糖,多糖是作为结肠微生物群的关键决定因素。膳食多糖、宿主和肠道微生物之间形成复杂的相互作用,它们代谢的多糖类型差异很大。例如,拟杆菌属含有大量的多糖降解酶,将抗性淀粉、植物细胞壁多糖、菊粉和纤维素代谢成短链脂肪酸和其他肠道可吸收的产物。
拟杆菌是结肠中动物源性糖蛋白最有效的降解菌之一,这就可以解释为什么该属在食用西方动物性饮食的个体中富集,而在食用植物性饮食的个体中富集较少,同时增加了这样一种可能性:如果缺乏拟杆菌,那么微生物群无法将不可消化的膳食成分转化为宿主可利用的能量形式,对生长产生不利影响。
母乳低聚糖(HMO)可以塑造婴儿肠道微生物群
HMO是有益菌的代谢基质。研究人员分析了88名马拉维母亲的母乳,与严重发育不良的6个月的婴儿相比,健康婴儿的母亲母乳中的总HMO、岩藻糖基HMO和唾液酸HMO浓度更高,在215名母亲的第二个队列中,健康婴儿和中度发育不良婴儿的母亲的母乳中总的HMO和唾液化的HMO浓度增加。作者又用小鼠模型将唾液酸化乳低聚糖与瘦体重增加联系起来。
不同膳食淀粉类型的影响
膳食淀粉酶抗性淀粉(RS)的健康益处来自肠道微生物发酵和短链脂肪酸(SCFA)的产生,研究人员比较了印度南部发育迟缓和非发育迟缓(“健康”)儿童的肠道发酵能力,使用两种类型的RS:高直链淀粉玉米淀粉(HAMS)和乙酰化HAMS(HAMSA)。
这两种类型的RS导致健康和发育迟缓的儿童粪便pH值显著降低,粪便中乙酸和丙酸增加,但健康儿童在服用HAMSA后的乙酸和丁酸明显高于发育不良儿童。这表明这些儿童的结肠生理发生了改变。HAMS能增加发育不良儿童的粪便丁酸,丁酸对结肠健康,特别是对结肠上皮细胞,非常重要。(这在我们之前的文章里也有详细讲过 你吃的膳食纤维对你有帮助吗) 。
可以看到发育不良儿童发酵某些类型RS的能力受损,这种发现为改善儿童发育迟缓的生理影响而补充RS类型的选择具有重要意义。RS干预被认为是可以改善肠道健康的一种方法。
腐败失调通常是通过高可溶性和不溶性纤维,低饱和脂肪和低动物蛋白的饮食来解决的。
乳制品


乳制品的影响是可变的。发酵乳制品,如新鲜酸奶有时会有所帮助。这些饮食变化有助于降低结肠中拟杆菌的浓度,增加乳酸产生菌(双歧杆菌、乳酸杆菌和乳酸链球菌)的浓度。
定期摄入酸奶可降低粪便中脲酶阳性菌和拟杆菌的浓度可能有助于致癌的RIA酶。发酵乳制品和嗜伊乳杆菌制剂被证明在治疗和预防沙门氏菌病、志贺氏菌病、抗生素引起的腹泻和抑制肿瘤生长方面是有用的。
纤维
在饮食中补充一定来源的纤维可以对结肠失调产生不同的影响。不溶性纤维降低细菌浓度和微生物酶活性。另一方面,可溶性纤维在提高有益的短链脂肪酸水平的同时,往往会提高细菌浓度和酶活性。这种差异可能解释了不溶性纤维在预防结肠癌方面的优越性。
低聚糖
在洋葱和芦笋等蔬菜中发现的含有果糖的低聚糖,已经发展成为一种食品补充剂,用于提高双歧杆菌的粪便水平和降低粪便pH值。在一些蔬菜中发现的低聚糖,特别是胡萝卜,能抑制肠道细菌与肠粘膜的结合。胡萝卜汁和浓缩胡萝卜低聚糖在欧洲用于细菌性腹泻已有近一个世纪。
其他
相比之下,在发酵失调中,淀粉和可溶性纤维可能会加剧肠道生态的异常。当上小肠受累时,单糖也是禁忌。不吃谷类食品和加糖的饮食通常是最有益的。水果、脂肪和淀粉类蔬菜在不同情况下都有不同程度的耐受性。
微生物群重塑可以很快帮助治疗儿童期的环境肠道功能障碍和营养不良。以代表性马拉维饮食为基础并由严重营养不良的马拉维儿童粪便微生物定植的侏儒小鼠中,通过将这些小鼠与接受健康微生物群的动物共住、通过共食促进微生物转移或通过灌胃五种菌群来改善生长障碍。
这就提示了我们可以从益生菌益生元的角度去思考干预措施。
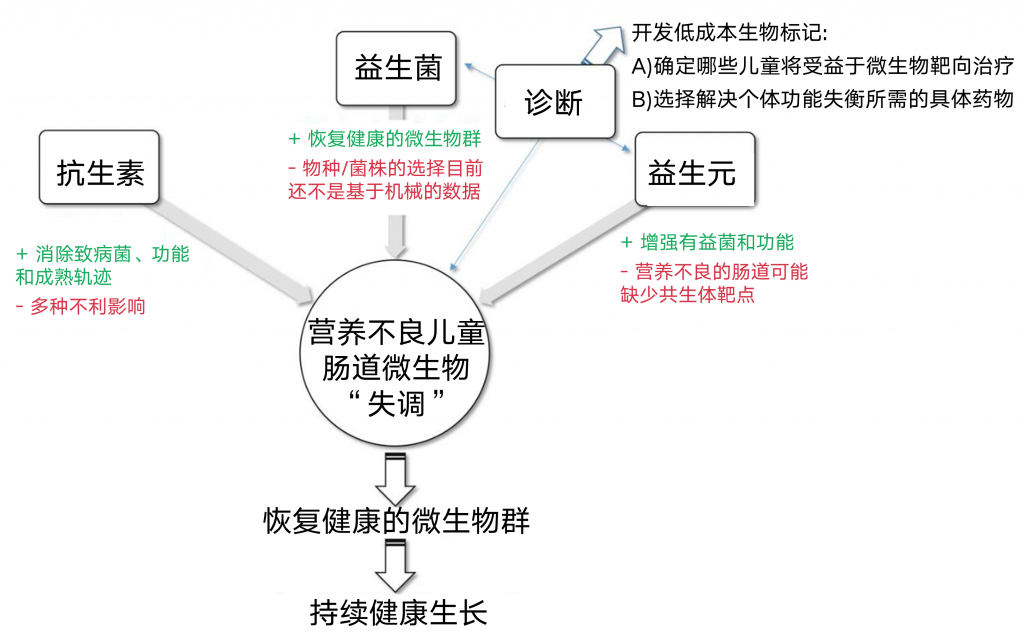

在一项研究中,含有益生菌德氏乳杆菌保加利亚亚种、嗜热链球菌和干酪乳杆菌DN-114-001的发酵乳
改善营养不良小鼠的生长。益生菌混合剂也改善了肠道组织病理学和在营养不良状态下改变的各种免疫反应。
正如施瓦泽等人的一项研究所证明的那样,个别益生菌菌株也可以改善体重增加。无菌小鼠轻度体重不足与常规饲养的小鼠相比发育迟缓,胰岛素样生长因子-1(IGF-1)和IGF-1结合蛋白3的浓度降低。表明肠道微生物群通过生长激素轴促进生长。
长期以来,乳酸菌给药一直被用于改善肠道微生物生态。
双歧杆菌是结肠的主要乳酸菌,其浓度是乳杆菌的1000倍。人和动物服用短双歧杆菌可降低粪便中梭状芽孢杆菌和肠杆菌种类、氨和产毒细菌酶(包括β-葡萄糖醛酸酶和色氨酸酶)的浓度;尿液指标也会降低。在欧洲,为了改变肠道菌群而使用特定的大肠杆菌和肠球菌菌株已经很流行了。
侧孢芽孢杆菌(Bacillus laterosporus)是一种新的非致病性微生物,具有独特的代谢产物,具有抗菌、抗肿瘤和免疫调节活性。这种菌在美国作为食品补充剂已经有5年了。我们发现它是一种有效的辅助治疗方法,可以控制一些患者的小肠功能障碍相关症状。
几十年来,欧洲一直在使用酵母布拉氏酵母菌(Saccharomyces boulardii)来控制非特异性腹泻,这一点同样值得关注,而且研究得更为深入。布拉氏酵母菌最初是从印度荔枝果中分离出来的,在法国作为药物进行种植和包装。对照研究已证明其在预防抗生素相关性腹泻和艰难梭菌性结肠炎方面的有效性。
酿酒酵母(S. boulardii)还被证明可以刺激大鼠分泌性IgA的产生。患有反应性关节炎和其他疾病的患者应禁用此类免疫增强疗法,以防过度的肠道免疫反应疾病。
以代表性马拉维饮食喂养的无菌小鼠接受了发育不良的马拉维婴儿中分离的25个菌株群落(其中19个菌株成功定植)。与未添加益生元或添加菊粉的小鼠相比,添加唾液酸化牛乳低聚糖(S-BMO)的小鼠体重增加、消瘦改善和骨骼形态改善。然而研究人员同样给无菌小鼠添加S-BMO之后并没有增重效果,这就说明了其促进生长的作用机制是依赖菌群的。
抗生素药物可能导致或有助于控制失调,这取决于药物和失调的性质。如果厌氧菌污染小肠是问题所在,甲硝唑或四环素类药物可能是有益的。当肠道细菌过度生长占优势时,环丙沙星通常是首选药物,因为它倾向于保留厌氧菌。
草药抗生素可能是首选,在细菌过度生长综合征中需要长期的抗菌治疗,它们相对更安全。柑橘种子具有广谱的抗菌、抗真菌和抗原生动物作用,可能是理想的一线治疗手段。
草药药典列出了许多具有天然抗生物活性的物质,草药治疗肠道失调的潜力实际上是无限的。
其他潜在干预措施包括:
(1) 通过改善水、环境卫生和个人卫生等方案减少粪便接触和与动物接触;
(2) 母乳喂养和增强饮食多样性;
(3) 营养补充剂,包括锌、多不饱和脂肪酸和氨基酸;
(4) 抗炎剂,如5-氨基环酸;
(5) 急性营养不良和感染情况下的抗生素;
(6) 注意疫苗的使用,减毒活细菌疫苗可能以与非致病性亚临床感染相同的方式诱发生长迟缓;此类疫苗的临床试验应将生长作为一项结果指标。
考虑到可能导致生长障碍的饮食、环境和宿主因素的范围,在所有儿童营养不良的情况下,单一的治疗剂不太可能完全恢复微生物功能、全身代谢物以及微量和微量营养素的健康平衡。
从饮食、环境卫生条件等各方面去完善,结合肠道微生态的最新研究,特别是其发病机制和潜在原因,了解为什么某些菌群在某些个体中的代表性过高或过低,以及它们如何影响肠道健康。从这些研究中获得的信息来指导未来新疗法的发展。
相关阅读:
主要参考文献
Nataro J P, Guerrant R L. Chronic consequences on human health induced by microbial pathogens: Growth faltering among children in developing countries[J]. Vaccine, 2017, 35(49): 6807-6812.
Velly H, Britton R A, Preidis G A, et al. Mechanisms of cross-talk between the diet, the intestinal microbiome, and the undernourished host.[J]. Gut microbes, 2017, 8(2): 98-112.
Dinh D M, Ramadass B, Kattula D, et al. Longitudinal Analysis of the Intestinal Microbiota in Persistently Stunted Young Children in South India[J]. PLOS ONE, 2016, 11(5).
Hoffman D J, Camposponce M, Taddei C R, et al. Microbiome, growth retardation and metabolism: are they related?[J]. Annals of Human Biology, 2017, 44(3): 201-207.
Balamurugan R, Pugazhendhi S, Balachander G M, et al. Effect of native and acetylated dietary resistant starches on intestinal fermentative capacity of normal and stunted children in southern India[J]. International Journal of Environmental Research and Public Health, 2019, 16(20).
Mahfuz M, Das S, Mazumder R N, et al. Bangladesh Environmental Enteric Dysfunction (BEED) study: protocol for a community-based intervention study to validate non-invasive biomarkers of environmental enteric dysfunction[J]. BMJ Open, 2017, 7(8).
Blanton L V, Charbonneau M R, Salih T, et al. Gut bacteria that prevent growth impairments transmitted by microbiota from malnourished children[J]. Science, 2016, 351(6275).
Rouhani S, Griffin N W, Yori P P, et al. Diarrhea as a Potential Cause and Consequence of Reduced Gut Microbial Diversity Among Undernourished Children in Peru[J]. Clinical Infectious Diseases, 2019.
Harper K M, Mutasa M, Prendergast A J, et al. Environmental enteric dysfunction pathways and child stunting: A systematic review.[J]. PLOS Neglected Tropical Diseases, 2018, 12(1).
Owino V O, Ahmed T, Freemark M, et al. Environmental Enteric Dysfunction and Growth Failure/Stunting in Global Child Health[J]. Pediatrics, 2016, 138(6).

谷禾健康 原创
转移性肾细胞癌(RCC)长期以来被认为是一种“免疫性恶性肿瘤”,对不同的免疫疗法敏感。免疫检查点阻断疗法(ICB)的发展,使肾细胞癌(RCC)的临床预后发生了革命性的变化。虽然如此,但治疗响应的持续时间以及预测的改善仍旧没有满足医疗需求。虽然人们已经认识到抗生素(ATBs)会降低ICB在各种恶性肿瘤中的临床活性,但对于不同的肠道非致病菌(共生菌)对ICB在肾细胞癌中的疗效的直接影响却知之甚少。
近日,来自法国科学家的一项发表在《Eur Urol (欧洲泌尿学杂志)》期刊的一篇题为“Gut Bacteria Composition Drives Primary Resistance to CancerImmunotherapy in Renal Cell Carcinoma Patients” 研究发现:微生物群的组成受TKI和ATB的影响,并影响免疫治疗的成功, 未来研究人员表示在开始治疗前对粪便的分析可能可以指导临床医生用药,以防止肾细胞癌患者对免疫治疗的原发性耐药。
简称/名词介绍:
ORR:客观缓解率,指肿瘤缩小达到一定量并且保持一定时间的病人的比例,也就是在任何时候完全缓解和/或部分缓解的患者数量。
PFS:无进展生存期,指从随机分组开始到第一次肿瘤进展或死亡时间。
BOR:本文中,研究者评估的从nivolumab开始治疗之日到治疗结束的最佳肿瘤反应(完全缓解、部分缓解、疾病稳定或疾病进展)。
文章中使用RECIST疗效评价标准1.1评估肿瘤反应
完全缓解【complete response,CR】:除结节性疾病外,所有目标病灶完全消失或所有目标结节须缩小至正常大小(短轴<10mm)
部分缓解【partial response,PR】:所有可测量目标病灶的直径总和低于基线≥30%。目标结节总和使用短径,而所有其它目标病灶的总和使用最长直径。
疾病进展【progressive disease,PD】:可测量目标病灶的直径总和增大≥20%超过观察到的最小总和,如治疗期间未观察到总和降低,则定义为超过基线。
疾病稳定【stable disease,SD】:介于PR和PD之间。
摘要
文章的主要目的是评估在晚期肾细胞癌患者中,其肠道菌群组成对ICB疗效的预测价值。研究人员收集了69例晚期肾细胞癌患者的粪便样本和2994例健康志愿者的粪便样本。同时,研究人员还进行了临床前研究,将对ICB具有抗性的肾细胞癌患者粪便微生物移植到荷瘤小鼠上,以此证明了肠道细菌组成与ICB临床结果之间的因果关系。研究人员还评估了在开始nivolumab治疗前使用TKl对微生物群组成的影响。通过WGS-MG测序分析识别其微生物群组成。研究发现,近期抗生素使用可改变肠道菌群组成,并降低患者的客观缓解率,促进了不同优势物种类群的形成,如Clostridium hathewayi菌在肾细胞癌患者的粪便中较为富集。还有一个重要的点,就是在接受nivolumab药物前服用酪氨酸激酶抑制剂(TKI)能够改变肠道菌群的组成。最后,研究人员表示微生物群的组成受TKI和ATB的影响,并影响免疫治疗的成功。未来的研究将有助于提高这些特定细菌的作用,以及它们作为新的生物标志物的潜力。
实验设计

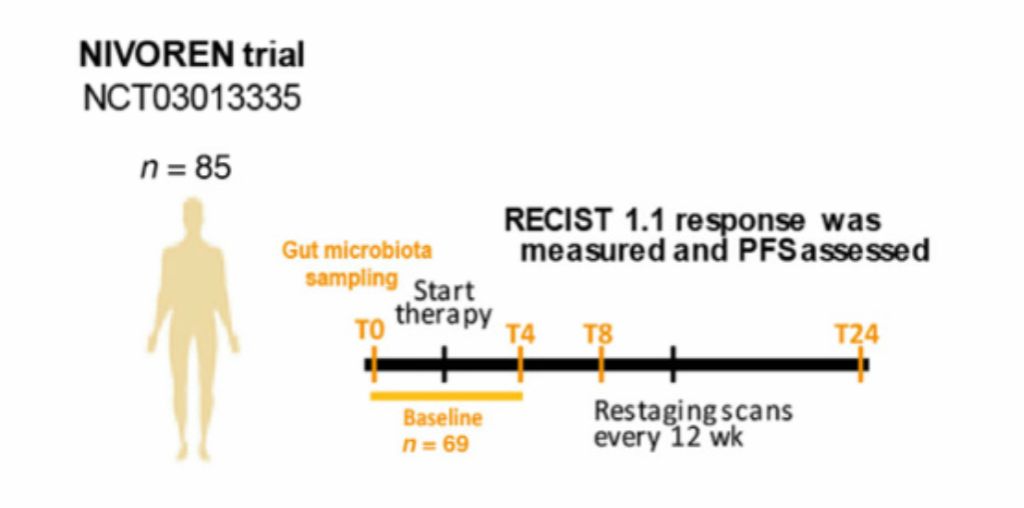
受试者纳入标准:
对IV期肾细胞癌患者和疾病进展的患者每2周注射3mg/kg的nivolumab(纳武单抗),直到疾病进展或在NIVOREN
GETUG-AFU 26第二阶段试验中出现无法忍受的毒性为止。
细节:
第一年在基线和每8-12周进行一次CT扫描,然后每12-15周进行一次CT扫描直到疾病进展。根据国际人体微生物组标准指南(SOP_03_V1) 进行粪便样本收集,在第一次注射nivolumab前(T0,<1mo);第二次(T4,4wk);第四次(T8,8wk);第12次(T24,24wk)
宏基因组学和统计学分析:
从粪便标本中提取总DNA,并按照MetaGene Polis(INRA)工作流程使用IonProton技术进行测序。从丰度矩阵开始,只考虑在所有样本中至少有20%存在的分类群,然后对原始数据进行归一化和标准化。监督偏最小二程判别分析(PLS-DA)和随后的变量对模型的重要性图(VIP)找出与BOR相关的组中的差异物种。双尾Mann-Whitney U和Kruskal-Wallis检验分别评估成对比较和多重比较的意义,p<0.05。计算用于网络相关分析的Pearson矩阵。所有的p值都经过FDR矫正。
主要结果
1. ATBs影响了ICBs对肾细胞癌患者的临床疗效,并改变了肠道菌群的β多样性和组成
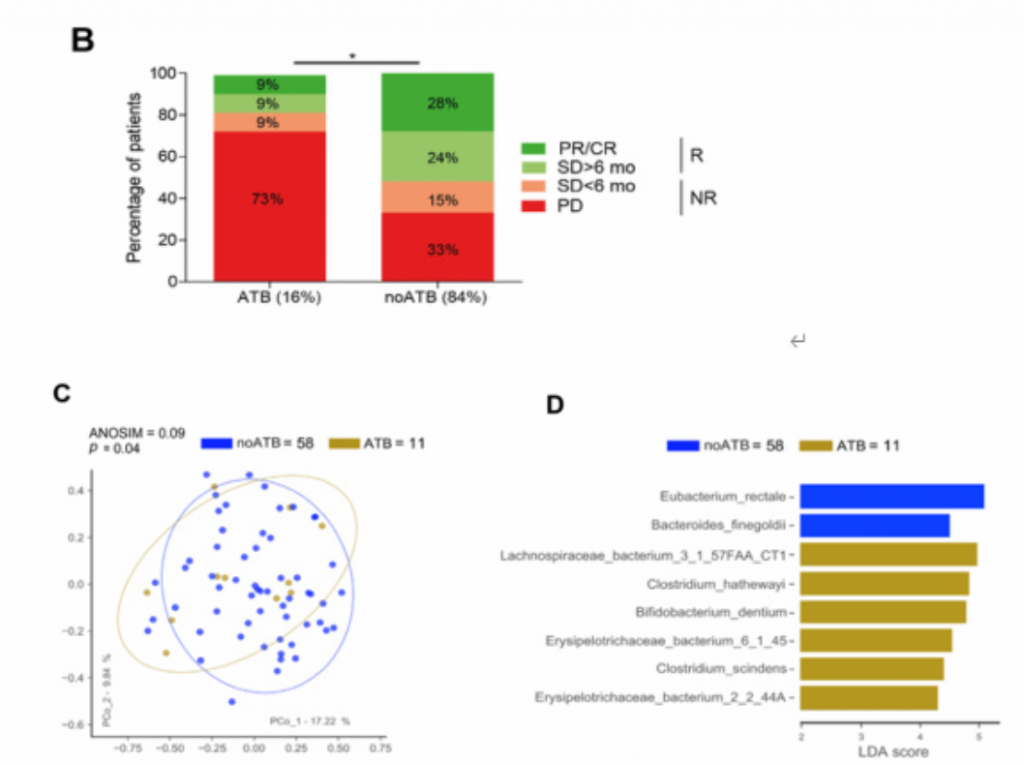

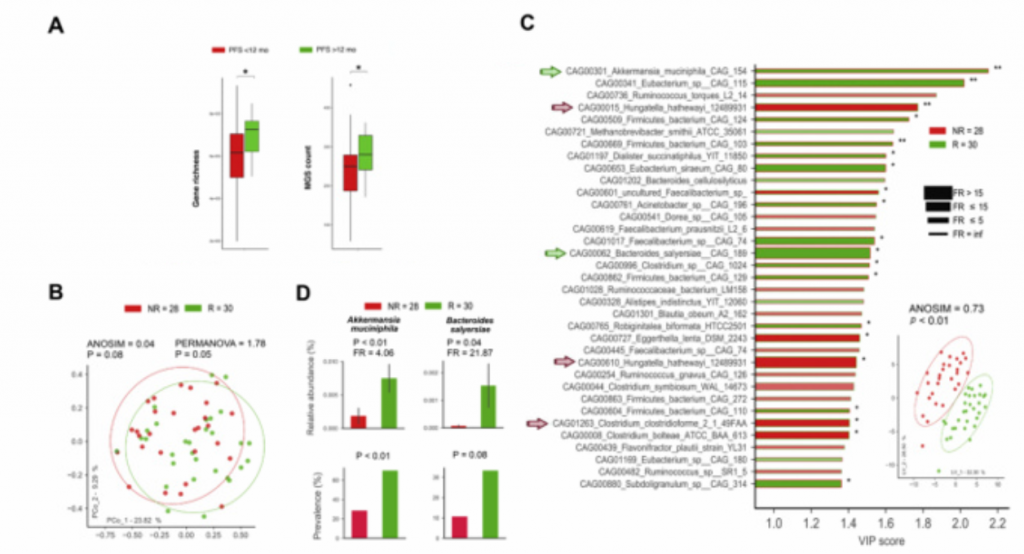

ATB:抗生素;noATB:未使用抗生素;NR:无肿瘤反应;PR:部分缓解;PD:疾病进展;
PFS:无进展生存期;R:有肿瘤反应;SD:疾病稳定;ORR:客观缓解率
(B).使用和不使用抗生素肾细胞癌患者人数占总患者人数的比例以及不同RECIST疗效结果占使用或不使用抗生素肾细胞癌患者人数的比例。ATB组11例,在抗PD-1阻断后2个月内服用抗生素;noATB组58例,未服用抗生素。接受ATBs治疗的患者的ORR低于未接受ATBs治疗的患者(9%
vs 28%, p < 0.03,p值采用双尾卡方检验)
(C). 基于PCoA分析的预处理样品粪便微生物群组成标准化和归一化数据的β多样性排序图。95%置信度。ANOSIM指标通过999次置换来评估ATB组和noATB组之间的差异。ATB个体与noATB个体的从粪便中分离出的细菌种类有显著差异。
(D).
Lefse图,基于LDA得分为每个组识别出差异物种。在这些差异物种中,如Eubacterium rectale菌在noATB粪便中富集,而其他细菌类群,如Erysipelotrichaceae bacterium_2_2_44A和Clostridium hathewayi在ATB粪便中富集。
2. 在noATB队列中,肠道菌群组成可以预测ICBs的临床结果。
利用粪便中的微生物组成的Alpha和Beta多样性结果可以对肾细胞癌患者人群中的R和NR个体进行分层,并可用于预测PFS>
12个月的患者。
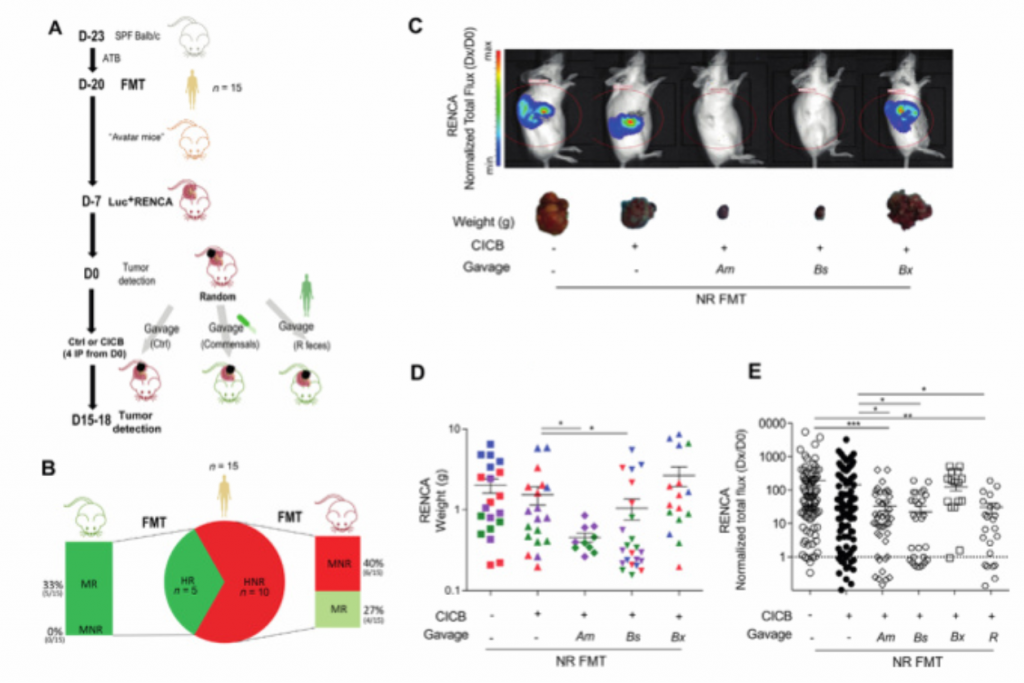

mAb:单克隆抗体;MGS:metagenomic species;SEM:标准误
(A).对noATB基线样本(n=58)中的粪便微生物使用鸟枪法测序,图中展示了PFS<12个月和PFS>12个月的所有癌症患者的基因丰富度和MGS计数。ICBS开始后12个月,丰富度计数(GC)或MGS水平与以无疾病进展为标准的临床反应相关。
(B). noATB预处理样本的PCoA分析(使用细菌流行率>=20%的阈值)的β多样性排序图。95%置信度。ANOSIM和PERMANOVA指标使用999次置换,评估R(完全缓解或部分缓解或病变稳定>6个月)和NR(死亡或疾病进展或病变稳定<6个月)之间的差异。两组间有明显的分离。
(C).使用偏最小判别分析的变量对模型的重要性图,按重要程度由大到小描述了35个组间差异物种。箭头突出重要物种。条形填充颜色表示物种平均相对丰度最高的队列,条形框颜色表示物种平均相对丰度最低的队列。条形的宽度表示FR的高低。*表示Mann-Whitney
U检验的显著性。Akkermansia muciniphila, Bacteroides
salyersiae,和 Eubacterium siraeum菌种比例过高。
(D).被选中的Akkermansiamuciniphila和Bacteroides salyersiae菌种的相对丰度和流行率条形图。在肾细胞癌患者粪便中这两种菌的流行率和相对丰度在R和NR队列中都较高。相对丰度的p值由双尾Mann-Whitney U检验得到,流行率的p值由卡方检验得出。
3.在肾细胞癌患者中,在使用nivolumab前先使用TKI和ATB药物与肠道菌群组成改变密切相关。在69个RCC队列中,R和NR的细菌比较分析,弥补了用NR-FMT在小鼠中观察到的反应性的不足,建立了粪便中有利的细菌组成与临床结果之间的因果关系。

CICB:联合ICB治疗;D0:随机日期;Dx:最后一次IVIS测量;
(A). 在无特定病原体(SPF)的BALB/c小鼠体内注射ATB3天后进行粪便微生物移植(FMT)。2周后,原位接种荧光素酶工程肾癌(Luc+RencA),从第7天开始每4天腹腔接种抗PD-1+抗CTLA-4单抗(CICB)或同型对照单抗(Ctrl)。此外,在第4天,每隔3天给接受CICB的受体小鼠口服Akkermansia muciniphila菌(Am)、Bacteroides salyersiae 菌(Bs)细菌B.xylanosolvens(Bx)或应答者患者(R)的粪便。
(B). 15份FMT供体粪便的比例. (人类有肿瘤反应者[HR]和人类无肿瘤反应者[HNR])在BALB/c小鼠(小鼠有肿瘤反应者[MR]和小鼠无肿瘤反应者[MNR])。观察到患者的反应和小鼠受体对ICBS的反应之间有27%的一致性:只使用了4份高于15FMT的粪便样本。
(C)(E).使用荧光素酶活性的生物发光成像监测ATB治疗小鼠在FMT后的Renca进展。在每个ICB周期前口服具有免疫刺激作用的Am或Bs或R-FMT来补偿NR-FMT(不含Am或Bs菌),恢复了对治疗的敏感度(牺牲时的肾脏重量)且荧光亮度降低。
(C)(D).使用肿瘤重量的生物发光成像监测ATB治疗小鼠在FMT后的Renca进展。在每个ICB周期前口服具有免疫刺激作用的Am或Bs或R-FMT来补偿NR-FMT(不含Am或Bs菌),恢复了对治疗的敏感度(牺牲时的肾脏重量)。
4. TKIs诱导肠道菌群改变。TKIs诱导了显著的和典型的微生物群落改变,包括免疫刺激共生物种,可以利用这些共生物种来提高肾细胞癌患者ICBS的疗效。[if !vml]
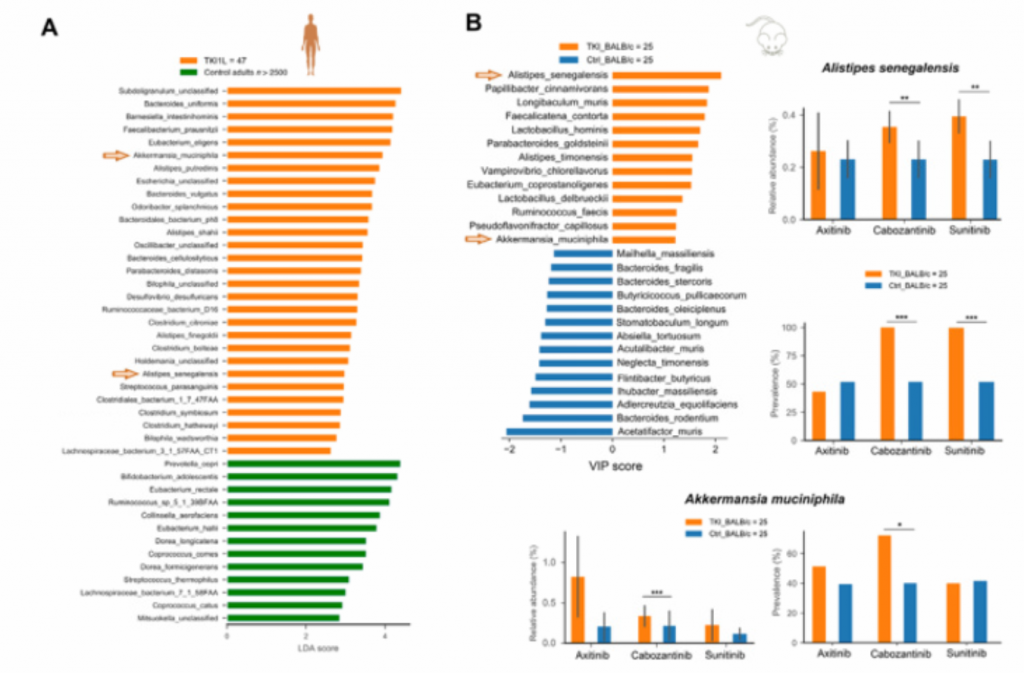

(A).接受TKI一线治疗的患者与对照成人粪便菌群的差异。按LDA分值排序的组间差异物种。观察到在TKI一线治疗组中Akkermansia muciniphila和Alistipes senegalensis富集。
(B).对接受TKI治疗(阿西替尼、舒尼替尼和卡博替尼)的BALB/c小鼠进行分析,利用偏最小二乘判别分析,差异物种按重要性从大到小排序。在BALB/c小鼠中,随着时间的推移,所有三种TKI都显著地诱导了菌群的α和β多样性的变化。
箭头表示相关的细菌种类。
柱状条形图分别描述了TKI治疗组中最具判别意义的两个菌种的相对丰度和流行率,即Akkermansia muciniphila和Alistipes senegalensis. 其中,观察到在人类和小鼠身上,Sunitinib和Cabozantinib有效的刺激了Alistipes senegalensis的丰度增长。对于三种不同的TKI(axitinib(阿西替尼)、sunitinib(舒尼替尼)和Cabozantinib(卡博替尼)),使用Mann-Whitney U检验来评估统计学差异. (*p<0.05,**p<0.01,*p<0.001)
结论
通过应用不同的生物信息学和组间差异分析手段(LEfSe, PLS-DA, VIP, and networks),研究人员确定了一组与原发耐药相关的物种(厚壁菌门,梭菌科,Clostridium clostridioforme种和Clostridium hathewayi种),并且由于使用ATB和癌症转移的状况。这些物种变得丰富。据以往的一些研究报告,Clostridium hathewayi菌种是与结肠癌诊断相关的致病因子的一部分,并且可以减轻小鼠的抗原特异性T细胞反应。
研究人员还发现了一些与预后良好和肠道稳态状态相关的共生物种,它们分别属于优杆菌科(Eubacterium
rectale和Eubacterium siraeum种),毛螺菌科(Dorea longicatena种),Verrucomicrobioaceae科(Akkermansia muciniphila种),而且都属于拟杆菌目。
结果表示微生物群的组成受TKIs和ATBs的影响,并影响免疫治疗的成功。ATB显著影响微生物群的β多样性,导致如前所述的优杆菌科家族成员(如Eubacterium rectale)的优势不突出,而有利于致病菌种(Erysipelotrichaceae bacterium_2_2_44A和Clostridium hathewayi)。这种微生物群的改变与ICB治疗期间ORR的降低有关(ATB组73%的原发耐药,noATB 33%,p<0.03)。在使用nivolumab之前使用TKI也可导致肠道菌群组成的变化,可能抑制ICB的疗效。该研究的局限性在于,比如研究的结论依赖于69名肾细胞癌患者的单一队列,其中只有11名患者服用ATBs和二线治疗,并受到许多混杂因素(既往治疗、发病和其他因素,如血红蛋白)的干扰。
展望
研究人员表示在开始治疗前对粪便的分析可能可以指导临床医生用药,以防止肾细胞癌患者对免疫治疗的原发性耐药。而更好地了解肠道菌群组成与局部、全身和肿瘤免疫系统之间的机制联系,将有助于为肾细胞癌患者的肠道菌群失调设计最佳的补充治疗方案。

肥胖和营养不良是普遍面临的健康问题,而肠道菌群在其中扮演的什么样的角色?最近一项研究通过交叉过量、过低饮食干预以及随机双盲万古霉素抗生素实验,揭示了不同热量摄入和抗生素会破坏肠道菌群特定代谢产物(如:丁酸和其他短链脂肪酸)影响肠道屏障,并改变特定微生物群落(如阿克曼菌),这种变化是粪便热量流失的原因,表明肠道菌群在饮食能量吸收中起着因果的作用。

单位:美国国家卫生所
期刊: Nature Medicine 《自然医学》
摘要
文章揭示了营养不良和口服万古霉素对人体肠道菌群和营养吸收的影响。以往的研究发现,营养不良显著增加粪便热量损失,且降低了拟杆菌门和厚壁菌门的相对丰度,这是人类肠道中的两个主要门。还有各种证据表明,早期使用抗生素与儿童体重增加有关,在营养不良中,抗生素促进生长的证据好坏参半。在本文中,研究人员进行了一项长期的住院研究,使用了两种干预措施。在每个实验中,研究人员都测量了过量饮食和饮食不足期间的粪便卡路里流失,这是营养吸收的直接表征,第一阶段是随机交叉饮食干预,所有受试者按随机顺序接受3天的过量和不足饮食喂养。第二阶段是随机、双盲、安慰剂对照的药物干预,使用万古霉素或安慰剂(NCT02037295)。研究人员观察到,肠道菌群结构在营养不良和饮食过量的情况下有轻微的变化,但口服万古霉素后群落结构伴随着多样性降低发生了更显著的变化。两种干预措施中嗜粘蛋白艾克曼菌的丰度都增加了,这导致了更多的粪便热量流失。这些结果表明,营养吸收对环境扰动敏感,并与临床前模型相关,表明肠道菌群在饮食能量吸收中可能起因果作用。
背景
全球肥胖症的流行促使人们努力确定影响能量平衡的环境和宿主因素,能量平衡的定义是能量摄入和消耗之间的平衡。虽然卡路里消耗是能量摄入量的关键决定因素,但个体消化和吸收所消耗的饮食底物的能力的不同程度也可能影响能量平衡。在过去的十年中,利用啮齿动物模型得到的研究成果,支持了数以万亿计的微生物在人类胃肠道(肠道菌群)的因果作用,由于它们对能量摄入和消耗的广泛影响,形成了能量平衡的个体间变化。但可惜的是,尚无直接证据表明微生物群对营养吸收有影响.
实验设计
实验对象:
选取了除葡萄糖耐受和肥胖症以外的27名健康志愿者(男17名,女10名,年龄35.1±7.3,BMI 32.3±8.0),其中25名完成了整个实验。在整个研究过程中,参与者都是住院患者,每天都接受监测,没有被报告过副作用,特别是腹泻或腹部症状。
设计方案:
第一阶段:随机的交叉饮食干预
所有受试者均以过量(OF)和节食(UF)三天的随机顺序进行饮食,期间会有3天的洗脱期。OF为WMD的150%的饮食,UF为WMD的50%的饮食。
第二阶段:药物干预
同样的受试者被随机分为安慰剂组和口服万古霉素组
注:
(WMD)体重维持饮食【20%大卡蛋白质;30%大卡脂肪;50%大卡碳水化合物】;(DXA)双能X线吸收法,用于骨密度测定;(OGTT) 口服葡萄糖耐量试验;(Dye marker)表示粪便收集所使用的染料标记物;(CH) 间接量热法,用于评估24小时能量消耗;(HPN,LPL) 肝素诱导的LPL测定;(CBC) 全血细胞计数
主要结果
“ Δ ”表示组间的平均差异;“ P ”表示双边配对学生t检验; 红点表示开始饮食阶段为OF的受试者,白点表示开始饮食阶段为UF的受试者
a):过量饮食组(4,446.5 ± 547.8 kcal d−1)的每日摄入热量显著高于营养不良组(1,494.2 ± 211.0 kcal d−1),
b):与营养不良的人相比,过量饮食的人每天消耗的卡路里绝对数量明显更高。
c):当以每天摄入的卡路里的百分比来表示时,UF期间的粪便热量流失相对于OF明显更大,且有很强且显著的体内相关性(Pearson’s r = 0.70, P = 0.004)
d):UF比OF转运时间快,转运时间被定义为每次干预期间染料标记第一次出现和最后一次出现之间的时间(以h为单位)。
Δ ”表示组间的平均差异;“ P ”表示双边非配对学生t检验;误差条表示95%置信区间的均值
a):3天的平均摄入热量。安慰剂组(Placebo)和万古霉素组(Vancomycin)每天摄入的热量是相当的。
b):万古霉素导致粪便热量流失显著增加。
c):粪便平均热量流失百分比。
d):万古霉素组和安慰剂组的转运时间没有差异(P=0.2)
2.使用扩增子和宏基因组测序相结合的方法,评估了饮食干预和药物干预对肠道微生物群落结构的影响。在饮食干预组间分析中发现了几种对饮食敏感的细菌物种。在药物干预组间分析中也发现了几种显著富集的物种。且扩增子和宏基因组测序结果具有一致性。尽管存在这些差异,但在这两种干扰下,有两种细菌的种类都发生了一致的变化。嗜粘蛋白艾克曼菌和一种隶属于Lachnospiraceae NK4A136群的一个未确认的种。
饮食干预:
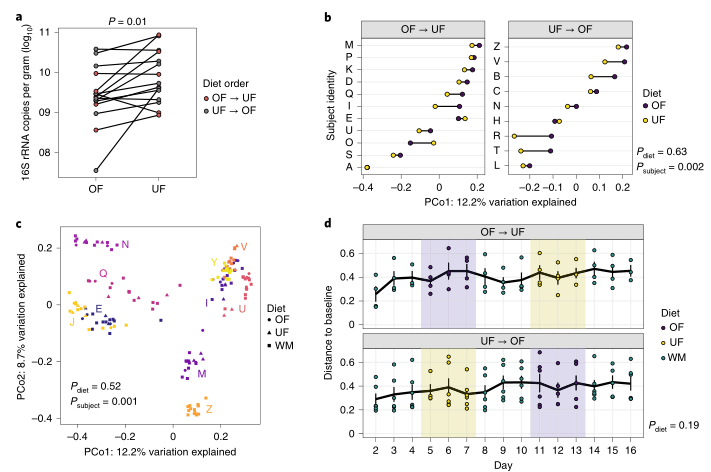
a):整体肠道菌群在OF和UF期间的定植。在UF期间,肠道菌群由于相对地缺乏营养,这可能导致细菌定殖的减少。但是在UF期间与OF相比,总的定殖水平显著增加(P=0.01,双边配对的Wilcoxon检验)。
b):两种饮食措施的Bray-Curtis距离的PCoA第一主坐标的差异。受试者按饮食顺序分开;c):在两种饮食措施期间每天从10个受试者中取样,其PcoA分析结果。每个点代表一个样本,其中颜色表示受试者身份,形状表示饮食方式(WM,保持体重);d):随着时间的推移,微生物群落到基线样本(第一天)的距离。颜色代表饮食,每个点代表一个样本字母表示受试者身份。发现在整个3天的UF和OF干预过程中,总体微生物群落结构保持不变,在基线上保持显著的个体间差异。
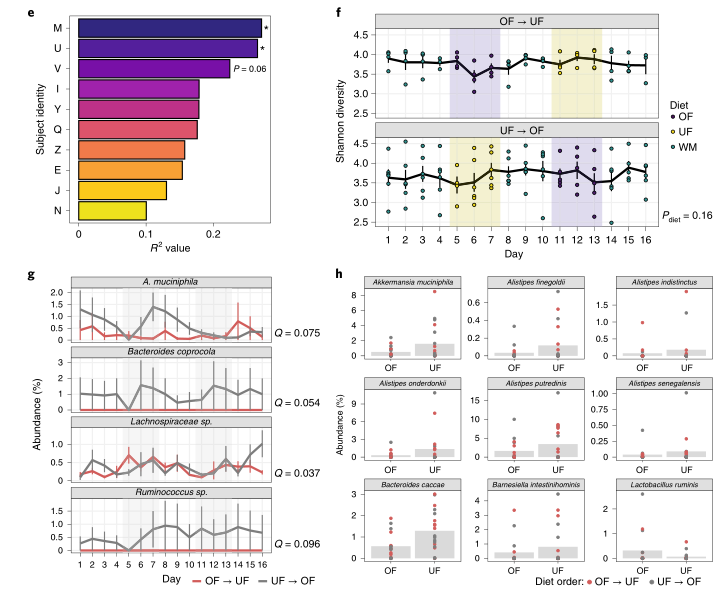
e):在被评估的10个个体中,有2个个体被发现在UF组中的微生物群落总体结构上有显著差异,这可能表明肠道菌群的基线关系到其对饮食干预的敏感性。(对每个受试者进行Adonis分析,R2值量化不同饮食上的方差,“*”表示P<0.05,纵坐标的字母表示受试者身份)
f):在整个第一阶段的16天内,微生物的总体Shannon多样性相对稳定。
g):通过16SrRNA鉴定出的4个与饮食显著相关的物种:嗜粘蛋白艾克曼菌、Bacteroides coprocola、毛螺旋菌、瘤胃球菌。纵坐标为相对丰度,横坐标为时间(d)。
(经FDR调整后的P值,Q < 0.1,双侧Wald检验的DESeq2)。线代表mean ± s.e.m.
h):基于宏基因组测序的物种分类,发现了9种细菌在不同饮食组间的显著差异(FDR < 0.05, 配对的Wilcoxon检验),每个点代表一个样本,纵坐标表示相对丰度。这与16S rRNA基因测序的分析一致。
药物干预:
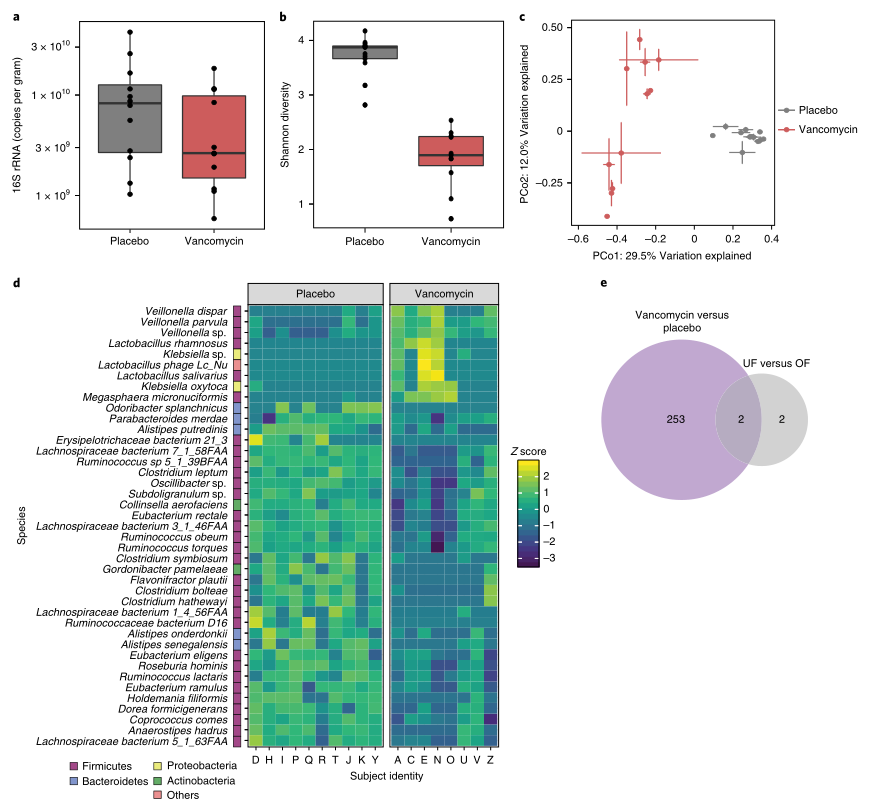
a):不同治疗组的肠道菌群的定植水平无明显差异(P = 0.26,双侧非配对Wilcoxon检验)。每个点代表每个受试者样本的平均值。
b):不同治疗组的微生物群落Shannon多样性。(P <0.0001,双侧非配对Wilcoxon检验)。每个点代表每个受试者样本的平均值。
c):不同治疗组间的基于Bray-Curtis距离的PCoA分析。发现万古霉素对肠道微生物群落结构也有显著影响,超过了先前存在的个体间差异。(每个数据点都显示了每个受试者样本的平均值和标准差)
d):通过宏基因组测序得到的不同治疗组间差异丰富物种的热图。横坐标代表受试者样本,纵坐标代表物种(FDR<0.05,双侧非配对Wilcoxon检验)。其中万古霉素组的物种相对丰度有下降的趋势,31种下降,10种增加。与16SrRNA基因测序数据一致,在万古霉素处理的个体中,有3个Veillonella菌属显著富集,还检测到多种乳杆菌和克雷伯氏菌以及感染乳杆菌的强毒噬菌体(LcNu)的富集。
e):万古霉素和安慰剂与UF和OF之间的16S rRNA序列变异的Venn图。
3. 对UF和OF组、万古霉素组和安慰剂组与代谢疾病相关的宿主-微生物相互作用的机制研究。丁酸盐是肠道细菌代谢的主要终产物。脱氧胆酸,一种次级胆酸,较低的浓度可能意味着肠道屏障的保护和较低的营养吸收。
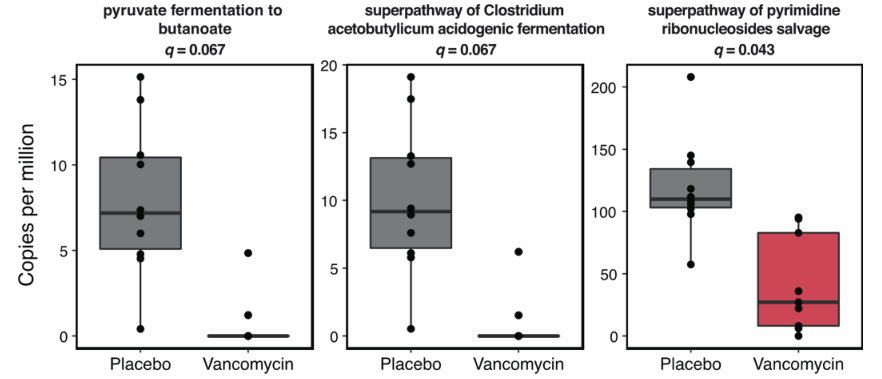
通过分析KEGG代谢途径,发现了三条在万古霉素和安慰剂之间差异丰富的代谢途径。其中的两条(丙酮酸发酵为丁酸和乙酰丁酸梭菌产酸发酵超途径)与糖发酵为主要短链脂肪酸丁酸盐(又名丁酸)有关。说明万古霉素治疗期间肠道菌群可能会减少丁酸的产生或细菌代谢。
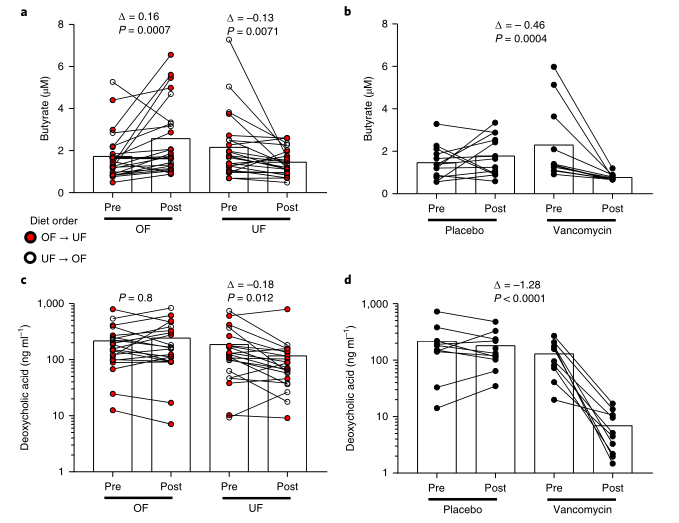
“ Δ ”表示组内干预措施前后的差异
a):OF和UF期间丁酸盐的平均浓度;b):万古霉素组和安慰剂组的丁酸盐的平均浓度。UF和万古霉素处理组的丁酸盐平均浓度均显著下降,这支持肠道菌群在这些干预过程中获取营养的能力下降的说法。
c):OF和UF期间脱氧胆酸的平均浓度;d):万古霉素组和安慰剂组的脱氧胆酸的平均浓度。脱氧胆酸的平均浓度在UF和万古霉素处理组也显著降低了。
结论
在这项分两个阶段的研究中,研究人员直接测量了摄入的和粪便的卡路里,证明了限制热量摄入和口服万古霉素都会导致粪便热量流失增加,血浆丁酸水平降低。这种影响的幅度约为摄入卡路里的2.5%,这将转化为100公斤受试者在1年内体重减轻约1.2公斤。另一方面,研究人员观察到UF和OF对肠道微生物群落结构的轻微干扰,而口服万古霉素引起了广泛的变化,降低了肠道细菌的多样性,并使肠道细菌的相对丰度发生了显著变化。这两种扰动都导致了嗜粘蛋白艾克曼菌的相对丰度增加。而在人一项基于人体的随机、双盲、安慰剂对照的先导研究显示,补充嗜粘蛋白艾克曼菌有降低体重和脂肪量的趋势。此外,体外研究表明,丁酸和其他短链脂肪酸可以刺激肠道屏障的形成,从而保护肠道免受LPSs的破坏。根据研究人员的观察表明,热量摄入和抗生素可能会破坏这些代谢产物和其他调节屏障功能的微生物代谢产物之间的平衡,导致营养吸收的改变。研究中也有一些局限性,比如尽管肠道微生物群落结构和代谢物浓度发生广泛变化,但未发现口服万古霉素对粪便热量的影响、不知道其他抗生素是否会对粪便卡路里产生影响、任何关于营养吸收的机制都是推测出来的,因为没能直接评估营养在肠道中的传输等。

肥胖到底美不美? 我不知道。
我只知道肥胖有可能会影响到健康。
肥胖威胁到健康的范围很广,包括2型糖尿病、冠状动脉疾病、中风、睡眠呼吸暂停和诱发某些癌症等严重疾病,甚至加速衰老,影响寿命。
肥胖不仅会产生这些生理上的不良影响,也会对患者心理造成一定影响,比如说由于行动不便导致无法工作,无法正常社交,甚至抑郁…


肥胖给很多人的生活带来困扰。但是,我们会发现这样一些现象,有些人是所谓的“吃货”,却不怎么胖,而有些人说自己“连喝水都会胖”。
看来肥胖背后的原因恐怕不简单。
今天,我们来详细讨论一下关于肥胖。
首先来看一下,肥胖的定义。
肥胖给很多人的生活带来困扰。但是,我们会发现这样一些现象,有些人是所谓的“吃货”,却不怎么胖,而有些人说自己“连喝水都会胖”。
看来肥胖背后的原因恐怕不简单。
今天,我们来详细讨论一下关于肥胖。
首先来看一下,肥胖的定义。


世界衡量标准
BMI全称身体质量指数,是世界卫生组织(WHO)确认的,衡量成人肥胖/超重的金标准。我们平常知道的都是以 BMI>25 算超重。
但由于人种差异带来的体脂比、肥胖形态的不同,亚洲许多国家和地区有自己的标准。
亚太地区标准
亚太地区肥胖和超重的诊断标准:

*亚太地区肥胖和超重的诊断标准专题研讨会依据亚洲人的情况制定。在BMI相对较低时,就易出现腹型或内脏肥胖,并显示患者高血压、糖尿病、高脂血及蛋白尿的危险性明显增加。
《中国成人肥胖患病率的地理变化:2013-2014年国家慢性病和危险因素监测调查》(以下简称《肥胖调查》)中有写到我国肥胖现状。
*《肥胖调查》由中国疾病预防控制中心张晓博士及其同事们共同完成。

该团队利用了中国慢性病和危险因素监测数据库,评估了2013-2014年全国和各省肥胖率。
将“中国肥胖标准”定义为:
普通型肥胖:BMI ≥28;
腹型肥胖:女性腰围大于85cm,男性腰围大于90cm
按照这个标准,该调查报告显示:2004年-2014年间,中国肥胖症患病率增加3倍多。腹型肥胖增长超50%。
从地区来看,“京津冀”的肥胖发生率很高。以天津为例,女性腹型肥胖率达49.4%,男性为54.4%。
儿童肥胖率也在日趋上涨
据经济合作与发展组织的调查数据显示:
至少有五分之一的儿童患有肥胖和超重。
《中国儿童肥胖报告》显示:
1985-2014年,我国7岁以上学龄儿童超重肥胖率:

肥胖已经是一种全球流行病,而且肥胖人数正越来越多。
3.1 能量摄入/消耗
我们知道,要维持健康的体重,需要保持食物摄入和能量消耗的平衡。

而这种平衡是由控制进食行为和能量代谢的中枢神经系统来负责。
饮食
饮食是影响体重非常重要的因素。饮食通常与饥饿感和饱腹感有关。我们饿不饿并不是自己能决定的,而是听大脑发出的信号,告诉我们饿了(产生饥饿感),该吃东西了,也就产生了食欲。那么这个食欲是怎么调节的呢?
这里有一个理论叫作“葡萄糖稳态理论”,这也是短期调节食欲的基础。


这就好比是特定脑区是一个指挥中心,它整合来自大脑、外周循环和胃肠道的信号,以调节能量的摄入和消耗。
神经元
在下丘脑弓形核(ARC)中,含有两类调节能量代谢的神经元:促进食欲神经元和抑制食欲神经元。

此外,pvn神经元进一步处理信息投射到其他回路,从而控制能量摄入和消耗。
小分子信号
当我们吃东西之后会诱发一系列的信号,包括肠道激素、肽、代谢物和营养素,进而影响能量摄入。大脑又会激活身体的不同机制,来控制食欲,或利用吃的食物和营养来开启发酵过程,合成代谢产物。
图1 体重调节的关键代谢机制
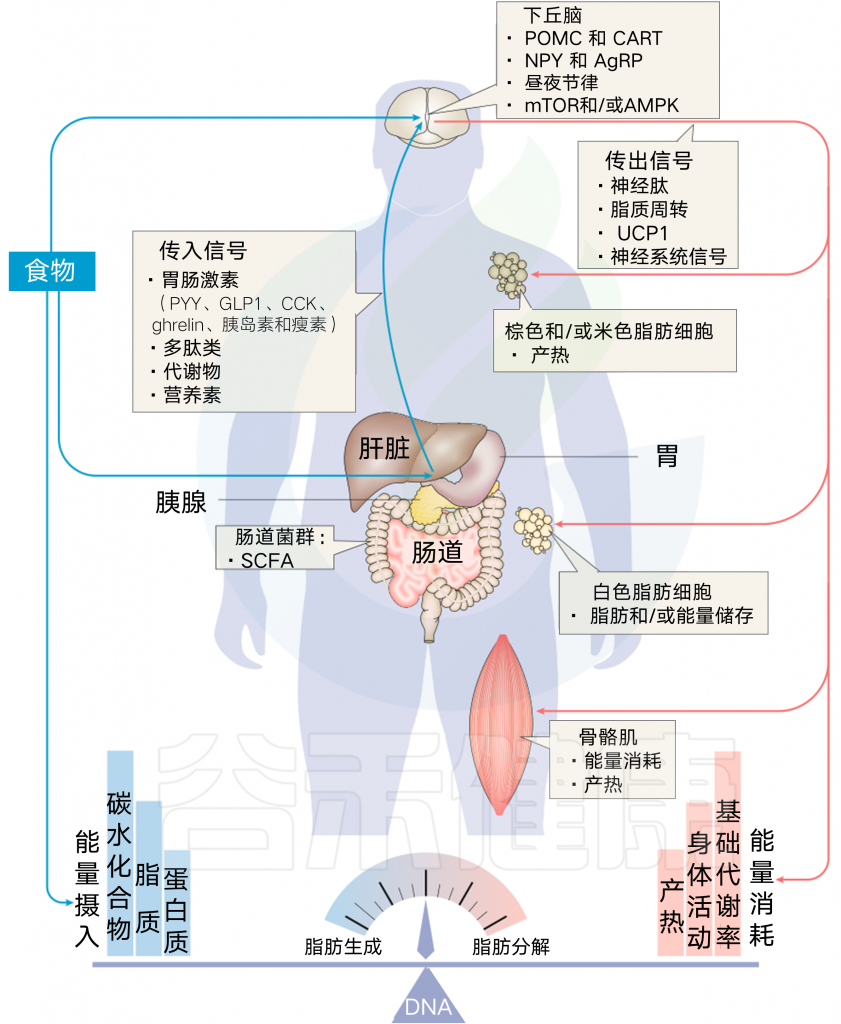

此外,在大脑中,传出信号被产生并发送到不同的组织,以促进产热和/或能量储存,并有助于能量消耗。(对应图中红线部分)
胃肠激素调节——饱腹感的生理介质
胃肠激素通过对胃肠运动和分泌的局部影响来优化营养物质的消化和吸收过程。在这方面研究最多的是胆囊收缩素(CCK)、胰腺多肽、肽YY、胰高血糖素样肽-1(GLP-1)、氧调节蛋白和胃饥饿素ghrelin。
它们通过各种不同的机制来增加你的饱腹感,让你别再吃了(具体方式在后面碳水化合物的小节展开)。
神经递质
许多肠肽既是激素又是神经递质。CCK和GLP-1等肽在投射到中枢神经系统内外对能量平衡至关重要的区域的神经元中表达。
大脑皮层高级神经活动,通过神经递质影响下丘脑食欲中枢,在调节饥饿感和饱腹感方面发挥一定作用。神经递质种类很多,包括五羟色胺、多巴胺等。
基于谷禾人群队列,我们选择了146例超重和肥胖人群,以及179例对照正常体重人群。其中超重标准为BMI>28,队列年龄分布为35~75岁。
根据菌群测序数据和相关营养及代谢调查进行KS统计检验,发现:
神经递质的检测数据显示与神经兴奋有关的多种神经递质和代谢物质肥胖人群普遍偏高,包括:
谷氨酸、五羟色胺、色胺和多巴胺。
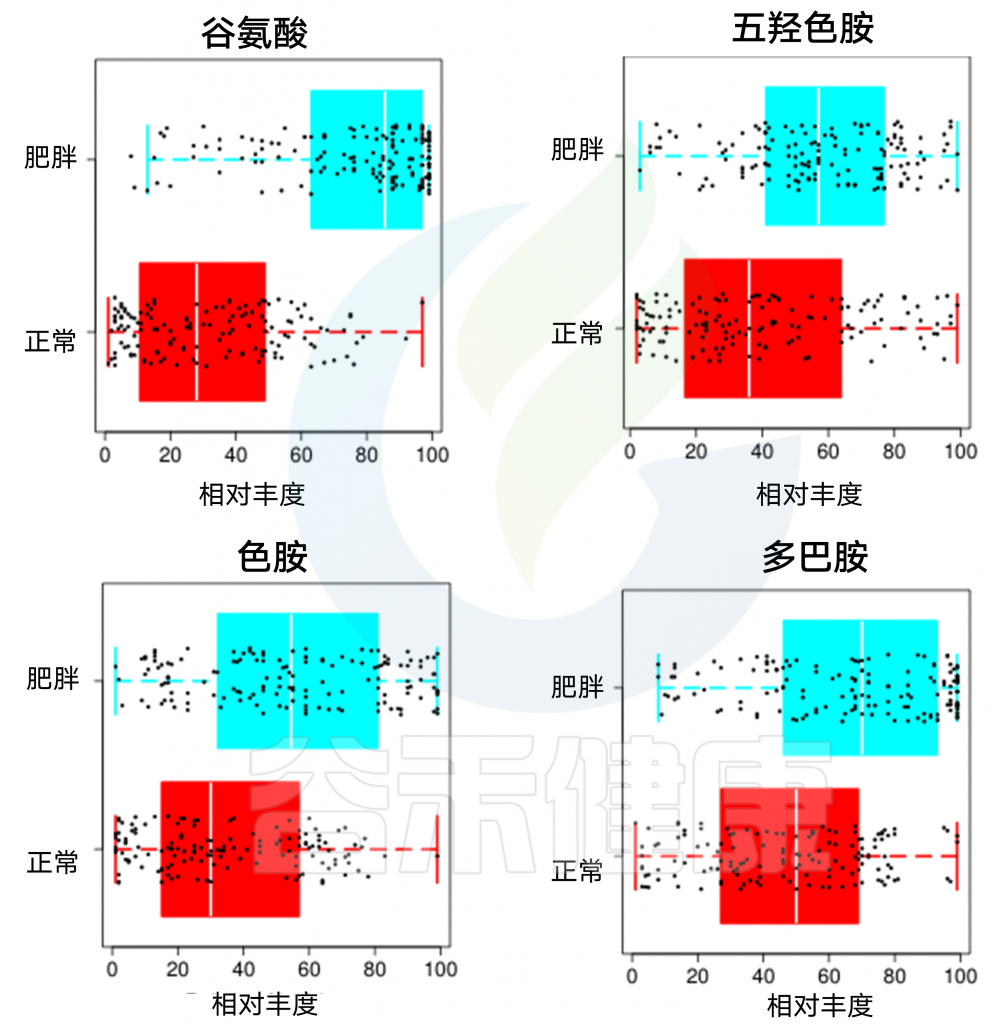

而神经抑制类的γ-氨基丁酸(GABA)则偏低:
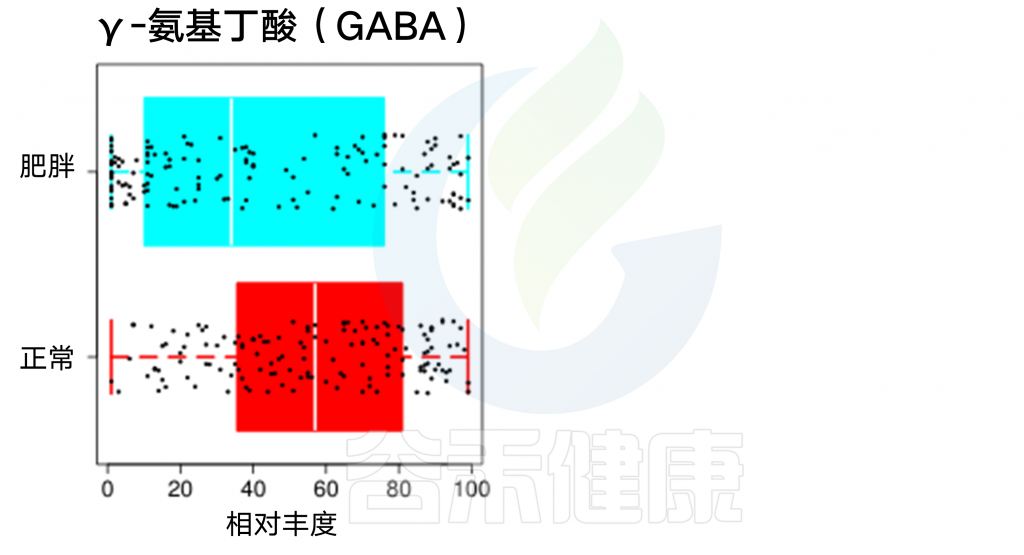

这些结果与食欲和饮食产生的神经兴奋是否有直接联系还需要进行更深入的生理分子机制的研究。
短链脂肪酸
短链脂肪酸影响与之相关的短期途径,调节食欲和食物摄入。能量收集上的差异似乎是由细菌产生的短链脂肪酸引起的,它提高了消化残余物的能量利用率。
短链脂肪酸有助于血糖稳定以及饥饿和饱腹激素的平衡。结肠输注短链脂肪酸混合物增加血浆PYY水平,这是由上皮G蛋白偶联受体(GPR41和GPR43)的激活触发的。
[具体关于短链脂肪酸的文章:你吃的膳食纤维对你有帮助吗?点此复习]

睡眠改变会影响饱腹感
这就涉及到“生物钟系统”。饮食脂肪和碳水化合物与生物钟系统相互作用,在生物钟系统中,特定的脂肪酸和葡萄糖可以影响行为和分子的昼夜节律,通过改变能量状态传感器影响中枢神经系统、非中枢神经系统和外周器官。这一假设符合葡萄糖稳态理论。
代谢的昼夜节律振荡受日常喂养模式和能量利用模式的影响,影响内分泌系统(瘦素、胰岛素或ghrelin分泌)与睡眠模式之间的昼夜节律排列。睡眠改变(如睡眠不足)可以改变内分泌昼夜节律,影响饱腹感和/或饥饿感,以及与主观幸福感有关的其他方面。

运动改善肥胖者的代谢灵活性
代谢灵活性的程度,即在骨骼肌和脂肪组织中将葡萄糖和脂肪酸之间的燃料选择转移的能力。
体育锻炼已被证明在改善肥胖患者的代谢灵活性方面具有关键作用。研究报告说,随着饮食脂肪的增加,肥胖者开始运动后增强了肌肉脂肪酸氧化。


3.2 三大类营养物质
人体摄入的营养物质中,有包括碳水化合物、脂肪、蛋白质在内的宏量营养素,也有微量营养素诸如维生素和矿物质等。但人新陈代谢的最核心内容是三大营养物质的代谢及其相互转化。
我们先看看这三大营养物质是如何直接或间接产生热量。注意热量不等同于能量。能量加上氧气参与,转化为热量。
在三大营养物质的代谢中,起枢纽作用的是糖类代谢,蛋白质(身体携带氧气的关键)要转变成为热量,需要先转变成为糖类,才能够燃烧产生热量,脂肪的燃烧,也需要糖类的参与才能够顺利完成。也就是说,蛋白质、脂肪是能量的两个储藏仓库,而糖类,会直接释放热量。
接着我们具体来看每种营养素与肥胖之间的关系。
3.2.1 碳水化合物
碳水化合物包括不同类型的分子,从复杂的多糖和淀粉到单糖,如单糖或双糖,以及不同的纤维,能量值和消化率不同。


这些结构差异导致它的物理性质、消化率和功能的不同。碳水化合物对食物摄取和饱腹感的影响是通过与胃肠-脑神经内分泌信号、肠道发酵(由短链脂肪酸或其他代谢物诱导)和碳水化合物的物理或化学性质(如膨胀和粘度)相关的几种途径介导的。
碳水化合物通过调节胃肠道肽释放来影响饱腹感
与维持血糖水平有关的食欲和饱腹感调节由胰岛素和胰高血糖素调节,胰岛素和胰高血糖素由胰腺分泌,分别导致导致糖原生成和糖原分解。 事实上已证实,包括纤维在内的碳水化合物,对饱腹感相关胃肠道肽(CCK,ghrelin,GLP1,PYY和GIP)餐后释放有影响。单糖和双糖,如蔗糖、果糖和乳糖,是人类消耗的最常见的糖,它们在食欲和食物奖励中的作用与甜味受体有关。
纤维和淀粉是饮食中最复杂的碳水化合物结构。
它如何产生饱腹效应?
纤维通过调节胃肠道转运、葡萄糖吸收和粪便膨胀起作用。
低能量密度(2kcal/g)和水化能力产生饱腹效应,它们提供粘度和膨胀,影响肠道中的机械感受器,影响血糖反应和饱足信号,增加肠道蠕动能力,并作为肠道微生物的主要底物。
3.2.2 脂肪
脂类具有较高的能量密度,其消耗可能通过间接机制直接影响食物摄入和能量消耗以及代谢,从而影响肥胖和相关疾病。


脂类在能量积累中起着核心作用,在内分泌系统中起着重要的作用。 它在食欲和饱腹感调节中的作用包括通过感觉受体和化学感受器。
「瘦素」——脂肪与下丘脑饱腹调节中心沟通的桥梁
瘦素是由脂肪组织分泌的一种激素,分泌过程依赖胰岛素。
当体内瘦素水平较高时,会告诉大脑身体有足够的能量储备,不要再吃了。瘦素和胰岛素共同作用于下丘脑和其他脑区,从而抑制食物摄入,增加能量消耗。
可想而知,当瘦素长期处于低水平时,往往伴随着肥胖。低水平的瘦素在不断告诉大脑,身体正处于饥饿状态,那么很有可能出现暴饮暴食,且身体在不停地储存能量。
脂肪的质量比数量更重要
越来越多研究表明,除了饮食中的脂肪或碳水化合物的数量外,膳食脂肪的质量(主要指天然不饱和脂肪而不是反式或饱和脂肪)比数量更能决定饮食对维持体重的影响。
具体来看,目前研究的重点是脂肪质量与脂肪酸饱和度之间的关系。饮食中omega-6脂肪酸与omega-3脂肪酸比例的增加与通过脂肪生成、脂肪组织稳态、脂肪褐变和炎症机制增加体重,和肥胖的风险增加有关;这种增加是由脑-肠-脂肪轴通过二十烷类代谢物和大麻素系统的多动介导的。
在这种情况下,高脂肪消耗在与脂肪沉积有关的胃肠道调节喂养途径上的调节作用影响脂质的吸收和利用,减弱饱腹信号并促进超重,其中CCK、ghrelin、GLP1和其他神经肽与食欲和/或饱腹有关。此外,中链甘油三酯、共轭亚油酸和多不饱和脂肪酸引起不同的饱腹和胃排空效应。
多不饱和脂肪酸导致能量摄入和消耗变化
此外,多不饱和脂肪酸在调节身体成分中起着重要作用;它们导致能量摄入和支出的定向变化,以及脂质周转和脂肪生成的改变,这是由神经内分泌系统介导的。 此外,一些饮食脂质可能通过促进棕色和米色脂肪的生成来刺激产热功能。脂类也在食物质地中起作用,这可能会使食物更可利用。
当然,脂肪也可能表现出不受欢迎的口感,这可能导致食物的排斥,从而干扰能量的摄入,而不是餐后机制。
肥胖也与诱导的食物偏好和减少底物氧化、酮体保留糖代谢机制以及脂溶性和/或脂肪生成活动或炎症途径的变化有关。
要想躲避肥胖,建议多选不饱和脂肪酸
单不饱和脂肪酸摄入量与BMI呈负相关,突出了脂肪分布的重要性,而不仅仅是脂肪总量,而且影响的差异取决于遗传背景。
食用不饱和油不易导致肥胖,这表明脂肪质量比数量更重要(例如,在那些遵循地中海饮食模式的人中观察到的或食用树坚果)。
平时食用油的选择,动物油脂,橄榄油,菜籽油等都要好于色拉油、调和油。
3.3.3 蛋白质
蛋白质分子结构的多样性,决定了蛋白质分子有多种重要功能,它们也负责酶的功能,并具有内分泌调节作用。
膳食蛋白质和蛋白质衍生分子表现出食欲和厌食效应,这些效应是由不同的神经肽和肠道激素介导的,如胃饥饿素、CCK、GLP1、PYY、瘦素、胰岛素和特定氨基酸。

蛋白质有助于保持无脂质量和骨骼肌,从而促进能量消耗的维持。
高蛋白饮食对食欲抑制作用
蛋白质在饮食中的比例影响食欲调节和饱腹感的诱导。例如,干预性研究显示了高蛋白饮食对食欲抑制的饮食作用。富含蛋白质的饮食导致饥饿感减少,能量消耗和β-羟丁酸水平增加,这可能有助于食欲下降。
蛋白质具有明确的产热性质,由氧化磷酸化过程、尿素合成、糖异生和能量产生的中间代谢途径介导。然而,对于特定的蛋白质,如明胶gelatin,在食欲抑制中也有独特的作用。
此外,与蛋白质诱导饱腹感有关的机制已被归因于氨基酸(如酪氨酸、色氨酸或组氨酸)、影响胃迷走神经传入的鲜味物质(包括味精)或来自甜味剂的阿斯巴甜(asp-phe)氨基酸有关的钙传感受体,它们调节食欲和餐后发生热。
长期动物蛋白的摄入对体重的维持有不利的影响
然而,一些长期的纵向分析表明,动物蛋白的摄入对随访5年后体重的维持有不利的影响。 事实上,每天食用250克肉类,与肉类含量较低的等热量饮食相比,每年增加422克体重。因此,以动物蛋白和糖为代价增加植物蛋白的摄入量,可能是在人群水平上对抗超重和肥胖的一种方法。
这些结果突出了营养素比例的重要性。但进一步的研究还应侧重于蛋白质来源和血糖指数的体重维持。
4.1 遗传机制
些人哪怕吃正常量的食物就是比一般人容易发胖,这可能与肥胖基因有关。
接下来我们来看看遗传因素在决定个体对肥胖的易感性方面起了什么样的作用。
不同的研究报道了总脂肪比例与食物摄入调节相关基因(如FTO)、脂肪代谢相关基因(如APOA5)和脂肪细胞分化相关基因(如PPARG)在不同人群中的相关性。
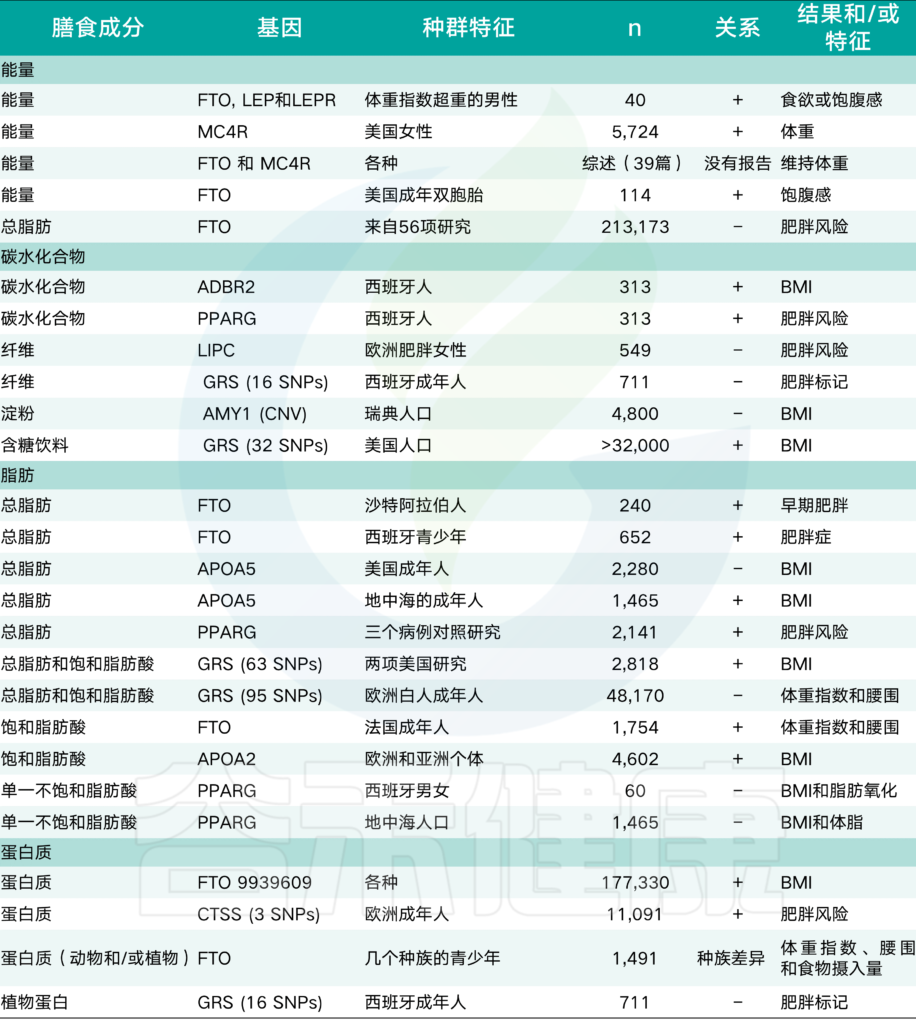
肥胖基因——FTO基因(减弱饱腹感)
与没有风险等位基因的参与者相比,那些具有FTO变异型rs9939609的风险等位基因的人报告显示,主观饱腹感较低,能量密集的食物消耗较高,这表明具有遗传风险的个体已经损害了中枢神经系统的饱腹感。
此外,有FTO危险等位基因的个体也会消耗较高比例的能量作为脂肪,显示出肥胖风险的加剧。
APOA2等位基因的存在通过调节参与支链氨基酸和色氨酸代谢的途径,在饱和脂肪酸摄入时增加的肥胖风险。
与之相反,APOA5基因变异rs662799的C携带者,在饮食中消耗更多的脂肪,则可避免肥胖。

然而需要注意的是,即便是检测出了携带肥胖基因,也不意味着必然会永久肥胖下去;反之,不携带肥胖基因,也不意味着可以胡吃海喝不运动。要知道决定肥胖的不止基因这一个因素,例如还有肠道微生物群的影响。如果说基因难以改变,那么肠道菌群是你可以改变的。
4.2 菌群介入,影响肥胖
易患肥胖的个体的肠道微生物群可以通过饮食、益生菌等来改变。
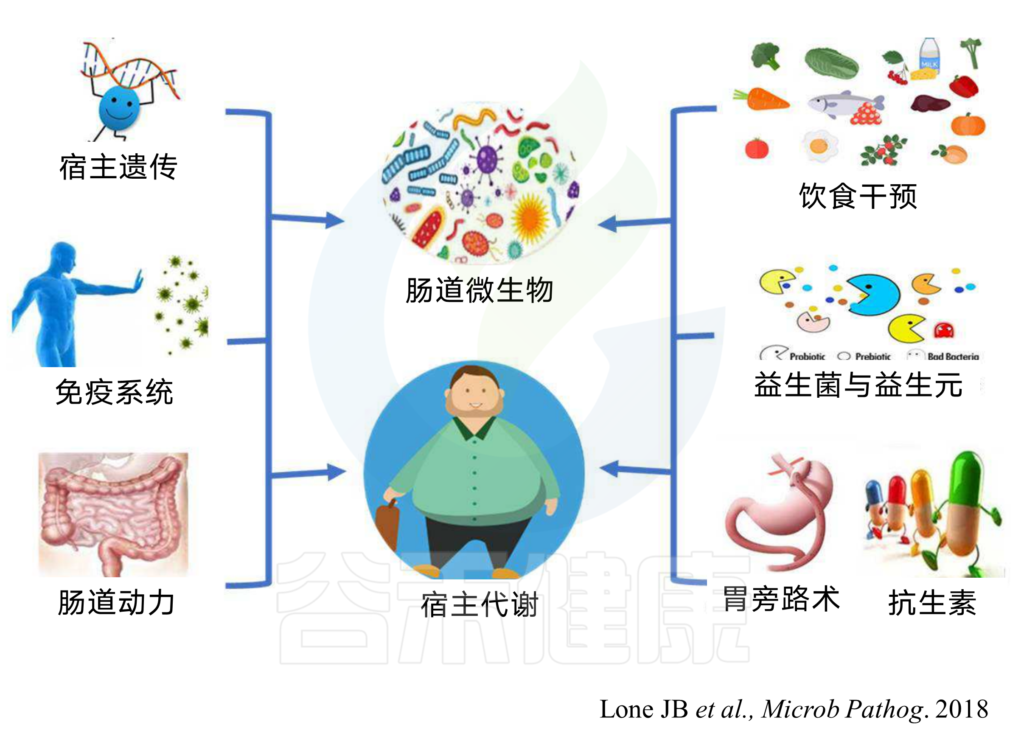
碳水化合物(即纤维)、蛋白质和脂肪的摄入会影响肠道微生物群,从而使宏量营养素与微生物群相互作用。具体在前面 深度解读|饮食、菌群和健康 一文有详细阐述。
个体微生物群的组成是独特的,是个体代谢和体重状况的代表性特征。
人体摄入宏量营养素、肠道菌群与肥胖的关系
↑, 增加;↓,减少;NA,不可用;第三列:营养物质和/或饮食基质与肠道微生物群之间的关系
4.2.1 菌群和肥胖之间的关系
菌群丰度和种类
菌群丰度和多样性与肥胖呈负相关
开创性的研究已经描述了微生物群与肥胖之间的关系。数据显示肥胖小鼠的厚壁菌数量增加,拟杆菌数量减少,这表明这些微生物对宿主代谢可能有影响。这些结果随后在人类研究中得到证实,研究人员在研究中比较了来自瘦弱或肥胖人群的样本。
一些研究描述了肥胖者从食物中获得的能量的增加,并确认了这些人粪便样本中的普雷沃氏菌科和古细菌的增加。此外,菌群丰度和多样性与肥胖呈负相关,即菌群丰度低的人会提高肥胖、胰岛素抵抗和血脂异常,以及低度全身炎症风险。
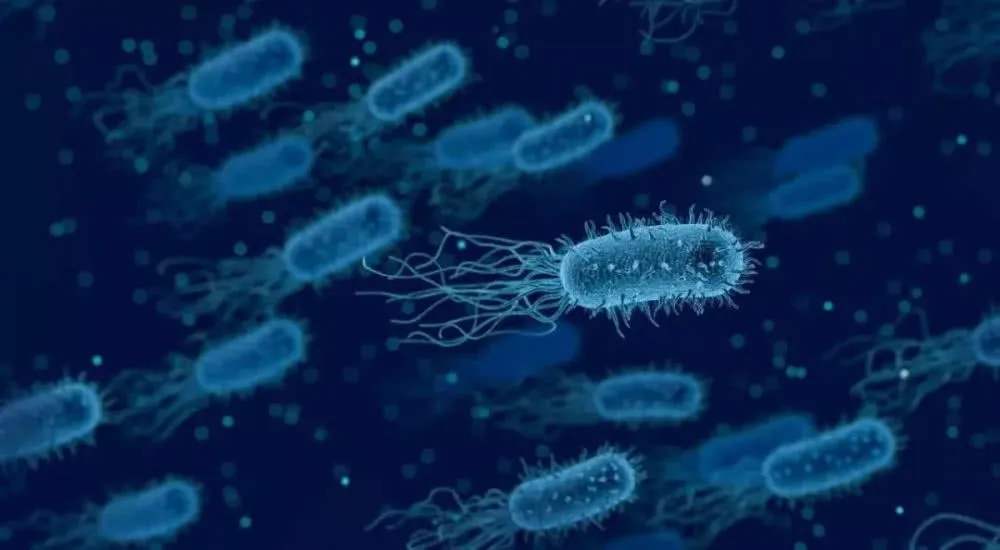
基于谷禾人群队列数据发现:
肠道菌群的种类数量肥胖人群要显著低于对照人群(下左图),均值分别为850比1150,这一现象与之前的研究是符合的。
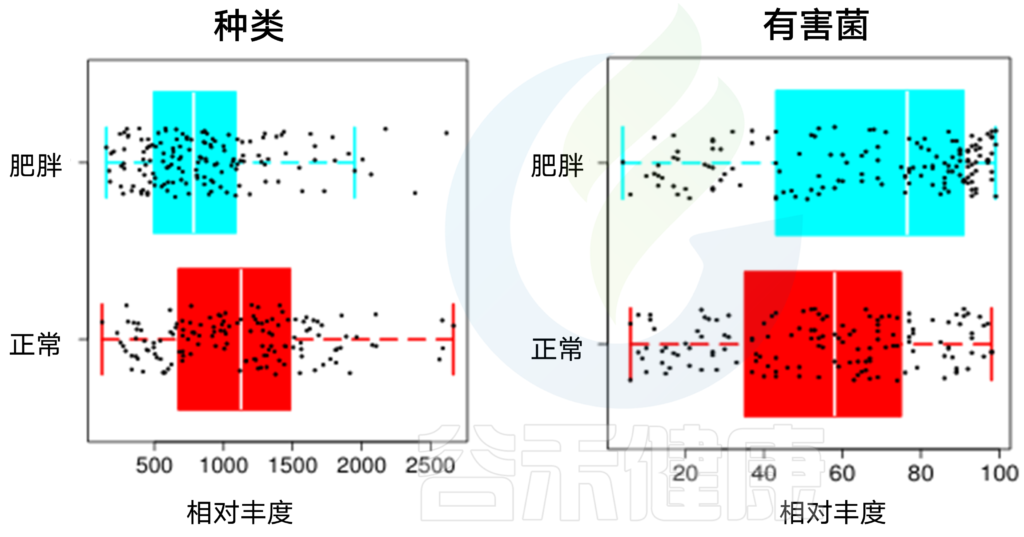
有害菌
在有害菌属的丰度水平分布上,肥胖人群也要高于对照人群(上右图)。进一步对具体菌属进行分析,发现肺炎克雷伯氏菌的丰度水平肥胖人群更高(下左图)。
有益菌
而双歧杆菌属的水平肥胖人群普遍较低。
一项调查同卵双胞胎脂肪摄入质量的研究发现,单不饱和脂肪酸与双歧杆菌和拟杆菌的丰度正相关,以及n-3多不饱和脂肪酸和乳酸杆菌之间存在正相关关系,而n-6多不饱和脂肪酸与双歧杆菌是负相关。
一些学者认为在饮食中添加益生菌可以减轻饮食中脂肪对体重维持和脂肪积累的有害影响。
4.2.2 菌群如何影响肥胖
肠道微生物群影响超重和肥胖个体体重和代谢的两种可能机制。
(1)肠道微生物群将不可消化的膳食纤维发酵为短链脂肪酸,这些脂肪酸可能由肠道上皮代谢或是葡萄糖和脂质从头合成的一部分。
(2)由于紧密连接处的薄弱导致肠道通透性增加,来自肠道细菌表面的脂多糖(LPS)能够进入循环,并可能在包括肌肉、肝脏和脂肪组织在内的多个组织中引起免疫反应、炎症、巨噬细胞浸润和胰岛素抵抗。胰岛素抵抗和厌食激素(包括胰高血糖素样肽1[GLP-1]和肽酪氨酸[PYY])在下丘脑的表达降低刺激了食物摄入的增加。
此外,微生物蛋白水解可产生支链氨基酸和芳香烃氨基酸,可通过微生物交叉喂养(微生物物种的营养相互依赖性)进一步代谢。这些交叉喂养途径的紊乱导致这些氨基酸的吸收增加,并与肠道完整性和胰岛素抵抗的损害有关。
糖化和蛋白水解代谢物生产中涉及的微生物群落和微生物网络
肠道微生物的功能群、主要代谢途径和生产碳水化合物和蛋白质发酵产生的代谢物的中间体,包括糖解产物短链脂肪酸,琥珀酸盐和乙醇以及蛋白质水解代谢产物,包括氨、吲哚和酚类化合物、硫化氢、胺和支链脂肪酸(BCFAs)。
4.2.3 饮食干预菌群
越来越多的研究者开始对饮食模式感兴趣,以研究食物营养素、肠道微生物群组成和遗传背景之间复杂相互作用。
对人类的一项观察研究表明,肥胖人群中存在小肠细菌生长,他们的饮食中富含碳水化合物和精制糖,缺乏纤维。饮食蛋白质和碳水化合物对肠道微生物群的调节作用改变了蛋白质消化的衍生物。这些衍生物通过改变芳香族和支链氨基酸的发酵以及作为短链脂肪酸的前体而影响能量代谢。
基于谷禾肠道菌群的营养量化算法可以有效反映和量化饮食及营养元素的摄入状况。数据显示,主要饮食结构中精制糖摄入肥胖人群显著偏高,而乳制品摄入普遍偏低。
低聚果糖调节菌群,与短链脂肪酸相关
膳食宏量营养素发酵产生的代谢产物对肥胖及合并症的影响已被广泛研究。此外,碳水化合物的摄入被认为是调节肠道微生物群的主要因素。纤维通过调节胃肠道转运、葡萄糖吸收和粪便膨胀起作用,影响血糖反应和饱足信号。
可发酵膳食纤维在调节微生物方面具有关键作用肠道菌群。益生元,如低聚果糖,对肠道微生物群的影响已经被一些研究证明,因为低聚果糖调节了粪便细菌和其他细菌的丰度,并与丁酸盐的产生相关,通过降低下丘脑神经肽Y的表达而减少食物摄入。
还研究了富含糖和人工甜味剂的“西方”饮食对肠道微生物组成的影响。不幸的是,甜味剂和人体肥胖的肠道微生物群之间的联系仍然不清楚。

富含脂肪的饮食可以通过抗菌作用影响肠道微生物群
其他研究者认为,饮食中脂肪摄入对体重增加的影响,除了燃料正平衡外,还有其他作用。富含脂肪的饮食可以通过抗菌作用影响肠道微生物群,从而促进与肥胖相关的全身促炎症状态相关的失调的发展。对健康人进行的横断面研究发现,在习惯性饮食中,拟杆菌和放线菌与脂肪摄入呈正相关。此外,与体重指数相关的现有分类群也与饱和脂肪酸的热量摄入相关。
一些作者认为在饮食中添加益生菌可以减轻饮食中脂肪对体重维持和脂肪积累的有害影响。
饮食干预后的菌群改变与脂肪改变有关
一项包括一组健康人的对照喂养试验发现,在饮食干预24小时后,肠道微生物群的组成发生了变化,这些变化在10天内保持稳定。
研究人员还报告了长期饮食模式和菌群之间的关系。更具体地说,他们报告了拟杆菌与蛋白质、动物脂肪之间的关系,普雷沃菌与碳水化合物之间的关系。同样,其他营养干预措施也发现,大鼠高脂高糖和低脂高糖饮食后,菌群多样性下降。这些饮食与肠道炎症的增加和迷走神经-肠道-大脑连接有关,与身体脂肪沉积的增加有关。
综合分析,健康饮食模式下菌群丰富,炎症减少
以往有多项研究显示肥胖人群在一些炎症指标上较高,存在长期的炎症反应,我们针对主要炎症指标的统计检验同样发现以下炎症指标确实存在偏高:
一些作者强调了使用肠道微生物群的综合分析和代谢组学分析,客观评估对坚持健康的饮食模式,帮助阐明这些模式的明确饮食组成,如地中海饮食模式,以及它们在心脏代谢紊乱的复杂相互作用中的假定作用。例如,一项试验报告了肥胖人群中与健康饮食模式相关的肠道微生物群组成的差异。更具体地说,那些饮食摄入更健康的人微生物丰富,炎症标志物浓度降低。
在这些研究的基础上,数据表明饮食因素之间的相互作用,如宏量营养素分布、肠道微生物群组成和遗传背景,与肥胖中发现的代谢障碍有关。对个体特征和对肠道菌群代谢物相关敏感性的整体研究有助于制定新的策略,提高肥胖防治效果。
现在我们知道各种因素会改变肠道微生物,肠道微生物的改变会导致代谢功能的改变,从而导致肥胖。
要精确的了解每个人具体的问题所在,就要了解自己的肠道微生物,请进行肠道菌群检测,不仅了解肠道菌群,更重要的是能找出肥胖背后的真正问题,确定适合你身体的方式,科学减肥。
相关阅读:
主要参考文献:
San-Cristobal R, Navas-Carretero S, Martínez-González M Á, et al. Contribution of macronutrients to obesity: implications for precision nutrition[J]. Nature Reviews Endocrinology, 2020: 1-16.
de Clercq, Nicolien C., et al. “Gut microbiota in obesity and undernutrition.” Advances in Nutrition 7.6 (2016): 1080-1089.
Canfora, Emanuel E., et al. “Gut microbial metabolites in obesity, NAFLD and T2DM.” Nature Reviews Endocrinology15.5 (2019): 261-273.
Diabetes Care 2015 Jan; 38(1): 150-158.https://doi.org/10.2337/dc14-2391
Lancet 2004; 363: 157–63
Linfeng Zhang, Zengwu Wang, et al. Prevalence of Abdominal Obesity in China: Results from a Cross-Sectional Study of Nearly Half a Million Participants.Obesity.2019 Sep. DOI:10.1002/oby.22620.
Hou X, Lu J, et al. Impact of waist circumference and body mass index on risk of cardiometabolic disorder and cardiovascular disease in Chinese adults: a national diabetes and metabolic disorders survey. PLoS One. 2013,8(3): e57319.DOI: 10.1371/journal.pone.0057319.
Geographic variation in prevalence of adult obesity in China: results from the 2013-2014 National Chronic Disease and Risk Factor Surveillance. Ann Intern Med. 29 October 2019.2.
Lone Jameel Barkat,Koh Wee Yin,Parray Hilal A et al. Gut microbiome: Microflora association with obesity and obesity-related comorbidities.[J] .Microb. Pathog., 2018, 124: 266-271.